 |
| Temas de FC |
E. Román Riechmann*![]() , A. García Díaz**
, A. García Díaz**
*Servicio de Pediatría. Unidad de Gastroenterología Pediátrica. Hospital Universitario Puerta de Hierro Majadahonda. Madrid. **Servicio de Pediatría. Hospital Universitario El Escorial. Madrid
| Resumen
Los trastornos funcionales gastrointestinales (TFGI) o trastornos del eje cerebro-intestino (TECI) son un motivo frecuente de consulta en la edad pediátrica, afectando la calidad de vida del paciente y de sus familias y dando lugar, muchas veces, a exploraciones complementarias innecesarias y a tratamientos no justificados. Ante la ausencia de parámetros biológicos que confirmen el diagnóstico y la gran variabilidad en la práctica clínica, el diagnóstico se basa en los criterios de Roma, desarrollados para establecer subgrupos dentro del conjunto de síntomas recurrentes o crónicos que constituyen los TFGI. Una historia clínica cuidadosa y una exploración física exhaustiva, descartando datos de alarma, son las principales herramientas para la orientación diagnóstica y el abordaje terapéutico, buscando un diagnóstico proactivo precoz y tranquilizar al paciente y la familia. En el primer año de vida predominan, sobre todo, las regurgitaciones, el estreñimiento y los cólicos del lactante. En el niño mayor y en el adolescente son muy frecuentes los trastornos de la defecación y los trastornos de dolor abdominal. El papel del pediatra de Atención Primaria es fundamental en estos trastornos, estableciendo el diagnóstico adecuado y, en determinados casos, derivando a una unidad de Gastroenterología Pediátrica. |
| Abstract
Functional gastrointestinal disorders (FGIDs) or disorders of the brain-gut interaction (BGIDs) are a frequent reason for consultation in the paediatric age, affecting the quality of life of patients and their families and often leading to unnecessary tests and treatments. In the absence of biological parameters to confirm the diagnosis and due to the great variability in clinical practice, the diagnosis is based on the Rome criteria, developed to establish subgroups within the set of recurrent or chronic symptoms that constitute FGIDs. A careful clinical history and a thorough physical examination, ruling out potential alarm features, are the main tools for diagnostic and therapeutic approach, looking for an early proactive diagnosis and reassuring the patient and family. In the first year of life, regurgitation, constipation and infant colic mainly occur. In older children and adolescents, defecation disorders and abdominal pain disorders are much more frequent. The role of the primary care paediatrician is essential in these disorders, establishing the appropriate diagnosis and, in certain cases, referring to a paediatric gastroenterology unit. |
Palabras clave: Trastornos funcionales gastrointestinales; Trastornos eje cerebro-intestino; Lactante regurgitador e irritable; Estreñimiento funcional; Dolor abdominal funcional.
Key words: Functional gastrointestinal disorders; Brain-gut axis disorders; Regurgitative and irritable infant; Functional constipation; Functional abdominal pain.
Pediatr Integral 2024; XXVIII (7): 453 – 464
OBJETIVOS
• Diagnosticar con los datos de la historia clínica y la exploración física, los principales trastornos funcionales gastrointestinales en la edad pediátrica.
• Identificar los síntomas y signos de alarma.
• Entender la base fisiopatológica de alteración en el eje cerebro-intestino microbiota y el abordaje bio-psico-social del tratamiento.
• Adecuar las intervenciones en el caso del niño regurgitador y/o irritable.
• Optimizar el tratamiento en los casos de estreñimiento funcional, familiarizándose con los laxantes más habituales.
• Conocer la utilidad de las distintas intervenciones en los casos de dolor abdominal funcional, según el subtipo.
Trastornos funcionales digestivos más frecuentes en Pediatría
Introducción
Se consideran como trastornos funcionales gastrointestinales (TFGI) a un conjunto de síntomas gastrointestinales crónicos o recurrentes no explicados por anomalías estructurales o bioquímicas y que interfieren de forma importante con la calidad de vida del niño y de su familia. Han pasado de ser meros diagnósticos de exclusión a entidades clínicas específicas con criterios diagnósticos propios.
Estos trastornos se asocian a una gran variabilidad en la práctica clínica. Una historia clínica cuidadosa y una exploración física exhaustiva, descartando la presencia de síntomas y signos de alarma, son las principales herramientas para la orientación diagnóstica y el abordaje terapéutico, buscando un diagnóstico proactivo precoz y tranquilizar tanto al paciente como a la familia.
Respecto a la repercusión de estos trastornos en la calidad de vida de los niños afectados y de sus familias, los niños de 5 a 18 años con TFGI refieren una peor calidad de vida en todas las dimensiones (física, emocional, social y escolar) que los controles sanos e, incluso, algo peor que pacientes con otras enfermedades gastrointestinales y presentan, además, una mayor frecuencia de ansiedad, depresión y absentismo escolar. Los padres de niños de 2-3 años con TFGI perciben una peor calidad de vida en sus hijos y refieren mayor número de consultas por síntomas gastrointestinales y en salud mental y mayor uso de medicación(1).
En este capítulo, tras unas consideraciones generales, se van a revisar los TFGI pediátricos más frecuentes: lactante regurgitador y/o irritable, estreñimiento funcional y trastornos de dolor abdominal funcional.
Prevalencia
En todas las edades, los TFGI son uno de los principales motivos de consulta, tanto en Atención Primaria como en Gastroenterología Pediátrica. Su prevalencia en población aparentemente sana es muy alta, aunque la gran heterogeneidad en las definiciones aplicadas en los distintos estudios hace difícil el establecer datos globales.
Una reciente revisión sistemática de los estudios de prevalencia en población general, siguiendo los criterios de Roma IV, aporta una prevalencia global del 22,2 % en menores de 4 años, siendo los más frecuentes el estreñimiento funcional y la regurgitación del lactante, y del 21,8 % entre 4 y 18 años, con un predominio del estreñimiento y de los trastornos de dolor abdominal funcional(2).
Fisiopatología
La posible fisiopatología de los TFGI ha evolucionado, pasando de ser considerados como trastornos principalmente psicosociales a implicar en el organismo a múltiples sistemas. En la actualidad, se considera el modelo bio-psico-social, que implica una compleja interacción entre factores de vulnerabilidad genética, ambientales, psicológicos y psicosociales que, junto con experiencias tempranas en la vida, configurarían la habilidad del sistema nervioso central y entérico para adaptarse a los cambios fisiológicos o de estrés. Una función intestinal alterada supondría alteraciones en el procesamiento central de las señales de dolor del intestino, con una hipersensibilidad visceral y/o una posible disregulación inmune mucosa y microbiana(3,4).
El modelo bio-psico-social es contemplado como una disfunción del eje cerebro-intestino, por ello la denominación actual de TECI. A este eje se incorpora la microbiota intestinal. Se han identificado mecanismos de señalización específicos que comunican la microbiota con el cerebro a través de vías neuronales, endocrinas e inmunes. El cerebro, a su vez, modula la composición y función de la microbiota intestinal a través del sistema nervioso autónomo, regulando la motilidad, la secreción, la permeabilidad y la liberación de hormonas intestinales que afectan la expresión de genes microbianos. Los cambios en cualquier nivel de estas interacciones pueden alterar el equilibrio, contribuyendo potencialmente a la patogénesis de los TFGI(5).
La asociación familiar, con una mayor prevalencia de TFGI en padres de niños con estos trastornos, expresa una predisposición genética, aunque el agrupamiento de casos en las familias puede tener relación también con compartir factores ambientales, factores de estrés, conductas aprendidas e, incluso, exposición a infecciones.
Criterios diagnósticos
Los pacientes con TFGI se han identificado por su pertenencia a algunos de los subgrupos sintomáticos, mediante los denominados “criterios de Roma”. Los criterios de Roma III (2006) establecieron dos grandes categorías: menores de 4 años, trastornos que expresan alteraciones fisiológicas, de maduración y del desarrollo afectivo; y niños y adolescentes (4-18 años), en los que prevalece el modelo bio-psico-social.
Los criterios de Roma IV se desplazaron desde el consenso a la evidencia y, tratando de superar la dicotomía funcional-orgánico, se denominaron “Trastornos de la interacción cerebro-intestino”, clasificados por síntomas gastrointestinales, en relación con una combinación de alteraciones en motilidad, sensibilidad visceral, inmunidad mucosa, microbiota intestinal y procesamiento del sistema nervioso central (SNC). Establecieron, explícitamente, que la necesidad de una evaluación médica debe ser decidida en cada caso y, también, la posible coexistencia de TFGI con otros procesos patológicos gastrointestinales orgánicos (como la enfermedad inflamatoria intestinal) o no orgánicos(3,4). No obstante, y a pesar del intento de aclarar las definiciones, todavía se cuestiona su aplicabilidad en la práctica clínica habitual. Se espera que, en el 2026, sean publicados los nuevos criterios de Roma V, que avanzarán en estas consideraciones.
TFGI del niño pequeño
En general, son niños sanos con buena ganancia ponderal, en los que no se evidencia ninguna enfermedad de base. La información de los problemas que experimenta el paciente es recibida a través de los padres y/o cuidadores, con el componente subjetivo y de angustia que ello implica. Se consideran alteraciones transitorias de un sistema gastrointestinal y de un eje cerebro-intestino en desarrollo(3).
Los puntos clave del tratamiento son tranquilizar a los padres o cuidadores, mediante un diagnóstico proactivo precoz del trastorno funcional, explicando la benignidad del proceso y anticipando su historia natural hacia la resolución.
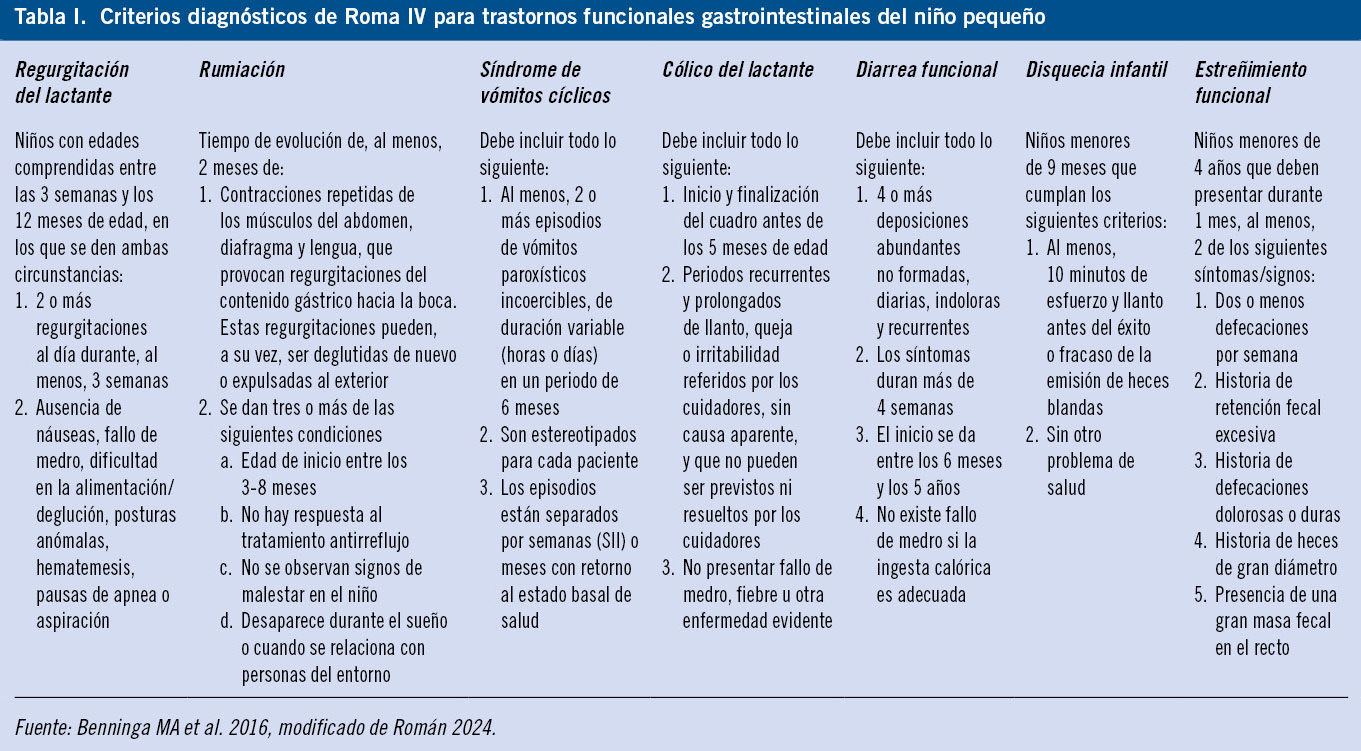
Los distintos cuadros clínicos se agrupan en 7 categorías, cuyos criterios diagnósticos se exponen en la tabla I(3,6).
TFGI del niño mayor
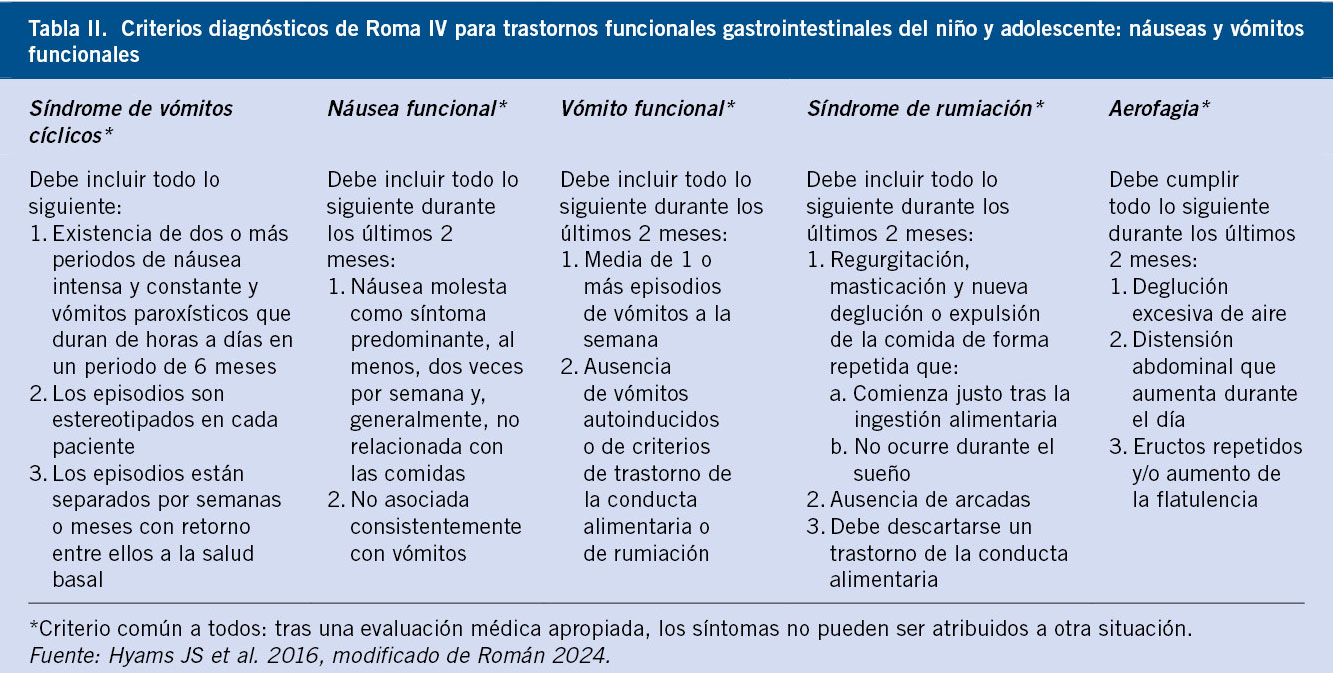
Como novedades, los criterios de Roma IV incluyeron en este grupo nuevos trastornos, como son las náuseas y vómitos funcionales; eliminaron como criterio diagnóstico la ausencia de enfermedad orgánica que explique los síntomas y consideraron como tal que: “los síntomas no pueden atribuirse a otra enfermedad, después de una evaluación médica adecuada”. El tratamiento se basa en un abordaje biopsicosocial, con el objetivo de normalizar la vida del paciente. Los distintos cuadros clínicos se agrupan en 3 categorías(4,6,7):
1. Trastornos de náuseas y vómitos funcionales (Tabla II).
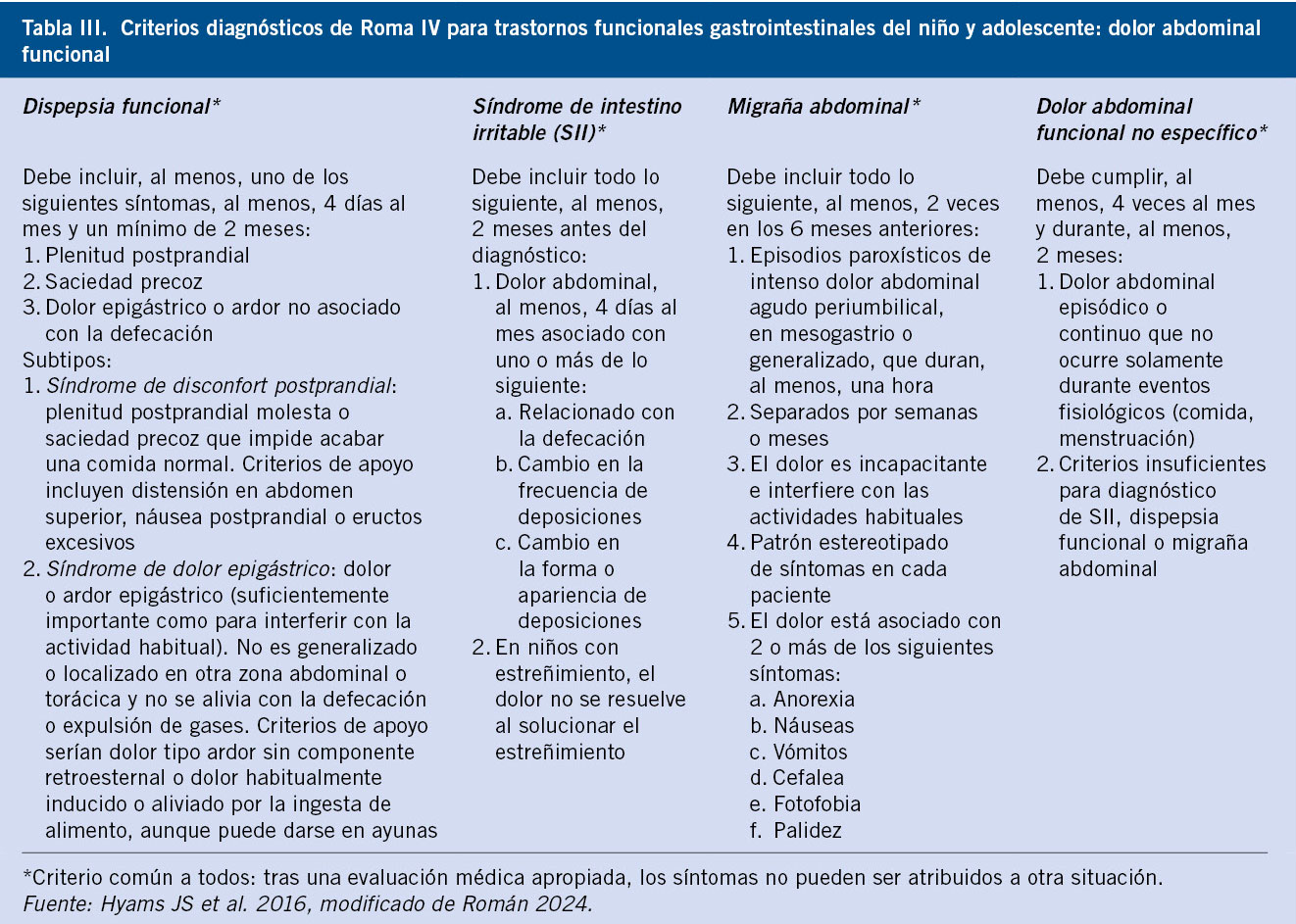
2. Trastornos de dolor abdominal funcional (Tabla III).
3. Trastornos de la defecación (Tabla IV).
Lactante regurgitador y/o irritable
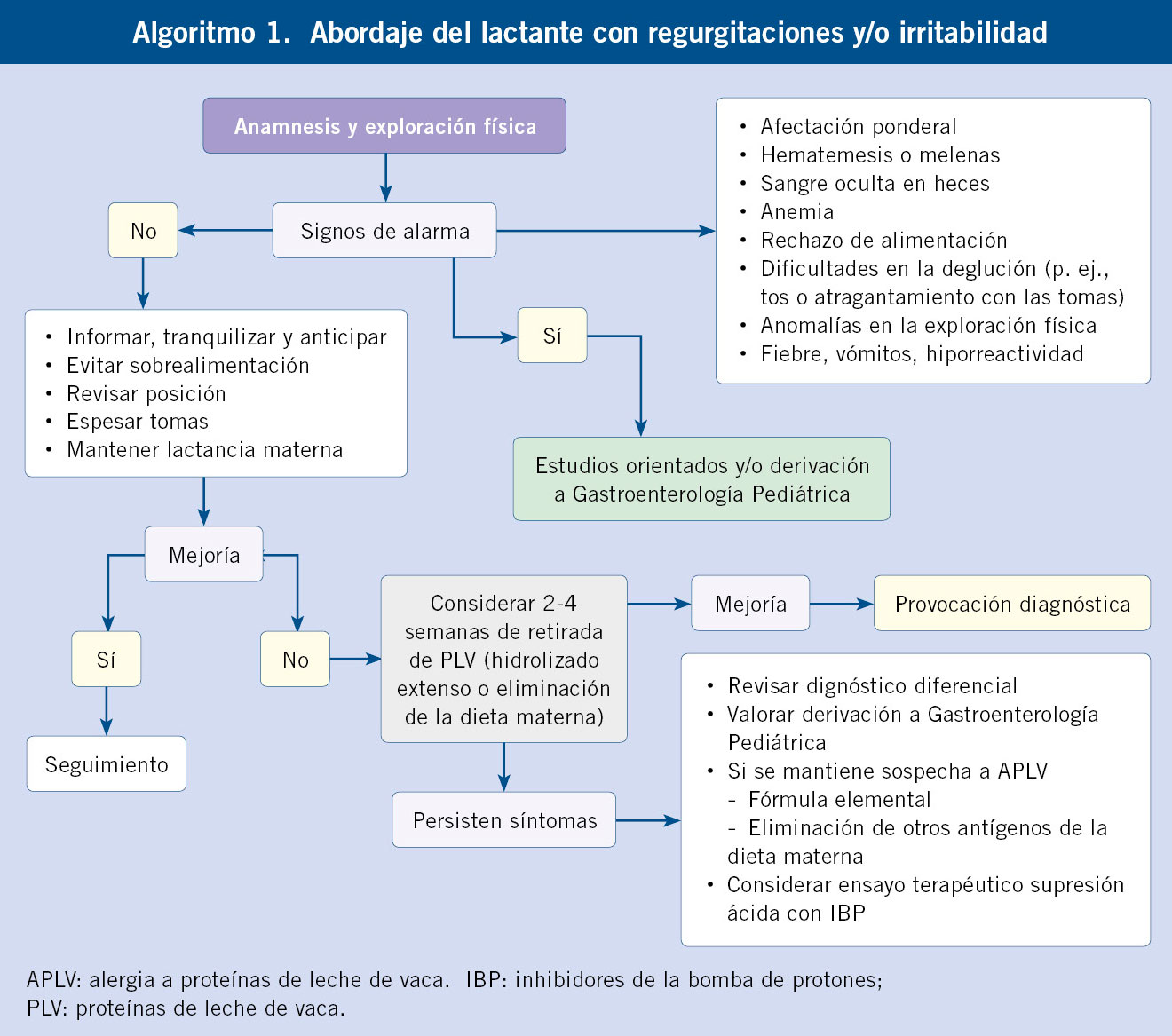
En el caso del niño regurgitador y/o irritable, la causa más probable es un trastorno funcional en relación con un eje cerebro-intestino en desarrollo. Es fundamental un diagnóstico precoz y seguimiento, anticipando la evolución natural a la resolución (en torno al 5º mes de vida para el cólico y al año de vida para la regurgitación) (Algoritmo 1).
Se considera regurgitación la emisión pasiva y sin esfuerzo del contenido gástrico a la boca, consecuencia de un esfínter esofágico inferior inmaduro o incompetente. La alta frecuencia de regurgitaciones en el lactante pequeño está justificada también por la escasa capacidad gástrica, el carácter líquido de la dieta, la postura habitualmente horizontal y la presencia de una aerofagia fisiológica. Es importante descartar siempre la existencia de signos de alarma que obligarían a descartar una patología de base. Los casos en que se asocian síntomas molestos y/o complicaciones, se considerarían ya enfermedad por reflujo gastroesofágico(3).
Los episodios de irritabilidad y llanto inconsolables que no pueden ser prevenidos por los cuidadores, pues ocurren sin causa aparente, se consideran cólicos del lactante. Los criterios de Roma IV ampliaron la edad de 4 a 5 meses y eliminaron la necesidad de una duración mínima de horas (criterio arbitrario) o una frecuencia mínima a la semana (difícil de aplicar en la práctica diaria). En este caso, los trastornos del eje cerebro-intestino consideran una interacción entre una base genética, eventos de la vida temprana, situaciones de estrés y tipo de afrontamiento y percepción parental asociado a una dismotilidad, hiperalgesia visceral, aumento de permeabilidad y componentes inflamatorios y de alteración del microbioma.
Respecto al tratamiento en las regurgitaciones del lactante, el tratamiento postural eficaz en decúbito prono está contraindicado por el riesgo de muerte súbita en los menores de un año y hay que evitar la posición semisupina sentada por el aumento de la presión intraabdominal. De forma individualizada, se podría considerar el espesamiento de las tomas en algunos lactantes con escasa ganancia ponderal, mediante el empleo de fórmulas espesadas con almidón de maíz, almidón de arroz o harina de semilla de algarrobo. Las recientes recomendaciones del Comité de nutrición de la ESPGHAN establecen, en los casos de regurgitaciones sin otros síntomas, si los padres experimentan una angustia importante, extraer la leche materna y complementar con agentes espesantes y, en los lactantes alimentados con fórmula, considerar las fórmulas infantiles espesadas industrialmente (fórmulas antirreflujo) o fórmulas con espesantes añadidos. Para evitar la sobrealimentación, generalmente se prefiere utilizar espesantes de bajo contenido energético, como la algarroba o la goma guar(8). Asimismo, en determinados casos, se podría hacer una prueba de retirada de proteínas de leche de vaca (PLV) a través de la dieta materna o con el empleo de hidrolizados extensos de PLV durante dos a cuatro semanas, con provocación diagnóstica posterior si mejoría(9). En el tratamiento farmacológico, hay suficiente evidencia sobre la falta de eficacia en el uso de inhibidores de la bomba de protones y no hay evidencia de beneficio en la evolución del proceso con el uso de procinéticos o antiácidos(10).
Al tratarse las regurgitaciones y cólicos del lactante de dos TFGI muy frecuentes en la primera infancia, no es infrecuente su coincidencia. Los criterios de Roma IV establecieron la ausencia de una buena correlación entre la existencia de enfermedad por reflujo gastroesofágico y el llanto o el comportamiento irritable del lactante. Estos síntomas dependerían de la percepción subjetiva, tanto de los cuidadores como del médico, existiendo falta de evidencia en el beneficio del uso de inhibidores de la bomba de protones.
La base del tratamiento en los casos de irritabilidad es tranquilizar y apoyar a los padres, explicando el llanto como una forma de expresar el lactante cualquier tipo de disconfort y reforzando el hecho de que se trata de un proceso autolimitado. Por lo general, no se recomienda el uso de “fórmulas anticólicos” u otras fórmulas con contenido modificado en lactantes con cólicos(8). Como en el caso del niño regurgitador, en determinados casos, sobre todo en presencia de otros síntomas cutáneos o respiratorios, se puede considerar la posibilidad de una alergia a PLV no mediada por IgE y plantear una dieta de eliminación de PLV durante 2 a 4 semanas(9). En lactantes alimentados al pecho, se contempla la administración del Lactobacillus reuteri DSM 17938 o Bifidobacterium lactis BB12, disminuyendo el tiempo de llanto(11). No hay evidencia de beneficio con ninguna medicación ni con el uso de terapias alternativas, como la osteopatía o la quiropráctica. Podría haber cierto beneficio con la administración de hierbas aromáticas como la camomila, melisa o hinojo, siempre que no interfiera con la nutrición del lactante(12).
Se han descrito, asociado a estos casos, sobremedicaciones, intervenciones nutricionales innecesarias (razón más frecuente para abandono de lactancia materna), riesgo de maltrato infantil (síndrome del niño zarandeado) y de depresión materna y aumento de incidencia posterior de TFGI y de trastornos de conducta(12).
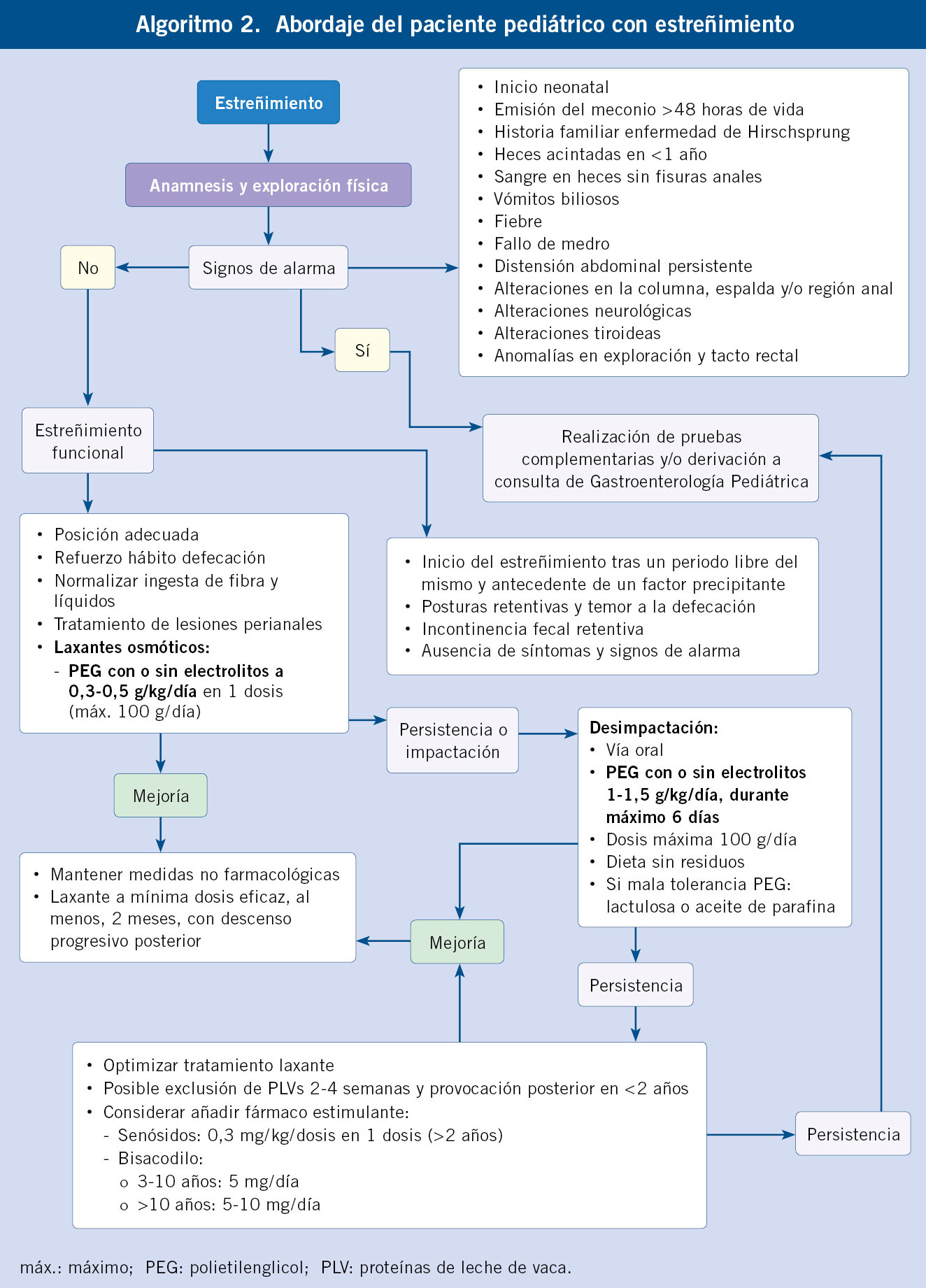
Estreñimiento funcional
El estreñimiento funcional es el TFGI más frecuente en todas las edades. El fracaso del tratamiento y/o la mala evolución, en la mayoría de los casos, está en relación con situaciones de infratratamiento (Algoritmo 2).
Consiste en la emisión dolorosa e infrecuente de heces duras o grandes que puede acompañarse, en niños con adecuado control de esfínteres, de episodios de incontinencia. Los criterios de Roma IV incorporaron la subdivisión en pacientes sin control de esfínteres y con adecuado control de esfínteres, teniendo en cuenta en estos últimos la incontinencia fecal y la emisión de heces de gran diámetro que puedan obstruir el inodoro(3,4).
Lo más frecuente es una actitud retentora por miedo a la defecación, lo que lleva a una mayor reabsorción de agua en el colon y a deposiciones de consistencia más dura, de gran tamaño y a la posible producción de fisuras anales. Esta actitud puede relacionarse con cambios en la dieta o el intento de control de esfínteres.
La historia clínica y exploración física, excluyendo signos o síntomas de alarma que planteen el diagnóstico diferencial con la enfermedad de Hirschsprung, obstrucciones anatómicas o alteraciones en la columna vertebral, metabólicas o neuroentéricas, confirman el diagnóstico, sin precisar muchas veces de la realización de un tacto rectal. La detección de algún dato de alarma implica la indicación de exploraciones complementarias orientadas a descartar otras patologías, principalmente enfermedad celíaca e hipotiroidismo. Respecto a los estudios de imagen, se descarta la indicación de la radiografía simple de abdomen y se plantea la utilidad de la ecografía para valorar el diámetro rectal y el posible diagnóstico de impactación fecal.
El objetivo del tratamiento es reblandecer las heces y evitar el dolor. En niños más mayores, el abordaje es fundamentalmente conductual, reforzando y facilitando el hábito de la defecación. Es importante informar sobre la posición más adecuada, con una base de apoyo en los pies para una prensa abdominal más eficaz, así como el reforzar la rutina de un patrón defecatorio diario y el tratamiento de lesiones anales si existiesen. No se recomienda el aumento de ingesta de fibra, pero sí completar los requerimientos diarios normales para la edad. La fibra medicamentosa no es más efectiva y es peor tolerada, por lo que su uso en Pediatría está muy limitado. No hay una base fisiopatológica para la recomendación de aumentar la ingesta de agua, pues la mayor parte es reabsorbida en tramos proximales, por lo que sería cuestionable su utilidad para reblandecer(13).
Respecto a la alimentación en niños pequeños, tanto en lactantes amamantados como en los alimentados con fórmula, se deben aplicar intervenciones no nutricionales como tratamiento de primera línea. No se debe interrumpir la lactancia. En casos seleccionados, se puede considerar el uso de fórmulas con alto contenido de β-palmitato o con mayor contenido de magnesio para ablandar las heces(8).
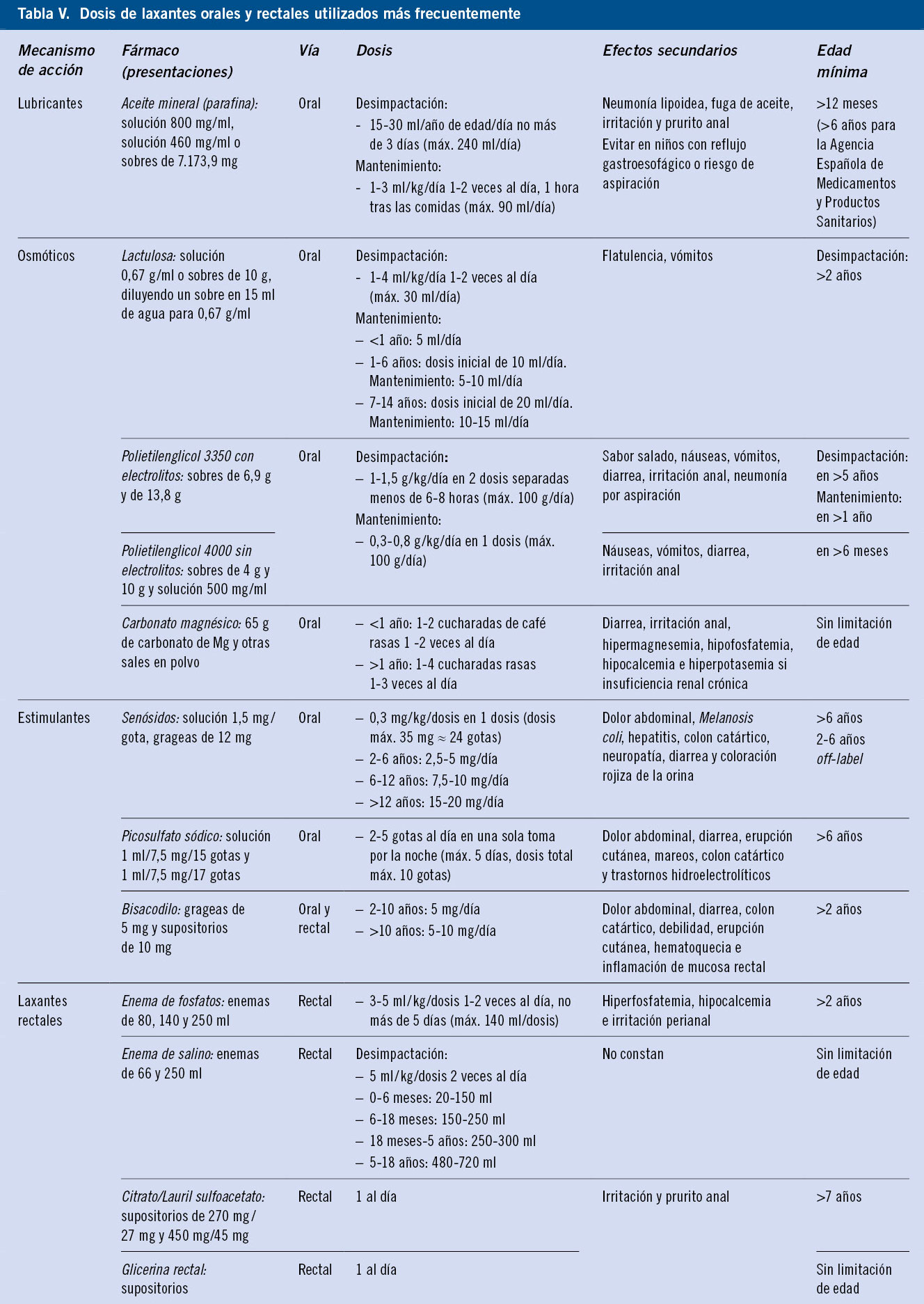
Se considera importante un tratamiento laxante adecuado, mediante laxantes osmóticos tipo polietilenglicol (PEG), lactulosa o leche de magnesio, siendo el de primera elección el PEG con o sin electrolitos(13,14), seguido de aceite mineral y laxantes estimulantes. Es fundamental la indicación de una dosis adecuada y, al menos, durante 2 meses, pues la principal causa de mala respuesta al tratamiento es la infradosificación y la corta duración del mismo. Se considera un estreñimiento funcional como refractario, cuando no responde al tratamiento habitual óptimo durante un mínimo de 3 meses, incluyendo estimulación rectal. En la tabla V se exponen las dosis de laxantes orales y rectales utilizados más frecuentemente según las últimas guías de práctica clínica, Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) y Pediamecum. Se exponen, así mismo, las dosis, en caso de ser necesario realizar una desimpactación.
Como en los TFGI previos, en los primeros años y en casos sugestivos de componente alérgico, se puede plantear una prueba de exclusión de PLV durante 2-4 semanas. La respuesta a la retirada y a la reintroducción confirmaría el diagnóstico de trastorno de la motilidad inducido por proteínas alimentarias(9). Hay falta de evidencia para el empleo de probióticos(11).
En niños mayores es importante diferenciar el estreñimiento funcional con encopresis de la incontinencia fecal no retentiva, con una frecuencia de defecación normal y en lugares inapropiados (ropa interior, suelo, cama…) para el contexto sociocultural del niño y en ausencia de retención fecal. Hay que descartar alteraciones emocionales y puede ser un signo de alarma para investigar abusos sexuales(4).
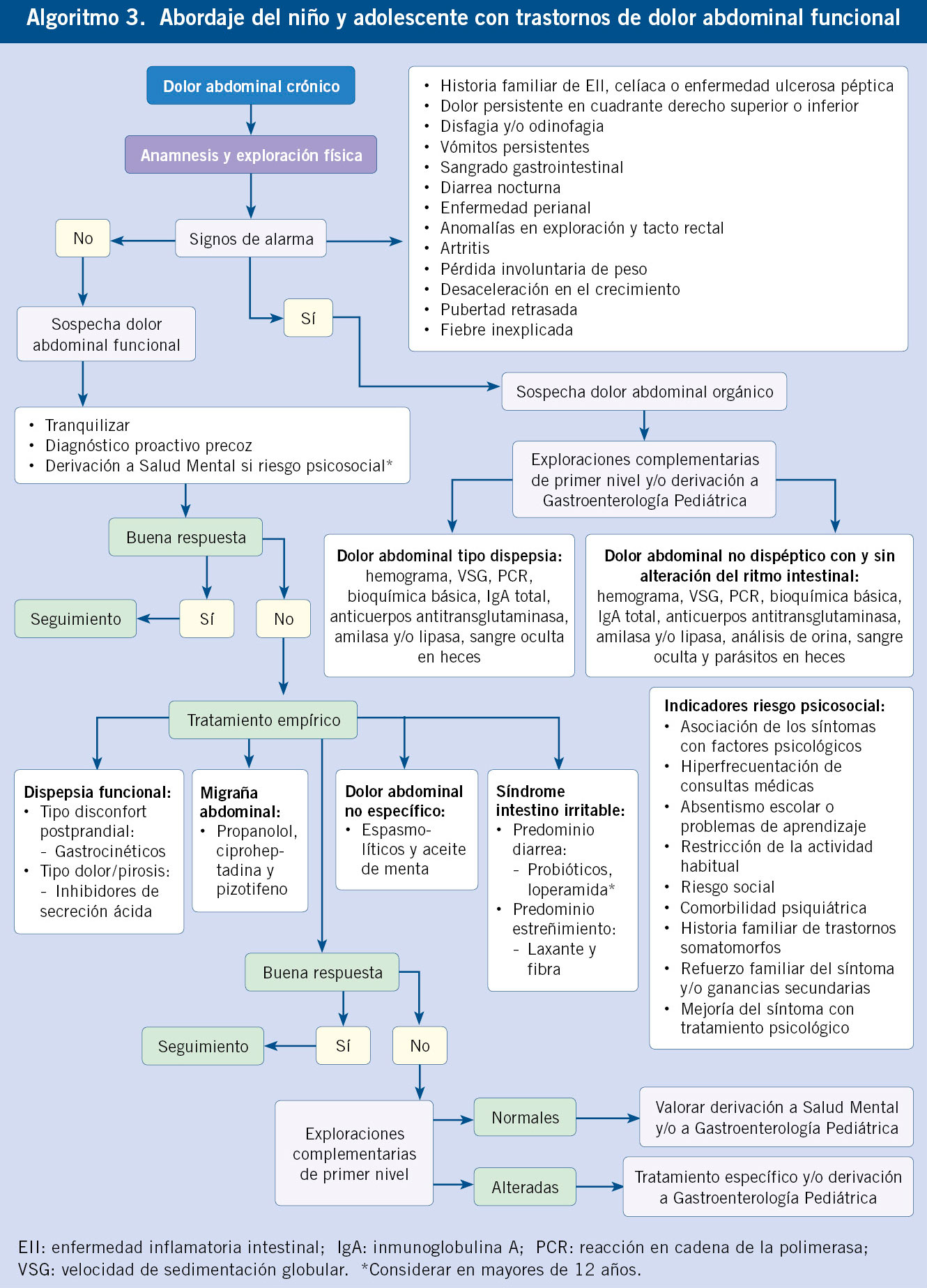
Trastornos de dolor abdominal funcional
El síntoma dominante es el dolor abdominal, distinguiéndose varios subtipos dependiendo de la sintomatología acompañante. Se trata de un diagnóstico de primera línea, no de exclusión, aunque la evolución de cada caso pueda hacer cambiar el diagnóstico a lo largo del seguimiento (Algoritmo 3).
El pediatra, además de explicar el concepto de funcionalidad, tranquilizar por la ausencia de síntomas de alarma y apoyar al niño y a la familia mediante visitas de seguimiento, tendría que intentar descubrir los posibles desencadenantes. El tratamiento está orientado a recuperar la actividad normal y mejorar la calidad de vida del paciente y su familia, no a conseguir la desaparición completa de los síntomas, tratando de evitar los ingresos y valorando la conveniencia del tratamiento empírico(7).
Existe escasa evidencia en la literatura científica sobre la eficacia del tratamiento farmacológico. Es un tratamiento sintomático, por lo que la elección del fármaco debe estar basada en el subtipo clínico y en el síntoma predominante del cuadro. Hay que considerar también otros abordajes no farmacológicos (terapia cognitivo-conductual, acupuntura, yoga, masajes, manipulación espinal, moxibustión o actividades físicas)(15). En todo momento, hay que considerar el efecto placebo de la intervención o la historia natural con mejoría de los síntomas.
Abordaje según subtipos
Dispepsia funcional
La principal característica es el dolor o disconfort localizado en el epigastrio. Los criterios de Roma IV contemplan dos subtipos de dispepsia, el síndrome de disconfort postprandial (plenitud postprandial molesta o saciedad precoz que impide acabar una comida normal), y el síndrome de dolor epigástrico (dolor o ardor epigástrico suficientemente importante como para interferir con la actividad habitual).
Un hecho importante es que se ha eliminado la necesidad de que haya “dolor” al hablar de dispepsia funcional y también la necesidad de disponer de una gastroscopia normal para confirmar el diagnóstico, estando indicada solo si hay datos sugestivos de patología orgánica. Se mantiene la “no indicación” de test no invasivos para el diagnóstico de la infección por Helicobacter pylori en estos pacientes(16).
Respecto a la orientación terapéutica, si destaca la pirosis y el dolor epigástrico, se puede hacer un ensayo terapéutico con inhibidores de la bomba de protones y, si el síntoma predominante es la plenitud o saciedad precoz, se puede plantear iniciar tratamiento con un procinético(4).
Síndrome de intestino irritable (SII)
Se caracteriza por dolor abdominal y alteración del hábito intestinal, siendo fundamental la relación que tiene el dolor con la defecación, tanto en frecuencia como en cambios en la consistencia. Se refuerza la diferencia con estreñimiento funcional: en niños con SII y predominio de estreñimiento, el dolor no se resuelve al solucionar el estreñimiento, a diferencia de lo que ocurre en el estreñimiento funcional. En los casos con predominio de diarrea, se plantearía el diagnóstico diferencial, con diarrea infecciosa, enfermedad celíaca, malabsorción de carbohidratos, sobrecrecimiento bacteriano o enfermedad inflamatoria intestinal.
Respecto al tratamiento, cuando predomina la diarrea, se ha extendido el uso de los probióticos, aunque la gran variabilidad de los estudios en cuanto a cepas, dosis y duración de tratamiento, impiden disponer de unas recomendaciones claras. No hay evidencia de eficacia de ningún tratamiento farmacológico, aunque en los casos con predominio de estreñimiento se ha utilizado el polietilenglicol(17). Respecto a la intervención nutricional, en niños no hay evidencia como hay en adultos para recomendar las dietas bajas en FODMAPs (Fermentable Oligosaccharides, Disaccharides, Monosaccharides And Polyols)(18). Si se decide establecer una dieta de prueba, implica un soporte nutricional adecuado y un seguimiento estrecho. En una primera fase se instaura una dieta estricta y se reevalúa la sintomatología en dos a cuatro semanas. Si hay respuesta, se introducen progresivamente grupos de alimentos para restringir aquellos que desencadenan síntomas; aunque, a veces, esto es difícil de valorar. Respecto a otras dietas restrictivas, una práctica común es la restricción en lactosa o fructosa. No hay evidencia de relación entre la intolerancia a la lactosa y los TFGI con dolor abdominal. La reducción de fructosa en la dieta se ha relacionado con una disminución en la intensidad de los episodios de dolor, aunque sin disminuir su frecuencia. Esta respuesta parece estar asociada más con el abandono de bebidas azucaradas y otros productos manufacturados que con la fructosa presente en alimentos naturales. Por todo ello, no debe recomendarse la eliminación de lactosa o fructosa de manera sistemática en estos pacientes, ni tampoco otras dietas restrictivas, como es la retirada del gluten o del trigo, dada la infrecuencia de la patología sensible al gluten/trigo en niños(19).
En el manejo terapéutico de estos pacientes tiene gran importancia el abordaje psicológico. La terapia cognitivo-conductual y la hipnosis, junto con los probióticos, son las intervenciones que han demostrado mayor evidencia en la mejoría de la sintomatología del SII(17).
Migraña abdominal
Episodios recurrentes y paroxísticos de dolor abdominal muy intenso e incapacitante, que suelen asociarse con síntomas vegetativos y que, característicamente, son estereotipados en cada paciente. Entre los episodios existe un estado basal de salud, durante el que pueden persistir otros síntomas digestivos menores. Como en el resto de trastornos funcionales, existe poca evidencia en cuanto al tratamiento farmacológico. Los fármacos más usados como profilácticos para disminuir la frecuencia e intensidad de las crisis son el propanolol y la ciproheptadina. En aquellos pacientes que asocian cefalea pueden usarse fármacos antimigrañosos, como flunarizina y pizotifeno(4).
Dolor abdominal funcional no específico
Cuadros de dolor abdominal, continuo o intermitente, que no cumplen criterios para ser clasificados como dispepsia funcional, intestino irritable o migraña abdominal. Con respecto a los criterios de Roma III se añadió a la definición “no especifico” para evitar confusiones.
Se ha descrito la eficacia del aceite de menta (pippermint). Se han utilizado los anticolinérgicos por su efecto espasmolítico y los antidepresivos a dosis bajas, aunque una reciente revisión de la Cochrane no recomienda su uso generalizado para el dolor crónico, incluido el abdominal(20). Teniendo en cuenta el riesgo/beneficio de estos fármacos, su uso debería limitarse a casos graves que no responden a otras terapias. Como en el síndrome de intestino irritable, el abordaje psicoterapéutico parece ser eficaz, sobre todo, la terapia conductual y la hipnoterapia(17).
Función del pediatra de Atención Primaria
El papel del pediatra de Atención Primaria es fundamental en el abordaje y orientación de estos trastornos, pues es el profesional que va a establecer los diagnósticos adecuados y a evitar intervenciones y tratamientos innecesarios. La base del abordaje terapéutico va a ser siempre transmitir confianza al paciente y a las familias. En determinados casos será preciso derivar a una unidad de Gastroenterología Pediátrica, para lo que es fundamental un abordaje conjunto de estos trastornos por parte del pediatra de Atención Primaria y del pediatra gastroenterólogo, para ofrecer una orientación común y poder transmitir a la familia y al paciente un mensaje uniforme y la misma tranquilidad desde todos los niveles de atención(7).
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1. Varni JW, Shulman RJ, Self MM, Nurko S, Saps M, Saeed SA, et al. Gastrointestinal symptoms predictors of health-related quality of life in pediatric patients with functional gastrointestinal disorders. Qual Life Res. 2017; 26: 1015-25.
2. Vernon-Roberts A, Alexander I, Day AS. Systematic Review of Pediatric Functional Gastrointestinal Disorders (Rome IV Criteria). J Clin Med. 2021; 10: 5087. Disponible en: https://doi.org/10.3390/jcm10215087.
3. Benninga MA, Faure C, Hyman PE, St James Roberts I, Schechter NL, Nurko S. Childhood Functional Gastrointestinal Disorders: Neonate/Toddler. Gastroenterology. 2016; 150: 1443-55.
4. Hyams JS, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, van Tilburg M, et al. Childhood Functional Gastrointestinal Disorders: Child/Adolescent. Gastroenterology. 2016; 150: 1456-68.
5. Dong TS, Mayer E. Advances in Brain-Gut-Microbiome Interactions: A Comprehensive Update on Signaling Mechanisms, Disorders, and Therapeutic Implications. Cell Mol Gastroenterol Hepatol. 2024; 18: 1-13. Disponible en: https://doi.org/10.1016/j.jcmgh.2024.01.024.
6. Román Riechmann E. Trastornos funcionales gastrointestinales: Trastornos eje cerebro-intestino (TECI). En: AEPap (ed.). Congreso de Actualización en Pediatría 2024. Madrid: Lúa Ediciones 3.0; 2024. p. 89-100.
7. Guías de actuación conjunta Pediatría Primaria-Especializada. Trastornos funcionales gastrointestinales. Grupo GastroSur-Oeste de Madrid de Gastroenterología Pediátrica. 2017. Disponible en: https://www.seghnp.org/sites/default/files/inline-files/2017_GastroSur_TFGI.pdf.
8.** Haiden N, Savino F, Hill S, Kivelä L, De Koning B, Köglmeier J, et al. Infant formulas for the treatment of functional gastrointestinal disorders: A position paper of the ESPGHAN Nutrition Committee. J Pediatr Gastroenterol Nutr. 2024; 79: 168-80. Disponible en: https://doi.org/10.1002/jpn3.12240.
9. Espín, B, Díaz Martin JJ, Blesa Baviera LC, Claver Monzón A, Hernández Hernández A, García Burriel JI, et al. Alergia a las proteínas de leche de vaca no mediada por IgE: documento de consenso de la SEGHNP, AEPAP, SEPEAP y SEICAP. An Pediatr. 2019; 90: 193.e1-e11.
10. Rosen R, Vandenplas Y, Singendonk M, Cabana M, DiLorenzo C, Gottrand F, et al. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the NASPGHAN and ESPGHAN. J Pediatr Gastroenterol Nutr. 2018; 66: 516-54.
11. Szajewska H, Berni Canani R, Domëllof M, Guarino A, Hojsak I, Indrio F, et al. Probiotics for the Management of Pediatric Gastrointestinal Disorders: Position Paper of the ESPGHAN Special Interest Group on Gut Microbiota and Modifications. J Pediatr Gastroenterol Nutr. 2023; 76: 232-47.
12. Indrio F, Dargenio VN, Francavilla R, Szajewska H, Vandenplas Y. Infantile Colic and Long-Term Outcomes in Childhood: A Narrative Synthesis of the Evidence. Nutrients. 2023; 15: 615. Disponible en: https://doi.org/10.3390/nu15030615.
13.** Rajindrajith S, Devanarayana NM, Thapar N, Benninga MA. Myths and misconceptions about childhood constipation.Eur J Pediatr. 2023; 182: 1447-58.
14. De Geus A, Koppen IJN, Flint RB, Benninga MA, Tabbers MM. An Update of Pharmacological Management in Children with Functional Constipation. Paediatr Drugs. 2023; 25: 343-58.
15.** Chakraborty PS, Daniel R, Navarro FA. Non-pharmacologic approaches to treatment of pediatric functional abdominal pain disorders. Front Pediatr. 2023: 11: 1118874. Disponible en: https://doi.org/10.3389/fped.2023.1118874.
16. Galicia Poblet G, Alarcón Cavero T, Alonso Pérez N, Borrell Martínez B, Botija Arcos G, Cilleruelo Pascual ML, et al. Manejo de la infección por Helicobacter pylori en la edad pediátrica. An Pediatr. 2021; 95: 383.e1-e9. Disponible en: doi.org/10.1016/j.anpedi.2021.05.014.
17.** Rexwinkel R, Vlieger AM, Saps M, Tabbers MM, Benninga MA. A therapeutic guide on pediatric irritable bowel síndrome and functional abdominal pain-not otherwise specified. Eur J Pediatr. 2022; 181: 2603-17.
18. Thomassen RA, Luque V, Assa A, Borrelli O, Broekaert I, Dolinsek J, et al. An ESPGHAN Position Paper on the Use of Low FODMAP Diet in Pediatric Gastroenterology. J Pediatr Gastroenterol Nutr. 2022; 75: 356-68.
19.** Valverde Fernández J, Román Riechmann E, Juste Ruiz M. Nutrición en los trastornos funcionales gastrointestinales. En: Manual de nutrición. Comité de Nutrición y Lactancia Materna de la AEP. Asociación Española de Pediatría. Madrid: Lúa Ediciones 3.0; 2021. p. 94-103.
20. De Bruijn CMA, Rexwinkel R, Gordon M, Benninga M, Tabbers MM. Antidepressants for functional abdominal pain disorders in children and adolescents. Cochrane Database Syst Rev. 2021; 2: CD008013. Disponible en: https://doi.org/10.1002/14651858.cd008013.pub3.
21. Infante Pina D. Dolor abdominal crónico y recurrente. Pediatr Integral. 2019; XXIII: 339-47. Disponible en: https://www.pediatriaintegral.es/publicacion-2019-10/dolor-abdominal-cronico-y-recurrente/.
Bibliografía recomendada
– Haiden N, Savino F, Hill S, Kivelä L, De Koning B, Köglmeier J, et al. Infant formulas for the treatment of functional gastrointestinal disorders: A position paper of the ESPGHAN Nutrition Committee. J Pediatr Gastroenterol Nutr. 2024; 79: 168-80. Disponible en: https://doi.org/10.1002/jpn3.12240.
Documento de posicionamiento del Comité de Nutrición de ESPGHAN, en el que se revisa la evidencia actual sobre la seguridad y eficacia de fórmulas específicamente elaboradas para abordar la regurgitación, los cólicos y el estreñimiento.
– Rajindrajith S, Devanarayana NM, Thapar N, Benninga MA. Myths and misconceptions about childhood constipation.Eur J Pediatr. 2023; 182: 1447-58.
Excelente revisión de varios mitos y conceptos erróneos ampliamente difundidos sobre el estreñimiento y que siguen interfiriendo con el tratamiento racional del estreñimiento infantil.
– Chakraborty PS, Daniel R, Navarro FA. Non-pharmacologic approaches to treatment of pediatric functional abdominal pain disorders. Front Pediatr. 2023: 11: 1118874. Disponible en: https://doi.org/10.3389/fped.2023.1118874.
Revisión de las intervenciones no farmacológicas utilizadas en el tratamiento de los trastornos de dolor abdominal funcional, incluidas modificaciones en la dieta, manipulación del microbioma intestinal e intervenciones psicológicas (terapia cognitivo conductual, hipnoterapia, técnicas de respiración y relajación).
– Rexwinkel R, Vlieger AM, Saps M, Tabbers MM, Benninga MA. A therapeutic guide on pediatric irritable bowel síndrome and functional abdominal pain-not otherwise specified. Eur J Pediatr. 2022; 181: 2603-17.
Propuesta de un enfoque personalizado para cada paciente, basado en sus síntomas físicos y psicológicos. Plantea una toma de decisiones compartida, incluidas las intervenciones farmacológicas y no farmacológicas, y discutida con la familia.
– Valverde Fernández J, Román Riechmann E, Juste Ruiz M. Nutrición en los trastornos funcionales gastrointestinales. En: Manual de nutrición. Comité de Nutrición y Lactancia Materna de la AEP. Asociación Española de Pediatría. Madrid: Lúa Ediciones 3.0; 2021. p. 94-103.
Actualización sobre el papel de la alimentación como uno de los pilares del tratamiento de los TFGI. La evidencia limitada sobre el efecto de la intervención nutricional refuerza la necesidad de evitar intervenciones dietéticas innecesarias y que puedan conllevar a carencias nutricionales.
| Caso clínico |
|
Niño varón de 4 años sin antecedentes personales de interés, en seguimiento por su pediatra por estreñimiento de 2 años de evolución, coincidiendo el inicio con la retirada del pañal. Los padres indican que durante los primeros años de vida realizaba 2-3 deposiciones diarias tipo 4-5 en la escala de Bristol, pero que a los 2 años comenzó a hacer una deposición cada 1-2 días de consistencia caprina, 1-2 en la escala de Bristol y con esfuerzo defecatorio. Presentó fisura anal con restos de sangre en las heces a los 3 años, iniciando desde entonces actitudes retentivas, con dolor durante la defecación. Han seguido tratamiento intermitente con polietilenglicol sin electrolitos (500 mg/ml), 5 ml al día, sin mejoría de los síntomas, retirándose a los pocos días por miedo a los efectos secundarios. Actualmente, administran de forma ocasional y durante 2-3 días polietilenglicol, con emisión de heces blandas tras su empleo. Sin embargo, los padres refieren preocupación, porque cuando no administran el laxante, el paciente puede permanecer 3 o 4 días sin realizar deposición. Asocia disconfort abdominal ocasional que calma al realizar deposición. Sin vómitos. Refieren dieta variada, curva ponderoestatural ascendente (p48 de peso) e ingesta adecuada, sin rechazo de alimentación. Acudió en una ocasión a Urgencias por estreñimiento de 4 días de evolución, realizándose radiografía de abdomen, en la que se objetivaban abundantes heces desde recto hasta marco cólico izquierdo. En esta ocasión administraron enema de suero salino que fue efectivo. Presenta una exploración física normal, salvo abdomen globuloso, aunque blando y depresible, palpándose masas fecales en fosa iliaca izquierda. Refiere molestias a la palpación profunda en región periumbilical, sin datos de irritación peritoneal. Exploración perianal sin alteraciones.
|


 Esophageal pathology
Esophageal pathology 