 |
| Temas de FC |
A. Hernández Hernández1![]() , G. García Ron2, R. da Cuña Vicente3, C. Coronel Rodríguez4
, G. García Ron2, R. da Cuña Vicente3, C. Coronel Rodríguez4
1Centro de Salud de Tacoronte. Tenerife, 2Centro de Salud de Las Águilas. Madrid,3Zona Básica de Salud Íscar. Valladolid, 4Centro de Salud Amante Laffón. Sevilla
| Resumen
En la edad pediátrica, el manejo de la infección por Helicobacter pylori (HP) ha planteado muchas controversias: escasa correlación entre los síntomas digestivos y la presencia de infección por HP; en niños, la infección por HP es poco probable que tenga las consecuencias que muestra en adultos: enfermedad ulceropéptica (PUD) o cáncer gástrico (CaG) e, incluso, puede tener algún beneficio; creciente resistencia a antibióticos (claritromicina) que hace necesario tratamiento erradicador (>90 %), no basado en “prueba y tratamiento” empírico, sino en “estrategia de estrategia”: endoscopia, biopsia y cultivo; el diagnóstico y/o tratamiento no debe estar basado en pruebas no invasivas. Todo ello llevó a la NASPGHAN y a la ESPGHAN (North American Society for Pediatric Gastroenterology, Hepatology and Nutrition y European Society for Paediatric Gastroenterology Hepatology and Nutrition), en 2017, a revisar la literatura para proporcionar pautas actualizadas del tratamiento de la infección por HP en la población pediátrica de América del Norte y Europa. En 2021, autores de diferentes sociedades científicas pediátricas españolas publican un documento de consenso, sobre la base de la revisión de la literatura hasta diciembre de 2020, para aunar criterios sobre el manejo, diagnóstico y tratamiento de la infección por HP en la edad pediátrica en España. En agosto de 2024, la ESPGHAN/NASPGHAN publican nuevas guías que cambian algunas de las recomendaciones previas y matizan otras. En esta revisión se trata de actualizar posturas y controversias, basadas en estos documentos, con respecto al tema y su manejo, tanto a nivel de Atención Primaria como hospitalario, en nuestro país. |
| Abstract
In the pediatric age, the management of Helicobacter pylori (HP) infection has raised many controversies: Little correlation between digestive symptoms and the presence HP infection; In children, HP infection is unlikely to have the consequences that it shows in adults: peptic ulcer disease (PUD) or gastric cancer (GCa), and may even have some benefit; Increasing resistance to antibiotics (clarithromycin) that requires eradication treatment (>90 %), not based on empirical “test and treatment” but on “strategy of strategy”: endoscopy, biopsy and culture; The diagnosis and/or treatment should not be based on non-invasive tests. All of this led NASPGHAN and ESPGHAN (North American Society for Pediatric Gastroenterology, Hepatology and Nutrition and European Society for Paediatric Gastroenterology Hepatology and Nutrition), in 2017, to review the literature to provide updated guidelines for the treatment of HP infection in the pediatric population of North America and Europe. In 2021, authors from different Spanish pediatric scientific societies publish a consensus document, based on the review of the literature until December 2020, combining criteria on the management, diagnosis and treatment of HP infection in pediatric age in Spain. In August 2024, ESPGHAN/NASPGHAN published new guidelines that changed some of the previous recommendations and clarified others. This review attempts to update positions and controversies, based on these documents, regarding this issue and its management, both at the Primary Care and hospital levels, in our country. |
Palabras clave: Infección por Helicobacter pylori en niños; Pruebas de erradicación; Secuenciación de próxima generación; Resistencia a los antibióticos.
Key words: Helicobacter pylori infection in children; Testing for eradication; Next generation sequencing; Antibiotic resistance.
Pediatr Integral 2024; XXVIII (7): 440 – 452
OBJETIVOS
• Valorar correctamente la clínica digestiva del paciente pediátrico, mediante una adecuada historia clínica y exploración, con el objetivo de diferenciar el dolor abdominal funcional de aquel que pueda tener alguna causa específica orgánica y tratable.
• Saber por qué y para qué solicitar los exámenes complementarios a su alcance en el primer nivel, orientados a confirmar o descartar patología orgánica, y no solo la presencia de infección por HP como posible causa, sino las repercusiones gástricas que pueda tener y su correcto diagnóstico y tratamiento, informando de forma clara a los padres.
• Conocer las indicaciones de derivación al pediatra digestivo de segundo nivel, con la intención de que valore, no solo la presencia de HP, sino si hay lesiones subsidiarias de ser tratadas lo más específicamente posible.
• Hacer un seguimiento y apoyo adecuados que favorezca el cumplimiento completo de la pauta de tratamiento indicada en atención especializada.
• Seguir y verificar la normalización de dicha clínica a lo largo del tiempo, una vez tratado, e indicar, en su caso, nueva revaloración por atención especializada.
Nuevas estrategias para el diagnóstico y tratamiento de la infección por Helicobacter pylori
Introducción
La infección por Helicobacter pylori (HP) en niños es mayoritariamente asintomática y no está relacionada con la clínica; causa, con baja frecuencia, enfermedad ulceropéptica, y el cáncer gástrico es muy poco probable. Por lo tanto, la estrategia “test y tratamiento” ha de ser abandonada por la de biopsia, cultivo y tratamiento antibiograma guiado.
Los doctores Warren y Marshall fueron los primeros en describir la relación entre la enfermedad ulceropéptica (PUD) y la infección por HP en el año 1982, lo que marcó un antes y un después en el manejo de esta patología, motivo por el cual recibieron el premio Nobel de Medicina en el año 2005.
La infección por HP se adquiere en la infancia y sigue siendo una causa importante de PUD y cáncer gástrico (CaG) en adultos, principalmente. Los niños y los adolescentes desarrollan con poca frecuencia estas complicaciones. Además, la infección por HP en la primera infancia puede estar asociada con beneficios inmunológicos en el futuro, en la prevención de obesidad, alergias, asma, enfermedad celiaca, u otras enfermedades gastrointestinales como la esofagitis eosinofílica o la enfermedad inflamatoria intestinal, aunque esto sigue siendo controvertido y no hay evidencia suficiente(1).
Las directrices conjuntas ESPGHAN/NASPGHAN (European Society for Paediatric Gastroenterology Hepatology and Nutrition/North American Society for Pediatric Gastroenterology, Hepatology and Nutrition) se desarrollaron para el tratamiento de la infección por HP en niños y adolescentes en 2009 y se publicaron en 2011(2). Sobre la base de los nuevos conocimientos clínicos y, en particular, la necesidad creciente de llevar a cabo una terapia de erradicación que evite las altas incidencias de resistencias a antibióticos usados clásicamente, especialmente la claritromicina, por un lado, y, por otro, la baja probabilidad de que dicha infección cause síntomas sin PUD y menos CaG motivaron que la NASPGHAN y la ESPGHAN acordaran revisar la literatura para proporcionar pautas actualizadas para el tratamiento de la infección por HP en la población pediátrica en América del Norte y Europa, que se publicaron en junio de 2017(1). Estas pautas se aplican solo a pacientes pediátricos, definidos como niños y adolescentes menores de 18 años, y pueden diferir de las recomendaciones recientes dadas para adultos, debido a una relación riesgo-beneficio diferente según la edad y el país (la incidencia de CaG es mayor en países orientales, este de Asia, China y Japón, Europa oriental, meridional y en América del Sur), y al hecho de que algunos antibióticos no están autorizados en la población pediátrica(1).
En 2021, autores de diferentes sociedades científicas pediátricas españolas publican un documento de consenso, basándose en la revisión de la literatura hasta diciembre de 2020, para aunar criterios sobre el manejo, diagnóstico y tratamiento de la infección por HP en la edad pediátrica en España(3). Muy recientemente, en agosto de 2024, la ESPGHAN/NASPGHAN publican nuevas guías que cambian o matizan algunas de las recomendaciones previas(4).
Las nuevas pautas hacen hincapié en diferentes aspectos referentes al diagnóstico. El objetivo del estudio de los síntomas gastrointestinales es identificar la causa, en lugar de determinar si hay o no infección por HP. Por lo tanto, se ha de cambiar la estrategia de “prueba y tratamiento” por la de “criterio de criterio”, es decir, no se justifica la realización de un examen no invasivo para detectar la infección y tratar si la prueba es positiva, sin comprobar que haya lesiones a nivel gastrointestinal, dado que la clínica abdominal es poco probable si no existen lesiones gastrointestinales(4). El diagnóstico ha de basarse en pruebas invasivas: endoscopia gastrointestinal superior (EGC) con biopsias para cultivo, estudio anatomopatológico, test rápido de ureasa in situ (RUT) u otros. Los pacientes a estudiar se restringen a los que se sospecha PUD por síntomas de organicidad, a solo los que presentan anemia ferropénica, en las que se hayan descartado otras causas y sean resistentes al tratamiento, no como estudio de su causa. En las nuevas guías de 2024, la púrpura trombocitopénica inmunitaria crónica (PTIc) en niños deja de ser indicación de estudio de infección de HP, tanto con test invasivos como no invasivos. Tampoco es indicación tratar la infección por HP para mejorar el recuento plaquetario, pero si el niño se somete a una endoscopia gastrointestinal superior por sangrado, se puede considerar la realización de pruebas para HP y tratamiento si se le encuentra(4). No son indicación de estudio, los pacientes que presentan dolor abdominal crónico funcional o niños con talla baja o asintomáticos con familiares con antecedentes de PUD o CaG(3); en estos últimos y solo en familiares de primer grado afectos con CaG, se sugiere realizar estudio de HP con test no invasivos, test de aliento con urea marcada con C13 o con prueba de determinación de antígenos monoclonales en heces. Esta recomendación es con evidencia baja a moderada(4).
En cuanto al tratamiento, ha de estar basado en la demostración de infección en pacientes con PUD por cultivo o estudios moleculares (PCR) y buscando la erradicación mediante estudios de sensibilidad específica, o bien, en su caso, tener en cuenta resistencias locales y nacionales del HP a los antibióticos usados, así como tratamientos previos, sobre todo, el uso de claritromicina. El objetivo es conseguir una tasa de erradicación del 90 % con la terapia inicial. El tratamiento debe administrarse durante 14 días, insistiendo en la adherencia y el cumplimiento estricto del mismo. Los regímenes que contienen claritromicina deben restringirse a niños infectados con cepas susceptibles. Cuando no se conocen los perfiles de susceptibilidad a los antibióticos, se recomienda la terapia triple de alta dosis con inhibidor de la bomba de protones (IBP), amoxicilina (AMO) y metronidazol (MET) durante 14 días o una terapia cuádruple basada en bismuto, evitando el uso de claritromicina (CLA). El éxito de la terapia debe controlarse después de 6 a 8 semanas mediante pruebas no invasivas confiables: test de urea marcada con carbono 13 exhalada (13C-UBT) o Ag monoclonales en heces. Como norma general, para la realización de pruebas invasivas y no invasivas se recomienda un periodo de 2 semanas sin IBP, al menos, y de 4 semanas sin tomar antibióticos o sales de bismuto(3,4).
En poblaciones de alta prevalencia de CaG, como Japón o China, el beneficio del tratamiento en reducir la tasa de dicha neoplasia puede ser mayor que el riesgo que provoca (efectos secundarios y aumento de resistencia). En estos países se está apostando por la prevención primaria mediante una vacuna, con resultados prometedores en un ensayo en fase III, aunque requiere de mayor optimización para garantizar una protección duradera(5).
Epidemiología
La infección por HP afecta a 4.400 millones de personas. Se inicia desde la primera infancia, con claro predominio en los países en vías de desarrollo. La prevalencia en estos se mantiene estable, a diferencia de los países más desarrollados donde desciende, con las correspondientes implicaciones que ello supone.
La infección por HP es un problema de salud pública y es la infección crónica más frecuente a nivel mundial, de inicio en la infancia y duradera de por vida. Se ha estimado que esta bacteria infecta al 50 % de la población mundial, unos 4,4 mil millones de personas. En los países en vías de desarrollo, el 50-66 % de las personas están infectadas a los 2 años de edad, con riesgo de infección creciente a ritmo de 3-10 %/año. En los países desarrollados, el 10-20 % de los niños están infectados a los 10 años y la prevalencia aumenta a ritmo de 0,5-1 %/año.
La transmisión se produce de persona a persona, vía oro-oral o feco-oral, intrafamiliar, de padres a hijos y entre hermanos.
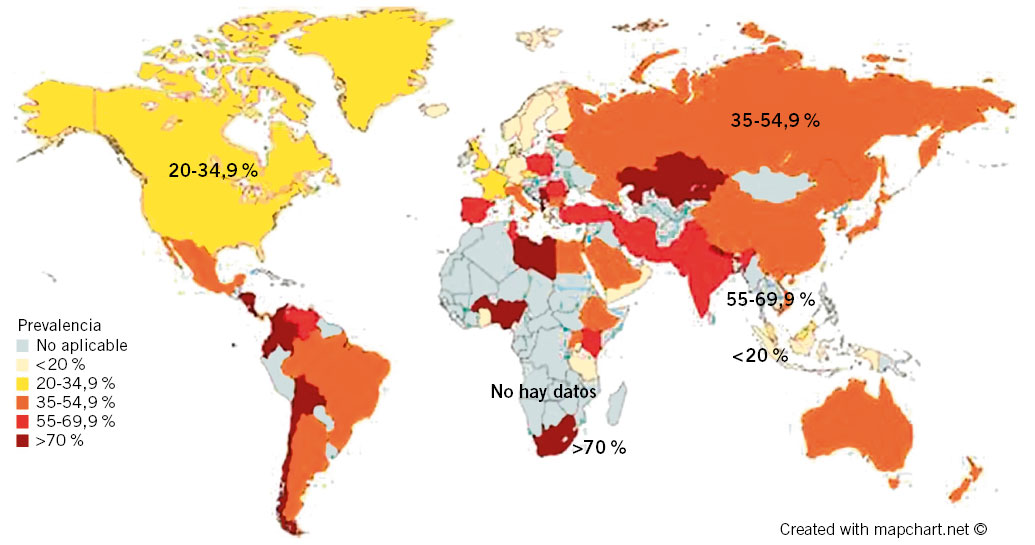
Las mayores tasas de prevalencia mundial afectan a países en vías de desarrollo: África (79,1 %), América Latina y el Caribe (63,4 %) y Asia (54,7 %). Las regiones con prevalencia más baja son Norteamérica (37,1 %) y Oceanía (24,4 %) (Fig. 1). Aunque estas diferencias puedan explicarse por factores, como acceso al agua potable, urbanización, sanidad y estatus socioeconómico, entre otros, lo cierto es que dentro de un mismo país o, incluso, región, pueden encontrarse importantes diferencias. En EE.UU., la prevalencia de blancos no hispanos vs. no blancos oscila entre (18,4-26,2 % vs. 34,5-61,6 %), y puede llegar al 75 % en la población nativa de Alaska(6).
Figura 1. Prevalencia del Helicobacter pylori (HP) mundial. Modificada de: Hooi JKY, Ying Lai W, Khoon Ng W, Suen MMY, Underwood FE, Tanyingoh D, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017; 153: 420-29.
Se ha observado una disminución de la prevalencia en los países altamente industrializados del mundo occidental: Europa, América del Norte y Oceanía; mientras que ha seguido estancada en los países en vías de desarrollo, como Asia, América Latina y Caribe. Esto tiene importantes implicaciones en cuanto a las secuelas de la infección por HP, incluida la PUD y el CaG, así como en las estrategias de diagnóstico y erradicación.
Patogenicidad del HP
La infección por HP está relacionada con la PUD, el CaG y el linfoma MALT (linfoma de tejido linfoide asociado a mucosas), condicionados por factores de virulencia del HP y otros genéticos del hospedador.
El Helicobacter pylori es una bacteria Gram negativa, espiral y flagelada, que coloniza específicamente la mucosa gástrica del ser humano. El HP, ante situaciones adversas (presencia de antibióticos, acidez gástrica), puede transformarse de una forma espiral activa a una cocoide inactiva, resistente a los antibióticos y a la acidez gástrica, que le permite permanecer latente sin perder vitalidad ni factores de virulencia, permitiendo una infección crónica y refractaria al tratamiento. En esta forma, también constituye un reto diagnóstico al no ser cultivable y generar falsos negativos en el test de aliento con urea marcada con 13C, además de dificultar su identificación morfológica en las biopsias(7).
El CaG es la tercera causa de muerte por cáncer en el mundo, mata casi a un millón de personas/año (780.000 muertes/año). El 90-100 % de CaG está relacionado con la infección crónica de HP. Las tasas de prevalencia de infección de HP se correlacionan con la incidencia de CaG salvo en África, “enigma africano”. Allí se dan altas tasas de infección por HP con relativa baja incidencia de CaG. Factores genéticos, ambientales (la coinfección con ciertos parásitos puede modificar la respuesta inmunológica en un sentido Th2 u otro Th1) u otras circunstancias (población con esperanza de vida más corta, con peor acceso a sistemas sanitarios y registros adecuados), parecen descartar dicha diferencia(7).
El Centro Internacional de Investigaciones sobre el Cáncer (IARC) considera al HP carcinógeno Clase I y, la OMS, en 2017, lo declara como uno de los 12 patógenos prioritarios, colocando a esta bacteria dentro de la categoría de alta prioridad por su creciente resistencia a antibióticos y ser una amenaza para la salud pública(8).
La mayoría de las infecciones por HP, más del 80 % de los casos, son asintomáticas. Cuando presentan clínica, se asocian a enfermedad ulceropéptica en el 5-10 %, a dispepsia en el 1-10 %, a cáncer gástrico no-cardias en <1 % y a linfoma de tejido linfoide asociado a las mucosas (MALT) en <0,1 %(9).
La infección por HP no solo va a producir efectos sobre la mucosa gástrica, sino que se han descrito consecuencias extradigestivas: anemia ferropénica refractaria al tratamiento y trombocitopenia inmune primaria crónica (PTIc). En esta última y en lo que se refiere a la PTIc en niños, a diferencia de los adultos, no hay evidencia de que el HP sea causa de PTIc ni de que la evolución de la misma difiera por hacer tratamiento de HP(4). En el caso de anemia ferropénica refractaria a tratamiento, cuando en la realización de endoscopia superior para el estudio de la misma se encuentre el HP, se recomienda tratar(1,4). La infección por HP se ha relacionado con talla baja en países del tercer mundo; sin embargo, no ha podido ser demostrada en países europeos; esta ni es motivo para hacer estudio de HP ni se ha visto que su tratamiento, cuando se encuentra HP, modifique el pronóstico de talla(1,4). En otras entidades, como la obesidad, la diabetes mellitus tipo 1, la enfermedad celiaca, la púrpura de Schönlein Henoch, la enfermedad atópica (rinitis, asma, esofagitis eosinofílica…), la halitosis, la estomatitis aftosa recurrente o la otitis media con derrame, los estudios presentan resultados contradictorios: no muestran dicha relación o carecen de la suficiente calidad(3,4).
Por otra parte, se ha observado que la infección por HP puede ser un factor protector contra la enfermedad por reflujo gastroesofágico, esófago de Barret y adenocarcinoma esofágico, por el efecto alcalinizante de la ureasa sobre el ambiente ácido del estómago y de otras patologías como la atopia, asma o enfermedad inflamatoria intestinal (EII), llegando a cuestionarse su papel como patógeno e incluso considerándolo como parte de la microbiota comensal(10,11).
Los mecanismos de virulencia y patogénesis del HP están condicionados por:
• La capacidad de supervivencia del HP en un medio ácido, como el estómago (ureasa).
• La presencia de flagelos, que le permiten moverse dentro del mucus gástrico, alcanzar la mucosa gástrica y adherirse a la misma mediante una serie de adhesinas de superficie, que se unen a receptores específicos del epitelio gástrico, dando lugar a una colonización crónica.
• La liberación de una serie de toxinas vacuolantes (vacA), codificadas por los genes VacA s1/m1 y VacA m1, no solo causa daño epitelial, edema e inflamación, sino alteraciones inmunológicas. Otras toxinas son inyectadas directamente en la célula epitelial (CagA, sistema de secreción tipo IV), precisamente las cepas CagA+ y VacA (s1m1) son las que se consideran más patógenas y conllevan un mayor riesgo de lesiones precancerosas, sobre todo, si se produce infección simultánea por ambas cepas y desde la infancia.
Estos factores de virulencia producen cambios en la comunicación y en la señalización intracelular, favoreciendo la apoptosis celular y la oncogénesis, además de ser capaces de modificar o alterar la respuesta inmune celular y el propio equilibrio inmunológico, para no solo evadir el sistema inmune, favoreciendo la colonización crónica, y también la proliferación y el escape de las células cancerosas(10). Dichos factores de virulencia y sus mecanismos de acción se resumen en la figura 2 y tabla I.
Figura 2. Factores de virulencia del Helicobacter pylori. Modificada de: Longo DL, et al. Harrison. Principios de Medicina interna. 18 ed. Mc Graw Hill.
Clínica
La infección por HP es mayoritariamente asintomática. Si hay síntomas de organicidad, pueden indicar lesiones de la mucosa gástrica: no hay relación del dolor abdominal funcional con la presencia de infección por HP.
La infección por HP se adquiere, en su mayoría, en la infancia. En España, el 20 % de los niños escolares están infectados, alcanzando hasta el 51 % de prevalencia en los niños entre 11-15 años. Sin embargo, la infección por HP es mayoritariamente asintomática (80-90 %). Las manifestaciones clínicas, cuando las hay, son frecuentemente inespecíficas y otras pueden estar justificadas por la presencia de complicaciones (anemia ferropénica, desnutrición, talla baja, etc.)(12).
En un metaanálisis no se ha encontrado asociación entre la infección de HP con el dolor abdominal recurrente, ni con vómitos, diarrea, flatulencia, halitosis, regurgitación, estreñimiento o náuseas; sí se observó asociación con dolor abdominal inespecífico (aquel que no cumple completamente los criterios del dolor funcional) y, en el ámbito hospitalario, o sea, en pacientes que previamente han sido remitidos por sospecha de organicidad, y no en pacientes de AP, también se relacionó con dolor epigástrico, vómitos persistentes, hemorragia digestiva y anemia ferropénica(13). En la anemia ferropénica refractaria, y cuando se realice estudio gastroendoscópico en busca de causa de la misma por fallo al tratamiento habitual, puede indicarse estudio de HP y tratarlo en su caso, no así en el PTIc(4). La presencia de desnutrición o talla baja no justifica el estudio de infección por HP.
Macarthur et al., en una revisión sistemática (con metaanálisis), publicada en 1995 en estudios retrospectivos, sí observó un mayor riesgo de dolor abdominal recurrente en los niños infectados con HP, que no se confirmó en otros estudios de carácter prospectivo de mayor tamaño(14).
Son varios los artículos publicados recientemente, en los que no se encuentra relación alguna entre la presencia de sintomatología digestiva: dispepsia, dolor abdominal crónico, náuseas, halitosis o pérdida de apetito, con estar o no infectados por HP(3,12).
Indicaciones diagnósticas
La prioridad no es el diagnóstico de la infección, sino la causa que motiva la clínica. El hallazgo de lesiones gástricas con infección de HP indica cultivo y tratamiento con antibiograma guiado.
La primera pregunta a resolver es a qué pacientes está indicado investigar la presencia de infección por HP. Como se ha comentado previamente, al no estar relacionado el dolor abdominal funcional y/o la dispepsia con la infección del HP(15), no está justificado realizar estudios en este tipo de pacientes, salvo que la clínica sea sugestiva de causa orgánica (Tabla II), por lo que se debe indicar una gastroesofagoscopia (GEC) para determinar la causa subyacente de los síntomas y no solamente el diagnóstico de infección por HP(3,4).
Los hallazgos de la GEC que indican estudio y búsqueda de infección por HP son las erosiones y úlceras gastrointestinales, aunque solo son causa de síntomas en el 5 % de los casos. En los niños, es más frecuente que la infección por HP cause gastritis en el antro de tipo nodular, sin úlcera, lo que no supone, por lo general, riesgo para el paciente pediátrico, puede ser un hallazgo incidental en el estudio gastroenteroscópico de niño con otras enfermedades gastrointestinales, sin otras lesiones en mucosa gástrica o duodenal y plantear un dilema al gastroenterólogo sobre si recomendar o no un tratamiento de erradicación; dicha decisión, en el contexto clínico, ha de ser consensuada con la familia y el paciente valorando beneficios (evitar futuras complicaciones UPD, atrofia/metaplasia intestinal, linfoma MALT gástrico y CaG, más teóricos que reales, pues el riesgo de enfermedad péptica es bajo en niños y el riesgo de complicaciones graves es extremadamente bajo en Europa y América del Norte, otro posible beneficio es disminuir la ansiedad de los padres ante la “falta de tratamiento”) y riesgos (aumento de resistencia a antibióticos, efectos secundarios, alteración de microbiota, fracaso de tratamiento y necesidad de retratamiento, posibilidad de reinfección y bloqueo de posible efecto protector de HP sobre otras enfermedades crónicas). Si la decisión es tratar, ha de ser de tipo erradicador guiado por estudio de sensibilidad antibiótica(1,3,4).
La búsqueda de HP y su tratamiento erradicador ya no están justificados en los casos de trombocitopenia inmune primaria crónica (PTIc), con recaídas y resistente al tratamiento con corticoides; sí en la anemia ferropénica refractaria, descartada por otras causas; y en el inusual hallazgo de un linfoma MALT de bajo grado. Es obligatoria la erradicación de la infección; puesto que, en la mayoría de los casos, supone el tratamiento curativo de la enfermedad(3,4).
En las guías ESPGHAN/NASPGHAN de 2017 se había retirado la recomendación de hacer estudio de infección por HP en niños asintomáticos con antecedentes familiares de primer grado de padecer úlcera gástrica o duodenal o cáncer gástrico. En las nuevas guías ESPGHAN/NASPGHAN de 2024, se ha cambiado el criterio y se sugiere realizar estudio de HP con test no invasivos, test de aliento con urea marcada con C13 o con prueba de determinación de antígenos monoclonales en heces. Esta recomendación es con evidencia baja a moderada, como se ha comentado en la introducción(4).
Todo ello en base a que en los países de alta prevalencia de CaG (países del este de Asia, Europa oriental y meridional y América del Sur) la erradicación del H. pylori puede estar asociada con una disminución del riesgo de CaG en adultos japoneses asintomáticos sanos. Si bien los datos de países con una baja prevalencia de CaG son muy limitados, se ha visto que el H. pylori se agrupa en familias y las cepas se comparten entre los miembros de la familia. Un antecedente familiar de CaG en un pariente de primer grado se asocia con un riesgo dos a tres veces mayor de CaG; por ello, las pautas para adultos recomiendan una endoscopia con biopsia en los miembros de la familia asintomáticos mayores de 45 años. Sin embargo, no se ha comprobado que la erradicación del HP en estos casos reduzca la incidencia de CaG.
Si bien una prueba no invasiva para H. pylori en niños con antecedentes familiares de CaG en familiares de primer grado sería suficiente en la mayoría de los escenarios clínicos, algunos casos en los que se detecta H. pylori pueden justificar un examen endoscópico con pruebas de susceptibilidad. Las pruebas invasivas deben limitarse a los niños positivos para H. pylori que residen en un hogar con familiares de primer grado en quienes se ha diagnosticado CaG. Después del tratamiento de la infección, se debe confirmar la erradicación exitosa de H. pylori(4,5,16).
En las nuevas guías, además, no se recomienda realizar pruebas no invasivas de detección de H. pylori en niños pertenecientes a grupos raciales o étnicos con mayor riesgo de CaG que vivan en Norteamérica o Europa(4).
Exámenes diagnósticos
Los test invasivos: biopsia, cultivo, test ureasa, PCR, son los que determinan el diagnóstico, y los no invasivos: 13C-UBT y Ag en heces, el control de erradicación.
Para la determinación de infección por HP hay, básicamente, dos tipos de test: invasivos, mediante gastroendoscopia, y los no invasivos. El diagnóstico se realizará por cultivo de la biopsia gástrica y, cuando no se disponga de este o no haya crecimiento, se considerará diagnóstica la presencia de HP en el estudio histológico, determinado con tinción de Gram, además de otro test invasivo positivo (test rápido de ureasa o PCR). Es preferible la realización de métodos de PCR que aporten información de resistencia a la claritromicina y/o al levofloxacino, frente a los que solo informan de la presencia bacteriana. Las únicas excepciones valorables son la PTIc con bajo recuento plaquetario y el paciente de alto riesgo para la realización de procedimientos bajo sedación o anestesia(3).
A continuación, se detallan los diferentes test empleados, que se resumen en la tabla III. Los exámenes no invasivos son:
• Test del aliento con urea marcada con 13C (UBT). Esta prueba, para el diagnóstico de infección por HP, tiene una sensibilidad y especificidad cercana al 100 %. Es el método más factible de seguimiento y control de la infección, muy sencillo, y puede realizarse a cualquier edad, incluso en lactantes, aunque los resultados son menos fiables en niños menores de 6 años.
• Detección de antígenos monoclonales en heces mediante ELISA en niños infectados por HP. Presenta una sensibilidad y especificidad del 85-95 %, no así con el uso de antígenos policlonales u otros métodos de laboratorio, como inmunocromatografía, con resultados más heterogéneos. Este examen complementario es útil, tanto para el diagnóstico de infección, cuando se dispone de histología positiva y no de cultivo, como, y principalmente, para el control del tratamiento de erradicación del HP junto con el test de urea 13C en el aliento. Hay que considerar que, al igual que el del aliento, puede ver atenuada su sensibilidad y especificidad por toma previa de IBP, antibióticos o sangrado gástrico(17).
• Test rápidos (inmunoensayocromatográfico). Es una prueba de detección cualitativa del antígeno del HP (heces), obteniendo los resultados en 10 minutos. El examen utiliza anticuerpos específicos para antígenos de HP(17).
• Detección de Ac IgG anti-HP en sangre periférica mediante ELISA o EIA (enzime immunoassay). Presenta una sensibilidad del 90 % y especificidad entre el 50-90 % en adultos, y menor del 60 % en niños. Ha dejado de utilizarse como prueba diagnóstica o de control de la erradicación, ya que dicha serología puede persistir positiva hasta más de 18 meses post-erradicación, aunque conserva su validez para estudios epidemiológicos, al igual que la detección de Ac en orina o saliva, y en el caso de que no se pueda suprimir el tratamiento antisecretor. Actualmente, no se recomiendan las pruebas basadas en anticuerpos para H. pylori en suero, sangre total, orina y saliva en el ámbito clínico(4).
La detección por inmunoblot de Ac IgG circulantes frente a proteínas Cag A y Vac A (citotóxica y vacuolizante, respectivamente), que son factores implicados en la patogenicidad del HP y en su capacidad para generar úlcera péptica y cáncer gástrico, es un marcador de riesgo del HP(17).
La endoscopia es un método invasivo, sensible y específico para la confirmación de enfermedad péptica, grado de afectación, presencia de agente etiológico y, sobre todo, para la obtención de muestras para cultivo y valoración de resistencias microbianas o detección de factores de patogenicidad, como la proteína Cag A y Vac A. Se recomienda que se obtengan al menos seis biopsias gástricas (tres del cuerpo y tres del antro) para el diagnóstico de infección por H. pylori durante la endoscopia superior(4). En las muestras obtenidas en los diversos puntos de lesión, se pueden realizar los siguientes estudios:
• Test de ureasa rápida (RUT). En la misma sala de endoscopia, detecta presencia de HP en pocos minutos sobre las muestras obtenidas. Tiene una sensibilidad del 85-95 % y especificidad del 95-100 %(18). Dicha sensibilidad puede verse disminuida por el tratamiento previo o la presencia de sangrado.
• Examen histológico. Permite observar la presencia de microorganismos de forma espirilar, mediante tinciones de Gram o Giemsa, e informa de manera precisa de los cambios morfológicos de la mucosa gástrica. El informe histológico de las biopsias gástricas se realiza según la clasificación del Sistema de Sydney, que valora la presencia de inflamación crónica (de tipo linfocítico mayor que neutrofílico, patrón más típico de los niños), actividad aguda, atrofia, metaplasia intestinal y displasia, además de la presencia de HP(19). Tiene una especificidad del 100 %, pero sensibilidad variable, dado el riesgo de biopsias de zonas no afectas(1,3,17).
• Cultivo microbiológico. Es la prueba de mayor utilidad para identificar diferentes cepas, resistencia microbiana, detección de factores de patogenicidad y hacer un tratamiento dirigido basándose en sus sensibilidades(3,4). Tiene como hándicap el lento crecimiento del HP, que puede precisar de hasta 8-10 días. Presenta una especificidad del 100 %, pero sensibilidad variable, entre 60-98 %; además, disminuye significativamente por tratamientos previos, muy influenciable por la técnica de recogida, conservación y procesamiento de la muestra para el adecuado cultivo(17).
• PCR (Polymerase Chain Reaction). Determina el ADN del HP, tanto en heces como en muestra de biopsia. En estas últimas, la especificidad es del 98 % (94,3-98,6 %) y la sensibilidad del 80,8 % (75,3-85,6 %). El diagnóstico por PCR en heces, aunque más asequible, tiene menor rendimiento que el obtenido en biopsias gástricas, con sensibilidad entre 63-84 %. Es diagnóstico de infección activa; además, identifica mutaciones asociadas a resistencias antimicrobianas (claritromicina y, recientemente, también al levofloxacino) y otros factores de virulencia del HP(17,18).
Tiene especial valor cuando no se han podido suspender antibióticos, IBP o hay sangrado activo que interfieren significativamente con el cultivo, la histología y el test de ureasa(3,18).
Los estudios moleculares: las pruebas fenotípicas de susceptibilidad a los fármacos (DST) mediante PCR, las PCR ampliadas y la secuenciación de nueva generación (NGS), para determinar la presencia de HP y mutaciones asociadas a resistencias de diferentes antibióticos, no solo claritromicina, sino otros, como las quinolonas, metronidazol, rifamixinas, etc., abren nuevas perspectivas. Van a constituir un método diagnóstico crucial para la vigilancia de las resistencias a los antibióticos y en el tratamiento de los fracasos de estos(18). En las nuevas guías, a las pruebas moleculares se les da el mismo valor que al cultivo y se recomienda que el diagnóstico de la infección por H. pylori se base en una biopsia gástrica, utilizando las siguientes pruebas: (a) cultivo o pruebas moleculares y (b) histopatología según el sistema de Sydney(4).
• Técnica de hibridación in situ con sondas fluorescentes (FISH). La detección de HP se realiza mediante la hibridación con una sonda de oligonucleótido fluorescente dirigida al ARNr 16S, específica del HP. Permite detectar HP en formas cocoides, viables pero no cultivables, y resistencias a claritromicina en muestras de biopsia. Es una herramienta potente, rápida y sensible para la detección del HP sin necesidad de cultivo ni extracción de ácidos nucleicos. No está disponible en la mayoría de laboratorios(3).
Secuencia diagnóstica
Búsqueda de causa orgánica de la clínica mediante EGC, biopsia, cultivo, RUT, PCR, para tratamiento antibiograma guiado (ver algoritmo al final del artículo).
1. El diagnóstico de la infección por HP se realizará siempre mediante test invasivo con biopsias recogidas durante la endoscopia, indicada cuando la clínica sea sugestiva de causa orgánica (Tabla II) (ver algoritmo al final del artículo). Las únicas excepciones valorables son la PTIc con bajo recuento plaquetario y el paciente de alto riesgo para la realización de procedimientos bajo sedación o anestesia(3).
2. El diagnóstico se realizará mediante el cultivo de la biopsia gástrica. Cuando no se disponga de este, o no haya crecimiento, se considerará diagnóstica la PCR preferiblemente, dado que permite determinar resistencias a antibióticos y la presencia de HP en el estudio histológico, según el sistema Sydney(4) ya no es criterio necesario otro test invasivo positivo (test rápido de ureasa)(3).
3. Como norma general, para la realización de pruebas invasivas para el diagnóstico y no invasivas para confirmar la erradicación de HP, se espere al menos 2 semanas después de suspender IBP (o en su caso sustituir por anti H2 hasta 48 horas antes de la EGC) y de 4 semanas después de suspender los antibióticos y las sales de bismuto(4).
4. Se recomienda que se obtengan, al menos, seis biopsias gástricas (tres del cuerpo y tres del antro) para el diagnóstico de infección por H. pylori durante la endoscopia superior. Las tomas para cultivo se recogerán en primer lugar, antes de progresar con el endoscopio al duodeno, conservándose y transportándose en los medios adecuados, bien sea para cultivo o anatomía patológica(3,4).
5. Se recomienda realizar cultivo y antibiograma en todas las biopsias remitidas a microbiología, al menos, una del antro y otra del cuerpo(3).
Secuencia terapéutica
El tratamiento ha de ser guiado por el antibiograma o empírico, basado en resistencias locales y nacionales. Busca la erradicación mayor del 90 %, con triple o cuádruple terapia con bismuto. El fracaso al tratamiento ha de plantear nueva endoscopia y cultivo, o terapia empírica como doble resistencia (ver algoritmo al final del artículo).
Tratamiento de primera línea
Recomendamos que se obtenga la susceptibilidad antimicrobiana por cultivo para la(s) cepa(s) infectantes de H. pylori de acuerdo con una metodología estandarizada y/o por PCR en tiempo real para resistencia al CLA, y que el tratamiento de erradicación se adapte en consecuencia. No así para el MET, ya que los resultados no son confiables (ni por métodos moleculares ni por cultivos) y no mejoran la tasa de erradicación(4).
Con sensibilidad antibiótica conocida
La primera opción de tratamiento será la triple terapia [IBP*+AMO** (amoxicilina)+MET/CLA (metronidazol/claritromicina)] dirigida durante 14 días, en función del resultado de antibiograma.
*IBP clásicos: omeprazol y lanzoprazol. Han de utilizarse a altas dosis para evitar polimorfismo CYP2C19 de los metabolizadores rápidos o usar los nuevos IBP (esomeprazol, raveprazol) que evitan estos polimorfismos.
Sugerimos una terapia triple guiada por test de sensibilidad a antibióticos, utilizando una dosis alta de IBP, una dosis alta de AMO y una duración de 14 días(4).
**En alérgicos a penicilina: si la cepa es sensible a CLA y MET, usar la triple terapia con dosis estándar de MET en lugar de AMO; si la cepa es resistente a CLA, usar cuádruple terapia mediante sales de bismuto (SB) con tetraciclinas (TRC) en lugar de AMO si el niño es mayor de 8 años (IBP+SB+TRC+MET).
Terapia secuencial de 10 días: IBP-AMO 5 días + IBP-CLA-MET 5 días. Es igual de efectiva en pacientes con una cepa HP sensible a todo, pero no debe usarse si existe resistencia a MET o CLA o si la sensibilidad es desconocida. Su rendimiento no mejora la triple terapia de 14 días y se expone al paciente a tres antibióticos diferentes, con el mayor riesgo de desarrollo de resistencias.
Si presenta doble resistencia: triple terapia con AMO a altas dosis y MET, o cuádruple terapia (IBP+SB+AMO+MET). Otra posibilidad es la cuádruple terapia concomitante (IBP+AMO+MET+CLA) de uso en adultos, no estudiada en el paciente pediátrico, y que puede producir muchos efectos secundarios.
Con sensibilidad antibiótica desconocida
Cuando no se dispone de antibiograma, se hace tratamiento empírico basado en resistencias locales o nacionales, como si de doble resistencia se tratara.
En las nuevas guías se sugiere una terapia cuádruple basada en bismuto (SB, IBP, AMO, MET), como terapia de erradicación empírica de primera línea con sensibilidad antibiótica desconocida(4).
Se recomienda el uso concomitante de probióticos durante el tratamiento erradicador, por su beneficio en la prevención de efectos adversos asociados al uso de antibióticos de amplio espectro(20); aunque, actualmente, no existe evidencia suficiente para aconsejar el uso concreto de un probiótico que favorezca la erradicación de HP. Las nuevas guías de uso e indicaciones de probióticos del año 2023 recomiendan, en el caso de niños y con evidencia 1, el uso de S. Bulardii CNCM, I-174; no así en adultos, donde la evidencia de este y otros probióticos, en general, es menor(21).
Debe comprobarse la eficacia del tratamiento erradicador a las 6-8 semanas de haber finalizado el tratamiento, mediante test no invasivos validados [test de aliento (13C-UBT) o test de antígeno monoclonal de dos pasos en heces](3,4).
Tratamiento de segunda línea
No hay evidencia suficiente para generar recomendaciones específicas para la terapia de rescate en la población pediátrica, por tanto, lo que se indica a continuación son sugerencias basadas en la opinión de expertos(4).
En caso de fracaso del tratamiento de primera línea, se recomienda actuar según el estudio inicial de resistencias:
• Para cepas con susceptibilidad a ambos fármacos, se empleará triple terapia con sustitución recíproca entre claritromicina y metronidazol.
• Si la cepa es resistente a alguno de ellos, se recomienda la triple terapia con dosis altas de amoxicilina o la cuádruple terapia con bismuto, pudiendo sustituir la amoxicilina por tetraciclina, si el niño es mayor de 8 años.
• Si la cepa presenta doble resistencia, se recomienda la alternativa no empleada previamente durante el tratamiento inicial.
• Las resistencias a AMO son raras, por lo que se pueden repetir en terapia de rescate a altas dosis y en tres tomas. La resistencia a MET puede superarse con dosis mayores y de uso más prolongado; el uso de dosis altas de IBP o inhibidores más potentes; debe evitarse CLA o fluoquinolonas si hay resistencia o uso previo sin conocer resistencias(4).
• Si las resistencias son desconocidas y después de dos terapias fallidas con adherencia confirmada del paciente, se recomienda un nuevo estudio endoscópico con realización de cultivo para hacer tratamiento dirigido; en caso de no lograr crecimiento, se tratará como si presentase doble resistencia.
Es fundamental transmitir bien a la familia la importancia de realizar el tratamiento de forma correcta, para lograr la erradicación y reducir el riesgo de desarrollo de resistencias antimicrobianas. El uso de refuerzos como el diario de las dosis elaborado por la ESPGHAN, la prevención del riesgo de aparición de efectos adversos del tratamiento, mediante el empleo de probióticos y un seguimiento estrecho, pueden favorecer el éxito del tratamiento(3,4,20,21).
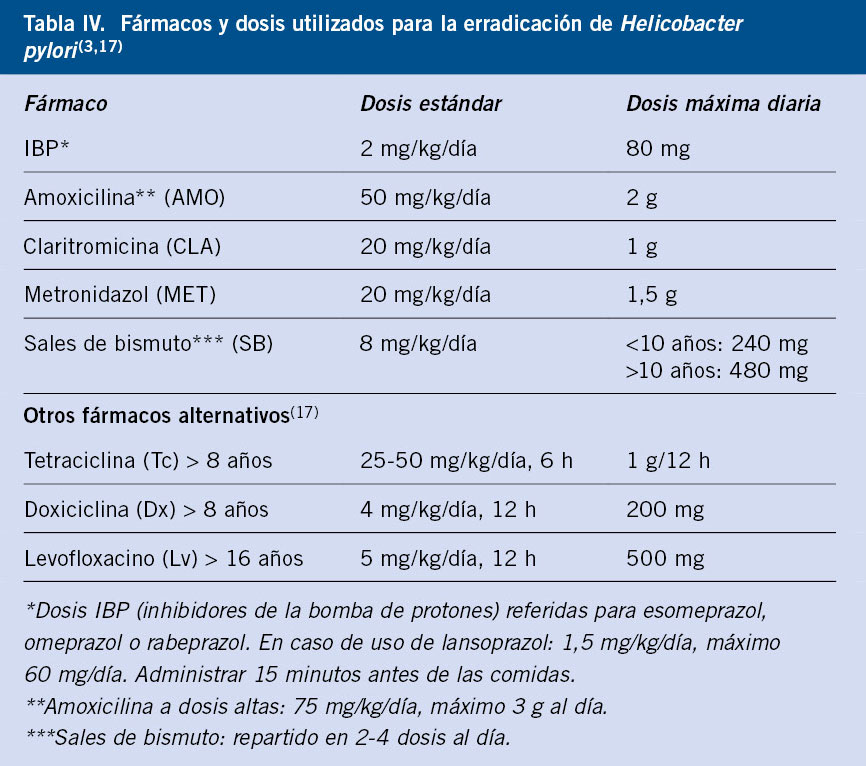
La posología de fármacos recomendados se especifica en la tabla IV.
Perspectivas futuras
En el diagnóstico, los métodos moleculares de próxima generación van a implicar obviar los cultivos. En cuanto al tratamiento, se postulan nuevas estrategias de antibióticos, IBP más potentes, vacunas, probióticos e, incluso, el uso de nanopartículas.
Los métodos diagnósticos moleculares de siguiente generación, la PCR ampliada y la secuenciación de nueva generación (NGS), han demostrado ser altamente sensibles y específicos (sensibilidad y especificidad cercanas al 100 %) en el diagnóstico del HP, mediante el estudio directo de biopsias o heces, además de permitir identificar genes de virulencia de esa cepa en concreto, y de resistencia antimicrobiana. Posibilitan iniciar un esquema de tratamiento específico y personalizado para su erradicación, sin tener que utilizar un esquema antimicrobiano empírico basado en cultivos, muy influenciable por la técnica de recogida, conservación y procesamiento de la misma. El HP tiene crecimiento lento, 8-12 días, y puede dar muchos falsos negativos, por formas cocoides que no crecen en cultivos y son difíciles de identificar en las biopsias. Por otra parte, se ha comprobado que la actividad in vitro a los antibióticos, determinada por antibiograma, puede ser diferente a la de in vivo. Todo ello supone un cambio paradigmático en el diagnóstico y tratamiento de esta infección.
En cuanto a las nuevas estrategias de tratamiento, destacan:
• El uso de IBP clásicos (omeprazol, lanzoprazol) a alta dosis, en contraposición a la utilización de esomeprazol o raveprazol a dosis habituales, que evitan polimorfismo CYP2C19, causantes de una metabolización rápida de dichos fármacos.
• Nuevos fármacos, como el vonoprazán, inhibidor selectivo de canales de potasio, es hasta 300 veces más selectivo que los IBP tradicionales, no influenciado por el metabolismo hepático. Se ha propuesto el uso combinado de amoxicilina-vonoprazán, como terapia de primera o de segunda línea, para infecciones por HP. Puede ser una alternativa adecuada para evitar efectos secundarios y resistencias por uso combinado de antibióticos.
• Se está ensayando el uso de nuevos antibióticos, como las fluoroquinolonas de cuarta generación, entre ellas, la sitafloxacina, candidata a integrarse en la triple o cuádruple terapia en adultos y adolescentes mayores de 16 años(22).
• Los probióticos. En un metaanálisis reciente, se ha demostrado que su suplementación no mejora las tasas de erradicación por sí solos, pero sí parece reducir los efectos adversos generados por la combinación de antibióticos, favoreciendo la adherencia al tratamiento. En el caso de los niños, el S. Bulardii parece tener evidencia 1 con respecto a otros probióticos por separado o en combinación de varios(21).
• La nanotecnología. El uso de nanopartículas de metales pesados (plata, cobre, zinc) ligadas a moléculas produce lisis del HP, aunque aún no se ha probado en humanos.
• Las vacunas. Utilizando los factores de virulencia del HP (p. ej., ompA, cagA) en población pediátrica, estas han fallado en mostrar una respuesta duradera de protección a la infección, pero prometen ser una nueva revolución terapéutica(23).
Función del pediatra de Atención Primaria
• Valorar correctamente la clínica digestiva del paciente pediátrico, mediante una adecuada historia clínica y exploración, con el objetivo de diferenciar el dolor abdominal funcional de aquel que pueda tener alguna causa específica orgánica y tratable.
• Saber por qué y para qué solicitar los exámenes complementarios a su alcance en el primer nivel, orientados a confirmar o descartar patología orgánica, y no solo la presencia de infección de HP como posible causa, sino las repercusiones gástricas que pueda tener y su correcto diagnóstico y tratamiento, informando de forma clara a los padres.
• Conocer las indicaciones de derivación al pediatra digestivo de segundo nivel, con la intención de que valore, no solo la presencia de HP, sino si hay lesiones subsidiarias de ser tratadas lo más específicamente posible.
• Hacer un seguimiento y apoyo adecuado que favorezca el cumplimiento completo de la pauta de tratamiento indicada en atención especializada.
• Seguir y verificar la normalización de dicha clínica a lo largo del tiempo, una vez tratado, e indicar, en su caso, nueva revaloración por atención especializada.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.*** Jones NL, Koletzko S, Goodman K, Bontems P, Cadranel S, Casswall T, et al. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017; 64: 991-1003.
2. Koletzko S, Jones NL, Goodman KJ, Gold B, Rowland M, Cadranel S, et al. Evidence-based Guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J Pediatr Gastroenterol Nutr. 2011; 53: 230-43.
3.*** Galicia Poblet G, Alarcón Cavero T, Alonso Pérez N, Borrell Martínez B, Botija Arcos G, Cilleruelo Pascual ML, et al. Manejo de la infección por Helicobacter pylori en la edad pediátrica. An Pediatr. 2021; 383: 1-9.
4. Homan M, Jones NL, Bontems P , Carroll MW, Czinn SJ, Gold BD, et al. Updated joint ESPGHAN/NASPGHAN guidelines for management of Helicobacter pylori infection in children and adolescents (2023). J Pediatr Gastroenterol Nutr. 2024; 79: 758-85.
5. Saito H, Nishikawa Y, Masuzawa Y, Tsubokura M, Mizuno Y. Helicobacter pylori Infection Mass Screening for Children and Adolescents: a Systematic Review of Observational Studies. J Gastrointest Canc. 2021; 52: 489-97.
6. Hooi JKY, Ying Lai W, Khoon Ng W, Suen MMY, Underwood FE, Tanyingoh D, et al. Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology. 2017; 153: 420-29.
7. Kadkhodaei S, Siavoshi F, Akbari Noghabi K. Mucoidand coccoid Helicobacter pylori with fast growth and antibiotic resistance. Helicobacter. 2020; 25: e12678.
8. Fallone CA, Moss SF, Malfertheiner P. Reconciliation of recent Helicobacter pylori treatment guidelines in a time of increasing resistance to antibiotics. Gastroenterology. 2019; 157: 44-53.
9. Sharara AI. Confirmatory testing for eradication of Helicobacter pylori: Challenges and opportunities. Clin Gastroenterol Hepatol. 2021; 19: 232-4.
10.** Reyes VE. Helicobacter pylori y su papel en el cáncer gástrico. Microorganismos. 2023, 11: 1312.
11. Reshetnyak VI, Burmistrov AI, Maev IV. Helicobacter pylori: Commensal, symbiont or pathogen? World J Gastroenterol. 2021; 27: 545-60.
12. Aguilera Matos I, Díaz Oliva SE, Escobedo ÁA, Villa Jiménez OM, Velazco Villaurrutia YDC. Helicobacter pylori infection in children. BMJ Paediatrics Open. 2020; 4: e000679.
13. Spee LA, Madderom MB, Pijpers M, van Leeuwen Y, Berger MY. Association between Helicobacter pylori and gastrointestinal symptoms in children. Pediatrics. 2010; 125: e651-69.
14. Macarthur C, Saunders N, Feldman W. Helicobacter pylori, gastroduodenal disease, and recurrent abdominal pain in children. JAMA. 1995; 273: 729-34.
15. Chobot A, Porębska J, Krzywicka A, Żabka A, Bąk-Drabik K, Pieniążek W, et al. No association between Helicobacter pylori infection and gastrointestinal complaints in a large cohort of symptomatic children. Acta Paediatr. 2019; 108: 1535-40.
16. Ford AC, Yuan Y, Moayyedi P. Long‐term impact of helicobacter pylori eradication therapy on gastric cancer incidence and mortality in healthy infected individuals: a meta‐analysis beyond 10 years of follow‐up. Gastroenterology. 2022; 163: 754‐6.e1.
17. Hernández A. Manejo de la infección por Helicobacter pylori en niños y adolescentes. Algoritmos y casos clínicos en patología digestiva en pediatría II. Ed. IMC; 2019; p. 47-60.
18. Pohl D, Keller PM, Bordier V, Wagner K. Review of current diagnostic methods and advances in Helicobacter pylori diagnostics in the era of next generation sequencing. World J Gastroenterol. 2019; 25: 4629-60.
19. Domșa A-MT, Gheban D, Lazăr C, Pop B, Borzan CM. Particular morphological features in the diagnosis of pediatric Helicobacter pylori gastritis: A Morphometry-Based Study. J Clin Med. 2020; 9: 3639.
20. Malfertheiner P, Megraud F, Rokkas T, Gisbert JP, Liou JM, Schulz C, et al. Management of Helicobacter pylori infection: the Maastricht VI/Florence consensus report. Gut. 2022; gutjnl-2022-327745.
21. Guarner F, Sanders ME, Eliakim R, Szajewska H, Herrra C, Karakan T, et al. World Gastroenterology Organisation Global Guidelines. Probiotics and prebiotics. 2023. Disponible en: http://www.worldgastroenterology.org/guidelines/global-guidelines/probiotics-and-prebiotics.
22.*** Garrido TM, López-Martínez M, Flores-Hinojosa JA, Tijerina-Rodríguez L, Bosques-Padilla F. Empiric treatment vs susceptibility-guided treatment for eradicating H. pylori: Is it possible to change that paradigm using modern molecular methods? Revista de Gastroenterología de México. 2022; 87: 330-41.
23. Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E. Prevalence of Antibiotic Resistance in Helicobacter pylori: A Systematic Review and Meta-analysis in World Health Organization Regions. Gastroenterology. 2018; 155: 1372-82.
24. Hernández Hernández A, Monge Zamorano M, Quintana Herrera C. Dolor abdominal crónico y recurrente. Infección por Helicobacter pylori. Pediatr Integral. 2015; XIX: 33-50. Disponible en: https://www.pediatriaintegral.es/publicacion-2015-01/dolor-abdominal-cronico-y-recurrente-infeccion-por-helicobacter-pylori/.
Bibliografía recomendada
– Jones NL, Koletzko S, Goodman K, Bontems P, Cadranel S, Casswall T, et al. Joint ESPGHAN/NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017; 64: 991-1003.
Este artículo marca las nuevas estrategias a partir de 2016 y revisa las directrices previas de 2011 de la ESPGHAN/NASPGHAN, en cuanto a pautas de diagnóstico y tratamiento de la infección por HP en pacientes menores de 18 años de los países occidentales, Europa y EE.UU., fundamentalmente. Dado el problemático incremento de resistencias a claritromicina y a otros antibióticos usados, basados en la estrategia de “test and treat”, se exige que, en las nuevas guías, los tratamientos se basen en antibiogramas guiados para lesiones gástricas objetivadas mediante GEC y no empíricos, esto es “strategy strategy”.
– Galicia Poblet G, Alarcón Cavero T, Alonso Pérez N, Borrell Martínez B, Botija Arcos G, Cilleruelo Pascual ML, et al. Manejo de la infección por Helicobacter pylori en la edad pediátrica. An Pediatr. 2021; 383: 1-9.
Documento de consenso publicado en 2021, elaborado por 13 autores pertenecientes a diferentes sociedades de la Pediatría española: Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), Asociación Española de Pediatría de Atención Primaria (AEPap), Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y Sociedad Española de Enfermedades Infecciosas y Microbiología Clínica (SEIMC). Se revisa, exhaustivamente, la última literatura descrita, desde la publicación de la guía ESPGHAN/NASPGHAN hasta diciembre de 2020 incluido, con el objetivo de aunar los criterios entre AP y especializada, en cuanto a la búsqueda de la infección, el diagnóstico y tratamiento, poniendo en común diversas cuestiones para llegar a una recomendación final en cada una de las mismas.
– Homan M, Jones NL, Bontems P , Carroll MW, Czinn SJ, Gold BD, et al. Updated joint ESPGHAN/NASPGHAN guidelines for management of Helicobacter pylori infection in children and adolescents (2023). J Pediatr Gastroenterol Nutr. 2024; 79: 758-85.
Estas nuevas guías hacen revisión exhaustiva de las recomendaciones previas, publicadas por la ESPGHAN/NASPGHAN en 2017, basadas en las nuevas evidencias entre 2016-2021, incluso posterior si fue literatura relevante, bien concretando, modificando o cambiando algunas de las mismas: sobre todo en cuanto a la no necesidad de hacer estudio o tratamiento de HP en la PTIc, se modifican indicaciones de si hacer estudio en niños con antecedente familiar de primer grado con CaG, con test no invasivos y cambios en el valor de diagnóstico de la PCR equiparable o superior al cultivo para confirmación diagnóstica de presencia de HP en biopsias gástricas y estudio de resistencia a CLA y otros antibióticos.
– Reyes VE. Helicobacter pylori y su papel en el cáncer gástrico. Micro organismos. 2023, 11: 1312.
Artículo de obligada lectura, si se quieren conocer los factores de patogenicidad y virulencia del HP y su intrincada interacción con la mucosa gástrica y sistema inmunológico, que pueden llevar a la colonización crónica de esta bacteria y su capacidad para producir la enfermedad ulceropéptica o, en el peor de los casos, el propio cáncer gástrico y que se resume en la tabla I.
– Garrido TM, López-Martínez M, Flores-Hinojosa JA, Tijerina-Rodríguez L, Bosques-Padilla F. Empiric treatment vs susceptibility-guided treatment for eradicating H. pylori: Is it possible to change that paradigm using modern molecular methods? Revista de Gastroenterología de México. 2022; 87: 330-41.
En este artículo se hace una revisión de lo que va a suponer el desarrollo de nuevos métodos moleculares no invasivos de siguiente generación (NGS) para la detección genotípica y fenotípica de resistencia a la mayoría de antibióticos, y no solo a la claritromicina. Promete ser una herramienta que revolucione la terapéutica del HP, ofreciendo esquemas de tratamiento antibiótico personalizado y con menores costes, repasando además las nuevas estrategias y los medicamentos de dicho tratamiento.
| Caso clínico |
|
Niño de 8 años y 6 meses de edad con dolor abdominal de 4-5 meses de evolución, que se repite cada 2-3 semanas, localizado frecuentemente en epigastrio, mesogastrio y periumbilical, sin irradiación a otras zonas, de intensidad 7-8/10, que puede durar 2-3 horas, más frecuente en la mañana, otras veces en la tarde. No mejora con la comida, ni se relaciona con la toma de ninguna comida en particular. Nunca ha llegado a despertar y, en algunas ocasiones, se acompaña de náusea y sensación de acidez. Heces de consistencia variable: Bristol 2-3-4, defecación diaria o, como máximo, dos días sin hacer, sin clínica miccional. Al menos, 3 veces, sus padres han tenido que irlo a recoger al colegio por tal motivo. Por lo demás, es un niño inteligente, va bien en el cole y con buenas relaciones con sus iguales y profesores. Tampoco refieren nuevos eventos estresantes en el entorno familiar. Dicho dolor se ha calmado con metimazol en gotas. Antecedentes personales: niño nacido por parto eutócico. Peso adecuado a su edad gestacional. Test de AEG, APGAR 9/9. Sin otros antecedentes destacables, “alérgico a la penicilina”, y usa como alternativa azitromicina o claritromicina para tratamiento de amigdalitis, otitis y otros cuadros respiratorios. Antecedentes familiares: abuelo paterno murió de cáncer gástrico. Madre padece de gastritis no filiada. Padre diagnosticado recientemente de enfermedad de Crohn. Hermano de 2 años sano, acude a guardería. Exploración física: peso: 23 kg (pc10); talla: 120 cm (pc3); IMC: 19,97 (pc25); hábito asténico, escaso panículo adiposo, lo único llamativo son las caries dentales y cierta palidez de piel y mucosa. Dolor sordo a la palpación profunda en epigastrio, sin visceromegalias ni escíbalos.
|






 Esophageal pathology
Esophageal pathology 