 |
| Temas de FC |
B. Gómez Cortés, I. Gangoiti Goikoetxea, J. Benito Fernández
Servicio de Urgencias de Pediatría. Hospital Universitario Cruces. Barakaldo. Vizcaya
| Resumen
La incidencia de meningitis bacteriana ha disminuido en las últimas dos décadas gracias al desarrollo y, finalmente, inclusión en el calendario vacunal, de las vacunas frente al S. pneumoniae y el N. meningitidis. Sin embargo, siguen presentando una elevada morbimortalidad, al igual que las encefalitis La aparición de nuevas herramientas diagnósticas, como los paneles múltiples de técnicas de reacción en cadena de la polimerasa que, en la actualidad, proporcionan resultados en pocas horas, ha facilitado el diagnóstico etiológico precoz de estas entidades. Hasta la confirmación microbiológica, disponemos, además, de varios scores validados que permiten identificar aquellos pacientes con pleocitosis y muy bajo riesgo de presentar una meningitis bacteriana y reducir la tasa de ingreso y de tratamiento antibiótico empírico. Con vistas a la prevención secundaria, es necesario conocer los criterios de contacto estrecho ante un caso de infección invasiva por N. meningitidis o H. influenzae. Esto permite limitar el uso de la quimiprofilaxis a aquellos individuos en los que verdaderamente está indicada y reducir en ellos el riesgo de desarrollar un caso secundario. |
| Abstract
The incidence of bacterial meningitis has decreased in the last two decades thanks to the development, and finally inclusion in the immunization schedule, of vaccines against S. pneumoniae and N. meningitidis. However, these infections and the herpes encephalitis still have a high morbidity and mortality. The use of new diagnostic tools, such as the multiple polymerase chain reaction panels, which currently provide results in a few hours, has facilitated the early etiological diagnosis of these entities. Until the microbiological confirmation, we have several validated scores that can identify those patients with pleocytosis and a very low risk of presenting a bacterial meningitis, reducing the rates of admission and empirical antibiotic treatment. In relation to the secondary prevention, it is necessary to know the criteria for defining a close contact of a case of invasive infection by N. meningitidis or H. influenzae. This makes it possible to limit the use of chemoprophylaxis to those individuals in whom it is truly indicated and reduce the risk of developing a secondary case in them. |
Palabras clave: Meningitis; Encefalitis; Neisseria meningitides; Streptococcus pneumoniae; Herpes simplex.
Key words: Meningitis; Encephalitis; Neisseria meningitides; Streptococcus pneumoniae; Herpes simplex.
Pediatr Integral 2023; XXVII (6): 341 – 349
OBJETIVOS
• Reconocer los síntomas y signos sugestivos de infección del SNC.
• Realizar adecuadamente la estabilización inicial de los pacientes con sospecha clínica de meningitis bacteriana o encefalitis, mediante la sistemática ABCDE.
• Conocer los criterios diagnósticos de encefalitis y los criterios de bajo riesgo de meningitis bacteriana en un paciente con pleocitosis.
• Pautar el tratamiento antibiótico o antiviral adecuado en función de la sospecha clínica y los agentes etiológicos más probables en cada caso.
• Conocer, ante un caso de infección invasiva por N. meningitidis o H. influenzae, los criterios para considerar a una persona como contacto estrecho, así como las pautas de quimioprofilaxis secundaria recomendadas en estos casos.
Meningitis y meningoencefalitis
Introducción
Las infecciones del sistema nervioso central son entidades poco frecuentes, pero con elevada morbimortalidad en el caso de las meningitis bacterianas y encefalitis herpética.
Las infecciones en la edad pediátrica son un motivo de consulta muy frecuente, tanto en Atención Primaria como en el ámbito hospitalario, pero son menos habituales aquellas que afectan al sistema nervioso central (SNC). A pesar de que la mayoría de ellas son de causa viral y tienen buen pronóstico, la morbimortalidad de estas infecciones sigue siendo alta, incluso en nuestro entorno.
Las infecciones del SNC pueden manifestarse como:
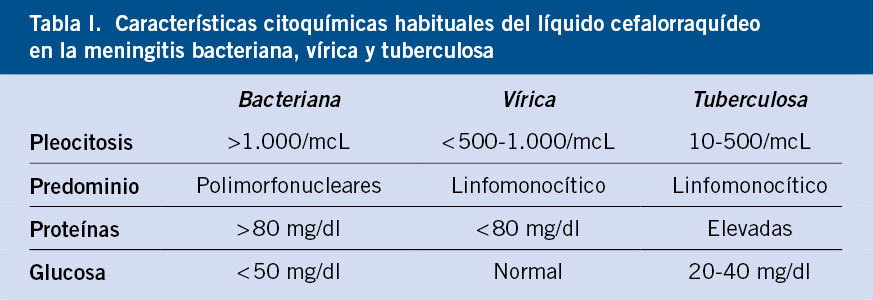
• Meningitis: inflamación de las meninges que afecta a piamadre, aracnoides y espacio subaracnoideo. Presenta pleocitosis, que se define como aumento de celularidad del líquido cefalorraquídeo (LCR): más de 25 células por microlitro en el neonato, más de 10 en el lactante entre 1 y 2 meses y por encima de 5 células por microlitro en los pacientes mayores de 2 meses.
• Encefalitis: inflamación del parénquima cerebral asociado a disfunción neurológica, debido a causas infecciosas o inmunomediadas. Se trata de un diagnóstico clínico en el que el síntoma guía es la alteración del estado mental, que puede presentarse como una disminución o alteración del estado de consciencia, letargia o cambios de personalidad.
• Meningoencefalitis: síndrome clínico caracterizado por signos y síntomas consistentes en inflamación de las meninges y del parénquima cerebral.
Epidemiología
La gran mayoría de meningitis son de etiología viral, destacando los enterovirus. El S. pneumoniae y la N. meningitis son las causas más frecuentes de meningitis bacterianas fuera del periodo neonatal.
Solo el 5 % de las meningitis son bacterianas. Los gérmenes implicados varían con la edad, siendo el Streptococcus del grupo B y la E. coli los más prevalentes en los primeros 2-3 meses de vida (periodo etario de mayor incidencia), y S. pneumoniae y N. meningitidis en lactantes mayores y niños(1). La L. monocytogenes, bacteria clásicamente implicada en la meningitis neonatal, es en la actualidad una causa infrecuente La meningitis tuberculosa no es frecuente en nuestro medio.
Dentro de las causas de meningitis viral, los enterovirus (85-95 %, fundamentalmente Echovirus) son los más frecuentes. Es difícil conocer la incidencia exacta de las infecciones víricas del SNC, ya que el diagnóstico etiológico no siempre se llega a realizar. Son más frecuentes en los meses de primavera, verano y otoño, y tienen dos picos de incidencia en Pediatría: menores de un año y entre los 5-10 años.
En cuanto a las meningoencefalitis, los miembros de la familia Herpesviridae son la causa más frecuente en nuestro entorno(2). El virus herpes simple de tipo 1 es una causa importante de encefalitis grave esporádica que, sin tratamiento antiviral, puede evolucionar hasta en un 70 % a coma y muerte(3). Le siguen en frecuencia el herpes virus tipo 2 (que predomina en neonatos), el virus Epstein-Barr y el herpesvirus humano 6.. Otras causas virales menos frecuentes son: los virus respiratorios y el rotavirus; en pacientes no inmunizados, los virus del sarampión, la rubéola y la parotiditis; y en inmunodeprimidos, el citomegalovirus. Aunque poco frecuentes en nuestro medio, se debe tener en cuenta también la posibilidad de virus emergentes, como el virus del Nilo Occidental, transmitido por mosquitos o el flavivirus causante de encefalitis centroeuropea, trasmitido por la garrapata del ciervo (se ha descrito también a través de la leche no pasteurizada).
Fisiopatología
En las meningitis bacterianas, la clínica y las posibles lesiones y secuelas vienen determinadas por la interrelación de los factores de virulencia del patógeno y la respuesta inmune del huésped y el proceso inflamatorio que esto provoca.
El proceso por el que se desarrolla una meningitis bacteriana se inicia con la colonización del tracto respiratorio, gastrointestinal o urinario, desde donde la bacteria invade el torrente sanguíneo. Determinados factores del huésped (asplenia, déficit del complemento o de anticuerpos, tratamientos inmunosupresores…) y el haber padecido ciertas infecciones virales previas, como la gripe, favorecen esta invasión. Una vez en el torrente sanguíneo, la cápsula polisacárida bacteriana inhibe el depósito de adhesinas, y la fagocitosis y diferentes moléculas de la superficie bacteriana actúan sobre componentes concretos del complemento, facilitando la supervivencia de la bacteria frente al sistema inmune y la invasión meníngea. Esta se ve facilitada, cuanto mayor es la duración y el grado de la bacteriemia.
En el caso del S. pneumoniae y el H. influenzae, hay evidencia de que el plexo coroideo es el punto de entrada inicial al sistema ventricular. Una vez alcanzado el LCR, las bacterias pueden multiplicarse rápidamente, debido a las bajas concentraciones de inmunoglobulinas y de complemento existentes en él. El acúmulo de neutrófilos en LCR viene desencadenado principalmente por el componente C5a del complemento y se relaciona con la gravedad de la enfermedad. En la actualidad, el único tratamiento adyuvante que ha demostrado utilidad para reducir la mortalidad en países desarrollados es la dexametasona, en el tratamiento de la meningitis neumocócica. Sin embargo, se están desarrollando estudios con otros fármacos que, en el futuro, puedan mejorar el pronóstico de estos pacientes, como bloqueantes del receptor del C5a o inhibidores de la matriz-metaloproteinasa (doxiciclina)(4).
Por otra parte, los fragmentos bacterianos producidos tras la muerte de la bacteria por el tratamiento antibiótico estimulan al sistema inmune, generando una potente respuesta inflamatoria. Esto ha planteado la hipótesis de que el uso de antibióticos no bacteriolíticos, como la daptomicina, pueda reducir esta respuesta proinflamatoria y prevenir el daño neuronal, aunque todavía no hay estudios suficientes que la avalen.
Como hemos visto, la fisiopatología y la traducción clínica de la meningitis bacteriana están definidas por la interrelación de los factores de virulencia del patógeno y la respuesta inmune del huésped. Una vez que el proceso inflamatorio ha comenzado, se produce la lesión del endotelio de la barrera hematoencefálica, que provoca edema vasogénico, pérdida de la autorregulación cerebral, edema cerebral vasogénico y aumento de la presión intracraneal. Todo ellos pueden generar en la clínica: hidrocefalia, convulsiones, déficits motores o sensitivos, e incluso coma.
En las infecciones del SNC por enterovirus, por el contrario, la transmisión se produce habitualmente vía fecal-oral. Las partículas virales se unen a receptores específicos de los enterocitos y atraviesan la mucosa intestinal, alcanzando las placas de Peyer donde se replican. La transmisión a través de la inhalación de gotitas infectadas y la posterior replicación del virus en la nasofaringe es mucho menos frecuente. En cualquiera de los dos casos, se produce una viremia primaria que permite al virus extenderse a otros órganos, como el hígado y el bazo, donde se replica de nuevo y, posteriormente, una viremia secundaria. En cualquiera de los dos periodos de viremia, el virus puede alcanzar el SNC, aunque el mecanismo por el que lo logra es todavía desconocido.
En cuanto a las encefalitis virales, el VHS-1 se transmite principalmente por contacto directo y puede alcanzar el SNC por diseminación hematógena, extensión directa atravesando la lámina cribosa o por vía neurógena. El VHS-2 se transmite principalmente por contacto sexual, por lo que es una causa mucho menos frecuente de encefalitis, salvo en el neonato. Los virus pueden además producir encefalitis postinfecciosa, desencadenando una respuesta autoinmune; en este caso, el virus no se detectaría en las pruebas microbiológicas realizadas en LCR.
Clínica
Los signos y síntomas de inflamación meníngea son más frecuentes e intensos en las meningitis de origen bacteriano. En las encefalitis, el síntoma guía es la alteración del nivel de consciencia.
• Meningitis: la mayoría de los pacientes presenta fiebre y síntomas o signos sugestivos de inflamación meníngea, aunque, como en otras entidades, los síntomas pueden ser más sutiles e inespecíficos en lactantes pequeños y especialmente en neonatos. En estos dos grupos, la clínica inicial puede ser de rechazo de la alimentación, irritabilidad, vómitos o decaimiento. En niños mayores y adolescentes, los síntomas propios de inflamación meníngea y de hipertensión intracraneal (HTIC) son más evidentes: cefalea, fotofobia, rigidez de nuca e, incluso, alteración del nivel de consciencia(5). Los pacientes con meningitis bacteriana suelen presentar, más frecuentemente que aquellos con meningitis viral, una alteración del Triángulo de Evaluación Pediátrica, principalmente en relación al lado que evalúa la apariencia(6).
En la exploración, se pueden identificar determinados signos sugestivos de inflamación meníngea:
- Rigidez de nuca: incapacidad para tocar el tórax con la barbilla, presentando una limitación a la flexión pasiva del cuello. Aunque es un signo altamente sugestivo de meningitis, puede aparecer en otras entidades, tanto de origen neurológico (hematoma epidural cervical, hemorragia subaracnoidea, absceso epidural, tumor cerebral…) como no neurológico (adenopatías cervicales, absceso retrofaríngeo, neumonía de lóbulo superior, contractura muscular, discitis…).
- Signo de Kernig: el paciente, en decúbito supino y manteniendo la cadera y rodilla flexionadas a 90º, es incapaz de extender la rodilla a más de 135º o al realizarlo flexiona la rodilla contraria.
- Signo de Brudzinski: el paciente en decúbito supino flexiona las extremidades inferiores cuando se le realiza una flexión pasiva del cuello.
- Fontanela abombada: en el lactante, puede indicar la presencia de HTIC; este hallazgo parece ser mucho menos frecuente en el neonato(7). Puede estar ausente si se asocia deshidratación.
En cuanto a los hallazgos propiamente neurológicos, la mayoría de los pacientes con meningitis bacteriana presentan algún grado de alteración del nivel de consciencia (somnolencia, irritabilidad, letargia o incluso coma), siendo este uno de los predictores más fuertes de mortalidad o secuelas(8). Se estima que un 20-30 % de las meningitis bacterianas generan convulsiones, incrementándose este porcentaje en el neonato. En las meningitis de etiología viral, tanto la alteración del nivel de consciencia como las convulsiones son signos menos frecuentes, mientras que el resto de los síntomas sí suelen ser comunes, aunque de menor intensidad.
Ciertas lesiones cutáneas pueden orientar a determinadas etiologías. La presencia de exantema petequial o purpúrico es característico del N. meningitidis, aunque la mayoría de las meningitis meningocócicas sin sepsis asociada no lo presentan(9). Un exantema palmoplantar maculopapular, la herpangina o lesiones sugestivas de enfermedad boca-mano-pie, pueden verse en meningitis por enterovirus. Las infecciones por enterovirus pueden presentar también exantema petequial, aunque en este caso suele tratarse de elementos puntiformes y ser excepcional el componente purpúrico y hemorrágico característico del N. meningitidis.
• Encefalitis: el síntoma definitorio de la encefalitis es la alteración del nivel de consciencia. Esta puede presentarse como disminución o fluctuación del nivel de consciencia, letargia o cambios de la personalidad o el comportamiento. Además de esta, los síntomas más habituales son la fiebre, convulsiones y la aparición de hallazgos neurológicos focales, siendo los más comunes la parálisis de nervio craneal, la alteración de los movimientos y la ataxia(10). Nuevamente, los neonatos y lactantes muy pequeños pueden presentar síntomas inicialmente inespecíficos, como irritabilidad, letargia o rechazo de la alimentación.
Al igual que en las meningitis, ciertas lesiones cutáneas pueden orientar a la etiología: exantema palmoplantar o característico del boca-mano-pie en el caso de los enterovirus, y lesiones vesiculares en las encefalitis herpéticas. Deben plantearse otras causas menos frecuentes: antecedente de picadura por garrapata (Borrelia o Ricketssia), mordeduras o arañazos (Bartonella y Arbovirus) o viaje a área endémica (fiebre de las montañas rocosas, rabia, virus del Nilo, Dengue…).
Diagnóstico
Existen scores que permiten identificar pacientes con pleocitosis y bajo riesgo de meningitis bacteriana. La clínica y ciertas pruebas complementarias orientan en la sospecha de encefalitis, pero el diagnóstico solo lo da la confirmación microbiológica.
El diagnóstico de la infección del SNC se orienta mediante la historia clínica y la exploración física, pero la piedra angular para su diagnóstico sigue siendo el estudio del LCR. Este es la base del diagnóstico y la interpretación de sus diferentes parámetros, que suele guiar a la toma inicial de decisiones. Otras pruebas complementarias como la analítica sanguínea, pruebas de imagen y neurofisiológicas, pueden apoyar la sospecha clínica.
• Meningitis: el análisis citoquímico del LCR ayuda en la orientación inicial de la etiología de la meningitis (Tabla I).
Los reactantes de fase aguda en sangre que mayor rendimiento ofrecen en la identificación de una meningitis bacteriana son:
- La procalcitonina (PCT) sérica: predictor más fuerte para diferenciar meningitis bacteriana de viral. El punto de corte de 0,5 ng/mL presenta una sensibilidad del 99 % y una especificidad del 83 %(11).
- El recuento leucocitario: la neutrofilia >10.000/mcL se asocia a mayor riesgo.
- La proteína C reactiva sérica, que se incrementa en procesos de más de 6-12 horas de evolución.
Existen reglas de predicción clínica validadas que, mediante la combinación de parámetros clínicos y analíticos, permiten identificar pacientes con pleocitosis y bajo riesgo de meningitis bacteriana. Las que han demostrado un mayor rendimiento son el Bacterial Meningitis Score (BMS)(12) y, sobre todo, el Meningitis Score for Emergencies (MSE), publicado más recientemente(13). La tabla II muestra los parámetros incluidos en cada uno de ellos.
Se debe tener en cuenta que no son aplicables en pacientes que hayan recibido tratamiento antibiótico en las últimas 72 horas o con algún factor de riesgo de presentar meningitis bacteriana (mal estado general, exantema purpúrico, inmunosuprimidos, shunt de LCR o neurocirugía reciente). El BMS está validado en pacientes a partir de los 3 meses de edad y el MSE en pacientes a partir del mes de edad.
• Encefalitis: se trata de un diagnóstico clínico, en el que el síntoma guía es la alteración del estado mental, que puede presentarse como una disminución o alteración del estado de consciencia, letargia o cambios de personalidad. Este criterio mayor debe ser acompañado por, al menos, dos de los siguientes criterios menores para definir una posible encefalitis, y de tres para definir una probable encefalitis(14). El diagnóstico definitivo solo lo da el aislamiento microbiológico.
Criterios menores:
- Fiebre ≥38ºC en las 72 horas antes o después del inicio de los síntomas.
- Convulsiones focales o generalizadas no atribuibles a comorbilidad previa.
- Nueva focalidad neurológica.
- Pleocitosis en LCR.
- Prueba de imagen con alteraciones del parénquima cerebral sugestivas de encefalitis.
- Electroencefalograma con alteraciones compatibles con encefalitis y no atribuibles a otra causa.
Las características citoquímicas del LCR pueden variar dependiendo del germen causante. Es habitual encontrar pleocitosis leve (<1.000/mm3), inicialmente con predominio de polimorfonucleares y posteriormente de mononucleares. Las proteínas suelen estar aumentadas en relación con la destrucción tisular, y la glucorraquia suele ser normal. Sin embargo, hay etiologías virales que pueden no provocar grandes cambios citoquímicos, como los parechovirus.
Tanto en las meningitis como en la encefalitis, el aislamiento microbiológico del germen causante proporcionará el diagnóstico definitivo y la etiología. Clásicamente, el diagnóstico microbiológico se basaba en el cultivo de LCR. Sin embargo, los cultivos tardan tiempo y la sensibilidad para el diagnóstico de infecciones no es óptima. De hecho, el cultivo viral ha quedado denostado. En los últimos años, la aparición de técnicas moleculares de diagnóstico rápido, como la técnica de reacción en cadena de la polimerasa (rt-PCR), basada en la ampliación del material genético (DNA o RNA), permite el diagnóstico de múltiples procesos patológicos. Las nuevas técnicas comercializadas de rt-PCR no requieren de complejas manipulaciones previas y se obtienen resultados rápidos, incluso a pie de cama. Las actuales rt-PCR múltiples rápidas en LCR permiten identificar presencia de material genético de varios microorganismos en aproximadamente una hora, incluso en aquellos tratados con antibiótico previamente. Así y todo, el cultivo bacteriano sigue estando indicado al permitir además la realización del antibiograma.
En todo paciente con sospecha clínica de meningitis, debería solicitarse, cultivo bacteriano y rt-PCR, al menos, para S. pneumoniae, N. meningitidis y enterovirus y parechovirus. En las sospechas de encefalitis, se debería ampliar el estudio con rt-PCR para virus herpes simple 1, 2 y 6, y otros microorganismos según la clínica asociada o la situación epidémica (influenza). Se aconseja también realizar una rt-PCR para Mycoplasma pneumoniae en frotis faríngeo y de enterovirus en muestra de heces y/o orofaríngea. En ambos casos, si se dispone de ella, se recomienda solicitar una rt-PCR múltiple en LCR, que incluya todos estos agentes y otros menos frecuentes.
Diagnóstico diferencial
Aunque menos frecuentes, se debe plantear diagnóstico diferencial con otras entidades, como la encefalomielitis aguda diseminada o ciertas encefalitis autoinmunitarias.
En apartados previos, ya se han comentado las características clínicas diferenciadoras entre las meningitis víricas y bacterianas. Dentro de estas últimas, ciertos patógenos como M. tuberculosis, T. pallidum y B. burgdoferi (enfermedad de Lyme) suelen producir una clínica más insidiosa.
Otros procesos no infecciosos también pueden producir una inflamación del SNC y cursar con síntomas parecidos a los de una meningoencefalitis viral; es el caso de enfermedades neoplásicas, hemorragias intracraneales, exposición a fármacos o toxinas y enfermedades autoinmunes. Entre estas últimas, la encefalomielitis aguda diseminada (EMAD) está considerada la primera causa de encefalitis autoinmunitaria en niños y adolescentes(15). Debuta de forma aguda con déficits neurológicos multifocales, clínica de encefalopatía y signos de desmielinización en la RM cerebral. Habitualmente, el curso clínico es rápidamente progresivo a lo largo de varios días, llegando a poder ser necesario el ingreso en la unidad de cuidados intensivos, en caso de disfunción del tronco encefálico o aumento de la presión intracraneal.
Otro diagnóstico a tener en cuenta es la encefalitis autoinmunitaria, debida a anticuerpos contra el receptor de N-metil-D-aspartato (anti-NMDA), que es, tras la EMAD, la segunda causa de encefalitis de causa autoinmunitaria en la población pediátrica(16). En este caso, tras un pródromo inicial de cefalea y fiebre que puede confundirse con cualquier proceso viral, el paciente comienza con nuevos síntomas, entre los que destacan los de la esfera psiquiátrica (ansiedad, agitación, alteraciones del comportamiento, alucinaciones e incluso cuadros psicóticos). Puede asociar alteraciones del sueño y la memoria, convulsiones, discinesias e inestabilidad autonómica (hipertermia, alteraciones de la presión arterial y de la frecuencia cardíaca…).
Tratamiento
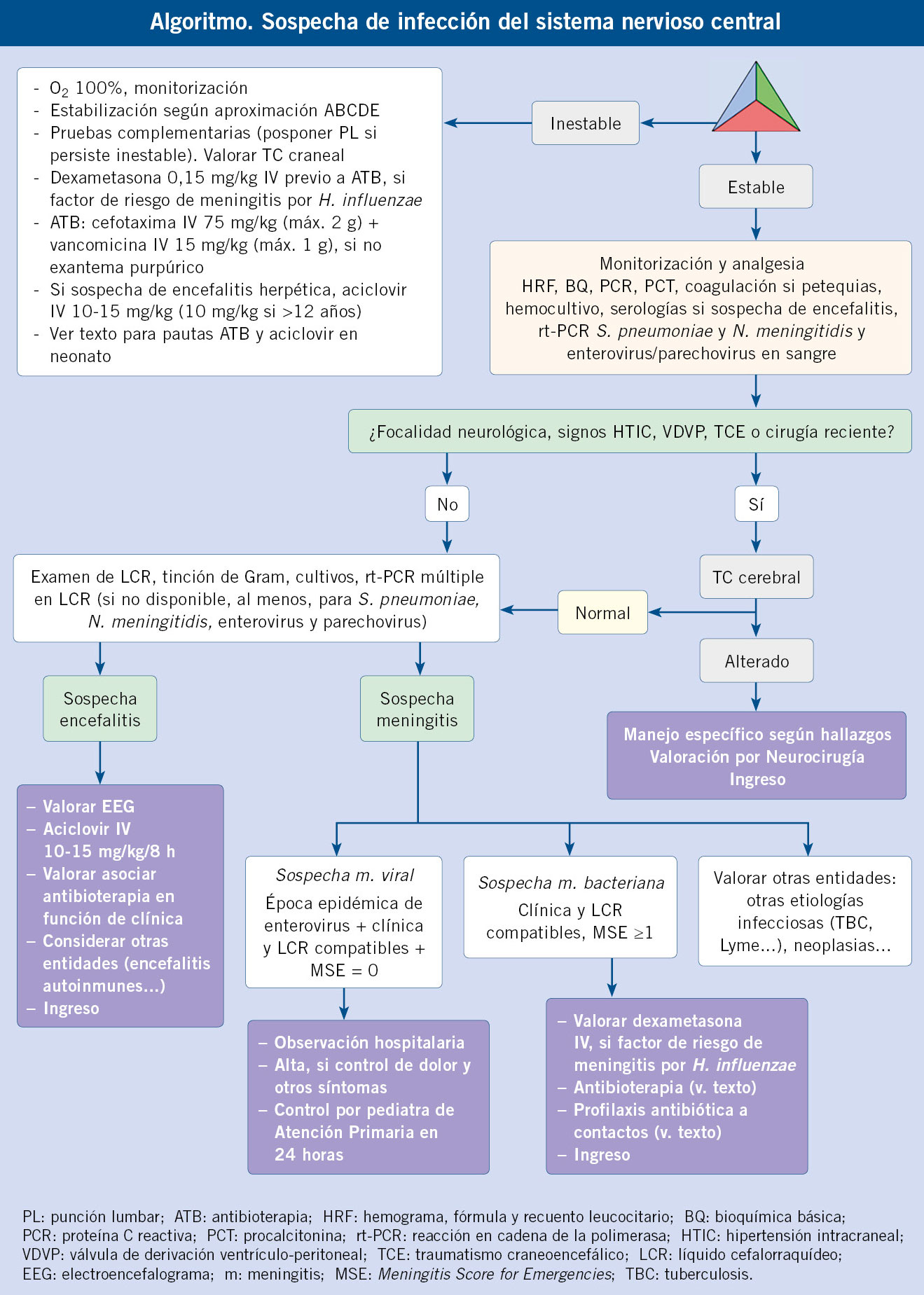
Ante una sospecha de meningitis bacteriana o encefalitis herpética, es esencial realizar una adecuada estabilización inicial mediante la valoración ABCDE e iniciar precozmente el tratamiento antibiótico o antiviral para reducir la morbimortalidad.
El tratamiento del paciente con meningitis o encefalitis se basa en la estabilización y el inicio precoz de tratamiento antibiótico o antiviral, en aquellos casos con sospecha de meningitis bacteriana o encefalitis viral, respectivamente.
1. Estabilización inicial: se iniciará con la valoración del triángulo de evaluación pediátrico (TEP). Los pacientes con meningitis bacteriana o encefalitis suelen presentar una situación de disfunción del SNC (menos frecuentemente shock compensado o descompensado), aunque en etapas iniciales pueden presentar un TEP normal.
En todo paciente con un TEP alterado, deberá realizarse la aproximación ABCDE y las medidas de soporte necesarias de acuerdo a los hallazgos identificados.
• Vía aérea: habitualmente permeable, pero puede verse comprometida si existe una disminución del nivel de consciencia.
• Ventilación: determinación de la frecuencia respiratoria y saturación de O2. Si alteración de la apariencia y si se dispone de capnógrafo no invasivo, determinación de CO2 espirado. Administración de oxigenoterapia. Si polipnea, se debe valorar la posibilidad de compensatoria de acidosis metabólica que pudiera indicar situación de sepsis asociada.
• Circulación: determinar la frecuencia cardíaca y presión arterial. Evaluar relleno capilar, pulsos periféricos, coloración y gradiente térmico. La alteración del alguno de estos datos puede indicar una alteración de la perfusión y, por tanto, una situación de shock asociada. Canalización de vía periférica y, en caso de taquicardia, hipotensión o signos de mala perfusión, iniciar expansiones con sueros isotónicos a 10 ml/kg, valorando respuesta y repitiendo en caso necesario hasta mejoría de dichos parámetros. Si no existe situación de shock, se recomienda esperar a disponer de la natremia para iniciar la sueroterapia más apropiada: sueroterapia de mantenimiento, si la natremia es ≥135 mEq/L; y restricción a 60-75 % del ritmo de mantenimiento, si la natremia es <130 mEq/L, por el riesgo de desarrollar un síndrome de secreción inadecuada de hormona antidiurética (SIADH).
• Estado neurológico: valorar el estado de alerta (escala AVPU), características de las pupilas que puedan orientar a signos de HTIC, y la presencia de posturas o movimientos anómalos. Si solo responde a estímulos dolorosos, considerar Glasgow <9 y valorar la necesidad de instrumentalizar la vía aérea. Si presenta una convulsión activa, dar prioridad al mantenimiento de la vía aérea y, en caso de convulsión de más de 5 minutos, administrar una benzodiacepina (intravenosa como primera opción, intramuscular, intranasal o bucal como alternativa, si no se dispone de acceso venoso). Determinar la glucemia y evaluar el dolor, administrando analgesia apropiada en caso necesario.
• Exposición: identificar lesiones cutáneas que puedan orientar a la etiología del cuadro y determinar la temperatura. Proteger de la hipotermia.
2. Tratamiento antibiótico o antiviral:
• Tratamiento antibiótico: en pacientes previamente sanos con TEP normal y sospecha de meningitis, la decisión de iniciar tratamiento antibiótico vendrá determinada por la presencia o no de factores clínicos de riesgo y la puntuación del BMS o el MSE. En aquellos pacientes sin factores de riesgo y con puntuaciones indicando un muy bajo riesgo (BMS/MSE = 0), es adecuado el tratamiento de soporte y el control clínico.
En pacientes con TEP alterado, factores de riesgo o puntuaciones de BMS/MSE ≥1, se iniciará tratamiento antibiótico. Idealmente, se recomienda administrar la primera dosis una vez realizada la punción lumbar, para que no afecte al rendimiento de la tinción del Gram y el cultivo del LCR. Sin embargo, ante un paciente con alta sospecha de etiología bacteriana inestable o en el que la punción lumbar se tenga que demorar, la antibioterapia se iniciará una vez extraído el hemocultivo, para evitar retrasos que afecten al pronóstico.
Debido a la limitación para atravesar la barrera hematoencefálica, la concentración que alcanzan en el LCR la mayoría de los antibióticos, es de solo el 10-20 % de la alcanzada en sangre. Sin embargo, esta se incrementa en las primeras 24 horas del proceso infeccioso, por la mayor permeabilidad provocada por la respuesta inflamatoria. El tratamiento empírico en pacientes previamente sanos, fuera del periodo neonatal es:
- Vancomicina 15 mg/kg/6 h (máx. 1 g/6 h).
- Ceftriaxona 50 mg/kg/12 h (más 2 g/12 h) o cefotaxima 75 mg/kg/6 h (máx. 2 g/6 h).
En áreas con baja prevalencia de S. pneumoniae resistente a cefalosporinas (incluida resistencia intermedia), se puede considerar la monoterapia con ceftriaxona/cefotaxima.
En la meningitis neonatal, el tratamiento empírico será:
- Ampicilina 75 mg/kg/6 h en >7 días y 100 mg/kg/8 h en ≤7 días.
- Ceftazidima 50 mg/kg/8 h.
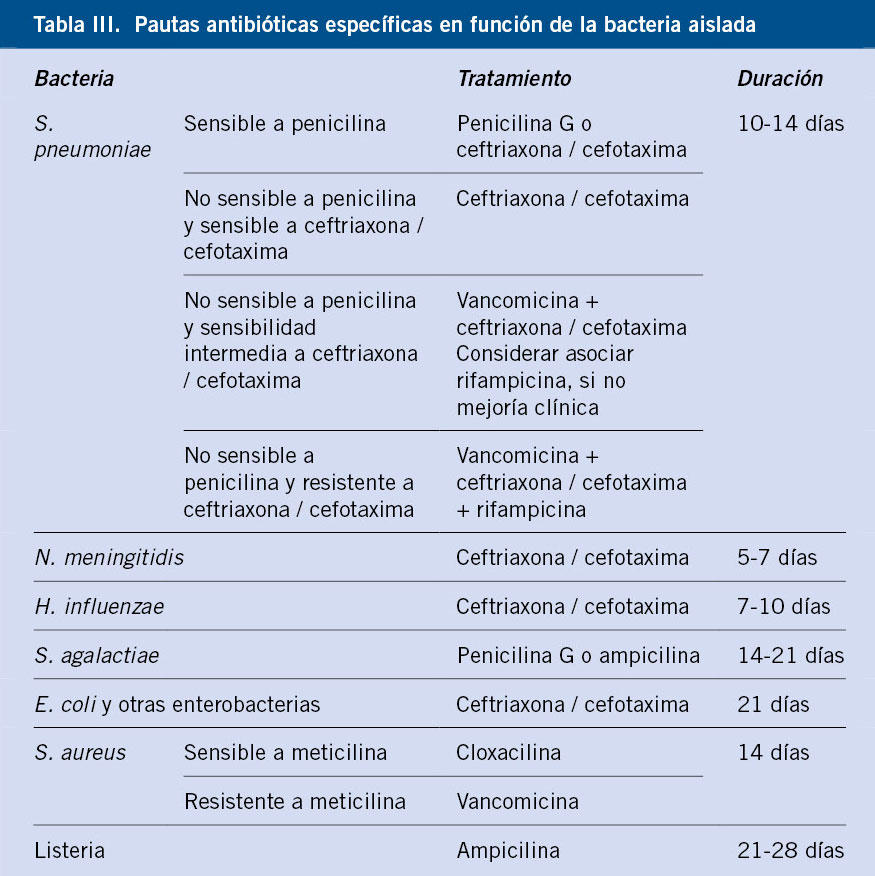
Una vez se aísle la bacteria causante, el tratamiento antibiótico se modificará a la pauta específica (Tabla III)(17).
Se valorará repetir la punción lumbar si no hay mejoría clínica en 48 horas (la fiebre puede persistir más tiempo), hay empeoramiento clínico tras mejoría inicial y en las meningitis por bacilos gramnegativos.
• Tratamiento antiviral: la mayoría de los pacientes con meningitis viral no precisan tratamiento antiviral. Se iniciará tratamiento empírico con aciclovir en pacientes con sospecha clínica de encefalitis. Dosis:
- Neonato: 20 mg/kg/8 h.
- <12 años: 10-15 mg/kg/8 h.
- ≥12 años: 10 mg/kg/8 h.
• Dexametasona: diferentes estudios han analizado la utilidad de la dexametasona como tratamiento adyuvante en pacientes con meningitis bacteriana. Varios meta-análisis muestran que reduce la tasa de sordera en meningitis por Haemophilus, pero sin diferencias en las meningitis por otras bacterias. Tampoco reduce la mortalidad ni la tasa de otras secuelas(18). El beneficio parece ser superior cuando se administra en procesos de corta evolución y se debe tener en cuenta que su uso podría reducir la penetración de la vancomicina a través de la barrera hematoencefálica. Dado que en nuestro medio, la meningitis por Haemophilus es muy poco frecuente en la actualidad, solo parece indicado su uso en pacientes con factores de riesgo de esta (anemia drepanocítica, asplenia…). En caso de administrarse, debe hacerse antes o a la vez que la primera dosis de antibiótico, utilizando una pauta de 0,15 mg/kg/6 h durante 48 horas. También está indicado el tratamiento adyuvante con dexametasona en la meningitis tuberculosa. En este caso, el tratamiento se mantiene durante dos meses.
Pronóstico: la mortalidad de la meningitis bacteriana se estima en el 4-5 % en países desarrollados y el doble en países en vías de desarrollo. Entre las principales secuelas neurológicas que pueden desarrollar los pacientes, destacan la sordera y el desarrollo de epilepsia secundaria. Las meningitis neumocócicas presentan tanto mayor mortalidad (7-15 %) como riesgo de sordera. La hipoglucorraquia <20 mg/dl
se relaciona también con mayor riesgo de sordera, mientras que una escala de Glasgow <9 en la valoración inicial y la persistencia de convulsiones más allá de las 72 horas de inicio del tratamiento antibiótico, se asocian con mayor riesgo de secuelas neurológicas.
El desarrollo de secuelas a medio y largo plazo en pacientes con meningitis por enterovirus o parechovirus, fuera del periodo neonatal, es excepcional, aunque pueden persistir durante varias semanas con astenia, irritabilidad y dificultades para concentrase. Algunos estudios sugieren un posible impacto en el desarrollo cognitivo, pero la evidencia existente hasta la fecha es baja. Por el contrario, el desarrollo de secuelas neurológicas en la encefalitis herpética es elevado, siendo la prevalencia en algunos estudios de hasta el 50-60 %. Entre ellas destacan los trastornos epilépticos, las dificultades en el aprendizaje, los retrasos del desarrollo y los trastornos del comportamiento(19). La prevalencia es superior en la encefalitis neonatal, en la que se describe, además, una mortalidad en torno al 4 %.
Prevención
La vacunación frente al H. influenza, S. pneumoniae y N. meningitidis ha reducido la incidencia de meningitis bacteriana y sus complicaciones. Se deben conocer los criterios de quimioprofilaxis en contactos de casos de infección invasiva.
1. Profilaxis primaria: el calendario de vacunación actual, propuesto por el Consejo Interterritorial del Sistema Nacional de Salud, incluye las vacunas frente al H. influenzae B, S. pneumoniae (vacuna conjugada 13-valente) y N. meningitidis. Además, se recomienda la administración de la vacuna de S. pneumoniae de 23 polisacáridos a pacientes inmunodeprimidos con asplenia, déficit de complemento, enfermedad renal crónica avanzada, enfermedades cardiovasculares, respiratorias o hepáticas crónicas, fístula de LCR o implante coclear.
2. Profilaxis secundaria: se recomienda pautar rifampicina en los siguientes supuestos, ver dosis en la tabla IV.
a. N. meningitidis(20):
• Contactos estrechos con el caso índice:
- Todas las personas que viven en el domicilio del caso índice.
- Todas las personas que hayan pernoctado en la misma habitación del caso, alguno de los 10 días previos a su hospitalización.
- Otras personas que hayan tenido contacto directo con las secreciones nasofaríngeas del enfermo los 10 días precedentes a su hospitalización, como besos íntimos en la boca.
- El personal sanitario que haya realizado maniobras de resucitación boca a boca o intubación endotraqueal sin mascarilla.
• En guarderías y centros de educación infantil: todos los niños y el personal del aula. Si los niños de varias aulas en el mismo centro tuvieran actividades en común, se valorará considerar como contactos a todos ellos. Este hecho será evaluado con especial atención en guarderías; ya que, generalmente, la separación de los niños en aulas es menos rígida que en los centros escolares. No se considerarán como contactos a los compañeros de autobús escolar, recreos u otras actividades limitadas en el tiempo.
• No está indicado administrar quimioprofilaxis a los alumnos que asisten a la misma clase o centro de educación primaria, secundaria y universitaria, a no ser que hayan tenido contacto estrecho.
b. H. influenzae B:
• Convivientes y personas que hayan contactado con el caso índice cuatro o más horas al día, al menos, cinco de los siete días previos a la hospitalización, si están en contacto con niños menores de 4 años que no hayan recibido la vacunación completa frente a H. influenzae B o con individuos inmunodeprimidos.
• Contactos en la guardería, cuando haya 2 casos de enfermedad invasiva en menos de 60 días.
Función del pediatra de Atención Primaria
• Reconocer los síntomas y signos sugestivos de infección del SNC para iniciar precozmente un manejo adecuado de estos pacientes.
• Realizar adecuadamente la estabilización inicial de los pacientes con sospecha clínica de meningitis bacteriana o encefalitis, mediante la sistemática ABCDE, llevando a cabo medidas que reduzcan la morbimortalidad.
• Activar el sistema de Emergencias de manera adecuada, con el objetivo de trasladar a estos pacientes a un medio hospitalario.
• Conocer las indicaciones de quimioprofilaxis secundaria en contactos de casos de infección invasiva por N. meningitidis o H. influenzae.
• Promover la vacunación de niños y niñas para reducir la incidencia de estas infecciones.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.* Ouchenir L, Renaud C, Khan S, Bitnun A, Boisvert A-A, McDonald J, et al. The Epidemiology, Management, and Outcomes of Bacterial Meningitis in Infants. Pediatrics. 2017; 140: e20170476.
2.** Granerod J, Ambrose HE, Davies NW, Clewley JP, Walsh AL, Morgan D, et al; UK Health Protection Agency (HPA) Aetiology of Encephalitis Study Group. Causes of encephalitis and differences in their clinical presentations in England: a multicentre, population-based prospective study. Lancet Infect Dis. 2010; 10: 835-44.
3.** Rozenberg F. Herpes simplex virus and central nervous system infections: encephalitis, meningitis, myelitis. Virologie (Montrouge). 2020; 24: 283-94.
4.* Bewersdorf JP, Grandgirard D, Koedel U, Leib SL. Novel and preclinical treatment strategies in pneumococcal meningitis. Curr Opin Infect Dis. 2018; 31: 85-92.
5. Curtis S, Stobart K, Vandermeer B, Simel DL, Klassen T. Clinical features suggestive of meningitis in children: a systematic review of prospective data. Pediatrics. 2010; 126: 952-60.
6.* Johansson Kostenniemi U, Norman D, Borgström M, Silfverdal SA. The clinical presentation of acute bacterial meningitis varies with age, sex and duration of illness. Acta Paediatr. 2015; 104: 1117-24.
7.** Martínez E, Mintegi S, Vilar B, Martínez MJ, López A, Catediano E, et al. Prevalence and predictors of bacterial meningitis in young infants with fever without a source. Pediatr Infect Dis J. 2015; 34: 494-8.
8.** Roine I, Peltola H, Fernández J, Zavala I, González Mata A, González Ayala S, et al. Influence of admission findings on death and neurological outcome from childhood bacterial meningitis. Clin Infect Dis. 2008; 46: 1248-52.
9.** Gangoiti I, Valle JR, Sota M, Martínez-Indart L, Benito J, Mintegi S, et al. Characteristics of children with microbiologically confirmed invasive bacterial infections in the emergency department. Eur J Emerg Med. 2018; 25: 274-80.
10.*** Britton PN, Dale RC, Blyth CC, Clark JE, Crawford N, Marshall H, et al. Causes and Clinical Features of Childhood Encephalitis: A Multicenter, Prospective Cohort Study. Clin Infect Dis. 2020; 70: 2517-26.
11.** García S, Echevarri J, Arana-Arri E, Sota M, Benito J, Mintegi S, et al. Outpatient management of children at low risk for bacterial meningitis. Emerg Med J. 2018; 35: 361-6.
12.*** Nigrovic LE, Malley R, Kuppermann N. Meta-analysis of bacterial meningitis score validation studies. Arch Dis Child. 2012; 97: 799-805.
13.*** Mintegi S, García S, Martín MJ, Durán I, Arana-Arri E, Fernández CL, et al; Meningitis Group of the Spanish Society of Pediatric Emergencies. Clinical Prediction Rule for Distinguishing Bacterial from Aseptic Meningitis. Pediatrics. 2020; 146: e20201126.
14.** Venkatesan A, Tunkel AR, Bloch KC, Lauring AS, Sejvar J, Bitnun A, et al. Case definitions, diagnostic algorithms, and priorities in encephalitis: consensus statement of the international encephalitis consortium. Clin Infect Dis. 2013; 57: 1114-8.
15.* Cole J, Evans E, Mwangi M, Mar S. Acute disseminated encephalomyelitis in children: an updated review based on current diagnostic criteria. Pediatr Neurol. 2019; 100: 26-34.
16.* Dalmau J, Armangué T, Planagumà J, Radosevic M, Mannara F, Leypoldt F, et al. An update on anti-NMDA receptor encephalitis for neurologists and psychiatrists: mechanisms and models. Lancet Neurol. 2019; 18: 1045-57.
17.* Garrido Colino C. Meningitis bacteriana (v.1.1/2008). Guía_ABE. Infecciones en Pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico. 2008. Disponible en: http://www.guia-abe.es.
18.** Brouwer MC, McIntyre P, Prasad K, van de Beek D. Corticosteroids for acute bacterial meningitis. Cochrane Database Syst Rev. 2015; 2015: CD004405.
19.* Rismanchi N, Gold JJ, Sattar S, Glaser C, Sheriff H, Proudfoot J, et al. Neurological Outcomes After Presumed Childhood Encephalitis. Pediatr Neurol. 2015; 53: 200-6.
20.*** Departamento de salud. Gobierno vasco. Protocolos de vigilancia Epidemiológica. Enfermedad meningocócica invasiva. 2019. Disponible en: https://www.euskadi.eus/contenidos/informacion/vigilancia_protocolos/es_def/adjuntos/Protocolo-EMI_19062019_cast.pdf.
21. Justo Ranera A, Soler-Palacín P, Codina MG, Gonzalo de Liria CR. Meningoencefalitis viral. Pediatr Integral. 2018; XXII: 282-93. Disponible en: https://www.pediatriaintegral.es/publicacion-2018-09/meningoencefalitis-viral/.
Bibliografía recomendada
– Britton PN, Dale RC, Blyth CC, Clark JE, Crawford N, Marshall H, et al. Causes and Clinical Features of Childhood Encephalitis: A Multicenter, Prospective Cohort Study. Clin Infect Dis. 2020; 70: 2517-26.
Estudio multicéntrico que incluye más de
500 casos de pacientes con sospecha de encefalitis, proporcionando información sobre etiología, características clínicas y evolución de los mismos. Un tercio de los casos asociaron mortalidad o secuelas a corto plazo.
– Nigrovic LE, Malley R, Kuppermann N. Meta-analysis of bacterial meningitis score validation studies. Arch Dis Child. 2012; 97: 799-805.
Metaanálisis de 8 estudios y más de 5.000 pacientes, que analiza el rendimiento del BMS para identificar pacientes con pleocitosis y bajo riesgo de meningitis, obteniendo una sensibilidad del 99,3 % y una especificidad del 62,1 %
– Mintegi S, García S, Martín MJ, Durán I, Arana-Arri E, Fernández CL, et al; Meningitis Group of the Spanish Society of Pediatric Emergencies. Clinical Prediction Rule for Distinguishing Bacterial from Aseptic Meningitis. Pediatrics. 2020; 146: e20201126.
Estudio de derivación y validación del Meningitis Score for Emergencies, que incluye más de 1.000 pacientes atendidos en 25 hospitales españoles. Obtuvo una sensibilidad del 100 % y una especificidad del 83,2 %, para identificar pacientes de bajo riesgo de meningitis bacteriana.
– Departamento de salud. Gobierno vasco. Protocolos de vigilancia Epidemiológica. Enfermedad meningocócica invasiva. 2019. Disponible en: https://www.euskadi.eus/contenidos/informacion/vigilancia_protocolos/es_def/adjuntos/Protocolo-EMI_19062019_cast.pdf.
Documento elaborado por el departamento de salud del Gobierno Vasco con información sobre incidencia, definiciones de caso y contacto de infección meningocócica invasiva y recomendaciones de quimioprofilaxis secundaria.
| Caso clínico |
|
Niña de 5 años, sin antecedentes médico-quirúrgicos de interés, trasladado en soporte vital avanzado, monitorizada y recibiendo oxigenoterapia al 100 % con mascarilla con reservorio. Ha presentado un episodio de desconexión del medio de 10 minutos de duración, sin respuesta a estímulos verbales y sin asociar movimientos de extremidades. Al ceder, presenta hipotonía generalizada y refieren que la notan adormilada. A la llegada del soporte vital avanzado, presenta respuesta a estímulos verbales. La familia refiere cuadro catarral leve de varios días de evolución, con fiebre en las últimas 24 horas, en que la notaban menos activa de lo habitual y más adormilada. Traslado sin incidencias. A su llegada al hospital, unas dos horas después del episodio descrito, se encuentra afebril, con constantes normales para su edad, incluida glucemia y capnografía. Realiza dos vómitos y refiere cefalea frontal. En la exploración neurológica llama la atención que, a pesar de reaccionar con el estímulo verbal, impresiona de dificultad para fijar la mirada, bradilalia y bradipsiquia. El resto de la exploración es anodina, salvo exaltación de los reflejos osteotendinosos de extremidades inferiores. La marcha es normal, no tiene dismetrías y no hay signos meníngeos. La analítica no muestra alteraciones electrolíticas, los valores de PCR y PCT negativos, presentando únicamente una discreta leucocitosis con neutrofilia (13.500 leucocitos/mcL con 75 % de neutrófilos). Se completa estudio con: determinación de tóxicos en orina (negativa), TAC cerebral (sin alteraciones) y punción lumbar (líquido de aspecto claro, sin pleocitosis y con glucorraquia y proteinorraquia normales).
|





 Meningitis and meningoencephalitis
Meningitis and meningoencephalitis 