 |
 |
A. Terrén Loraa, M. Maroto Péreza, J. Morales Ortad, A.G. Garcíaa,b,c
aInstituto Fundación Teófilo Hernando. bDepartamento de Farmacología. cInstituto de Investigación Sanitaria del Hospital Universitario de La Princesa, Facultad de Medicina, Universidad Autónoma de Madrid. Madrid. dAlter Farmacia S.A.
Artículo elaborado por la Cátedra UAM-Alter Nutrinfant
Resumen Tras la lactosa y los lípidos, los Oligosacáridos de Leche Materna (OLM) son los compuestos sólidos más abundantes en la leche materna. Aunque se han identificado más de 200, 20 representan más del 90% y solo 3 han sido autorizados para su uso en alimentación infantil: la 2’-fucosilactosa (2’FL), la lacto-N-neotetraosa (LNnT) y la 6’-siali-lactosa (6’-SL). Dados sus notables efectos sobre la salud infantil y la abundante evidencia preclínica y clínica, existe un creciente interés por esclarecer sus mecanismos de acción en cuanto a su capacidad para prevenir o mitigar varias enfermedades del bebé. Entre los efectos reputados se encuentran los siguientes: (1) maduración de los linfocitos; (2) acción bactericida y viricida frente a varios patógenos; (3) disminuyen la incidencia de enterocolitis necrotizante en bebés prematuros; (4) influyen en la composición de la microbiota intestinal del bebé, con predominio de bifidobacterias; y (5) aumentan la producción de ácidos grasos de cadena corta. Dado que las fórmulas infantiles a base de leche de vaca carecen de OLM, actualmente hay un creciente interés por incorporarlos a la alimentación de los niños no amamantados y obtener así los beneficios para la salud del lactante citados anteriormente. |
| Abstract
After lactose and lipids, human milk oligosaccharides (HMOs) are the third most abundant solid components of human milk. Although more than 200 different HMOs have been identified, only 20 constitute over 90% and only 3 of them have been authorized to be used in infant nutrition, namely, 2’fucosyllactose (2’FL), lacto- N-neotetraose (LNnT) and the 6’-siali-lactose (6’-SL) sodium salt. Given their notable effects on infant health, and the proliferating experimental preclinical and clinical evidence, there is growing interest in clarifying their mechanism of action in preventing or mitigating various infant diseases. Among well-reported HMOs effects, the following can be found: (1) lymphocyte maturation, acting as preventive of allergies; (2) they possess antibacterial and antiviriasic effects against various pathogens causing infant respiratory and gastrointestinal infections; (3) they decrease the incidence of necrotizing enterocolitis of premature infants; (4) they exert an influence on the infant intestinal microbiota, where bifidobacteria predominates; (5) they augment the production of short chain fatty acids. Given the fact that most infant formulae are cow ́s milk-based, that possess scarce oligosaccharides concentrations; in light of their proven benefits in several infant diseases; and considering their contribution to the prevention of infant obesity, there is currently growing interest in the supplementation of powder infant milk formulae with authorized HMOs in order to improve infant health. |
Palabras clave: Oligosacáridos de leche materna; Fórmula infantil; Obesidad infantil.
Key words: Human Milk Oligosaccharides; Infant Formula; Child obesity.
Pediatr Integral XXV (5): 267.e1 – 267.e8
Oligosacáridos de la leche humana y microbiota: impacto sobre la salud y obesidad infantil
Introducción
Los OLM presentan multitud de funciones fisiológicas, entre las que destacan la modulación de la microbiota intestinal.
La leche humana posee una variable y compleja composición, y ha evolucionado así para proporcionar al bebé los nutrientes que necesita para su desarrollo en los primeros meses de vida. Hay varios factores que pueden modificar su composición, por ejemplo: la nutrición y el estado de salud de la madre, el estado de salud del bebé o la etapa de la lactancia(1,2). En este contexto, se ha extendido la curiosa idea de que la madre “ajusta” la composición de su leche para adecuarla en cada momento a las necesidades de su bebé(3).
Uno de los componentes críticos de la leche humana son los oligosacáridos (OLM), a los que se les atribuyen múltiples funciones fisiológicas en el bebé, a saber: propiedades prebióticas, modulación y maduración de su sistema inmune, desarrollo de la barrera intestinal y actividades antimicrobianas(4-7). En esta revisión, nos centraremos en estas interesantes estructuras, en su impacto sobre la microbiota intestinal, en sus efectos sobre la salud infantil en general y sobre su capacidad para prevenir la obesidad infantil y, por ende, la obesidad en la vida adulta, que muchas veces es una extensión de la obesidad infantil. Algunos artículos recientes han tratado diversos aspectos parciales de esta temática. Ello se debe al hecho de que la suplementación con OLM de formulaciones infantiles de leche en polvo reviste creciente interés(8,4,9-11).
Oligosacáridos de la leche materna
Se han identificado más de 200 tipos de OLM y sus concentraciones y abundancias relativas varían a lo largo de todo el período de lactancia.
Los OLM constituyen un grupo de complejos glicanos multifuncionales que solo están presentes en la leche humana. Entre sus componentes sólidos más abundantes se encuentran: la lactosa y los lípidos y, en tercer lugar, se hayan los OLM(12,13). Cabe destacar que los OLM son más abundantes y poseen una estructura más variable que los encontrados en la leche de otros mamíferos(14,15). Se han identificado más de 200 OLM con 15 estructuras distintas(16). Sin embargo, solo 20 de ellos comprenden más del 90% de los OLM presentes en la leche humana(17).
Desde la óptica estructural (Fig. 1), los OLM poseen una lactosa unida a un monosacárido simple o ramificado.
Figura 1. Biosíntesis y estructura de los oligosacáridos de la leche humana (OLM). Los oligosacáridos fucosilados 2’-fucosilactosa (2’FL) y 3’-fucosilactosa (3’FL), necesitan la presencia del nucleótido guanosina difosfo-fucosa (GDP), que actúa como donante de residuos de fucosa, mientras que los oligosacáridos ácidos 3’-siali-lactosa (3’-SL) y 6’-siali-lactosa (6’-SL), contienen ácidos siálicos donados por el ácido citidina monofosfato-N-acetilneuroamínico (CMP). Los oligosacáridos neutros no fucosilados se forman a partir de la lactosa por medio de glucosiltransferasas. LNnT: lacto-N-neotetraosa; GlcNac: N-acetil glucosamina. Modificado de: Castanys-Muñoz y cols. 2013.
Algunos de ellos se encuentran fucosilados por la adición de una molécula de fucosa y otros están sialilados por la adición de una molécula de ácido siálico; pueden tener carácter neutro o ácido(18,19). Entre los fucosilados neutros se encuentra la 2’-fucosilactosa (2’FL), y entre los no fucosilados neutros está la lacto-N-neotetraosa (LNnT). Por su parte, los acídicos incluyen la 3’sialilactosa y 6’sialilactosa(20,21).
Los tipos y concentraciones de OLM (Tabla I) varían considerablemente entre las mujeres lactantes y a lo largo del curso temporal de la lactancia; pero dos de ellos son especialmente abundantes a saber, el 2’FL y el LNnT.
Así, en la leche madura las concentraciones de 2’FL oscilan entre 1,1 y 4,3 g/L(13,21-23). Por otra parte, las concentraciones de LNnT son más bajas y varían entre 0,1 y 0,6 g/L(24-27). Los niveles más altos se producen durante el primer mes de lactancia(24). En otros estudios, se ha encontrado que el calostro contiene 20-25 g/L de OLM totales, mientras que la leche materna producida entre los 5 y 90 días de lactancia contiene 5-20 g/L(4,28). Se han descrito algunas variaciones geográficas, pero la concentración media de OLM en la leche materna es similar en diversos países(29). Sin embargo, la concentración total de OLM varía hasta 4 veces entre madres individuales en el mismo periodo de lactancia(17).
Estas variaciones interindividuales en la estructura y abundancia de los OLM parecen tener un sustrato genético; aunque también, podrían influir en esta variabilidad los estímulos medioambientales que, sin embargo, se han estudiado escasamente. En particular, cabe resaltar que las enzimas que catalizan la fucosilación de los OLM se expresan distintamente en grupos de población específicos. Por ejemplo, el 80% de la población caucásica expresa la fucosil transferasa 2 y las madres se denominan “secretoras”; el estado no secretor es más común en poblaciones africanas o afroamericanas(30,31). El perfil secretor de OLM se centra fundamentalmente en el 2’FL, con menores cantidades de lacto-N-fucopentaosa 1 y difucosilactosa(32). Las no secretoras tienen una proporción menor de OLM fucosilados y una concentración más baja de OLM totales(30).
Otros estudios han demostrado cierta variabilidad en la composición de los OLM en relación con factores, tales como: la estación climática o la introducción de fórmulas infantiles y alimentos sólidos en la dieta del bebé(17); esta variabilidad se ha relacionado también con el índice de masa corporal (IMC) de las madres(33), aunque en otro estudio, esta relación resultó ser dudosa(29).
Los OLM parecen poseer un valor nutricional escaso, ya que son digeridos mínimamente en el tracto gastrointestinal del bebé. Pero sí que se absorben intactos en el tracto gastrointestinal proximal; además, en la parte distal del tracto digestivo comienzan a metabolizarse pronto por el microbioma en desarrollo del bebé(19). En los últimos años, están apareciendo estudios que revelan el importante papel de los OLM en la prevención de distintas enfermedades que amenazan la salud del bebé, así como en la prevención de la obesidad infantil. Los analizaremos seguidamente.
OLM y desarrollo del sistema inmune
Los OLM poseen un efecto inmunomodulador directo e indirecto, mediante una acción local en las células del sistema inmunológico del tracto gastrointestinal.
Los OLM contribuyen al desarrollo del sistema inmune del bebé por un mecanismo indirecto relacionado con sus efectos sobre la composición del microbioma y a través de sus efectos sobre ciertas respuestas de las células epiteliales del tracto gastrointestinal. Pero también se han conocido mecanismos directos de modulación de la respuesta inmune. Así, los OLM actúan sobre las células linfoides asociadas con la mucosa; es más, también pueden ejercer efectos moduladores sistémicos pues, aunque escasamente (1%), los OLM se absorben y alcanzan la circulación sistémica. Ello se respalda por estudios que demuestran la presencia de OLM en sangre de bebés amamantados por sus madres, en concentraciones entre 1 y 133 mg/L. De ahí que hoy se acepte que los OLM de la dieta puedan afectar directamente el desarrollo del sistema inmune en el bebé(34,35).
Puesto que los OLM poseen analogías estructurales con la proteína de adhesión selectina, es plausible que los OLM se unan directamente a las células inmunes(36). En este contexto, cabe resaltar que los OLM sialilados contribuyen a la maduración de los linfocitos, ejerciendo así un efecto preventivo de alergias. Este efecto se ha reforzado con un estudio realizado en ratones con síntomas de alergia producida por la alimentación oral con ovoalbúmina; los OLM amortiguaron los síntomas alérgicos, al tiempo que redujeron la liberación de quimiocinas(37).
OLM y enfermedades infecciosas (Fig. 2)
Figura 2. Actividad antibacteriana/antivírica de los oligosacáridos de la leche materna (OLM). A. Las bacterias y los virus se unen a los glicanos que forman el glicocalix de las células epiteliales enterales y provocan la infección del huésped. B. La presencia de los OLM inhibe la infección por bacterias y virus fijándolos en la luz intestinal. C. La presencia de los OLM impide la adhesión de virus y bacterias a los glicanos de la superficie celular.
Numerosos estudios han demostrado el papel de los OLM en la prevención de enfermedades infeccionas en el bebé; tanto gastrointestinales como respiratorias.
Se sabe que muchos virus y bacterias tienen que adherirse a la superficie de las células epiteliales enterales, con el fin de proliferar y producir una infección. Esta adhesión tiene lugar en los azúcares (glicanos) que forman el glicocalix epitelial. La estructura de los OLM remeda la de estos glicanos; de ahí que puedan actuar como receptores solubles o señuelos, bloqueando la unión de los gérmenes al epitelio, que serán expulsados por las heces, previniendo así las infecciones. Algunos ejemplos ilustran estos efectos de los OLM.
En un modelo de ratón, se ha observado que el oligosacárido 2’FL atenúa un 80% la invasión por Chlostridium jejuni, al tiempo que inhibe la liberación de mediadores proinflamatorios en la mucosa intestinal y reduce los episodios diarreicos. Por otra parte, el oligosacárido LNnT reduce el número de Streptococcus pneumonia en el pulmón de un modelo animal(4,19). Los OLM también ejercen un singular efecto antibacteriano contra el principal patógeno neonatal, el Streptococcus B, ya que actúan como un sustrato que modifica el crecimiento de esta bacteria(38). Por otra parte, el efecto antiadhesivo de los OLM también se extiende a ciertos parásitos protozoarios, caso de la Entamoeba histolytica, causante de disentería amebiana y de abscesos hepáticos. Para producir una infección, la E. histolytica requiere adherirse a la mucosa del colon pues, de lo contrario, se expulsan por las heces. Puesto que los OLM se digieren poco en el intestino delgado, llegan intactos al colon; allí reducen la adhesión del parásito a la mucosa y, por ende, también protegen el epitelio frente a sus efectos citotóxicos(39).
Uno de los ingeniosos mecanismos por el cual los OLM prestan protección frente a las enfermedades viriásicas, está relacionado con el bloqueo de los receptores virales de lectina; de esta manera, los virus no pueden reconocer los glicanos de las células epiteliales, previniendo así su adhesión y colonización. Hay un creciente número de estudios que documentan las acciones antivirales de los OLM. Por ejemplo, el OLM 2’FL bloquea con alta eficacia la adhesión de norovirus(40). Por otra parte, se sabe que la infección por rotavirus es la causa principal de gastroenteritis y diarrea en bebés y niños jóvenes; además, esta infección es la causa del 5% de todas las muertes que acontecen en niños menores de 5 años. El papel protector de los OLM frente a estas infecciones se apoya en algunos estudios que demuestran que la gastroenteritis por rotavirus es menos frecuente en bebés amamantados por sus madres, en comparación con bebés alimentados con fórmulas artificiales modificadas(41,42).
También, se han realizado estudios que demuestran un efecto protector de los OLM frente a virus respiratorios. Por ejemplo, los oligosacáridos 2’FL y LNnT reducen la carga viral del virus influenza, disminuyendo así su capacidad infecciosa. Es más, parece que los OLM de la leche materna incrementan la inmunidad innata frente a los virus respiratorios(43-45). Durante la lactancia, los OLM entran en contacto con la mucosa laringofaríngea; en esa región, pueden reducir la adhesión viral y la penetración de los gérmenes patógenos en la mucosa respiratoria, lo que explicaría su efecto preventivo de infecciones respiratorias(16).
Por otra parte, se ha descrito que los OLM reducen la frecuencia de infecciones por Streptococcus B. Ello se explica por sus efectos antibacterianos, que pueden prestar cierta sinergia con algunos antibióticos. Dado que los OLM están presentes en plasma y orina de bebés amamantados con leche natural, se explicaría así la menor tasa de infecciones estreptocócicas en los mismos(38).
Otras enfermedades
Los OLM reducen el riesgo de padecer enterocolitis necrotizante en bebés y mejoran la absorción de minerales para el mantenimiento de la salud ósea.
Se han realizado algunos estudios que demuestran el efecto beneficioso de los OLM sobre otras enfermedades, por ejemplo, en la enterocolitis necrotizante. Esta grave patología afecta al 5-10% de los bebés prematuros con pesos menores de 1,5 kg. Resulta curioso el hallazgo de que los bebés amamantados por sus madres posean un riesgo 6-10 veces menor de padecer enterocolitis necrotizante, en comparación con aquellos que se alimentaron con una fórmula infantil(46,47).
Por último, cabe reseñar un estudio sobre salud ósea realizado en ratas. Se observó que la administración de OLM aumentaban la mineralización, la densidad y la estructura del hueso, reduciendo la resorción ósea; concomitantemente, los OLM elevaron la absorción de calcio, magnesio y fósforo inorgánico, datos indicadores de un mejor desarrollo y mantenimiento de la salud ósea(48).
OLM y microbiota
La abundancia de bifidobacterias está determinada por la presencia de OLM en la alimentación del bebé, y sus concentraciones y abundancias relativas varían a lo largo de todo el período de lactancia.
El desarrollo de la microbiota intestinal es un proceso secuencial que acontece durante los 3 primeros años de vida del niño. En niños amamantados por sus madres predominan las bifidobacterias, con escasas bacterias de los géneros Chlostridium y Enterococcus, y casi nula presencia de Klebsiella y Enterobacter. La microbiota de los bebés alimentados con fórmulas artificiales es más compleja y remeda la microbiota de los adultos.
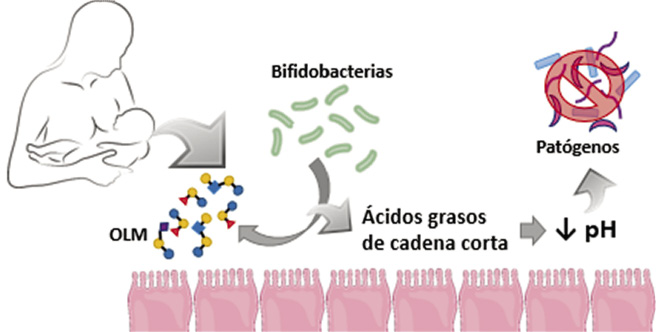
El predominio de bifidobacterias se debe a la presencia de OLM en la leche materna (Fig. 3).
Figura 3. Efecto prebiótico de los oligosacáridos de la leche materna (OLM). Los OLM de la leche materna llegan intactos al intestino de los lactantes, donde son fermentados por las bifidobacterias. Durante esta fermentación, se liberan ácidos grasos de cadena corta que acidifican el medio impidiendo el crecimiento de patógenos.
Estos oligosacáridos sufren un proceso de fermentación protagonizado por las bifidobacterias del intestino grueso. En este proceso se libera ácido acético, que reduce el pH del microambiente intestinal, ejerciendo así una acción bacteriostática inhibidora del crecimiento de gérmenes patógenos.
En este proceso, también se producen otros ácidos grasos de cadena corta (AGCC), tipo ácido propiónico y ácido butírico. Estos AGCC constituyen una importante fuente de energía para los enterocitos y son críticos para el mantenimiento de la salud intestinal. Cabe destacar que los OLM aumentan la producción de acetato, propionato y butirato, los tres AGCC predominantes; el lactato y el succinato, también presentes, se han estudiado poco(39).
Se han realizado otros estudios que demuestran que los AGCC ejercen efectos sistémicos. Tal es el caso de la regulación de la expresión de genes(49) y de la activación y diferenciación de células inmunes, un efecto relacionado con enfermedades alérgicas e inflamatorias(39,50,51).
OLM, microbioma y obesidad infantil
Diversos estudios apuntan a un efecto de los OLM sobre la composición corporal del bebé durante los primeros meses de vida.
Un vasto análisis realizado en 129 millones de niños, adolescentes y adultos revela el enorme impacto sociosanitario que a nivel mundial tiene la obesidad(52). En un estudio llevado a cabo en los EE.UU, se observó que en el periodo 2015-2016, el 35% de los niños tenían sobrepeso y el 18,5% eran obesos(53). Otro estudio hecho en Nueva Zelanda, concluyó que 1 de cada 3 niños en edad preescolar tenían sobrepeso o eran obesos(54).
Los niños obesos presentan un mayor riesgo de sufrir enfermedades cardio-metabólicas (hipertensión, menor tolerancia a la glucosa, hiperinsulinismo y función hepática anormal)(55-58). Un estudio realizado en 689 niños y adolescentes entre los 4 y 18 años de edad, demostró la asociación entre la evolución del índice de masa corporal (IMC) durante el desarrollo infantil y la tardoadolescencia, y la aparición de marcadores de riesgo cardiometabólico durante el periodo entre adolescencia tardía y el adulto(59). Por otra parte, el niño obeso padece alteraciones del ánimo, la conducta y el sueño. Además, la obesidad infantil se asocia con una pobre adaptación psicosocial del niño que incluye: insatisfacción por el aspecto de su cuerpo, depresión, alteraciones en la ingesta alimentaria, conducta obsesiva con el control de peso, pobre relación social y, en general, una disminución de su calidad de vida(58,60).
Con frecuencia, la obesidad del adulto tiene su origen en la infancia. Así, los bebés que experimentan una rápida ganancia de peso poseen una probabilidad 4 veces más alta de sufrir sobrepeso u obesidad durante la infancia; es más, estos niños tienen el doble de probabilidad de padecer sobrepeso u obesidad durante su vida adulta, particularmente cuando la rápida ganancia de peso acontece durante su primer año de vida(61,62). En otro estudio, se concluye que hasta el 83% de los niños que presentan sobrepeso, serán obesos en la edad adulta(63). De ahí que la prevención de la obesidad en la infancia se haya convertido en una estrategia prioritaria en salud pública(64). Y en este contexto, existe gran interés por conocer la influencia de distintos OLM sobre el crecimiento y el peso del bebé en sus primeros meses de vida, como se refleja en los estudios que comentamos seguidamente.
La distinta composición en OLM de la leche materna se ha relacionado con el crecimiento del bebé y su composición corporal durante los primeros 6 meses de vida(65). En este estudio, se halló una correlación entre el porcentaje de OLM en la leche materna y un menor porcentaje de masa grasa al mes y 6 meses de edad de los bebés. Esta correlación fue positiva para el 2’FL y negativa para el LNnT. Esta relación podría explicarse en base a los AGCC producidos como resultado de la fermentación bacteriana de los OLM. Se sabe que estos compuestos modulan la homeostasia energética y el apetito(66). En un reciente estudio, se exploró la hipótesis de que el crecimiento normal o excesivo estaba relacionado con la distinta concentración del AGCC en las heces del bebé y con la de OLM en la leche de sus madres. Los autores concluyen que el crecimiento más rápido de los bebés se correlaciona con niveles más bajos de OLM en la leche de sus madres(67).
Otro estudio, también reciente, abordó la posible relación entre la composición en OLM de la leche materna y el crecimiento de los bebés en los primeros meses de vida. La población fue bastante amplia, pues para el análisis de los OLM se incluyeron muestras de leche de 802 madres. Los autores encontraron una asociación negativa entre la diversidad de OLM y la concentración de LNnT con la altura y el peso de los bebés; también observaron una correlación positiva entre el 2’FL y la altura y peso de los bebés. Los autores resaltan la relevancia de estos hallazgos en el contexto de los suplementos a base de los OLM 2’FL y LNnT, que se están empezando a introducir en las fórmulas de leches infantiles(68). Estos resultados concuerdan con el estudio antes analizado(65). En esa dirección va un tercer estudio exploratorio realizado en 30 pares de madres y bebés. Su objetivo era evaluar los OLM en leche materna en bebés con peso elevado, en comparación con los que tenían un peso normal. Los resultados sugieren que la concentración de LNnT se relaciona negativamente con la altura, ganancia de peso e índice de masa grasa a los 5 y 9 meses de edad. También, se observó una correlación positiva entre la concentración de 2’FL, la ganancia de peso y el índice de masa grasa a los 5 meses de vida(69).
La relación entre microbioma y la ganancia de peso se ha estudiado en algunos trabajos. Así, en dos estudios, se establece una correlación entre la composición del microbioma y el IMC de sujetos delgados u obesos(70,71). En otro estudio, se observó un predominio de Firmicutes en aquellos bebés con alimentación mixta, leche materna y fórmula, con respecto a bebés amamantados exclusivamente por sus madres; ello sugiere que la composición del microbioma del bebé está relacionada con los OLM que ingiere(14,72). En este sentido, cabe destacar otro estudio en el que se demuestra la existencia de una relación Firmicutes-Bacteroides más alta en niños, adultos y obesos(73). Finalmente, en una cohorte de 165 bebés noruegos se halló que el microbioma de bebés con tan solo 10 días de edad, se correlacionaba con el IMC a los 12 años de edad; dicha correlación fue incluso mayor entre el microbioma a los 2 años de edad y el IMC a los 12 años de edad(74).
También, se han realizado algunos estudios en modelos animales que, a pesar de la dificultad de extrapolar los hallazgos al contexto clínico pediátrico, revisten interés. Así, en varios estudios animales, se ha demostrado una asociación entre una elevada proporción Firmicutes-Bacteroides y obesidad(75). En otro curioso estudio, se observó que los ratones ganaban peso más rápidamente tras la administración de muestras fecales de humano obesos(76). Finalmente, en un estudio realizado en ratones y armadillos alimentados con oligosacáridos sialilados, se encontraron cambios paralelos entre el incremento de peso y el microbioma(77).
Bases para la suplementación de las formulaciones infantiles con oligosacáridos
Las fórmulas infantiles con los OLM 2´FL y LNnT son seguras. En algunos estudios, además se ha observado una morbilidad menor y un menor uso de antibióticos y antipiréticos en sujetos alimentados con este tipo de fórmulas.
Al contrario que la leche materna humana, la leche de vaca contiene niveles bajos de oligosacáridos. Además, y también en comparación con la leche humana, los oligosacáridos de la leche de vaca presentan una limitada diversidad estructural(78). Ello constituye el fundamento racional para la suplementación con los OLM 2’FL y LNnT, de las formulaciones infantiles basadas en la leche de vaca. La seguridad de esta suplementación tiene un apoyo experimental preclínico sólido(79,80). También, hay algunos ensayos clínicos diseñados para conocer la influencia de los OLM sobre la salud del niño en sus primeros meses de vida.
En un reciente ensayo clínico multicéntrico, se evaluó la seguridad de dos formulaciones infantiles basadas en leche de vaca con proteínas intactas; una se utilizó como control y la otra se complementó con 1 g/L de 2’FL y 0,5 g/L de LNnT. Se incluyeron bebés de 0 a 14 días de edad y se alimentaron, durante los 6 meses posteriores al reclutamiento, con la leche control (n=87) o con la leche suplementada con OLM (n=88). A partir de los 6 meses de edad, todos los bebés recibieron la fórmula suplementada con OLM, entre los 6 y los 12 meses. El objetivo primario fue la ganancia de peso a lo largo de 4 meses y los secundarios incluyeron medidas antropométricas, tolerabilidad gastrointestinal, patrones conductuales y morbilidad a lo largo de los 12 meses. El estudio concluyó que la fórmula suplementada con 2’FL y LNnT fue segura, se toleró bien y permitió un aumento adecuado de peso con la edad de los bebés. Además, entre las variables secundarias se observó una morbilidad más baja (particularmente bronquitis) y una disminución del uso de medicación (antipiréticos y antibióticos)(81).
Conclusiones
Los singulares oligosacáridos de la leche humana madura despliegan un amplio abanico de efectos “fisiofarmacológicos” positivos para la salud del bebé. Entre ellos cabe destacar: la regulación del sistema inmune, el desarrollo de la microbiota intestinal o la atenuación del riesgo de infecciones gastrointestinales y respiratorias. También existe creciente evidencia que sugiere la asociación entre desajustes de la microbiota intestinal del bebé y el potencial para desarrollar sobrepeso y obesidad infantil; esta dishomeostasia de la microbiota intestinal podría ser corregida por los OLM, disminuyendo así el riesgo de obesidad infantil y, por tanto, de obesidad en la vida adulta. Los estudios aquí analizados y las drásticas diferencias entre los OLM y los oligosacáridos de la leche de vaca, constituyen el fundamento racional para la suplementación con OLM de las fórmulas infantiles basadas en la leche de vaca. Los escasos ensayos clínicos realizados hasta ahora y otros futuros estudios, clarificarán hasta qué punto la suplementación de las fórmulas infantiles con OLM ejerce efectos fisiofarmacológicos parecidos a los OLM de la leche humana. Sería harto interesante la realización de ensayos clínicos en los que se evalúe simultáneamente, en el mismo bebé, la ingesta de fórmulas lácteas suplementadas con OLM, el microbioma y la ganancia de peso y grasa corporal.
Bibliografía
1. Michaelsen KF, Skafte L, Badsberg JH, Jørgensen M. Variation in macronutrients in human bank milk: influencing factors and implications for human milk banking. J Pediatr Gastroenterol Nutr. 1990; 11: 229-39.
2. Fujimori M, França EL, Fiorin V, Morais TC, Honorio-França AC, de Abreu LC. Changes in the biochemical and immunological components of serum and colostrum of overweight and obese mothers. BMC Pregnancy Childbirth. 2015; 15: 166.
3. Hennet T, Borsig L. Breastfed at Tiffany’s. Trends Biochem Sci. 2016; 41: 508-18.
4. Bode L. The functional biology of human milk oligosaccharides. Early Hum Dev. 2015; 91: 619-22.
5. Plaza-Díaz J, Fontana L, Gil A. Human Milk Oligosaccharides and Immune System Development. Nutrients. 2018; 10: 1038.
6. Craft KM, Townsend SD. Mother Knows Best: Deciphering the Antibacterial Properties of Human Milk Oligosaccharides. Acc. Chem. Res. 2019; 52: 760-8.
7. Triantis V, Bode L, Joost van Neerven RJ. Immunological Effects of Human Milk Oligosaccharides. Front Pediatr. 2018; 6: 190.
8. Maessen SE, Derraik JGB, Binia A, Cutfield WS. Perspective: Human Milk Oligosaccharides: Fuel for Childhood Obesity Prevention? Adv Nutr. 2020; 11: 35-40.
9. Salamone M, Di Nardo V. Effects of human milk oligosaccharides (HMOs) on gastrointestinal health. Front Biosci. 2020; 12: 183-98.
10. Wiciński M, Sawicka E, Gębalski J, Kubiak K, Malinowski B. Human Milk Oligosaccharides: Health Benefits, Potential Applications in Infant Formulas, and Pharmacology. Nutrients. 2020; 12: 266.
11. Van Leeuwen SS. Challenges and Pitfalls in Human Milk Oligosaccharide Analysis. Nutrients. 2019; 11: 2684.
12. Zivkovic AM, German JB, Lebrilla CB, Mills DA. Human milk glycobiome and its impact on the infant gastrointestinal microbiota. PNAS. 2011; 108: 4653-8.
13. Coppa GV, Zampini L, Galeazzi T, Gabrielli O. Prebiotics in human milk: a review. Dig Liver Dis. 2006; 38: 291-4.
14. Wang M, Li M, Wu S, Lebrilla CB, Chapkin RS, Ivanov I, et al. Fecal microbiota composition of breast-fed infants is correlated with human milk oligosaccharides consumed. J Pediatr Gastroenterol Nutr. 2015; 60: 825-33.
15. Kirmiz N, Robinson RC, Shah IM, Barile D, Mills DA. Milk Glycans and Their Interaction with the Infant-Gut Microbiota. Annu Rev Food Sci Technol. 2018; 9: 429-50.
16. Smilowitz JT, Lebrilla CB, Mills DA, German JB, Freeman SL. Breast milk oligosaccharides: structure-function relationships in the neonate. Annu Rev Nutr. 2014; 34: 143-69.
17. Azad MB, Robertson B, Atakora F, Becker AB, Subbarao P, Moraes TJ, et al. Human Milk Oligosaccharide Concentrations Are Associated with Multiple Fixed and Modifiable Maternal Characteristics, Environmental Factors, and Feeding Practices. J Nutr. 2018; 148: 1733-42.
18. Blank D, Dotz V, Geyer R, Kunz C. Human Milk Oligosaccharides and Lewis Blood Group: Individual High-Throughput Sample Profiling to Enhance Conclusions From Functional Studies. Adv Nutr. 2012; 3: 440-9.
19. Bode L. Human Milk Oligosaccharides: Structure and Functions. Nestle Nutr Inst Workshop Ser. 2020; 94: 115-23.
20. Hamosh M. Bioactive factors in human milk. Pediatr Clin North Am. 2001; 48: 69-86.
21. Bao Y, Chen C, Newburg DS. Quantification of neutral human milk oligosaccharides by graphitic carbon high-performance liquid chromatography with tandem mass spectrometry. Anal Biochem. 2013; 433: 28-35.
22. Chaturvedi P, Warren CD, Altaye M, Morrow AL, Ruiz-Palacios G, Pickering LK, et al. Fucosylated human milk oligosaccharides vary between individuals and over the course of lactation. Glycobiology. 2001; 11: 365-72.
23. Hong Q, Ruhaak LR, Totten SM, Smilowitz JT, German JB, Lebrilla CB. Label-free absolute quantitation of oligosaccharides using multiple reaction monitoring. Anal Chem. 2014; 86: 2640-7.
24. Erney RM, Malone WT, Skelding MB, Marcon AA, Kleman-Leyer KM, O’Ryan ML, et al. Variability of human milk neutral oligosaccharides in a diverse population. J Pediatr Gastroenterol Nutr. 2000; 30: 181-92.
25. Sumiyoshi W, Urashima T, Nakamura T, Arai I, Saito T, Tsumura N, et al. Determination of each neutral oligosaccharide in the milk of Japanese women during the course of lactation Br J Nutr. 2003; 89: 61-9.
26. Asakuma S, Urashima T, Akahori M, Ohbayashi H, Nakamura T, Kimura K, et al. Variation of major neutral oligosaccharides levels in human colostrum. Eur J Clin Nutr. 2008; 62: 488-94.
27. Thurl S, Munzert M, Henker J, Boehm G, Müller-Werner B, Jelinek J, et al. Variation of human milk oligosaccharides in relation to milk groups and lactational periods. Br J Nutr. 2010; 104: 1261-71.
28. Thurl S, Munzert M, Boehm G, Matthews C, Stahl B. Systematic review of the concentrations of oligosaccharides in human milk. Nutr Rev. 2017; 75: 920-33.
29. McGuire MK, Meehan CL, McGuire MA, Williams JE, Foster J, Sellen DW, et al. What’s normal? Oligosaccharide concentrations and profiles in milk produced by healthy women vary geographically. Am J Clin Nutr. 2017; 105: 1086-100.
30. Totten SM, Zivkovic AM, Wu S, Ngyuen U, Freeman SL, Ruhaak LR, et al. Comprehensive profiles of human milk oligosaccharides yield highly sensitive and specific markers for determining secretor status in lactating mothers. J Proteome Res. 2012; 11: 6124-33.
31. de Mattos LC. Structural diversity and biological importance of ABO, H, Lewis and secretor histo-blood group carbohydrates. Rev. Bras. Hematol. Hemoter. 2016; 38: 331-40.
32. Sprenger N, Lee LY, De Castro CA, Steenhout P, Thakkar SK. Longitudinal change of selected human milk oligosaccharides and association to infants’ growth, an observatory, single center, longitudinal cohort study. PLOS ONE. 2017; 12: e0171814.
33. Jantscher-Krenn E, Aigner J, Reiter B, Köfeler H, Csapo B, Desoye G, et al. Evidence of human milk oligosaccharides in maternal circulation already during pregnancy: a pilot study. Am J Physiol Endocrinol Metab. 2019; 316: 347-57.
34. Macpherson AJ, Geuking MB, McCoy KD. Immune responses that adapt the intestinal mucosa to commensal intestinal bacteria. Immunology. 2005; 115: 153-62.
35. Goehring KC, Kennedy AD, Prieto PA, Buck RH. Direct Evidence for the Presence of Human Milk Oligosaccharides in the Circulation of Breastfed Infants. PLOS ONE. 2014; 9: e10169.
36. Eiwegger T, Stahl B, Haidl P, Schmitt J, Boehm G, Dehlink E, et al. Prebiotic oligosaccharides: In vitro evidence for gastrointestinal epithelial transfer and immunomodulatory properties. Pediatr Allergy Immunol. 2010; 21: 1179-88.
37. Castillo-Courtade L, Han S, Lee S, Mian FM, Buck R, Forsythe P. Attenuation of food allergy symptoms following treatment with human milk oligosaccharides in a mouse model. Allergy. 2015; 70: 1091-102.
38. Lin AE, Autran CA, Szyszka A, Escajadillo T, Huang M, Godula K, et al. Human milk oligosaccharides inhibit growth of group B Streptococcus. J Biol Chem. 2017; 292: 11243-9.
39. Correa-Oliveira R, Fachi JL, Vieira A, Sato FT, Vinolo MA. Regulation of immune cell function by short-chain fatty acids. Clin Transl Immunol. 2016; 5: e73.
40. Almand EA, Moore MD, Jaykus LA. Norovirus Binding to Ligands Beyond Histo-Blood Group Antigens. Front Microbiol. 2017; 8: 2549.
41. Parashar UD, Gibson CJ, Bresee JS, Glass RI. Rotavirus and severe childhood diarrhea. Emerg Infect Dis. 2006; 12: 304-6.
42. Plenge-Bönig A, Soto-Ramírez N, Karmaus W, Petersen G, Davis S, Forster J. Breastfeeding protects against acute gastroenteritis due to rotavirus in infants. Eur J Pediatr. 2010; 169: 1471-6.
43. Kwon SJ, Na DH, Kwak JH, Douaisi M, Zhang F, Park EJ, et al. Nanostructured glycan architecture is important in the inhibition of influenza A virus infection. Nat Nanotechnol. 2017; 12: 48-54.
44. Zevgiti S, Zabala JG, Darji A, Dietrich U, Panou-Pomonis E, Sakarellos-Daitsiotis M. Sialic acid and sialyl-lactose glyco-conjugates: design, synthesis and binding assays to lectins and swine influenza H1N1 virus. J Pept Sci. 2012; 18: 52-8.
45. Xiao L, Leusink-Muis T, Kettelarij N, van Ark I, Blijenberg B, Hesen NA, et al. Human Milk Oligosaccharide 2’-Fucosyllactose Improves Innate and Adaptive Immunity in an Influenza-Specific Murine Vaccination Model. Front Immunol. 2018; 9: 452.
46. Neu J, Walker WA. Necrotizing enterocolitis. N Engl J Med. 2011; 364(3): 255-264
47. Hintz SR, Kendrick DE, Stoll, BJ, Neurodevelopmental and growth outcomes of extremely low birth weight infants after necrotizing enterocolitis. Pediatrics. 2005; 115: 696-703.
48. Bryk G, Coronel MZ, Pellegrini G, Mandalunis P, Rio ME, de Portela ML, et al. Effect of a combination GOS/FOS® prebiotic mixture and interaction with calcium intake on mineral absorption and bone parameters in growing rats. Eur J Nutr. 2015; 54: 913-23.
49. Koh A, De Vadder F, Kovatcheva-Datchary P, Bäckhed F. From Dietary Fiber to Host Physiology: Short-Chain Fatty Acids as Key Bacterial Metabolites. Cell. 2016; 165: 1332-45.
50. Kumari M, Kozyrskyj AL. Gut microbial metabolism defines host metabolism: An emerging perspective in obesity and allergic inflammation. Obes Rev. 2017; 18: 18-31.
51. Richards JL, Yap YA, McLeod KH, Mackay CR, Marino E. Dietary metabolites and the gut microbiota: An alternative approach to control inflammatory and autoimmune diseases. Clin Transl Immunol. 2016; 5: e82.
52. NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in body-mass index, underweight, overweight, and obesity from 1975 to 2016: a pooled analysis of 2416 population-based measurement studies in 128·9 million children, adolescents, and adults. Lancet. 2017; 390: 2627-42.
53. Skinner AC, Ravanbakht SN, Skelton JA, Perrin EM, Armstrong SC. Prevalence of Obesity and Severe Obesity in US Children, 1999-2016. Pediatrics. 2018; 141: e20173459.
54. Shackleton N, Milne BJ, Audas R, Derraik JGB, Zhu T, Taylor RW, et al. Improving rates of overweight, obesity and extreme obesity in New Zealand 4-year-old children in 2010-2016. Pediatr Obes. 2018; 13: 766-77.
55. Reilly JJ, Kelly J. Long-term impact of overweight and obesity in childhood and adolescence on morbidity and premature mortality in adulthood: systematic review. Int J Obes (Lond). 2011; 35: 891-8.
56. Bastien M, Poirier P, Lemieux I, Després JP. Overview of epidemiology and contribution of obesity to cardiovascular disease. Prog Cardiovasc Dis. 2014; 56: 369-81.
57. Kohut T, Robbins J, Panganiban J. Update on childhood/adolescent obesity and its sequela, Curr Opin Pediatr. 2019; 31: 645-53.
58. Pulgarón ER. Childhood obesity: a review of increased risk for physical and psychological comorbidities. Clin Ther. 2013; 35: 18-32.
59. Oluwagbemigun K, Buyken AE, Alexy U, Schmid M, Herder C, Nöthlings U. Developmental trajectories of body mass index from childhood into late adolescence and subsequent late adolescence-young adulthood cardiometabolic risk markers. Cardiovasc Diabetol. 2019; 18: 9.
60. Güngör NK. Overweight and obesity in children and adolescents. J Clin Res Pediatr Endocrinol. 2014; 6: 129-43.
61. Zheng M, Lamb KE, Grimes C, Laws R, Bolton K, Ong KK, et al. Rapid weight gain during infancy and subsequent adiposity: a systematic review and meta-analysis of evidence. Obes Rev. 2018; 19: 321-32.
62. Singh AS, Mulder C, Twisk JW, van Mechelen W, Chinapaw MJ. Tracking of childhood overweight into adulthood: a systematic review of the literature. Obes Rev. 2008; 9: 474-88.
63. Freedman DS, Khan LK, Serdula MK, Dietz WH, Srinivasan SR, Berenson GS. Racial differences in the tracking of childhood BMI to adulthood. Obes Res. 2005; 13: 928-35.
64. Deshmukh-Taskar P, Nicklas TA, Morales M, Yang SJ, Zakeri I, Berenson GS. Tracking of overweight status from childhood to young adulthood: the Bogalusa Heart Study. Eur J Clin Nutr. 2006; 60: 48-57.
65. Alderete TL, Autran C, Brekke BE, Knight R, Bode L, Goran MI, et al. Associations between human milk oligosaccharides and infant body composition in the first 6 mo of life. Am J Clin Nutr. 2015; 102: 1381-8.
66. Pekmez CT, Dragsted LO, Brahe LK. Gut microbiota alterations and dietary modulation in childhood malnutrition – The role of short chain fatty acids. Clin Nutr. 2019; 38: 615-30.
67. Pekmez CT, Larsson MW, Lind MV, Vazquez N, Yonemitsu C, Larnkjær A, et al. Breastmilk Lipids and Oligosaccharides Influence Branched Short‐Chain Fatty Acid Concentrations in Infants with Excessive Weight Gain. Mol. Nutr. Food Res. 2020; 64: 1900977.
68. Lagström H, Rautava S, Ollila H, Kaljonen A, Turta O, Mäkelä J, et al. Associations between human milk oligosaccharides and growth in infancy and early childhood, Am J Clin Nutr. 2020; 111: 769-78.
69. Larsson MW, Lind MV, Laursen RP, Yonemitsu C, Larnkjær A, Mølgaard C, et al. Human Milk Oligosaccharide Composition Is Associated With Excessive Weight Gain During Exclusive Breastfeeding-An Explorative Study. Front Pediatr. 2019; 7: 297.
70. Leong KSW, Derraik JGB, Hofman PL, Cutfield WS. Antibiotics, gut microbiome and obesity. Clin Endocrinol (Oxf). 2018; 88: 185-200.
71. Castaner O, Goday A, Park YM, Lee SH, Magkos F, Shiow STE, et al. The Gut Microbiome Profile in Obesity: A Systematic Review. Int J Endocrinol. 2018; 2018: 4095789.
72. Ho NT, Li F, Lee-Sarwar KA, Tun HM, Brown BP, Pannaraj PS, et al. Meta-analysis of effects of exclusive breastfeeding on infant gut microbiota across populations. Nat Commun. 2018; 9: 4169.
73. Riva A, Borgo F, Lassandro C, Verduci E, Morace G, Borghi E, et al. Pediatric obesity is associated with an altered gut microbiota and discordant shifts in Firmicutes populations. Environ Microbiol. 2017; 19: 95-105.
74. Stanislawski MA, Dabelea D, Wagner BD, Iszatt N, Dahl C, Sontag MK, et al. Gut Microbiota in the First 2 Years of Life and the Association with Body Mass Index at Age 12 in a Norwegian Birth Cohort. mBio. 2018; 9: e01751-18.
75. Million M, Lagier JC, Yahav D, Paul M. Gut bacterial microbiota and obesity. Clin Microbiol Infect. 2013; 19: 305-13.
76. Ridaura VK, Faith JJ, Rey FE, Cheng J, Duncan AE, Kau AL, et al. Gut microbiota from twins discordant for obesity modulate metabolism in mice. Science. 2013; 341: 1241214.
77. Charbonneau MR, O’Donnell D, Blanton LV, Totten SM, Davis JC, Barratt MJ, et al. Sialylated Milk Oligosaccharides Promote Microbiota-Dependent Growth in Models of Infant Undernutrition. Cell. 2016; 164: 859-71.
78. Tao N, De Peters EJ, German JB, Grimm R, Lebrilla CB. Variations in bovine milk oligosaccharides during early and middle lactation stages analyzed by high-performance liquid chromatography-chip/mass spectrometry. J Dairy Sci. 2009; 92: 2991-3001.
79. Coulet M, Phothirath P, Allais L, Schilter B. Pre-clinical safety evaluation of the synthetic human milk, nature-identical, oligosaccharide 2’-O-Fucosyllactose (2’FL). Regul Toxicol Pharmacol. 2014; 68: 59-69.
80. Coulet M, Phothirath P, Constable A, Marsden E, Schilter B. Pre-clinical safety assessment of the synthetic human milk, nature-identical, oligosaccharide Lacto-N-neotetraose (LNnT). Food Chem Toxicol. 2013; 62: 528-37.
81. Puccio G, Alliet P, Cajozzo C, Janssens E, Corsello G, Sprenger N, et al. Effects of Infant Formula with Human Milk Oligosaccharides on Growth and Morbidity: A Randomized Multicenter Trial. J Pediatr Gastroenterol Nutr. 2017; 64: 624-31.




 Anemia. Classification and diagnosis
Anemia. Classification and diagnosis 