 |
| Temas de FC |
S. Fernández-Plaza, S. Viver Gómez
Centro de Salud Galapagar, Galapagar. Madrid
| Resumen
La anemia por déficit de hierro es la causa más frecuente de anemia en el mundo, es una anemia microcítica e hipocrómica que es necesario diferenciar de otras causas de microcitosis, como la talasemia o la anemia de los trastornos crónicos. Puede tener consecuencias sobre el rendimiento intelectual y neurodesarrollo del niño, principalmente a edades precoces, por lo que aplicar programas de detección precoz de la ferropenia es objeto de controversia. El tratamiento de elección de la anemia por déficit de hierro es oral, con sales ferrosas y, solo en casos seleccionados, debe realizarse de forma endovenosa. La lactancia materna y las recomendaciones dietéticas, juegan un papel importante en la prevención de la ferropenia y consecuentemente de la anemia por déficit de hierro, principalmente durante los primeros años de vida y en determinados grupos de riesgo. |
| Abstract
Iron deficiency anemia is the most common cause of anemia in the world, and it is a microcytic and hypochromic anemia that must be differentiated from other causes of microcytosis such as thalassemia or anemia of chronic disorders. It can have consequences on the intellectual performance and neurodevelopment of the child, especially at an early age, and hence, implementing early detection programs for iron deficiency remains subject of controversy. The treatment of choice for this deficiency anemia is oral iron, in the form of ferrous salts, and only in selected cases should it be performed intravenously. Breastfeeding and dietary recommendations play an important role in the prevention of iron deficiency and consequently iron deficiency anemia, mainly during the first years of life and in specific risk groups. |
Palabras clave: Anemia por déficit de hierro; Ferritina; Ferropenia; Microcitosis.
Key words: Iron deficiency anemia (IDA); Serum ferritin; Iron deficiency; Microcytic anemia.
Pediatr Integral 2021; XXV (5): 222 –232
Anemia ferropénica
Introducción
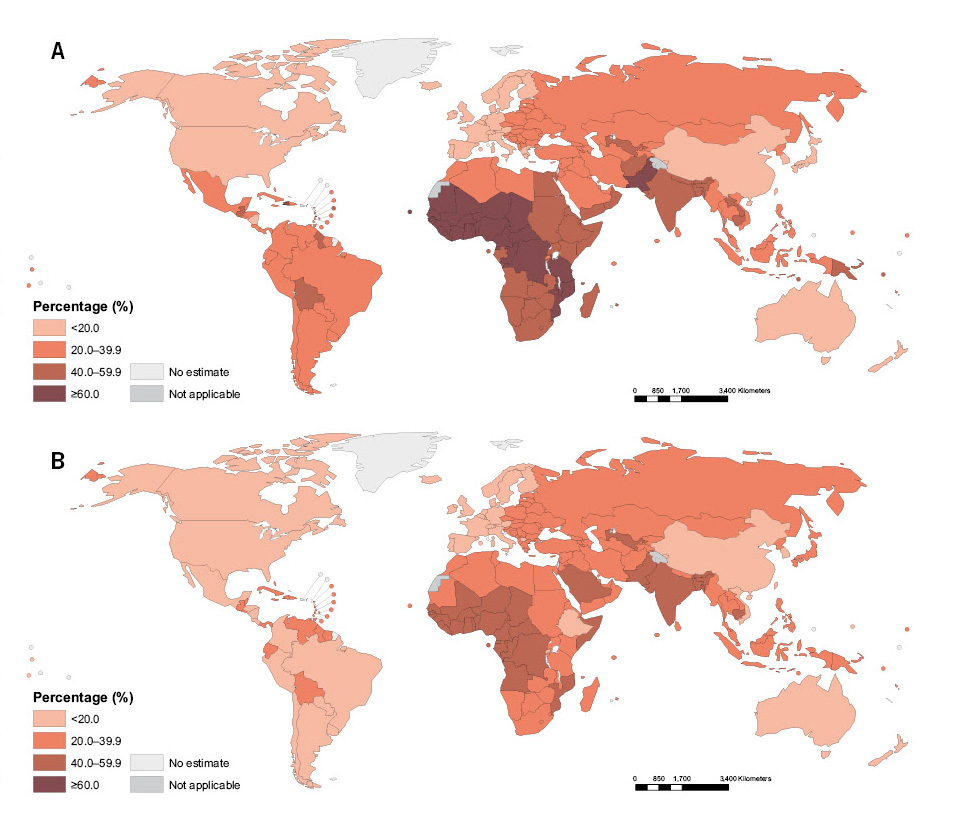
El déficit de hierro es el trastorno nutricional más frecuente a nivel mundial y la principal causa de anemia microcítica en la edad pediátrica, la prevalencia global de la anemia en 2010 es de un 32,9%. Afecta al 33% de las mujeres no embarazadas, al 40% de las embarazadas y al 42% de los niños (Fig. 1)(1).
Figura 1. A. Estimación global de prevalencia de anemia en lactantes y niños de 6-59 meses. B. Prevalencia de anemia en mujeres embarazadas de 5-49 años en 2011.
Fuente: https://www.paho.org/
En este artículo, diferenciamos la ferropenia de la anemia por déficit de hierro y revisamos las características de la anemia ferropénica, las consecuencias que esta presenta para la salud de la población infantil y, finalmente, cómo abordar su diagnóstico y tratamiento. También analizamos la necesidad de hacer programas de cribado de la ferropenia y las recomendaciones nutricionales que pueden contribuir a su desarrollo o prevención.
Conceptos
Las situaciones progresivas que se producen como consecuencia del déficit de hierro son: ferropenia latente, ferropenia sin anemia y, finalmente, anemia ferropénica.
Cuando hablamos de ferropenia hacemos referencia a la disminución del hierro corporal por debajo de los niveles necesarios para mantener una homeostasis normal; como hemos mencionado anteriormente, es el déficit nutricional más extendido en el mundo, principalmente en medios más desfavorecidos. El reto fundamental a la hora de diagnosticar la ferropenia consiste en determinar qué parámetro es el más fiable para reflejar el estado real del hierro en el organismo. El descenso de la hemoglobina es un indicador tardío del déficit de hierro, ya que se produce en fases avanzadas de la ferropenia, por lo que su uso no está recomendado. Por el contrario, la ferritina es uno de los parámetros más usados, es muy específico, ya que refleja el estado de las reservas de hierro en el organismo y nos permite realizar un diagnóstico precoz de ferropenia(1,2). Una ferritina en suero menor de 10-15 ng/ml posee una especificidad del 99% para el diagnóstico de ferropenia. En la población pediátrica, el punto de corte recomendado es de 15 mcg/L(1,3); en los últimos años, algunos autores sugieren que en niños entre 1 y 3 años, valores de 18 mcg/L se correlacionan mejor con cifras de Hb clínicamente relevantes a estas edades(4).
Si el aporte de hierro sigue siendo insuficiente, lo que inicialmente constituye una ferropenia latente, evoluciona a fases más avanzadas con repercusión sobre la eritropoyesis, como la ferropenia sin anemia en la que se produce un descenso del contenido de hemoglobina en los reticulocitos y, finalmente, la anemia ferropénica, que representa la fase más tardía de la depleción de las reservas de hierro del organismo y se define como una reducción de la cifra de hemoglobina o del número de eritrocitos considerados normales para la edad o el sexo (Tabla I)(5).
Los parámetros de la serie roja se modifican con la edad y por ello, es necesario usar los valores de referencia para cada edad cuando diagnosticamos una anemia.
Epidemiología
El déficit de hierro es la carencia nutricional más frecuente y la principal causa de anemia en la infancia, con un pico de prevalencia en menores de 3 años. Afecta principalmente a poblaciones y clases sociales más desfavorecidas.
El déficit de hierro es el déficit nutricional más frecuente a nivel mundial y constituye un importante problema de salud pública, principalmente en los países más desfavorecidos, pero también en nuestro ámbito. Afecta hasta un 42% de la población mundial con dos picos de prevalencia, el primero entre el primer y tercer año de vida, y el segundo durante la adolescencia. En países desarrollados como el nuestro o Estados Unidos, aproximadamente un 15% de los lactantes menores de dos años tienen una ferropenia, la prevalencia de la anemia por déficit de hierro en estas edades se estima del 3%(6). En los últimos años, el porcentaje global de niños pequeños con ferropenia se ha reducido discretamente, pero se ha descrito un incremento en grupos de población más desfavorecidos, como los inmigrantes o determinados grupos étnicos (afroamericanos)(7).
Las adolescentes también constituyen un grupo con mayor riesgo de desarrollar una ferropenia. Se estima que en nuestro medio, un 11% de las niñas durante la pubertad presentan una ferropenia y hasta un 5% una anemia franca(7,8). En la mayoría de los casos, la causa son las pérdidas menstruales abundantes, que muchas veces no son reconocidas por las pacientes y que conllevan anemias graves que pueden necesitar ingreso.
A nivel mundial, existen grandes diferencias de prevalencia como se ve en la figura 1.
Causas /Factores de riesgo
Factores relacionados con la dieta integran la principal causa de anemia por déficit de hierro en la infancia. Las pérdidas sanguíneas durante la menstruación constituyen el motivo más frecuente en niñas adolescentes.
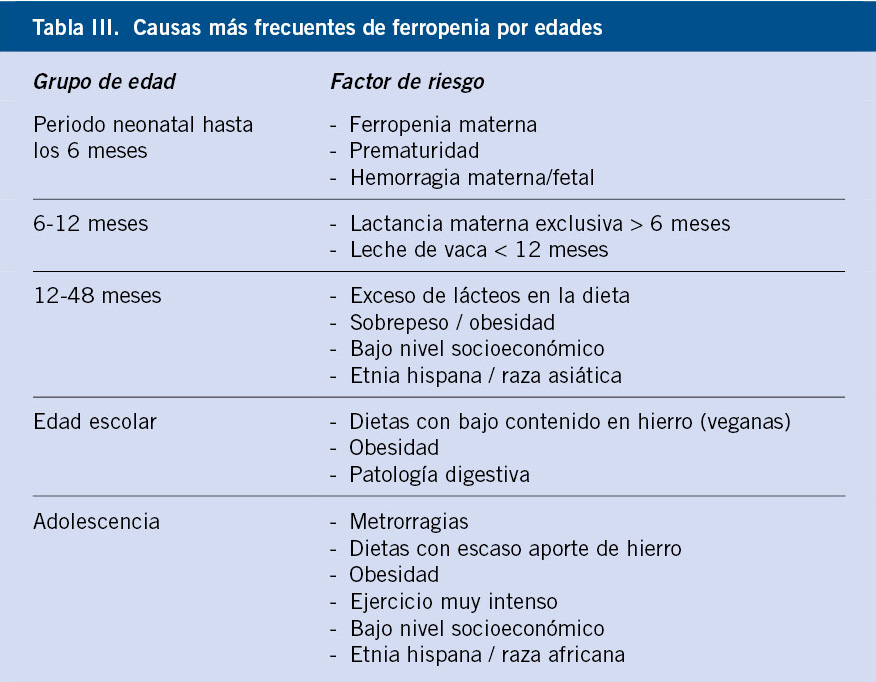
Las causas de ferropenia o anemia por déficit de hierro se pueden clasificar según el mecanismo de producción en tres grupos: aporte insuficiente, aumento de pérdidas, disminución de la absorción intestinal (Tabla II).
En función de la edad, podemos encontrarnos con que algunos de estos mecanismos de producción son más frecuentes (Tabla III).
En nuestro medio, la ferropenia al nacimiento es poco frecuente, debido a la transfusión placentaria de hierro procedente de la madre al feto durante el tercer trimestre de gestación. Las reservas generadas durante este periodo, cubren las necesidades del lactante durante los seis primeros meses de vida. Algunas situaciones afectan tanto a la madre como al feto (como hemorragias maternas o fetales, embarazos gemelares…) y pueden suponer un riesgo de anemia por déficit de hierro durante estos primeros meses de vida. Aunque se ha comprobado que niveles de hierro bajo maternos durante la gestación disminuyen la transferencia de este durante el final del embarazo, en este momento, no está establecido el beneficio de fortificar la dieta con hierro en las mujeres gestantes(6).
La prematuridad y el bajo peso al nacimiento asocian ferropenia con frecuencia, debido a varios factores: por un lado, por la disminución de la transferencia materna de hierro placentaria durante el último trimestre; y por otro, las tasas de crecimiento aumentadas en estos recién nacidos. Existe una correlación directa entre el grado de prematuridad y el riesgo de anemia, si bien en recién nacidos a término, la ferropenia se produce a partir de los 6 meses de vida, y la anemia asociada a la prematuridad se manifiesta a los 2-3 meses del nacimiento. En la actualidad, se recomienda pautar suplementos de hierro en los recién nacidos pretérmino(9,10).
Durante el periodo de lactancia y la primera infancia, la dieta constituye la principal causa de ferropenia. El bajo nivel socioeconómico y la inmigración, también son factores de riesgo que hay que tener en cuenta durante este periodo de la vida del niño.
En los primeros 12 meses de vida, son causas frecuentes de déficit de hierro: la lactancia materna exclusiva a partir de los 6 meses, sin introducir otros alimentos que aportan este mineral en cantidad suficiente; el consumo de preparados lácteos con escasa suplementación de hierro; o la introducción precoz de leche de vaca. Esta última, se ha asociado a un incremento de micro sangrado intestinal en los lactantes, junto con un menor aporte de hierro por ml y una menor biodisponibilidad de la leche de vaca (un 10% en comparación con el 50% de la leche materna)(6).
El exceso de leche de vaca en la dieta (más de 600 ml), por tanto, es un parámetro que puede ayudarnos a sospechar una anemia por déficit de hierro en los niños pequeños, por un lado, su ya mencionado bajo contenido en hierro y su escasa absorción, pero también el hecho de llevar asociado un menor consumo de otros alimentos ricos en este mineral, son factores que contribuyen a la ferropenia. En 2006, Sutcliffe y cols., encontraron una asociación entre la depleción de hierro y el uso prolongado del biberón en niños durante el segundo y tercer año de vida, en comparación con el uso del vaso en estas edades. El riesgo relativo de ferropenia descrito en el trabajo de Sutcliffe fue del 2,5 (IC 2,46-2,53) y parece relacionarse con un mayor consumo de lácteos en los niños que se alimentaban con biberón, frente a los que usan vaso(11).
Durante la edad escolar, la prevalencia del déficit de hierro es baja, siendo las pérdidas de sangre su causa principal, las epistaxis o el sangrado gastrointestinal secundario a la enfermedad inflamatoria intestinal o las infecciones por parásitos intestinales, o los sangrados por el uso crónico de antiinflamatorios no esteroideos, deben valorarse como posible origen de la anemia en estas edades. Las pérdidas sanguíneas durante la menstruación constituyen el motivo más frecuente de anemia por déficit de hierro en niñas adolescentes. Las tasas de crecimiento rápido y las carencias nutricionales que se producen en este periodo, contribuyen a esta situación.
Como causas menos frecuentes de anemia ferropénica, se encuentran: los síndromes malabsortivos que afectan al duodeno, el más común la enfermedad celíaca, pero también la enfermedad de Crohn, las infecciones por Giardia o las resecciones proximales del intestino delgado que provocan el síndrome del intestino corto. Los niños que reciben tratamiento con inhibidores de la bomba de protones o antagonistas de los receptores H2 también pueden tener afectada la absorción de hierro por la dificultad de transformar el hierro férrico a ferroso.
Finalmente, se ha descrito una “anemia ferropénica refractaria a tratamiento con hierro” producida por mutaciones en el gen TMPRSS6, que codifica para la matriptasa 2, una serín-proteasa transmembrana que juega un papel esencial en la inhibición de la hepcidina, el regulador clave de la homeostasis del hierro. Se hereda por un mecanismo autosómico recesivo y los pacientes presentan niveles normales o elevados de hepcidina, a pesar de la ferropenia(6).
Fisiopatología
La mayor parte del hierro del organismo es reutilizado, las cantidades que son necesarias reponer diariamente se obtienen a expensas de la absorción del hierro de la dieta en el duodeno proximal, por un mecanismo regulado por hepcidina.
El hierro es un nutriente fundamental para todos los organismos vivos, constituye el 0,005% del peso corporal en el ser humano, lo que se corresponde con 3 y 4 g en mujeres y hombres, respectivamente; y solo 300 mg en recién nacidos a término. La distribución de este hierro en el organismo es la siguiente. El 75% se encuentra unido a proteínas del grupo hemo, principalmente la hemoglobina (aproximadamente 2,5 g del total), pero también la mioglobina (400 mg), encargadas del transporte de oxígeno. Solo un 3% del total del hierro forma parte de citocromos, peroxidasas y catalasas, implicadas en reacciones enzimáticas fundamentales para el funcionamiento celular. El hierro unido a transferrina plasmática es de 3 a 7 mg, constituye solo una parte del hierro unido a transferrina, ya que esta se encuentra también asociado a la transferrina presente en los líquidos intersticiales. Finalmente, el hierro restante, se encuentra principalmente almacenado en forma de ferritina o hemosiderina, la mayoría en el hígado, el bazo y la médula ósea. En el caso del varón adulto, estas reservas alcanzan 1 g y en la mujer aproximadamente 600 mg(3,6).
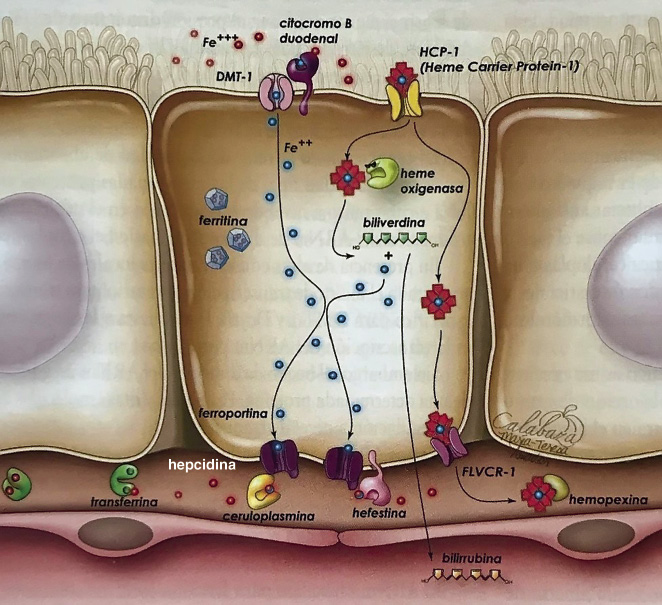
El metabolismo del hierro se mantiene en un equilibrio dinámico en el que la mayor parte del hierro es reutilizado, y solamente 1 o 2 mg de las necesidades diarias de hierro del adulto provienen de la dieta. Sin embargo, durante la infancia hasta un 30% de los requerimientos deben ser aportados exógenamente, debido al aumento de masa muscular y crecimiento. Es un nutriente difícil de absorber y las cantidades que se reponen diariamente lo hacen exclusivamente a expensas de la absorción del hierro de la dieta en el duodeno proximal, por un mecanismo regulado por hepcidina. El hierro ferroso (Fe 2+) que llega a la luz duodenal, penetra en el enterocito a través del transportador de metales divalentes DMT1, previamente en la luz intestinal, el citocromo B duodenal (DcytB) ha transformado también el hierro férrico a ferroso para permitir su paso por DMT 1 (Fig. 2).
Figura 2. Metabolismo del hierro en el enterocito. Modificado de: Baragaño González M. Alteraciones del metabolismo del hierro y las anemias sideroblásticas. En: Madero L, Lassaletta A, Sevilla J. Hematología y Oncología. Madrid: Ergon S.A. 3ª ed. 2015; 9: 97. Joaquín Carrillo Farga. Elaborado por María Teresa Amador.
Una vez en el interior del enterocito, el hierro debe salir de la célula hacia el líquido intersticial y lo hará por la zona basal de la célula, a través de una proteína integral de membrana, la ferroportina, que transporta hierro divalente (Fe2+) al plasma. Este último paso está regulado por la hepcidina, que actúa bloqueando la acción de la ferroportina y, por tanto, reduce la absorción del hierro procedente de la dieta(3). La expresión de la hepcidina depende de las reservas de hierro, la biodisponibilidad del hierro contenido en la dieta, la presencia de procesos inflamatorios o del índice de eritropoyesis. En situación de depleción de las reservas, anemia o hipoxemia, se produce un descenso de la hepcidina para permitir el transporte por la ferroportina y así aumentar la entrada de hierro. Por el contrario, en situaciones de normalidad, se eleva la hepcidina y, por lo tanto, se produce menor absorción de hierro. En los procesos inflamatorios e infecciosos, también se ha comprobado una producción aumentada de la hepcidina, reduciendo así la disponibilidad de hierro para los patógenos(6).
El hierro ferroso que permanece atrapado en el interior de la célula sin poder salir, se agrupa en moléculas de ferritina que constituye la principal forma de almacenamiento del hierro.
En el plasma, el hierro no puede ser transportado por la transferrina, a menos que se encuentre en estado férrico. La hefestina es una proteína anclada en la membrana basal del enterocito junto a la ferroportina que transforma el hierro Fe2+ en hierro férrico (3+), para que pueda unirse a la transferrina y ser distribuido por el organismo(3).
El hierro hémico en forma ferrosa, está presente en los alimentos de origen animal, es soluble y se absorbe fácilmente en el intestino (hasta un 30%), independientemente del pH gástrico. Mientras el hierro no hémico, en forma férrica, presente en los vegetales, solo tiene una biodisponibilidad del 10% y para su absorción necesita ser reducido a forma ferrosa. Además, el hierro no hémico interacciona con otros componentes presentes en los alimentos y forma complejos insolubles en la luz intestinal que disminuyen su absorción. Existen sustancias como las vitaminas A y C, el ácido cítrico, las proteínas y el ácido láctico, que favorecen la absorción de hierro; mientras por el contrario, el calcio, la fibra rica en fosfatos, los fitatos y los taninos reducen su absorción (Fig. 3).
Figura 3. Factores de influyen en la absorción de hierro.
También es necesario recordar, que en situaciones de deficiencia grave del nutriente, también se verá comprometida la síntesis de aquellas proteínas en las que los grupos hemo están presentes, como la mioglobina.
Manifestaciones clínicas
Aunque en la mayoría de las ocasiones la anemia ferropénica suele cursar de forma silente, hay que tener en cuenta sus efectos sobre el neurodesarrollo, principalmente a edades precoces.
La ferropenia con o sin anemia suele ser una condición clínicamente silente. El cuadro clínico del síndrome anémico es menos frecuente e incluye manifestaciones mucocutáneas como la palidez, debida al descenso de la hemoglobina, y la vasoconstricción que la acompaña. Los lugares idóneos para explorarla son: la conjuntiva ocular, el velo del paladar y la región subungueal. Determinadas alteraciones de mucosas y faneras (coiloniquia, fragilidad del cabello y glositis…) deben hacernos sospechar procesos de larga evolución. Los síntomas cardiocirculatorios como: taquicardia, palpitaciones, taquipnea o auscultación de soplos, son menos frecuentes y su presencia depende de la intensidad de la anemia, y de la rapidez con la que se instaura. En la mayoría de las ocasiones son bien tolerados por el niño, cuando el déficit de hierro se produce de forma progresiva. Los síntomas derivados de la hipoxia tisular como: cefalea, anorexia, irritabilidad, fatiga o descenso de la actividad, son poco frecuentes y suelen reflejar anemias por déficit de hierro graves o de instauración más brusca.
Pica y pagofagia. Pueden ser la manifestación inicial de la ferropenia y pueden producirse sin anemia. Consiste en la apetencia por sustancias que no son alimentos y sin valor nutricional como: tiza, barro, cal, papel, jabón… en el caso de la pica, y del hielo en el caso de la pagofagia, esta última está descrita con mayor frecuencia en adolescentes. Se desconoce el mecanismo por el que se producen ambos fenómenos y su asociación con la ferropenia, pero responden bien al tratamiento con hierro. Aunque la frecuencia real de estos síntomas es desconocida, según datos recogidos por Powers JM y cols. (2017), un 49% de los padres referían la presencia de este síntoma tras el diagnóstico de anemia por déficit de hierro en sus hijos(6).
Alteración de la función cognitiva. Diferentes estudios observacionales han descrito la posible asociación entre el déficit de hierro y la presencia de alteraciones en el desarrollo cognitivo. Se ha estimado que un descenso de 10 g/L en la hemoglobina reduce el coeficiente intelectual (CI) en 1,73 puntos(12). Low M y cols. en 2013, publican una revisión sistemática, con el fin de analizar la influencia de la ferropenia sobre el CI de la población infantil en edad escolar. De los estudios incluidos en el trabajo de Low M y cols., 31 se realizaron en poblaciones con nivel socioeconómico medio-bajo. Los autores concluyen que los suplementos de hierro en niños con anemia, mejoran parámetros hematológicos y no hematológicos, como el rendimiento intelectual; no obstante, no encuentran beneficios similares en niños con ferropenia sin anemia. Los autores también encuentran evidencia de beneficio sobre el desarrollo ponderoestatural(12).
Por otro lado, en el trabajo publicado en 2001 por Sheriff y cols., bajas concentraciones de hemoglobina (≥ de 9,5 g/L) en niños de 8 meses, se asocian con alteraciones en el desarrollo psicomotor a los 18 meses de edad. Los autores consideran que el momento óptimo para hacer un cribado de anemia en la primera infancia es antes de los 8 meses, ya que así se asegura el beneficio del tratamiento sobre el neurodesarrollo del niño(13). Finalmente, Algarín C y cols., relacionan en su publicación de 2013, la anemia por déficit de hierro con tiempos de respuesta motora más lentos y peor control inhibitorio en niños, a los ocho o nueve años de recibir tratamiento con hierro por la anemia. Según los autores, estos hallazgos parecen relacionados con el efecto de la anemia ferropénica sobre la mielinización y los circuitos dopaminérgicos(14).
Síndrome de piernas inquietas (SPI). Diferentes autores han descrito la asociación entre el déficit de hierro y el síndrome de las piernas inquietas. El hierro participa en la producción de dopamina, densidad de las sinapsis y en la síntesis de mielina, lo que justificaría su prescripción para mejorar los síntomas de esta enfermedad. Sin embargo, no hay evidencia clara sobre la eficacia del tratamiento con hierro en estos pacientes. Existen escasos estudios randomizados en Pediatría que demuestren su eficacia. Cuatro estudios pediátricos, muestran mejoría de la sintomatología tras el tratamiento con hierro en niños con SPI y ferritinas por debajo de 50 mcg/L(15,16).
Trombosis. Algunas publicaciones de casos sugieren la relación entre la anemia ferropénica y los accidentes cerebrovasculares. Maguire JL y cols., en el año 2007, concluyeron que niños previamente sanos con un infarto cerebral, tienen 10 veces más probabilidad de tener una anemia por déficit de hierro que un niño sano sin infarto cerebral. El trabajo sugiere que la anemia por déficit de hierro es un factor de riesgo significativo de infarto cerebral en niños sin otras patologías y que, por ello, su detección precoz debe ser una prioridad(17). Otros autores describen un riesgo 3,8 veces superior de trombosis en estos niños y encuentran una asociación significativa entre anemia, ferropenia y trombocitosis en los casos que estudian, pudiendo ser este el mecanismo implicado en esta complicación(17,18).
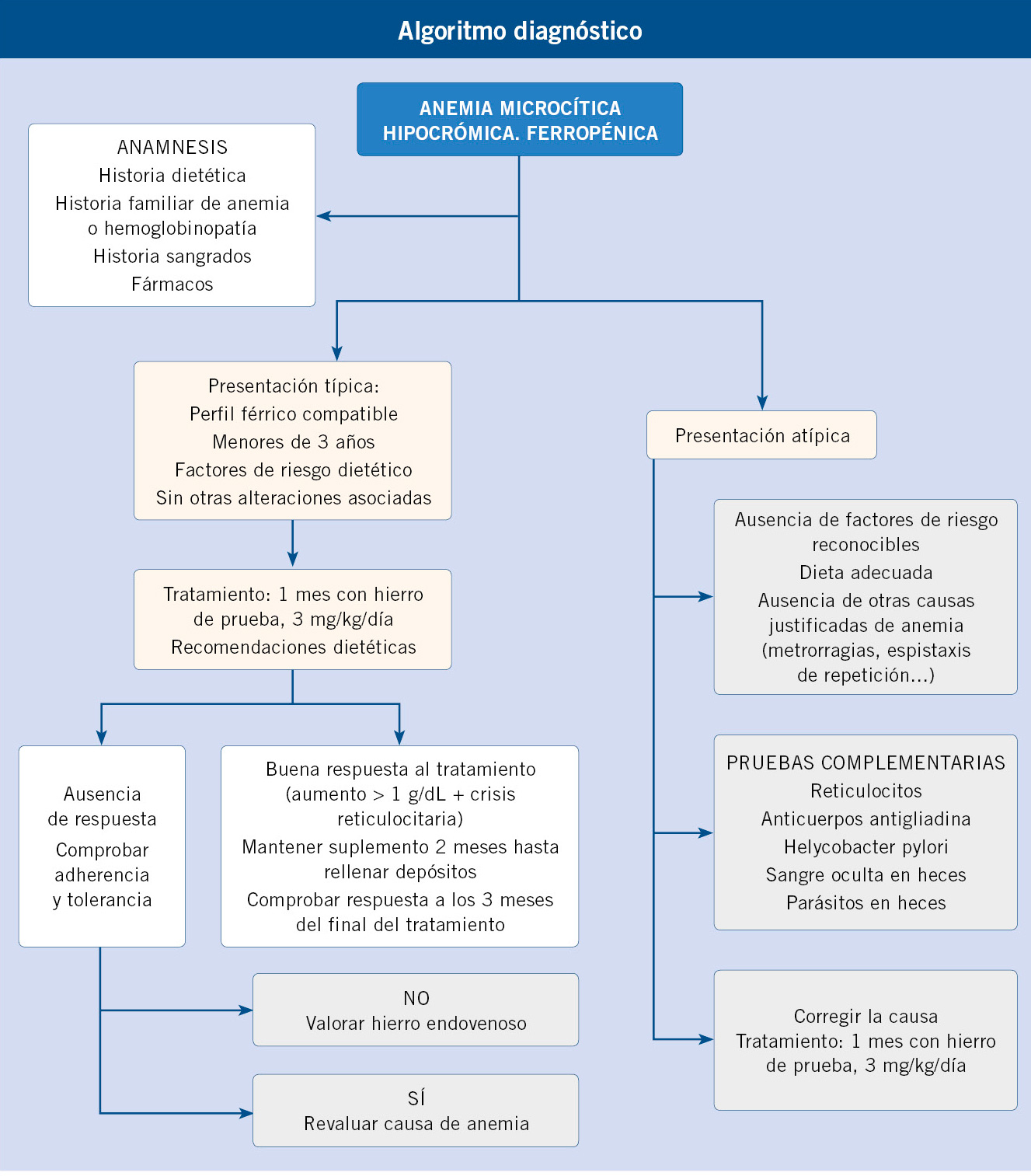
Diagnóstico
La anemia por déficit de hierro es una anemia microcítica, hipocrómica e hiporregenerativa. Las pruebas complementarias de elección para el diagnóstico son: hemograma (Hb, VCM, RDW) y perfil férrico (ferritina, índice de saturación de la transferrina y receptor soluble de la transferrina).
El déficit de hierro origina alteraciones analíticas de manera progresiva. Inicialmente, se produce un descenso de los depósitos en forma de ferritina, sin que tengan lugar modificaciones en el hematocrito ni en otros parámetros hematológicos. Tal y como hemos mencionado, podemos considerar que cifras de ferritina por debajo de 15 mcg/L reflejan una ferropenia; no obstante, no se debe olvidar que, una ferritina normal o aumentada no excluye un déficit de hierro, ya que la ferritina es un reactante de fase aguda y puede estar elevado en presencia de otras patologías coexistentes, tanto infecciosas como inflamatorias. Esto ocurre especialmente en la edad pediátrica, periodo en el que estos episodios, son habituales. En los últimos años, con el mejor conocimiento de la homeostasis del hierro, se han descrito nuevos parámetros que nos permiten valorar el estado del hierro en nuestro organismo con mayor precisión. El receptor soluble de la transferrina (RsTf) es un indicador eficaz para el diagnóstico de la ferropenia, ya que a diferencia de la ferritina, no se ve afectada por los procesos inflamatorios y es inversamente proporcional a la disponibilidad de hierro(6). Es decir, al producirse una depleción de los depósitos de hierro, aumenta la expresión de los “receptores de transferrina” en la membrana celular y, por consiguiente, la cantidad de RsTf circulante. Un índice del receptor soluble del receptor de la transferrina elevado nos indica una deficiencia de hierro. Su disponibilidad en todos los laboratorios es un limitante para la generalización de su uso.
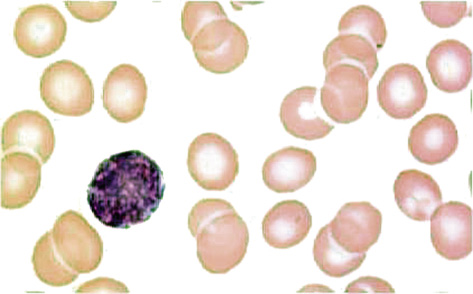
En una segunda fase, la carencia de hierro acaba afectando la eritropoyesis, se produce un descenso de la sideremia, de la saturación de la transferrina con hierro (ISTf) y la elevación de la transferrina. Por último, en una tercera fase, la carencia repercute sobre las cifras de Hb, que descienden por debajo de las de referencia para la edad. Los hallazgos del laboratorio sugestivos de anemia por déficit de hierro incluyen también la presencia de una hipocromía y microcitosis (disminución del tamaño de los hematíes, 2 desviaciones estándar por debajo del valor medio para su edad) (Fig. 4).
Figura 4. Microcitosis e hipocromía.
Como ya hemos indicado anteriormente, el volumen corpuscular medio, al igual que otros parámetros, se modifica con la edad. Entre los seis meses y los dos años de vida, nos encontramos los glóbulos rojos más pequeños, su tamaño aproximado es de 70 fl y aumenta de forma progresiva hasta la adolescencia. Finalmente, describiremos la anemia ferropénica como: microcítica, hipocrómica e hiporreactiva, ya que los reticulocitos están disminuidos.
Las causas más frecuentes de anemia microcítica incluyen: déficit de hierro, alfa o beta talasemias y anemia por procesos inflamatorios crónicos. Los indicadores que nos pueden ayudar a establecer un diagnóstico diferencial de las anemias con microcitosis se incluyen en la tabla IV.
El índice de Mentzer, descrito en 1973, resulta muy útil para diferenciar la anemia por deficiencia de hierro de la talasemia. Se obtiene del cociente entre el volumen corpuscular medio (VCM, en fL) y el recuento de glóbulos rojos (en millones por microlitro), si el resultado es inferior a 12, es más probable que la microcitosis sea atribuible a una talasemia. Si el resultado es mayor de 13, entonces debemos pensar en la anemia por déficit de hierro. En la deficiencia de hierro, la eritropoyesis está afectada y la médula no puede producir tantos glóbulos rojos y estos son pequeños (microcíticos); por lo que, tanto el recuento de glóbulos rojos como el VCM serán bajos y, como resultado, el índice será superior a 13. Por el contrario, en la talasemia, que es un trastorno de la síntesis de la globina, el número de glóbulos rojos producidos es normal, pero las células son más pequeñas, el recuento de glóbulos rojos es normal, pero el VCM es bajo; por lo que, en este caso, el índice será inferior a 12. En ocasiones, ambas patologías pueden coexistir y por ello es recomendable primero corregir la ferropenia para llegar después al diagnóstico de talasemia. La tabla IV hace referencia a los parámetros que os ayudan a realizar un diagnóstico diferencial entre las principales anemias microcíticas.
Otras causas menos frecuentes de anemia con VCM bajo son: la anemia sideroblástica, la anemia por déficit de cobre, la piropoiquilocitosis y la atransferrinemia congénita.
Finalmente, es necesario tener en cuenta que, ante unos hallazgos de laboratorio compatibles con microcitosis o anemia, la historia clínica es fundamental para identificar la causa subyacente de la ferropenia con o sin anemia.
Tratamiento de la anemia
El tratamiento de elección de la anemia ferropénica son las sales ferrosas por vía oral, durante, al menos, tres meses. Se recomienda realizar un control analítico al finalizar el tratamiento y tres meses después.
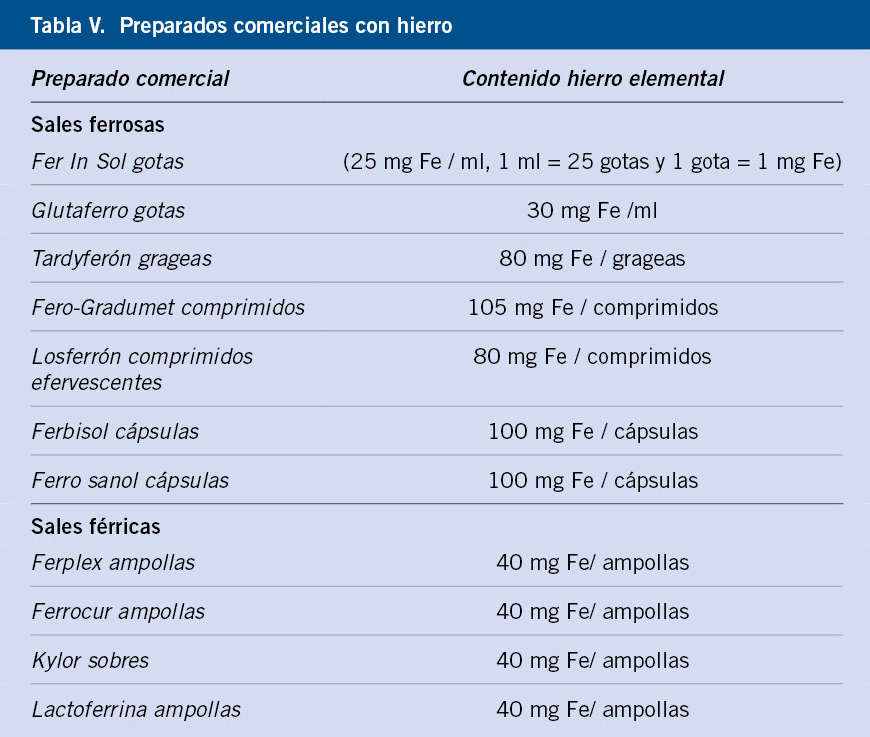
La vía oral es la indicada, de entrada, para corregir la anemia por déficit de hierro. Existen numerosos preparados orales de hierro en el mercado, aunque las sales ferrosas (sulfato, fumarato o gluconato ferroso) son las de elección por su mejor biodisponibilidad, ya que no requieren acidificar el medio para poder absorberse a nivel intestinal, habitualmente presentan peor sabor y tolerancia digestiva que los complejos polisacáridos que contienen hierro en estado férrico (Tabla V). Por esto último, en muchas ocasiones, se pautan estas últimas formulaciones.
En 2017, Powers JM y cols., publicaron los resultados de un ensayo clínico aleatorizado doble ciego, cuyo objetivo era determinar si las fórmulas polisacáridas eran igual o más eficaces que las sales ferrosas en el tratamiento de la anemia por déficit de hierro en lactantes y niños pequeños. El ensayo conocido como BESTIRON, concluye que, a igual duración del tratamiento, los niños que fueron tratados con hierro ferroso tuvieron un incremento de 1 g/dl más, que los que recibieron las formas férricas; por lo tanto, los autores concluyen que el segundo grupo requiere tratamientos más prolongados para reponer los depósitos(19).
En relación a la dosis que se considera más adecuada para tratar la ferropenia, existen pocos ensayos clínicos en Pediatría, comparando diferentes dosificaciones en el tratamiento de la anemia ferropénica. No obstante, el estudio BESTIRON muestra una excelente respuesta hematológica y buena tolerancia a dosis de 3 mg/kg de hierro elemental, una vez al día en niños entre 9 y 48 meses. En adolescentes, Powers y cols., recomiendan pautas de 65 mg de hierro elemental una vez al día(19). En casos de anemias graves, la dosis se puede aumentar hasta 6 mg/kg, monitorizando los efectos secundarios.
Los efectos secundarios del tratamiento incluyen: síntomas digestivos (estreñimiento, náuseas, diarrea, anorexia, heces oscuras…) y la pigmentación dental y gingival reversibles. Estos efectos adversos aunque habituales, se producen con menos frecuencia que en el adulto. Es importante no olvidar que el proteinsuccinilato contiene caseína y los compuestos con ferrimanitol contienen ovoalbúmina y están contraindicados en alérgicos a proteínas de la leche de vaca y huevo, respectivamente.
Los pacientes pediátricos en tratamiento con hierro oral pueden tener una Hb normal al mes del comienzo, siempre que se identifique y corrija la causa subyacente. Los pacientes con anemia moderada/grave presentan una crisis reticulocitaria a los 7-10 días del inicio y un incremento de la Hb de 2g/dl en las 4 primeras semanas del inicio.
En todo paciente con una anemia por déficit de hierro, es fundamental identificar y corregir la causa subyacente. En caso de no hacerlo, puede producirse una respuesta parcial o recurrencia de la ferropenia. Las principales causas de anemia refractaria al tratamiento con hierro son: falta de adherencia terapéutica, persistencia de la causa subyacente o error diagnóstico (Tabla VI).
En el seguimiento de la anemia por déficit de hierro, los expertos recomiendan hacer una determinación de la ferritina al final del tratamiento y a los tres meses de finalizado este, con el fin de asegurar que los depósitos son adecuados, evitando así futuras recaídas.
Solamente, en ocasiones puntuales, es necesario recurrir a la administración de hierro endovenoso. Su uso, se aprobó por primera vez por la Food and Drug Administration (FDA) en Pediatría, en la insuficiencia renal crónica. Las indicaciones más frecuentes de esta vía de administración son: el fracaso terapéutico, la intolerancia digestiva o la asociación de patologías que contraindiquen la vía digestiva. La dosis se calcula mediante la fórmula de Ganzoni (Fig. 5), que estima la cantidad de hierro deficitario de cada paciente de forma individualizada, dependiendo del peso, la cifra de hemoglobina y de la hemoglobina deseada(6).
Figura 5. Fórmula de Ganzoni.
Los efectos secundarios locales del hierro endovenoso incluyen alteraciones de la pigmentación de la piel o linfangitis en los casos de extravasación, por lo que hay que ser especialmente precavido para que la medicación se administre intravenosa y no subcutánea. Los efectos sistémicos incluyen: náuseas, dolor abdominal, fiebre y mialgias, o reacciones de hipersensibilidad. La probabilidad de estos efectos adversos se reduce con un ritmo de infusión lento, ya que la mayoría se producen de forma similar al síndrome del hombre rojo relacionado con la vancomicina. Raramente, puede producir reacciones anafilácticas, por lo que es recomendable que su administración se realice en un medio hospitalario(6). Existen diversos preparados de hierro intravenoso de los cuales el hierro sacarosa (Venofer®) es el más empleado actualmente, con él ha disminuido de forma considerable la incidencia de efectos secundarios que se observaban con el hierro dextrano de bajo peso molecular, dextriferón (Ferinject®), principalmente las reacciones anafilácticas. El pico de reticulocitos se consigue a los 3-4 días de la infusión y se suele observar una respuesta en la cifra de hemoglobina transcurrida una semana.
La indicación de realizar una transfusión de hematíes, dependerá del contexto clínico del paciente y deberá de valorarse en función de su estabilidad.
Recomendaciones dietéticas
Una dieta adecuada con alimentos ricos en hierro, juega un papel fundamental en la prevención de la ferropenia y la anemia ferropénica. Las recomendaciones dietéticas deben adaptarse a la edad del niño.
Una de las principales recomendaciones orientadas a prevenir la anemia por déficit de hierro durante los primeros meses de vida, es promover la lactancia materna exclusiva hasta los 6 meses, frente al uso de preparados lácteos. En mayores de 12 meses, se recomienda limitar el consumo de lácteos a 600 ml al día.
La dieta debe ser equilibrada, sin excluir ningún alimento, que contenga, al menos, tres raciones al día de alimentos que contengan hierro. Las fuentes de alimentos con mayor biodisponibilidad de hierro incluyen: carnes rojas, cereales fortificados, yema de huevo y frutas con vitamina C. El hierro hemo contenido en fuentes animales tiene mejor absorción que el hierro no hemo de fuentes vegetales (el mito de las espinacas). En contraposición, los tanatos (contenidos en el té), los alimentos con salvado o ricos en fosfatos, oxalatos y fitatos (fibra vegetal, semillas o granos) inhiben su absorción, por lo que debe limitarse su consumo.
Recomendaciones de cribado
En España, la recomendación de realizar cribado de anemia por déficit de hierro, se limita a grupos de población con factores de riesgo.
Existen discrepancias sobre la necesidad de hacer cribado universal de anemia ferropénica a la población infantil menor de 24 meses. La Academia Americana de Pediatría recomienda llevar a cabo una determinación de rutina en este grupo de edad, basándose en los efectos negativos que la anemia por déficit de hierro puede tener sobre el desarrollo cognitivo(20). No obstante, otras entidades como la United States Preventive Services Task Force, las guías de práctica clínica de Canadá y Reino Unido, y el grupo Previnfad de la Asociación Española de Pediatría de Atención Primaria, no recomiendan realizar análisis de rutina, basándose en la ausencia de evidencia clara de los beneficios de esta medida(6). Sin embargo, las diferentes sociedades científicas antes mencionadas, sí recomiendan estudiar aquellos pacientes con factores de riesgo como:
• Factores de riesgo perinatales, como: prematuridad (principalmente en recién nacidos por debajo de los 1.500 g), bajo peso al nacimiento, gestaciones múltiples, ferropenia materna grave durante la gestación, hemorragias uteroplacentarias o neonatales, o múltiples extracciones sanguíneas. En los lactantes prematuros, se recomienda comenzar con los suplementos de hierro a las dos semanas de vida (2-4 mg/kg de hierro elemental diariamente), manteniendo la dosis de, al menos, 2 mg/kg durante el primer año de vida.
• Hasta los 12 meses, lactancia materna exclusiva; por encima de los 6 meses, introducción de leche de vaca antes de los 12 meses, escaso consumo de alimentos ricos en hierro o bajo nivel socioeconómico.
• Mayores de 12 meses con dietas restrictivas, malnutrición, obesidad (dietas inadecuadas con exceso de carbohidratos y grasas), elevado consumo de lácteos por encima de 700 ml/día y niños con enfermedades que puedan asociar ferropenia.
Función del pediatra de atención primaria
Una de las principales tareas que debe desempeñar el pediatra de atención primaria en la consulta, es la prevención y promoción de la salud. Por ello, conocer y actuar sobre los factores de riesgo derivados de la alimentación asociados a la ferropenia durante las etapas iniciales de la vida, constituye una función preferente del pediatra. Proporcionar pautas adecuadas de alimentación, reducirá la incidencia de anemia ferropénica en la población infantil.
Por otro lado, el diagnostico diferencial y etiológico de la ferropenia/anemia ferropénica junto con su tratamiento, son procesos que se realizan casi exclusivamente en atención primaria por lo que el pediatra debe conocerlos, identificando aquellas situaciones que requieran una derivación a atención especializada.
Finalmente, no podemos olvidar la importancia del seguimiento una vez finalizado el tratamiento.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de las autoras.
1.*** World Health Organization. WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. Disponible en: www.who.int/es/news/item/20-04-2020-who-guidance-helps-detect-iron-deficiency-and-protect-brain-development (acceso en marzo de 2021)
2.** Oatley H, Borkhoff CM, Chen S, Macarthur C, Persaud N, Birken CS, et al. Screening for Iron Deficiency in Early Childhood Using Serum Ferritin in the Primary Care Setting. Pediatrics. 2018; 142: e20182095.
3.*** Baragaño González M. Alteraciones del metabolismo del hierro y las anemias sideroblásticas. En: Madero L, Lassaletta A, Sevilla J. Hematología y Oncología. Madrid: Ergon S.A. 3ª ed. 2015; 9: 95-112.
4.** Abdullah K, Birken CS, Maguire JL, Fehlings D, Hanley AJ, Thorpe KE, et al. Re-Evaluation of Serum Ferritin Cut-Off Values for the Diagnosis of Iron Deficiency in Children Aged 12-36 Months. J Pediatr. 2017; 188: 287-90.
5.** Hernández Merino A. Anemias en la infancia y la adolescencia. Clasificación y diagnóstico. Pediatr Integral. 2012; 16: 357-65.
6.*** Powers JM, Buchanan GR. Disorders of Iron Metabolism: New Diagnostic and Treatment Approaches to Iron Deficiency. Hematol Oncol Clin North Am. 2019; 33: 393-408.
7. Gupta PM, Hamner HC, Suchdev PS, Flores-Ayala R, Mei Z. Iron status of toddlers, nonpregnant females, and pregnant females in the United States. Am J Clin Nutr. 2017; 106: 1640S-6S.
8. Gupta PM, Perrine CG, Mei Z, Scanlon KS. Iron, Anemia, and Iron Deficiency Anemia among Young Children in the United States. Nutrients. 20160; 8: E330.
9.** García Reymundo M, Hurtado Suazo JA, Calvo Aguilar MJ, Soriano Faura FJ, Ginovart Galiana G, Martín Peinador Y, et al. Recomendaciones de seguimiento del prematuro tardío (Follow-up recommendations for the late preterm infant). An Pediatr (Barc). 2019; 90: 318. e1-e8.
10. Sánchez Ruiz-Cabello FJ y grupo previnfad/PAPPS. Prevención primaria y cribado de ferropenia en lactantes. Previnfad Ferropenia. 2011.
11. Sutcliffe TL, Khambalia A, Westergard S, Jacobson S, Peer M, Parkin PC. Iron depletion is associated with daytime bottle-feeding in the second and third years of life. Arch Pediatr Adolesc Med. 2006; 160: 1114-20.
12.** Low M, Farrell A, Biggs BA, Pasricha SR. Effects of daily iron supplementation in primary-school-aged children: systematic review and meta- analysis of randomized controlled trials. CMAJ. 2013; 185: E791-802.
13.** Sherriff A, Emond A, Bell JC, Golding J, ALSPAC Study Team. Should infants be screened for anaemia? A prospective study investigating the relation between haemoglobin at 8, 12, and 18 months and development at 18 months. Arch Dis Child. 2001; 84: 480-5.
14. Algarín C, Nelson CA, Peirano P, Westerlund A, Reyes S, Lozoff B. Iron-deficiency anemia in infancy and poorer cognitive inhibitory control at age 10 years. Dev Med Child Neurol. 2013; 55: 453-8.
15.*** Allen RP, Picchietti DL, Auerbach M, Cho YW, Connor JR, Earley CJ, et al. Evidence-based and consensus clinical practice guidelines for the iron treatment of restless legs syndrome/Willis-Ekbom disease in adults and children: an IRLSSG task forcereport. Sleep Med. 2018; 41: 27-44.
16. Munzer T, Felt B. The Role of Iron in Pediatric Restless Legs Syndrome and Periodic Limb Movements in Sleep. Semin Neurol. 2017; 37: 439-45.
17.** Maguire JL, deVeber G, Parkin PC. Association between iron-deficiency anemia and stroke in young children. Pediatrics. 2007; 120: 1053-7.
18.** Azab SF, Abdelsalam SM, Saleh SH, Elbehedy RM, Lotfy SM, Esh AM, et al. Iron deficiency anemia as a risk factor for cerebrovascular events in early childhood: a case-control study. Ann Hematol. 2014; 93: 571-6.
19.*** Powers JM, Buchanan GR, Adix L, Zhang S, Gao A, McCavit TL. Effect of Low-Dose Ferrous Sulfate vs Iron Polysaccharide Complex on Hemoglobin Concentration in Young Children with Nutritional Iron-Deficiency Anemia: A Randomized ClinicalTrial. JAMA. 2017; 317: 2297-304.
20.** Baker RD, Greer FR; Committee on Nutrition American Academy of Pediatrics. Diagnosis and prevention of iron deficiency and iron-deficiency anemia in infants and young children (0-3 years of age). Pediatrics. 2010; 126: 1040-50.
Bibliografía recomendada
– Hernández Merino A. Anemias en la infancia y la adolescencia. Clasificación y diagnóstico. Pediatr Integral. 2012; 16: 357-65.
Muy buen artículo, que nos permite conocer mejor las anemias, su clasificación en función de sus características y, de esa forma, centrar su diagnóstico. Es un buen punto de partida.
– World Health Organization. WHO guideline on use of ferritin concentrations to assess iron status in individuals and populations. Disponible en: www.who.int/es/news/item/20-04-2020-who-guidance-helps-detect-iron-deficiency-and-protect-brain-development (acceso en marzo de 2021).
Guía actualizada sobre el papel de la ferritina en el cribado del déficit de hierro a nivel mundial. Los autores responden a preguntas sobre la ferropenia, basándose en la evidencia científica.
– Powers JM, Buchanan GR. Disorders of Iron Metabolism: New Diagnostic and Treatment Approaches to Iron Deficiency. Hematol Oncol Clin North Am. 2019; 33: 393-408.
Excelente artículo de revisión sobre la ferropenia y la anemia deficitaria en hierro con bibliografía actualizada.
– Baragaño González M. Alteraciones del metabolismo del hierro y las anemias sideroblásticas. En: Madero L, Lassaletta A, Sevilla J. Hematología y Oncología. Madrid: Ergon S.A. 3ª ed. 2015; 9: 95-112.
En este capítulo, se repasa de forma exhaustiva la fisiología del hierro, muy importante para entender el origen y comportamiento de la anemia ferropénica en sus diferentes fases.
| Caso clínico |
|
Anamnesis Niña de 13 años con cefalea intermitente de un mes de evolución. Presenta episodios intermitentes de cefalea biparietal continua, no irradiada, pulsátil, de 4-5 días de evolución. Durante los episodios presenta: decaimiento, postración, pérdida de apetito y malestar digestivo. Sin sono ni fotofobia. • Antecedentes familiares, natural de Colombia. Adoptada a los 13 meses, tiene una hermana gemela. • Antecedentes personales: reglas abundantes e irregulares, sin epistaxis de repetición ni otros sangrados. Sin dolor abdominal recurrente, curva ponderoestaural en el P50. Exploración física Saturación de O2: 98%; FC: 104 lpm; TA: 110/80 mm Hg. Buen estado general. Bien nutrida, hidratada y perfundida. Tez oscura (difícil de valorar, palidez en la exploración inicial), sin exantemas ni petequias. Sin signos de dificultad respiratoria. AC: tonos rítmicos, soplo sistólico paraesternal izquierdo de características funcionales. AP: normal. Exploración neurológica sin alteraciones significativas. Pruebas complementarias Hemograma: hematíes: 4,65 x106/mm³; hemoglobina: 7,34 g/dl; hematocrito: 26,4%; VCM: 61,7 fL; HCM: 15,8 pg; RDW: 35%. Leucocitos: 5,91 x 10³/mm³ con fórmula normal; plaquetas: 319 x 10³/mm³. Bioquímica sanguínea: normal (LDH y bilirrubina normal). Estudio del metabolismo del hierro: hierro: 11 µg/dl; ferritina: 2 ng/ml; transferrina: 379 mg/dl; índice saturación transferrina: 2,4% 15 45. Capacidad total fijación hierro: 672 µg/dl. Diagnóstico Anemia microcítica hipocrómica, compatible con anemia por déficit de hierro por exceso de pérdidas. Evolución clínica • Se inicia tratamiento con hierro, con buena tolerancia. A los 20 días, presenta mejoría clínica, no presenta cefalea, menos cansancio y auscultación cardiaca normal. • Control analítico al mes: hematíes: 5,08 x 106/mm³; hemoglobina: 11,7 g/dl; hematocrito: 38,2%; VCM: 75,2 fL; HCM: 23 pg; RDW: 32,5%. Hierro: 126 µg/dl; ferritina: 35 ng/ml; transferrina: 315 mg/dl. Índice saturación transferrina: 28,6% 15 45. Capacidad total fijación hierro: 441 µg/dl.
|







 Anemia. Classification and diagnosis
Anemia. Classification and diagnosis