 |
| Temas de FC |
F. del Pino Troconis*, A. Torrelo Fernández**
*Médico Dermatólogo egresada del Hospital Universitario de Caracas. Venezuela. **Jefe de Servicio de Dermatología, Hospital Infantil del Niño Jesús de Madrid. España
| Resumen
La sarna es una infestación de la piel causada por Sarcoptes scabiei var.hominis, un ectoparásito presente en todo el mundo que afecta de 100 a 130 millones de personas al año. Se estima que la prevalencia promedio es del 5 al 10% en niños de países en desarrollo. La transmisión generalmente ocurre después del contacto cercano y prolongado de piel a piel. La sarna clásica se caracteriza por una erupción papular eritematosa y prurito intenso. Otras variantes clínicas incluyen: sarna costrosa, sarna nodular y sarna ampollar. La presencia del ácaro, los huevos o gránulos fecales en el examen microscópico de muestras tomadas de lesiones cutáneas confirma el diagnóstico. Para la erradicación de los ácaros de la sarna, los medicamentos de elección son la permetrina tópica y la ivermectina oral. La sarna es una enfermedad cutánea parasitaria altamente contagiosa, que es estigmatizante y debilitante. Esta revisión tiene como objetivo familiarizar a los médicos de Atención Primaria con las manifestaciones clínicas, para realizar un diagnóstico preciso y un tratamiento rápido, esenciales para el control efectivo de esta patología y para la prevención de la propagación de la enfermedad. |
| Abstract
Scabies is a parasitic infestation of the skin, caused by Sarcoptes scabiei var. hominis, a worldwide spread ectoparasite that affects nearly 100 to 130 million people each year. It is estimated that the average prevalence is 5 to 10% in children from developing countries. Transmission usually occurs after a close and prolonged skin-skin contact. Classic scabies is characterized by intense itch and a papular, erythematous rash. Other clinical variants include crusted scabies, nodular scabies and bullous scabies. The presence of the mite, its eggs or faeces in microscopic tests from skin lesions confirms the diagnosis. For the elimination of scabies mites, the medications of choice are topical permethrin and oral ivermectin. Scabies is a highly contagious parasitic skin disease that is stigmatizing and debilitating. |
Palabras clave: Sarcoptes scabiei ; Escabiosis; Ectoparasitosis; Sarna; Prurito.
Key words: Sarcoptes scabiei; Scabies; Ectoparasitosis; Itch.
Pediatr Integral 2021; XXV (4): 176.e1 – 176.e15
Sarna, pediculosis y otras ectoparasitosis
Sarna (escabiosis)
Introducción
La sarna es una de las primeras enfermedades humanas de las que se conoció su causa en el siglo XVII. Es una infestación cutánea parasitaria contagiosa causada por un ácaro, Sarcoptes scabiei variedad hominis, que prevalece a nivel mundial y causa una significativa morbilidad y mortalidad.
La sarna o escabiosis es una de las afecciones cutáneas más comunes que se encuentran en todo el mundo. La palabra escabiosis proviene del término latino “scabere” que significa rascar. Se trata de una ectoparasitosis causada por Sarcoptes scabiei var. hominis, un ácaro parasítico microscópico obligado, que vive todo su ciclo de vida, de 10-14 días, en la epidermis humana.
Este ácaro se conocía como Acarus scabiei (DeGeer, 1778), antes de que se estableciera el género Sarcoptes (Latreille, 1802) y se convirtió en S. scabiei. La investigación durante los últimos 40 años ha aumentado considerablemente, principalmente sobre la biología del ácaro, las interacciones parásito-huésped y los mecanismos que utiliza para evadir las defensas del huésped. Roncalli y Friedman aportan conocimientos de sarna en humanos y en medicina veterinaria, desde los tiempos bíblicos hasta principios del siglo XX. La primera referencia escrita a una enfermedad de la piel de humanos y otros mamíferos que podría ser sarna, aparece en el Levítico en la Biblia (1200 a. C.). Según Friedman, la relación causal entre el ácaro del picor Acarus scabiei (ahora Sarcoptes scabiei) y la enfermedad en humanos, fue descubierta por Bonomo y Cestoni en 1687 y “marcó el establecimiento por primera vez en la historia de la medicina, de una causa definitivamente conocida de cualquiera de las enfermedades del hombre”. Hoy en día, es una enfermedad cutánea contagiosa de los humanos y de muchos mamíferos domésticos y salvajes, que está desatendida, prevalece a nivel mundial, y causa una significativa morbilidad y mortalidad.
Entre los ácaros, los S. scabiei pertenecen al superorden Acariformes, orden Sarcoptiformes, suborden Oribatida, infraorden Desmonomata y al grupo Astigmata. Pertenece a la superfamilia Sarcoptoidea y a la familia Sarcoptidae, que contiene la subfamilia Sarcoptinae, la cual incluye el género Sarcoptes y la especie: Sarcoptes scabiei var. hominis(1-3).
Epidemiología
Actualmente, la sarna está en la lista de enfermedades tropicales desatendidas (ETD) de la Organización Mundial de la Salud (OMS). Ocurre en todos los países, pero su distribución no es uniforme, por ello, son necesarios métodos de muestreo de población y criterios de diagnóstico estandarizados.
En 2017, se agregó la sarna a la lista de ETD de la OMS. Se recomendó que se incluyera como categoría A, definida como aquellas condiciones que cumplen los cuatro criterios especificados, y se recomienda para la acción a gran escala, para garantizar el acceso a medicamentos orales y desarrollar pautas para su uso en salud pública. Las recomendaciones incluyeron: definir mejor la carga global, integrar los esfuerzos de control para capitalizar los programas basados en ivermectina para otras ETD y establecer pautas provisionales para las intervenciones de salud pública para su control.
La sarna ocurre en todos los países, pero su distribución no es uniforme. Se encuentra una carga de enfermedad mucho mayor en los países de bajos y medianos ingresos, donde el acceso a un tratamiento efectivo, a menudo, es inadecuado y el hacinamiento de la población aumenta la transmisión. Las áreas con climas cálidos y húmedos tienen la prevalencia más alta, entre ellas las islas en la región del Pacífico y América Central, y las comunidades indígenas del norte de Australia. En climas templados, la incidencia es mayor en otoño e invierno que en verano. Los individuos con enfermedades concomitantes o ingresados en entornos institucionales (orfanatos, residencias de anciano, refugios para personas sin hogar, prisiones o campamentos de desplazados), pueden correr un mayor riesgo de padecer sarna.
El estudio de Carga Global de Enfermedad (Global Burden of Disease, GBD) de 2016 estimó que la prevalencia global es de alrededor de 147 millones, con 455 millones de casos de incidentes anuales, con una prevalencia que oscilaba entre el 0,2 y el 71,4%, siendo hasta 40-50% en niños menores de 18 años. Causa una carga de morbilidad ajustada por edad similar a Haemophilus influenzae, meningitis tipo B y leucemia linfoide aguda.
Los factores predisponentes incluyen mala higiene, desnutrición, pobreza, hacinamiento, falta de vivienda, reducción del acceso a la atención de la salud, contacto sexual indiscriminado, demencia, alteraciones sensitivas e inmunodeficiencia. Los niños menores de dos años y las personas de edad avanzada corren el mayor riesgo y, generalmente, no hay predilección por género.
Mientras que la carga directa de la sarna es alta, esta puede ser la “punta del iceberg” de la carga mediada a través de la infección bacteriana secundaria. En algunas poblaciones, del 41 al 93 % de los casos de impétigo son asociados a escabiosis. Por otro lado, pueden desarrollarse complicaciones del impétigo como infecciones bacterianas locales y sistémicas, glomerulonefritis post-estreptocócica y, posiblemente, fiebre reumática. Además, la considerable morbilidad y mortalidad de la sarna costrosa no se incluyó en los estudios. Se necesitan estudios más rigurosos en una variedad de entornos y dirigidos a poblaciones desfavorecidas, para describir la carga global y la distribución(3-5).
En la sarna clásica, el contacto prolongado piel con piel, incluido el contacto sexual, es el modo principal de transmisión, y la transmisión mediada por fómites es poco frecuente, siendo más importante en la sarna costrosa (anteriormente conocida como sarna noruega), donde los ácaros son más numerosos.
Los ácaros vivos en ropa de cama, muebles, juguetes y ropa, pueden ser una fuente de infección. Los ácaros pueden sobrevivir fuera del huésped durante 4 días, permaneciendo infecciosos y aún penetrarían en la piel. La humedad relativamente alta y la temperatura baja, también prolongan la supervivencia en el huésped. Mellanby y cols., determinaron que el punto de muerte térmica de hembras de S. scabiei var. hominis expuestas a temperaturas letales fue 49ºC (120°F) en 10 min, y 47,5°C (117,5°F) en 30 min.
Ciclo biológico
El parásito es de color marrón-blanco y tiene 4 pares de patas. La hembra tiene un tamaño aproximado de 0,3 x 0,4 mm y tienen aproximadamente el doble del tamaño del macho. Desde el huésped inicial, y quizás movida por el calor y el olor, la hembra pasa a su nuevo huésped y, bien en la superficie de la piel o en el estrato córneo, es fecundada, muriendo el macho tras la cópula. Excava túneles de 1-3 mm, avanzando de 0,5-5 mm por día, y en ellos coloca de dos a tres huevos ovalados al día y sus deyecciones. Durante una infestación normal, es posible encontrar de 5 a 15 hembras, llegando a miles en el caso de una sarna noruega. Después de 3-8 días de haber depositado los huevos, las larvas salen de los mismos y se dirigen a la superficie de la piel. En menos de 10 días, se transforman en hembras y machos adultos. Las formas juveniles excavan túneles en la epidermis, donde se alimentan de detritus celulares. El ciclo se completa en 2-3 semanas. Se produce una nueva fecundación y se reproduce el ciclo. Esto explica que el periodo de incubación sea de entre una a tres semanas. Puede pasar hasta un mes antes de que un individuo recientemente infectado note el prurito o inflamación, indicadores de la presencia de sarna.
Fisiopatología
Cuando el S. scabiei infecta a un huésped, primero debe penetrar en el estrato córneo de la epidermis. Los ácaros segregan un líquido transparente alrededor de su cuerpo, que facilita su penetración en la piel. A medida que se introduce, las patas impulsan al ácaro hacia adelante, con lo que se forma un túnel en el estrato córneo.
A medida que los ácaros se introducen en la piel, liberan sustancias que inducen respuestas inflamatorias e inmunitarias por parte del huésped, así como sustancias que pueden inhibir ciertos aspectos de estas respuestas, permitiendo que eludan los mecanismos de protección del huésped. Esto último ayuda a los ácaros a sobrevivir inicialmente en la piel del huésped y a establecer una población. Puesto que los síntomas en la piel tardan en aparecer cuatro o más semanas en una infección primaria, parece que en una infección inicial, los procesos innatos / inmunes se deprimen, pero con el tiempo, a medida que los ácaros proliferan y se establece una población, se manifiestan síntomas de la enfermedad.
Debido a la ubicación del ácaro en la epidermis, las sustancias solubles (que incluyen saliva, enzimas y hormonas de muda, heces y materiales excretores nitrogenados) que contienen propiedades antigénicas y farmacológicas, se difunden en la epidermis y dermis. Estas sustancias inducen respuestas en estos tejidos, incluidos queratinocitos, fibroblastos, macrófagos, mastocitos, linfocitos, células de Langerhans y otras células dendríticas, y células endoteliales de la microvasculatura.
Al excavar en la epidermis, los ácaros ingieren plasma del huésped que contiene anticuerpos del huésped y otros componentes plasmáticos, incluidos serinas proteasas, complemento y otras enzimas que podrían dañar el revestimiento intestinal del ácaro, que es crucial para la digestión y absorción de nutrientes. El intestino del ácaro segrega serinas de proteasa o serpinas (SMS). Las SMS pueden inhibir la actividad del complemento al unir C1q, lectina de unión a manosa y propiedad de ladinina en las tres vías del complemento y, por lo tanto, protegen el revestimiento intestinal del ácaro del ataque y daño del complemento. Además, contribuyen a la supervivencia y el crecimiento de bacterias en la piel del huésped y, así, promueven la colonización bacteriana que, a menudo, acompaña a una infección crónica por sarna; por lo tanto, estos ácaros han desarrollado una variedad de moléculas que les permite protegerse de los mecanismos de defensa del complemento del huésped.
También son capaces de provocar directamente prurito a través de la activación del receptor de proteasa activado (PAR-2) en fibras nerviosas periféricas. Los eosinófilos también pueden participar en el prurito, mediante la liberación de varias proteínas (p. ej. sustancia P, factor de crecimiento nervioso, proteína catiónica eosinofílica, proteína básica principal y peroxidasa eosinófilo). La estimulación directa de las fibras nerviosas periféricas por Sarcoptes scabiei var. hominis como prurito mecánico, podría ser también uno de los factores pruritogénicos. El prurito grave en la sarna puede ser provocado por múltiples y complejas vías inmunitarias y pruritógenas. En resumen, la inmunidad Th2 es predominante en lesiones de sarna ordinarias humanas y está acompañada de infiltración masiva de macrófagos IL-31(+) M2 y deposición dérmica de periostina(6-8).
Clínica
Se distinguen clínicamente tres tipos de sarna: sarna clásica, sarna nodular y sarna costrosa. La sarna clásica se presenta con prurito y múltiples lesiones cutáneas localizadas en espacios interdigitales, manos, muñecas, axilas, glúteos, areola en mujeres y genitales en hombres, y los patrones morfológicos de la enfermedad pueden diferir en lactantes, niños y ancianos. La sarna costrosa ocurre con mayor frecuencia en pacientes inmunocomprometidos, manifestándose como hiperqueratosis con o sin prurito.
Sarna clásica
El síntoma cardinal de la sarna es el prurito, común en todos los pacientes. Suele iniciarse de forma insidiosa a los 15-20 días después del contagio (periodo de incubación), salvo en reinfestaciones, donde puede acortarse a 1-3 días, donde la sensibilización se desarrolla rápidamente y el prurito puede surgir a escasas 24-48 horas del contagio. Paulatinamente, se va exacerbando y es difícil de controlar. La intensidad es máxima en la noche, aunque también puede producirse durante el día, pudiendo interferir en las actividades. Abarca todo el cuerpo, con excepción de la cabeza y la espalda. Sin embargo, esto puede variar en el paciente inmunocomprometido y en los niños de corta edad, donde normalmente el prurito es más generalizado, con un rascado incontrolado e insatisfactorio. Se produce un sueño interrumpido, por lo que el niño está cansado e irritable, alterando la tranquilidad familiar, y afecta el estado de la salud física y psicológica del niño y su familia.
Se describen dos tipos de lesiones cutáneas elementales:
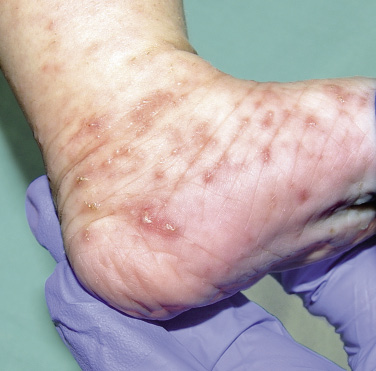
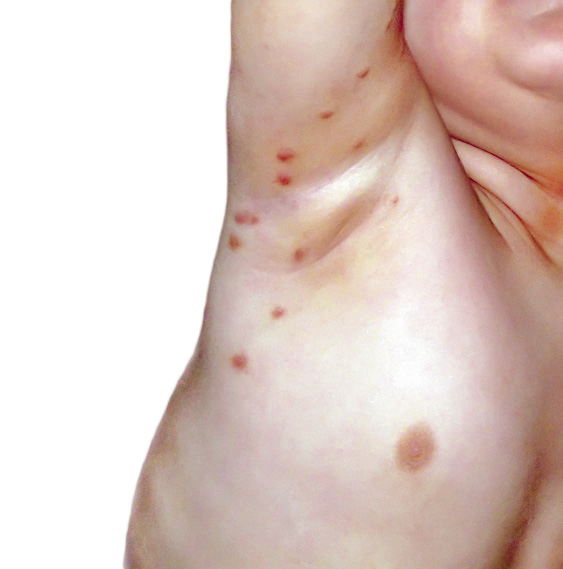
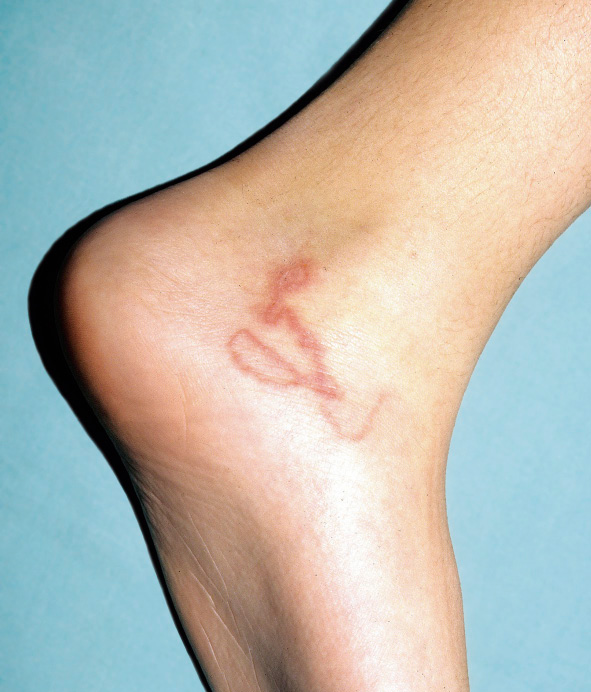
• Lesiones directas: aquellas producidas de forma directa por el ácaro, y las de mayor valor diagnóstico son los denominados “surcos acarinos” (Fig. 1).
Figura 1. Surcos acarinos en un lactante
Estos son la expresión externa de los túneles epidérmicos labrados por la hembra a la par que digiere la epidermis. Son trayectos lineales, levemente sobreelevados y eritematosos que miden varios milímetros; al final de los mismos, se observa una fina vesícula que corresponde al sitio donde está alojado el parásito: la denominada eminencia acarina o perla escabiótica, o vesícula perlada de Bazin, Éstas son lesiones vesiculosas, transparentes, menores de 1 mm, con eritema perilesional, debido a la reacción inflamatoria que se genera. La hembra buscará, para poder penetrar mejor, áreas con estrato córneo más fino. Esto explica que sean mucho más frecuentes en zonas de pliegues, aunque los podemos encontrar por cualquier área anatómica.
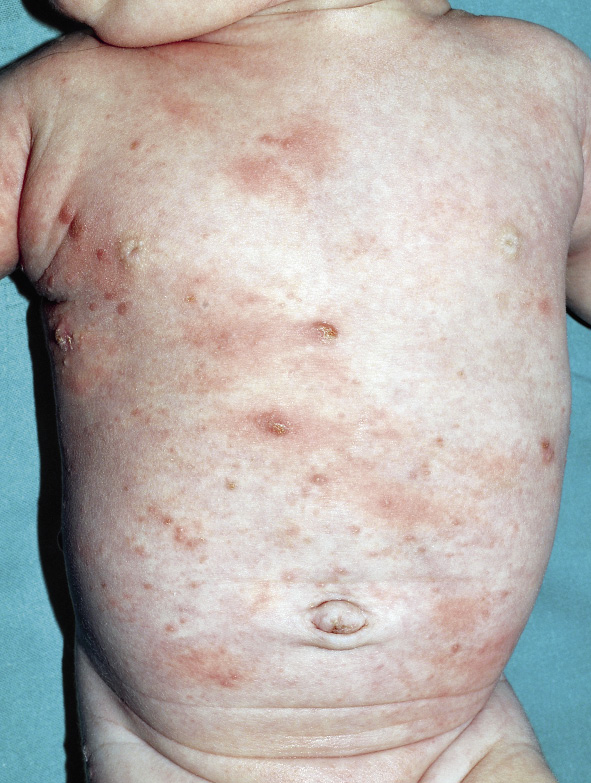
• Lesiones indirectas: producidas como una reacción cutánea a la presencia del ácaro y por los efectos lesivos del rascado. Encontramos pápulas, lesiones sobreelevadas y eritematosas de distribución bilateral, simétrica y generalizada (Fig. 2).
Figura 2. Erupción papulovesiculosa en el tronco.
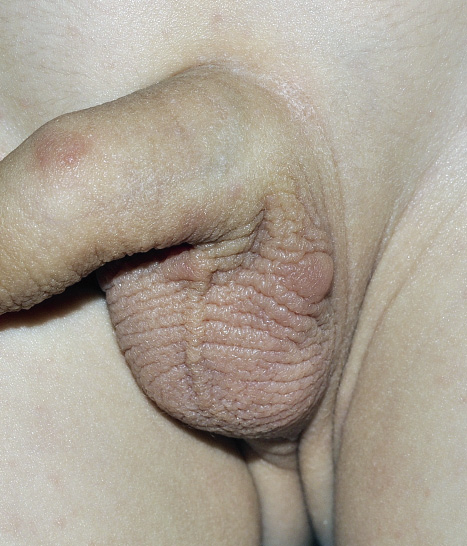
En pacientes atópicos es fácil encontrar elementos nodulares, de 6 a 10 mm de diámetro, intensamente pruriginosos, denominados nódulos acarinos, que se localizan en codos, axilas, flancos, escroto, pene y pliegues sub e interglúteos (Fig. 3).
Figura 3. Nódulos escabióticos.
Otras lesiones secundarias que podremos observar, según cual sea el momento evolutivo o la intensidad de la infestación son costras, escamas y ampollas.
En resumen, la combinación del prurito y las lesiones elementales, configura una erupción con particularidades propias y altamente sugestivas de dicho diagnóstico. Cronológicamente, en el primer momento de la infestación, son las lesiones directas (vesículas y surcos) más fácilmente detectables. A medida que el proceso se extiende, la erupción se diversifica y gradualmente se torna polimorfa, incorporando: pápulas, nódulos, escamas, costras hemáticas y melicéricas, y excoriaciones, constituyendo una amalgama de lesiones difícilmente reproducible en otras dermatosis.
Se ha descrito sarna en edades muy tempranas, incluso a partir de los 15 días de vida. Por ello, la topografía de la enfermedad varía en relación con la edad del niño. Así, en los lactantes, afecta prácticamente a todo el cuerpo, pudiendo encontrarse lesiones en áreas muy típicas de este grupo de edad y evocadoras del diagnóstico, como son el cuero cabelludo y las plantas.
Igualmente, en las palmas y plantas, no es extraño observar elementos pustulosos, tipo acropustulosis palmoplantar, donde es raro encontrar al ácaro. La mayor parte de las veces se producen tras un correcto tratamiento y eliminación de los ácaros. Se manifiestan en forma de brotes recurrentes, vesiculosos, intensamente pruriginosos y originados a partir de infestaciones escabióticas previas, en la mayoría de los casos. Los pies se afectan en el 100% de los casos y, algo menos, las manos. Pueden afectarse también el dorso de los dedos. No hay afectación oral y no hay otros miembros de la familia afectos. Los episodios duran varias semanas, pero pueden recurrir semanas o meses después. Se ha comprobado su asociación hasta en un 50% de los casos con dermatitis atópica. Entre los diagnósticos diferenciales están enfermedad mano-pie-boca, impétigo, infección herpética, sífilis congénita, foliculitis pustulosa eosinofílica infantil, síndrome de Gianotti-Crosti, psoriasis pustulosa infantil, eccema dishidrótico y sarna recurrente. La resolución espontánea a los 3-5 años de edad es la norma y su información a los padres puede ayudar a tranquilizarlos ante la recidiva de lesiones. Ocasionalmente, se han descrito niños con brotes ocasionales a lo largo de los años. Apreciaremos zonas de eccematización o lesiones impetiginizadas, que pueden dificultar la observación nítida de surcos y vesículas, al igual que nódulos en la axila y zona del pañal, incluso puede haber ampollas (frecuentes en los lactantes). El lactante se muestra irritable, por la falta de sueño secundario al prurito y con sobreinfecciones añadidas.
En niños en edad escolar y adolescentes, las lesiones tienen la topografía del adulto, siendo más frecuentes, por este orden, en región interdigital, axila, ingles e interglútea, y también en cara interna de antebrazos, brazos y anterior de muñeca. Las lesiones en cara y región retroauricular son algo más habituales en este grupo de edad que en los adultos; sin embargo, se puede encontrar por cualquier área anatómica. Debido al intenso prurito y al difícil autocontrol del mismo, característico de la edad pediátrica, se producen intensas lesiones por rascado con excoriaciones, en los casos más crónicos, llegándose a formar áreas de liquenificación y lesiones nodulares granulomatosas.
En mujeres adolescentes, es habitual la afectación de la areola y el pezón; y en el hombre, lesiones en el pene y escroto. Aparecen también lesiones en abdomen y región peri umbilical en ambos sexos. Los ácaros tienden a esconderse sobre la piel debajo de los anillos, brazaletes o pulseras de reloj. No es infrecuente que, en algunos casos, la erupción y el prurito puedan persistir varias semanas, incluso meses, después del tratamiento adecuado con los escabicidas. Posiblemente, sea debido a que aún se mantienen reacciones de hipersensibilidad a los ácaros muertos o a sus deyecciones, que permanecen atrapadas en la capa córnea.
Formas clínicas especiales
La sarna costrosa es la presentación más rara de esta enfermedad y constituye una forma clínica con una gran carga infectante. Clínicamente, presenta múltiples lesiones costrosas e hiperqueratósicas, donde habitan numerosos ácaros. El prurito, por el contrario, es mínimo y no corresponde a la extensión ni a la intensidad de las lesiones.
La sarna costrosa también conocida como sarna noruega, escabiosis crustosa, sarna hiperqueratósica o sarna de Boeck, es la presentación más rara de esta enfermedad. Ocurre en el momento en el que el fallo del sistema inmunitario del huésped condiciona una superinfestación, lo que resulta en una gran reacción inflamatoria e hiperqueratosis epidérmica secundaria; por tanto, constituye una forma clínica con una gran carga infectante (de hasta 4.700 ácaros por cm2 de piel afecta).
Los factores de riesgo para desarrollar una sarna costrosa se relacionan con un déficit en la respuesta inmunitaria celular, que puede encontrarse en los pacientes en situaciones especiales (Tabla I), algunas propias de la edad infantil y otras, exclusivas del adulto y que comparten alteraciones inmunitarias y dificultad en la percepción del picor y las respuestas que éste induce. En recién nacidos, esta forma de presentación se debe a la inmadurez de la respuesta inmune. Los síntomas son más graves que en la forma clásica.
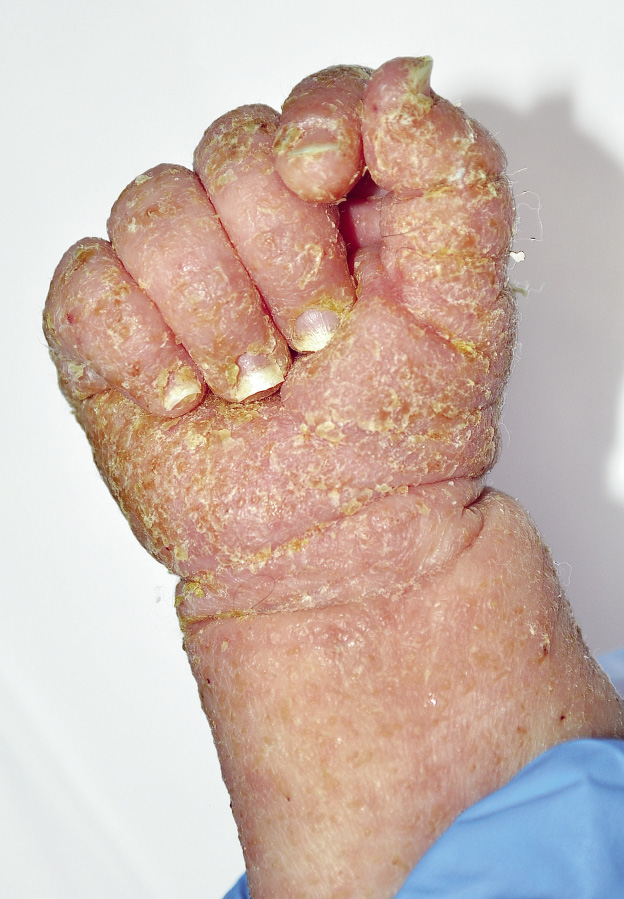
Clínicamente, se caracteriza por la proliferación profusa de ácaros en la epidermis con eritrodermia, pápulas escamosas, costrosas, hiperqueratósicas, de color gris a amarillo-blanco, placas fisuradas y nódulos (Fig. 4).
Figura 4. Sarna noruega.
Las lesiones frecuentemente se distribuyen de forma generalizada en el cuerpo, pero tienden a ser exageradas en plantas, palmas, región retroauricular y superficie extensora de los codos. Las costras pueden ser escamosas y sueltas, o adherentes y gruesas. Al eliminar la corteza, la superficie de la piel aparece lisa, aterciopelada y roja. Las uñas están a menudo decoloradas, engrosadas y distróficas. La linfadenopatía generalizada es frecuente. El prurito, por el contrario, es mínimo y no corresponde a la extensión ni a la intensidad de las lesiones. La sobreinfección añadida es la regla. La piel engrosada dificulta el tratamiento, ya que los productos tópicos difícilmente la atraviesan. Estas formas se asocian a una alta mortalidad por las complicaciones que pueden aparecer, si no se hace un buen diagnóstico y un buen tratamiento. Representan un peligro para el personal médico y para otros individuos que entran en contacto estrecho con el paciente.
En lactantes y niños pequeños, las lesiones son más extensas, pero afectan con más frecuencia a palmas/plantas, muñecas y tobillos. La impetiginización y la eczematización son comunes. Los lactantes no pueden rascarse, sino que se alimentan mal y parecen irritables. Por su parte, los ancianos pueden presentar síntomas y signos poco llamativos y, aunque la respuesta inflamatoria puede ser tenue, el prurito a menudo sigue presente. En individuos encamados, las lesiones pueden involucrar la espalda.
La sarna ampollosa es otra variante clínica rara, que se caracteriza por una erupción ampollar acompañada de pápulas y túneles, con prurito nocturno. Aproximadamente, el 20% de los lactantes y niños afectados pueden tener principalmente prurito diurno. Los sitios de predilección incluyen el tronco y las extremidades. Se han planteado varias hipótesis para explicar la sarna ampollosa. Ésta podría ser el resultado de sobreinfección por Staphylococcus aureus, autoeczematización o exposición del antígeno del penfigoide ampolloso por el proceso inflamatorio que originaría la producción de anticuerpos frente a la zona de membrana basal.
La sarna nodular, una rara variante clínica de la escabiosis, se caracteriza por nódulos eritematosos extremadamente pruríticos, que pueden persistir incluso después del tratamiento de la escabiosis (Fig. 5).
Figura 5. Sarna nodular.
El prurito es más intenso por la noche. Los sitios de predilección incluyen pene, escroto, ingle, glúteos y pliegues axilares. Estos nódulos habitualmente no contienen ácaros vivos y no indican una infestación activa, más bien, representan una reacción de hipersensibilidad retardada a partes de ácaros retenidos, huevos y/o gránulos fecales (escíbalos) de una infestación anterior o actual. Sin embargo, en los lactantes, se pueden encontrar parásitos en las lesiones nodulares, especialmente en las axilas. También puede deberse a una penetración más profunda del ácaro en la epidermis o en la dermis, lo que resulta en una respuesta inflamatoria más exagerada.
Complicaciones
La sarna a menudo se complica con impétigo, abscesos, celulitis y, rara vez, infecciones necrotizantes de los tejidos blandos. La prevención primaria de la infección estreptocócica de la piel mediante el control de la sarna, podría ser un componente importante para prevenir enfermedades sistémicas.
Debido al traumatismo cutáneo inducido por el rascado, la infestación por sarna, a menudo, se complica con impétigo por Streptococcus pyogenes (S. pyogenes) o Staphylococcus aureus. La sarna impetiginizada es común en áreas con alta prevalencia de sarna. En Australia, los niños aborígenes tenían siete veces más probabilidades de tener sarna e infecciones cutáneas concomitantes con S. pyogenes o S. aureus que infecciones de la piel aisladas. Además, el tratamiento de la sarna por sí solo disminuye las tasas de impétigo en áreas con altas prevalencias de sarna e impétigo. Los abscesos, la celulitis y, rara vez, las infecciones necrotizantes de los tejidos blandos, también pueden ocurrir como complicaciones locales. La sarna herpeticum puede resultar cuando la escabiosis costrosa está sobreinfectada con herpes simple.
Las complicaciones sistémicas de la sarna se deben principalmente a una infección bacteriana secundaria. La infección cutánea estreptocócica es probablemente un factor importante de fiebre reumática aguda y posterior enfermedad cardíaca reumática en algunos entornos, aunque este vínculo no está establecido de manera concluyente. En Nueva Zelanda y Etiopía, los diagnósticos de sarna se asociaron con la fiebre reumática y el desarrollo de enfermedades cardíacas reumáticas, apoyando el papel potencial del impétigo asociado a la sarna en estas condiciones de alta morbilidad. Las infecciones bacterianas secundarias también predisponen a las personas con sarna a la bacteremia y a la sepsis. La sarna costrosa sin tratar conlleva un alto riesgo de mortalidad por sepsis secundaria. Hasta la fecha, no se han estimado formalmente las proporciones de la carga mundial total de morbilidad de glomerulonefritis, enfermedad renal crónica o cardiopatía reumática atribuible a la sarna. Se estima que la enfermedad cardíaca reumática causa más de 300.000 muertes por año, con una distribución global que se superpone con áreas que son altamente endémicas para la sarna. La prevención primaria de la infección estreptocócica de la piel mediante el control de la sarna, podría ser un componente importante para prevenir estas enfermedades. Otras complicaciones son dermatitis, urticaria y eritema multiforme. Se pueden producir dermatitis de contacto por el uso de tratamientos inadecuados.
Los niños y adultos con sarna sufren angustia emocional debido al prurito severo, malestar y aislamiento social. El ausentismo escolar es también un problema potencial en muchas sociedades. Desafortunadamente, la carga emocional y el estigma de la sarna pueden disuadir a las personas afectadas de buscar un tratamiento y esto puede promover aún más la transmisión y, de hecho, exacerbar la carga física y emocional(8-10).
Diagnóstico
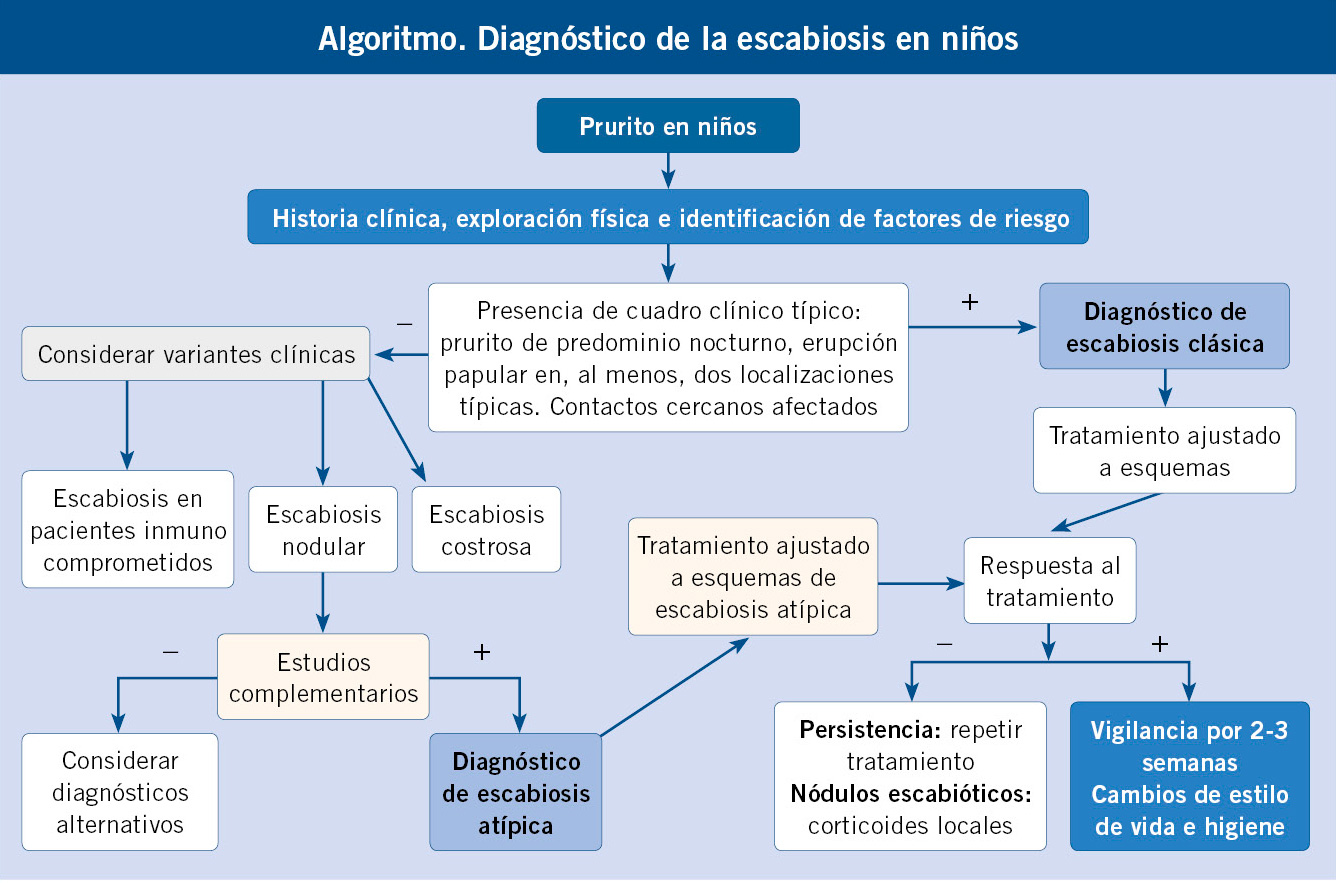
Los criterios de consenso de la Alianza Internacional para el Control de la Sarna 2020 (IACS) para el diagnóstico de la sarna, incluyen tres niveles de certeza diagnóstica y ocho subcategorías. La sarna confirmada (nivel A) requiere la visualización directa del ácaro o sus productos. La sarna clínica (nivel B) y la sarna sospechosa (nivel C) dependen de la evaluación clínica de los signos y síntomas. Se desarrollaron métodos de consenso basados en la evidencia para microscopía, visualización, síntomas y signos clínicos.
El diagnóstico de sospecha es eminentemente clínico y se establece por la topografía y la morfología de las lesiones, el prurito (su típica historia y características, sobre todo, su carácter nocturno) y el dato epidemiológico de la existencia de más casos entre los convivientes o contactos del niño (Algoritmo 1). La historia clínica y exploración hay que centrarla sobre el niño, los familiares cercanos, amigos, quienes le cuidan e indagar sobre contactos fortuitos que haya podido tener o que su cama haya sido ocupada temporalmente por alguna otra persona.
El examen físico, buscando las eminencias acarinas y los surcos, suele ser determinante, en la mayoría de casos. Debe ser minucioso, desde las plantas a la cabeza, prestando atención a pliegues en general e interdigitales en particular, con buena fuente de luz. En ocasiones, las lesiones típicas están camufladas por la eccematización y la impetiginizacion y son difíciles de observar. El diagnóstico de confirmación busca la identificación directa del ácaro o sus productos, tanto en las lesiones específicas (surcos y eminencias) como bajo las uñas, en algunas ocasiones.
Un primer examen directo consiste en colocar una cinta adhesiva transparente en una zona escarificada previamente y observarla al microscopio, para demostrar la presencia de ácaro hembra, restos de ácaro, huevos o detritus fecales, también llamados escíbalos.
La técnica de elección, simple e indolora, será la visión directa del material obtenido del raspado de una lesión sospechosa: eminencia, túnel o surco acarino. Se tensa la piel, se deposita una gota de aceite y con la punta de un bisturí, se desprende suavemente el techo de la eminencia o del surco, y se toma el líquido claro transparente que se obtiene y otros elementos que afloren de la vesícula. Se transfiere todo ello a un portaobjetos, al que se agrega KOH al 10%, se coloca un cubreobjetos y se observa detenidamente en el microscopio.
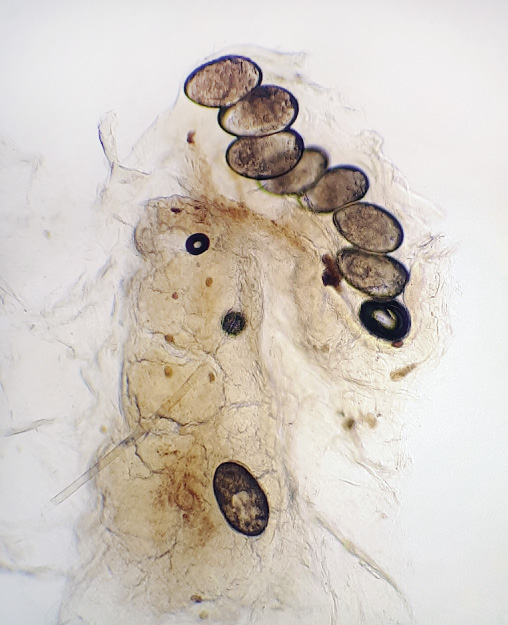
El diagnóstico definitivo se hace encontrando ácaros de sarna, sus huevos o sus materias fecales, pero un examen negativo no descarta la enfermedad (Fig. 6A y B).
Figura 6A. Ácaro de la sarna tomado de un surco acarino (arriba).
Figura 6B. Huevos y heces del ácaro de la sarna (derecha).
El éxito de la técnica depende de varios factores como son ausencia de rascado que permita detectar lesiones intactas, elección adecuada de la lesión, número de tomas que se hagan y experiencia del clínico que la realice.
Como variedad o complemento de la citada técnica, se puede usar la prueba de la tinta, que consiste en aplicar una gotita de tinta china en el extremo de entrada del túnel, limpiando después la superficie con un algodón humedecido con alcohol. La tinta que penetra en el túnel permite la visualización del surco con precisión.
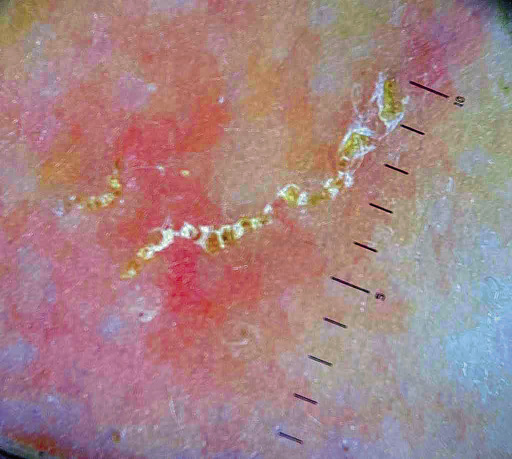
Los avances en métodos no invasivos de alta potencia que incluyen videomicroscopía, videodermoscopia y microscopía confocal de reflectancia, permiten la confirmación del diagnóstico a través de la visualización directa del ácaro. El hallazgo de un patrón “en ala delta” que se debe a la presencia del Sarcoptes scabiei y su surco (Fig. 7).
Figura 7. Dermatoscopia de un surco acarino. Foto cortesía: Dra. Nicole Knöpfel.
Puede ofrecer importante información diagnóstica en casos que dificulten el raspado, como en los niños. Estos métodos, aunque sensibles, requieren tiempo considerable para un examen completo y son dependientes de costosos equipos y personal especializado; por lo tanto, son más apropiados para su uso en clínicas o entornos de investigación.
El estudio histológico tras biopsia de la lesión sospechosa, no es una técnica de rutina, pero pudiera ser necesario cuando los datos clínicos no son concluyentes. El examen histológico de una lesión clásica puede mostrar S. scabiei adultos, huevos y escíbalos dentro de la epidermis, y eosinófilos, histiocitos y linfocitos en la dermis subyacente. Se puede observar espongiosis. En la escabiosis costrosa, la acantosis, la paraqueratosis y la espongiosis se observan típicamente en la epidermis. Innumerables ácaros en todas las etapas de desarrollo se ven a menudo dentro de la epidermis, dado el alto número de la carga del parásito.
El estudio mediante PCR necesita la presencia física de un ácaro en la toma de estudio. Los test intradérmicos son técnicamente complejos, ya que necesitarían extractos de ácaro en cantidades importantes, hoy por hoy, difícil de obtener. Los presentes en las muestras incorporan otros antígenos extra acarinos que contaminan el estudio y se necesitarían alérgenos escabióticos altamente purificados, con proteínas estandarizadas, homogéneas y reproducibles en la repetición de las pruebas. Recientes análisis de ADN han conseguido la secuencia completa de genes del Sarcoptes scabiei. Se consiguen así, antígenos recombinantes apropiados, por lo que estamos a la puerta de poder alcanzar un inmunodiagnóstico preciso y la selección específica de tratamientos, tanto en la escabiosis animal como humana. Las técnicas serológicas y moleculares están en desarrollo, pero no están aún en una etapa en la que puedan recomendarse para uso clínico o de salud pública.
Los Criterios IACS 2020 (Tabla II) comprenden tres niveles, que representan grados de certeza diagnóstica.
La sarna confirmada (nivel A) es el nivel más específico, que requiere la visualización directa del ácaro o sus productos. Sarna clínica (nivel B) y sospecha de sarna (nivel C) se espera que sean más sensibles, pero menos específicos, dependiendo de la evaluación clínica de los signos y síntomas. Cada nivel puede ser apropiado para usar en el diagnóstico de sarna, dependiendo del entorno clínico, de salud pública o de investigación. Por ejemplo, los diagnósticos de nivel A podrían usarse para ensayos clínicos de nuevas terapias, pero es poco probable que sean prácticos de implementar en la mayoría de los estudios de campo. Los niveles B y C pueden ser más apropiados para entornos clínicos y encuestas de campo, particularmente en entornos de bajos ingresos (Tabla I).
Los Criterios IACS 2020 no están destinados a ser utilizados en el diagnóstico de variantes o presentaciones atípicas de la sarna, como sarna costrosa, sarna ampollar o sarna en personas mayores con deterioro cognitivo o en cama(11).
Diagnóstico diferencial
Dada la naturaleza inespecífica del prurito y las lesiones morfológicamente variadas de la sarna, existen numerosos diagnósticos diferenciales. En la tabla III, se muestra una lista completa, que incluye condiciones comunes e infrecuentes.
La capacidad de reconocer estas condiciones dependerá de la experiencia del examinador. La dermatoscopia también puede ser útil para diferenciar causas. Es importante recordar que las lesiones que se infectan secundariamente con S. aureus o S. pyogenes desarrollan una apariencia diferente y puede ser difícil discernir de las lesiones de sarna subyacentes individuales.
Tratamiento
Los objetivos del tratamiento son: erradicación de los ácaros del individuo infestado, prevención de la propagación a otras personas, alivio del prurito asociado y reconocimiento y tratamiento de las complicaciones.
El tratamiento de la sarna lo realizarán el niño afectado, las personas que conviven en su misma casa y sus contactos íntimos, a pesar de estar asintomáticos. Para evitar epidemias intrahospitalarias, debe evitarse ingresar al paciente. El fracaso del tratamiento puede deberse a un tratamiento inadecuado o a un mal cumplimiento del mismo. Sin embargo, el fallo en el tratamiento no debe diagnosticarse hasta, al menos, seis semanas después de la finalización, ya que pueden tardar en desaparecer tanto los síntomas como los signos. Las medidas básicas y fundamentales para el tratamiento de escabiosis se resumen en la tabla IV.
Erradicación de la infestación
Para la erradicación de los ácaros de la escabiosis, los medicamentos de elección son la permetrina tópica y la ivermectina oral.
• Permetrina: la crema tópica al 5% de permetrina es altamente eficaz y tiene una tasa de éxito de 95 a 98%, cuando se usa adecuadamente. Es un piretroide sintético que actúa sobre las membranas de las células nerviosas, retrasando la polarización y provocando la parálisis y la muerte del parásito. La absorción sistémica es lenta e inferior al 2% de la dosis aplicada sobre la piel, siendo el estrato córneo la principal barrera limitante. Las esterasas cutáneas la inactivan con rapidez y se excreta de forma casi completa por la orina, el sudor y el sebo en pocas horas. Cuando se usa correctamente, la probabilidad de efectos tóxicos sistémicos es, como mínimo, entre 40 y 400 veces menor que tras la utilización de una loción de lindano al 1%. Su tolerancia local es excelente, aunque hasta un 3% de pacientes refieren prurito y/o quemazón a los pocos minutos de su empleo. El medicamento es seguro de usar en el embarazo y la lactancia, así como en niños de 2 meses de edad. Los efectos adversos incluyen reacciones cutáneas locales como parestesia transitoria, ardor, prurito y eritema. La crema se debe aplicar durante la noche, masajearse suavemente en la piel y retirar de 8 a 14 horas después de la aplicación, y el proceso se repite una o dos semanas más tarde. El Centro para el Control y la Prevención de Enfermedades (CDC) recomienda una capa fina de escabicida en toda la superficie cutánea, desde el cuello hasta las palmas y plantas, con especial énfasis en espacios interdigitales, muñecas, codos, axilas, mamas, glúteos, zona periumbilical y genitales. En los niños menores de 2 años y en inmunodeprimidos, también se incluirá el cuero cabelludo. Los ácaros pueden esconderse bajo las uñas, especialmente en la sarna noruega, por lo cual deben recortarse bien y tratarse exhaustivamente. Los estudios han demostrado que la permetrina tópica es superior al lindano tópico, crotamitón y benzoato de bencilo.
• Ivermectina: la ivermectina es un antihelmíntico eficaz y seguro frente a la oncocercosis, que ha demostrado ser un escabicida excelente administrado por vía oral en una dosis única de 200 µg/kg, incluso en pacientes con sarna noruega. No tiene actividad ovicida, por lo tanto, se recomienda una segunda dosis después de 7-14 días, para erradicar los ácaros que puedan haber eclosionado después de la primera dosis. Además de una mayor adherencia para el tratamiento individual, la ivermectina oral tiene ventajas como tratamiento para los contactos domésticos y para el control comunitario. El medicamento debe tomarse con alimentos. Los efectos secundarios incluyen dolor de cabeza, fiebre, escalofríos, anorexia, erupción cutánea y artralgias. La ivermectina oral no está aprobada para su uso en niños menores de 5 años o en mujeres embarazadas, o durante la lactancia, debido a la falta de datos de seguridad. Una revisión sistemática Cochrane 2018 y metaanálisis de 15 ensayos controlados aleatorios, mostraron que la ivermectina oral es tan eficaz como la permetrina tópica al 5%. Se han desarrollado formulaciones de liberación lenta de ivermectina, que proporcionan un efecto terapéutico potencial de hasta 6 meses.
• Crema azufrada: el azufre ha sido durante más de un siglo un escabicida eficaz y económico, que se sigue empleado en muchas zonas del mundo. Se utiliza azufre precipitado al 6-10% en una base lavable (pasta al agua) o en vaselina, aplicado durante 3 noches consecutivas, realizando un lavado a las 24 horas de la última aplicación. Algunos pacientes se quejan de su mal olor o de irritación cutánea, mancha la ropa y, a pesar de que puede ser útil para niños menores de 2 meses y en mujeres embarazadas o en periodo de lactancia, excepcionalmente también puede producir efectos tóxicos e incluso muertes en lactantes. Al cabo de 24 horas de realizar el tratamiento, siguiendo cualquiera de las pautas anteriores (permetrina, lindano o azufre), el riesgo de contagio es mínimo. En todos los casos, se recomienda realizar una segunda aplicación al cabo de una semana y controles clínicos a las 2 y 4 semanas.
• Lindano: el lindano (hexacloruro de gammabenceno), en forma de cremas o lociones al 1%, continúa siendo una alternativa terapéutica válida para la sarna, a pesar de su posible toxicidad y de la aparición de resistencias. El preparado permanecerá en contacto con la piel durante 6 o 12 horas, y después se lavará. Se absorbe aproximadamente un 10% de la dosis aplicada tópicamente. De forma infrecuente, se han descrito alteraciones neurológicas (convulsiones), focomielia y anemia aplásica que, en la mayoría de casos, se deben a su empleo inadecuado (aplicaciones repetidas e innecesarias, baños calientes antes del tratamiento, ingesta accidental, erosiones y úlceras extensas, etc.). Se recomienda evitarlo en niños menores de 10 años, mujeres embarazadas o en periodo de lactancia, y si existen alteraciones de la barrera cutánea (p. ej. eritrodermias o ictiosis) o trastornos neurológicos.
• Crotamitón: la crema de crotamitón al 10% (1 o 2 aplicaciones separadas por 24 horas y lavado a los 2 o 3 días después del último tratamiento) es antipruriginosa y su eficacia es próxima al 60%. A pesar de que su toxicidad es poco conocida, algunos expertos la recomiendan en niños pequeños y en las mujeres en periodo de lactancia.
• Benzoato de bencilo: el benzoato de bencilo al 20-25% en un vehículo alcohólico o en emulsión, solo o asociado con sulfiram al 25%, se dejará aplicado durante 6 o 12 horas en niños menores de 5 años y durante 2 días consecutivos, a partir de esta edad. Sus principales inconvenientes son la neurotoxicidad (similar a la del lindano), su mal olor y la intensa irritación que provoca en las pieles sensibles y en las mucosas.
• Moxidectina: la moxidectina oral, una lactona macrocíclica, ha sido aprobada para el tratamiento de la oncocercosis. El medicamento ha demostrado ser prometedor, como candidato para el tratamiento de la sarna. En comparación con la ivermectina, la moxidectina tiene una vida media plasmática más larga (>20 días frente a 1 día), obviando así la necesidad de una segunda dosis, mejorando el cumplimiento del paciente y reduciendo el riesgo de reinfestación temprana. Se necesitan ensayos bien diseñados, a gran escala, aleatorizados, doble ciego, controlados con placebo, para proporcionar más información sobre la eficacia y el perfil de seguridad de esta droga.
Otras opciones de tratamiento incluyen la aplicación tópica de 1% de ivermectina, 5% fenotrina y 0,5% malathion.
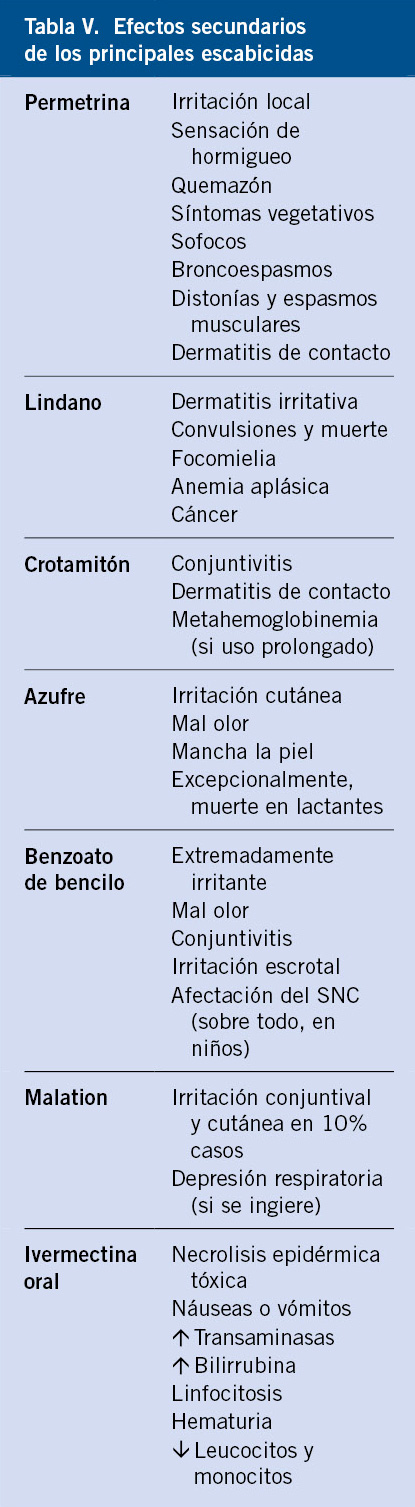
Se puede observar una lista de los efectos adversos más frecuentes de los diferentes medicamentos usados en el tratamiento de la escabiosis en la tabla V.
La sarna costrosa es notoriamente difícil de tratar, debido a inmunidad comprometida del huésped, naturaleza generalizada de la erupción, fuerte infestación de la epidermis y penetración limitada de escabicidas tópicos en las lesiones hiperqueratósicas. Como tal, los pacientes afectados pueden requerir tratamiento combinado o tratamientos repetidos con escabicidas. El tratamiento combinado con crema tópica de permetrina al 5% o benzoato de bencilo (diariamente, durante 7 días, luego semanalmente hasta la cura) e ivermectina oral (200 μg/kg como dosis única, administrado en los días 1, 2, 8, 9 y 15), es el tratamiento de primera línea. Se pueden administrar dos dosis adicionales de ivermectina oral los días 22 y 29, si es necesario, para pacientes con infestaciones graves. El uso concomitante de queratolítico tópico, como ácido salicílico 3-5% en vaselina, 10% de urea y 5% de ácido láctico, o eliminación mecánica de la capa hiperqueratósica, puede acelerar la resolución de la lesión. Se recomienda recortar las uñas afectadas. Si el examen microscópico del raspado de las lesiones indica persistencia de la infestación, se realizará una nueva tanda de tratamiento.
Tratamiento de los nódulos escabióticos
Los ácaros en la sarna nodular pueden ser erradicados con escabicidas. Los nódulos que persisten después de la erradicación de los ácaros se pueden tratar con la aplicación tópica de un corticoide potente. Aquellos que no responden a la terapia tópica con corticosteroides, pueden tratarse con inyección intralesional de corticoide, antihistamínicos orales y/o corticoides orales, durante 7-10 días. Para la dermatitis irritativa, se administrarán emolientes, corticoides tópicos y antihistamínicos orales.
Alivio sintomático del prurito
Los antihistamínicos orales se pueden utilizar para aliviar el prurito. Se deben evitar los antihistamínicos tópicos, debido al riesgo de reacciones alérgicas locales y a la ineficacia general. Después de la erradicación de los ácaros, se pueden utilizar corticoides tópicos, si es necesario, para controlar el prurito.
Tratamiento de la infección bacteriana
Los antibióticos tópicos, como mupirocina, ácido fusídico, retapamulina y ozenoxacino, se pueden utilizar para tratar la infección bacteriana secundaria. Debido a que el uso tópico de antibióticos puede inducir resistencia bacteriana y alergia al contacto, deben utilizarse con precaución. La infección bacteriana secundaria grave puede requerir tratamiento sistémico con cloxacilina, clindamicina, cefalosporinas de primera o segunda generación, o macrólidos, que sean más eficaces contra S. aureus.
Prevención
Después de completar cualquiera de los anteriores tratamientos, se recomienda cambiar la ropa utilizada y lavarla y/o secarla a temperatura superior a 50ºC. Cuando esto no es posible, resulta igualmente eficaz para evitar las reinfestaciones, guardarla en una bolsa cerrada durante 9-10 días (el parásito es capaz de sobrevivir fuera de la piel más de 4 días).
La ropa y sábanas utilizadas dentro de los tres días antes del tratamiento y hasta que se complete el curso de tratamiento, deben lavarse a máquina con agua caliente (50ºC) y secarse en una secadora caliente para minimizar la transmisión de la enfermedad. Esto es especialmente importante en casos de sarna costrosa. Todos los muebles tapizados y alfombras deben aspirarse, y las bolsas de aspiración deben desecharse de forma inmediata y adecuada. El tratamiento simultáneo de todos los contactos cercanos, aunque asintomáticos, es importante para evitar la transmisión y la reinfestación. El riesgo puede minimizarse limitando el número de parejas sexuales y practicando una estricta higiene personal. La sarna sigue siendo un problema importante de salud pública y endémica en muchos países en desarrollo. Los estudios han demostrado que la administración masiva de medicamentos, en particular la administración de ivermectina oral, es una estrategia importante para su control en áreas hiperendémicas, produciendo un efecto relevante a largo plazo, tanto en la sarna como en el impétigo. El tratamiento masivo farmacológico con ivermectina oral también debe considerarse en brotes institucionales o en toda la comunidad. Se ha demostrado que una dosis única de ivermectina oral de 200 µg/kg es eficaz y la adición de un antibiótico oral no proporciona beneficios adicionales(7,10,12).
Pediculosis
La pediculosis es una ectoparasitosis que se relaciona con la población infantil y adolescente en edad escolar.
La pediculosis o infestación de piojos es una ectoparasitosis, que se relaciona con población infantil, adolescente en edad escolar y adultos (educadores, monitores, padres, guardas y pediatras). La vía de transmisión del parásito y la proclividad al contacto personal, convierten a colegios, guarderías y campamentos, en focos de contagio, a modo de brotes masivos, e implicarán, en muchos casos, mantener al niño o joven alejado de las clases, con el fin de evitar nuevos contagios.
Epidemiología
La infestación por piojos es la parasitosis externa más frecuente que afecta a niños entre 3 y 12 años y, más habitualmente, en el sexo femenino. La vía de transmisión es el contacto directo con el cabello de un hospedador infestado o contacto indirecto por medio de fómites.
La infestación por piojos es, sin lugar a dudas, la parasitosis externa más frecuente, afectando a cientos de millones de personas en todo el mundo cada año, pero se desconocen los números exactos, ya que no es una enfermedad reportable. Generalmente, afecta a niños entre 3 y 12 años, y es más frecuente en el sexo femenino. Si bien su prevalencia experimenta picos más importantes durante el otoño y la primavera, puede tener lugar en cualquier época del año. En los países industrializados, las pequeñas epidemias generalmente se desarrollan en escolares, que permiten la rápida propagación de la infestación. También es común en varios miembros del mismo hogar.
Si bien es cierto que una descuidada higiene provoca una mayor diseminación de la infestación, también se afirma que el piojo prefiere la piel y el pelo limpio y sano para desarrollarse y presenta una cierta predilección por los cabellos finos y claros.
El riesgo de transmisión solo es posible a través del piojo adulto. La vía de transmisión más frecuente y más simple es el contacto directo del cabello de un hospedador infestado con cabello de otro potencial hospedador. Los fómites (en peines, sombreros, gorros, auriculares) son los elementos que permiten una transmisión indirecta. Para que esta vía de contagio sea efectiva, es necesario que el tiempo transcurrido no exceda las 48 horas(10,13,14).
Caracterización y ciclo vital
El piojo de la cabeza (Pediculus humanus capitis) pertenece al orden Anoplura, que parasita exclusivamente al hombre y es hematófago. Son visibles a simple vista, ya que su longitud oscila entre 1 y 2 mm, siendo la hembra de mayor tamaño que el macho. Está altamente especializado, carece de alas y presenta garras en el extremo terminal de las patas, que le permiten adherirse al pelo y trepar por él, también posee piezas dentales adaptadas a la succión de sangre, y una saliva anticoagulante y vasodilatadora, responsable de la irritación que ocasiona el prurito. Se mueve rápidamente, desplazándose hasta 23 cm por minuto. En el abdomen presenta seis orificios con membranas diafragmáticas, llamados espiráculos, que comunican el sistema respiratorio con el ambiente exterior. Dichas aberturas pueden cerrarse voluntariamente, lo que le permite flotar en el agua y sobrevivir hasta 36 horas aún en agua clorada y, también, protegen al parásito de la acción de ciertas sustancias tóxicas. Las hembras colocan 3 a 10 huevos por día y viven de 4 a 5 semanas.
Los huevos denominados liendres, presentan forma ovoidea y un tamaño de 0,8 mm. Son operculados, de color blanco, y se hallan unidos al pelo por una secreción adherente, insoluble en agua, que dificulta su total eliminación. Las liendres son depositadas sobre el cabello, en zonas muy cercanas al cuero cabelludo y, para eclosionar, necesitarán que transcurran 4-14 días. De cada huevo nacerá una ninfa que, en los días posteriores a su emergencia, todavía deberá presentar 3 estadios más, para llegar a la madurez sexual, esto le lleva 9 días. La hembra inicia la puesta de los huevos 1-2 días después de su madurez sexual, y pone una media de 10 huevos diarios, lo que representa que una hembra puede llegar a poner 250-300 huevos durante su ciclo vital.
Sintomatología
El prurito es el síntoma más característico, produciéndose complicaciones como infecciones secundarias tipo pioderma o impétigo.
Los pacientes suelen presentar prurito, típicamente de una reacción de hipersensibilidad mediada por el sistema inmune. Puede llevar de 2 a 6 semanas desarrollar síntomas después de la primera exposición, mientras que puede desarrollarse después de 1 o 2 días después de la exposición. El prurito es de intensidad variable, lo que conduce a máculas eritematosas, pápulas, costras y abrasiones en cuero cabelludo; es más intenso en las zonas más cercanas a la nuca y las orejas, aunque, en raras ocasiones, puede llegar a afectar a cejas, pestañas y barba. Pueden producirse infecciones, hiperpigmentación y liquenificación.
Algunas de las complicaciones observadas incluyen:
• Eccema.
• Linfadenopatías cervicales.
• Conjuntivitis.
• Pedicúlide: es una reacción papular secundaria a la parasitosis, localizada en el cuello y la parte superior y posterior del tronco. Son pequeñas pápulas eritematosas que desaparecen al realizar el tratamiento adecuado. Pueden simular un rash de origen viral.
• Excoriaciones por rascado.
• Prúrigo agudo.
• Sobreinfección bacteriana: las excoriaciones favorecen el ingreso de bacterias, provocando la infección de las lesiones por el estafilococo o el estreptococo.
• Miasis sobreagregada.
• Alteraciones del tallo piloso: el pelo puede verse ralo, opaco y seco por la infestación, el rascado intenso y el uso de productos químicos.
• El uso del peine fino y el rascado intenso pueden dejar una alopecia leve(10,13,15).
Diagnóstico
El diagnóstico se confirma con la presencia de, al menos, un piojo vivo. Encontrar solo liendres en el examen no es suficiente para confirmar una infestación actual, ya que las liendres pueden permanecer en el cabello durante meses después de un tratamiento exitoso.
El método óptimo para el diagnóstico es la inspección visual del cuero cabelludo y del cabello, preferiblemente húmedo, porque retrasa el desplazamiento de los parásitos. Además, se recomienda que la búsqueda de liendres se lleve a cabo en las regiones temporal, retroauricular y occipital, dado que frecuentan áreas que reciben poca luz. El tiempo medio requerido para el examen es de 13 minutos por cabeza. Para confirmar la infestación, se recomienda peinar y usar como herramienta el peine microacanalado contra liendres. La presencia de liendres adheridas firmemente a ¼ de pulgada de la base del cabello puede indicar, mas no confirmar, que haya una infestación; si se ubican a más de ¼ de pulgada sugieren que la persona estuvo infestada y, por lo tanto, no es necesario iniciar tratamiento, pues estas liendres no son viables. Cabe resaltar que las liendres, a menudo, se confunden con otras partículas en el cabello, como caspa, gotas secas de espray para el cabello o polvo.
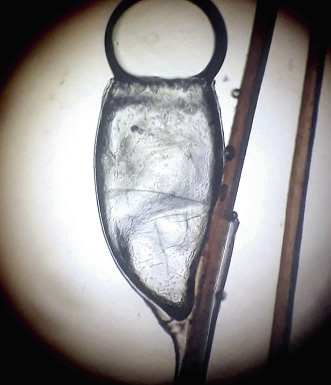
Ante la detección de liendres, puede interesarnos distinguir si éstas están llenas o vacías (Fig. 8).
Figura 8. Liendre adherida a un cabello.
Así, conviene saber que las llenas son blancas y mates, mientras que las vacías son translúcidas. Otro elemento que puede ayudar a discernir entre ambos estados, es su situación: las liendres son depositadas a 1 mm, aproximadamente, del cuero cabelludo; así, teniendo en cuenta que se desplazan, debido al crecimiento del pelo, unos 0,4 mm diarios y que tardan unos 7 días en eclosionar, esto indica que las liendres, situadas a más de 3,5 mm del cuero cabelludo, tienen una probabilidad muy alta de estar vacías.
Un examen con lámpara de Wood puede revelar fluorescencia de color amarillo verdoso de las liendres y los huevos. El estudio micológico se realiza para descartar una infección por hongos, cuando el diagnóstico no está claro. Cuando se encuentran piojos en un miembro de una familia, todos los demás miembros de la familia en contacto también deben ser examinados, en busca de evidencia de infestación(16).
Tratamiento
El tratamiento consiste en la eliminación mecánica de piojos y liendres, además de un tratamiento tópico.
Debe tratarse únicamente a las personas en las que se haya confirmado la presencia de un piojo vivo. Todos los contactos cercanos (familia, colegio) deberán ser informados y examinados en busca de piojos. Todas las personas infestadas en el mismo hogar se tratarán a la vez.
Tratamiento mecánico
Las lendreras pueden utilizarse, tanto en el diagnóstico como en el tratamiento de la pediculosis. Básicamente, son peines con las púas muy juntas que al pasar por el cabello arrastran los piojos y las liendres. Pueden ser de plástico o de metal. Se recomiendan las metálicas, pues retiran tanto los piojos como las liendres. Lo fundamental es que tengan las púas muy juntas (menos de 0,3 mm de distancia entre ellas). Es importante que el pelo esté mojado durante la operación, en vez de que los piojos se muevan con más dificultad. Conviene separar el cabello en varias secciones y luego peinarlo intensivamente, sección por sección, con la lendrera, en vez de empezando desde la raíz del cabello y moviéndose hacia su extremo. La duración recomendada para la detección de los parásitos es de entre 5 y 15 minutos, dependiendo de la longitud del cabello. Cuando se trata de retirar las liendres, pueden requerirse hasta 30 minutos. Tras cada pasada, hay que limpiar bien el peine para evitar que los piojos que pudieron haberse adherido a él vuelvan a la cabeza en la siguiente pasada. Se recomienda repetir el proceso el proceso cada 3-4 días durante 2 semanas, desde la detección del último piojo vivo, para poder detectar cualquier liendre que pueda haber quedado. El uso de las lendreras por sí solo habitualmente no es suficiente para eliminar los piojos. Existen diferentes tipos de tratamientos tópicos disponibles: insecticidas químicos, como malation o piretrinas; productos de acción física, como las siliconas (dimeticona); y los llamados «productos naturales», tipo aceites y esencias. Para que los tratamientos sean eficaces, es esencial que se apliquen de forma correcta(17).
Particularmente, la dimeticona pertenece a las siliconas sintéticas. Se trata de un producto inodoro, incoloro e hidrofóbico. Su mecanismo de acción consiste en cubrir la cutícula del piojo, ocupando los conductos que se encuentran en ella destinados a la oxigenación del parásito. Así pues, el mecanismo de acción es meramente mecánico, limitando su aporte de oxígeno en menos de 1 min y ocasionándole la muerte en pocas horas. Es más efectivo en pacientes con infestaciones leves. Pese a que la dimeticona a baja concentración (4%) tiene baja actividad ovicida, hay estudios que han demostrado que la dimeticona a alta concentración (92%) tiene una actividad ovicida cercana al 95%. Actualmente, existen más de una decena de productos pediculicidas con dicho componente, solo o en combinación con otros. Es exclusivo para uso externo y se aplica de forma uniforme sobre el pelo limpio y seco, asegurándose de que el cuero cabelludo quede totalmente cubierto. Se debe frotar el pelo extendiendo la loción de forma uniforme, desde las raíces hasta las puntas. Se debe dejar secar el pelo de forma natural durante 1 hora después de su aplicación y, posteriormente, utilizar un peine ultrafino para peinar el cabello y remover las liendres. Luego se debe lavar el pelo con champú normal, enjuagar y secar. Es importante reaplicar la loción 7 días después para eliminar cualquier piojo que pueda eclosionar en ese tiempo y evitar el contacto con ojos, mucosas, zonas sensibles y heridas(18).
Tratamiento tópico
• Piretrinas: la permetrina está considerada, hoy día, como el tratamiento pediculicida de elección, ya que es activa, tanto sobre adultos como sobre ninfas y liendres. Es una piretrina sintética que actúa sobre el sistema nervioso del insecto, altera los canales de sodio de sus membranas celulares y provoca, en un primer momento, hiperactividad y descoordinación, seguido de parálisis y muerte del parásito. Las piretrinas sintéticas, son estables, presentan una acción más prolongada y una excelente tolerancia cutánea. Se pueden aplicar a partir de los 2 meses de edad, con la precaución de evitar el contacto directo con ojos y/o mucosas durante su aplicación. Han aparecido muchas resistencias al producto. Existen también resistencias cruzadas, por lo que, si falla el tratamiento con piretrinas sintéticas, sería aconsejable utilizar otro grupo terapéutico(13,16,17).
Es relativamente frecuente asociar piretrinas con el butóxido de piperonilo, un agente sintético de escasa actividad pediculicida, pero capaz de potenciar el efecto neurotóxico de las piretrinas sobre el parásito, aumentando su efecto alrededor de 10 veces, ya que es capaz de inhibir el citocromo P-450, enzima responsable de la eliminación de los piretroides en el parásito, mediante reacciones de hidrólisis e hidroxilación.
Su modo de empleo será en función de su forma de presentación (cremas, lociones, aerosoles, champús) y de la concentración del activo vehiculado (0,5-1,5%). Es recomendable que se repita la aplicación, transcurridos 10 días después de iniciado el tratamiento, para asegurar que se cubre todo el ciclo biológico del parásito.
• Organofosforados: provocan la parálisis del ectoparásito, derivada de la capacidad de inhibir irreversiblemente la acetilcolinesterasa, neurotransmisor requerido para que se efectúe la transmisión del impulso nervioso. El malatión es el más utilizado, ya que presenta una toxicidad menor que la del resto de este grupo, aunque en tratamientos prolongados puede llegar a provocar irritación. Es activo frente a formas adultas y tiene un gran poder ovicida y un pobre efecto sobre la liendre, aunque mejor que la permetrina. Se recomienda como segunda línea de tratamiento por su toxicidad. El champú al 0,5% se aplica durante 10 min. La loción se deja actuar durante 8-12 h. No se recomienda repetir su aplicación, excepto que se constaten piojos vivos a los 7 días. Han aparecido muchas resistencias al producto. Es inflamable, y si se ingiere puede producir distrés respiratorio. No debe aplicarse en menores de 6 años.
• Hidrocarburos clorados: clásicamente, han sido muy utilizados en el tratamiento de las pediculosis, pero en la actualidad, su utilización se halla muy limitada, sobre todo, en niños de corta edad, debido a su importante toxicidad, su alta persistencia ambiental y la aparición de resistencias. El lindane o gammahexaclorobenceno, derivado del DDT, resulta efectivo frente a todas las formas integrantes del ciclo biológico del piojo, al ser capaz de atravesar la capa de quitina que le cubre y actúa sobre su sistema nervioso. Tiene escaso poder pediculicida; no está aprobado en otros países, pero sí en España. Una sola aplicación a concentraciones del 0,2 al 1%, suele ser suficiente para eliminar los parásitos del hospedador, aunque es recomendable repetir el tratamiento de dos a tres veces a intervalos de 4 días, para minimizar el riesgo de que se produzcan recidivas. Hay que aplicarlo durante 4 min y, a continuación, enjuagar el pelo, y se recomienda una segunda aplicación a la semana, debido a su escaso poder ovicida. Está contraindicado en mujeres gestantes, prematuros y niños con historia de convulsiones. El champú al 1% puede aplicarse durante 4 min y después aclarar bien. Puede repetirse al cabo de una semana. La loción al 1% se deja durante 8 h por la noche. No debe utilizarse como fármaco de primera línea. Posee un alto poder irritante ocular y de mucosas, es capaz de desencadenar dermatitis y, en caso de una absorción continuada y superior a la prescrita, estados de nerviosismo, vigilia, vértigo y cuadros neurológicos graves. Existe riesgo de absorción sistémica y de efectos secundarios en el sistema nervioso central (vértigo, convulsiones) o sobre la médula ósea (supresor).
• Carbamatos: su mecanismo de actuación también reside en su capacidad de inhibir la acetilcolinesterasa, aunque, sensiblemente, con menor intensidad. Uno de sus principales representantes es el carbaril que, formulado vía tópica a concentraciones del 0,5-1%, presenta una baja toxicidad, debido a su escasa absorción percutánea. No deberá ser utilizado en formas pulverizables, por su toxicidad, si se inhala(13).
Tratamientos orales
• Ivermectina: tratamiento surgido a raíz de la resistencia a los tratamientos convencionales. Es un antiparasitario, relacionado con los antibióticos macrólidos, pero sin actividad antibacteriana. En 2012, la FDA aprobó su uso tópico (loción de ivermectina al 0,5%) para las infestaciones del cuero cabelludo. Ha presentado resultados prometedores en diferentes estudios. En cuanto a su administración oral, se ha demostrado en un ensayo controlado y aleatorizado, que una sola administración de ivermectina de 200 µg/kg de peso corporal, repetida al cabo de 7 días, logra una tasa de eliminación de los piojos a los 15 días mayor que la que se obtiene con 2 aplicaciones de loción de malatión al 0,5%, en pacientes con infestaciones por piojos del cuero cabelludo resistentes a los piretroides. Debido a la inmadurez de la barrera hematoencefálica en edad pediátrica, la ivermectina no está recomendada en menores de 5 años de edad, así como en embarazadas y durante la lactancia. En la actualidad, la ivermectina por vía oral (no aprobada por la FDA) y tópica son tratamientos cómodos que se administran una sola vez y que eliminan las ninfas cuando salen de las liendres; se pueden reservar para los casos de piojos del cuero cabelludo resistentes a los fármacos, para que no se produzca resistencia a la ivermectina.
Resistencias
Al igual que en el mundo microbiológico, los ectoparásitos desarrollan resistencias. La resistencia a los pediculicidas tópicos ha ido en aumento en los últimos años, principalmente debido al uso indiscriminado de ellos. Se ha postulado que el mecanismo de resistencia es una mutación en la subunidad de los canales de sodio conocida como knock down resistance (KDR). Dicha mutación enlentece el efecto de los pediculicidas, disminuyendo su eficacia. En estudios realizados en el Reino Unido, se ha demostrado una disminución de la eficacia de la permetrina, el pediculicida más utilizado, del 97% a mediados de los años noventa, al 13% en 2013. Es importante conocer las zonas donde se está desarrollando resistencia, para realizar medidas de salud pública para evitar que éstas aumenten. Se han realizado estudios para determinar la presencia de mutaciones genéticas en los piojos y así poder predecir su capacidad de resistencia. Pese a ello, hoy en día, no existe la posibilidad de determinar si un tratamiento será efectivo o no en la práctica clínica diaria, aunque se puede sospechar cuándo, a pesar del uso correcto, siguen apareciendo piojos vivos. En este caso, se recomienda utilizar un pediculicida distinto, de otra familia, más que aumentar las dosis del que se venía utilizando. Recientemente, se ha recomendado la combinación de dos productos con acción pediculicida en casos de resistencia. Otras veces lo que se produce es una reinfestación, es decir, la reaparición de piojos vivos en la cabeza en un niño que tuvo piojos y en la que, tras un tratamiento correcto, no se encontraron parásitos durante, al menos, 10 días(18).
¿Cómo evitar la diseminación de los piojos y las reinfestaciones?
• En las épocas en que se presentan los picos de infestación, es preferible que los niños lleven el pelo corto y las niñas recogido, de forma que se minimicen las posibilidades de contacto.
• Incrementar la frecuencia del lavado de manos e incluir un lavado de uñas, para evitar la diseminación de la parasitosis.
• En la piscina, utilizar gorro. Los piojos son capaces de sobrevivir en el agua de piscinas durante un cierto período; una vez allí, se hallan a flote y, por consiguiente, son susceptibles a depositarse sobre un nuevo pelo, ya sea del mismo huésped o de otro distinto.
• Tratar al resto de los miembros de la familia o al círculo estrecho de personas que están en contacto con el individuo parasitado, con pediculicidas que eviten el contagio y la diseminación del agente causal.
• Evitar compartir los peines, cepillos, diademas y demás complementos o utensilios utilizados en los procesos de peinado. Una alternativa, para evitar diseminaciones, es sumergirlos, de forma periódica, en una solución insecticida, como mínimo, durante un período de 30 minutos.
• Lavar y secar, a altas temperaturas, la ropa que haya podido permanecer en contacto con la zona afectada por la parasitosis.
• Sanear a fondo el entorno que frecuenta el parasitado (habitación, asientos del coche, sillones), así como cambiar con frecuencia la ropa de cama y proceder a su lavado mediante la utilización de un programa de agua caliente(13).
Larva migrans cutánea
La enfermedad se produce por la penetración de la piel de formas larvales de nemátodos como Ancylostoma brasiliensis que son propensos a penetrar en la piel, probablemente por secreción de hialuronidasa.
También se llama dermatitis lineal serpiginosa, picazón en el suelo, gusano de arena y picazón del fontanero. Ancylostoma brasiliensis es el agente etiológico más común.
La infección ocurre cuando las personas entran en contacto con el suelo contaminado con heces de perros y gatos. Durante la temporada de lluvias, el número de personas infectadas aumenta, probablemente debido a la disolución de las gotas en las heces de los animales infectados, facilitando la eclosión de los huevos y penetración de larvas en la piel de los individuos.
Manifestaciones clínicas
Las lesiones son serpiginosas, afectando las áreas de presión como pies, piernas y glúteos. Puede cursar con eosinofília.
Las lesiones suelen ser lineales, elevadas, eritematosas y serpiginosas e, incluso, pueden aparecer vesículas o ampollas (Fig. 9).
Figura 9. Larva Migrans
Las áreas más afectadas son pies, piernas y glúteos; aparece con menos frecuencia en la cara, las axilas y el pene. El desplazamiento de las larvas desencadena un prurito intenso. Cuando se producen eccemas e infección secundaria, el diagnóstico es muy difícil; si afecta los espacios interdigitales puede confundirse con dermatofitosis. También pueden producirse alteraciones hematológicas, con eosinofilia que, en algunos casos, alcanza el 30%.
Tratamiento
El tratamiento puede ser tópico con tiabendazol o sistémico con albendazol o ivermectina, dependiendo del número de lesiones y su ubicación. En pacientes con lesiones múltiples o afectación de áreas hiperqueratósicas, como las regiones palmoplantares, se recomienda el tratamiento sistémico. Albendazol a una dosis de 15 mg/kg/día durante tres días, es una buena opción terapéutica. Su uso no impide la lactancia y el riesgo fetal es de categoría C. La curación varía del 77% al 100%.
La ivermectina, en una dosis única de 200 µg/kg, también es efectiva. Dependiendo de la evolución, se repite la misma dosis después de siete días. Cuando hay un número reducido de lesiones y se encuentran en la piel lampiña, se puede indicar un tratamiento tópico con tiabendazol 5% pomada(15).
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.** Arlian L, Morgan M. A review of Sarcoptes scabiei: past, present and future. Parasit Vectors. 2017; 10: 297.
2.* Roncalli RA. The history of scabies in veterinary and human medicine from biblical to modern times. Vet Parasitol. 1987; 25: 193-8.
3.* Friedman R. The story of scabies. New York: Froben Press; 1947.
4.*** Thomas C, Coates S, Engelman D, Chosidow O, Chang A. Ectoparasites: Scabies. J Am Acad Dermatol. 2019; 82: 533-48.
5.*** Leung A, Lam J, Leong K. Scabies: A Neglected Global Disease Curr Pediatr Rev. 2020; 16: 33-42.
6.* Gilson R, Crane J. Sarna (Sarcoptes Scabiei). Stat Pearls. 2020.
7.** Cox V, Fuller L, Engelman D, Steer A, Hay R. The public health control of scabies: priorities for research and action. Br J Dermatol. 2020. doi: 10.1111/bjd.19170.
8.* Arlian L, Morgan M, Rider SD. Sarcoptes scabiei: genomics to proteomics to biology. Parasit Vectors. 2016; 9: 380. doi.org/10.1186/s13071-016-1663-6.
9.*** Jannic A, Bernigaud C, Brenaut E, Chosidow O. Scabies Itch. Dermatol Clin. 2018; 36: 301-8.
10.*** García J, Fraile, P. Sarna, pediculosis y picaduras de insectos. Pediatr Integral. 2012; XVI(4): 301-20.
11.*** Engelman D, Yoshizumi J, Hay R, Osti M, Micali G, Norton S, et al. The 2020 International Alliance for the Control of Scabies Consensus Criteria for the Diagnosis of Scabies. Br J Dermatol. 2020. doi: 10.1111/bjd.18943.
12.** Middleton J, Walker SL, House T, Head MG, Cassel JA. Ivermectin for the control of scabies outbreaks in the UK. Lancet. 2019; 394: 2068-9.
13.* Bonett R, Garrote A. Pediculosis y su tratamiento. Offarm. 2004; 23: 66-72.
14.* Bragg B, Simon L. Pediculosis Humanis (Lice, Capitis, Pubis). StatPearls Publishing; 2020.
15.** Cox AE, Oiticica AE, Talhari C, Santos M. Update on parasitic dermatoses. An Bras Dermatol. 2020; 95: 1-14.
16.** López D, Medina ÁP, Mosquera SL, Reinel L. Update and integrated perspective of pediculosis. Rev Asoc Colomb Dermatol. 2017; 25; 38-48.
17.** Nazzaro G, Genovese G, Veraldi S. Human lice: spectators and actors of the history of humanity through the ages. Indian J Dermatol Venereol Leprol. 2019; 85: 679-80.
18.* B. de Pablo Márquez. Update on human head lice. Semergen. 2019; 45: 128-33.
Bibliografía recomendada
– Arlian L, Morgan M. A review of Sarcoptes scabiei: past, present and future. Parasit Vectors. 2017; 10: 297.
Esta revisión destaca algunos de los principales avances sobre: biología del ácaro, genoma, proteoma y capacidades inmunomoduladoras, todos los cuales proporcionan una base para el control de la enfermedad.
– Jannic A, Bernigaud C, Brenaut E, Chosidow O. Scabies Itch. Dermatol Clin. 2018; 36: 301-8.
Revisión muy actualizada, puntual y minuciosa de las características clínicas, diagnóstico y tratamiento en la sarna. Muy recomendable para la lectura y muy útil para la práctica diaria.
– Engelman D, Yoshizumi J, Hay R, Osti M, Micali G, Norton S, et al. The 2020 International Alliance for the Control of Scabies Consensus Criteria for the Diagnosis of Scabies. Br J Dermatol. 2020. doi: 10.1111/bjd.18943.
Esta revisión incluye Los criterios IACS 2020, representando un conjunto pragmático de características y métodos de diagnóstico. Estos criterios pueden proporcionar una mayor consistencia y estandarización para el diagnóstico de la sarna. Sin embargo, requieren mayores estudios de validación.
| Caso clínico |
|
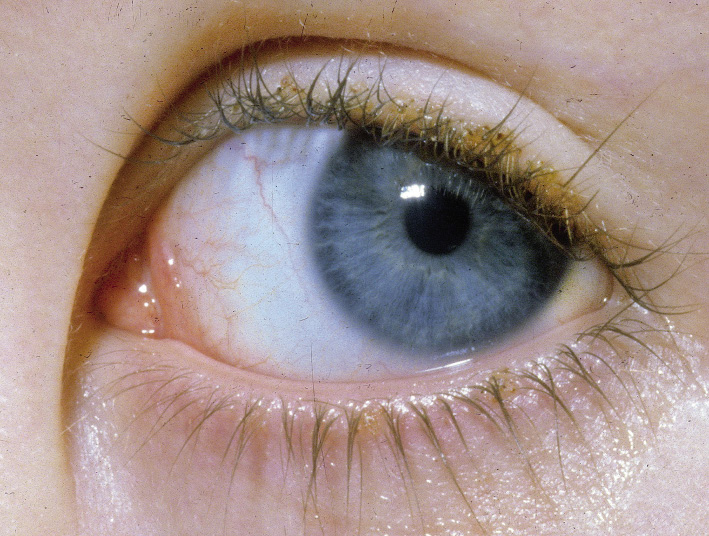
Una niña de 5 años de edad fue traída a consulta por abundante prurito y rascado palpebral en las últimas dos semanas. La paciente no presentaba antecedentes médicos personales de interés. A la exploración, se observaron máculas eritematosas de bordes difusos en ambos párpados y eritema conjuntival. A mayor aumento, se observan pequeños elementos de color grisáceo adheridos a la raíz de las pestañas (Imagen derecha). |






 Acne
Acne 