 |
| Temas de FC |
T. Pozo Román*, B. Mínguez Rodríguez**
*Jefe de Unidad de Dermatología en el Hospital Universitario Río Hortega. Valladolid. **Médico Adjunto de Pediatría en el Hospital San Joan de Deu. Barcelona
| Resumen
La dermatitis atópica es una dermatosis inflamatoria común y frecuentemente familiar que, habitualmente, aparece durante la lactancia o la primera infancia, y se asocia con frecuencia a otras enfermedades atópicas, como: asma, rinoconjuntivitis alérgica, alergias alimentarias o esofagitis eosinófilica. Es una enfermedad genética compleja con influencias medioambientales, caracterizada por un prurito intenso y una evolución crónica en brotes. |
| Abstract
Atopic dermatitis is a common and frequently familial inflammatory dermatosis, which usually appears during infancy or early childhood and is often associated with other atopic diseases such as asthma, allergic rhinoconjunctivitis, food allergies or eosinophilic esophagitis. It is a complex genetic disease with environmental influences, characterized by intense pruritus and a chronic course in flares. |
Palabras clave: Dermatitis atópica; Eczema; Atopia; Dermatitis seborreica; Malassezia (Pityrosporum).
Key words: Atopic dermatitis; Eczema; Atopy; Seborrheic dermatitis; Malassezia (Pityrosporum).
Pediatr Integral 2021; XXV (3): 119 – 127
Dermatitis atópica y dermatitis seborreica
Dermatitis atópica
Introducción/definición
La dermatitis atópica se caracteriza por brotes de lesiones inflamatorias, pruriginosas, con una distribución característica e historia personal y/o familiar de atopia (rinoconjuntivitis alérgica, asma, alergias alimentarias, etc.).
La dermatitis atópica (DA) y la alergia alimentaria tienen predilección por lactantes y niños pequeños; mientras que, el asma prevalece en niños mayores y la rinoconjuntivitis predomina en los adolescentes. Esta secuencia característica, dependiente de la edad, se denomina «marcha atópica», pero no siempre ocurre, pudiendo aparecer o no las enfermedades, y hacerlo simultáneamente o en diferentes momentos.
Es más prevalente en niños (10-20%) que en adultos (1-3%) y, en el 90% de los casos, aparece en la infancia (un 45% durante los 6 primeros meses de vida y el 60% antes del año). Al menos, el 50% de los niños atópicos mantienen alguna manifestación de la enfermedad durante la adolescencia y el 20% también alguna manifestación en la vida adulta(1,2).
La mayoría de los casos se pueden considerar como leves, pero un 10% de los pacientes sufren una enfermedad grave y este porcentaje de casos graves es más alto en la población adulta. Se calcula que la prevalencia de la dermatitis atópica grave en adultos en España es del 0,08%(3).
En las formas más graves, se altera el ciclo del sueño y es causa de irritabilidad, lo que afecta, además de al rendimiento en los estudios o en el deporte, a la autoestima, las relaciones sociales y las actividades rutinarias y de ocio.
Por otro lado, la DA y especialmente la DA grave, implica un gasto económico importante, tanto directo (visitas médicas, coste farmacológico) como indirecto (pérdida de horas lectivas y productividad), y tanto a nivel personal como para los sistemas sanitarios, lo que acentúa la necesidad de evaluar su impacto en el entorno familiar y en el de los cuidadores de los pacientes. Es necesario reconocer que se trata de una enfermedad “familiar” más que individual y, como tal, debe ser valorada(4).
Etiopatogenia
Una deficiente función de la barrera cutánea, la alteración de la respuesta inmune, una alteración del microbioma cutáneo y una importante influencia psicosomática son los factores etiopatogénicos principales.
Es una enfermedad genética compleja, con interacciones entre distintos genes y de estos con el medio ambiente.
En los pacientes con DA, la piel lesional y, en menor medida, la no lesionada, presentan una barrera cutánea defectuosa, con: aumento de la pérdida de agua trasepidérmica, alteración de los lípidos cutáneos, aumento de la proliferación epidérmica, reducción de la expresión de filagrina, inflamación y aumento de receptores de IgE en las células de Langerhans.
La piel sin lesiones muestra también perfiles inmunológicos diferentes al de la piel normal (17% más de células T que la piel normal y un aumento de la expresión de linfocitos Th1, Th2 y Th22). Los antígenos que atraviesan la piel llegan a los ganglios (vía células dendríticas) y estimulan la respuesta Th2 con el consiguiente aumento de producción de IgE y de diversos mediadores procedentes también de diversas células inflamatorias e incluso epidérmicas. La inmunidad mediada por la vía Th1 (que está atenuada) y el sistema inmune innato, contribuyen a la inflamación cutánea con la liberación de citoquinas y con el déficit de péptidos antimicrobianos.
Los pacientes con DA muestran cambios importantes en el microbioma cutáneo, fundamentalmente una disminución de Staphylococcus Epidermidis y una colonización dominante de Staphylococcus Aureus (hasta un 90% en las lesiones), que se correlaciona con la gravedad de la enfermedad. A la inversa, la recuperación de la diversidad del microbioma precede a la resolución de los brotes.
Todas estas alteraciones interaccionan entre sí; de forma que: la disfunción de la barrera altera el microbioma de la piel y la respuesta inmune; el microbioma cutáneo altera la respuesta inmune y la barrera cutánea; y, por último, la disregulación inmune altera también el microbioma cutáneo y la función barrera de la piel(5).
Clinica y diagnóstico
El diagnóstico de la DA es fundamentalmente clínico y sigue basándose en los criterios clásicos de Hanifin y Rajka(6): 3 o más criterios mayores, y 3 o más criterios menores (Tabla I).
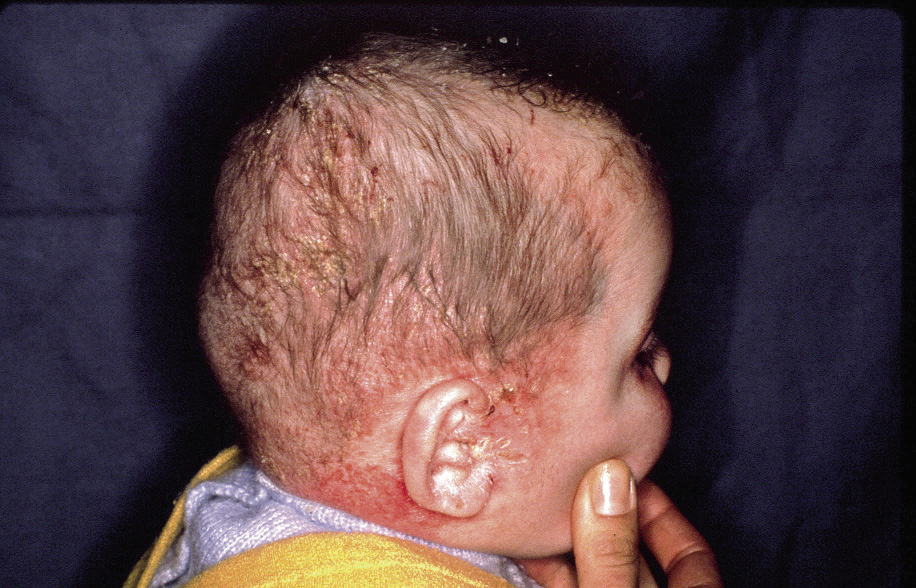
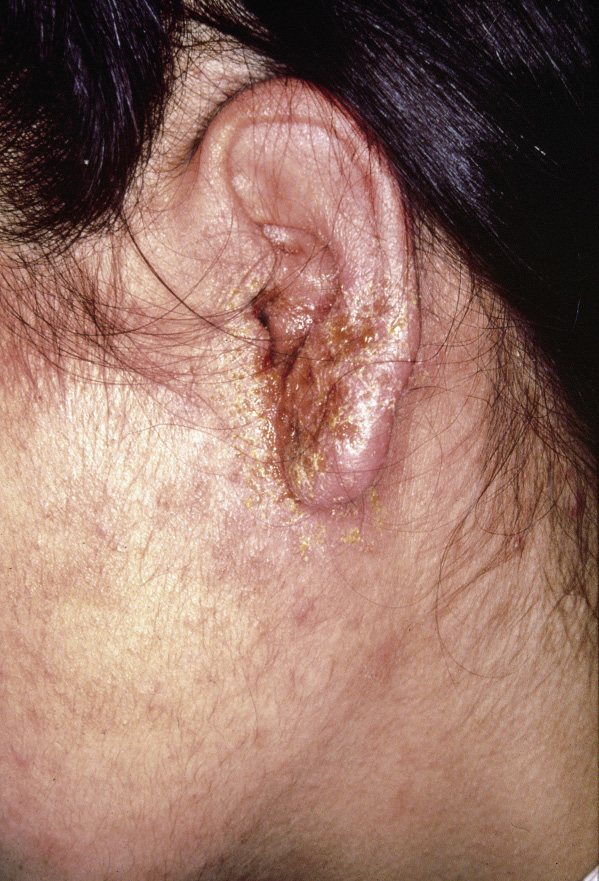
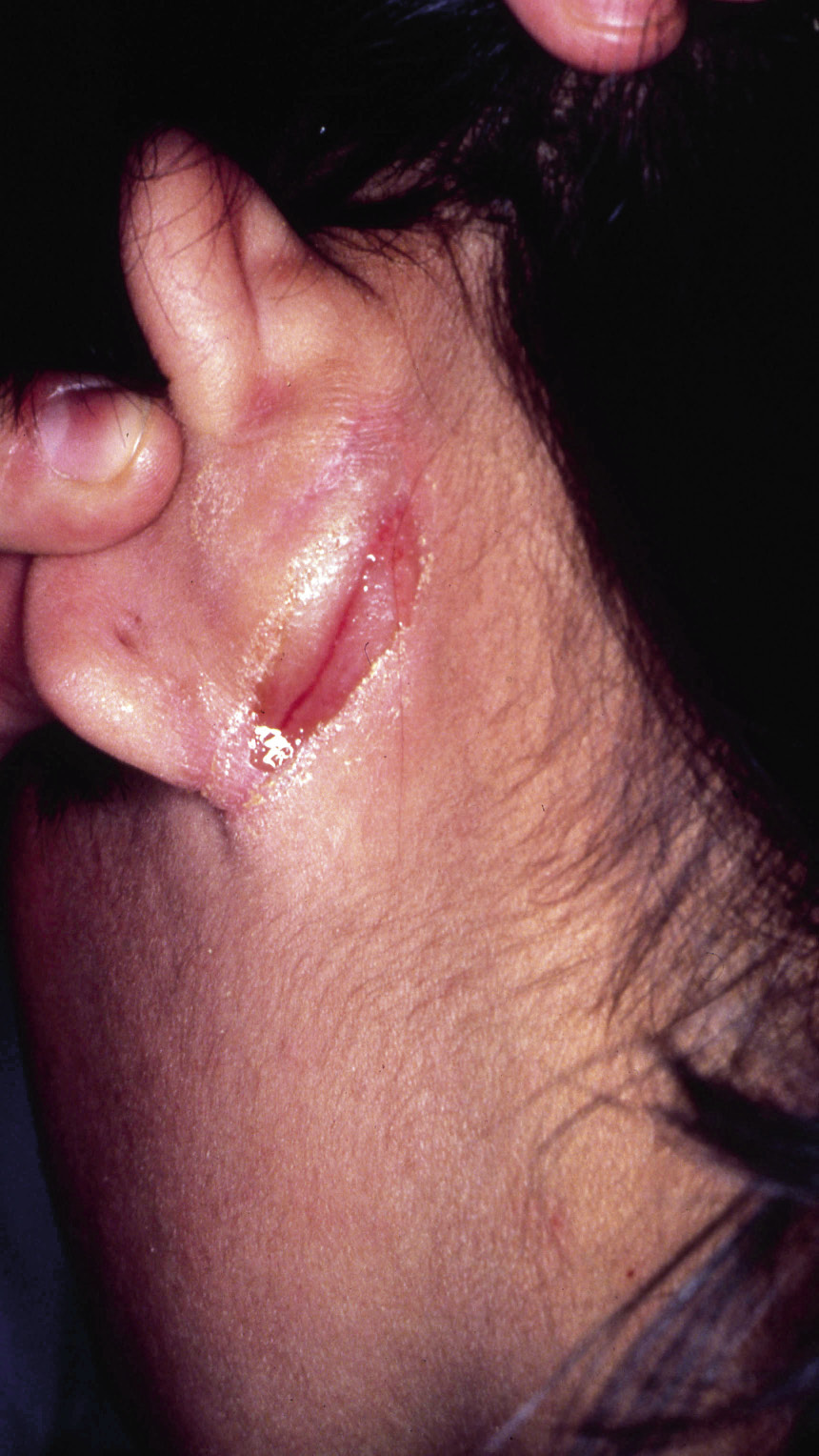
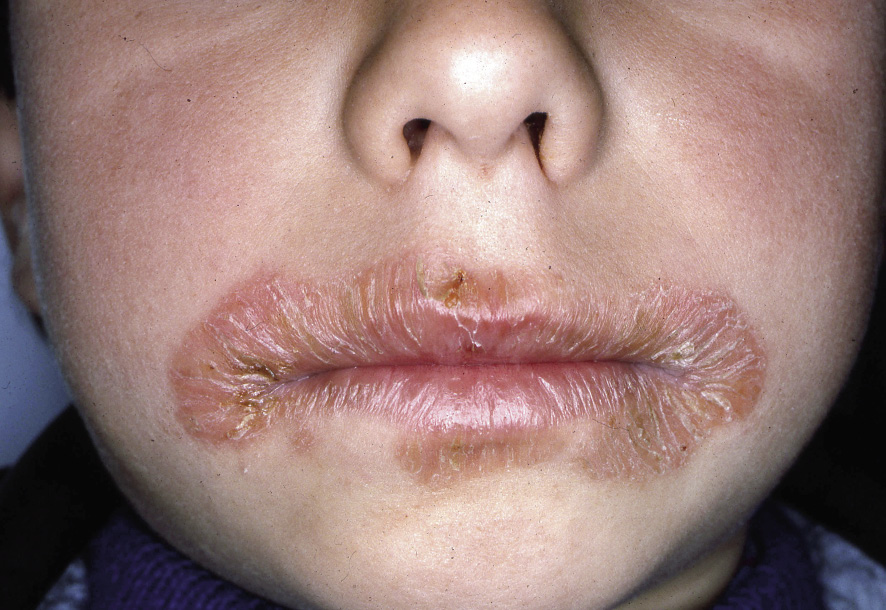
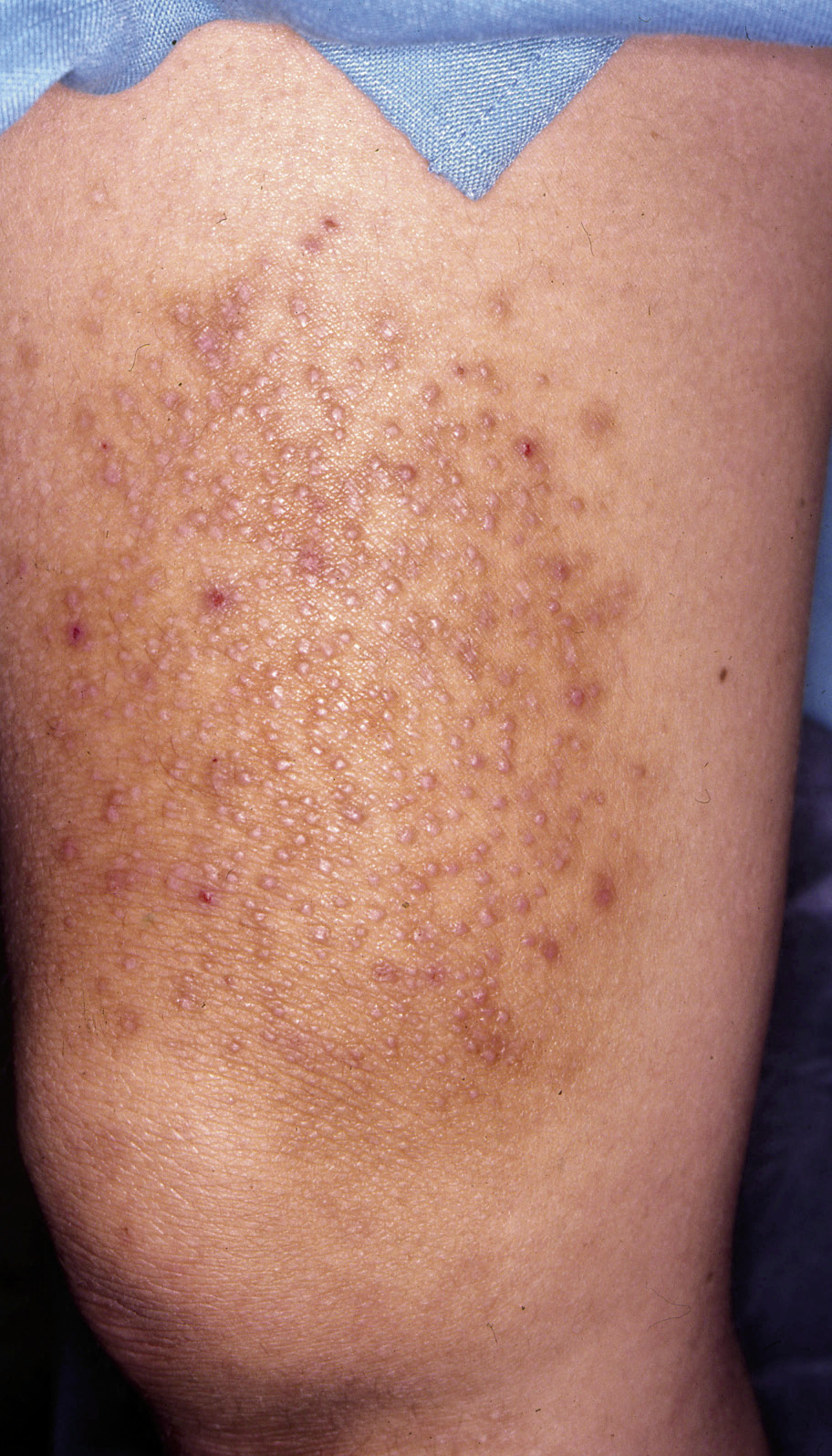
El diagnóstico de la DA es fundamentalmente clínico (Figs. 1-5).
Figura 1. Dermatitis atópica en fase aguda.
Figura 2. Eccema impetiginizado.
Figura 3. Eccema retroauricular con fisuración.
Figura 4. Eccema labial y perioral.
Figura 5. Eccema cronificado por el rascado (neurodermitis).
Característicamente, las lesiones típicas de eccema atópico son áreas de piel eritematosas, a menudo, mal definidas, con intenso picor, pero la distribución y características de las mismas cambia con la edad. Hay también algunas manifestaciones clínicas de la enfermedad, características, que hay que conocer (Tabla II).
Es importante también distinguir entre formas: agudas, subagudas y crónicas, porque el tratamiento tópico es diferente (Tabla II) y conocer otras manifestaciones clínicas de la DA, que son muy frecuentes (Tabla III).
Diagnóstico diferencial
La clínica de la DA es muy característica y la mayoría de los posibles diagnósticos diferenciales pueden excluirse por la historia clínica (sarna, dermatitis seborreica, dermatitis de contacto irritativa e ictiosis).
En algunos casos, puede ser necesaria la realización de biopsias (linfomas cutáneos de células T y psoriasis) o la realización de pruebas de contacto (dermatitis alérgica de contacto o aerotransportada), o estudios especiales (enfermedades fotosensibles, enfermedades por deficiencias del sistema inmune, eritrodermias por otras causas, etc.). Merece la pena comentar que la utilidad de las pruebas de parche atópico que se han utilizado desde hace 20 años para el diagnóstico de alergias alimentarias y aeroalérgenos es muy reducida, porque aunque son específicas, no son sensibles, especialmente en niños con síntomas gastrointestinales relacionados con la alergia alimentaria y, en el caso de los aeroalérgenos que pudieran desencadenar la DA, no hay datos suficientes(7,8).
Valoración de la gravedad de la DA
En los últimos años, la valoración objetiva de la gravedad de la DA se ha vuelto especialmente importante en la clínica diaria, con la aparición de los nuevos tratamientos para la DA grave y su elevado coste, como el criterio fundamental para decidir: primero, su administración (limitada a las formas graves y con falta de respuesta a los tratamientos clásicos); y, después, la continuidad de su administración.
Hay múltiples escalas de valoración de la enfermedad y de la calidad de vida, que se usaban fundamentalmente en investigación y que ahora se han trasladado a la práctica clínica habitual, aunque como ya hemos comentado, solo para los pacientes con cuadros graves de DA(9) (Tabla IV).
Conducta a seguir / Tratamiento
En el manejo de la DA, es tanto o más importante el tratamiento de la enfermedad, como la prevención de los factores que desencadenan los brotes.
Se recomienda: evitar los factores desencadenantes, usar de forma regular cremas emolientes y tratar los brotes, para contener la inflamación subclínica y las reagudizaciones sintomáticas(9,10).
Prevención
En la prevención de los brotes, la educación de los niños y de los padres, aunque consuma mucho tiempo, es particularmente importante. En un estudio sobre un programa educacional dirigido a los propios niños, el 97% de los que recibían educación sobre dermatitis atópica, obtenían una disminución significativa del SCORAD (Scoring Atopic Dermatitis) (Tabla IV) a los 6 meses(11).
Esta educación, además de enseñar las características y evolución probable de la enfermedad y las medidas básicas para prevenir los brotes, debe tener en cuenta que, en una sociedad como la actual, en la que “todo el mundo” opina, hay muchas cosas que no están demostradas y que, por tanto, no hay que hacer. Por ejemplo:
• Solo en pacientes con alergia demostrada a alimentos, las dietas de exclusión han demostrado cierta utilidad, aunque no consiguen controlar al completo los brotes de DA. Únicamente, son fiables las pruebas de provocación a doble ciego y controladas con placebo. Las pruebas de alergia, RAST y prick test, son positivas en más del 40% de los pacientes, sin que ello tenga relevancia clínica, y las pruebas epicutáneas a alimentos, que pueden ser útiles en pacientes con RAST y prick test negativos, aunque específicas, son poco sensibles.
Con la exclusión de los alérgenos más comunes (leche de vaca, huevo, frutos secos, soja y pescado) en niños de alto riesgo o en sus madres durante el embarazo y la lactancia, se ha visto que, aunque se observa una disminución de la prevalencia de atopia durante los primeros 2 años de vida, estas diferencias no se mantienen a largo plazo. Estas dietas tan restrictivas son además muy difíciles de mantener en niños e incluso pueden ser perjudiciales (se ha demostrado, por ej.: el aumento de alergia al cacahuete al retrasar su introducción)(12). Algunos estudios epidemiológicos han mostrado una asociación significativa entre la diversidad de comidas dadas durante el 1er año de vida y la protección frente a la DA(13).
• Se recomienda la lactancia materna exclusiva hasta los 4 meses, como prevención frente a la alergia alimentaria asociada a la DA, pero con un nivel de evidencia C; es decir, solo un escalón por encima de la opinión de los expertos (D). También, se recomienda la utilización de fórmulas de leche hipoalergénicas, cuando no es posible la lactancia materna, en niños con alto riesgo (un pariente de primer grado con síntomas alérgicos), en este caso, con un nivel de evidencia algo mayor (B)(9).
• Los estudios con prebióticos y probióticos no son concluyentes en el momento actual, respecto a si benefician o no(14-16).
• No se deben aceptar tratamientos no recomendados por su médico (porque no han demostrado su eficacia o su seguridad), como: montelukast (antagonista de leucotrienos), capsaicina tópica, ácidos grasos esenciales (tópicos u orales), fitoterapia (hierbas chinas), acupuntura, sangre autóloga, biorresonancia, homeopatía, masaje-terapia o aroma-terapia, baños de sal y balneoterapia, vitaminas y minerales, vitamina B12 en aceite de aguacate, etc.(10).
• No hay evidencias suficientes de que la utilización de antihistamínicos no sedantes reduzcan el picor en pacientes con DA; sin embargo, pueden ser útiles antes del ejercicio, porque disminuyen el picor causado por la sudoración. Tampoco, los antihistamínicos sedantes, como la hidroxicina, parecen controlar los síntomas de la DA, pero al inducir el sueño, pueden mejorar el descanso y reducir el rascado(17).
El cuidado de la piel sana es fundamental en estos pacientes que presentan alteraciones de la barrera cutánea y aumento de la pérdida de agua transepidérmica, por ello: la ducha o el baño deben ser cortos (5 minutos) y con agua tibia; la idea de bañarse solo 1-2 veces por semana no es buena, porque aumenta la proliferación de Staphylococcus Aureus en la piel; se deben utilizar jabones poco irritantes (de avena, hipergrasos, etc.) y de forma limitada (a las superficies que pudieran estar más sucias); el uso de cremas hidratantes o baños de aceite, diariamente, es esencial; y hay que evitar las causas de picor y/o brotes, como son el uso de ropa de lana directamente sobre la piel o de vestidos o calzado que favorezcan la sudoración, así como la exposición a alérgenos clínicamente relevantes (diagnosticados en los test de alergia).
Cuando las recidivas son frecuentes, es útil aplicar entre los brotes, en las áreas habitualmente afectadas por la dermatitis atópica, inhibidores de la calcineurina o corticoides tópicos (dos/tres veces por semana). Es más dudosa la utilidad de los baños de lejía 2 veces por semana (diversos estudios no han mostrado diferencias con los baños solo de agua) y tampoco hay referencias de la utilidad de la mupirocina nasal en la DA(18).
Tratamiento
El tratamiento antiinflamatorio es necesario, incluso en la inflamación subclínica, para intentar restablecer cuanto antes el equilibrio en la piel que ha estado inflamada.
Aunque los brotes de eccema tienden a la curación espontánea en 1-2 semanas, es necesario tratar todos los brotes; porque, si no se hace, tienden a hacerse subintrantes y las lesiones a extenderse. El tratamiento debe adaptarse a las características del paciente y al de las lesiones que presenta y, por ello, vamos a distinguir una serie de situaciones y el tratamiento correspondiente en cada una de ellas(19).
En las formas leves (limitadas a 4-6 localizaciones), el tratamiento antiinflamatorio debe ser tópico (Tablas V y VI) y los corticoides son la primera elección, aunque los inhibidores de la calcineurina han aumentado las opciones cuando las lesiones son subagudas.
En las formas graves (con una extensión importante o resistentes al tratamiento tópico, o con intensa afectación de localizaciones especialmente importantes, como las manos o la cara), es necesario asociar al tratamiento tópico, el tratamiento sistémico: corticoides orales, ciclosporina, metotrexato, azatioprina, micofenolato mofetilo o fototerapia. Desde el 31 de enero de 2020, está aprobado también un fármaco biológico, dupilumab, inicialmente solo para mayores de 12 años, pero desde el 2 de diciembre de 2020 también para mayores de 6 años, que ha demostrado en niños, resultados similares a los de adultos(20).
La colonización microbiana de las lesiones y la superinfección (Staphylococcus Aureus en todo el cuerpo y Malassezia furfur en lesiones de cabeza y cuello) parecen tener un papel en la exacerbación de los brotes y justifica la asociación de antimicrobianos cuando estas situaciones se produzcan.
Tratamientos empleados
Los corticoides tópicos son el tratamiento antiinflamatorio de primera línea en todas las fases de la DA, pero especialmente en las fases agudas. Excepto en las formas crónicas, donde son necesarios corticoides de alta potencia, tipo propionato de clobetasol, en el resto suele ser suficiente con corticoides de baja y media potencia, como clobetasona (baja potencia) o aceponato de metilprednisolona (media-alta potencia).
Los inhibidores de la calcineurina (tacrolimus y pimecrolimus) son la alternativa a los corticoides tópicos y, más comúnmente, un complemento de los mismos para reducir sus efectos adversos. Tacrolimus al 0,1% tiene una potencia antiinflamatoria similar a la de un corticoide de mediana potencia y es claramente superior a pimecrolimus al 1%.
El crisaborol al 2% es un inhibidor de la fosfodiesterasa 4, principalmente de la 4B, que disminuye la liberación de citoquinas proinflamatorias, como: TNF, IL12 e IL23. Se ha aprobado en mayores de 2 años por la EMA (Agencia Europea del Medicamento, 27 de marzo de 2020), aunque no dispone todavía del preceptivo “informe de posicionamiento terapéutico”. Su uso está restringido hasta un máximo del 40% de la superficie corporal y, hasta ahora, no se ha demostrado su superioridad frente a corticoides tópicos o inhibidores de la calcineurina.
Otros tratamientos tópicos que han demostrado su utilidad, como coadyuvantes en el tratamiento del prurito, son: doxepina (antihistamínico), agonistas tópicos de los receptores cannabinoides, antagonistas tópicos de los receptores l-opioides o anestésicos tópicos, pero NO pueden recomendarse de forma rutinaria por sus efectos adversos o porque su uso no está aprobado en la DA.
Los corticoides sistémicos (a dosis no mayores de 0,5 mg/kg/día de dosis inicial) producen mejorías rápidas, aunque temporales, con recidivas rápidas, por lo que se deben usar en cuadros agudos o cuando es precisa una respuesta rápida. Es relativamente frecuente la “corticofobia”, tanto por parte de médicos como de pacientes, lo que exige pararse a explicar las ventajas y desventajas de estos fármacos, así como a un manejo cuidadoso, especificando bien las dosis y los tiempos.
La fototerapia (ultravioleta B de banda estrecha y ultravioleta A1) solo está autorizada a partir de 12 años, pero es muy útil, aunque la necesidad de desplazamientos y las dificultades horarias son un obstáculo, a veces, insuperable.
La ciclosporina es el único fármaco con indicación autorizada en España y el más rápido de acción. Su eficacia es del 53-95%, pero esta eficacia está limitada por sus efectos secundarios a medio y largo plazo (cansancio, hiperplasia gingival, aumento de la tensión arterial, hipertricosis, insuficiencia renal, etc.).
La azatioprina o metotrexato, ambos “off-label” en la DA grave, son fármacos teóricamente con una eficacia similar (26-39% y 42%, respectivamente), que están indicados en DA graves. Son lentos (más de un mes para empezar a ver mejoría), pero generalmente se toleran bien durante meses, aunque exigen controles analíticos periódicos.
Otras alternativas sin indicación aprobada para la DA, son: micofenolato mofetilo, alitretinoína (en eccemas de manos), rituximab, omalizumab, ustekinumab, tofacitinib o apremilast, con respuestas escasas o variables.
La inmunoterapia dirigida contra alérgenos específicos (ácaros del polvo o pólenes) puede considerarse en pacientes sensibilizados con DA grave e historia de exacerbaciones clínicas tras exposición a estos alérgenos.
La psicoterapia puede estar indicada en pacientes en los que las exacerbaciones estén relacionadas con episodios de estrés (exámenes, problemas de relación, etc.).
Dupilumab es un anticuerpo monoclonal humano que se administra de forma subcutánea, bloquea la cadena alfa común a IL4 e IL13 y disminuye no solo la producción de IgE, sino también la respuesta inflamatoria mediada por células Th2. Está indicado en formas graves que no responden a ciclosporina o que presentan alguna contraindicación para su uso. Dupilumab es el primero de una serie de nuevos fármacos, que están saliendo ahora, para el tratamiento de la DA moderada-grave. Algunos ya están aprobados por la EMA, como baricitinib (pendiente del informe de posicionamiento terapéutico de la Agencia Española de Medicamentos y Productos Sanitarios), y otros todavía no están aprobados o están todavía en fases avanzadas de ensayo clínico, que van a cambiar radicalmente el pronóstico de estos pacientes.
Dermatitis seborreica
Introducción
La dermatitis seborreica es un eccema frecuente, autolimitado en la infancia y con una evolución crónica y recidivante en el adulto.
La dermatitis seborreica (DS) es un eccema frecuente, con dos formas clínicas, la del lactante y la del adulto. La primera es autolimitada a los primeros 3 meses de vida; mientras que, la segunda es crónica y, aunque puede ocurrir en la pubertad, su frecuencia es máxima de la cuarta a la sexta décadas de vida. Esta última afecta más a los hombres que a las mujeres.
Etiopatogenia
Existe una relación de la dermatitis seborreica con: sobreproducción de sebo (seborrea), alteraciones en la composición del mismo y levaduras comensales del género Malassezia (Pityrosporum).
La etiopatogenia no es plenamente conocida, pero existe una relación con: sobreproducción de sebo (seborrea), alteraciones en la composición del mismo y levaduras comensales del género Malassezia (Pityrosporum). En los bebés, el sebo se produce durante algunas semanas después del nacimiento, y la forma adulta de la DS no se desarrolla antes de la pubertad, lo que apoya una función de la activación de las glándulas sebáceas por los andrógenos. Sin embargo, los pacientes con DS pueden tener una producción normal de sebo, y los que tienen una producción excesiva de sebo no suelen tener DS. Malassezia Furfur y otras especies pueden aislarse de las lesiones de DS, incluida la DS del lactante, pero no hay una relación entre el número de levaduras y la gravedad de la DS (la piel no afectada puede tener una carga de microorganismos similar a la de las lesiones). Sin embargo, con el tratamiento antimicótico, las lesiones cutáneas mejoran y la cantidad de levaduras desciende y estas vuelven a aumentar cuando se produce una recidiva de la DS. Se ha descubierto también, que un componente principal de la microflora cutánea residente, el Propionibacterium acnes, disminuye enormemente en la DS; así que, podría estar asociada a un desequilibrio de la flora microbiana.
Clínica y diagnóstico
El diagnóstico de la dermatitis seborreica es clínico. Las lesiones, en general poco molestas, se localizan en las áreas con abundancia de glándulas sebáceas y, con menos frecuencia, en pliegues.
Las lesiones son áreas eritematosas, en general bien delimitadas, con sensación untuosa al tacto, y descamación suelta y moderada. Es rara la vesiculación y formación de costras. Se localiza en las áreas con abundancia de glándulas sebáceas (cuero cabelludo, cara, orejas, región preesternal) y, con menos frecuencia, en pliegues, pero pueden producirse formas generalizadas e incluso eritrodérmicas.
Dermatitis seborreica del lactante
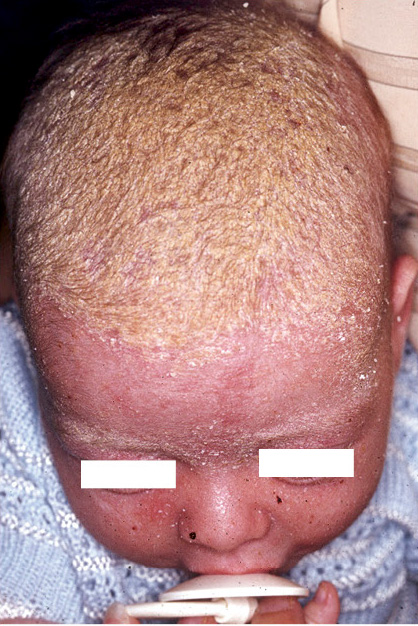
Suele comenzar una semana después del nacimiento y puede persistir durante varios meses. Al principio, son escamas grasientas, adheridas al vértex y a la fontanela anterior, que pueden extenderse a todo el cuero cabelludo (costra láctea) y a la cara (Fig. 6).
Figura 6. Dermatitis seborreica. Costra láctea.
Las lesiones de las axilas, los pliegues inguinales, el cuello y los pliegues retroauriculares suelen estar más inflamadas, aunque bien delimitadas. Las lesiones pueden sobreinfectarse por Candida y, más raramente, por Streptococcus del grupo A. Puede desarrollarse una erupción diseminada de lesiones eritemato-descamativas con aspecto psoriasiforme, después de una DS intensamente inflamatoria o sobreinfectada, especialmente en la zona del pañal.
Dermatitis seborreica del adulto
En cuero cabelludo, las lesiones se localizan predominantemente en las regiones parietales y el vertex, pero también en región occipital, con un patrón más difuso. En la cara, las lesiones se localizan de forma simétrica en: pliegues naso-genianos, cejas y pliegues retroauriculares, pero también en: la frente, en el borde de implantación del cuero cabelludo, en la región de la glabela y, en ocasiones, en la cara posterior del cuello, también en el borde de implantación del pelo. Las lesiones no suelen mostrar infiltración y la descamación es fina y está suelta. Las lesiones en el tronco, se localizan en el área preesternal (en hombres) y en el centro de la espalda donde suelen adoptar una morfología petaloide. Son más raras en axilas. Los brotes de 1-2 semanas de duración, son más o menos recidivantes y, frecuentemente, están relacionadas con el estrés. El prurito suele ser moderado, pero puede ser intenso y pueden observarse foliculitis (por Pityrosporum) e inflamación de las glándulas de Meibomio en el tarso palpebral (meibomitis).
Diagnóstico diferencial
El diagnóstico diferencial fundamental de la dermatitis seborreica es con la dermatitis atópica.
La DS del lactante se diferencia de la dermatitis atópica por: su inicio más temprano, el patrón de distribución diferente y la ausencia de prurito, irritabilidad e insomnio. La dermatitis irritativa del pañal, está limitada al área del pañal y, habitualmente, no afecta los pliegues. La candidiasis de la zona del pañal afecta preferentemente a los pliegues, con fisuración ocasional, y suele haber lesiones satélite alrededor de las lesiones principales. En la psoriasis invertida de la zona del pañal, las lesiones están más infiltradas y delimitadas, y ayuda la presencia de lesiones típicas en otras localizaciones.
La seudotiña amiantácea (escamas gruesas similares al amianto, que se adhieren a mechones de pelo del cuero cabelludo, de forma irregular) y que podría confundirse con la costra láctea, ocurre en la dermatitis atópica y en la psoriasis.
Otros trastornos infrecuentes, que también deben considerarse en el diagnóstico diferencial, sobre todo, en las formas resistentes al tratamiento, son: la histiocitosis de células de Langerhans, la acrodermatitis enteropática y la enfermedad de Leiner. Esta última, que antes se consideraba la variante máxima de la DS del lactante, hoy en día, se considera una eritrodermia en el contexto de una inmunodepresión subyacente.
Otro diagnóstico diferencial, a considerar, sobre todo, en niños prepúberes, y especialmente de raza negra, con descamación en el cuero cabelludo, es una tiña de la cabeza (por Trichophyton tonsurans).
La DS del adulto, cuando es extensa y grave, obliga a descartar la infección por el VIH. El principal diagnóstico diferencial es con la psoriasis en cuero cabelludo. En esta, las lesiones son placas eritematosas cubiertas por escamas más blancas y adheridas, sobre todo, en la región occipital y regiones temporales.
La pitiriasis simple (caspa) se define como una descamación difusa, más o menos intensa, del cuero cabelludo y barba, pero sin eritema ni irritación significativos. Este trastorno, frecuente, puede considerarse la forma más leve de dermatitis seborreica del cuero cabelludo.
Tratamiento
El lavado de las lesiones con un champú de ketoconazol 2% y la aplicación de una crema emoliente, son suficientes en la mayoría de los casos.
Tanto la DS del lactante como la del adulto responden satisfactoriamente al lavado con champús suaves y a la aplicación de emolientes. La crema o el champú de ketoconazol (al 2%) o ciclopirox olamina está indicada en los casos más extensos o persistentes. En las fases más agudas, pueden utilizarse ciclos cortos de corticoides tópicos de baja potencia o inhibidores de la calcineurina (aunque su uso no está aprobado en esta indicación) para suprimir la inflamación.
Papel del pediatra de Atención Primaria
El papel del pediatra de Atención Primaria está en reconocer las formas típicas y menos típicas de ambas enfermedades, para poder tratarlas cuando se trate de formas leves o moderadas y remitirlas al especialista en las formas más graves, o que no respondan al tratamiento. En el caso de la DA, su papel es fundamental en la prevención de los brotes, en la educación de los pacientes y sus familias (no hay que olvidar que se trata de una enfermedad a menudo familiar) y en el despistaje de las otras enfermedades que se asocian con la DA (asma, alergia ambiental, etc.).
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.** Eichenfield LF, Tom WL, Chamlin SL, Feldman SR, Hanifin JM, Simpson EL, et al. Guidelines of care for the management of atopic dermatitis: Section 1. Diagnosis and assessment of atopic dermatitis. J Am Acad Dermatol. 2014; 70: 338-51.
2.* Spergel JM. Epidemiology of atopic dermatitis and atopic march in children. Immunol Allergy Clin N Am. 2010; 30: 269-80.
3.* Sicras-Mainar A, Navarro-Artieda R, Sánchez L, Sastre J. Prevalence of Severe Atopic Dermatitis in Adults in 3 Areas of Spain. J Investig Allergol Clin Immunol. 2018; 28: 195-97.
4.* Sicras-Mainar A, Navarro-Artieda R, Carrascosa Carrillo JM. Impacto económico de la dermatitis atópica en adultos: estudio de base poblacional (estudio IDEA). Actas Dermo-sifiliográficas. 2018; 109: 35-46.
5.** Patrick GJ, Archer NK, Miller LS. Which Way Do We Go? Complex Interactions in Atopic Dermatitis Pathogenesis. J Investig Dermatol. 2021; 14: 274-84.
6.** Hanifin JM, Rajka G. Diagnostic features of atopic dermatitis. Acta Dermatol Venereol. 1980; 92: 44-7.
7.* Luo Y, Zhang G-Q, Li Z-Y. The diagnostic value of APT (atopy patch test) for food allergy in children: a systematic review and meta-analysis. Pediatric Allergy and Immunology. 2019; 30: 451-61.
8.* Dickel H, Kuhlmann L, Bauer A, Bircher AJ, Breuer K, Fuchs T. Atopy patch testing with aeroallergens in a large clinical population of dermatitis patients in Germany and Switzerland, 2000-2015: a retrospective multicentre study. J Eur Acad Dermatol Venereol. 2020; 34: 2086-95.
9.*** Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018; 32: 657-82.
10.*** Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol. 2018; 32: 850-78.
11.** Heratizadeh A, Werfel T, Wollenberg A, Abraham S, Sybylle PH, Schnopp C, et al. Effects of structured patient education in adult atopic dermatitis: Multi-center randomized controlled trial. J Allergy Clin Immunol. 2017; 140: 845-53.
12.* Du Toit G, Roberts G, Sayre PH, Bahnson HT, Radulovic S, Santos AF, et al. Randomized trial of peanut consumption in infants at risk for peanut allergy. N Eng J Med. 2015; 372: 803-13.
13.** Roduit C, Frei R, Loss G, Büchele G, Weber J, Depner M, et al. Development of atopic dermatitis according to age of onset and association with early-life exposures. J Allergy Clin Immunol. 2012; 130: 130-6e5.
14.* Fölster-Holst R, Müller F, Schnopp N, Abeck D, Kreiselmaier I, Lentz T, et al. Prospective, randomized controlled trial on Lactobacillus rhamnosus in infants with moderate to severe atopic dermatitis. Br J Dermatol. 2006; 155: 1256-61.
15.* Rosenfeldt V, Benfeldt E, Nielsen SD, Michaelsen KF, Jepessen DL, Valerius NH, et al. Effect of probiotic Lactobacillus strains in children with atopic dermatitis. J Allergy Clin Immunol. 2003; 111: 389-95.
16.* Grüber C. Probiotics and prebiotics in allergy prevention and treatment: future prospects. Exp Rev Clin Immunol. 2012; 8: 17-9.
17.** He A, Feldman SR, Fleischer AB. An assessment of the use of antihistamines in the management of atopic dermatitis. J Am Acad Dermatol. 2018: 79: 92-6.
18.** Hon KL, Tsang YCK, Lee VWY, Pong NH, Ha G, Lee ST, et al. Efficacy of sodium hypochlorite (bleach) baths to reduce Staphylococcus aureus colonization in childhood onset moderate-to-severe eczema: A randomized, placebo-controlled cross-over trial. J Dermatolog Treat. 2016; 27: 156-62.
19.*** Paller AS, Siegfried EC, Vekeman F, Gadkari A, Kaur M, Mallya UG, et al. Treatment patterns of pediatric patients with atopic dermatitis: A claims data analysis. J Am Acad Dermatol. 2020; 82: 651-60.
20.** Igelman S, Kurta AO, Sheikh U, McWilliams A, Armbrecht E, Jackson Cullison SR, et al. Off-label use of dupilumab for pediatric patients with atopic dermatitis: A multicenter retrospective review. J Am Acad Dermatol. 2020; 82: 407-11.
21. Prieto-Torres L, Torrelo A. Dermatitis atópica y otras erupciones eccematosas. Pediatr Integral. 2016; XX(4): 216-26.
Bibliografía comentada
- Patrick GJ, Archer NK, Miller LS. Which Way Do We Go? Complex Interactions in Atopic Dermatitis Pathogenesis. J Investig Dermatol. 2021; 14: 274-84.
Resume el conocimiento actual sobre la etiopatogenia de la dermatitis atópica.
- Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part I. J Eur Acad Dermatol Venereol. 2018; 32: 657-82.
- Wollenberg A, Barbarot S, Bieber T, Christen-Zaech S, Deleuran M, Fink-Wagner A, et al. Consensus-based European guidelines for treatment of atopic eczema (atopic dermatitis) in adults and children: part II. J Eur Acad Dermatol Venereol. 2018; 32: 850-78.
Reflejan el consenso europeo actual, en el tratamiento de la dermatitis atópica.
- Paller AS, Siegfried EC, Vekeman F, Gadkari A, Kaur M, Mallya UG, et al. Treatment patterns of pediatric patients with atopic dermatitis: A claims data analysis. J Am Acad Dermatol. 2020; 82: 651-60.
Pone en evidencia cómo hacemos las cosas y lo que tenemos que mejorar.
| Caso clínico |
|
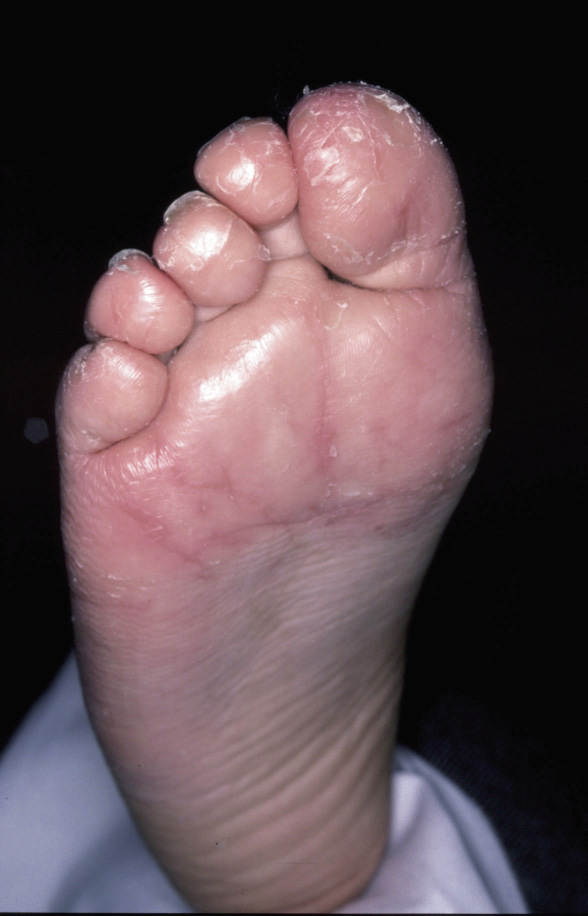
Paciente de 11 años que, desde hace meses, nota la aparición de fisuras en los dedos 1º y 2º de ambos pies. La exploración queda reflejada en la figura 7.
Figura 7. |









 Atopic dermatitis and seborrheic dermatitis
Atopic dermatitis and seborrheic dermatitis 