 |
| Temas de FC |
J.T. Ramos Amador, A. Berzosa Sánchez, I. Callejas Caballero, M. Illán Ramos
Unidad de Enfermedades Infecciosas en Pediatría. Hospital Clínico San Carlos. Madrid
| Resumen
La tuberculosis es una de las 10 primeras causas de mortalidad en el mundo y supone la primera por un único microorganismo infeccioso. En los últimos años, se ha observado en España una disminución de incidencia en niños; si bien, se han producido importantes cambios epidemiológicos que han contribuido al aumento de cepas resistentes. En el niño, la tuberculosis se considera un evento centinela, que indica transmisión comunitaria reciente desde un adulto bacilífero. Todos los niños de riesgo deberían ser estudiados y clasificados como: expuestos, infectados o enfermos. En la infancia hay mayor probabilidad de progresión de infección a enfermedad y riesgo de diseminación. La inespecificidad de la clínica, menor rentabilidad de las pruebas microbiológicas y barreras terapéuticas complican el manejo óptimo de la tuberculosis en niños. La tuberculina y la radiografía (Rx) de tórax continúan siendo las piedras angulares diagnósticas. Recientes avances incluyen técnicas de IGRA (ensayo de liberación de interferón-gamma), que aportan mayor especificidad, diferenciando infecciones por micobacterias atípicas y vacunación con BCG, y técnicas de PCR en muestras clínicas, que aumentan la rentabilidad respecto a la tinción y permiten la detección rápida de resistencias. Es importante continuar con vigilancia activa de forma coordinada, con medicina preventiva y servicios de adultos de todos los contactos domiciliarios o escolares para intervenir eficazmente en los distintos eslabones de la cadena epidemiológica. |
| Abstract
Tuberculosis is one of the top 10 causes of death worldwide and the leading cause of death from a single infectious agent. Although the incidence of tuberculosis has decreased in recent years in Spain, important epidemiological changes have contributed to a rise in resistant strains. Tuberculosis in childhood reflects recent transmission from an infected contagious adult and ongoing transmission. All children at risk should be evaluated and classified as exposed, latently infected or ill. In children there is a higher likelihood of progression from latency to disease, as well as an increased risk of dissemination. The unspecificity of clinical symptoms, lower yield of microbiological diagnosis, along with the therapeutical barriers in the pediatric age challenge the optimal management of tuberculosis in children. Tuberculin skin test and chest-X-ray remain the cornerstone in diagnosis. Recent advances include interferon-gamma release assay (IGRA), that increase specificity and permit differentiation from infection due to atypical mycobacteria and BCG vaccination, PCR techniques in clinical samples increasing the yield compared to smear and permitting a faster diagnosis turnaround time as well as detection of resistant strains. To efficiently intervene in all the different steps of the epidemiological chain, it is crucial to maintain active surveillance to all close contacts in coordination with adult and preventive medicine facilities. |
Palabras clave: Tuberculosis; Niños; Revisión
Key words: Tuberculosis; Childhood; Review.
Pediatr Integral 2021; XXV (2): 76 – 90
Tuberculosis pulmonar en Pediatría
Introducción
La tuberculosis (TB) continúa siendo la principal causa de mortalidad infecciosa en el mundo y un grave problema de salud pública en países occidentales.
La tuberculosis (TB) ha acompañado al ser humano desde la antigüedad y continúa siendo un gravísimo problema de salud pública en todo el mundo. Aun con los avances experimentados en los últimos años, la incidencia global en la edad pediátrica es difícil de estimar por la inespecificidad de la clínica que lleva a: un escaso reconocimiento de la enfermedad, la dificultad para llegar a un diagnóstico etiológico y la infranotificación en numerosos países(1).
Las manifestaciones clínicas y radiológicas de TB en niños son menos específicas que en el adulto. La confirmación microbiológica de la enfermedad se ve limitada por la naturaleza paucibacilar de la enfermedad en niños. En general, los cultivos y las técnicas moleculares rápidas son positivas en una minoría de niños con TB. Además, en países subdesarrollados, con frecuencia existen dificultades logísticas para obtener muestras adecuadas en niños pequeños. Sin embargo, en la era actual de aumento de riesgo de resistencias, existe una necesidad creciente de confirmación microbiológica para la toma de decisiones terapéuticas adecuadas, que se ve facilitada por el desarrollo de técnicas de diagnóstico molecular (PCRs) que permiten, no solo mayor rapidez diagnóstica, sino detección de multirresistencias.
Por otro lado, en los niños que inician tratamiento, se añade la dificultad de dosificación por la falta de preparados galénicos apropiados y coformulaciones, fáciles de administrar, que complican la dificultad de adherencia y de monitorización. Los principios del tratamiento son los mismos que en adultos; si bien, en niños la tolerancia y respuesta al tratamiento son mejores, incluido en cepas resistentes.
Etiología
La tuberculosis es causada por Mycobacterium tuberculosis (MTB), de lento crecimiento, que puede quedar en estado de latencia o instaurar un cuadro clínico inespecífico progresivo.
La TB es una de las enfermedades más antiguas de las que se tiene constancia, habiéndose detectado signos de la enfermedad en el Neolítico; si bien, no se convirtió en un grave problema epidemiológico hasta la revolución industrial, cuando las condiciones de hacinamiento favorecieron su propagación. El término tuberculosis fue acuñado por Schönlein en 1839, basado en la palabra tubérculo, en referencia a las lesiones características de la enfermedad. La bacteria causal, MTB, descrita por Koch en 1882, pertenece al complejo M. tuberculosis complex, que abarca, al menos, 9 especies, que incluyen: M. bovis, M. africanum, M. canetti y M. microti. Estas especies son también responsables de la TB humana, pero con mucho menor relevancia desde el punto de vista clínico y de salud pública. El ser humano es el único reservorio de M. tuberculosis, aunque numerosos animales son susceptibles a la infección(2).
MTB es un bacilo ácido-alcohol resistente, inmóvil, no esporulado, que mide de 0,8 a 4 micras, con alto contenido de lípidos, responsable de varias de sus características biológicas, como la dificultad para ser destruido por los macrófagos. Tiene un metabolismo aeróbico estricto, con desarrollo óptimo a 35-37ºC, y su crecimiento depende del oxígeno y del pH circulante. Es muy resistente a las condiciones de frío, congelación y desecación. Por el contrario, es muy sensible al calor, luz solar y ultravioleta. Su multiplicación es muy lenta, se divide cada 15-20 horas, y crece en medios selectivos entre 3 y 8 semanas. Este lento crecimiento justifica su clínica inespecífica y la lenta instauración del cuadro clínico. Ante circunstancias adversas, puede entrar en estado de latencia y permanecer en esas condiciones durante años(2).
Epidemiología
La tuberculosis en niños supone entre el 10-20% del total de casos en el mundo, mientras que en España representa el 6%. Se ha producido un aumento de cepas resistentes, y en España la resistencia a isoniacida (INH) es algo superior al 4%.
La TB continúa siendo la principal causa de mortalidad infecciosa en el mundo. En Pediatría, ha sido ignorada durante décadas, debido: a la menor cantidad de casos pediátricos en comparación con el adulto, a su escasa capacidad infectiva, a las limitaciones para establecer un diagnóstico y a su vinculación con la pobreza. Aun con la dificultad en determinar la incidencia de TB en la infancia, recientemente se han hecho grandes avances para cuantificar con mayor precisión la carga de la enfermedad en los niños a escala global.
En países desarrollados, la TB infantil supone menos del 5% del total de casos, mientras que en países subdesarrollados representa entre un 10-20%. Basado en extrapolaciones de datos de adultos en relación a la positividad de los cultivos de esputo, hubo gran infraestimación de la OMS en 2012, pues no se tuvieron en cuenta algunos ajustes necesarios por el infradiagnóstico de la población pediátrica. Por ello, en subsiguientes estimaciones con modelos matemáticos, concluyen que se producen más de 1 millón de casos de TB en niños por año en el mundo, lo cual supone aproximadamente un 12% del total de 10 millones de casos anuales estimados en adultos en 2019(1). A su vez, la mortalidad pediátrica por TB está pobremente cuantificada. La OMS estima que se producen al año 210.000 muertes por TB en niños, de las cuales la cuarta parte ocurren en población VIH, mortalidad global superior al 14% estimado en el adulto(1). Por otro lado, la OMS estima que el 23% de la población mundial está infectada por MTB. Aunque el impacto es mucho mayor en países pobres, todavía continúa siendo un problema de salud pública de gran importancia en los países occidentales. No obstante, se han experimentado avances recientes muy notables, con los que, si continúan, la OMS pretende disminuir un 80% la incidencia y un 90% la mortalidad por TB para 2030, mediante la estrategia End TB; si bien, la pandemia de COVID-19 amenaza con revertir estos progresos e impedir alcanzar este objetivo(1).
En Europa, existe gran variabilidad entre países, tanto en incidencia como en proporción de cepas resistentes. La prevalencia de resistencias ha aumentado en los últimos años, sobre todo, en países de la Europa del Este, donde se estima que la cuarta parte de los nuevos diagnósticos en niños se producen por cepas resistentes a INH(3). En países desarrollados, la inmigración procedente de zonas endémicas contribuye a mantener la prevalencia e incidencia de TB, con riesgo de TB-resistente y de transmisión de MTB al niño, que es más vulnerable a formas graves.
En España, la incidencia de TB es variable y se estima en 9,4 casos por 100.000 habitantes/año, ocurriendo el 6% en menores de 15 años(4). En niños, aunque ha habido un ligero descenso en los últimos años, aún se diagnostican formas diseminadas, lo que indica transmisión reciente. Puesto que en la mayoría de los casos pediátricos, la enfermedad ocurre en el primer año tras la primoinfección, la TB infantil se considera un evento centinela, que refleja transmisión en la comunidad desde un adulto bacilífero(4). Por ello, el número de niños enfermos o infectados es un fiel indicador de la situación epidemiológica en la comunidad. En España, la proporción de cepas resistentes a INH en población pediátrica es algo mayor del 4%, especialmente en población inmigrante(5), lo cual tiene implicaciones terapéuticas.
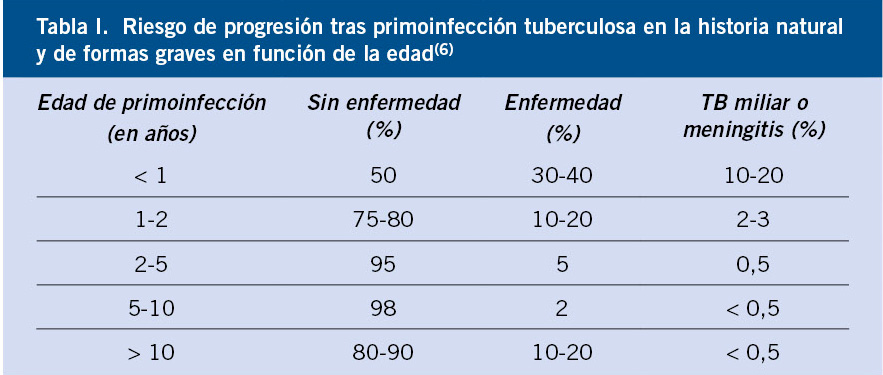
El riesgo de contagio depende, sobre todo, de la prevalencia de TB en la comunidad, y de la frecuencia, intensidad y proximidad de los contactos. Los niños más susceptibles son: aquellos que provienen de zonas endémicas, los que están infectados por VIH u otro tipo de inmunosupresión o malnutrición, y los que conviven en condiciones precarias sociosanitarias con poblaciones de riesgo. Tras primoinfección reciente, los lactantes y niños representan una población especialmente susceptible. A menor edad, mayor riesgo de desarrollo de TB extrapulmonar y formas diseminadas, que incluyen TB miliar y meningitis(4-6). Se estima que hasta el 50% de los menores de un año desarrollarán enfermedad activa tras la primoinfección y entre un 10-20% de ellos TB miliar o meningitis. Los niños en edad escolar desarrollarán la enfermedad en una proporción mucho menor (<5%) y, excepcionalmente, se complicarán con formas diseminadas. Los adolescentes, en cambio, aunque también excepcionalmente presentan formas diseminadas, con frecuencia (10-20%) son sintomáticos, habitualmente con clínica respiratoria y signos sistémicos(6). En la tabla I, se detalla el riesgo de progresión en la historia natural de la enfermedad y de formas graves en función de la edad en niños inmunocompetentes(6).
Para alcanzar el objetivo global de la OMS de “cero tuberculosis en el niño”, se necesitan esfuerzos coordinados para mejorar el reconocimiento y el diagnóstico de la enfermedad, así como mejorar la notificación y el tratamiento(7). Es imprescindible atajar todos los escalones de la cadena epidemiológica que permitan evitar nuevas infecciones e identificar a los potenciales transmisores. En ausencia de tratamiento, los niños infectados constituyen el reservorio de la enfermedad futura. Se estima que por cada adulto infectado bacilífero, se infecta una media de entre 8 y 12 casos secundarios. De los infectados, aproximadamente el 90% permanecerán como TB latente y el 10% desarrollarán enfermedad a lo largo de su vida. De ellos, la mitad desarrollarán la enfermedad en los primeros dos años desde el contagio y el resto a lo largo de su vida, cerrándose el círculo epidemiológico. En situaciones de inmunosupresión, se altera la balanza hacia una mayor progresión de la enfermedad en sujetos con infección latente, como ocurre en población con coinfección VIH, en la que se estima que el riesgo de progresión a enfermedad es del 10% anual, lo que provoca un incremento marcado en la incidencia en la comunidad(8). Por otro lado, aunque el riesgo de recurrencia de TB existe, el genotipado de cepas permite distinguir reinfección y recidiva, que es mucho más frecuente por mala adherencia al tratamiento. En adultos inmunocompententes, se estima que la infección previa previene de enfermedad hasta en el 80% de los casos, tras la exposición(4).
Cualquier situación que disminuya la inmunidad del sujeto infectado, desequilibrará la balanza hacia una mayor progresión de la enfermedad y formas diseminadas, con aumento del riesgo de transmisión al niño. Todos los niños en contacto con el bacilo de la TB deberán ser estudiados y clasificados como expuestos, infectados o enfermos. Asimismo, todos los niños procedentes de áreas de alta prevalencia deben ser cribados mediante la prueba de la tuberculina, debiendo considerarse la repetición periódica de la misma(9,10).
Fisiopatología
La inmunidad innata y adaptativa, sobre todo, la inmunidad celular, son esenciales para contener la infección, lo que ocurre en la mayoría de sujetos. Los niños e inmunodeprimidos tienen mayor riesgo de enfermedad y de diseminación.
Tras la exposición a un sujeto bacilífero, se estima que solo el 30% de las personas expuestas resultan infectadas y, de estas, el 90% controlan la infección. Se desconocen las razones por las cuales la mayoría de los expuestos no se infectan. La TB es una enfermedad que precisa una convivencia estrecha y mantenida para su transmisión por inhalación, habitualmente más de 4 horas diarias en el mismo habitáculo con un enfermo bacilífero(11), aunque se han descrito infecciones tras solo 15-20 minutos de exposición ocasional a individuos altamente bacilíferos(12). Al toser o estornudar, las gotas cargadas de bacilos se dispersan en el aire, quedando suspendidas durante horas, si bien, solo las más pequeñas (<5 micras, <10 bacilos) tendrán capacidad infectiva. Los enfermos bacilíferos eliminan la micobacteria por secreciones respiratorias, lo que se refleja en tener una baciloscopia de esputo positiva(11).
MTB es un patógeno intracelular y, por tanto, la inmunidad celular tiene un papel fundamental en la contención de la infección. Por ello, los niños con alteración de la inmunidad celular, entre los que se incluyen niños con: VIH, inmunodeficiencias primarias, tratamiento esteroideo prolongado o con terapias biológicas, tienen un riesgo muy aumentado de desarrollar la enfermedad(13,14).
Tras la primoinfección, MTB llega al pulmón, donde se produce su fagocitosis por macrófagos alveolares, que constituyen la primera y predominante línea de defensa frente al bacilo. Los macrófagos infectados, al unirse con lisosomas, forman un complejo de fagolisosoma, dentro del cual se produce una actividad bactericida que incluye radicales de nitrógeno y oxígeno que suprimen y matan a MTB, impidiendo su crecimiento. Esta respuesta inicial de inmunidad innata es suficiente en la mayoría de los casos, para aclarar la carga bacilar inicial de manera efectiva. En otros sujetos esta respuesta es inadecuada y el bacilo continúa multiplicándose dentro del macrófago, extendiéndose por el intersticio pulmonar hasta los ganglios linfáticos regionales, hiliares y mediastínicos, activando una respuesta inmune adaptativa en el foco de infección, en el curso de semanas, en la que es esencial el papel de linfocitos B y, sobre todo, T de CD4 y CD8 con producción de IFN-γ. Para controlar este foco, se forman granulomas compuestos de: macrófagos, células dendríticas, linfocitos y células epiteliales. En la mayoría de las ocasiones, estos granulomas son suficientes para controlar, pero no para eliminar la carga bacilar que puede persistir en este microambiente durante décadas. Esto se considera una infección de tuberculosis latente (ITBL) y se define como la evidencia de sensibilización inmune a la micobacteria sin signos clínicos de la enfermedad.
Sin embargo, en algunos casos, especialmente en niños pequeños e inmunodeprimidos, la inmunidad adaptativa es insuficiente para controlar la infección y la micobacteria continúa replicándose y la infección progresa, dando lugar a enfermedad pulmonar o diseminándose como enfermedad extrapulmonar, produciendo una forma de TB conocida como primoinfección tuberculosa, en los primeros meses tras el contagio(4,11,15). En la figura 1, se refleja la posible evolución tras la exposición a MTB.
Figura 1. Posible evolución tras la exposición a Mycobacterium tuberculosis (MTB)(15)
Los niños eliminan escasos bacilos a través de secreciones respiratorias, por lo cual muy excepcionalmente serán bacilíferos y, de ahí, su escasa contagiosidad. Los niños habitualmente se contagian tras contacto con adultos bacilíferos y no por contacto con otro niño con TB(11). Sin embargo, en adolescentes y adultos jóvenes, que se infectaron en la primera infancia, puede haber reactivaciones y, especialmente, si presentan formas pulmonares cavitadas, pueden ser altamente bacilíferos y contagiosos(4).
Clínica
Todos los niños en contacto con el bacilo tuberculoso deberán ser clasificados en: expuestos, infectados o enfermos. Es necesario siempre un alto grado de sospecha por la inespecificidad de la clínica y radiología.
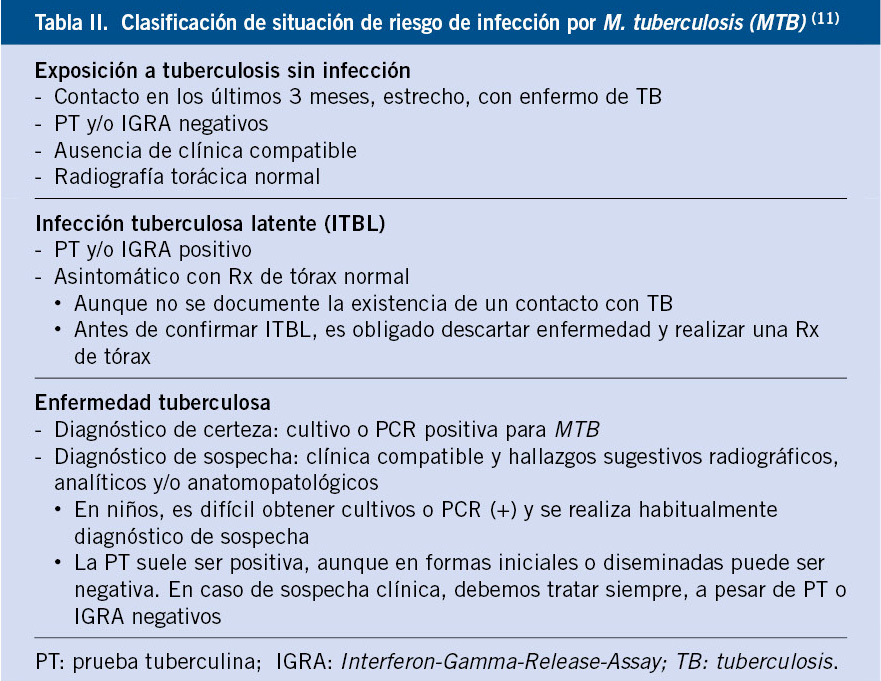
En el manejo clínico de la TB es imprescindible definir las diferentes situaciones en las que se encuentra el niño. Todos los niños en contacto con el bacilo tuberculoso deberán ser clasificados en: expuestos, infectados o enfermos (Tabla II), ya que cada situación determina una actitud diagnóstico-terapéutica diferente.
Además, es necesario conocer el contexto epidemiológico de resistencias y definir la situación en: TB susceptible a INH, si la prevalencia de resistencia en la comunidad es inferior al 4%; y resistente, si es igual o superior a esta proporción, así como de multirresistencia(7).
Se considera exposición a TB: cuando existe un contacto reciente y estrecho con adulto enfermo de TB bacilífera, estando el niño clínicamente asintomático, con Rx de tórax normal y prueba de la tuberculina (PT) y/o de inmunodiagnóstico (interferón-gamma release assay: IGRA) negativas. Se considera ITBL: cuando existe evidencia inmunológica de infección por MTB (PT y/o IGRA positivo), en un paciente clínicamente asintomático y con Rx de tórax normal o no compatible con TB. Por el contrario, se considera enfermedad tuberculosa (ETB): si existe clínica compatible y hallazgos radiológicos, analíticos o anatomo-patológicos sugestivos y/o microbiología positiva para MTB. El diagnóstico de certeza lo proporciona un cultivo o una PCR positiva para MTB, aunque con frecuencia en niños, no se alcanza la confirmación microbiológica (formas paucibacilares), realizándose habitualmente un diagnóstico de sospecha, apoyado en una historia epidemiológica, con o sin confirmación en la fuente, que suele ser un adulto(11).
La presentación clínica de la ETB es muy variable, desde formas oligosintomáticas (síntomas constitucionales inespecíficos o respiratorios) hasta síntomas de afectación grave. La localización más frecuente es la pulmonar, que supone un 80-92% en nuestro medio(16,17). La TB en el niño se caracteriza por mayor componente adenopático mediastínico que de consolidación pulmonar, a diferencia del adulto(4). Predominan los síntomas respiratorios (tos crónica, dificultad respiratoria, dolor torácico) y constitucionales (fiebre, sudoración, pérdida de peso), si bien, su presentación es muy variable y depende de la edad. En lactantes, son frecuentes: fiebre, tos y disnea, así como auscultación alterada con estertores, hipoventilación e incluso sibilancias. Las sibilancias que no responden a broncodilatadores, pueden representar compresión de vía aérea por adenopatías mediastínicas aumentadas de tamaño, lo que puede ocurrir también en casos de estridor, que se puede poner de manifiesto o empeorar al inicio del tratamiento como reacción paradójica (Fig. 2).
Figura 2. Niño de 7 años con estridor por ensanchamiento mediastínico por adenopatías hiliares. A. Al diagnóstico. B. Reacción paradójica a 2 semanas de inicio de tratamiento. Afilamiento de bronquio principal izquierdo.
En edad escolar, es infrecuente que haya sintomatología(6). En el adolescente, es más común la presentación con fiebre y síntomas constitucionales. En ocasiones, la TB puede debutar de manera similar a una neumonía bacteriana, presentando consolidación lobar y/o derrame pleural. Las adenopatías de gran tamaño también pueden erosionar hacia el interior, produciéndose una TB endobronquial y cursar con dificultad respiratoria. La figura 3 muestra diferentes formas de presentación de TB pulmonar en la infancia y adolescencia(4).
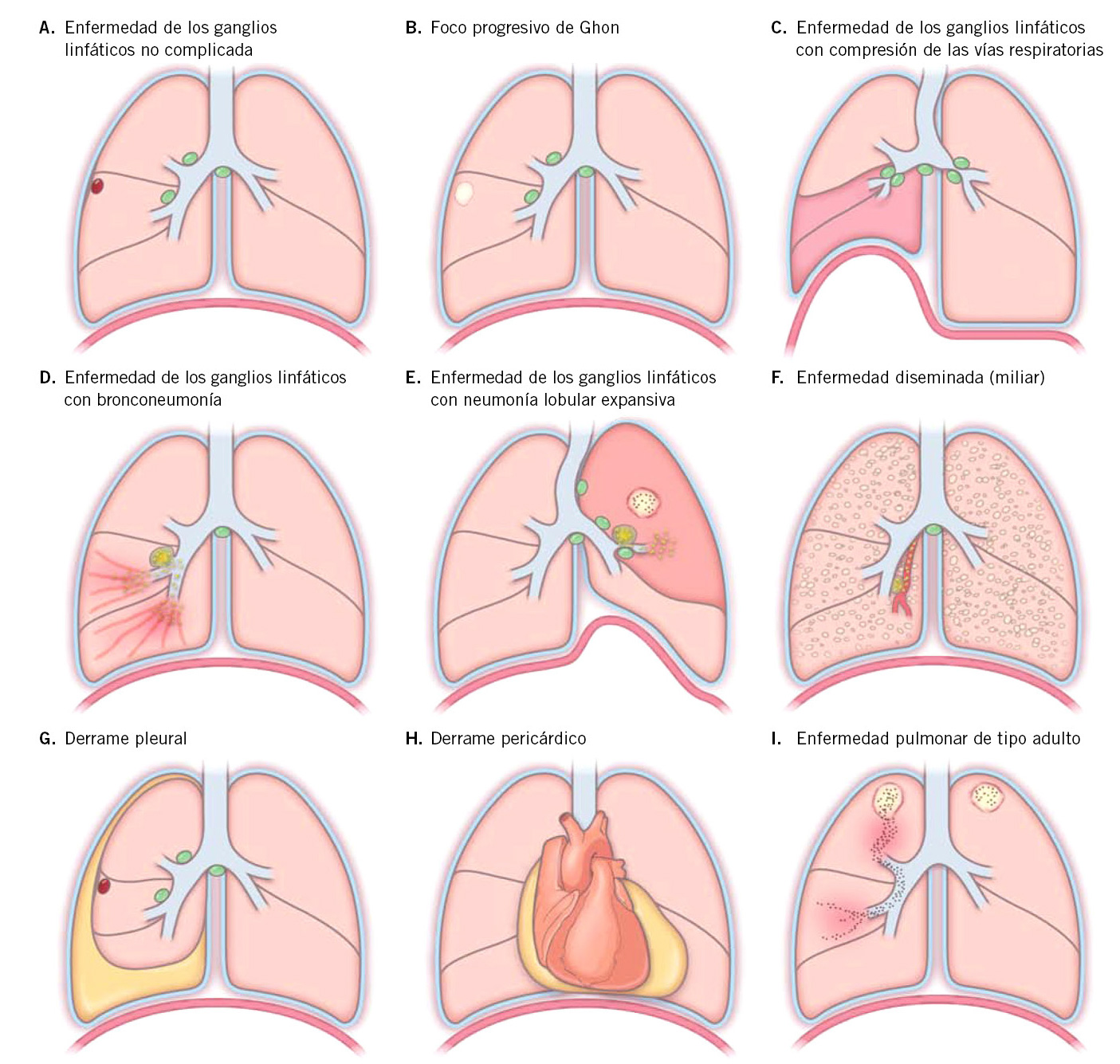
Figura 3. Síndromes clínicos de tuberculosis intratorácica en niños. A. Adenopatías mediastínicas hiliares asociadas con un nódulo periférico ipsilateral o complejo de Ghon. B. Complejo de Ghon con cavitación. Casi exclusiva de lactantes e inmunodeprimidos. C. Adenopatías aumentadas que comprimen la vía aérea causando, o bien obstrucción completa con atelectasia global en lóbulo medio (LM) y lóbulo inferior derecho (LID), o bien obstrucción parcial con efecto de válvula que conduce a hiperinsuflación en el pulmón izquierdo. D. Ganglios linfáticos necróticos, erosionando el bronquio intermedio con diseminación endobronquial y consolidación parcheada en LM y LID. E. Ganglios linfáticos necróticos que comprimen y obstruyen el bronquio izquierdo en lóbulo superior izquierdo (LSI) con infiltración del nervio frénico, causando una parálisis hemidiafragmática. Además, la diseminación endobronquial causa consolidación completa del LSI con desplazamiento de la tráquea y fisuras, acompañado de formación de cavidad. F. Micronódulos difusos en ambos campos pulmonares consecuencia, o bien de una diseminación hematógena tras una primoinfección reciente, o bien tras de una infiltración de vaso adyacente a una lesión pulmonar o a un ganglio necrótico. G. Derrame pleural: habitualmente indica una primoinfección reciente con reacción de hipersensibilidad a tuberculoproteínas con vaciado del contenido desde un complejo subpleural de Ghon (habitualmente no visible) en la cavidad pleural. H. Derrame pericárdico: ocurre habitualmente como consecuencia del vaciado del contenido de adenopatías subcarinales necróticas al espacio en pericárdico. I. Formación de una cavidad en ambos lóbulos superiores con diseminación endobronquial en LM. Los nódulos y cavidades en los segmentos apicales son típicos de la enfermedad tipo adulto. Adaptado de4.
Las formas extrapulmonares son más frecuentes en niños. La enfermedad puede afectar a cualquier órgano o sistema, y presentarse con: síntomas neurológicos, digestivos, osteoarticulares o cutáneos, entre los que se incluye el eritema nodoso, como forma de debut(12,17). La presentación más común de TB extrapulmonar es la adenopatía cervical o escrófula(16). Aunque en nuestro medio es excepcional, no debemos olvidar la TB congénita, que es de difícil diagnóstico, cursa con formas diseminadas y presenta elevada mortalidad(18).
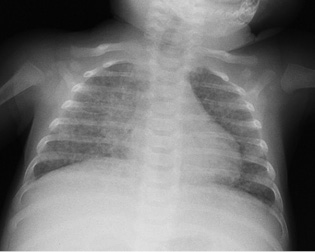
En lactantes o inmunodeprimidos existe un mayor riesgo de diseminación tras la primoinfección, incluyendo meningitis y TB miliar (Fig. 4).
Figura 4. Niña de 2 meses con tuberculosis miliar.
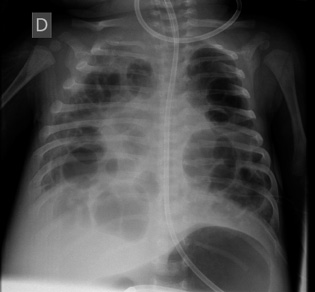
El cuadro clínico de TB miliar se manifiesta generalmente de forma insidiosa con: febrícula, malestar, anorexia y pérdida de peso, a menudo con adenopatías generalizadas, hepatoesplenomegalia y síntomas respiratorios, habitualmente con hipoxemia. En la Rx de tórax, se evidencian infiltrados diseminados como en “granos de mijo”, que pueden evolucionar a la formación de neumatoceles(19) (Fig. 5).
Figura 5. Neumatoceles múltiples en el curso evolutivo de tuberculosis miliar en lactante de 2 meses(18).
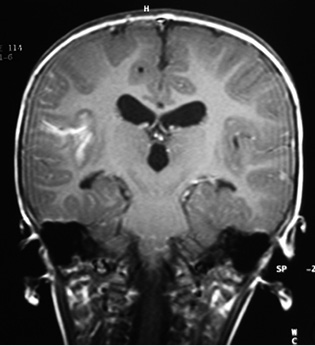
Con frecuencia, va acompañada de meningitis, que tiene la máxima incidencia entre los 6 meses y los 4 años. La presentación es subaguda, con: cefalea, irritabilidad o vómitos, seguido de afectación de pares craneales, alteración de conciencia, signos meníngeos y convulsiones. La hidrocefalia es precoz y frecuente (Fig. 6).
Figura 6. Hidrocefalia y realce meníngeo en meningitis tuberculosa.
En el fondo de ojo se pueden encontrar tubérculos coroideos, que es una importante pista diagnóstica, porque en más de la mitad de los casos de infección diseminada o meningitis, la PT o IGRA pueden ser basalmente negativos. El líquido cefalorraquídeo (LCR) clásicamente es de aspecto claro, con: pleocitosis y linfocitosis, hipoglucorraquia e hiperproteinorraquia(11).
En lactantes suele existir retraso en el diagnóstico de TB por presentar clínica inespecífica y atípica, y frecuentes falsos negativos en la PT e IGRA. Sin embargo, en ausencia de tratamiento, su mortalidad es muy elevada. Por ello, debemos considerar la ETB en el diagnóstico diferencial de lactantes pequeños con sepsis y/o neumonía con mala evolución clínica, en especial, ante la presencia de factores de riesgo epidemiológicos(11,19).
Diagnóstico
En el niño, la rentabilidad de las pruebas microbiológicas es menor por la naturaleza paucibacilar. La prueba de tuberculina (PT) y la Rx de tórax continúan siendo básicas. Las pruebas de IGRA (Interferon-Gamma-Release-Assay) aportan especificidad. La PCR (reacción en cadena de la polimerasa) en secreciones respiratorias o jugos gástricos incrementa la sensibilidad de la baciloscopia y aporta rapidez, permitiendo la detección de resistencias.
En la infancia, la TB plantea dificultades diagnósticas por la inespecificidad de la clínica, lo que requiere siempre un alto grado de sospecha, y por la menor rentabilidad de la microbiología. Es esencial hacer un diagnóstico precoz, tanto en niños expuestos como afectos de ITBL, como en las fases precoces de la ETB.
Historia clínica
Es fundamental y debe ser minuciosa y sistemática. Se debe investigar: contacto con inmigrantes, viaje a áreas endémicas y convivencia en situaciones o poblaciones de riesgo. Es obligado investigar siempre la posible fuente de contagio en el entorno habitual del niño, y si existe, es importante detallar el tiempo de exposición y comunicarse con los profesionales que controlan el caso índice, incluyendo medicina preventiva, averiguando la situación del paciente bacilífero, el tratamiento que recibe, el cumplimiento y la sensibilidad de la cepa. Es importante documentar la historia de vacunación BCG (fecha, número de dosis, cicatriz postvacunal) y la existencia de PT previa (fecha de realización y resultado), así como la existencia previa de clínica compatible, como: fiebre, adenopatías, síntomas constitucionales o respiratorios. Con frecuencia, no se realiza la PT a niños procedentes de países de alta prevalencia que llevan varios años en España, lo que debería constituir el primer paso en el diagnóstico precoz, como recomienda la Sociedad Española de Infectología Pediátrica (SEIP)(9); valorando repetir periódicamente la prueba según historia clínica y epidemiológica(9,10). La Academia Americana de Pediatría (AAP) recomienda evaluar factores de riesgo de TB en la primera visita a Atención Primaria, semestralmente en el primer año y anualmente a continuación, investigando factores de riesgo que incluyan: lugar de nacimiento, viajes y exposición a personas con historia de TB, o antecedentes de estancias en zonas de riesgo, cárcel o indigencia(15). En caso de procedencia o viaje a zona de riesgo, es recomendable realizar la PT en torno a las 10 semanas del regreso(9).
Pruebas inmunológicas
Para el diagnóstico, hay pruebas indirectas para evaluación de la respuesta inmune tras el contacto y directas para identificación de MTB. Entre las indirectas, hay dos tipos de pruebas diagnósticas para detección de la infección basadas en la respuesta inmunológica del niño tras contacto con MTB: la PT y pruebas de cuantificación de IFN-γ por linfocitos T tras estímulo con antígenos de MTB. Ninguno de los dos permite diferenciar entre ITLB y ETB(10).
La PT consiste en administrar intradérmicamente componentes antigénicos del bacilo (PPD o derivado proteico purificado), mediante la inyección de 0,1 ml del PPD, que contiene 2U de PPD-RT23 (5UI del estándar de PPD-S), utilizando una aguja de calibre 26, con bisel corto girado hacia arriba. La inyección se debe realizar en la cara anterior del antebrazo, produciéndose una pápula detectable de 6-10 mm. Debe leerse en el momento de máxima induración que se alcanza a las 72 h, con rotulador de punta gruesa, midiendo solo la induración del diámetro máximo transversal al eje mayor del brazo, anotándola en milímetros con la fecha de lectura. Si el niño ha tenido contacto previamente con el bacilo, se producirá una reacción de induración (intradermorreacción de Mantoux).
La PT presenta reactividad a las 8-12 semanas desde la infección. Puede tener falsos negativos, por problemas de: lectura, técnica de administración o almacenamiento, así como en recién nacidos y lactantes, tras vacunación reciente con vacunas de virus vivos, en niños con ETB diseminada, malnutrición o inmunosupresión; y falsos positivos por infecciones por micobacterias atípicas y tras vacunación con BCG. La induración en infecciones por micobacterias y por BCG es, en general, inferior a 10 mm. Aunque la induración ocasionada por la BCG es transitoria (habitualmente en los primeros 3 años tras la vacuna), en ocasiones, produce una induración intermedia entre 5 y 10 mm, cuya interpretación vendrá clarificada por la realización de IGRA. Aunque existe variabilidad de lectura interobservador, puntualmente ha habido problemas de desabastecimiento y, tiene el inconveniente, de requerir una segunda visita; la PT sigue siendo una herramienta diagnóstica fundamental. La duración del vial, una vez abierto, es de 4 semanas, conservado en nevera.
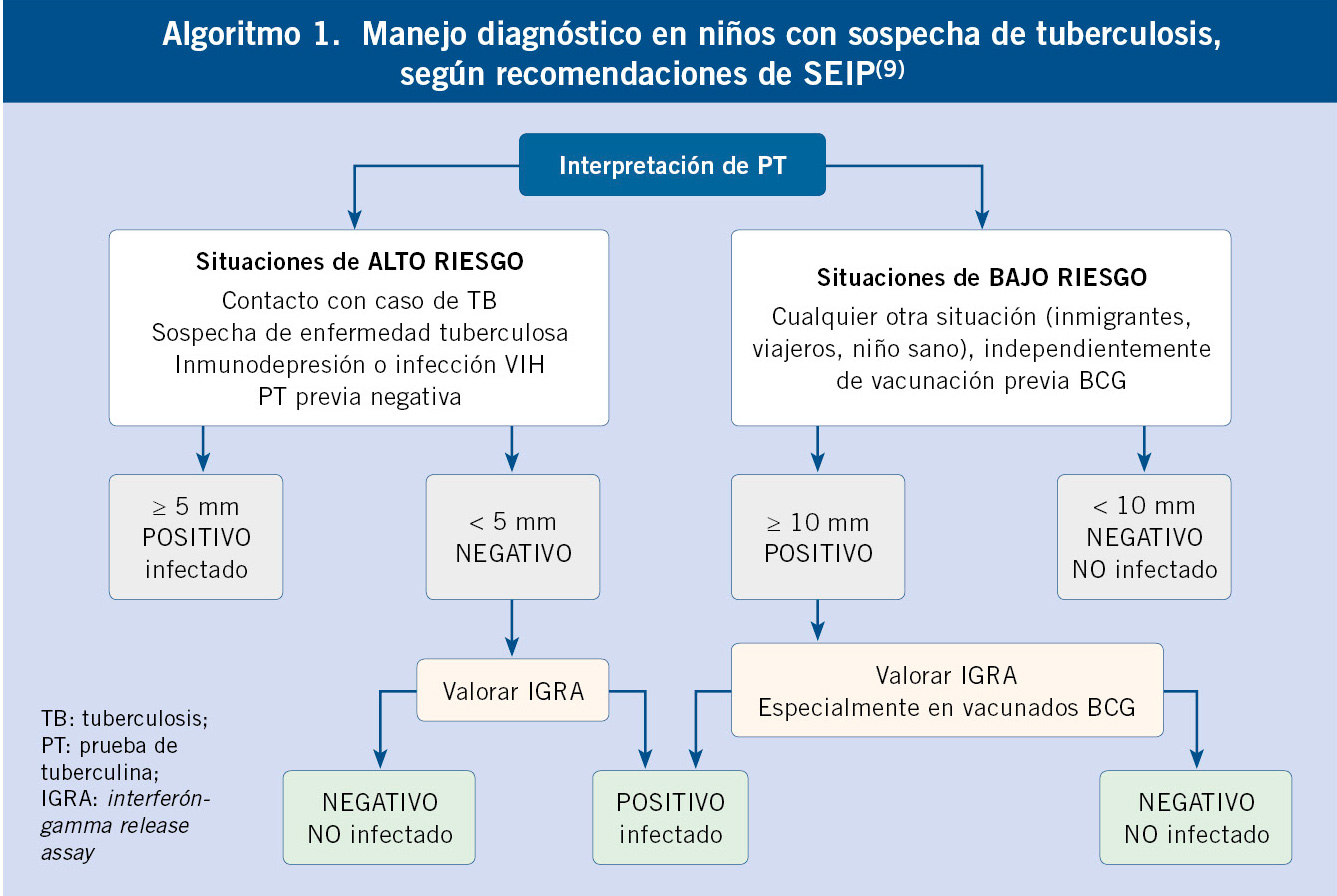
Las técnicas de cuantificación de IFN-γ consisten en realizar una extracción de sangre y estimular los linfocitos T con antígenos específicos de MTB. Si el paciente está infectado, sus linfocitos reconocen los antígenos y se activan produciendo IFN-γ. En nuestro país, se emplea la técnica de Interferon Gamma Release Assay (IGRA), que no está validada aún en menores de 5 años; si bien, cada vez se acumula más experiencia que avala su utilidad en niños pequeños, y así lo recomienda la AAP a partir de los 2 años en vacunados con BCG o en quienes haya dudas o dificultad para volver a una segunda visita(15). Estas técnicas son más específicas que la PT, no presentando falsos positivos por vacunación con BCG o por infección por la mayor parte de micobacterias atípicas, con la excepción de M. kansasii, M. szulgai y M. marinum, muy infrecuentes en nuestro medio en niños. Además, solo se precisa una única visita, coincidente con la extracción de sangre. Requiere experiencia por parte del laboratorio. Sin embargo, no sustituyen a la PT en la práctica diaria, utilizándose, sobre todo, en niños vacunados con BCG o problemas diagnósticos (casos de PT positiva en niños bajo riesgo de TB, sospecha de infección por micobacteria atípica y en casos de PT negativa, pero sospecha de ETB y/o inmunodeprimidos). Aunque la sensibilidad global no parece mayor que la PT, puede ser de utilidad en inmunodeprimidos, pues proporciona una información que podría ser complementaria, y así aumentar la rentabilidad diagnóstica. La interpretación de la PT y las indicaciones de IGRA se describen en el algoritmo 1.
Pruebas directas de identificación de Mycobacterium tuberculosis (MTB)
Siempre deben realizarse estudios microbiológicos en la mayor medida posible, pues permitirían la confirmación microbiológica y determinar la susceptibilidad de la cepa. Podemos clasificarlos en estudios microbiológicos tradicionales y moleculares de amplificación de ADN de MTB.
Estudios microbiológicos tradicionales
En el niño que no tenga capacidad para expectorar, la muestra respiratoria se obtiene mediante el aspirado de jugo gástrico, recogiendo 3 muestras en ayunas por sonda nasogástrica en días consecutivos. Una técnica alternativa es la obtención de esputo inducido, tras administrar suero salino hipertónico nebulizado que, por su efecto osmótico, atrae líquido intersticial a la luz de las vías respiratorias, aumentando las secreciones y provocando la expectoración espontánea. Presenta las ventajas frente al aspirado gástrico de: no requerir ingreso y de ser menos invasiva y de más fácil realización, siendo especialmente útil en pacientes que no expectoran, incluidos niños pequeños. La recogida de esputos inducidos junto con aspirados gástricos, puede favorecer mayores tasas de aislamiento microbiológico(21).
Las muestras se deben procesar para baciloscopia con visualización directa de bacilos ácido-alcohol resistentes (BAAR), mediante fluorescencia con tinción de auramina o tinción de Ziehl-Neelsen; así como para cultivo de MTB. Este se realiza en medio líquido (BACTEC), que es más rápido (puede positivizar en 2-3 semanas) y algo más sensible que el cultivo en medio sólido (Lowenstein), que muestra resultados a las 4-6 semanas.
La rentabilidad diagnóstica de las pruebas microbiológicas es menor en el niño que en el adulto, por su naturaleza paucibacilar. La baciloscopia tiene escasa sensibilidad no sobrepasando el 30%. El cultivo de jugos gástricos clásicamente muestra sensibilidades entre el 30-40%(17); si bien, combinándolo con esputo inducido puede estar próximo al 50%(21).
La recogida de otras muestras debe realizarse en función de la clínica del paciente. El lavado broncoalveolar solo se realiza si está indicada una broncoscopia por otro motivo (excepcional en Pediatría), y su rentabilidad no supera a la de los jugos gástricos(15).
Se debería obtener una muestra directa de la lesión, si es posible, y procesarla para microbiología y anatomía patológica. Es lo habitual en las adenitis cervicales, donde la rentabilidad de los estudios microbiológicos es más elevada (en torno al 80%). En cambio en derrames pleurales, la rentabilidad de la tinción es escasa y la del cultivo se sitúa en torno al 50% en algunas series(22). Por ello, el diagnóstico precoz en estas localizaciones extrapulmonares se debe basar en otras pruebas indirectas como: radiología, análisis del líquido pleural, LCR y anatomía patológica. Siempre deben complementarse con las muestras de esputo o jugos gástricos(20,22).
Técnicas moleculares de amplificación de ADN de Mycobacterium tuberculosis (MTB)
Las técnicas de reacción en cadena de la polimerasa (PCR) suponen un avance enorme en TB, sobre todo, en países subdesarrollados; pues, bajo el auspicio de la OMS y por un coste inferior a 1 euro, permiten un diagnóstico rápido y poder detectar el gen rpoB de resistencia a rifampicina (RIF) (geneXpert MTB/RIF® assay), que es un marcador de multirresistencia. Estas técnicas de amplificación de ADN de MTB presentan alta especificidad y sensibilidad algo mayor que la baciloscopia, aunque menor que el cultivo, con respecto al cual la sensibilidad está en torno al 70%. La sensibilidad parece aumentar con técnicas mejoradas de amplificación, que detectan un menor número de bacilos (Xpert MTB/RIF Ultra [Ultra]), aún en desarrollo e implementación por la OMS. Permiten resultados en pocas horas y se puede realizar en líquidos orgánicos y muestras de tejidos. En la actualidad, se realiza de rutina en la mayoría de los centros, siendo de particular utilidad en casos con alta sospecha y baciloscopia negativa. Su mayor problema deriva del hecho de no detectar resistencia a INH. Por ello, actualmente también está disponible en algunos centros, una PCR que permite la detección simultánea de genes de resistencia a INH y RIF, a un mayor coste, así como otras PCRs que detectan resistencia a fármacos de segunda línea.
Pruebas radiológicas
El espectro de alteraciones radiológicas en la TB en el niño es muy amplio, con signos radiológicos inespecíficos. Con frecuencia, hay gran diferencia entre un cuadro clínico relativamente leve u oligosintomático y las extensas lesiones radiológicas existentes. Esta discrepancia es un hallazgo que puede sugerir el diagnóstico de TB(15).
La Rx de tórax, con proyección lateral, es la primera y, con frecuencia, única técnica de imagen requerida. Es útil para detectar adenopatías hiliares o mediastínicas, que pueden no ser evidentes por la sombra tímica y otras estructuras solo con la proyección ántero-posterior. La alteración radiológica más frecuente es el ensanchamiento mediastínico por adenopatías, habitualmente como único hallazgo; aunque, en ocasiones, se acompaña de lesión parenquimatosa y/o atelectasia. Se ha demostrado que hasta el 60% de los niños asintomáticos con TB con Rx de tórax interpretada como normal, presentan adenopatías mediastínicas, sobre todo, subcarinales, en la tomografía computarizada (TC) de tórax. No obstante, este aumento leve-moderado de ganglios torácicos puede formar parte natural de la primoinfección y no significa, necesariamente, enfermedad activa, lo que unido a la naturaleza paucibacilar de la infección en Pediatría, no implica cambiar el manejo clínico y, por ello, no se recomienda realizar TC de rutina en el niño asintomático con Rx de tórax normal. La SEIP solo considera realización de TC torácico a niños sintomáticos con dudas diagnósticas, a menores de 2 años y cuando haya contacto con TB-resistente(9).
Otra manifestación común, sobre todo en adolescentes, es el derrame pleural, habitualmente unilateral. Con frecuencia, es la única alteración en la Rx de tórax, pues puede no acompañarse de condensación parenquimatosa o adenopatías. La ecografía torácica es de gran ayuda, permitiendo visualizar, a menudo, tabicación y guía para realización de toracocentesis, cuya indicación diagnóstica es obligada. Las lesiones cavitadas son formas post-primarias o del adulto, mucho menos frecuentes en niños, predominan en segmentos apicales y son muy contagiosas(4).
La evolución radiológica es mucho más lenta que la clínica, pudiendo quedar lesiones residuales después de un tratamiento correcto. Las adenopatías mediastínicas pueden persistir varios años después de la curación clínica. En ocasiones, al iniciar el tratamiento se observa un empeoramiento radiológico, que puede acompañarse de clínica respiratoria, lo que se conoce como reacción paradójica (Fig. 3), que no requiere modificación del tratamiento y sí consideración de añadir esteroides(4).
Otras pruebas diagnósticas
Anatomía patológica
Cualquier material accesible debe ser enviado para análisis histopatológico que permita confirmar o descartar TB, así como para cultivo y PCR. La existencia de granulomas múltiples en diferentes estadios evolutivos, con necrosis caseificante central, sugiere el diagnóstico de TB, si bien, múltiples entidades pueden producir granulomas. La PAAF/biopsia de adenopatías engrosadas accesibles, habitualmente cervicales, tiene alta rentabilidad diagnóstica.
Determinación de adenosindeaminasa (ADA)
Enzima secretada por linfocitos T. Existe más experiencia en su determinación en líquido pleural (normal: <40 U/L) y en LCR (normal: 1-4 U/L). En un contexto clínico adecuado y con examen compatible de estos líquidos, su aumento es altamente sugestivo de ETB, aunque no es una prueba específica de TB.
Diagnóstico diferencial
La tuberculosis puede presentar una amplia variabilidad clínica y radiológica, afectando cualquier órgano o sistema, por lo que es necesario establecer un amplio diagnóstico diferencial.
El diagnóstico diferencial en la ETB pulmonar incluye neumonía (bacteriana típica, atípica, fiebre Q, o viral). En casos de adenopatías mediastínicas, la repetición de la Rx de tórax a las 6-8 semanas, puede ser de gran utilidad, pues en algunas neumonías atípicas, como las producidas por Mycoplasma pneumoniae, o Chlamydia (pneumoniae, psitacci), son de corta duración, despareciendo en pocas semanas, a diferencia de la TB, donde persisten muchos meses e incluso años. En casos de compresión bronquial por adenitis mediastínica y enfisema, debemos realizar diagnóstico diferencial con cuerpo extraño en vía aérea. En inmunodeprimidos e infectados por el VIH, el diagnóstico diferencial es aún amplio y dependiente del estado de inmunosupresión y, de ahí, la necesidad frecuente de pruebas invasivas. Otras entidades que pueden simular una ETB pulmonar son: procesos inflamatorios o tumorales intratorácicos, entre los que se incluyen sarcoidosis y linfomas(15,20).
Los casos de adenitis subagudas con granulomas suponen un reto diagnóstico, dado que también pueden deberse a infección por otras micobacterias, Bartonella haenselae, toxoplasmosis, así como otros procesos autoinmunes o idiopáticos, siendo el enfoque diagnóstico-terapéutico distinto. Las adenitis por micobacterias atípicas son más frecuentes en nuestro medio que la escrófula, suelen presentarse en niños de menor edad, habitualmente menores de 5 años, sin clínica de síntomas constitucionales, y suelen ser más frecuentemente: unilaterales, submaxilares, preauriculares o cervicales anteriores. En estas formas, la Rx de tórax nunca debe presentar alteraciones. La presencia de adenopatías en niños mayores de 5 años, sobre todo, si son bilaterales, de localización axilar, supraclavicular o cervical posterior y se acompañan de síntomas constitucionales, nos debe hacer sospechar una ETB, sobre todo, ante determinados antecedentes epidemiológicos. Los test de IGRA son especialmente útiles en el diagnóstico diferencial entre adenitis tuberculosas y adenitis por otras micobacterias. En casos de infección por la mayor parte de micobacterias ambientales, el resultado del IGRA será negativo y la PT negativa o <10 mm. En la tabla III, se muestran claves en el diagnóstico diferencial(11).
Es fundamental mantener siempre un alto grado de sospecha, en particular ante cuadros graves que requieran un tratamiento inmediato, como es en TB miliar o meningitis tuberculosas, para lo cual los antecedentes epidemiológicos son fundamentales(11,12).
Tratamiento
Aunque el tratamiento varía según la localización de la enfermedad tuberculosa (ETB) y de la sensibilidad de la cepa, habitualmente, consiste en la combinación de varios fármacos con una fase de inducción de 2 meses (con 4 fármacos empíricamente) y una de mantenimiento durante 4-10 meses (con 2 fármacos). En la infección tuberculosa latente (ITBL), es de elección la isoniacida (INH) durante 6-9 meses. Es fundamental monitorizar la adherencia para conseguir la curación y prevenir resistencias.
En general, los principios del tratamiento y los fármacos utilizados en niños son los mismos que en adultos, con las limitaciones de menor información respecto a la farmacocinética y farmacodinamia, y con escasez de preparados fijos combinados que se puedan administrar a diferentes edades, lo cual dificulta la adherencia.
Infección tuberculosa latente (ITBL)
Para el tratamiento de la ITBL hay varias opciones terapéuticas. Es de elección INH durante 6 o 9 meses, en administración diaria. Ambas duraciones son válidas, aunque se recomienda 9 meses en inmunodeprimidos o enfermos crónicos. En caso de resistencia a INH o intolerancia o toxicidad, está indicado RIF durante 4 meses. Si se prefiere una pauta corta, una alternativa es la combinación de INH y RIF durante 3 meses(11). En mayores de 12 años, otra alternativa es la utilización de rifapentina (aún no disponible en España) e INH una vez a la semana durante 3 meses. Esta pauta corta ha demostrado que mejora el cumplimiento respecto a la pauta de 9 meses en países subdesarrollados; si bien, debe hacerse bajo terapia directamente observada (TDO) por el riesgo de resistencia(4,20). En población VIH, deben tenerse en cuenta las interacciones con antirretrovirales con RIF y rifapentina. El tratamiento y duración de la ITBL en caso de multirresistencia son desconocidos, y deben ser individualizados sopesando riesgos y beneficios(20). Son opciones válidas la observación o terapia de combinación, que podrían consistir en pirazinamida (PIZ) y etambutol (EMB)(15).
Enfermedad tuberculosa (ETB)
La infección producida por MTB está ocasionada por poblaciones bacilares en distinto grado de actividad. Por ello, el tratamiento de TB se divide en una fase intensiva de inducción y una fase de continuación. El tratamiento combinado en la fase de inducción, pretende reducir de forma precoz el número de bacterias de replicación rápida, lo cual se acompaña de: mejoría de la sintomatología, previene la transmisión respiratoria y evita la selección de cepas resistentes. Dada la capacidad del bacilo de mantenerse en un ambiente metabólico de bajo grado, la fase de continuación pretende completar la esterilización de los tejidos, actuando frente a la población bacilar de replicación lenta y en estado de latencia, lo cual evita recidivas, para lo cual debe mantenerse de forma prolongada.
El objetivo fundamental individual del tratamiento de TB en el niño va a ser la curación de la enfermedad y, desde un punto de vista de salud pública, también limitar la transmisión de la enfermedad y prevenir la emergencia de cepas resistentes. Se recomienda una fase de inducción de tres o cuatro fármacos durante 2 meses, seguidos de una fase de mantenimiento de dos fármacos durante 4 meses adicionales, hasta completar 6 meses de tratamiento.
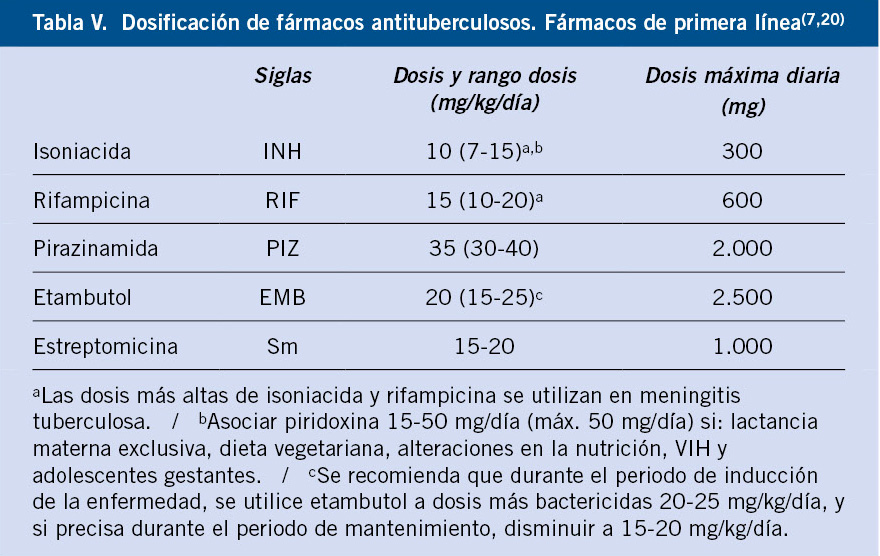
Puesto que la confirmación de laboratorio es infrecuente, debido a la naturaleza paucibacilar de la enfermedad y dado que, en ocasiones, puede existir un curso evolutivo rápido, es necesario un tratamiento empírico lo antes posible, que habitualmente estará basado en criterios: epidemiológicos, clínicos y radiológicos. El tratamiento debe incluir una combinación de fármacos, para los cuales, MTB sea susceptible o haya una alta probabilidad de que lo sea, basado en datos epidemiológicos o de la fuente de contagio. Se requiere un mínimo de 3 fármacos durante la fase de inducción. En casos de resistencias a INH en la comunidad superiores al 4%, el tratamiento empírico debe incluir 4 fármacos. Puesto que en el momento actual, la tasa de resistencia a INH en España supera este umbral, la recomendación de SEIP es el inicio con 4 fármacos, siendo de elección: INH, RIF, PIZ y EMB(7). El 4º fármaco en niños es preferiblemente EMB, que debe mantenerse toda la fase de inicio o, al menos, hasta disponer de la susceptibilidad de la cepa en el paciente o en la fuente. Si existen lesiones pulmonares extensas o cavitadas con alta carga bacilar, es recomendable mantener los 4 fármacos durante toda la fase de inducción(4,20). En la fase de mantenimiento, en cepas sensibles, se recomienda la combinación de INH y RIF. Debe tenerse en cuenta, la localización anatómica y la penetración en la misma de los fármacos empleados, en cuanto al tipo y a la duración del tratamiento. El tratamiento de la TB extrapulmonar, excepto en casos de meningitis o afectación ósea, es generalmente similar al tratamiento de la enfermedad pulmonar con una duración total de 6 meses. Aunque en localización ósea o meníngea, la OMS recomienda 12 meses, existe amplia experiencia en Suráfrica de tratamiento con éxito durante solo 6 meses en meningitis (9 en niños VIH)(20). En algunas formas de TB extrapulmonar o intratorácica están indicados los corticoides, como en la meningitis, donde es preferible dexametasona, durante un mínimo de 4 semanas con retirada gradual(11,20). En la tabla IV, se expone la recomendación del tipo y duración del tratamiento en función de la localización y, en la tabla V, la dosificación de fármacos de primera línea(20).
En ausencia de resistencias, la causa más frecuente de falta de respuesta es la mala adherencia al tratamiento, por lo cual se recomienda una TDO con vigilancia estrecha y revisiones periódicas frecuentes. En niños, se recomienda tratamiento diario durante la fase intensiva y, preferiblemente, durante todo el periodo de tratamiento(20). En niños VIH negativos, en los que se asegura una adherencia permanente, la OMS considera la alternativa de tratamiento intermitente 3 veces por semana, durante la fase de mantenimiento(20).
Uno de los problemas que dificultan la adherencia es la escasez de preparados pediátricos combinados. Recientemente, la Alianza por la Tuberculosis ha fomentado el desarrollo de comprimidos coformulados con dosis reducidas de: INH, RIF y PIZ, de sabor agradable y que se ajusta a las recomendaciones de la OMS(20).
Tuberculosis resistente
Se considera TB resistente la existencia de resistencia, al menos, a una droga de primera línea: INH, RIF, PIZ o EMB. Se considera multirresistencia (TB-MDR) cuando hay, al menos, resistencia a: INH y RIF, y tuberculosis extensamente resistente, si además, existe a fluorquinolonas o fármacos inyectables antituberculosos.
Se debe sospechar resistencia, en niños procedentes o contacto con pacientes de zonas de alta prevalencia de TB-resistente, o con alguien que no ha sido adherente o ha reiniciado tratamiento(4).
En general, los principios del tratamiento de la TB-resistente son los mismos que en adultos. Sería ideal disponer de pruebas de susceptibilidad que permitan dirigir la terapia. El tratamiento de la TB-resistente y multirresistente requiere, al menos, 4 fármacos activos a los cuales la cepa sea sensible. Deben utilizarse los de primera línea disponibles. El tratamiento debe administrarse con TDO con monitorización muy frecuente de la adherencia, respuesta al tratamiento y efectos secundarios con una periodicidad mínima de una visita mensual.
Recientemente, la OMS ha actualizado su recomendación de tratar solo 6 meses los casos de resistencia aislada a INH, con una pauta que incluya: RIF, PIZ, EMB y levofloxacina(15,20). En la ETB producida por una cepa resistente a RIF, la OMS indica que se debe considerar TB-MDR, mientras no se conozca la sensibilidad a INH y, en caso de que no se consiga conocer la misma en el paciente o la fuente, se debe tratar como TB-MDR(11). Nunca debe añadirse un régimen de monoterapia a una pauta que fracasa(20).
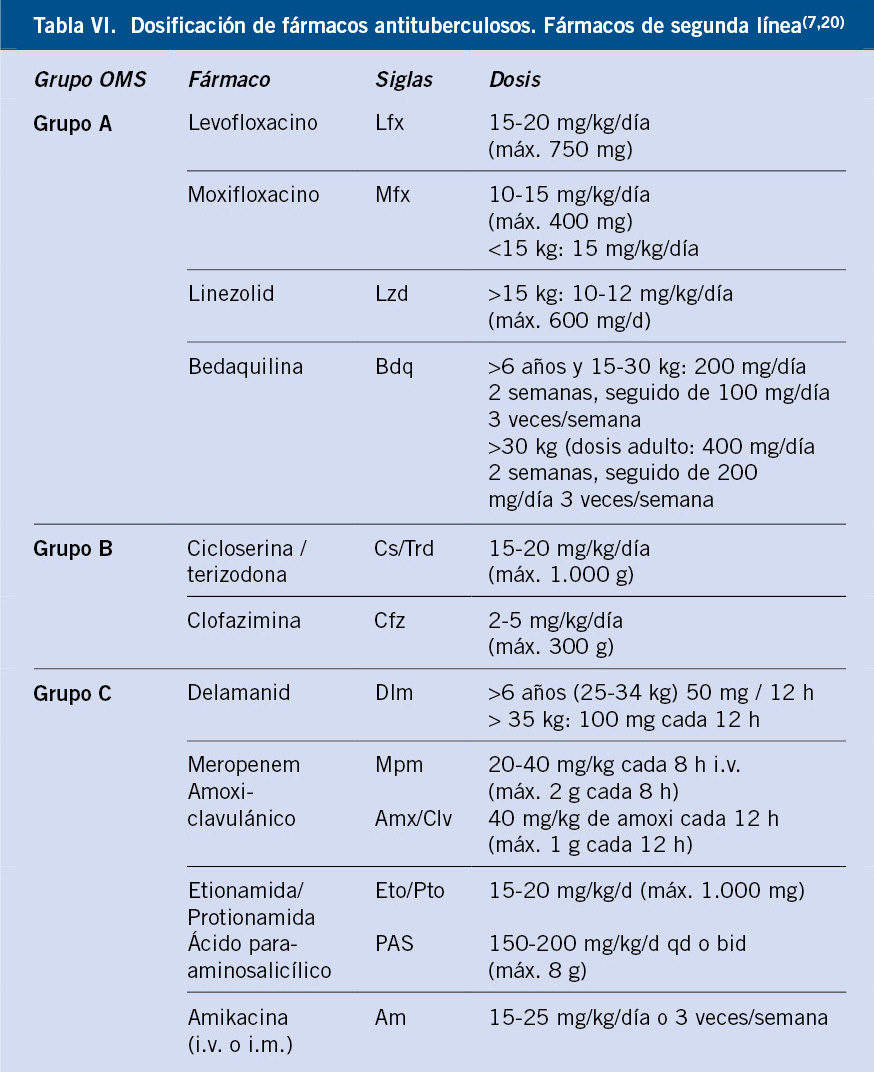
La OMS ha reclasificado, según prioridad, de mayor a menor, los fármacos de segunda línea en 3 categorías (Tabla VI).
Aunque la duración del tratamiento de la TB-multirresistente es desconocida, se siguen las recomendaciones de adultos con una duración entre 18 y 24 meses; si bien, en niños con probable ETB paucibacilar, podrían considerarse pautas más cortas(20).
Monitorización durante el tratamiento
Durante el seguimiento ambulatorio, se debería ofrecer una TDO. Se recomiendan controles clínicos frecuentes con monitorización de posibles efectos adversos. En niños, la toxicidad de los fármacos es escasa, menor que en adultos y, en general, puede solventarse con pequeñas modificaciones. El efecto adverso más frecuente es la hepatotoxicidad, principalmente por INH. No es necesario monitorización de transaminasas, a no ser que haya clínica sugestiva de hepatotoxicidad o mayor riesgo de hepatotoxicidad, como ocurre en la TB miliar o meníngea, pues la diseminación hematógena, con frecuencia, incluye afectación hepática, lo que podría conducir a mayor toxicidad. Habitualmente, no es necesario modificar el tratamiento si hay hepatotoxicidad leve, pero se deben suspender todos los fármacos potenciales si se confirman cifras de transaminasas superiores a 5 veces el límite de la normalidad o aumento de bilirrubina conjugada 2 veces por encima de lo normal(20), con reintroducción gradual de fármacos individualmente y valorando cambio a otros fármacos no hepatotóxicos, principalmente EMB o estreptomicina (S), y considerando prolongar el tiempo de tratamiento(11).
En casos de TB pulmonar, habitualmente, no hay alteraciones significativas de laboratorio, aunque puede haber: anemia, leucocitosis y VSG elevada, cuya monitorización puede ser útil para ver la evolución, si bien, no suele ser necesario realizar analítica de control durante el seguimiento. Respecto a la Rx de tórax de control, aunque la AAP la recomienda a los 2 meses, con frecuencia, solo se realiza un control al final del tratamiento, de acuerdo con guías de SEIP(7).
Los niños habitualmente también toleran mejor los fármacos de segunda línea que los adultos; si bien, es fundamental identificar precozmente los posibles efectos secundarios de la medicación. En la monitorización de la posible toxicidad, es importante considerar una posible reacción paradójica o en niños VIH el conocido como síndrome de reconstitución inmune, que habitualmente ocurre en las primeras semanas del inicio de la terapia, pero que puede demorarse hasta los 6-8 meses. En esta situación, no es necesario modificar el tratamiento y están indicados los esteroides, como prednisona (o equivalente) a 2 mg/kg/día, durante 3-4 semanas, con descenso progresivo(4,11).
Prevención
La prevención es fundamental en todos los eslabones de la cadena epidemiológica. Se requiere siempre un estado de alerta para la detección precoz del niño expuesto, para ofrecer profilaxis postexposición a niños de riesgo. Aunque la BCG es efectiva en la prevención de formas diseminadas en niños, hay esperanza en nuevas vacunas en desarrollo.
La prevención comienza por mantener siempre un alto grado de sospecha y evaluar continuamente la situación familiar y epidemiológica en la que se encuentra el niño, particularmente aquellos de alto riesgo, entre los que se incluyen: los que conviven con adultos infectados por el VIH e inmigrantes procedentes de zonas de alta endemia de TB o socialmente desfavorecidos.
La prevención podemos dividirla en profilaxis postexposición del niño expuesto, que va a consistir en quimioprofilaxis en menores de 5 años y en inmunodeprimidos, y vacunación al nacimiento en países de alta prevalencia o cuando la separación del niño a la fuente de contagio no sea posible.
Profilaxis postexposición
La SEIP ha actualizado recientemente su recomendación para administrar profilaxis postexposición solo a los niños de mayor riesgo de ETB y formas graves de la misma(7) (Algoritmo 2), en consonancia con las recomendaciones de la AAP(15). Debe realizarse con INH a todos los niños menores de 5 años e inmunodeprimidos que sean contactos expuestos a un caso de TB bacilífera (INH sensible), tras una primera PT negativa (y/o IGRA)(7), durante el periodo ventana hasta su positividad, que se considera de 8-12 semanas, en el caso de que el niño resultara infectado(7,15). Si la cepa de la fuente es resistente a INH, se recomienda RIF 8-12 semanas. En mayores de 5 años inmunocompetentes, dado el bajo riesgo de formas graves de ETB a partir de esta edad, es posible mantener actitud expectante sin iniciar profilaxis. En todos los casos, es necesaria una vigilancia estrecha para evaluar una posible ETB ante la menor sospecha clínica. Es obligado repetir una segunda PT (o IGRA) a las 8-12 semanas del contacto, retirándose si resulta negativa. En caso de positividad de la PT (en estos casos se considera ≥5 mm) o IGRA, es necesario emprender estudio para clasificar al niño como ITLB o ETB(11). En algunas situaciones de alto riesgo, como en inmunodeprimidos o menores de 3 meses en contacto con caso índice no adherente o retratamiento, se recomienda completar pauta de tratamiento de ITBL aún con resultado negativo de la segunda PT(11).
En todos los casos de exposición, se debe romper el contacto entre niño expuesto y enfermo de TB, permaneciendo en habitaciones separadas hasta que la fuente de contagio lleve 2 semanas de tratamiento adecuado, y se compruebe que no es bacilífera. En lactantes expuestos a madres con TB, la lactancia materna no está contraindicada, salvo en casos de mastitis TB. Sin embargo, se recomienda evitar el contacto físico con el niño en caso de ser bacilífera o con una TB-resistente, y administrar la leche materna en biberón en las primeras 2 semanas de tratamiento. En caso de que no sean posibles estas medidas preventivas, se debe considerar vacunación con BCG(11,15).
Vacunación
Aunque la protección ofrecida por la BCG ha sido variable en los diferentes estudios en los que se ha evaluado, se estima que podría tener una efectividad en torno al 80% en cuanto a protección frente a TB diseminada y meningitis, en lactantes y niños pequeños, tanto en cepas sensibles como resistentes y, de ahí, que sea una estrategia recomendada por la OMS en países con alta incidencia de enfermedad. La duración ofrecida ha sido variable, de menos de 10 años a más de 50 años. Los intensos esfuerzos internacionales recientes han permitido el desarrollo de múltiples vacunas actuales, de las cuales hay 2 que se han mostrado eficaces en ensayos clínicos y ofrecen grandes esperanzas para combatir el tremendo impacto que sigue teniendo todavía la TB en el mundo(23).
Papel del pediatra de Atención Primaria
Es fundamental la colaboración multidisciplinar para poder atajar la TB en niños en todos sus aspectos. El pediatra de Atención Primaria juega un papel básico en la detección precoz de situaciones de riesgo o casos sospechosos, implicándose activamente en la adherencia en la profilaxis postexposición y en el tratamiento de ITLB como ETB, así como en la detección precoz de toxicidad de la medicación. La comunicación entre el pediatra de Atención Primaria y el especialista hospitalario es de especial relevancia para lograr un óptimo control global del niño y del contexto epidemiológico en el que vive. Es fundamental la notificación de los casos y el estudio de contactos por parte de Salud Pública. A su vez, es necesario continuar con vigilancia activa de forma coordinada, con medicina preventiva y servicios de adultos, de todos los contactos domiciliarios o escolares para intervenir eficazmente en los distintos niveles de actuación.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1. World Health Organization. Global Tuberculosis Report 2020. Geneva, Switzerland; 2020. Consultado el 29 de diciembre de 2020. Disponible en:
https://apps.who.int/iris/bitstream/handle/10665/337538/9789240016095-eng.pdf.
2. Fitzgerald DW, Sterling TR, Haas DW. Mycobacterium tuberculosis. En Mandle, Douglas y Bennet. Enfermedades Infecciosas. Principios y Práctica. 9ª ed. De John Bennet, Ralph Dolin y Martin Blasser. Elsevier España; 2021. p. 2985-3021.
3. Yuen CM, Jenkins HE, Rodríguez CA, Keshavjee S, Becerra MC. Global and Regional Burden of Isoniazid-Resistant Tuberculosis. Pediatrics. 2015; 136: e50-9.
4.*** Pérez-Vélez C, Marais BJ. Tuberculosis in children. N Engl J Med. 2012; 367: 348-61.
5. Informe epidemiológico sobre la situación de la tuberculosis en España. Consultado el 29 de diciembre de 2020. Disponible en:
https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Documents/INFORMES/OTROS%20INFORMES/RENAVE_vigilancia_TB_2017.pdf. 2017.
6. Marais BJ, Gie RP, Schaaf HS, Beyers N, Donald PR, Starke JR. Childhood pulmonary tuberculosis: old wisdom and new challenges. Am J Resp Crit Care Med. 2006; 173: 1078-90.
7.*** Mellado Peña MJ, Santiago García B, Baquero-Artigao F, Moreno Pérez D, Piñeiro Pérez R, Méndez Echevarría A, et al. Actualización del tratamiento de la tuberculosis en niños. An Pediatr (Barc). 2018; 88: 52.e1-52.e-12.
8. Kaufmann SHE, McMichael A. Annulling a dangerous liaison: vaccination strategies against AIDS and tuberculosis. Nature Medicine. 2005; 11: S33-S44.
9.** Moreno-Pérez D, Andrés-Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Duran D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010; 72: 283.e1-283.e14.
10. Lewinsohn DM, Leonard MK, LoBue PA, Cohn DL, Daley CL, Desmond E, et al. Official American Thoracic Society/Infectious Diseases Society of America/Centers for Disease Control and Prevention Clinical Practice Guidelines: Diagnosis of Tuberculosis in Adults and Children. Clin Infect Dis. 2017; 64: 111-5.
11.*** Méndez-Echeverría A, Baquero-Artigao F. Tuberculosis pulmonar. Pediatr Integral. 2016; 20: 109-18.
12. Carvalho D, Goletti S, Manga D, Silva R, Manissero D, Migliori G. Managing latent tuberculosis infection and tuberculosis in children. Pulmunology. 2018; 24: 106-14.
13. López-Medina EM, Sainz T, de Ory SJ, Mellado-Peña MJ, González-Tomé MI, Gil EC, et al. Tuberculosis in a Spanish cohort of children living with HIV: the CHOTIS study (Childhood HIV & TB study). Int J Tuberc Lung Dis. 2020; 24: 303-9.
14. Noguera-Julián A, Calzada-Hernández J, Brinkmann F, Basu Roy R, Bilogortseva O, Buettcher M, et al. Tuberculosis disease in children and adolescents on therapy with anti-tumor necrosis factor-alpha agents: a collaborative, multi-centre PTBNET study. Clin Infect Dis. 2020; 71: 2561-9.
15.** Holmberg PJ, Temesgen Z, Banerjee R. Tuberculosis in children. Pediatr Rev. 2019; 40: 168-78. Doi: 10.1542/pir.2018-0093.
16. Santiago-García B, Blázquez-Gamero D, Baquero-Artigao F, Ruíz-Contreras J, Bellón JM, Muñoz-Fernández MA, et al. Pediatric extrapulmonary tuberculosis: Clinical spectrum, risk factors and diagnostic challenges in a low prevalence region. Pediatr Infect Dis J. 2016; 35: 1175-81.
17. Berzosa A, Illán M, Prados M, Calderón C, Francisco L, Callejas I, et al. Tuberculosis in the paediatric population of Madrid in the last 26 years. Enfermedades Infecciosas y Microbiología Clínica 2019 (en prensa). Enferm Infecc Microbiol Clin. 2020; 38: 312-6.
18. Guillen S, Callejas I, Berzosa A, Illán M, Soto B, Ramos JT. Disseminated tuberculosis complicated with pneumatoceles in two infants. PIDJ. 2021 (en prensa).
19. Del Rosal Rabes T, Baquero-Artigao F, Méndez-Echevarría AM, Mellado Peña MJ. Tuberculosis in infants less than 3 months of age. Enferm Infecc Microbiol Clin; 2015. pii: S0213-005X(15)00121-4.
20.** Khatami A, Britton PN, Marais BJ. Management of Children with Tuberculosis. Clin Chest Med. 2019; 40: 797-810.
21. Ruiz M, Guillén S, Prieto LM, Cacho JB, Álvarez A, Soto B, et al. Induced sputum versus gastric lavage for the diagnosis of pulmonary tuberculosis in children. BMC Infect Dis. 2013; 13: 222-6.
22. Cruz AT, Ong LF, Starke JR. Childhood pleural tuberculosis: a review of 45 cases. Pediatr Infect Dis J. 2009; 28: 981-84.
23. Stockdale L, Fletcher H. The Future of Vaccines for Tuberculosis. Clin Chest Med. 2019; 40: 849-56.
Bibliografía recomendada
- Pérez-Vélez C, Marais BJ. Tuberculosis in children. N Engl J Med. 2012; 367: 348-61.
Artículo de referencia básico, de enorme difusión, con revisión global del tema por dos de los mayores expertos mundiales, que describe similitudes y diferencias con TB de adultos.
- Mellado Peña MJ, Santiago García B, Baquero-Artigao F, Moreno Pérez D, Piñeiro Pérez R, Méndez Echevarría A, et al. Actualización del tratamiento de la tuberculosis en niños. An Pediatr (Barc). 2018; 88: 52.e1-52.e-12.
Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP), con nuevas recomendaciones sobre limitar la profilaxis postexposición a menores de 5 años e inmunodeprimidos, y actualización del tratamiento, incluido TB-resistente.
- Moreno-Pérez D, Andrés-Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Duran D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010; 72: 283.e1-283.e14.
Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP) y de la Sociedad Española de Neumología Pediátrica (SENP), básico en cuanto a manejo diagnóstico en niños expuestos, con ITLB y ETB con pauta de actuación e interpretación diagnóstica, que seguimos en la práctica clínica en España.
- Méndez-Echeverría A, Baquero-Artigao F. Tuberculosis pulmonar. Pediatr Integral. 2016; 20: 109-18.
Excelente revisión actualizada en fecha de publicación hace 4 años sobre: epidemiología, fisiopatología, clínica, diagnóstico y tratamiento de tuberculosis en niños, que es la base del presente trabajo.
- Holmberg PJ, Temesgen Z, Banerjee R. Tuberculosis in children. Pediatr Rev. 2019; 40: 168-78.
Magnífica revisión actualizada sobre aspectos fundamentales de TB en Pediatría, con el enfoque de la AAP y sobre actuación del pediatra general en el enfoque diagnóstico terapéutico de TB en niños.
- Khatami A, Britton PN, Marais BJ. Management of Children with Tuberculosis. Clin Chest Med. 2019; 40: 797-810.
Actualización más reciente sobre: tratamiento, monitorización de adherencia y toxicidad, con excelentes tablas y reciente clasificación de fármacos antituberculosos de la OMS.
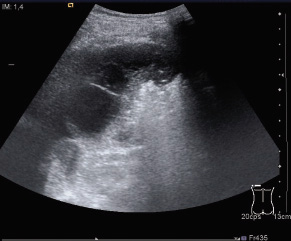
| Caso clínico: derrame pleural en niño de 11 años de origen peruano |
|
Motivo de consulta: varón de 11 años derivado por su pediatra por dolor en flanco izquierdo. En la historia actual, refieren un cuadro de 2 semanas de dolor en flanco izquierdo intermitente, que aumenta con la respiración profunda, acompañado de tos seca leve sin fiebre u otra sintomatología. Recibe tratamiento con ibuprofeno, con mejoría parcial y transitoria. En los antecedentes personales destaca que nació en Perú, viviendo en España los 5 años previos. Estuvo ingresado a los 9 meses por neumonía extrahospitalaria con evolución favorable. Calendario vacunal completo al llegar a España a los 6 años. En los antecedentes familiares destaca un tío materno, con el que tuvo contactos ocasionales, diagnosticado de tuberculosis pulmonar, tres años antes en Perú. En la exploración física, se objetiva: peso: 41,2 kg (P50-75); talla: 140 cm (P25-50). Frecuencia resp.: 20 rpm. Tª: 35,8ºC, con buen estado general. No se evidencian signos de dificultad respiratoria, destacando hipoventilación en hemitórax izquierdo y cicatriz de BCG en hombro izquierdo. Pruebas complementarias: Hemograma: Hb: 10,6 g/dl; VCM: 78; Leucocitos: 5900/uL (67% P, 23% L, 9% M, 1% E); Plaquetas: 579.000. Bioquímica: Transaminasas normales; LDH: 400; Creatinina: 0,5 mg/dl; Proteínas totales: 8,6 g/l (albúmina 4.6 g/l). PCR: 83,8 mg/l. Se solicita Rx tórax, que se sigue de una ecografía torácica, con las siguientes imágenes (Fig. 7 y 8). Figura 7. Figura 8. La Rx de tórax es informada como escoliosis y derrame pleural izquierdo. Sin condensación. Sin adenopatías mediastínicas. La ecografía muestra líquido pleural tabicado. Ante estos hallazgos, se solicita una prueba de tuberculina (PT) y toracocentesis, que muestra lo siguiente: 1.500 células (97% Monocitos, 3% PMN); Glucosa: 65 mg/dl; Proteínas: 5,9 g/l; pH: 7,29; LDH: 543 UI/l; Tinción de Gram: (-); Ag de neumococo: (-); Tinción de Ziehl-Neelsen: (-). Enseñanzas del caso: la más importante es que la ETB se podría haber prevenido en este niño. Con antecedentes de TB y viniendo de un país de alta prevalencia, llevaba 5 años en España y nunca se le había hecho la PT. Si se hubiera hecho cuando llegó a España a la edad de 6 años, es posible que la PT fuera positiva y siendo asintomático que fuera diagnosticado de ITLB, con lo cual se habría beneficiado de tratamiento con INH, impidiendo la progresión a enfermedad, unos años más tarde. Es importante recordar que la adolescencia es un período donde es más frecuente la clínica y las reactivaciones. Otra enseñanza del caso es la positividad de la baciloscopia en esputo, siendo negativa en jugos gástricos, lo que muestra que la combinación de jugos gástricos y esputo inducido podría aumentar la rentabilidad diagnóstica(21).
|







 New approach in the treatment of children with asthma
New approach in the treatment of children with asthma 