 |
| Temas de FC |
F. Álvarez Caro, M. García González
Unidad de Neumoalergia Infantil, Hospital Universitario de Cabueñes, Gijón
| Resumen
El asma es la enfermedad crónica más frecuente en Pediatría en muchos países. Se entiende, cada vez más, como un síndrome, que engloba pacientes que presentan síntomas recurrentes provocados por una obstrucción variable de la vía aérea inferior, tales como: respiración ruidosa y dificultosa, opresión torácica y tos, que varían en el tiempo y en intensidad; si bien, la causa de la misma puede diferir entre pacientes, existiendo, por tanto, distintos tipos de asma. Fisiopatológicamente, se trata de una inflamación crónica de las vías respiratorias, en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada en parte por factores genéticos. El diagnóstico es eminentemente clínico. Una historia de síntomas crónicos o intermitentes sugestivos, junto con exploración física compatible sugiere su presencia. La confirmación se basa en la demostración de obstrucción reversible, hiperreactividad bronquial o variabilidad de función pulmonar. La clasificación de la gravedad es fundamental para establecer un tratamiento apropiado. Esta se realizará con el paciente libre de tratamiento, en caso contrario, se puede estimar en función del escalón terapéutico de base mínimo necesario para mantener un buen control. Para determinar este último, existen diversos cuestionarios sencillos aplicables en la práctica clínica habitual. |
| Abstract
Asthma is the most frequent chronic disease in pediatrics in many countries. It is increasingly being understood as a syndrome, which includes patients who experience recurrent symptoms caused by a variable obstruction of the lower airway, such as noisy and difficult breathing, chest tightness and cough, which vary across time and in intensity, although its cause may differ among patients, therefore indicating the existence of different types of asthma. Pathophysiologically, it is a chronic inflammatory airway disease conditioned partially by genetic factors, involving different types of cells and mediators of inflammation. The diagnosis is eminently clinical. A history of suggestive intermittent or chronic symptoms along with compatible physical examination suggests its presence. Confirmation is based on the demonstration of reversible obstruction, bronchial hyperresponsiveness, or variability in lung function. Severity classification is essential to establish an appropriate treatment. This will be performed once the patient is free of treatment, otherwise it can be estimated based on the minimum maintenance therapeutic step necessary to obtain adequate control. To asses control, there are several simple questionnaires applicable in routine clinical practice. |
Palabras clave: Asma; Pediatría; Sibilancias.
Key words: Asthma, Pediatrics; Wheezing.
Pediatr Integral 2021; XXV (2): 56 – 66
Asma: concepto, fisiopatología, diagnóstico y clasificación
Concepto
El asma es una enfermedad inflamatoria crónica de las vías respiratorias en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada en parte por factores genéticos y que cursa con episodios recurrentes de hiperrespuesta bronquial y una obstrucción variable al flujo aéreo, total o parcialmente reversible, ya sea por la acción medicamentosa o espontáneamente.
La tendencia actual es usar términos “paraguas” para definir enfermedades con manifestaciones clínicas comunes, originadas por etiologías diferentes y con sustratos fisiopatológicos probablemente distintos. Así, el asma se entiende cada vez más como un síndrome, que engloba pacientes con síntomas recurrentes provocados por una obstrucción variable de la vía aérea inferior, como: respiración dificultosa, opresión torácica y tos, que varían en el tiempo y en intensidad. Si bien, la causa de la misma puede diferir entre ellos, existiendo, por tanto, “distintos tipos de asma”, lo que la convierte en la enfermedad crónica pediátrica de vías respiratorias inferiores más común(1,2). Fisiopatológicamente, se basa en una inflamación crónica de la vía aérea, en cuya patogenia intervienen diversas células y mediadores de la inflamación, condicionada por factores genéticos y que cursa con episodios recurrentes de hiperrespuesta bronquial y obstrucción variable al flujo aéreo, total o parcialmente reversible por la acción medicamentosa o espontáneamente(1).
Las dificultades en su definición se incrementan en los más pequeños, puesto que es en ellos donde el asma presenta unas particularidades que condicionan: diagnóstico, gravedad, grado de control, evolución y tratamiento. De hecho, en lactantes y preescolares, se recurría al III Consenso Internacional Pediátrico, que define el asma como: “sibilancias recurrentes y/o tos persistente en una situación en la que el asma es probable y se han descartado otras enfermedades más frecuentes”(3). Esta tendencia se ve refrendada por las últimas guías de consenso que expresan que el diagnóstico a esta edad es probabilístico, probabilidad que se ve aumentada si coexiste atopia(1). En este sentido no se debiera eludir el término de asma cuando hay más de 3 episodios al año, o episodios graves, de tos, sibilancias y dificultad respiratoria, con buena respuesta al tratamiento de mantenimiento con corticoides inhalados y si se produce un empeoramiento tras su retirada(1).
Fenotipos
Los niños con sibilancias recurrentes se pueden fenotipar epidemiológicamente o desde un punto de vista sintomático. A pesar de estos fenotipos, carecemos de certezas que indiquen una relación concluyente entre factores de riesgo y el ulterior desarrollo de asma en la edad adulta.
Los fenotipos se han definido para identificar las características y factores de riesgo asociados a los niños con sibilancias recurrentes, sin embargo la relación entre los factores de riesgo y el posterior desarrollo de asma no es concluyente. Tampoco existe evidencia que la presentación fenotípica sea estable en el tiempo o que un tratamiento sea más efectivo para un determinado fenotipo(4). Epidemiológicamente, según el Tucson Children´s Respiratory Study (TCRS), existirían 4 fenotipos:
1. No sibilantes (51%).
2. Sibilantes precoces transitorios (20%): presentan sibilancias antes de los 3 años de vida, dejando de presentar sintomatología en torno a los 6 años.
3. Sibilantes persistentes (14%): presentan sibilancias antes de los 3 años de vida y persisten a los 6 años.
4. Sibilantes de inicio tardío (15%): comienzan con sibilancias entre los 3 y 6 años.
Tanto los sibilantes persistentes como los de inicio tardío son los que presentan un mayor riesgo de presentar síntomas de asma en la adolescencia y edad adulta(5). Estudios prospectivos posteriores han redefinido los niños sibilantes en(6):
• Sibilantes transitorios del lactante: presentan síntomas en el primer año de vida que se resuelven en la edad preescolar. Se asocia a: menor función pulmonar (FP), vías aéreas intrapulmonares más estrechas, exposición pasiva a tabaco durante el embarazo, hermanos mayores y asistencia a guardería.
• Sibilantes persistentes no atópicos: empiezan con sintomatología en los primeros años de vida, resolviéndose en la media infancia. Se asocia a ausencia de sensibilización alergénica y de hiperreactividad bronquial (HRB) con metacolina.
• Sibilantes persistentes atópicos/Ig-E asociados: pueden empezar en los primeros años de vida, incrementando su prevalencia con la edad. Asocian: historia personal y familiar de atopia, HRB con metacolina y crecimiento pobre de la FP.
Los fenotipos epidemiológicos están limitados por su carácter retrospectivo, por lo que la European Respiratory Society (ERS) clasifica los niños sintomáticamente en(7):
• Sibilancias episódicas virales: presentan sibilancias habitualmente asociadas a infecciones respiratorias (IR), con ausencia de sintomatología entre episodios.
• Sibilancias por múltiples estímulos: con síntomas tanto en crisis como intercrisis. Los desencadenantes incluyen: virus, alérgenos, ejercicio o irritantes, entre otros.
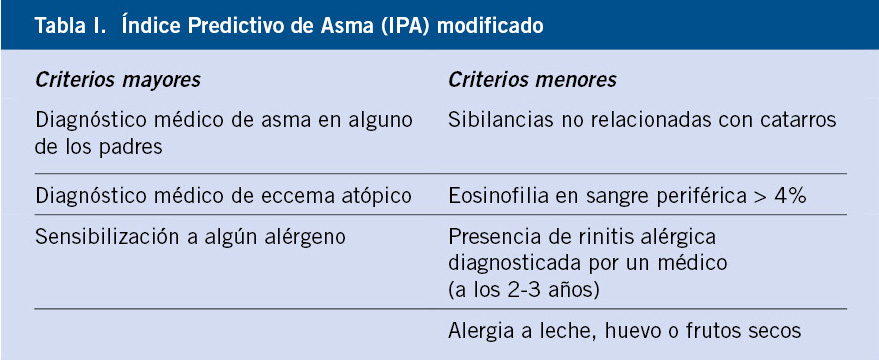
Diversos índices predictivos tratan de identificar los niños que continuarán presentando sibilancias en etapas posteriores. Se basan en la determinación de factores de riesgo fácilmente inidentificables en la anamnesis o exploración física. El pionero fue el Índice Predictivo de Asma (IPA), aplicable a aquellos niños que hubieran presentado sibilancias en, al menos, una ocasión(8). Fue modificado posteriormente, incluyendo la presencia de sensibilizaciones/alergias a neumo o trofoalergenos. La tabla I recoge su última versión(9). Se considera positivo, al menos, 1 criterio mayor o 2 menores.
Por tanto, niños <3 años con sibilancias recurrentes e IPA+ tendrán una elevada probabilidad de padecer asma atópico (aumenta 4-10 veces el riesgo de desarrollar asma a los 6-13 años), mientras que no la tendrán el 95% de los que tienen IPA-. Así, la sensibilización a alérgenos ambientales o alimentarios, tanto más cuanto mayor sea su número, es un indicador de riesgo de desarrollo de asma alérgico(9).
Prevalencia y factores de riesgo
El asma es una de las enfermedades crónicas más prevalentes en Pediatría. Diversos factores de riesgo se han asociado a su desarrollo, siendo: la atopia, la función pulmonar disminuida y las infecciones respiratorias, los más comúnmente relacionados.
El asma es un problema sanitario mundial, siendo una de las enfermedades crónicas pediátricas más frecuentes, si no la más, en muchos países(5). Existe variación geográfica con tasas más altas en países desarrollados. Experimentó un incremento notable en la década de los 80-90 y, en menor medida, en los años 2000, para posteriormente estabilizarse. En España, se han publicado estudios que tratan de establecer su prevalencia, pero la falta de protocolos estandarizados y la dificultad para su definición impiden su comparación(2). Globalmente, se sitúa en torno al 10%(10).
Factores genéticos, exposiciones perinatales, factores ambientales e intrínsecos del paciente contribuyen a su desarrollo. Uno de los más estudiados es la atopia, siendo esta un factor predisponente de persistencia de los síntomas(11). La “marcha atópica” se refiere al niño que empieza presentando sintomatología de dermatitis atópica y progresa posteriormente al desarrollo de: alergia alimentaria, rinoconjuntivitis alérgica y asma.
La FP reducida es otro factor de riesgo, estando más alterada en niños con sibilancias persistentes(5), pero la edad a la que se demuestra su reducción varía entre estudios(5,12). Finalmente, diversos patógenos respiratorios se han relacionado con riesgo de sibilancias recurrentes y asma(13).
Fisiopatogenia
El asma es un síndrome multifactorial en cuya fisiopatología intervienen tanto mecanismos inmunológicos, mayoritariamente IgE mediados, como no inmunológicos. La hiperreactividad bronquial es una característica definitoria.
Existirían dos vías por la que los factores predisponentes podrían facilitar la aparición de sibilancias recurrentes y asma(14):
1. Inmunológica: relacionada mayoritariamente con una alteración del equilibrio entre linfocitos Th1 (LTh1) y Th2 (LTh2). Este disbalance ocasionaría una respuesta inadecuada a infecciones virales los primeros años de vida. Es un mecanismo fundamental en el asma alérgico, traduciéndose en una inflamación de la vía aérea mediada por la IgE. La fase inflamatoria precoz consistiría en que las células presentadoras de antígeno presentarían el mismo a los LTh2, que en su proceso de activación secretarían diversas interleucinas (IL-4, IL-5 e IL-13). Activarían los linfocitos B que secretarían IgE específica que se uniría a receptores mastocitarios, de eosinófilos y basófilos, sensibilizando al paciente. En una exposición ulterior, el alérgeno se uniría a la IgE presente en las células efectoras, liberando distintos mediadores (histamina, prostaglandinas, leucotrienos, etc.), que contribuirían a la inflamación y sintomatología. La fase inflamatoria tardía consistiría en el reclutamiento en zonas de exposición alergénica de células inflamatorias (eosinófilos, basófilos, LTh, entre otras). En lactantes con sibilancias virales, la inflamación sería mayoritariamente neutrofílica(2).
2. Desarrollo pulmonar inadecuado: una maduración pulmonar inadecuada en época fetal, o una reestructuración o remodelado secundario a IR víricas graves, pudieran ser la causa de sibilancias recurrentes no atópicas.
Sea cual fuere la predisposición y mecanismo implicado, se traduciría en un estrechamiento de las vías aéreas a través de distintos procesos(14):
• Constricción del músculo liso bronquial.
• Engrosamiento inflamatorio de la mucosa bronquial. Se puede producir un remodelamiento bronquial donde destaca el papel de los fibroblastos.
• Hipersecreción de células mucosas y descamación del epitelio bronquial.
Una característica definitoria del asma es la HRB, entendida como una respuesta broncoconstrictora exagerada frente a estímulos: físicos, químicos o ambientales. Si bien, no es específica de asma, los asmáticos presentan una HRB a dosis más bajas de estímulos que son inocuos en niños sanos. Es fundamental la contracción excesiva de la musculatura lisa, si bien, su mecanismo exacto es incierto. Pudieran influir alteraciones en la masa muscular o función de la misma, una sensibilidad aumentada de determinadas vías neurales o un estrechamiento de la vía aérea, entre otras.
Etiopatogenia
El asma es una enfermedad poligénica multifactorial, en la que los genes no solo influyen en su desarrollo, sino también influyen y condicionan la respuesta terapéutica. Factores exógenos como: alérgenos, infecciones o irritantes influyen tanto en las exacerbaciones como en su desarrollo.
El asma es una enfermedad que resulta de la interacción de factores genéticos y ambientales. Hay que diferenciar entre factores causantes de su desarrollo, mayoritariamente intrínsecos, y los desencadenantes de los síntomas, mayoritariamente extrínsecos. Dentro de los dependientes del individuo destacan:
• Factores genéticos y epigenéticos: estudios demuestran una herencia poligénica con heredabilidad del 25-80%(15). La historia de atopia es un factor predisponente, incrementando 10-20 veces el riesgo de asma(2). Unos genes influirían en su desarrollo, mientras que otros lo harían en su gravedad o respuesta terapéutica. La epigenética es un mecanismo por el que el ambiente interacciona con el genoma para causar cambios en la expresión genética. Existen datos que sugieren el papel de la misma en la patogénesis del asma: en primer lugar, la concordancia entre gemelos monocigotos es solo del 50%(16); en segundo lugar, las interacciones genético-ambientales, como la observada entre tabaquismo materno en el embarazo y el antagonista del receptor de IL-1 con riesgo incrementado de asma en el descendiente(17); y en tercer lugar, la distinta prevalencia entre sexos(18). Por tanto: infecciones, dieta, tabaco o contaminantes, pueden inducir cambios epigenéticos y aumentar el riesgo de asma. La genética también se ha asociado a distinta respuesta terapéutica; así, variantes en el gen del receptor B2-adrenérgico, como la homocigosis Arg16Arg, se pudieran asociar a menores pico-flujo durante el tratamiento con salbutamol, frente a los homocigotos Gly16Gly(19). Otros genes condicionarían la respuesta a corticoides o antileucotrienos(20).
• Obesidad: existe mayor prevalencia en obesos (dependiente del índice de masa corporal)(21). Hormonas como la leptina, pudieran favorecer el riesgo de asma.
• Sexo: el asma pediátrico es predominantemente masculina, siendo máxima la diferencia en torno a la pubertad. Después, a partir de los 20 años, se iguala hasta la década de los 40 para, posteriormente, ser predominantemente femenina(22).
• FP neonatal: existe correlación entre FP al nacimiento y asma a los 10 años(12).
Dentro de los factores desencadenantes ambientales destacan:
• Exposición alergénica. Los alérgenos son conocidos como causa de exacerbación, pero su papel en el desarrollo del asma es incierto. Existe un consenso emergente de que alérgenos de interior tienen un papel en el desarrollo de asma, si bien, establecer una relación causal es complejo(23). Estudios demuestran un nivel mínimo de alérgeno necesario para el desarrollo de asma sin existir dosis-respuesta a partir de dicho nivel(24). La exposición en etapas precoces a animales domésticos (perro y gato), se ha mostrado como factor protector(23). Al igual que la exposición a animales de granja y vivienda rural, que se correlacionan negativamente con el desarrollo de asma. Si es debido a una mayor exposición alergénica o a un incremento de la exposición a agentes microbianos, es objeto de debate.
• IR. Si bien, son claras desencadenantes de exacerbaciones, su papel causante, favorecedor o protector de asma es incierto. Posiblemente, dependa: del tipo de infección, del número, de la susceptibilidad genética y de factores como: edad, atopia y microbioma. Las infecciones en lactantes por el virus respiratorio sincitial (VRS) y rinovirus predicen asma futura. Existe evidencia epidemiológica de la relación entre bronquiolitis VSR+ y sibilancias recurrentes, siendo mayor si tiene historia familiar atópica(25). Asimismo, se han relacionado infecciones por M. pneumoniae y riesgo de asma(26). Opuestamente, algunas infecciones pueden ser protectoras del desarrollo de asma. Las enfermedades alérgicas estarían relacionadas con el tamaño familiar, disminuyendo su incidencia con el número de hermanos(27). Así, en familias numerosas, pudiera existir menor riesgo, llevando a suponer que niños con hermanos mayores y mayor riesgo de infecciones, tienen menos probabilidad de padecer asma. Así, la “hipótesis higiénica” propone que las infecciones en la infancia temprana pueden proteger del desarrollo de asma(28).
• Exposición al tabaco. Uno de los principales factores de riesgo y quizás el más evitable(10). Su exposición postnatal, y muy especialmente prenatal, se asocia a peor FP y mayor incidencia de síntomas asmáticos.
• Contaminación ambiental. Su exposición en las primeras etapas de la vida, incrementa el riesgo de asma. Es especialmente relevante la asociación con los niveles de dióxido de nitrógeno. Las sustancias contaminantes están suspendidas en el aire de ciudades, especialmente en zonas próximas a carreteras, existiendo relación entre vivir en dichas zonas y riesgo de asma(29).
• Clima. Condiciones climáticas pueden afectar a niveles de alérgenos. El calentamiento global influiría en las estaciones polínicas y en el incremento de exacerbaciones por contaminación o IR.
• Dieta. La lactancia materna parece asociarse a menor incidencia de sibilancias en los primeros 2 años de vida. Su papel protector en etapas ulteriores es controvertido. La suplementación con vitamina D (400 UI/día) en lactantes prematuros ha demostrado disminuir las sibilancias durante el primer año de vida(30). Asimismo, su suplementación materna durante la gestación pudiera reducir el riesgo de asma.
• Exposición a fármacos. Si bien, el uso de paracetamol se relacionó con mayor riesgo de asma, dado que pudiera reducir los niveles pulmonares de glutatión, la evidencia actual concluye que su consumo no incrementa el riesgo. Asimismo, no se ha demostrado que el ibuprofeno o antibióticos lo favorezcan igualmente(31).
Diagnóstico de asma
El diagnóstico es eminentemente clínico. Una historia de síntomas crónicos o intermitentes sugestivos, junto con exploración física compatible sugiere su presencia. La confirmación se basa, si es posible, en la demostración de obstrucción reversible, hiperreactividad bronquial o variabilidad de función pulmonar y exclusión de otros diagnósticos.
El diagnóstico depende del concepto que se tenga del asma. En lactantes y preescolares es especialmente complejo establecer un diagnóstico concluyente. Por ello, se tendía a evitar la palabra asma; si bien, hoy por hoy, se recomienda utilizar este término como una etiqueta descriptiva de una constelación de signos y síntomas, haciendo menos controvertido el diagnóstico(32).
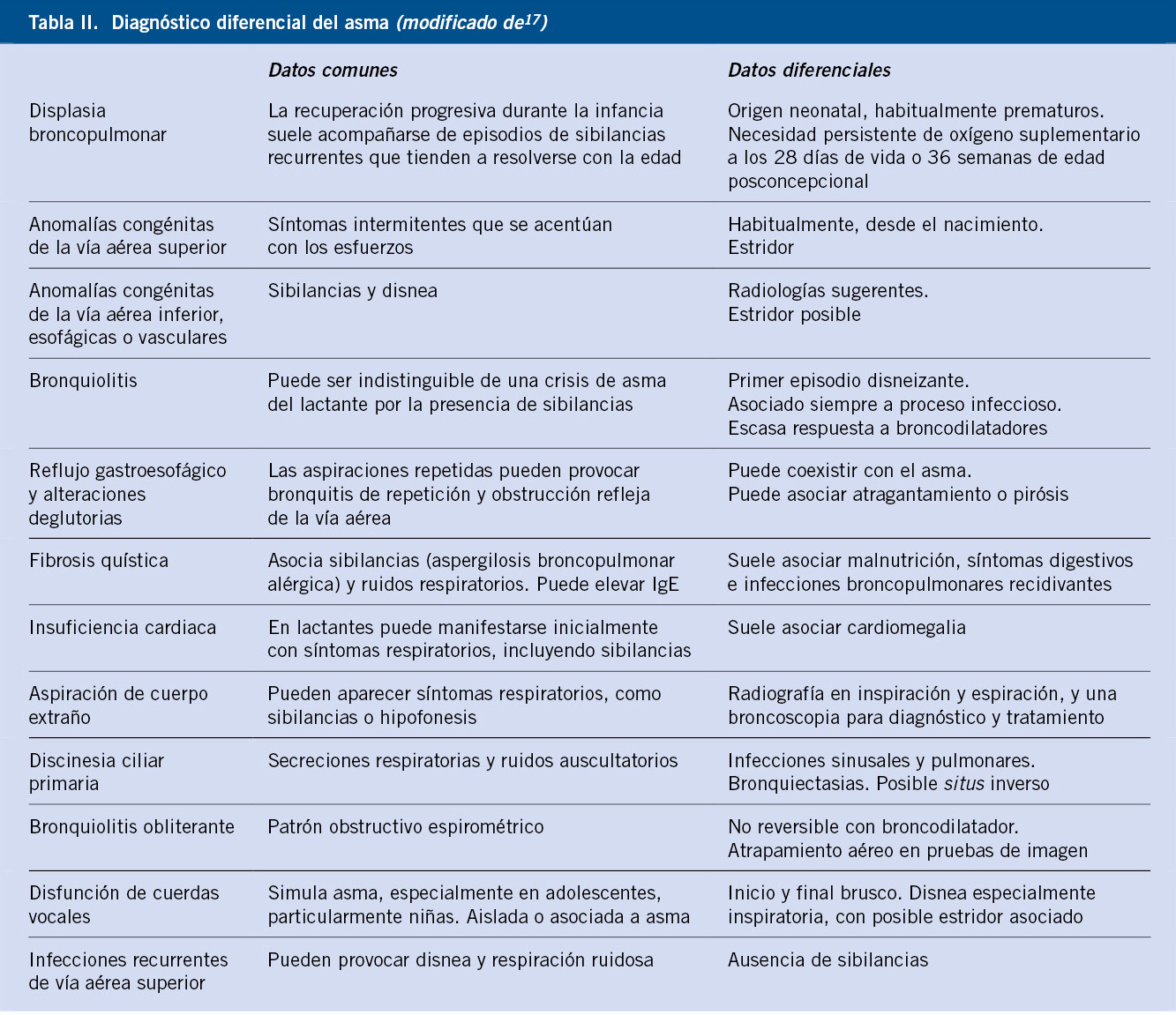
El diagnóstico clínico se basa en el reconocimiento de los síntomas propios (tos, sibilancias, disnea u opresión torácica) en ausencia de diagnóstico alternativo(2). La tos aislada no es suficiente para establecer el diagnóstico. La anamnesis debe indagar sobre antecedentes personales y familiares, prestando especial atención a los neonatales y de atopia. Es importante valorar el entorno, para identificar factores desencadenantes alérgicos y no alérgicos, y la respuesta al tratamiento. La edad y forma de inicio son útiles para delimitar el diagnóstico diferencial que se recoge en la tabla II.
En la exploración física conviene comprobar: aspecto general, morfología torácica, valores somatométricos, valorar el estado de la piel en busca de datos de atopia, rasgos faciales, así como valorar vía aérea superior e inferior.
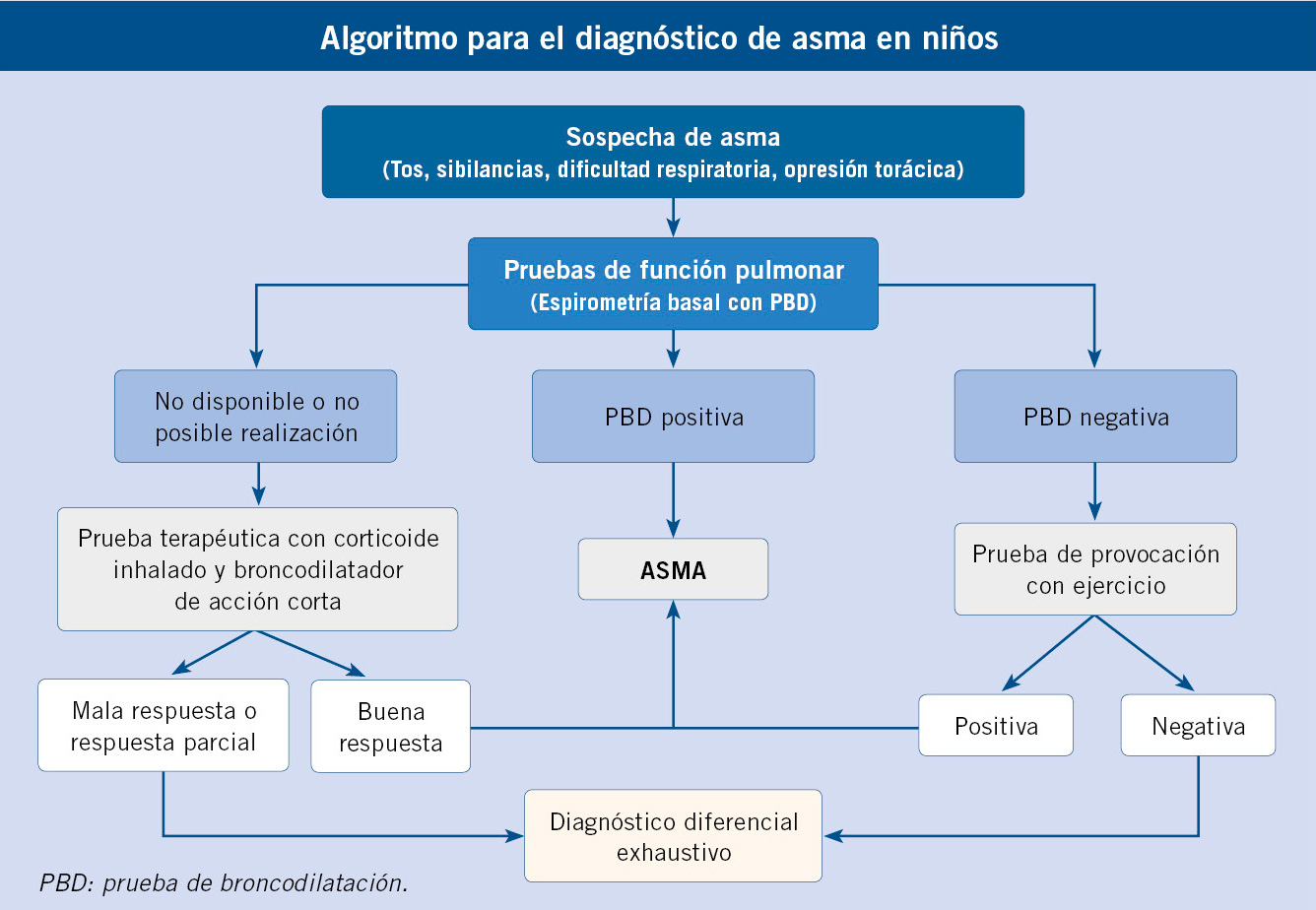
En niños no colaboradores (<5-6 años), es infrecuente necesitar pruebas complementarias; mientras que en colaboradores, la valoración de la FP es deseable. Destaca la espirometría forzada, realizable por la mayoría de niños >6 años. Es útil para el diagnóstico, pero especialmente para el seguimiento, al tener menor rentabilidad diagnóstica que en adultos, dado que el volumen espirado forzado en el primer segundo (FEV1) suele ser normal incluso en formas graves; por tanto, una espirometría normal no excluye el diagnóstico(10). Los parámetros a considerar son el FEV1, la capacidad vital forzada (FVC) y la relación FEV1/FVC. Esta última se correlaciona mejor con la gravedad, considerándose obstrucción si es <80-85%(1), o incluso si se sitúa por <90%(4). En relación al resto de valores, se consideran normales FEV1 y FVC ≥80%. Con respecto a los mesoflujos, valores <65% pudieran correlacionarse con obstrucción reversible en niños con FEV1 normal(33). Finalmente, el flujo máximo en la espiración forzada es dependiente del esfuerzo y una variabilidad ≥20% es sugerente de asma.
En el 2007, se comenzó a ampliar la edad de realización de esta maniobra a niños entre 2-6 años, prestando especial hincapié al FEV0,5. Es un parámetro útil y fiable, incluso clínicamente más relevante que el FEV1(34), dado que los niños más pequeños tienen una vía aérea proporcionalmente más larga en relación al volumen pulmonar, pudiendo realizar una espiración completa en menos de un segundo. Si bien, tradicionalmente la valoración de la espirometría se realiza en base al porcentaje de normalidad respecto a valores de referencia, existen ecuaciones de regresión para cada edad, que valoran los resultados en relación al límite inferior de normalidad y Z-scores(10). En <2-3 años se utiliza, como alternativa a la espirometría, la oscilometría de impulsos. Las consideraciones técnicas espirométricas se recogen en la tabla III.
La prueba de broncodilatación (PBD) estudia la reversibilidad de la obstrucción al flujo aéreo. Consiste en una espirometría basal con posterior repetición tras administración de broncodilatador (habitualmente, cuatro dosis de 100 μg de salbutamol separadas por 30 segundos). Tiene utilidad para el diagnóstico y debe realizarse rutinariamente, incluso con valores basales normales. La mayoría de niños tiene un asma intermitente o leve, por lo que en muchos es negativa, sin que ello excluya el diagnóstico. Se considera positiva un aumento del FEV1 ≥12% respecto al valor basal o >9% respecto al valor teórico.
Si aun así el diagnóstico es incierto, pueden ser útiles pruebas de provocación bronquial para demostrar HRB inespecífica. Se pueden utilizar estímulos, como ejercicio o agentes, tanto directos (metacolina o histamina) como indirectos (adenosina monofosfato, manitol o solución salina hipertónica). Se considera positiva una caída del FEV1 respecto al basal ≥10%(34). El test de esfuerzo es fácil de realizar y reproducible, con alta especificidad, siendo el de elección en niños(35). La interpretación debe hacerse junto a la clínica, puesto que la HRB no es exclusiva de asma.
Dado el carácter inflamatorio del asma, es útil observar el grado y el tipo de inflamación. Existen técnicas no invasivas que determinan la fracción exhalada de óxido nítrico (FeNO). Es un marcador de inflamación eosinofílica, fácilmente reproducible y reducible por corticoides inhalados, lo que le confiere utilidad, tanto diagnóstica como para monitorizar y ajustar el tratamiento(36). Se han propuesto puntos de corte que permitirían distinguir el paciente con asma; si bien, su normalidad no excluye el diagnóstico. Se han establecido niveles de normalidad <35 ppb para <12 años y <50 ppb para >12 años(1). Su determinación se afecta por múltiples factores (dieta, maniobras espirométricas o ejercicio físico previo, corticoides inhalados, tabaco y etnia, entre otros)(36); por tanto, aunque el FeNO puede ser útil para el diagnóstico en algunos casos, es fundamental utilizarlo en consonancia con otras herramientas para optimizar el tratamiento, especialmente en los casos complejos. Otros métodos para valorar la inflamación de la vía aérea son la inducción de esputo o el lavado broncoalveolar.
Dada la relación entre asma y alergia, es importante realizar un estudio alergológico, si bien, debe tenerse presente que no es una relación inequívoca. Debe realizarse a todo paciente con sospecha o diagnóstico de asma, independientemente de su edad, si existen indicios de que un alérgeno pueda influir en el desarrollo o control del asma. Puede realizarse mediante técnicas in vivo (prick test) o in vitro (IgE específica). El prick test tiene alta sensibilidad y valor predictivo negativo, es fácil de realizar, permite estudiar múltiples alérgenos de forma rápida y sencilla, y tiene excelente perfil de seguridad (reacciones sistémicas <1/2.000.000 de pruebas), siendo la prueba de elección inicial(10). Se testarán, además del control negativo (suero salino fisiológico o gliceraldehido) y positivo (histamina 10 mg/dl), los neumoalérgenos más frecuentes de la zona geográfica y los alérgenos sospechosos. La técnica debe incluir personal entrenado en su realización e interpretación, y los extractos utilizados deben ser estandarizados. Se realiza en la superficie volar del antebrazo, puncionando la piel con una lanceta a través de la gota del extracto sin producir sangrado. Se usará una lanceta distinta para cada extracto. Se valora midiendo la pápula generada, considerándose positivo si >3 mm. Su positividad no se correlaciona necesariamente con la gravedad. El resultado puede influenciarse por corticoides tópicos y antihistamínicos orales. En el caso de los antihistaminicos orales de 2ª generación, deben suspenderse 7-10 días antes.
Como alternativa o complemento se puede determinar la IgE específica, siendo un método cuantitativo, más caro y lento. Para Atención Primaria (AP) se ha diseñado el InmunoCap Rapid, que determina IgE específica frente a 10 alérgenos, ambientales y alimentarios, de forma cualitativa y semicuantitativa. Recientemente, se ha perfeccionado el diagnóstico in vitro mediante el estudio de alérgenos moleculares que diferencian la sensibilización secundaria a reactividad cruzada frente a la primaria, más posiblemente responsable de la clínica(10). Es vital tener presente que los resultados del estudio, tanto in vivo como in vitro, no confirman el diagnóstico de alergia, sino solo la sensibilización a determinados alérgenos. El diagnóstico se establecerá por la positividad en el estudio junto con la relevancia clínica a dicho alérgeno, bien por el efecto observado tras la exposición natural o por prueba de exposición controlada.
La realización de otras pruebas estará dirigida a facilitar el diagnóstico diferencial y dependerá de cada caso, pudiendo estar indicadas las siguientes:
• Estudio inmunitario: hemograma, inmunoglobulinas y subclases. Pudiera realizarse un estudio más extenso con subpoblaciones linfocitarias y función del complemento.
• Test del sudor: para descartar fibrosis quística.
• Radiografía de tórax: especialmente indicada si se aprecian síntomas atípicos.
Clasificación del asma
La clasificación de la gravedad del asma es vital para establecer un tratamiento apropiado. Esta se realizará idealmente con el paciente libre de tratamiento, en caso contrario, se puede estimar la gravedad en función del escalón de tratamiento de base mínimo necesario para mantener al paciente bien controlado.
Establecido el diagnóstico, es conveniente clasificar la gravedad para poder iniciar el tratamiento apropiado. Una clasificación incorrecta puede implicar una prescripción inapropiada o insuficiente. La tabla IV refleja la clasificación clásica del asma según gravedad.
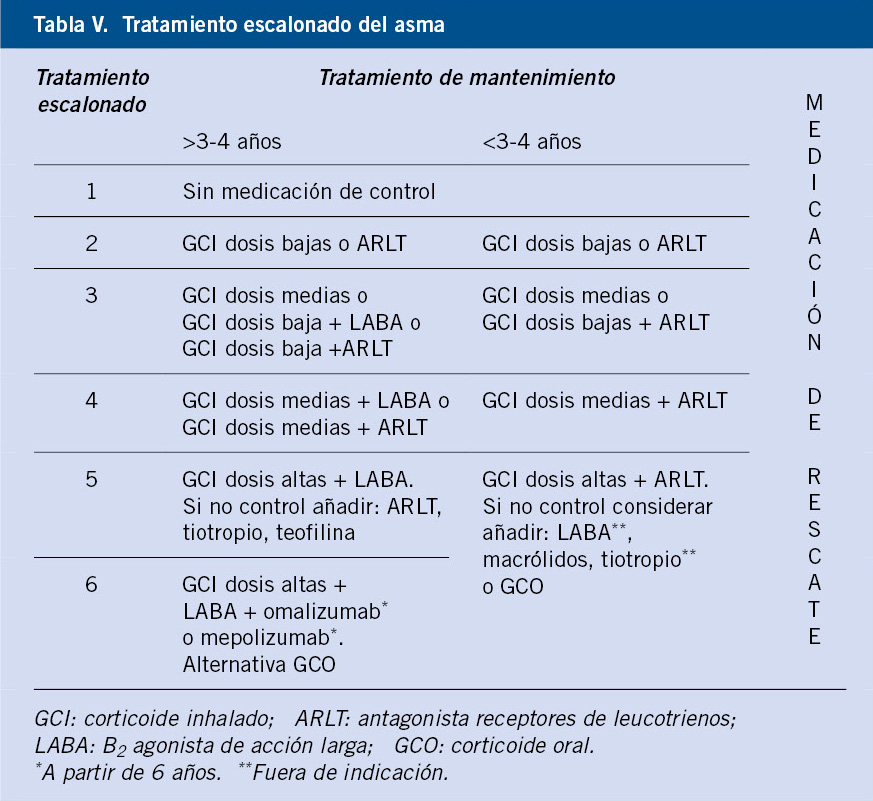
Esta clasificación valora frecuencia de síntomas y FP. El carácter de moderado o grave viene determinado por la frecuencia e intensidad de los síntomas, siendo el asma persistente, al menos, de carácter moderado. Si no es posible estudiar la FP, se clasificará de acuerdo exclusivamente a los síntomas. Es importante tener presente que para clasificar la gravedad el paciente debe estar sin tratamiento, hecho poco habitual. En caso contrario, se puede estimar en función del escalón terapéutico mínimo necesario para mantener buen control. Así, el niño que requiera un escalón 5-6 tendrá asma grave, el que precise un escalón 3-4 asma moderado, y el que requiera un escalón 1-2 asma leve (Tabla V)(1).
El asma es variable en el tiempo lo que dificulta su clasificación. Así, los niños pequeños tienen habitualmente asma solo con infecciones virales, pudiendo tener asma moderada/grave en invierno y estar asintomáticos en primavera y verano.
Control del asma
Incluye el control sintomático actual y el del riesgo futuro. Para determinar el primero, existen distintos cuestionarios, mientras que para el segundo, hay que valorar no solo los efectos secundarios del tratamiento, sino también los factores condicionantes de posibles limitaciones funcionales respiratorias futuras.
El control viene definido por el grado en que las manifestaciones se reducen o eliminan con el tratamiento. Su valoración es útil para la modificación del tratamiento e incluye dos componentes, el control actual y el riesgo futuro(4). Los criterios que definen el grado de control varían entre guías, pero se suele clasificar en asma bien o mal controlada(4). Su evaluación puede ser difícil, especialmente en niños pequeños. La mejor herramienta es la visita médica, y para facilitar evaluar el control actual, se han diseñado diversos cuestionarios. Destacan el cuestionario CAN (Control de Asma en Niños) y el Childhood Asthma Control Test (c-ACT), ambos validados en castellano.
• Cuestionario CAN: con versiones para niños de 9-14 años y padres de niños de 2-8 años. Evalúa las últimas 4 semanas y se puntúa entre 0 y 36. Se considera mal control una puntuación ≥8(37). El cuestionario CAN se recoge en la tabla VI.
• Cuestionario c-ACT: con versiones para ≥12 años (lo rellena el propio paciente) y para 4-11 años (4 preguntas para el niño y 3 para padres). También evalúa las 4 últimas semanas. La puntuación máxima son 25 puntos y se considera buen control si ≥20(38). El c-ACT para niños de 4-11 años se recoge en la figura 1.
Figura 1. Cuestionario c-ACT para niños de 4 a 11 años. Copyright GlaxoSmithKline. Usada con permiso.
El riesgo futuro evalúa la presencia de factores de riesgo de: exacerbaciones, desarrollar limitación fija del flujo aéreo (infratratamiento, prematuridad, exposición a tabaco, FEV1 bajo, asma grave, ingresos previos) y efectos secundarios (uso de corticoides orales, dosis altas de corticoides inhalados)(1,4). Además, es útil el control de la FP mediante espirometrías y, en algunos casos, de la inflamación mediante la FeNO. La FP es muy útil como indicador de riesgo futuro. Si no se controla con medicaciones habituales, es necesaria derivación a Neumoalergia infantil (Tabla VII).
Funciones del Pediatra de AP
El modelo óptimo de atención al niño asmático debe incluir al pediatra de AP y de Atención Especializada (AE). Dado que la mayoría de niños tiene asma leve/moderada y asumiendo el papel fundamental de la educación sanitaria y los controles periódicos, el pediatra de AP es primordial en la atención de estos niños. Sobre él recaerá la detección, siendo importante una anamnesis y exploración física apropiada, con especial atención a aquellos en los que las pruebas complementarias tienen menos valor. Establecida la sospecha, el pediatra de AP planteará el estudio de la FP (espirometría basal con PBD) y estudio alérgico, si se sospecha un desencadenante ambiental. Asimismo, evaluará el control mediante visitas periódicas, usando cuestionarios específicos y programará su periodicidad en función de la gravedad y control. Será apropiado en las mismas, la realización de espirometrías, independientemente de la valoración clínica, y una actuación educativa dirigida al niño y familia.
Como corolario, la labor del pediatra de AP en el diagnóstico y seguimiento de los niños con asma es vital, así como una buena coordinación con AE, para combinar el seguimiento en función de la gravedad, control y respuesta al tratamiento.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.** Guía española para el manejo del asma. GEMA 5.0 2020. Disponible en: www.GEMAsma.com.
2. García de la Rubia S, Pérez Sánchez S. Asma: concepto, fisiopatología, diagnóstico y clasificación. Pediatr Integral. 2016; XX(2): 90-3.
3. Warner JO, Naspitz CK. Third International Pediatric Consensus statement on the management of childhood asthma. International Pediatric Asthma Consensus Group. Pediatr Pulmonol. 1998; 25: 1-17.
4. GINA 2019. Global initiative for asthma. Global strategy for asthma management and prevention. Disponible en: www.GINAsthma.org.
5. Martínez FD, Wright Al, Taussig LM, Holberg CJ, Halonen M, Morgan WJ, et al. Asthma and wheezing in the first six years of life. The Group Health medical Associates. N Engl J Med. 1995; 332: 133-8.
6. Stein RT, Martínez FD. Asthma phenotypes in childhood: lessons form an epidemiological approach. Paediatr Respir Rev. 2004; 5: 155-61.
7. Brand PL, Baraldi E, Bisgaard H, Boner AL, Castro-Rodríguez JA, Custovic A, et al. Definition, assessment and treatment of wheezing disorders in preschool children: an evidence based approach. Eur Respir J. 2008; 32: 1096-110.
8. Castro-Rodríguez JA, Holberg CJ, Wright AL, Martínez FD. A clinical index to define risk of asthma in young children with recurrent wheezing. Am J Respir Crit Care Med. 2000; 162: 1403-6.
9. Guilbert TW, Morgan WJ, Zeiger RS. Atopic characteristics of children with recurrent wheezing at high risk for the development of childhood asthma. J Allergy Clin Immunol. 2004; 14: 1282-7.
10.** Moral Gil L, Asensio de la Cruz O, Lozano Blasco J. ASMA: Aspectos clínicos y diagnósticos. Protoc diagn ter pediatr. 2019; 2: 103-15.
11. Stern DA, Morgan WJ, Halonen M, Wright AL, Martínez FD. Wheezing and bronchial hyperresponsiveness in early childhood as predictors of newly diagnosed asthma in early adulthood: a longitudinal birth-cohort study. Lancet. 2008; 372:1058-64.
12. Haland G, Carlsen KC, Sandvik L, Devulapalli CS, Munthe-Kaas MC, Pettersen M et al. Reduced lung function at birth and the risk of asthma at 10 years of age. N Engl J Med. 2006; 355: 1682-9.
13. Holt PG, Upham JW, Sly PD. Contemporaneous maturation of immunologic and respiratory functions during early childhood: implications for development of asthma prevention strategies. J Allergy Cin Immunol. 2005; 116: 16-24.
14. Sánchez Sánchez E, García Marcos L. Actuación en el niño preescolar con sibilancias recurrentes. Protoc diagn ter pediatr. 2017; 1: 265-71.
15. Pellegrini J, De Arriba S. Sibilancias en el lactante. Bol Pediatr. 2014; 54: 72-7.
16. Nystad W, Roysamb E, Magnus P, Tambs K, Harris JR. A comparison of genetic and enviromental variantes structtures for asthma, hay fever and eczema with symptoms of the same diseases: a study of Norweigian twins. Int J Epidemiol. 2005; 34: 1302-9.
17. Ramadas RA, Sadeghnejad A, Karmaus W, Arshad SH, Matthews S, Huebner M, et al. Interleukin-1R antagonist gene and prenatal smoke exposure are associated with childhood asthma. Eur Respir J. 2007; 29: 502-8.
18. Weiss St, Gold DR. Gender differences in asthma. Pediatr Pulmonol. 1995; 19: 153-5.
19. Israel E, Drazen JM, Liggett SB, Boushey HA, Cherniack RM, Chinchilli VM, et al. The effect of polymorphisms of the beta(2)-adrenergic receptor on the response to regular use of albuterol in asthma. Am J Respir Crit Care Med. 2000; 162: 75-80.
20. Farzan N, Vijverberg SJ, Arets HG, Raaijmakers JAM, Maithland-van der Zee AH. Pharmacogenomics of inhaled corticosteroids and leukotriene modifiers: a systematic review. Clin Exp Allergy. 2017; 47: 271-93.
21. Egan KB, Ettinger AS, Bracken MB. Childhood body mass index and subsequent physician-diagnosed asthma: a systematic review and meta-analysis of prospective cohort studies. BMC Pediatr. 2013; 13: 121.
22. Weiss ST, Speizer FE. Epidemiology and natural history. En: Bronchial asthma mechanisms and therapeutics, 3rd, Weiss EB, Stein M (Eds), Little, Brown, Boston; 1993. p. 15.
23. Lynch SV, Wood RA, Boushey H, Bacharier LB, Bloomberg GR, Kattan M, et al. Effects of early life exposure to allergens and bacteria on recurrent wheeze and atopy in urban children. J Allergy Clin Immunol. 2014; 134: 593-601.
24. Torrent M, Sunyer J, García R, Harris J, Iturriaga MV, Puig C, et al. Early life allergen exposure and atopy, asthma, and wheeze up to 6 years of age. Am J Respir Crit Care Med. 2007; 176: 446-53.
25. Stein R, Sherrill D, Morgan W, Holberg G, Halonen M, Taussig L. Respratory syncitial virus in early life and risk of wheeze and allergy by age 13 years. Lancet. 1999; 354: 541-5.
26. Yeh JJ, Wang YC, Hsu WH, Kao CH. Incident asthma and Mycoplasma pneumoniae: a nationwide cohort study. J Allery Clin Immunol. 2016; 137: 1017-23.
27. Strachan DP. Hay fever, Hygiene and household size. BMJ. 1989; 299: 1259-60.
28. Martínez FD. Role of viral infections in the inception of asthma and allergies during childhood: could they be protective? Thorax. 1994; 49: 1189-91.
29. Modig L, Torén K, Jason C, Jarvholm B, Forsberg B. Vehicle exhaust outside the home and onset of asthma among adults. Eur Respir J. 2009; 33: 1261-7.
30. Hibbs AM, Ross K, Kerns LA, Wagner C, Fuloria M, Groh-Wargo S, et al. Effect of vitamin D supplementation on recurrent wheezing in black infants who were born preterm: the D-wheeze randomized clinical trial. JAMA. 2018; 319: 2086-94.
31. Marra F, Lynd L, Coombes M, Richardson K, Legal M, Fitzgerald JM, et al. Does antibiotic exposure during infancy lead to development of asthma?: a systematic review and metanalysis. Chest. 2006; 129: 610-8.
32. **Pavord ID, Beasley R, Agusti A, Anderson GP, Bel E, Brusselle G, et al. After asthma: redefining airways diseases. Lancet. 2018; 391: 350-400.
33. Simon MR, Chinchilla VM, Phillips BR, Sorkness CA, Lemanske Jr RF, Szefler SJ, et al. Forced expiratory flow between 25% and 75% of vital capacity and FEV1/forced vital capacity ratio in relation to clinical and physiological parameters in asthmatic children with normal FEV1 values. J Allergy Clin Immunol. 2010; 126: 527-34.
34. Sardón Prado O, Fidalgo Marrón L, González Pérez-Yarza E. Evaluación básica de la función pulmonar en el niño colaborador. Protoc diagn ter pediatr. 2017; 1: 31-47.
35. García de la Rubia S. Broncoespasmo inducido por ejercicio en el niño. Pediatr Integral. 2008; XII (2): 125-32.
36. Álvarez Caro F, Pérez Guirado A, Ruiz del Árbol Sánchez P, De Miguel Mallén A, Álvarez Berciano F. Óxido nítrico exhalado en el asma infantil. Arch Argent Pediatr. 2010; 108: 544-51.
37. Pérez-Yarza EG, Badía X, Badiola C, Cobos N, Garde J, Ibero M, et al; on behalf of the CAN Investigator Group. Development and validation of a questionnaire to asses asthma control in pediatrics. Pediatr Pulmonol. 2009; 44: 54-63.
38. Pérez-Yarza EG, Castro JA, Villa JR, Garde J, Hidalgo J; on behalf of the VESCASI Group. Validation of a Spanish version of the Childhood Asthma Control Test (Sc-ACT) for use in Spain. An Pediatr (Barc). 2015; 83: 94-103.
Bibliografía recomendada
- Guía española para el manejo del asma. GEMA 5.0 2020. Disponible en: www.GEMAsma.com.
Guía española de consenso para el manejo del asma, tanto en la edad pediátrica como en la edad adulta, en la que participan las principales sociedades implicadas en el manejo del paciente asmático.
- Pavord ID, Beasley R, Agusti A, Anderson GP, Bel E, Brusselle G, et al. After asthma: redefining airways diseases. Lancet. 2018; 391: 350-400.
Artículo que redefine el concepto de asma, adecuándolo a un término más amplio, equiparándolo a un síndrome, que englobaría distintos tipos de asma.
- Moral Gil L, Asensio de la Cruz O, Lozano Blasco J. ASMA: Aspectos clínicos y diagnósticos. Protoc diagn ter pediatr. 2019; 2: 103-15.
Artículo de revisión de los aspectos clínicos y diagnósticos más relevantes del asma pediátrico desde un enfoque global.
| Caso clínico |
|
Motivo de consulta: niño de 6 años que acude al centro de salud por mal control respiratorio en el último mes. Antecedentes familiares: madre fumadora habitual. Padre rinitis alérgica a ácaros del polvo y alergia a crustáceos. Antecedentes personales: recién nacido pretérmino de 34 semanas de gestación, que precisó ventilación mecánica no invasiva (CPAP) durante 1 semana. Alimentado con fórmula adaptada durante la lactancia. Alergia a huevo poco procesado (ovoalbúmina) ya superada. Resto de beikost sin incidencias. Dermatitis atópica flexural que controla con emolientes diarios y, ocasionalmente, corticoides tópicos (1 vez cada 4 meses). Calendario vacunal al día. Bronquiolitis a los 8 meses de vida. Posteriormente, desde los 3 años de vida, presentó episodios de disnea y sibilancias de forma recurrente, con una periodicidad inicial aproximada de 1 episodio cada 3 meses, por lo que se inició tratamiento de mantenimiento con fluticasona inhalada 50 mcg cada 12 horas, con buen control posterior, manteniendo dicho tratamiento en la actualidad. Enfermedad actual: niño de 6 años con asma que, en el último mes, a pesar de tratamiento de mantenimiento con fluticasona inhalada 50 mcg cada 12 horas, ha precisado asistencia en Urgencias en una ocasión por exacerbación respiratoria, requiriendo en dicho momento: salbutamol y corticoide oral. Asimismo, en dicho periodo de tiempo, refiere aparición de tos y sibilancias con el ejercicio físico habitualmente. Refiere, igualmente, tos seca irritativa diurna, pero especialmente nocturna, junto con sibilancias ocasionales, por lo que ha requerido salbutamol, tanto diurno como nocturno, con una periodicidad de 3 veces a la semana. Exploración física: peso de 25 kg. Frecuencia respiratoria: 25 rpm. Frecuencia cardiaca: 100 lpm. SatO2: 96%. Sin signos externos de dificultad respiratoria. Buena coloración. Eccema atópico en flexuras antecubitales y poplíteas. Saludo alérgico. Auscultación pulmonar: buena entrada de aire con sibilancias teleespiratorias. Insuficiencia ventilatoria nasal con rinorrea acuosa. Resto de exploración física: satisfactoria. Evolución: tras realizar exploración física, se realiza espirometría basal con los siguientes resultados: FEV1: 85%; FEV1/FVC: 87%; PBD: +15%. Igualmente, se administra cuestionario CAN objetivando puntuación de 14 puntos, por lo que se diagnostica de asma mal controlada, ajustándose tratamiento de mantenimiento a salmeterol/fluticasona inhalada 25/50 mcg cada 12 horas e incorporando bilastina oral y furoato de fluticasona intranasal para los síntomas nasales. En una revisión un mes más tarde, se constata mejoría en el control del asma, presentando en dicho momento una puntuación del cuestionario CAN de 2 puntos. Se realiza en dicho momento prick test, que evidencia positividad a ácaros (D. Pteronyssinus: 6 mm; D. Farinae: 6 mm; L. Destructor: 7 mm).
|






 New approach in the treatment of children with asthma
New approach in the treatment of children with asthma 