|
A.I. Dacosta Urbieta*/**, I. Rivero Calle*/**, J. Gómez-Rial**, F. Martinón-Torres*/**
*Servicio de Pediatría. Hospital Clínico Universitario. Santiago de Compostela. **Grupo de Genética, Vacunas, Infecciones y Pediatría (GENVIP). Instituto de Investigación Sanitaria de Santiago, Universidad de Santiago
Resumen El año 2020, el primero de la pandemia COVID-19, ha puesto en marcha un esfuerzo sin precedentes en la búsqueda de una vacuna frente al SARS-CoV-2. Se ha iniciado el desarrollo de más de 250 candidatos vacunales, de los cuales tres ya han sido aprobadas por las agencias reguladoras europeas. Las estrategias para desarrollarlas son variadas, algunas vacunas han optado por un enfoque clásico como las vacunas de: virus vivos atenuados, virus inactivados o de subunidades virales. En otros casos, se han empleado estrategias más novedosas, como las vacunas de ARNm y el uso de vectores virales. Entre las vacunas más destacadas están las de Moderna y Pfizer, ambas de ARNm; las vacunas de Astra Zeneca y del instituto de investigación de Gamelaya de vectores virales; la vacuna de Sinovac, de virus inactivados; y la de Novavax de subunidades. Todas estas vacunas utilizan como antígeno la proteína espicular (Spike [S]) del coronavirus. En este artículo se hace una revisión de las principales vacunas frente a la COVID-19 atendiendo a su mecanismo de acción, pauta de administración, perfil de seguridad y eficacia. |
| Abstract
The year 2020, the first year of the COVID-19 pandemic, has launched an unprecedented effort in the search for a vaccine against SARS-CoV-2. The development of more than 250 vaccine candidates has begun, of which three have already been approved by European regulatory agencies. The strategies to develop them are varied, some vaccines have opted for a classical approach such as live attenuated virus, inactivated virus or viral subunit vaccines. In other cases, newer strategies have been employed, such as mRNA vaccines and the use of viral vectors. Among the most prominent vaccines are Moderna and Pfizer, both mRNA; Astra Zeneca and the Gamelaya Viral Vector Research Institute’s vaccines; the Sinovac inactivated virus vaccine and the Novavax subunit vaccine. All these vaccines use as antigen the spicular protein (Spike [S]) of the coronavirus. This article reviews the main vaccines against COVID-19 taking into account their mechanism of action, administration guideline, safety profile and efficacy. |
Palabras clave: Vacunas; SARS-CoV-2; COVID-19; Vacunas ARNm; Vacunas vector viral.
Key words: Vaccines; SARS-CoV-2; COVID-19; MRNA vaccines; Viral vector vaccines.
Pediatr Integral 2020; XXIV (8): 494 –501
Vacunas frente al SARS-CoV-2: actualización práctica
Introducción
En octubre de 2019, el mundo recibió la noticia de que una nueva variante de coronavirus, denominada posteriormente SARS-CoV-2(1), era la causante de una serie de casos de síndrome de distrés respiratorio agudo en la ciudad china de Wuhan. Posteriormente, se conocieron otros fenotipos clínicos de la enfermedad, como fenómenos tromboembólicos o autoinmunes y pasó a conocerse como enfermedad causada por el coronavirus 2019 o por sus siglas COVID-19. El 11 de marzo de 2020, la Organización Mundial de la Salud (OMS) declaró la situación de pandemia. En los meses siguientes, fuimos testigos de cómo esta enfermedad se extendió rápidamente por el resto del mundo, causando una importante mortalidad, provocando cierres de la actividad económica, poniendo a prueba los sistemas sanitarios y cambiando por completo nuestras costumbres. Durante este tiempo, se han desarrollado diferentes estrategias terapéuticas tanto antivirales, entre los que destaca el remdesivir, como agentes inmunomoduladores, cuyo objetivo es atenuar la hiper-inflamación asociada a la enfermedad. Entre estos últimos, destacan la hidroxicloroquina, los corticoides y el tocilizumab, si bien hasta la fecha, solo el tratamiento con corticoides ha demostrado beneficio en la reducción de la mortalidad durante los ensayos clínicos realizados(3,4). Por todo ello, la gran esperanza para hacer frente a esta pandemia está depositada en el desarrollo de una vacuna segura y eficaz.
Desde que el 9 de noviembre de 2020 la farmacéutica Pfizer anunciase(5) que habían desarrollado una vacuna eficaz, el final de esta pandemia parece estar más cerca. Este anuncio marcó un hito en la historia de las vacunas, por la rapidez en la que se desarrollaron estos candidatos vacunales y por ser la primera vez que una vacuna de ARNm supera todas las fases de desarrollo clínico y se va a administrar a gran escala. Al poco de realizarse el anuncio de Pfizer, otras empresas farmacéuticas anunciaron los resultados de sus vacunas. En estos momentos, existen varios candidatos vacunales en diferentes fases de desarrollo. El objeto de este artículo es realizar una revisión de las tecnologías de fabricación de vacunas y de los diferentes candidatos vacunales para COVID-19, atendiendo a: su mecanismo de acción, pauta de administración, eficacia, efectos adversos y fase de desarrollo en la que se encuentran.
Tipos de vacunas frente a SARS-CoV-2
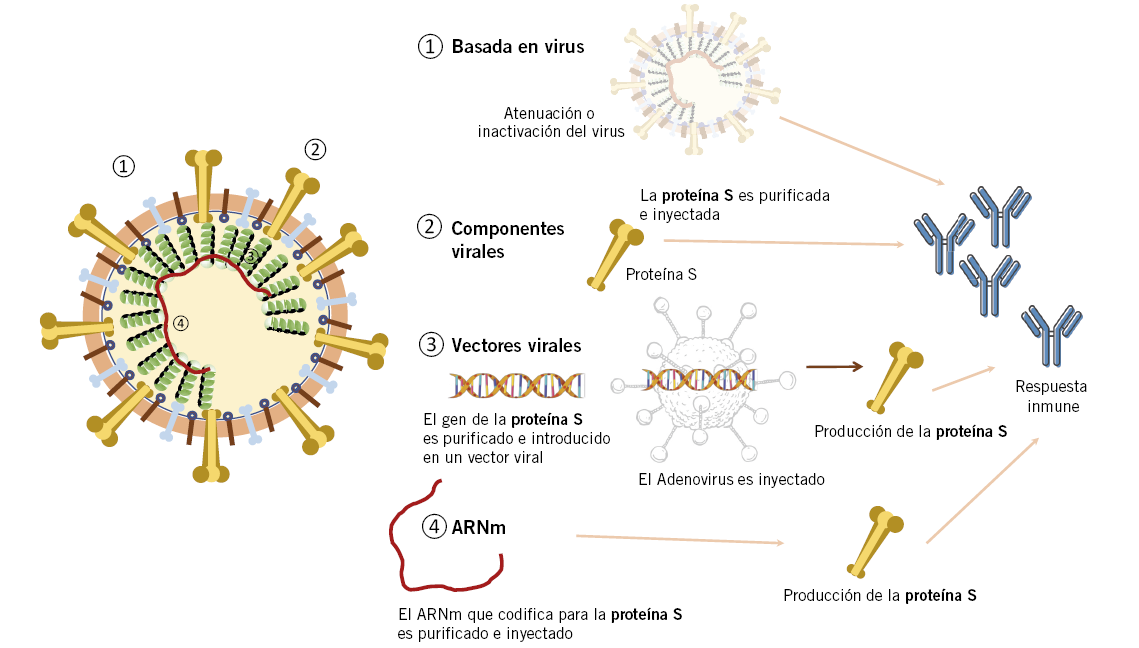
Se han seguido diferentes estrategias en el diseño de vacunas frente a SARS-CoV-2, desde la nueva tecnología de vacunas de ARNm hasta la aproximación clásica de vacunas de virus vivos atenuados y virus inactivados. En esta sección, se presenta un pequeño resumen del funcionamiento de estas estrategias (Fig. 1).
Figura 1. Mecanismos de funcionamiento de los principales tipos de vacunas frente a SARS-CoV-2
Vacunas de virus vivos atenuadas(6)
Esta es una de las primeras tecnologías de vacunación que se diseñó. Fue, por ejemplo, la que empleó Louis Pasteur en 1885, en la vacuna de la rabia. El proceso para crear una vacuna de virus vivos atenuados es el siguiente. Primero, se aísla el virus causante de la enfermedad que se quiere combatir. Posteriormente, se emplean mecanismos para reducir su virulencia, es decir, su capacidad de infectar y dañar al huésped. Para ello, se pasa repetidamente el virus por diferentes medios de cultivo, lo que va dando lugar a diferentes cepas. De esas cepas, se eligen aquellas que infecten, pero no produzcan enfermedad y generen respuesta inmune. Por ejemplo, en el caso de la polio oral o de Sabin, se aisló la cepa Mahoney de individuos que pasaban la enfermedad de forma asintomática. Posteriormente, realizaron pases del virus a través de cultivos de testes de mono hasta encontrar una cepa que no poseyese capacidad infectiva del sistema nervioso central.
Las vacunas de virus vivos atenuados han ayudado a hacer frente a enfermedades que antaño causaban una importante morbimortalidad. Y aún, a día de hoy, seguimos utilizándolas de forma habitual, como la del sarampión, parotiditis y rubeola, la de la varicela o la de la fiebre amarilla. Sin embargo, presentan como desventaja que el virus puede causar enfermedad en individuos susceptibles; por lo que están contraindicadas en ciertos pacientes, como embarazadas o inmunodeprimidos.
Las vacunas de virus vivos atenuados son eficaces, pero están contraindicadas en personas inmunodeprimidas.
Vacunas de virus inactivados(7)
Esta tecnología de fabricación de vacunas fue la siguiente en ser desarrollada. En este tipo de vacunas, se inactiva el virus empleando métodos físicos o químicos, como el uso de formaldehído, calor o luz ultravioleta y este deja de ser infeccioso. El problema de estas vacunas es que, si el proceso de inactivación del virus no se realiza correctamente, este puede reactivarse y causar enfermedad o, si el proceso de inactivación es lo suficientemente intenso, se perderá la capacidad de generar respuesta inmune al desnaturalizarse los antígenos.
Estas vacunas presentan, como principal ventaja, frente a las vacunas vivas atenuadas que: no pueden causar enfermedad, son menos reactógenas y más seguras. Como inconveniente, su capacidad de generar respuesta inmune es menor. Ejemplos de vacunas de virus inactivados que empleamos de forma habitual serían: vacuna de polio inyectable (vacuna de Salk) y hepatitis A.
Las vacunas de virus inactivados son más seguras al no poder causar la enfermedad, pero su capacidad de producir respuesta inmune es menor.
Vacunas de subunidades virales(8)
A finales del siglo pasado, se exploraron nuevas formas de diseñar vacunas. En lugar de emplear microorganismos enteros, atenuados o inactivados, se sugirió la posibilidad de usar antígenos específicos del microorganismo. Esto facilitaba la fabricación de las vacunas. Cuando se trabaja con microorganismos enteros, hay que emplear cultivos celulares. Sin embargo, es un proceso caro y existían algunos microorganismos que no podían ser cultivados. Este era el caso del virus de la hepatitis B. Gracias a la aparición de la tecnología recombinante, se empleó una cepa modificada de S. cerevisae para generar la proteína de antígeno de superficie del virus de la hepatitis B (HBsAg). Esta proteína era capaz de generar respuesta inmune, desarrollándose así la vacuna frente a la hepatitis B, que seguimos usando en la actualidad. Posteriormente, se desarrollaron otras vacunas empleando esta tecnología, como la del virus del papiloma humano.
El problema de estas vacunas, es que su capacidad de generar respuesta inmune es menor. Cuando se emplean vacunas atenuadas e inactivadas está presente el microorganismo entero, por lo que el paciente se expone a numerosos antígenos y a otras moléculas que activan su respuesta inmune. En el caso de las vacunas atenuadas, al emplear un solo antígeno, es necesario estimular la respuesta inmune con el uso de adyuvantes.
Las vacunas de subunidades virales permiten que la fabricación de vacunas sea más sencilla, pero la respuesta inmune es menor que con las vacunas de virus enteros, precisando la utilización de adyuvantes.
Vacunas de ARN(9,10)
La idea detrás del diseño de las vacunas de ARN era poder superar algunos de los problemas que presentan las vacunas anteriores: no poseer capacidad de producir enfermedad como las vacunas de virus vivos atenuados y producir una respuesta inmune más intensa y duradera que las vacunas inactivadas y de subunidades.
Existen dos tipos de vacunas de ARN, las convencionales y las autorreplicables. En las convencionales, la vacuna contiene ARN mensajero (ARNm) que se traduce en proteínas que codifican el antígeno, empleando los ribosomas celulares. En las autorreplicables, la vacuna contiene un complejo de ARN-polimerasa dependiente de ARN que amplifica el ARNm, creando más copias del mismo para posteriormente traducirlo, con lo que se produce mayor cantidad del antígeno.
Las vacunas de ARNm presentan la ventaja de que pueden estimular al sistema inmune innato sin necesidad de emplear adyuvantes. La presencia de ARNm exógeno en las células de paciente simula una infección viral y se generan citoquinas y quimoquinas que activan el reclutamiento de las células presentadores de antígenos y linfocitos CD8. Sin embargo, la inducción de respuesta inmune innata es a la vez ventaja e inconveniente en estas vacunas. La producción de interferón al detectarse ARNm exógeno en las células, puede dar lugar a una serie de respuestas inmunológicas encaminadas a reducir la transcripción de ARN viral lo que reduciría la efectividad de la vacuna.
Otro de los potenciales problemas de las vacunas de ARNm es su inestabilidad, ya que es una molécula que se degrada rápidamente. Necesitan condiciones de conservación específicas lo que puede complicar su logística y distribución a gran escala. Pero, a diferencia de las vacunas de ADN, no tienen potencial para integrarse en el genoma del huésped.
Las vacunas de ARN mensajero son una tecnología novedosa, que presenta ventajas frente a las vacunas tradicionales pero la inestabilidad de la molécula de ARN mensajero puede complicar su logística y distribución a gran escala.
Vacunas de ADN(11)
Las vacunas de ADN funcionan de forma similar a la anterior. Se inyecta en el paciente un plásmido de ADN que emplea la maquinaria celular del paciente para sintetizar proteínas y péptidos virales que activarán la respuesta inmune. El ADN es mucho más estable y fácil de manejar que el ARN, si bien para lograr que llegue al núcleo celular, la administración de la vacuna requiere de técnicas específicas (p. ej., electroporación).
Entre los potenciales problemas de la vacuna está el temor a que se produzca integración del ADN viral en el huésped. En estudios preliminares, no se ha observado integración del ADN en el huésped de forma significativa y, cuando se detecta, es varios órdenes de magnitud inferior a la tasa habitual de mutación. Otra de las preocupaciones es que la vacuna pueda causar fenómenos autoinmunes, pero tampoco se han observado un aumento significativo de los mismos en los ensayos clínicos realizados.
Las vacunas de ADN emplean una tecnología similar a las vacunas de ARN, pero son mucho más estables; a pesar de que existe preocupación por su riesgo potencial de integración en el genoma humano, no se ha visto este fenómeno en los ensayos clínicos realizados.
Vacunas de vectores virales(12)
En este tipo de vacunas, se emplea un virus que infecte a seres humanos, como el adenovirus. El vector viral se altera para reducir su capacidad infectiva y se modifica su genoma, para que al traducirse, se expresen proteínas del virus frente al que se crea la vacuna.
Estas vacunas tienen la ventaja de que los vectores virales simulan una infección provocando una respuesta inmunitaria fuerte, por lo que no necesitarían adyuvantes. Entre sus inconvenientes, la posibilidad de que el ADN se integre en el genoma del paciente o que se produzca una replicación persistente en sujetos inmunodeprimidos. Además, al emplear virus que infectan de forma natural a los seres humanos, la presencia de respuesta inmune previa a ese virus puede comprometer la respuesta inmune vacunal.
Finalmente, desde un punto de vista técnico. La necesidad de emplear cultivos celulares provoca que el proceso de fabricación sea más caro y laborioso.
Las vacunas de vectores virales modifican genéticamente un virus que infecta a humanos para que exprese proteínas del virus frente al que queremos generar la vacuna.
Candidatos vacunales frente a SARS-CoV-2
En esta sección realizaremos un pequeño resumen de los candidatos vacunales frente a SARS-COV-2 más relevantes hasta el momento (Tabla I).
Vacuna de Pfizer y BioNTech BNT162b2 – tozinamerán “Comirnaty®”(14)
Tipo de vacuna: ARNm incluido en nanopartículas liposomales que codifica la proteína spike del SARS-CoV-2.
Características del ensayo en fase 2/3: se realizó un ensayo clínico multicéntrico con 43.548 pacientes, de los cuales la mitad recibió la vacuna y la otra mitad placebo. Con respecto a los datos demográficos de los participantes: el 57% tenía entre 16 y 55 años, y el 43% restante eran mayores de 55; el 50% de los participantes eran mujeres y el 30% de los participantes eran obesos. Entre los criterios de exclusión para participar se incluía: haber padecido COVID-19 con anterioridad, empleo de tratamiento inmunosupresor o pacientes inmunodeprimidos. Sí que se incluyeron pacientes con enfermedad crónica estable, como hepatitis C o VIH.
Pauta de administración: 2 dosis separadas entre sí 21 días.
Efectos adversos: a nivel local, el más frecuente fue el dolor en el lugar de la inyección. Y en cuanto a los efectos secundarios a nivel sistémico, los más frecuentes fueron: malestar general, cefalea y fiebre. La tasa de efectos adversos graves fue del 1,1% en el grupo de vacuna.
Eficacia: a partir de los 7 días de administración de la segunda dosis de la vacuna, se produjeron 9 infecciones por SARS-CoV-2 en el grupo de vacunados frente a los 168 del grupo de placebo. Esto significa que presenta una eficacia del 95% CI95% (90,3-97,6). En el análisis por subgrupos, la efectividad fue similar en todos ellos.
Fase en que se encuentra la vacuna: fase 4 o de comercialización. Primera vacuna aprobada en el mundo frente al SARS-CoV-2, tanto por la FDA americana como por la EMA y por la OMS.
Vacuna de Moderna mRNA-1237(15)
Tipo de vacuna: ARNm incluida en nanopartículas liposomales que codifica la proteína spike del SARS-CoV-2.
Características del ensayo en fase 3: ensayo multicéntrico en el que participaron 30.400 pacientes, de los cuales la mitad recibió la vacuna y la otra mitad placebo. Los pacientes se estratificaron en tres grupos: pacientes de 18 a 65 años sin factores de riesgo (59,6%), pacientes de 18 a 65 años con factores de riesgo (15,1%) y pacientes mayores de 65 años (25,3%). El 82% presentaba riesgo ocupacional de contraer SARS-CoV-2, con un 25% de profesionales sanitarios incluidos en el estudio. A diferencia de la vacuna de Pfizer, sí se incluyeron participantes con historia de enfermedad por COVID-19 previa (2,2%).
Pauta de administración: 2 dosis con un intervalo de 28 días.
Efectos adversos: a nivel local, el más frecuente fue dolor en el lugar de la inyección (91,6%). A nivel sistémico, los más frecuentes fueron: fatiga (68,5%), cefalea (63,0%), dolor muscular (59,6%), dolor articular (44,8%), y escalofríos (43,4%). Se produjeron efectos adversos graves en el 0,2% al 9,7% de los participantes.
Eficacia: a partir de los 14 días de la segunda dosis de la vacuna, se registraron 5 casos en el grupo vacunal frente a 90 del grupo placebo, lo que significa una efectividad de 94,5% CI95% (86,5-97,8). La eficacia fue similar entre los diferentes subgrupos.
Fase en que se encuentra la vacuna: fase 4 o comercialización.
Vacuna de Oxford y Astra Zeneca ChAdOx1 (AZD1222)(16)
Tipo de vacuna: vacuna de vector viral empleando adenovirus que expresa la glucoproteína spike de SARS-CoV-2.
Características del estudio en fase 2/3: se realizó simultáneamente un estudio en fase 2/3 en Reino Unido y otro en fase 3 en Brasil. En el de Reino Unido, se reclutaron 10.673 pacientes, de los cuales la mitad recibió vacuna y la otra mitad placebo. En el grupo de vacuna, existían dos subgrupos, el subgrupo SD/SD formado por 2.741 participantes y el subgrupo LD/SD con 4.807. El subgrupo de SD/SD recibió 2 dosis de vacuna a dosis estándar de carga viral, mientras que el LD/SD recibió una primera dosis de vacuna de baja carga viral (mitad de dosis) y otra segunda dosis de vacuna de alta carga viral (dosis completa). El 86,7% de los pacientes tenían entre 18 y 55 años, con la particularidad de que en el grupo LD/SD solo se reclutaron pacientes de este grupo etario. En el estudio de Brasil, se reclutaron 4.088 pacientes y todos ellos recibieron 2 dosis de carga estándar de la vacuna. En este estudio, el 89,9% de los participantes tenía entre 18 y 55 años. Entre los dos estudios, el 60,5% eran mujeres y la mayoría de los participantes eran trabajadores sanitarios. Se incluyeron pacientes que habían padecido COVID-19 anteriormente.
Pauta de administración: en el protocolo se establecían 2 dosis separadas 4 semanas, pero en los ensayos clínicos existió gran variabilidad. El grupo SD/SD recibió la segunda dosis en las primeras 6 semanas tras la primera con una mediana de 36 días. El grupo LD/SD recibió la segunda dosis en las primeras 12 semanas.
Eficacia: a partir de los 14 días después de la segunda dosis de la vacuna, en el grupo de la vacuna se detectaron 30 casos y 101 en el grupo control, lo que supone una eficacia del 70,4% CI95% (54,8-80,6). Si estratificamos los resultados en el grupo SD/SD, la eficacia fue del 62,1% CI95% (41,0-75,7) y en el LD/SD 90,0% (67,4-97). No existían diferencias significativas entre otros subgrupos.
Efectos adversos: se produjeron 175 efectos adversos graves en 168 pacientes, 84 en el grupo de la vacuna y 91 en el control. Debido a que el estudio en fase 3 y 2/3 sigue en curso, no se han terminado de reportar los posibles efectos adversos.
Fase de la vacuna: fase 3, aprobación en el Reino Unido.
Vacuna de Novavax NVX-CoV737(17)
Tipo de vacuna: vacuna de subunidades que emplea la glucoproteína spike del SARS-CoV-2 (rSARS-Cov-2) y un adyuvante derivado de la saponina: Matrix-M1.
Características del ensayo en fase 1/2: se reclutaron 131 participantes que se dividieron en grupo placebo, B, C y D. Los pacientes del grupo B recibieron: 25 µg de rSARS-CoV-2; los del grupo C: 5 µg de r-SARS-CoV-2 + adyuvante; y los del grupo D: 25 µg de r-SARS + adyuvante. El 49,6% de los participantes eran mujeres y la edad media era de 30,8 ± 10,2 años.
Pauta de administración: 2 dosis separadas 21 días.
Eficacia: no hay datos disponibles aún de eficacia.
Efectos adversos: los efectos a nivel local o sistémicos estuvieron ausentes, o fueron moderados en la mayoría de los participantes.
Fase de la vacuna: fase 3.
Vacuna de Sinovac “CoronaVac®”(18)
Tipo de vacuna: virus inactivados.
Características del ensayo en fase 2: se reclutaron 600 pacientes. Estos 600 pacientes se dividieron en dos grupos, uno recibiría una pauta vacunal a los 0 y 14 días, y el otro grupo a los 0 y 28 días. Se asignaron en ratio 2:1 al grupo de la vacuna y al grupo placebo. Además, dentro del grupo de la vacuna, se realizaron otros dos subgrupos, uno que recibió 6 µg de producto y otro que recibió 3 µg de producto. La edad de los pacientes estaba comprendida entre los 18 y los 55 años, y un 51% de los mismos eran mujeres.
Pauta de administración: existen dos pautas: 0-14 días y 0-28 días, respectivamente.
Eficacia: no hay datos publicados de eficacia, pero la compañía ha comunicado en prensa una eficacia del 78%(19).
Efectos adversos: la tasa de efectos adversos fue del 33% en el grupo de 3 µg, 35% en el grupo de 6 µg y 22% en el placebo. No se registraron reacciones adversas graves.
Fase de la vacuna: fase 3.
Vacuna del Instituto de investigación en epidemiología y microbiología de Gamelaya Gam-Covid-Vac “Sputnik V®”(20)
Tipo de vacuna: vacuna de dos vectores virales rAd5-S y rAd26-S, empleando adenovirus que expresa la proteína spike de SARS-CoV-2.
Características del ensayo en fase 1/2: se reclutaron 38 pacientes en un estudio con vacuna no liofilizada y otros 38 en un estudio con vacuna liofilizada. De los primeros 38 pacientes, 18 de cada grupo realizaron el estudio en fase 1 y 20 en fase 2. La media de edad era de 26,4 ± 4,4 años para el grupo de vacuna y de 26,7 ± 5,8 años para los de la vacuna liofilizada. En los participantes en la fase dos, había un 30% de mujeres y ninguno había padecido COVID-19 previamente. Parte de los pacientes que participaron en el ensayo eran personal militar contratado.
Pauta de administración: primera dosis con vector rAd26-S y segunda dosis con vector rAd5-S a los 21 días.
Eficacia: no hay datos de eficacia publicados todavía, pero el instituto Gamelaya ha comunicado en nota de prensa datos preliminares de su estudio en fase 3, refiriendo una eficacia del 91,4% tras un estudio realizado en 22.714 pacientes(21).
Efectos adversos: las reacciones adversas más frecuentes fueron: dolor local (58%), hipertermia (50%), dolor de cabeza (42%), astenia (28%), artralgias, y mialgias (24%). No se detectaron efectos adversos graves.
Fase de la vacuna: licencia de emergencia para su uso, fase 3.
Vacuna de Bharat Biotech BBV152 “Covaxin®”(22)
Tipo de vacuna: vacuna de virus inactivado.
Características del ensayo en fase 2: se reclutaron 380 pacientes mayores de 12 años en 11 hospitales de la India. El 3,7% tenían entre 12 y 18 años; el 91,8% entre 18 y 55 años; y 4,4% entre 55 y 65 años. El 50% recibió una dosis de 3 µg y el 50% restante una dosis de 6 µg. Menos de un 30% de los participantes eran mujeres.
Pauta de administración: 2 dosis separadas 28 días.
Eficacia: dado que se trata de un ensayo en fase 2, no se pueden extraer datos de eficacia.
Efectos adversos: las reacciones adversas locales aparecieron en un 9,7% CI95% (6,9-13,2) y los efectos adversos sistémicos en 10,3% CI 95% (7,4-13,8). No se detectaron efectos adversos graves.
Fase de la vacuna: fase 3, aprobada en India.
Limitaciones
Todas estas vacunas tienen como limitación principal que su aprobación está basada en períodos de seguimiento relativamente cortos, antes de concluirse los estudios en fase 3, cuya duración oscila entre 1 y 2 años dependiendo del candidato. Aun así, el importante tamaño muestral compensa esta limitación, lo que unido a los datos de eficacia y el contexto pandémico, han permitido su aprobación condicionada (EMA) o autorización de uso de emergencia (FDA). Estas aprobaciones están sujetas a completar los estudios, un seguimiento exhaustivo con aporte de información en tiempo real, y mantener la farmacovigilancia incluso después de concluidos los ensayos, tal como se realiza habitualmente con las vacunas. A 12 de enero de 2021, se han administrado ya más de 30 millones de dosis vacunales en todo el mundo, sin incidencias reseñables en términos de seguridad.
Tampoco disponemos de información en embarazadas y niños, si bien se acordó con las autoridades reguladoras, la realización de estudios específicos en estas poblaciones una vez se dispusiese de datos de seguridad y eficacia en la población adulta. En estos momentos, se están poniendo en marcha los estudios de mujeres embarazadas y adolescentes, y los pediátricos previsiblemente se inicien en la primavera de 2021.
Función del pediatra de Atención Primaria
Dado que en estos momentos aún no se han realizado ensayos clínicos en población pediátrica de las vacunas frente a SARS-CoV-2 y que los pacientes pediátricos sanos no presentan complicaciones graves por COVID-19 con tanta frecuencia como los adultos, la población pediátrica no es un grupo prioritario de vacunación. Por lo que en los próximos meses, no parece probable que los profesionales de Pediatría y Enfermería pediátrica de Atención Primaria deban ocuparse de la vacunación pediátrica frente a COVID-19. Sin embargo, sí que pueden aportar su gran experiencia y su papel como expertos vacunales para animar a las familias de sus pacientes a recibir la vacuna y resolver las dudas de sus compañeros de Atención Primaria y de la población general(24). La situación privilegiada de España con altas tasas de vacunación y familias que demandan vacunas frente a otros países del entorno, se ha logrado en gran medida gracias al trabajo de los pediatras de Atención Primaria y es importante que siga manteniéndose.
Discusión y conclusiones
La pandemia de SARS-CoV-2 supone un reto para la humanidad, y la esperanza en este momento se encuentra en lograr vacunas que sean seguras y efectivas, y en cantidad suficiente. Ante este reto, varias empresas han presentado sus candidatos vacunales que, aunque emplean estrategias muy diferentes, todas las que se encuentran en fases más avanzadas se basan en la proteína espicular o proteína S (spike), a excepción de las vacunas de virus inactivados de Sinovac y Bharat Biotech, que incluyen otros antígenos. Esta aproximación tiene la limitación que podría suponer la aparición de nuevas variantes de coronavirus en donde la proteína S acumule mutaciones que le permitan evadir la respuesta vacunal. Hasta la fecha, hemos identificado decenas de miles de variantes genéticas del SARS-CoV-2 sin ventajas o desventajas biológicas demostradas, a pesar del sensacionalismo de algunas de las noticias que circulan en los medios, especialmente en relación a la denominada “variante inglesa”(25-27). Pero incluso, aunque acaben apareciendo variantes con ventajas genéticas, la tecnología nos permitirá adaptar las vacunas a estos cambios, y en el caso de las vacunas de ácidos nucleicos, muy rápidamente.
Otro aspecto importante es el impacto que estas vacunas puedan tener sobre la transmisión de la infección por SARS-CoV-2. Las primeras vacunas licenciadas sabemos que protegen frente a la enfermedad clínica, pero desconocemos su impacto en la cadena de transmisión. Esta característica no hace “peores” a las vacunas, sino que condiciona las estrategias de aplicación de las mismas y la necesidad de otras medidas concomitantes. Todas las vacunas aprobadas se administran por vía intramuscular, y no sabemos el grado de inmunidad que se genera en la mucosa del tracto respiratorio superior a través del cual penetra el virus(28). Hay estudios preclínicos con resultados muy esperanzadores, si bien será necesario mantener las medidas de distanciamiento e higiene mientras: se desconozca esta información en humanos, dure la fase pandémica y no se alcancen coberturas vacunales elevadas.
El inicio de la vacunación frente a la COVID-19 marca un punto de inflexión en esta pandemia, sin embargo, no la venceremos hasta que se vacune la última persona en la que esté indicada. Para inmunizar a toda la población mundial harán falta miles de millones de dosis de vacunas, por lo que habrá que esperar para saber si las compañías farmacéuticas poseen la capacidad industrial para fabricar ese gran número de vacunas al ritmo de la demanda. El hecho de que existan múltiples candidatos vacunales es algo muy positivo, ya que además de fomentar la competitividad y evitar el monopolio, será más fácil hacer frente a los problemas de desabastecimiento, fabricación y distribución.
La mayoría de las vacunas aún no han publicado los resultados de la fase 3 de los ensayos; en este momento, solo han obtenido autorización para su uso y se ha empezado a vacunar en el contexto europeo con las vacunas de ARNm (Pfizer-BioNTech y Moderna) y la vacuna de vector viral de Astra-Zeneca (solo en el Reino Unido), y todavía no se han realizado ensayos clínicos en ciertos subgrupos poblacionales, como los pacientes pediátricos y embarazadas. Es pronto para saber cuál será la efectividad de las vacunas en el mundo real. Sin embargo, el desarrollo, autorización e inicio de uso de las vacunas frente a la COVID-19 constituye un hito histórico, ha puesto en valor la investigación, y es la mejor noticia desde que comenzó la pandemia, el verdadero principio del fin.
Potencial conflicto de intereses
FM-T ha recibido honorarios de GSK, Pfizer Inc, Sanofi Pasteur, MSD, Seqirus, Novavax y Janssen como: asesor, consultor, o ponente fuera del objetivo del presente trabajo. FMT ha trabajado como investigador principal en ensayos clínicos promovidos por las compañías farmacéuticas arriba mencionadas y, además: Ablynx, Regeneron, Roche, Abbott and MedImmune, siendo todos los honorarios pagados a la institución. IRC ha recibido honorarios por ponencias de: MSD, GSK, Sanofi y Pfizer; ha recibido becas/ayudas de investigación de: Sanofi Pasteur, MSD, Novartis y Pfizer; ha recibido honorarios por consultorías para: Pfizer, MSD y Sanofi; y ha participado como subinvestigador en ensayos clínicos de vacunas de: Ablynx, Abbot, Seqirus, Sanofi Pasteur MSD, Sanofi Pasteur, Cubist, Wyeth, Merck, Pfizer, Roche, Regeneron, Jansen, Medimmune, Novavax, Novartis y GSK, siendo todos los honorarios pagados a la institución. AIDU ha participado como subinvestigador en ensayos clínicos de vacunas de: Ablynx, Abbot, Seqirus, Sanofi Pasteur MSD, Sanofi Pasteur, Wyeth, Merck, Pfizer, Roche, Jansen, Medimmune, Novavax, Novartis y GSK, siendo todos los honorarios pagados a la institución. JGR ha recibido honorarios por ponencias de MSD, GSK y Pfizer y honorarios por consultorías de MSD.
Financiación
FM-T recibe soporte para la realización de sus actividades de investigación del Instituto de Salud Carlos III (Proyecto de Investigación en Salud, Acción Estratégica en Salud): Fondo de Investigación Sanitaria (FIS; PI070069/PI1000540/PI1601569/PI1901090) del plan nacional de I+D+I y “fondos FEDER” y Proyectos GaIN Rescata-Covid_IN845D 2020/23 (GAIN, Xunta de Galicia).
Bibliografía
1. Munster VJ, Koopmans M, van Doremalen N, van Riel D, de Wit E. A Novel Coronavirus Emerging in China – Key Questions for Impact Assessment. N Engl J Med. 2020; 382: 692-4.
2. OMS. Alocución de apertura del Director General de la OMS en la rueda de prensa sobre la COVID-19 celebrada el 11 de marzo de 2020 (Internet). Consultado el 14 de diciembre de 2020. Disponible en: https://www.who.int/director-general/speeches/detail/who-director-general-s-opening-remarks-at-the-media-briefing-on-covid-19—11-march-2020.
3. Stone JH. Efficacy of Tocilizumab in Patients Hospitalized with Covid-19. N Engl J Med. 2020; 383: 2333-44.
4. Siemieniuk R, Rochwerg B, Agoritsas T, Lamontagne F, Leo Y-S, Agarwal A, et al. A living WHO guideline on drugs for covid-19. BMJ. 2020; 370: m3379.
5. Pfizer. Pfizer and BioNTech Announce Vaccine Candidate Against COVID-19 Achieved Success in First Interim Analysis from Phase 3 Study (Internet). Consultado el 14 de diciembre de 2020. Disponible en: https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against.
6. Minor PD. Live attenuated vaccines: Historical successes and current challenges. Virology. 2015; 479-80: 379-92.
7. Nunnally BK. Inactivated Viral Vaccines. Vaccine Analysis: Strategies, Principles, and Control; 2014. p. 45-80.
8. Karch CP, Burkhard P. Vaccine technologies: From whole organisms to rationally designed protein assemblies. Biochem Pharmacol. 2016; 120: 1-14.
9. Iavarone C, O’hagan DT, Yu D, Delahaye NF, Ulmer JB. Mechanism of action of mRNA-based vaccines. Expert Rev Vaccines. 2017; 16: 871-81.
10. Zhang C, Maruggi G, Shan H, Li J. Advances in mRNA Vaccines for Infectious Diseases. Front Immunol. 2019; 10: 594.
11. Kutzler MA, Weiner DB. DNA vaccines: ready for prime time? Nature Reviews Genetics. 2008; 9: 776-88.
12. Rauch S, Jasny E, Schmidt KE, Petsch B. New Vaccine Technologies to Combat Outbreak Situations. Front Immunol. 2018; 9: 1963.
13. Walsh EE, Frenck RW, Falsey AR, Kitchin N, Absalon J, Gurtman A, et al. Safety and Immunogenicity of Two RNA-Based Covid-19 Vaccine Candidates. Consultado el 17 de diciembre de 2020. N Engl J Med. 2020; 383: 2439-50.
14. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020.
15. FDA Briefing document. Vaccines and Related Biological Products Advisory Committee Meeting December 17, 2020. Moderna COVID-19 Vaccine (Internet). Consultado el 21 de diciembre de 2020. Disponible en: https://www.fda.gov/media/144434/download.
16. Voysey M, Costa Clemens SA, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2: an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK. Lancet. 2020; S0140-6736: 32661-1.
17. Keeck C, Gary Albert G, Cho I, Robertson A, Reed P, Neal S, et al. Phase 1-2 Trial of a SARS-CoV-2 Recombinant Spike Protein Nanoparticle Vaccine. N Engl J Med. 2020; 383: 2320-32.
18. Zhang Y, Zeng G, Pan H, Li Ch, Hu Y, Chu K, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial.
19. Sui-Lee W, Londoño E. A Second Chinese Coronavirus Vaccine Is Said to Be Effective. New York Times. 7 de diciembre de 2021 (Internet). Consultado el 8 de diciembre de 2021. Disponible en: https://www.nytimes.com/2021/01/07/business/china-coronavirus-vaccine-sinovac.html.
20. Logunov DY, Dolzhikova IV, Zubkova OV, Tukhvatulin AI, Shcheblyakov DV, Dzharullaeva AS, et al. Safety and immunogenicity of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine in two formulations: two open, non-randomised phase 1/2 studies from Russia. Lancet. 2020; 396: 887-97.
21. Gamaleya National Research Center for Epidemiology and Microbiology. The Sputnik V vaccine’s efficacy is confirmed at 91.4% based on data analysis of the final control point of clinical trials. 14 de diciembre de 2020 (internet). Consultado el 8 de enero de 2021. Disponible en: https://sputnikvaccine.com/newsroom/pressreleases/the-sputnik-v-vaccine-s-efficacy-is-confirmed-at-91-4-based-on-data-analysis-of-the-final-control-po/.
22. Ella R, Reddy S, Jogdand H, Sarangi V, Ganneru B, Prasad S, et al. Safety and immunogenicity clinical trial of an inactivated SARS-CoV-2 vaccine, BBV152 (a phase 2, double-blind, randomised controlled trial) and the persistence of immune responses from a phase 1 follow-up report. 22 de diciembre de 2020 (internet). Consultado el 8 de enero de 2021. Disponible en: https://www.medrxiv.org/content/10.1101/2020.12.21.20248643v1.
23. Boseley S. Belgian minister tweets EU’s Covid vaccine price list to anger of manufacturers. The Guardian. 18 de diciembre de 2020 (Internet). Consultado el 8 de enero de 2021. Disponible en: https://www.theguardian.com/world/2020/dec/18/belgian-minister-accidentally-tweets-eus-covid-vaccine-price-list.
24. de la Flor i Bru. La Pediatría de Atención Primaria como promotora de la vacunación en el adulto. Pediatría Integral. 2016. Pediatr Integral. 2016; XX(6): 357-358.
25. ECDC. Threat Assessment: Rapid increase of a SARS-CoV-2 variant with multiple spike protein mutations observed in the United Kingdom. Internet. Consultado el 21 de Diciembre de 2020. Disponible en: https://www.ecdc.europa.eu/sites/default/files/documents/SARS-CoV-2-variant-multiple-spike-protein-mutations-United-Kingdom.pdf.
26. Gómez-Carballa A, Bello X, Pardo-Seco J, Pérez Del Molino ML, Martinón-Torres F, Salas A. Phylogeography of SARS-CoV-2 pandemic in Spain: a story of multiple introductions, micro-geographic stratification, founder effects, and super-spreaders. Zool Res. 2020; 41: 605-20. doi: 10.24272/j.issn.2095-8137.2020.217. PMID: 32935498; PMCID: PMC7671907.
27. Gómez-Carballa A, Bello X, Pardo-Seco J, Martinón-Torres F, Salas A. Mapping genome variation of SARS-CoV-2 worldwide highlights the impact of COVID-19 super-spreaders. Genome Res. 2020; 30: 1434-48. doi: 10.1101/gr.266221.120. Epub 2020 Sep 2. PMID: 32878977; PMCID: PMC7605265.
28. Krammer F. SARS-CoV-2 vaccines in development. Nature. 2020; 586: 516-27.