|
| Temas de FC |
B. Aguirrezabalaga González*, J. de la Flor i Brú**
*Pediatra de Atención Primaria. Centro de salud Roces-Montevil (Gijón). Coordinadora del VACAP. **Pediatra de Atención Primaria. Centro de Salud “El Serral”. ABS Sant Vicenç dels Horts. SAP Baix Llobregat-Litoral. ICS. Barcelona. Vocal del VACAP
| Resumen
En este capítulo, se aborda la vacunación frente a la enfermedad meningocócica invasiva, que en los últimos años, está experimentando en nuestro medio un leve repunte, debido fundamentalmente al aumento de los serogrupos emergentes W e Y. Se describe la vacunación contra el serogrupo B, que sigue siendo el más prevalente y la vacunación contra los serogrupos A, C, W, Y, para la que contamos con nuevas vacunas tetravalentes conjugadas. |
| Abstract
In this issue, vaccination against meningococcal invasive disease is analyzed. Meningococcal invasive disease has increased over the last years in certain developed countries, mainly related to the emergent serogroups W and Y. Vaccination against serogroup B and serogroups A,C,W,Y, with new conjugate and multivalent vac-cines is discussed. |
Palabras clave: Enfermedad meningocócica; Vacunas contra el meningococo.
Key words: Meningococcal disease; Meningococcal vaccines.
Pediatr Integral 2020; XXIV(8): 457 – 467
Vacunas contra el meningococo
Vacunas contra el meningococo B
Introducción a las vacunas obtenidas por vacunología inversa y a las vacunas contra el meningococo serogrupo B.
La larga historia del desarrollo de las vacunas antimeningocócicas empieza en 1975, cuando se licencia en el Reino Unido la vacuna polisacárida A+C. Un hito importante se produce en 1999, cuando se licencia en Europa la primera vacuna conjugada contra el meningococo C. Posteriormente, la secuenciación del genoma del meningococo en el año 2000 sería un hecho decisivo que impulsaría la producción de vacunas por la técnica de vacunología inversa, que se concretaría años después con la aparición de la vacuna multicomponente recombinante contra el meningococo B (4CMenB) en 2013. Posteriormente, por técnica proteómica, apareció la vacuna bivalente (LP2086/fHbp) en 2014. Estas vacunas suponen un punto de inflexión importantísimo en vacunología, tanto por el desarrollo de nuevas técnicas para el diseño de vacunas, como por lo que supone en la prevención del serogrupo de meningococo, hasta el presente, más frecuente en nuestro medio.
El serogrupo B se caracteriza por presentar una cápsula cuyos antígenos se han revelado poco inmunógenos para la especie humana, además de presentar similitudes antigénicas con células neuronales, dado que el ácido polisiálico capsular se asemeja a glicoproteínas sialisadas humanas, lo cual supone un riesgo teórico de inducción de fenómenos autoinmunes. Por otra parte, los ensayos clínicos han mostrado que una vacuna basada en polisacárido capsular de meningococo B no es inmunógena. Esta situación invalida el método de desarrollo clásico de vacunas contra gérmenes capsulares que tan buenos resultados dio para: Haemophillus influenzae tipo b; meningococo de los serogrupos A, C, W, Y; y neumococo, basado en la glucoconjugación del polisacárido capsular con una proteína transportadora o carrier (habitualmente toxoide tetánico o la mutante atóxica de la toxina diftérica CRM [cross reactive material]197).
La clave para diseñar una vacuna contra el serogrupo B pasaba por encontrar una proteína que estuviera suficientemente expuesta en la membrana externa para ser detectada y reconocida por el sistema inmunitario, y fuera universal a la mayoría de cepas. Los primeros diseños utilizaron las vesículas de membrana externa (outer membrane vesicles, OMV), comunes a los gram negativos. Una proteína conservada en estas vesículas, llamada porina (Por) A, era el componente inmunógeno de las vacunas de OMV que se utilizaron para controlar, con éxito, brotes por el serotipo B causados por una única cepa, como se ha comprobado en algunos países (Cuba, Noruega y Nueva Zelanda). Sin embargo, Por A era específica de cada cepa, siendo útil para el control de brotes por estas cepas concretas, pero sin conferir una protección universal.
Posteriormente, la investigación se dirigió a obtener antígenos subcapsulares, básicamente proteínas de membrana externa que generaran respuesta de anticuerpos bactericidas, que tuvieran poca variabilidad antigénica y que se expresaran en la mayoría de cepas patógenas. Como no existe un antígeno común subcapsular que cumpla con estos criterios, ha sido preciso desarrollar vacunas con varias variantes antigénicas de una proteína (bivalente) o con varias proteínas inmunógenas (multicomponente), en ambos casos, con expresividad variable en distintas cepas.
Mediante la secuenciación del material genético de una bacteria, podemos acceder a las distintas secuencias genéticas que codifican distintas proteínas, y podemos conocer todas las proteínas que el microorganismo puede sintetizar. De todas las proteínas, se identifican las que por sus características (que estén más expuestas, que sean hidrofílicas…) sean potenciales candidatas a generar inmunogenicidad. Luego, se expresan utilizando E. coli y se inyectan en modelos animales para confirmar que sean inmunógenas, seleccionando las que confieran un adecuado perfil inmunógeno, pasando de cientos de potenciales candidatas a unas pocas proteínas seleccionadas.
Vacuna multicomponente contra el meningococo B (4CMenB)(1)
Composición
Es una vacuna multicomponente recombinante obtenida por la tecnología de vacunología inversa, que se compone de 3 antígenos subcapsulares del meningococo B, combinados con vesículas de membrana externa de meningococo. El diseño se basa en que la combinación de 4 proteínas de expresión variable en las distintas cepas de meningococo serogrupo B, permiten una cobertura amplia.
La vacuna se compone de las siguientes proteínas de membrana externa:
• fHbp (proteína de unión al factor H): conocida como proteína LP2086, que se fija al factor H, necesario para la eliminación de la bacteria mediante el complemento, bloqueando su acción. Está presente en casi todas las cepas. La secuencia de aminoácidos de esta proteína condiciona la existencia de 3 variantes (1,2,3) y 2 subfamilias (A y B). La identidad de secuencia de aminoácidos entre las variantes de una misma subfamilia es del 88-99%. En cambio, entre las dos subfamilias solo es del 60%. Hay reactividad cruzada entre las variantes 2 y 3 de la subfamilia A. Para esta vacuna, se utiliza una proteína perteneciente a la variante 1 (familia B).
• NHBA (proteína de adhesión a la heparina de Neisseria): presente en todas las cepas, con capacidad de unirse a la heparina, favoreciendo la supervivencia de la bacteria en sangre.
• NadA (proteína A de adhesión de Neisseria): participa en la adherencia a las células epiteliales y podría ser importante para la colonización. Está presente en el 30-40% de cepas, que suelen ser las más hipervirulentas.
• Por A (porina A): proteína de vesícula de membrana externa, que induce respuesta bactericida cepa-específica, útil en el control de epidemias, pero no protección cruzada con otras Por A. En esta vacuna, se incluye el serosubtipo P1.4, utilizado en el control de una epidemia en Nueva Zelanda. Se añade por demostrarse que su inclusión favorece una mayor inmunogenicidad. Su principal papel es el de adyuvante de las otras 3 proteínas, dado que la vacuna trivalente basada en los 3 componentes anteriores (fHbp, NHBA y Nad A) no es suficientemente inmunógena.
Inmunogenicidad
El desarrollo clínico de 4CMenB se basó en 13 ensayos clínicos(2,3) que incluyeron a 7.812 sujetos mayores de 2 meses que recibieron, al menos, 1 dosis. En el subgrupo de 2 meses-2 años, 5.850 recibieron, al menos, 1 dosis de 4CMenB, de los que 2.949 recibieron boosteren el segundo año. Un subgrupo de 2-10 años incluyó a 250 pacientes y, finalmente, se incluyeron 1.712 pacientes mayores de 11 años. La vacuna produjo una respuesta protectora robusta para los 4 antígenos (Fig. 1), en niños vacunados a los 2, 4, 6 meses y después del booster del segundo año.
Figura 1. Inmunogenicidad en lactantes.
Esta respuesta inmune coincide con el tiempo de mayor riesgo para enfermedad meningocócica invasiva, especialmente en el primer año, con mayor incidencia en los 5 primeros meses.
Seguridad(4)
La reactogenicidad de la vacuna está relacionada con la presencia de las colas lipídicas que componen las proteínas de membrana externa. En niños menores de 24 meses, se produce dolor, eritema en el lugar de inyección, fiebre e irritabilidad:
• Cuando la vacuna se administra simultáneamente junto a otras vacunas, entre el 69-79% de lactantes presentan fiebre igual o >38ºC, frente a un 44-59% que desarrollan esta reacción cuando se administran las vacunas habituales sin 4CMenB.
• 1% presentan fiebre superior a 40º.
• Administrada por separado, la incidencia de fiebre es similar al resto de vacunas.
• Cuando apareció la fiebre, normalmente siguió un patrón predecible, desapareciendo, en la mayoría de los casos, el día siguiente a la vacunación.
En la práctica, se recomienda que, siempre que sea posible, no se coadministre con otras vacunas. El aumento de reactogenicidad se ha descrito con la coadministración con vacunas antineumocócica y hexavalente, pero la recomendación de no coadministración se ha extendido a todas las vacunas inyectables inactivadas, y si por algún motivo debe hacerse, se recomienda que se utilice paracetamol profiláctico (que no se recomienda con la administración separada, ni como profiláctico en ninguna otra administración de vacunas, salvo en situaciones específicas e individualizadas). Se acepta la coadministración con las vacunas atenuadas triple vírica y varicela(5).
Puede coadministrarse con la vacuna antimeningocócica A, C, W, Y, aunque se recomienda separarlas si es posible. Se ha adoptado por convención, no basada en ningún dato objetivo, un periodo de 2 semanas entre la administración de vacunas antimeningocócicas B y otras vacunas inyectables inactivadas, pero la actual situación de pandemia por el SARS-CoV-2, con disminución de las actividades preventivas, puede hacer recomendable la coadministración de vacunas, para reducir visitas presenciales y para aprovechar oportunidades vacunales.
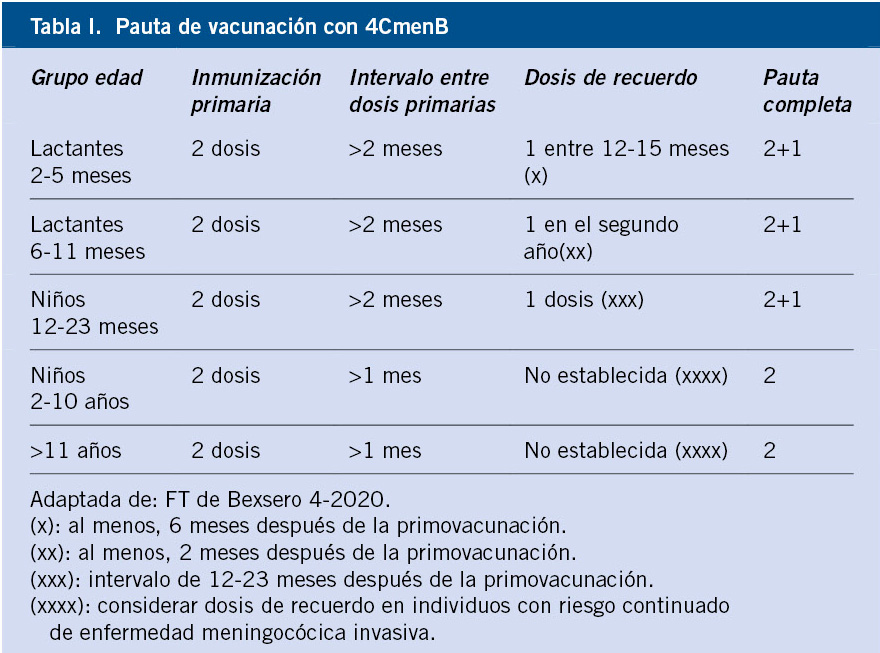
Pauta de vacunación (Tabla I)
Se ha producido en 2020 un cambio en la ficha técnica, que permite una pauta 2+1, incluso si se inicia la vacunación a partir de los 2 meses. Esta pauta se ha mostrado igual de inmunógena y es mucho más eficiente, al reducir una dosis con respecto a la pauta previa 3+1(6).
Valoración de la eficacia y cobertura estimada
Los ensayos clínicos controlados para probar la eficacia de una vacuna (incidencia en vacunados/incidencia en no vacunados), no son una estrategia posible en las vacunas antimeningocócicas, por la baja incidencia de la enfermedad. Por otra parte, la efectividad, que se mide en condiciones reales con estudios observacionales, requiere la introducción de la vacuna en programas de inmunización.
La validación de la protección con vacunas antimeningocócicas, usa correlatos de protección, que están definidos para esta bacteria desde los años 60, siendo la medición de títulos de anticuerpos mediante el ensayo bactericida del suero (serum bactericidal assay, SBA) el gold standard. Mide actividad de anticuerpo contra antígeno especifico y se consideran protectores títulos >1/4. Solo está validado para antígenos capsulares polisacáridos.
La presencia de cada antígeno, confiere actividad bactericida mediada por anticuerpos. Se diseñaron métodos para poder determinar la presencia de antígenos vacunales en las cepas que circulan por distintas regiones geográficas. El MATS(7), acrónimo de “meningococcal antigen typing system”, es una técnica de ELISA especifica que puede medir la presencia de antígeno y predecir la potencia bactericida de la vacuna, estimando la cobertura vacunal de las cepas circulantes en Europa en un 78% (Fig. 2).
Figura 2. Cobertura prevista por el MATS (meningococcal antigen typing system) de cepas de meningococo B en Europa.
Se precisa tan solo 1 antígeno para conferir protección y, mediante este método, se estima que, dependiendo de la región donde nos encontremos, se obtienen coberturas entre el 66-91% de las cepas circulantes. El sistema MATS puede subestimar o sobreestimar la seroprotección real obtenida, como se ha verificado en distintos estudios. En aislamientos en lactantes y adolescentes en Inglaterra y Gales, la seroprotección real fue mayor a la cobertura estimada inicialmente por MATS. En cambio, en 2016, tras un brote en adolescentes en la universidad de Princeton, donde la cepa aislada debería tener una cobertura por MATS del 100%, la seroprotección verificada por el SBA fue del 66,1%. Sin embargo, ningún caso se reportó entre adolescentes vacunados. La explicación a este fenómeno puede estar en que el SBA está validado para antígenos polisacáridos, cuando 4CMenB es una vacuna proteica, y en que la expresión de las proteínas de membrana externa, imprescindible para ser determinantes antigénicos, varía dependiendo de fenómenos físicos (temperatura) y biológicos (microbioma), lo cual puede hacer que la expresión in vitro sea diferente de la expresión in vivo.
Persistencia de la protección
La persistencia de los anticuerpos varió según el tipo de antígeno, lo que subraya la importancia de los 4 componentes. La tabla II nos muestra que, para los 4 antígenos de la vacuna, tenemos títulos altos tras el primer mes post-vacunación, que decaen a los 4 años, incluso en algunos casos, por debajo del nivel de protección.
Sin embargo, al revacunar, obtenemos una respuesta de memoria inmunológica. Esta respuesta es robusta y podría tener implicaciones de cara a plantear dosis de refuerzo en caso que se precisen, de acuerdo a las variaciones de la epidemiologia de la enfermedad(8).
En adolescentes y adultos jóvenes(9), se ha estudiado la persistencia de anticuerpos a 4-7, 5 años, mostrando títulos superiores a los niveles basales y una robusta respuesta a la administración de una dosis de recuerdo.
Indicaciones financiadas por el Sistema público de Salud
• Asplenia anatómica o disfunción esplénica grave(10).
• Deficiencias del sistema del complemento.
• Tratamiento con eculizumab.
• Trasplante de progenitores hematopoyéticos.
• Padecimiento anterior de enfermedad meningocócica invasiva.
• Personal de laboratorio expuesto a meningococo.
• En caso de agrupaciones de casos (brotes) u otras situaciones en las que las autoridades sanitarias lo considerasen necesario.
La vacuna puede utilizarse en personas sanas hasta los 50 años. Los datos son limitados en pacientes con condiciones médicas crónicas.
Es una vacunación de perfil sistemático con priorización en lactantes, según indica el calendario de vacunas 2021 del CAV-AEP (Fig. 3).
Figura 3. Calendario de vacunas de la AEP 2020.
Experiencia clínica internacional y datos de efectividad e impacto
• En Canadá, se emprendió en mayo de 2014, un programa de vacunación con 4CMenB en la región de Saquenay-Lac-Sant Jean (Quebec) durante el brote de enfermedad meningocócica por el serogrupo B en la Universidad de Acadia (Nueva Escocia). No se observaron casos entre los 49.000 residentes de 2 meses a 20 años que recibieron la vacuna(11).
• En EE.UU.(12), se ha utilizado la vacuna para el control de distintos brotes registrados en universidades: no se han descrito casos en los receptores de la vacuna.
La vacuna se introdujo en Reino Unido(13) el 1 de septiembre de 2015 en lactantes, con un esquema de 2+1. Tres años después de la implementación del programa, la cobertura de dos dosis en el primer año es del 92,5% y la cobertura con 3 dosis a los 2 años es del 87,5%.
Se ha constatado una reducción del 75% de casos de enfermedad meningocócica invasiva (EMI) Men B (población diana) con protección confirmada, al menos, hasta fin del 2º año de vida.
La efectividad vacunal frente EMI Men B tras 2 dosis (pauta 2+0), es del 52,7% (IC 95%: -33,5 a 83,2) y con la pauta completa 2+1 es del 59,1% (IC 95%: -31,1 a 87,1).
No se han detectado problemas de seguridad tras 3 millones de dosis administradas y se estima una evitación de 277 casos en los últimos 3 años.
Vacuna bivalente contra el meningococo B (fHbp)
La protección frente al meningococo está mediada por anticuerpos y el sistema del complemento, que reconocen polisacáridos capsulares o proteínas de membrana externa, capaces de activar la vía clásica o la vía alternativa del complemento, lo que lleva a la formación del llamado complejo de ataque a la membrana, que causa la lisis celular.
La vacuna bivalente (Trumenba®) es una vacuna recombinante adsorbida frente al meningococo B, que está compuesta de las variantes lipidadas recombinantes de proteínas de unión al factor H (fHbp), y se basa en la proteína de unión al factor H (fHbp) como diana antigénica. Es producida en células de E. Coli, mediante tecnología de ADN recombinante y está adsorbida en fosfato de aluminio. El fHbp está expuesto en la superficie, está expresado en casi todas las cepas y es capaz de inducir anticuerpos bactericidas. La fHbp se encuentra en la superficie del meningococo y es esencial para que las bacterias eviten el sistema inmune del huésped. Las variantes de fHbp se dividen en 2 subfamilias inmunológicamente distintas, A y B (Fig. 4).
Figura 4. Variantes de las 2 subfamilias de fHbp. Fuente: Wang. Vaccine 2011.
El 99% de cepas tienen el gen para expresar la proteína, y más del 96% de las cepas meningocócicas del serogrupo B aisladas en Europa, expresan variantes de fHbp de cualquiera de las subfamilias en la superficie bacteriana. La subfamilia A contiene las variantes 2 y 3, y la subfamilia B (incluida en la vacuna multicomponente 4C Men B) contiene la variante 1.
La inmunización con Trumenba®, que contiene una variante de fHbp de cada una de las subfamilias A y B, está dirigida a estimular la producción de anticuerpos bactericidas que reconocen la fHbp expresada en el meningococo. El ensayo de expresión del antígeno de superficie meningocócico(14) (meningococcal antigen surface expression, MEASURE) se desarrolló para relacionar el nivel de expresión de la fHbp en la superficie bacteriana con la eliminación de las cepas meningocócicas del serogrupo B, usando la actividad bactericida en suero con complemento humano (hSBA). Un estudio de más de 2.150 cepas aisladas diferentes de bacterias meningocócicas invasivas del serogrupo B, recogidas entre 2000 y 2014 en 7 países europeos, EE.UU. y Canadá, demostró que, más del 91% de todas las cepas de meningococo del serogrupo B aisladas, expresaban niveles suficientes de fHbp para ser susceptibles a la actividad bactericida por los anticuerpos inducidos por la vacuna.
Inmunogenicidad
La protección frente a la enfermedad meningocócica invasiva está mediada por anticuerpos bactericidas en suero, frente a antígenos de superficie bacteriana, que actúan de manera conjunta con el complemento humano. Como se ha dicho anteriormente, la baja incidencia de enfermedad meningocócica invalida los ensayos clínicos de eficacia tradicionales, debiendo utilizarse, en cambio, correlatos basados en el ensayo in vitrode actividad bactericida en suero, usando complemento humano (hSBA) frente al meningococo del serogrupo B. El título de hSBA se define como la mayor dilución de suero que es capaz de eliminar el 50% de bacterias. Un título en hSBA mayor o igual a 1:4 se considera protector frente a la enfermedad meningocócica, pero en el análisis de inmunogenicidad de Trumenba®(15), la respuesta se definió como un título de hSBA de, al menos, 1:8 o 1:16 dependiendo de la cepa usada.
Trumenba® se ha evaluado en 11 ensayos clínicos(16) con más de 15.000 sujetos. La eficacia se ha evaluado frente a 4 cepas de meningococo del serogrupo B, que expresan variantes de fHbp que representan a las dos subfamilias y, en conjunto, son representativas de las cepas meningocócicas del serogrupo B causantes de la enfermedad meningocócica invasiva (A22, A56, B24, B44). Además, la vacuna también se ha testado frente a 10 cepas adicionales del meningococo B (A06, A07, A12, A15, A29, B03, B09, B15 y B16). Se han estudiado pautas de 2 (0-6) o 3 dosis (0-1/2-6): ambas se han mostrado inmunógenas; si bien, la pauta de 3 dosis ha mostrado resultados algo superiores: un 79,8-90,2% de sujetos alcanzaron aumentos del título de hSBA >4 veces al basal y respuesta compuesta para las 4 cepas principales del 83,5% en pautas de 3 dosis, y del 73,5% en pautas de 2. En ficha técnica, se recomienda la pauta de 2 dosis en individuos sin factores de riesgo, y la de 3 dosis en sujetos de riesgo para enfermedad meningocócica invasiva.
La vacuna ha mostrado persistencia de la inmunogenicidad hasta 4 años después de la vacunación con 2 o 3 dosis, y una dosis de refuerzo ha mostrado una respuesta anamnésica en individuos previamente vacunados(17).
Trumenba® se puede administrar concomitantemente con VPH4, Tdpa, Men ACWY y Tdpa/VPI.
No se dispone de datos de efectividad, dado que esta vacuna no se ha incluido aún en ningún programa de inmunizaciones sistemáticas; si bien, se ha mostrado efectiva en el control de brotes epidémicos.
La vacuna se ha mostrado segura(18), con efectos adversos leves o moderados. Se han descrito fundamentalmente dolor en el lugar de inyección, fatiga y cefalea. La tasa de efectos graves fue semejante entre los vacunados y el grupo control. Las reacciones adversas tras la dosis de recuerdo en 268 sujetos de 15 a 23 años fueron similares a las reacciones adversas observadas durante la serie de vacunación primaria de Trumenba, aproximadamente 4 años antes.
Posología(19)
• La vacuna está autorizada para mayores de 10 años.
• Pauta de 2 dosis: con 6 meses de intervalo.
• Pauta de 3 dosis: un mes de intervalo entre la primera y la segunda, y 4 meses entre la segunda y tercera.
• Se debe contemplar la posibilidad de una dosis de refuerzo en individuos de riesgo continuado para EMI.
Inmunidad de grupo y vacunas proteicas contra el meningococo B
En relación al impacto sobre la portación nasofaríngea en personas vacunadas, los datos actualmente disponibles no muestran un efecto significativo en la reducción de la colonización nasofaríngea, por lo que hasta el presente, debemos considerar que ambas vacunas recombinantes proteicas contra el meningococo B no han demostrado impacto comunitario por inmunidad de grupo, y que su beneficio es individual(20).
Vacunas antimeningocócicas tetravalentes (ACYW) y frente al meningococo C
Historia del desarrollo vacunal
Los primeros intentos infructuosos de desarrollar estas vacunas se remontan a principios del siglo XX. Entre 1900 y 1940, se realizaron múltiples ensayos, la mayoría poco controlados. Algunas de estas vacunas estaban elaboradas a partir de células enteras y resultaban excesivamente reactógenas. Gracias al desarrollo exitoso de vacunas con toxoides diftérico y tetánico en la década de 1930, se abrió una línea de investigación con exotoxina meningocócica inactivada. Estos preparados resultaban inmunógenos, pero estaban contaminados con otros antígenos, como endotoxinas. El éxito posterior del tratamiento de la enfermedad meningocócica con antibióticos, hizo decaer el interés en la investigación de vacunas; de la misma manera, la aparición de resistencias antibióticas en la época de la guerra de Vietnam, renovó el interés en la investigación de las mismas.
A finales de la década de los 60, Gotschlich y cols., consiguen purificar polisacáridos meningocócicos de alto peso molecular, seguros e inmunógenos, que constituyen la primera vacuna exitosa frente a los serogrupos A y C. En 1978, se aprueba la primera vacuna polisacarídica frente a meningococo A, C, Y, W-135. La principal limitación de estas vacunas es que no producen inmunidad T-dependiente y son muy poco inmunógenas en niños menores de dos años. En los años 80, se desarrollaron con éxito vacunas de polisacáridos conjugados con proteínas frente al Haemophilus B, y esto sirvió de base para investigar vacunas de polisacáridos meningocócicos conjugados con proteínas. Las vacunas meningocócicas conjugadas frente a serogrupo C se introducen con éxito en Reino Unido en 1999 y, posteriormente, en otros países de Europa. En 2005, se licencia en EE.UU. una vacuna polisacarídica conjugada frente a los serogrupos ACYW (Menactra®), recomendándose su uso en adolescentes y adultos jóvenes. Posteriormente, se licencian otras dos vacunas (Menveo®, Nimenrix®) en EE.UU. y Europa.
Vacunas polisacarídicas/conjugadas: la evolución
Las vacunas polisacarídicas fueron las primeras en desarrollarse, pero presentan una serie de desventajas frente a la nueva generación de vacunas conjugadas, a saber:
• Polisacarídicas: seguras e inmunógenas en adultos, pero no en lactante y niño pequeño. Presentan fenómeno de hiporrespuesta en dosis repetidas. La respuesta inmune está basada en activación de linfocitos B, generando IgM de corta duración en el tiempo; al no activar los linfocitos T, no generan memoria inmune. Por último, no impactan en portación nasofaríngea y no producen efecto rebaño.
• Conjugadas: son inmunógenas en lactante y niño pequeño, sin presentar fenómeno de hiporrespuesta. La respuesta inmune activa también el linfocito T, siendo esta más potente (basada en IgG), y generan memoria inmunológica. Por último, dado el impacto sobre portación nasofaríngea, tienen efecto rebaño.
Por todo ello, las vacunas conjugadas han reemplazado a las polisacarídicas, aunque siguen estando disponibles en algunos países y pueden usarse para el control de brotes.
Epidemiología de los serogrupos A, C, Y, W
El meningococo presenta una epidemiología altamente dinámica, de tal manera que la distribución de serogrupos varía en tiempo y área geográfica.
• Serogrupo A: ha sido el causante de las epidemias de meningitis que se han sucedido en África, en el conocido como: “cinturón africano de la meningitis”. La campaña masiva de vacunación realizada con una vacuna conjugada frente a este serogrupo (MenAfriVac®), ha conseguido controlar los brotes y ha tenido un gran impacto en la portación nasofaríngea, demostrando así inmunidad de grupo.
• Serogrupo C: la introducción en calendarios de la vacuna conjugada frente a este serogrupo, consiguió una drástica disminución de la incidencia al cabo de dos años. Además, se ha demostrado una efectividad en la disminución de portación nasofaríngea del 75% y un 50% de protección indirecta, debido a la inmunidad de grupo.
• Serogrupo Y: a finales de los años 90, se produce en EE.UU. un aumento significativo de casos y, es por ello, que se introduce el uso de vacunas tetravalentes en adolescentes y preadolescentes.
• En la UE, se observa también entre el 2007 y 2011, un aumento de casos; en Suecia en el 2011 este serogrupo supuso casi el 50% de los casos.
• Serogrupo W: ha sido el causante del brote del año 2000 en la peregrinación anual a La Meca (Hajj), por un complejo clonal hipervirulento llamado ST-11.De este clon, se han descrito dos linajes diferentes, el que provocó el brote en La Meca y, el que en el año 2003, se detecta en Sudamérica; este último aparece posteriormente en Reino Unido en 2008 y en Holanda en 2013(21). Estas circunstancias han obligado a renovar las políticas vacunales: los viajeros a la Meca, desde el año 2000, precisan recibir vacuna tetravalente (A, C, Y, W); por otro lado, Reino Unido y Holanda han introducido estas vacunas en sus calendarios. Otros países Europeos también se han sumado a este cambio del calendario vacunal.
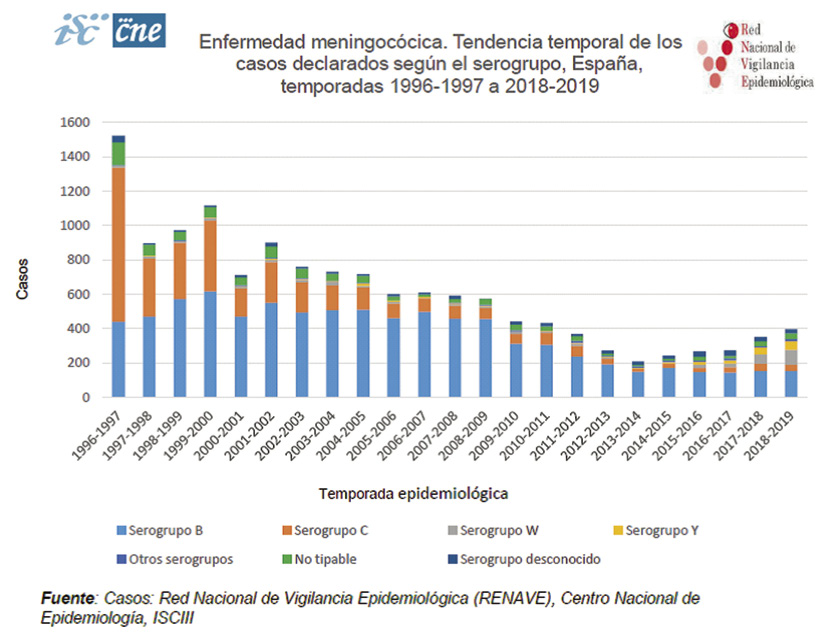
• Epidemiología en España (Fig. 5): como se aprecia en la imagen del informe RENAVE, además del aumento en la incidencia, se ha producido un cambio en la distribución de serogrupos en las últimas temporadas.
Figura 5. Tendencia temporal enfermedad meningocócica en España de 1996-1997 a 2018-2019. Fuente: Red Nacional de Vigilancia Epidemiológica (RENAVE),Centro Nacional de Epidemiología, ISCIII.
La incidencia por serogrupo W e Y ha aumentado en las cinco últimas temporadas: de 4 casos a 86 y de 6 casos a 51, respectivamente(22). Esto ha obligado a introducir cambios en el calendario vacunal, que comentaremos a lo largo de este capítulo.
Vacunas disponibles frente a los serogrupos A, C, Y, W
Actualmente disponemos en España de cinco vacunas para estos serogrupos: tres monovalentes frente al C (Menjugate®, Meningitec® y Neisvac-C®) y dos tetravalentes frente a A, C, Y, W (Nimenrix® y Menveo®). De entre las monovalentes frente al serogrupo C, actualmente Neisvac-C® es la que se utiliza mayoritariamente, ya que permite pauta de una sola dosis en el primer año de vida por su inmunogenicidad. Respecto a las tetravalentes, el componente “C” de estas genera inmunidad similar al de las monovalentes y, por tanto, se pueden sustituir en las pautas vacunales.
Todas estas vacunas son de tipo conjugado, variando la proteína utilizada: toxoide tetánico, o la mutante atóxica de la toxina diftérica (CRM197). Están expuestas en la tabla III.
Presentación, reconstitución, vías de administración
• Neisvac-C®: suspensión inyectable en jeringa precargada de 0,5 ml, debe agitarse hasta conseguir suspensión homogénea. Conservar entre +2 y +8ºC.
• Meningitec®: suspensión inyectable en jeringa precargada; tras la agitación se obtiene suspensión blanquecina y homogénea. Conservar entre +2 y +8ºC.
• Menjugate®: suspensión inyectable en jeringa precargada. Conservar entre +2 y +8ºC.
• Nimenrix®: polvo en vial y disolvente en jeringa precargada para solución inyectable. Tras la reconstitución, debe administrarse rápidamente. No administrarse si no se usa en el plazo de 8 horas. Conservar entre +2 y +8ºC.
• Menveo®: polvo en vial (oligosacárido A) y solución en vial (oligosacárido C, Y, W). Ha de prepararse mediante la reconstitución del polvo en vial con la solución del otro vial, debe usarse de forma inmediata. Conservar entre +2 y +8ºC.
• Vías de administración:
– Las vacunas se deben administrar por vía intramuscular, siendo la localización en cara anterolateral del muslo en niños pequeños, y en deltoides en niños mayores y adultos.
– Nimenrix® y Menveo® no se pueden utilizar por vía subcutánea.
Inmunogenicidad, eficacia y efectividad
Ya hemos comentado las ventajas de las vacunas polisacarídicas conjugadas frente a las no conjugadas en términos de respuesta inmune. La protección de estas vacunas se define con correlatos que están establecidos desde los años 60. Se definen a través del SBA (serum bactericidal assay), que mide títulos de anticuerpo suficientes para matar la bacteria “in vitro”. Se consideran protectores títulos >1/4, aunque solamente está validado para antígenos capsulares polisacarídicos.
Las primeras vacunas conjugadas frente al serogrupo C, fueron introducidas en el calendario infantil en 1999 y 2000 en Reino Unido, con un amplio catch-up hasta los 19 años de edad. La incidencia de EMI por este serogrupo disminuyó dramáticamente tras dos años de la introducción, y prácticamente desapareció en 2005. La efectividad en la reducción de la portación nasofaríngea en adolescentes fue mayor del 75%, y la reducción de la incidencia debida a la inmunidad de grupo se ha mantenido dos décadas.
Posteriormente, se comprobó que la efectividad de estas vacunas descendía a los 4 años de seguimiento a un 66%, en aquellos niños vacunados el primer año de vida sin recibir refuerzo posterior. Estos datos también se confirmaron en España, lo que llevó a introducir dosis de refuerzo en el segundo año de vida. Y es que la persistencia de anticuerpos funcionales séricos se considera el mayor determinante de efectividad de estas vacunas. Dada la rápida progresión de esta enfermedad, los anticuerpos inducidos por la memoria inmunológica, por sí solos, no serían suficiente respuesta, puesto que necesitan un plazo de 5 a 7 días para generarse.
La eficacia de las vacunas tetravalentes se basa en la demostración de niveles de anticuerpos bactericidas para cada uno de los antígenos, en un nivel no inferior a los generados por las vacunas polisacarídicas no conjugadas. Los títulos de anticuerpos bactericidas se mantienen en nivel aceptable entre 3-5 años. Las dosis de refuerzo consiguen una potente respuesta anamnésica y, respecto a la duración de la protección, la vacunación en adolescentes ofrece protección suficiente, al menos, 5 años.
La efectividad de los preparados tetravalentes está siendo evaluada en aquellos países que las han introducido en su calendario vacunal y nos van aportando los datos. En Reino Unido, tras tres años de campaña (y con bajas coberturas) el Joint Commitee on Vaccination and Inmunization (JCVI), resume los datos obtenidos en su informe de octubre de 2018:
• Por primera vez desde el brote, han disminuido en global los casos de EMI por serogrupo W.
• Las cohortes vacunadas han experimentado una disminución más llamativa.
• No se ha documentado disminución de casos en lactantes.
• Sí ha habido disminución de casos en niños de 1-4 años.
• En términos generales, en estos 3 años de vacunación, se han evitado unos 50 casos de EMI por serogrupo W.
El informe del JCVI de octubre de 2019, señala que la temporada 2017-2018 ha sido la primera en la que ha habido una disminución global de casos de EMI por serogrupo W.
Co-administración con otras vacunas
Las vacunas frente a serogrupo C se pueden administrar junto a las vacunas frente a: difteria, tétanos, tosferina, poliomielitis inactivada, triple vírica, hepatitis B, haemophilus influenzae B y neumococo.
Menveo® es compatible con: hepatitis A y B monovalente y combinada, fiebre amarilla, fiebre tifoidea (polisacárido Vi), encefalitis japonesa, rabia y meningococo del grupo B (Bexsero®).
En adolescentes (de 11 a 18 años de edad), Menveo® ha sido evaluado en dos estudios de coadministración con la vacuna Tdap (tétanos, difteria de baja carga y tosferina acelular) adsorbida sola o en combinación con la vacuna recombinante cuadrivalente contra el virus del papiloma humano (VPH genotipos 6, 11, 16, 18), en los cuales se demuestra la tolerancia de dicha coadministración.
Nimenrix®: en lactantes, se puede administrar simultáneamente con las vacunas combinadas DTPa-VHB-IPV/Hib y con la vacuna conjugada antineumocócica 10-valente.
A partir de 1 año de edad o más, Nimenrix® se puede administrar simultáneamente con cualquiera de las siguientes vacunas: vacunas de la hepatitis A (VHA) y de la hepatitis B (VHB), vacuna triple vírica, vacuna de sarampión, parotiditis, rubeola y varicela (SRPV), vacuna conjugada antineumocócica 10-valente o vacuna antigripal estacional no adyuvada.
En el segundo año de vida, Nimenrix® también se puede administrar simultáneamente con las vacunas combinadas de: difteria, tétanos, Pertussis acelular (DTPa), incluyendo combinaciones de vacunas DTPa con hepatitis B, polio inactivada o Haemophilus influenzae tipo b (VHB, IPV o Hib), tales como la vacuna DTPa-VHB-IPV/Hib y la vacuna conjugada antineumocócica 13-valente.
En personas entre 9-25 años, Nimenrix® se puede administrar simultáneamente con la vacuna recombinante bivalente (genotipos 16 y 18) del virus del papiloma humano (VPH2).
Hay que tener en cuenta que si se debe administrar una vacuna que tenga toxoide tetánico (TT) en su composición, se puede administrar simultáneamente con Nimenrix® o bien separarse 1 mes (administrando Nimenrix® en primer lugar y un mes después la otra vacuna que contenga TT).
Respecto a las vacunas tetravalentes polisacarídicas: se deberá guardar un intervalo mínimo de 8 semanas si ha recibido previamente una vacuna polisacarídica antes de recibir una conjugada; si se recibe primero una vacuna tetravalente conjugada, se debe guardar un intervalo de 2 semanas respecto a la polisacarídica.
Indicaciones y esquemas de vacunación
• Las recomendaciones del CISNS en su “calendario común de vacunación” para el año 2020, en relación a la vacunación antimeningocócica son las siguientes:
– Vacunación a los 4 meses (MenC): según el preparado, puede ser necesaria la primovacunación con una dosis (4 m) o dos dosis (2 y 4 meses de edad).
– Vacunación a los 12 meses: (Men C).
– Vacunación a los 12 años: (Men ACYW): se administrará una dosis a los adolescentes de 12 años de edad que no hayan recibido una dosis de Men ACYW después de los 10 años de edad.
– Vacunación después de los 12 y hasta los 18 años de edad (Men ACYW): la captación y vacunación de los adolescentes hasta los 18 años de edad, se realizará de manera progresiva. La información al respecto se puede consultar en el último documento elaborado por el Ministerio de Sanidad, publicado en marzo 2020(23).
– Recomendación de vacunación en grupos de riesgo:
a. Asplenia anatómica o disfunción esplénica grave.
b. Deficiencias del sistema complemento y tratamiento con eculizumab.
c. Trasplante de progenitores hematopoyéticos.
d. Padecimiento anterior de enfermedad meningocócica invasiva.
e. Personal de laboratorio expuesto a meningococo.
f. En caso de agrupaciones de casos (brotes) u otras situaciones en las que las autoridades sanitarias lo considerasen necesario.
g. En personas con infección por VIH.
• La recomendación del Comité Asesor de vacunas de la AEP para el 2021 es la siguiente:
– Una dosis a los 4 meses de MenC-TT y una dosis de MenACWY a los 12 meses, y otra a los 12-14 años de edad, con un rescate progresivo hasta los 18 años. Para el resto de edades, la recomendación es de protección individual. Además, otras recomendaciones incluyen:
a. Niños mayores de 6 semanas de vida con factores de riesgo de enfermedad meningocócica invasiva (EMI).
b. Viajes o estancias en países de elevada incidencia o en los que la vacuna esté incluida en calendario, como: EE.UU., Canadá, Argentina, Reino Unido, Austria, Grecia, Holanda, Italia o Suiza.
c. Con carácter individual, los niños en edades menores de los 12 meses y entre 1 y 12 años, pueden verse beneficiados también con estas vacunas, aumentando así su protección antimeningocócica.
Posología
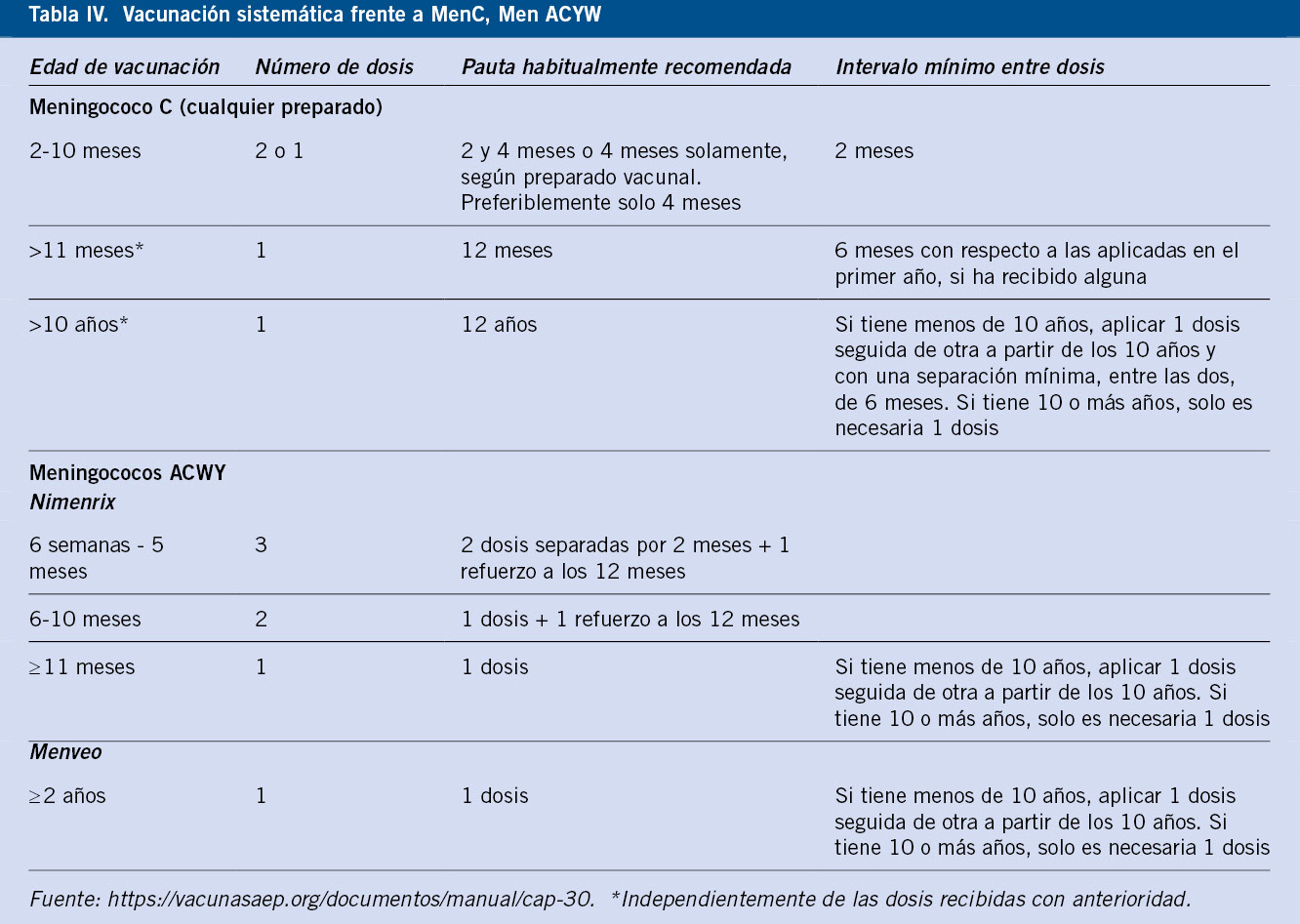
En las siguientes tablas, se expresa la pauta de vacunación frente a Men C, Men ACYW de manera sistemática, y en los grupos de riesgo.
• Vacunación sistemática frente a MenC, Men ACYW (Tabla IV).
• Vacunación en grupos de riesgo (Tabla V).
Seguridad
En este punto, conviene recordar, que la ficha técnica de cada vacuna es un documento que debemos tener a mano para consultar posibles dudas respecto a contraindicaciones y los efectos adversos descritos con cada una.
En términos generales, se podrían resumir en:
• Los efectos adversos más frecuentes de las vacunas frente a Men C son de tipo local; de tipo sistémico más frecuente son: cefalea y malestar general. Son muy infrecuentes las reacciones graves.
• Las vacunas frente a Men ACYW pueden tener efectos adversos de tipo local, y de tipo sistémico como: fiebre, cefalea, malestar general y trastornos gastrointestinales.
Precauciones y contraindicaciones
Contraindicaciones absolutas:
• Antecedente de reacción anafiláctica a dosis previa de la vacuna.
• Antecedente de reacción anafiláctica a alguno de los componentes de la vacuna.
• Contraindicaciones relativas (a valorar riesgo/beneficio):
– Enfermedad aguda, será preferible retrasar la vacuna.
– Embarazo y lactancia: con datos limitados en estas circunstancias, será necesario valorar la relación beneficio/riesgo en cada caso.
Vacunas en investigación(24,25)
Actualmente están en proceso de desarrollo vacunas pentavalentes ABCYW, de interés en Europa y mundo occidental, y vacunas ACYWX, de interés en África subsahariana.
Bibliografía
1. Bexsero®. Ficha técnica. Actualizada en mayo de 2020. Disponible en: http://www.ema.europa/docs/es.
2. Vesikari T, Esposito S, Prymula R, Ypma E, Kohl I, Tonneato D, et al. Inmunogenicidad y seguridad de una vacuna meningocócica del serogrupo B, recombinante, multicomponente, en fase de investigación (4CMenB) administrada concomitantemente con las vacunas rutinarias en lactantes y niños: resultados de dos ensayos aleatorizados. Lancet. 2013; 381: 825-35.
3. Flacco ME, Manzoli L, Rosso A, Marzuillo C. Immunogenicity and safety of the multicomponent meningococcal B vaccine (4CMenB) in children and adolescents: a systematic review and meta-analysis. Lancet Infect Dis. 2018; 18: 461-72. doi: 10.1016/S1473-3099(18)30048-3.
4. Bryan P, Seabroke S, Wong J, Donegan K, Webb E, Goldsmith C, et al. Safety of multicomponent meningococcal group B vaccine (4CMenB) in routine infant immunization in the UK: a prospective surveillance study. Lancet Child Adolesc Health. 2018; 2: 395-403. doi: 10.1016/S2352-4642(18)30103-2.
5. Vesikari T, Esposito S, Prymula R, Ypma E, Kohl I, Toneatto D, et al. Immunogenicity and safety of an investigational multicomponent, recombinant, meningococcal serogroup B vaccine (4CMenB) administered concomitantly with routine infant and child vaccinations: results of two randomised trials. Lancet. 2013; 381: 825-35. doi: 10.1016/S0140-6736(12)61961-8.
6.*** Martinón-Torres F, Safadi MA, Carmona A, Infante P, Tejedor JC, Weckx L et al. Reduced schedules of 4CMen B vaccine in infants and catch-up series in children: immunogenicity and safety results from a randomised open-label phase 3b trial. Vaccine. 2017; 35: 3548-57.
7. Medini D, Stella M, Mats. WJ. Global coverage estimates for 4CMenB, a novel multicomponent meningococcal B vaccine. Vaccine. 2015; 33: 2629-36. doi: 10.1016/j.vaccine.2015.04.015.
8.** Martinón-Torres F, Carmona A, Simko R, Infante P, Arimany JL, Giménez F, et al. Antibody persistence and booster responses 24-36 months after different 4Cmen B vaccination schedules in infants and children; a randomised trial. Journal of infection. 2018; 76: 258-69.
9. Martinón-Torres F, Nolan T, Toneatto D, Banzhoff A. Persistence of the immune response after 4CMenB vaccination, and the response to
10. Martinón-Torres F, Bernatowska E, Shcherbina A, Esposito S, Szenborn L, Campins Marti M, et al. Meningococcal B vaccine immunogenicity in children with defects in complement and splenic function. Pediatrics. 2018; 141: e20174250. doi: 10.1542/peds.2017-4250.
11. De Serres G, Billard MN, Gariepy MC, Rouleau I, Toth E, Landry M, et al. Short-term safety of 4CMenB vaccine during a mass meningococcal B vaccination campaign in Quebec, Canada. Vaccine. 2018; 36: 8039-46. doi: 10.1016/j.vaccine.2018.10.095.
12. McNamara LA, Shumate AM, Johnsen P, MacNeil JR, Patel M, Bhavsar T, et al. First use of a serogroup B meningococcal vaccine in the US in response to a university outbreak. Pediatrics. 2015; 135: 798-804. doi: 10.1542/ peds.2014-4015.
13. Ladhani SL, Andrews N, Parikh SR, Campbell H, White J, Edelstein M, et al. Vaccination of infants with meningococcal group B vaccine (4CMen B) in England. N Engl J Med. 2020; 382: 309-17.
14.* McNeil LK, Donald RGK, Gribenko A, French R, Lambert N, Harris SL, et al. Predicting the Susceptibility of Meningococcal Serogroup B Isolates to Bactericidal Antibodies Elicited by Bivalent rLP2086, a Novel Prophylactic Vaccine. mBio. 2018; 9: e00036-e00018. doi: 10.1128/mBio.00036-18.
15. Harris SL, Donald RG, Hawkins JC, Tan C, O’Neill R, Mc Neil L, et al. Neisseria meningitidis Serogroup B vaccine, bivalent rLP2086, induces broad serum bactericidal activity against diverse invasive strains including outbreak strains. Pediatr Infect Dis J. 2017; 36: 216-23.
16. Marshall HS, Richmond PC, Beeslaar J, Jiang Q, Jansen KU, Garcés-Sánchez M, et al. Meningococcal serogroup B specific responses after vaccination with bivalent rLP2086: 4 year follow-up of a randomised, single-blind, placebo-controlled, phase 2 trial. Lancet Infect Dis. 2017; 17: 58-67. doi: 10.1016/S1473-3099(16)30314-0.
17. Vesikari T, Ostergaard L, Beeslaar J, Absalon J, Eiden JJ, Jansen KU, et al. Persistence and 4-year boosting of the bactericidal response elicited by two- and three-dose schedules of MenB-FHbp: A phase 3 extension study in adolescents. Vaccine. 2019; 37: 1710-9. doi: 10.1016/j.vaccine.2018.11.073.
18. Fiorito TM, Baird GL, Alexander-Scott N, Bornschein S, Kelleher C, Du N, et al. Adverse events following vaccination with bivalent rLP2086 Trumenba(R): an observational, longitudinal study during a college outbreak and a systematic review. Pediatr Infect Dis J. 2018; 37: e13-e19. doi: 10.1097/INF.0000000000001742.
19. Trumenba® Ficha técnica. Disponible en: http://www.ema.europa/docs/es.
20. Marshall HS, McMillan M, Koehler AP, Lawrence A, Sullivan TR, Mac Lennan JM, et al. Meningococcal B Vaccine and meningococcal carriage in adolescents in Australia. N Engl J Med. 2020; 382: 31827.
21. Abad R, Vázquez JA. Vacunas multivalentes frente a enfermedad meningocócica: ¿dentro o fuera de nuestras agendas? An Pediatr (Barc). 2014; 81: 329.e1-7.
22. RENAVE. Enfermedad meningocócica invasora. Disponible en: https://www.isciii.es/QueHacemos/Servicios/VigilanciaSaludPublicaRENAVE/EnfermedadesTransmisibles/Documents. Consultado el 10 de septiembre de 2020.
23. Ministerio de Sanidad. Calendario de vacunación a lo largo de toda la vida. Disponible en: http://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones. Consultado el 27 abril de 2020.
24. Leszek Szenborn, MD,* Stan L. Block, “Immune Responses to Booster Vaccination With Meningococcal ABCWY Vaccine After Primary Vaccination. With Either Investigational or Licensed Vaccines”. The Pediatric Infectious Disease Journal • Volume 37, Number 5, May 2018.
25. Phase 3, Observer-blind, Randomized, Active Controlled Trial to Assess the Safety of an Investigational Meningococcal Serogroups ACYWX Conjugate Vaccine (NmCV-5) and Compare Its Immunogenicity to a Licensed Meningococcal Serogroups ACYW Conjugate Vaccine (Menactra®), in Healthy Subjects 2 to 29 Years of Age. ClinicalTrials.gov identifier: NCT03964012.
Bibliografía recomendada
– AEP. Manual de vacunas en línea de la AEP. Meningococo. Disponible en: https://vacunasaep.org/documentos/manual/cap-30. Actualizado en mayo de 2020. Consultado el 26 de mayo de 2020.
Completo manual de vacunas, actualizado permanentemente por el CAV de la AEP.
– Aguirrezabalaga B. Vacunas antimeningococicas tetravalentes. En: Avances en Vacunas de la SEPEAP: Enfermedad Meningococica: mantengamos la alerta. 2ªed. IMC; 2019. p. 91-100.
Monografía sobre enfermedad meningocócica elaborada por el Grupo de trabajo de vacunas (VACAP) de la SEPEAP.
– Harrison LH, Granoff DM, Pollard AJ. Meningococcal Capsular group A, C, W and Y Conjugate Vaccines. En: Plotkin´s Vaccines. 7th.ed. Elsevier.2018; 619-43.
Capítulo del libro de texto de vacunas referencial en todo el mundo.
– Márquez L. Meningococcal disease. En: Feigin and Cherry´s Textbook of Pediatric Infectious diseases. 8th ed. Elsevier; 2019. p. 898-912.
Capítulo correspondiente al libro de texto de mayor prestigio en infectología pediátrica.