 |
| Temas de FC |
J. Ruiz Contreras
Catedrático de Pediatría jubilado de la Universidad Complutense de Madrid. Exjefe del Servicio de Pediatría del Hospital Universitario 12 de Octubre. Madrid
| Resumen
Las infecciones respiratorias de repetición en los niños, cuando afectan exclusivamente a las vías respiratorias altas, se deben, casi siempre, a factores ambientales, tales como: la falta de exposición previa a los patógenos, asistencia del propio niño o sus hermanos a guardería y tabaquismo familiar. Con mucha menos frecuencia, obedecen a enfermedades o causas subyacentes como: asma, fibrosis quística, discinesia ciliar primaria e inmunodeficiencias primarias. De forma característica, las infecciones de las inmunodeficiencias primarias se acompañan de otros signos y síntomas de afectación de varios órganos o sistemas. La afectación difusa de todo el aparato respiratorio es la característica de todas estas enfermedades sistémicas, a diferencia de las alteraciones anatómicas, que facilitan las infecciones siempre en la misma localización. |
| Abstract
Recurrent respiratory infections in children, when they exclusively affect the upper respiratory tract, are almost always due to environmental factors, such as: lack of previous exposure to pathogens, attendance of the child himself or his siblings to daycare, and family smoking. Much less frequently, they are due to underlying diseases or causes such as: asthma, cystic fibrosis, primary ciliary dyskinesia, and primary immunodeficiencies. Typically, primary immunodeficiency infections are accompanied by other signs and symptoms of involvement of various organs or systems. Diffuse affectation of the entire respiratory system is characteristic of all these systemic diseases, unlike anatomical alterations, which facilitate infections always in the same location. |
Palabras clave: Infecciones respiratorias de repetición; Infecciones recurrentes; Infecciones oportunistas; Inmunodeficiencias primarias.
Key words: Recurrent respiratory infections; Recurring infections; Opportunistic infections; Primary immunodeficiencies
Pediatr Integral 2023; XXVII (5): 249 – 256
OBJETIVOS
• Diferenciar las infecciones respiratorias de repetición por causa ambiental de las debidas a enfermedades subyacentes.
• Conocer las enfermedades que pueden dar lugar a infecciones recurrentes en el niño, e identificarlas según los patógenos aislados.
• Aprender a sospechar la existencia de inmunodeficiencia primaria en niños con infecciones recurrentes.
• Conocer los principios básicos del tratamiento y la prevención de las infecciones recurrentes en el niño.
Infecciones de repetición en el niño
Introducción
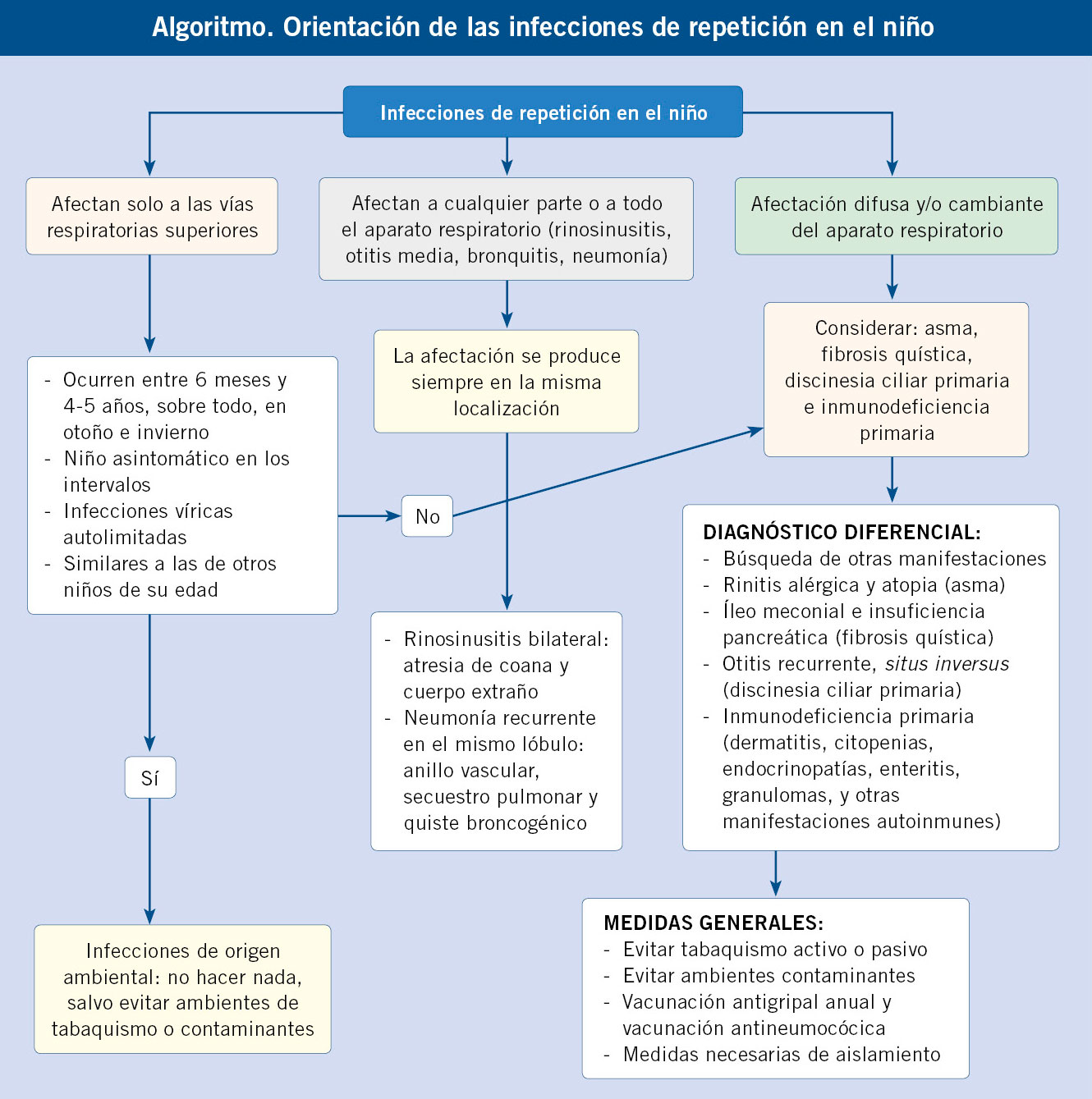
El término de “infecciones de repetición” alude a niños que padecen infecciones con una frecuencia que parece ser mayor que la de otros niños de su misma edad. En los países desarrollados, entre el 18 % y el 25 % de los niños tienen infecciones respiratorias de vías altas de repetición en los primeros 4 años de vida(1), como consecuencia de la exposición a patógenos, generalmente virus, con los que su sistema inmune no ha tenido contacto previo. Se ha estimado que la media anual durante esta época de la vida es de 6-8 infecciones de vías respiratorias altas, pero puede alcanzar hasta 10-12 infecciones al año, cuando el niño o sus hermanos asisten a guardería o hay factores ambientales, como el tabaquismo en los padres(1-3). La sucesión de estas infecciones, teniendo en cuenta que su duración es de alrededor de 8 días, da lugar a la impresión de que el niño está continuamente enfermo, lo que genera preocupación y ansiedad en sus padres. En muchos menos casos, las infecciones respiratorias de repetición se deben a enfermedades locales o sistémicas.
Casi siempre, la historia clínica y la exploración física serán suficientes para hacer el diagnóstico diferencial. En general, en las infecciones respiratorias de repetición debidas a factores ambientales: no se aísla ninguna bacteria, suelen curar sin tratamiento antibiótico, no afectan al desarrollo estáturo-ponderal y, en los intervalos entre ellas, el niño está asintomático (Tabla I).
Además, su incremento coincide, generalmente, con el comienzo de la asistencia a la guardería o al colegio por parte del niño o de algún hermano. Por último, los rasgos clínicos (síntomas, gravedad, duración) de las infecciones de repetición por factores ambientales son similares a las de los niños que tienen una incidencia normal de las mismas.
Etiología y diagnóstico diferencial de las infecciones respiratorias recurrentes en el niño
Para unificar criterios, se ha acuñado, de manera convencional, el término de infecciones recurrentes cuando hay 2 o más infecciones graves al año, tres o más infecciones respiratorias (otitis, sinusitis o bronquitis) anuales o cuando el niño recibe tratamiento antibiótico, al menos, durante 2 meses al año.
Al iniciar la evaluación de un niño con infecciones recurrentes, hay dos consideraciones, además de la gravedad de las mismas, que ayudan a la orientación diagnóstica inicial: 1) si la afectación del aparato respiratorio es difusa o localizada, y en este último caso, si es siempre en la misma localización; y 2) si están implicados otros órganos o sistemas.
En general, las infecciones respiratorias recurrentes que afectan de forma difusa o cambiante al aparato respiratorio, se deben a enfermedades sistémicas como el asma, la fibrosis quística, la discinesia ciliar primaria y las inmunodeficiencias primarias. Por el contrario, cuando las infecciones implican a solo una parte del aparato respiratorio y siempre con la misma localización, la etiología apunta a factores anatómicos locales.
Infecciones recurrentes de vías altas
La otitis media recurrente o crónica y la faringitis recurrente casi nunca se deben a enfermedades sistémicas, si no se acompañan de otras manifestaciones, mientras que la rinosinusitis crónica obedece, con frecuencia, a estas enfermedades.
La rinosinusitis, la otitis media y la faringitis son las infecciones recurrentes más frecuentes en los niños.
No es infrecuente que la rinosinusitis crónica (más de 12 semanas de duración) o recurrente (4 o más episodios al año)(2,3) sea la manifestación inicial de enfermedades sistémicas, como: la fibrosis quística del páncreas (FQ), la discinesia ciliar primaria (DCP) y varias inmunodeficiencias primarias (IP)(4). Se ha estimado que entre un 10 y 20 % de las rinosinusitis crónicas resistentes al tratamiento, incluso quirúrgico, se deben a una IP. Clínicamente, la rinosinusitis se manifiesta con: rinorrea purulenta, obstrucción nasal y, a veces, dolor facial.
Por el contrario, es raro que la otitis media recurrente (definida como 3 o más episodios de otitis media en 6 meses previos o 4 episodios en el año previo) o la otitis crónica sean la única manifestación de alguna enfermedad sistémica. Por lo general, se deben a factores locales, como puede ser la disfunción de la trompa de Eustaquio y del oído medio, secundaria a otitis media aguda en los primeros meses de vida. Cuando se deben a enfermedades sistémicas, se acompañan casi siempre de manifestaciones de otros órganos o sistemas (p. ej., la otitis crónica del síndrome de Wiskott Aldrich se acompaña de eccema y trombocitopenia).
La faringitis recurrente forma parte casi siempre de las infecciones de vías respiratorias altas de etiología viral y casi nunca es una manifestación de enfermedades sistémicas. Incluso, cuando se aísla el Streptococcus pyogenes en niños con faringitis recurrente, los estudios serológicos han demostrado que se trata de infecciones víricas en niños que son portadores de la bacteria. En algunos niños con faringitis estreptocócicas recurrentes, se han descrito alteraciones inmunológicas locales en las amígdalas(5), que más allá del interés científico, no tienen repercusiones diagnósticas ni terapéuticas.
La única enfermedad sistémica asociada a faringitis recurrente es el síndrome PFAPA (Periodic Fever, Adenopathy, Pharyngitis and Afthae), que forma parte de las fiebres periódicas(6). Es un trastorno autoinflamatorio de etiología genética desconocida, cuya incidencia es de 2,3/10.000 niños, que se caracteriza por brotes recurrentes de fiebre, faringitis, estomatitis, adenitis cervical y leucocitosis. No existe ninguna prueba diagnóstica, sino que es una enfermedad que se diagnostica por los criterios clínicos de Marshall modificados (Tabla II). Una o dos dosis de prednisona (1-2 mg/kg/peso), separadas por un intervalo de 24 horas, hacen desaparecer la fiebre, lo que constituye una valiosa pista diagnóstica.
Enfermedades sistémicas que causan infecciones respiratorias recurrentes
Las enfermedades sistémicas que causan infecciones respiratorias recurrentes afectan de forma difusa, cambiante o no, al aparato respiratorio.
El asma y la rinosinusitis recurrente o crónica coexisten muy frecuentemente, y hay acuerdo en que, en estos casos, ambas entidades forman parte de la misma enfermedad. Además, la existencia de rinosinusitis aumenta, por diferentes mecanismos, el riesgo de desarrollar asma, y el asma mal controlado agrava la rinosinusitis.
En la mitad de los pacientes con FQ, la enfermedad debuta con síntomas respiratorios, como rinosinusitis crónica y bronquitis recurrentes. La función pulmonar se afecta desde los primeros años de vida y pronto se desarrolla enfermedad pulmonar obstructiva crónica. Las infecciones víricas y bacterianas causan exacerbación de la bronquitis y producen un estado de inflamación crónica, que acaba destruyendo el tejido pulmonar con formación de bronquiectasias. Entre un 30 y un 50 % de los niños, desarrollan poliposis nasal (este hallazgo obliga a descartar la enfermedad).
La infección de la vía aérea por Staphylococcus aureus y Haemophilus influenzae no tipable comienza en los primeros años de vida. Más tarde, la colonización/infección por Pseudomonas aeruginosa marca un punto de inflexión en la enfermedad, con aumento de las exacerbaciones y deterioro de la función pulmonar. Esta bacteria llega a ser imposible de erradicar y su persistencia permite el acúmulo de mutaciones que facilitan su adaptación y el cambio al fenotipo a colonias mucoides, más resistentes al tratamiento antibiótico(7,8). Otros microorganismos que se aíslan son: Stenotrophomonas maltophilia, Achromobacter xylosoxidans, el complejo Burkholderia cepacia (la infección por esta bacteria se asocia también a deterioro de la función pulmonar) y micobacterias no tuberculosas (sobre todo, el complejo Mycobacterium avium) y Aspergillus fumigatus(9,10). Las infecciones víricas, especialmente virus gripales, virus respiratorio sincitial (VRS) y rinovirus son una causa frecuente de exacerbaciones, deterioro de la función pulmonar y posibles cambios en el microbioma de las vías respiratorias(11). El resto de las manifestaciones extrarrespiratorias de la enfermedad ayudan a su sospecha, que se confirma con la demostración de una concentración de cloro en el sudor ≥60 mEq/l y la demostración de dos mutaciones asociadas a la enfermedad en el gen del CFRT.
La discinesia ciliar primaria (DCP) es una enfermedad autosómica recesiva que aparece en 1/10.000 -1/20.000 recién nacidos, y que se debe a una alteración estructural y funcional de los cilios, dando lugar a una disminución del aclaramiento mucociliar, que facilita las infecciones respiratorias. Clínicamente, se caracteriza por infecciones respiratorias recurrentes de vías altas y bajas, y anormalidades en la migración de las vísceras torácicas y abdominales en un 50 % de los casos (síndrome de Kartagener, definido por la tríada de sinusitis crónica, bronquiectasias y situs inversus). Desde el primer año de vida, los niños presentan: obstrucción nasal, rinosinusitis recurrente, tos productiva crónica y neumonías de repetición, que evolucionan a enfermedad pulmonar crónica supurada con bronquiectasias localizadas o difusas y pérdida grave de la función pulmonar(9).
Los patógenos más frecuentes en los primeros años de la vida son: Haemophilus influenzae no tipable (el patógeno más frecuente en esta enfermedad)(10-12), neumococo, Staphylococcus aureus y Moraxella catarrhalis, pero más tarde, cuando aparecen las bronquiectasias, se aíslan Pseudomonas aeruginosa, que no es tan frecuente ni forma colonias mucoides, como en la FQ, o bacilos gramnegativos(9). El complejo Burkholderia cepacia raramente aparece en la DCP.
El diagnóstico se realiza mediante estudio estructural de los cilios por microscopía electrónica en el material obtenido por cepillado nasal o mediante biopsia del epitelio de las vías aéreas. Este método confirma el diagnóstico, pero no siempre lo excluye, por lo que, a veces, es necesario recurrir a otros métodos, como la videomicroscopía de alta velocidad.
Las infecciones respiratorias recurrentes que afectan siempre el mismo sitio(3) del aparato respiratorio orientan hacia defectos anatómicos. Por ejemplo, la rinosinusitis crónica unilateral sugiere obstrucción nasal por cuerpo extraño o atresia de coanas.
Las neumonías recurrentes en el mismo lóbulo son casi siempre defectos anatómicos como: compresión bronquial extraluminal (adenopatías, anillos vasculares), obstrucción bronquial intraluminal (granulomas, cuerpos extraños), malformación congénita de la vía aérea (antes denominada malformación
adenomatoidea quística), secuestro pulmonar intralobar, quistes broncogénicos y otros. El diagnóstico se hace mediante tomografía computarizada (TC) o resonancia magnética (RM) del tórax. La aspiración de cuerpos extraños en el bronquio se debería sospechar, sobre todo, si hay asimetría auscultatoria o en la radiografía de tórax, incluso aunque no exista el antecedente de crisis de sofocación, que puede no haber sido advertida por los padres.
Infecciones recurrentes e inmunodeficiencias primarias (IP)
Las infecciones de las IP se acompañan casi siempre de otras manifestaciones clínicas debidas a la afectación de varios órganos y sistemas.
Las IP son el paradigma de las enfermedades que cursan con infecciones recurrentes y se deberían sospechar siempre que existan algunos de los signos de alarma (Tabla III)(4,13). Son poco frecuentes (su incidencia oscila entre 1/10.000 y 1/100.000 nacidos vivos, con la excepción de la deficiencia aislada de IgA que oscila entre 1/200 y 1/1.000 y que casi siempre es asintomática), de origen genético y, con frecuencia, hereditarias, que afectan al sistema inmune.
En la aproximación diagnóstica a las IP, el tipo de infecciones que sufre el niño orienta hacia el componente del sistema inmune que está afectado: inmunidad adaptativa (inmunidad humoral o de células B e inmunidad celular o de células T) e inmunidad innata (fagocitosis, complemento y receptores que reconocen los patrones moleculares asociados a patógenos o PAMPs)(4,13).
Las deficiencias graves de células T cursan con infecciones víricas recurrentes e infecciones oportunistas por hongos y protozoos(4,13). Desde los primeros meses de vida (en las mutaciones “leaky”, en las que la función del gen afectado no se anula totalmente, puede haber retraso del inicio), el lactante presenta: diarrea crónica intratable o recurrente e infecciones por microorganismos oportunistas como virus (citomegalovirus, Epstein-Barr, adenovirus, influenza, norovirus y otros), hongos (candidiasis oral persistente o recurrente, neumonía por Aspergillus sp) y protozoos (diarrea por Criptosporidium, neumonía por Pneumocystis jirovecii). Es necesario tener en cuenta que las verrugas y el molusco contagioso son infecciones víricas, por lo que su persistencia y extensión orientan a inmunodeficiencia de células T. El norovirus causa infección gastrointestinal persistente y es casi imposible de erradicar en los niños con inmunodeficiencia combinada grave(14).
Las deficiencias de células B(4,13,15), como las agamma o hipogammaglobulinemias congénitas, la inmunodeficiencia variable común y la deficiencia específica de anticuerpos, se caracterizan por infecciones sino-pulmonares recurrentes por bacterias capsuladas (neumococo, Haemophilus. influenzae tipo b, Staphylococcus aureus) que, progresivamente, producen destrucción pulmonar y bronquiectasias. Son también características: la sepsis por Pseudomonas aeruginosa, las infecciones intestinales por Campylobacter jejuni y por Giardia intestinalis y la infección diseminada por enterovirus. Característicamente, en las agammaglobulinemias congénitas, los síntomas no suelen aparecer hasta los 4-5 meses de vida, cuando el niño pierde la protección de los anticuerpos maternos.
Los pacientes con enfermedad granulomatosa crónica (EGC), un trastorno del sistema NADPH oxidasa de los fagocitos que les impide generar radicales libres necesarios para la digestión intracelular(13,16), se caracterizan por sufrir infecciones recurrentes por microorganismos catalasas positivos, como son: Staphylococcus aureus, Aspergillus sp, Salmonella sp, Candida spp, Serratia spp, Klebsiella sp, Pseudomonas sp, M. tuberculosis, micobacterias atípicas, Burkholderia cepacia, Nocardia sp, Granulobacter bethesdensis y otros. Los cuadros clínicos más frecuentes son: neumonía, adenitis y abscesos cutáneos, abscesos hepáticos, osteomielitis y sepsis. También aparecen manifestaciones de hiperinflamación y autoinmunidad (aftas orales, enfermedad inflamatoria intestinal de comienzo precoz). Es característica la presencia de granulomas, que pueden afectar a varios órganos, dando lugar a síntomas obstructivos(16).
En el síndrome de hiper-IgE, autosómico dominante, hay abscesos y neumonías (con mucha frecuencia cavitadas). Las bacterias implicadas con más frecuencia son: S. aureus, Haemophilus influenzae tipo b, neumococo, Streptococcus pyogenes, P. aeruginosa y otros(4).
Las deficiencias de los factores tardíos del complemento (C5 en adelante) cursan con infecciones recurrentes por Neisseria, mientras que la deficiencia de C3 cursa con infecciones sinopulmonares por bacterias capsuladas y cuadros autoinmunes parecidos al lupus eritematoso sistémico(4,13).
Como quiera que el sistema inmune reside en todos los órganos o sistemas, es frecuente que en las IP, además de las infecciones, aparezcan otros síntomas o signos, como: anomalías faciales, alteraciones cutáneas o del pelo (albinismo, alopecia, vitíligo, manchas hipercrómicas, petequias, telangiectasias, alopecia), malformaciones óseas, úlceras orales (deficiencia de células T y EGC), alteraciones dentarias y otras. En las deficiencias graves de células T y en los síndromes de Omenn, Wiskott-Aldrich e hiper-IgE (formas dominantes por mutaciones en STAT3 o recesivas por deficiencia de DOCK8) es bastante común la afectación cutánea (dermatitis, eczema y eritrodermia generalizada)(17,18). Aunque pueden ser similares a la dermatitis atópica, los exantemas de las IP aparecen, a diferencia de aquella, desde los primeros días después del nacimiento.
Además de la función defensiva frente a las infecciones, la inmunidad celular se ocupa de la modulación de la inflamación y de la regulación que controla su propia activación. A ello se debe, aunque parezca paradójico, que muchas IP, especialmente las deficiencias de células T y la inmunodeficiencia variable común, cursen con aumento de inflamación y fenómenos autoinmunes, como: anemia hemolítica, trombopenia, neutropenia, enfermedad intestinal inflamatoria crónica, vasculitis, artritis, aftas orales o rectales, alopecia, vitíligo y endocrinopatías autoinmunes(19,20). Es más, en algunas ocasiones, estas manifestaciones autoinmunes aparecen antes o son más prominentes que las propias infecciones.
Evaluación inicial del niño con sospecha de IP
La historia clínica y la exploración física detalladas permiten una primera aproximación diagnóstica a las inmunodeficiencias primarias.
La historia clínica(4) debe recoger: el inicio de las manifestaciones clínicas; el tipo, frecuencia y localización de las infecciones; la repercusión de las mismas en el estado general del paciente; la historia perinatal, incluido el momento de la caída del cordón umbilical (su persistencia más allá de un mes después de nacer, se asocia a defectos de moléculas de adhesión linfocitarias); la existencia de sangrado (síndrome de Wiskott-Aldrich) e hipocalcemia (anomalía de DiGeorge); y la presencia de dermatitis, exantemas persistentes y manifestaciones autoinmunes. Es primordial, recoger la historia de vacunaciones del niño. Hay que buscar la existencia de diarrea crónica o candidiasis oral persistente.
La historia familiar (consanguinidad, muertes familiares en la infancia, fenómenos autoinmunes), además de ayudar al diagnóstico, permite formular un consejo genético, aunque hasta en la mitad de las IP no se encuentran antecedentes familiares.
Pruebas de laboratorio en las IP
Una vez sospechada una IP, el niño debería ser enviado rápidamente al especialista, que deberá determinar qué pruebas diagnósticas debe utilizar(4). Sin embargo, un panel de screening que incluya algunas pruebas de laboratorio fáciles de realizar, ayuda a acelerar el diagnóstico.
• El hemograma. Un hallazgo que debería siempre hacerse plantear una inmunodeficiencia grave de células T, es un conteo de linfocitos totales <2.500/mm3 en niños menores de 5 años o <1.500 en niños mayores de esta edad. Por otra parte, en varias IP aparecen citopenias inmunes, que ayudan a su diagnóstico. En el síndrome de Wiskot-Aldrich (WAS) hay trombocitopenia con plaquetas que tienen un volumen plaquetario disminuido. También en la inmunodeficiencia variable, la trombopenia es muy frecuente, precediendo, a veces durante varios años, la aparición de otras manifestaciones clínicas. La granulocitopenia es característica de la agranulocitosis congénita y otras neutropenias. Por último, la eosinofilia aparece en algunas IP, como el síndrome de Omenn y los síndromes de hiper-IgE.
• Poblaciones y subpoblaciones linfocitarias por citometría de flujo. Linfocitos totales (CD3+) T helper (CD4+) y T citotóxicos/supresores (CD8+) y linfocitos B (CD19+, CD20+ CD21+).
• Cuantificación de inmunoglobulinas (IgG, IgA e IgM), isohemaglutininas y respuesta de anticuerpos a vacunas proteicas (difteria, tétanos, hepatitis A o B) o de polisacáridos (vacuna neumocócica de polisacáridos puros).
• Analítica general, con parámetros de función hepática y renal, albúmina y proteínas totales.
• Radiografía lateral de cavum para visualizar las adenoides.
• Radiografía del tórax para ver la sombra tímica (ausencia en las deficiencias de cálulas T).
Prevención y manejo de las infecciones recurrentes
En los niños con infecciones respiratorias recurrentes, son fundamentales el tratamiento precoz y la prevención mediante la vacunación neumocócica y la vacunación antigripal anual.
Independientemente de las medidas preventivas específicas y del tratamiento indicado para cada una de las enfermedades que cursan con infecciones recurrentes, en todos estos pacientes se recomienda:
• Evitación del tabaquismo activo o pasivo y de ambientes contaminados.
• Es primordial el tratamiento precoz de las infecciones y exacerbaciones con el antibiótico adecuado, según la infección y enfermedad del paciente, para evitar el daño pulmonar irreversible.
• Cuando exista destrucción pulmonar y bronquiectasias, se recomiendan medidas de aclaramiento de la vía aérea, como drenaje postural, y fisioterapia respiratoria. También es muy aconsejable el ejercicio físico regular, que incrementa la salud y la calidad de vida de los pacientes.
• La vacunación frente a neumococo debe realizarse con las vacunas neumocócicas de valencia ampliada, 15-valente o 20-valente (incluso aunque hayan recibido la vacuna neumocócica conjugada 13-valente).
• Se recomienda la vacunación anual frente a la gripe, teniendo en cuenta que los niños con IP deben recibir la vacuna inactivada (la intranasal viva atenuada de la gripe está contraindicada).
• Las vacunas vivas de virus (triple vírica, varicela, herpes zóster, rotavirus, gripe intranasal) están contraindicadas, siempre que existan deficiencias de células T; mientras que, en los defectos del sistema mononuclear fagocítico y en la predisposición mendeliana a la infección por micobacterias, están contraindicadas las vacunas bacterianas vivas (tifoidea oral y BCG). La vacuna oral frente a la polio está contraindicada en las agammaglobulinemias congénitas.
• Más allá de la profilaxis con trimetoprim-sulfametoxazol y con itraconazol en los niños con enfermedad granulomatosa crónica y en inmunodeficiencias graves de células T, no hay evidencia de la utilidad de la profilaxis antibiótica oral en las enfermedades que cursan con infecciones sinopulmonares recurrentes. Por lo tanto, la decisión debería ser individualizada en cada paciente, dado que además puede contribuir a la selección de resistencias bacterianas.
Función del pediatra en Atención Primaria
La función del pediatra de Atención Primaria en las infecciones de repetición del niño consiste en diferenciar las infecciones de repetición de vías altas de causa ambiental, que ocurren de los 6 meses a los 4-5 años de edad, de las infecciones recurrentes que se deben a una causa sistémica. Estas últimas deberían ser enviadas a un centro hospitalario en el que se disponga de los medios diagnósticos y terapéuticos adecuados. En el caso de algunas inmunodeficiencias primarias, es necesario establecer medidas preventivas urgentes para evitar infecciones que pueden comprometer la vida del paciente.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio del autor.
1.** Marengo R, Ortega Martell JA, Esposito S. Paediatric Recurrent Ear, Nose and Throat Infections and Complications: Can We Do More? Infect Dis Ther. 2020; 9: 275-90.
2.** Grüber C, Keil T, Kulig M, Roll S, Wahn U, Wahn V, et al. History of respiratory infections in the first 12 yr among children from a birth cohort. Pediatr Allergy Immunol. 2008; 19: 505-12.
3.*** Bush A. Recurrent Respiratory Infections. Pediatr Clin North Am. 2009; 56: 67-100.
4.*** Huwyler C, Lin SY, Liang J. Primary Immunodeficiency and Rhinosinusitis. Immunol Allergy Clin North Am. 2020; 40: 233-49. Disponible en: https://doi.org/10.1016/j.iac.2019.12.003.
5.** Dan JM, Havenar-Daughton C, Kendric K, Al-Kolla R, Kaushik K, Rosales SL, et al. Recurrent group a streptococcus tonsillitis is an immunosusceptibility disease involving antibody deficiency and aberrant T FH cells. Sci Transl Med. 2019; 11: 1-28.
6.** Hausmann J, Dedeoglu F, Broderick L. Periodic Fever, Aphthous Stomatitis, Pharyngitis, and Adenitis Syndrome and Syndrome of Unexplained Recurrent Fevers in Children and Adults. J Allergy Clin Immunol Pract. 2023; S2213-2198: 00298-2. Disponible en: https://doi.org/10.1016/j.jaip.2023.03.014.
7.** Planet PJ. Adaptation and Evolution of Pathogens in the Cystic Fibrosis Lung. J Pediatric Infect Dis Soc. 2022; 11: S23-31.
8.** Malhotra S, Hayes D, Wozniak DJ. Cystic fibrosis and pseudomonas aeruginosa: The host-microbe interface. Clin Microbiol Rev. 2019; 32: e00138-18.
9.** Mirra V, Werner C, Santamaria F. Primary ciliary dyskinesia: An update on clinical aspects, genetics, diagnosis, and future treatment strategies. Front Pediatr. 2017; 5: 1-13.
10.** Pereira R, Barbosa T, Cardoso AL, Sá R, Sousa M. Cystic fibrosis and primary ciliary dyskinesia: Similarities and differences. Respir Med. 2023; 209: 107169. Disponible en: https://doi.org/10.1016/j.rmed.2023.107169.
11.** Kiedrowski MR, Bomberger JM. Viral-Bacterial Co-infections in the Cystic Fibrosis Respiratory Tract. Front Immunol. 2018; 9: 1-12.
12.** Wijers CDM, Chmiel JF, Gaston BM. Bacterial infections in patients with primary ciliary dyskinesia: Comparison with cystic fibrosis. Chron Respir Dis. 2017; 14: 392-406.
13.*** McCusker C, Upton J, Warrington R. Primary immunodeficiency. Allergy, Asthma Clin Immunol. 2018; 61: 14. https://doi.org/10.1186/s13223-018-0290-5.
14.** Ruffner MA, Sullivan KE, Henrickson SE. Recurrent and sustained viral infections in primary immunodeficiencies. Front Immunol. 2017; 8: 1-13.
15.*** El-Bohy M, Poowuttikul P, Secord E. Humoral Immune Deficiencies of Childhood. Immunol Allergy Clin North Am. 2021; 41: 527-33. Disponible en: https://doi.org/10.1016/j.iac.2021.07.004.
16.** Rider NL, Jameson MB, Creech CB. Chronic granulomatous disease: Epidemiology, pathophysiology, and genetic basis of disease. J Pediatric Infect Dis Soc. 2018; 7: S2-5.
17.*** Hoskins S, Skoda-Smith S, Torgerson TR, Boos MD. Eczematous dermatitis in primary immunodeficiencies: A review of cutaneous clues to diagnosis. Clin Immunol. 2020; 211: 108330. Disponible en: https://doi.org/10.1016/j.clim.2019.108330.
18.** Lehman H, Gordon C. The Skin as a Window into Primary Immune Deficiency Diseases: Atopic Dermatitis and Chronic Mucocutaneous Candidiasis. J Allergy Clin Immunol Pract. 2019; 7: 788-98. Disponible en: https://doi.org/10.1016/j.jaip.2018.11.026.
19.** Padron GT, Hernández-Trujillo VP. Autoimmunity in Primary Immunodeficiencies (PID). Clin Rev Allergy Immunol. 2022. Disponible en: https://doi.org/10.1007/s12016-022-08942-0.
20.*** Costagliola G, Peroni DG, Consolini R. Beyond Infections: New Warning Signs for Inborn Errors of Immunity in Children. Front Pediatr. 2022; 10: 1-8.
Bibliografía recomendada
– Bush A. Recurrent Respiratory Infections. Pediatr Clin North Am. 2009; 56: 67-100.
Es una revisión general del tema de las infecciones recurrentes respiratorias. Su lectura proporciona una información general de rinosinusitis, otitis y faringitis recurrentes, y sobre las infecciones de vías respiratorias bajas. Especialmente interesante es el cuadro donde aparecen las causas de las infecciones de repetición, que ocurren siempre en el mismo sitio. Finalmente, ofrece un enfoque general del problema, que es instructivo y útil.
– Huwyler C, Lin SY, Liang J. Primary Immunodeficiency and Rhinosinusitis. Immunol Allergy Clin North Am. 2020; 40: 233-49. Disponible en: https://doi.org/10.1016/j.iac.2019.12.003.
El título de este artículo es engañoso, porque más allá de tratar de la sinusitis y las inmunodeficiencias primarias, es una excelente revisión sobre estas infrecuentes enfermedades. Se recogen las diferentes formas con sus manifestaciones clínicas y se expone cuál debería ser el enfoque diagnóstico de las mismas. Todo ello apoyado con excelentes cuadros y tablas.
– McCusker C, Upton J, Warrington R. Primary immunodeficiency. Allergy, Asthma Clin Immunol. 2018; 61: 14. https://doi.org/10.1186/s13223-018-0290-5.
Este artículo ofrece también una excelente revisión sobre las IP, incluidos la clínica, fenotipo, diagnóstico y tratamiento, este último aspecto muy pormenorizado.
– El-Bohy M, Poowuttikul P, Secord E. Humoral Immune Deficiencies of Childhood. Immunol Allergy Clin North Am. 2021; 41: 527-33. Disponible en: https://doi.org/10.1016/j.iac.2021.07.004.
Mediante la presentación de 3 casos clínicos, los autores presentan una excelente revisión de las inmunodeficiencias humorales, con respecto al diagnóstico y tratamiento, siempre reflejando la situación de la vida real. La mejor manera de aprender sobre este tema de una manera eficaz y entretenida.
– Hoskins S, Skoda-Smith S, Torgerson TR, Boos MD. Eczematous dermatitis in primary immunodeficiencies: A review of cutaneous clues to diagnosis. Clin Immunol. 2020; 211: 108330. Disponible en: https://doi.org/10.1016/j.clim.2019.108330.
En este artículo, se hace hincapié en la importancia de las manifestaciones de dermatitis en los pacientes con inmunodeficiencias primarias, sobre todo de células T, y las características que las hacen diferentes de la dermatitis atópica. La descripción clínica se apoya en algunas fotografías que son ilustrativas. En definitiva, el artículo nos recuerda que el diagnóstico más probable en una enfermedad que cursa con infecciones recurrentes y dermatitis sea una inmunodeficiencia primaria.
– Costagliola G, Peroni DG, Consolini R. Beyond Infections: New Warning Signs for Inborn Errors of Immunity in Children. Front Pediatr. 2022; 10: 1-8.
Ya el título de este artículo nos recuerda que, además de las infecciones, hay otros signos y síntomas que deberían despertar la sospecha de inmunodeficiencias primarias. Describe cómo en estas enfermedades coexisten infecciones y manifestaciones autoinmunes. Va recorriendo estas últimas, señalando a qué trastornos del sistema inmune se asocian, y las pruebas de laboratorio necesarias para su diagnóstico.
| Caso clínico |
|
Lactante varón de 6 meses de edad, que ingresa porque, desde hace alrededor de 4 semanas, tiene: fiebre intermitente (no ha superado en ningún momento los 38,6ºC), tos cianosante, que ha ido aumentando progresivamente y, durante la última semana, dificultad respiratoria. Exploración física: temperatura: 37,8ºC; frecuencia cardiaca: 140 latidos/minuto; saturación de O2 respirando aire ambiente: 91 %. Afectación moderada del estado general con movimientos activos. Peso: 5,8 kg (percentil 10); talla: 66 cm (percentil 43); perímetro cefálico: 41 cm (50). Exantema de pequeños elementos pápulo-eritematosos, de 1-2 mm de diámetro, generalizado por tronco, extremidades y mejillas, más acentuado en pliegues inguinales. Discreta palidez de mucosas. Bien hidratado. Dificultad respiratoria con 50-60 respiraciones por minuto con tiraje subcostal leve. Auscultación cardiaca: normal, salvo discreta taquicardia. Auscultación pulmonar: estertores inspiratorios y espiratorios diseminados; algunas sibilancias espiratorias aisladas. El resto de la exploración física es normal. Antecedentes familiares: no se encuentra nada de interés. Ambos padres sanos. Una hermana de 4 años sana, actualmente acatarrada. Antecedentes personales: embarazo normal; parto normal, a término; peso al nacimiento: 3.230 g; talla: 49 cm; perímetro cefálico: 34,5 cm. Periodo neonatal: eliminación de meconio en las primeras 24 horas de vida. Caída del cordón a los 5 días. A las 3 semanas de vida, fue diagnosticado de dermatitis atópica, que ha sido tratada con hidratación de piel e hidrocortisona tópica, con escasa mejoría. Alimentado con lactancia materna (hace las tomas con poca avidez). Ha recibido todas las vacunas del calendario sin complicaciones. Varios catarros, coincidiendo con cuadros similares en su hermana de 4 años. Analítica: hemograma: leucocitos: 11.308 /mm3 (82 % neutrófilos, 10 % linfocitos, 6 % monocitos); Hb: 8,9 g/dl; plaquetas: 486.167 mm3. Detección de VRS en aspirado nasofaríngeo: negativo. PCR múltiple para virus respiratorios: se detecta gripe A. Cuantificación de inmunoglobulinas: IgG: 33 mg/dl; IgM: 28 mg/dl; IgA: 6,67 m. En la radiografía de tórax, se aprecian infiltrados sugerentes de neumonía intersticial, que se confirma con TAC. Lavado broncoalveolar: se demuestra gripe A por PCR y cultivo. Citomegalovirus negativo. Pneumocystis jirovecii: negativo. Se diagnostica al paciente de neumonía por gripe A.
|




 Fever of unknown origin
Fever of unknown origin