 |
| Temas de FC |
R. Bazire Batiz*, C. Morales Cabeza**
*Servicio de Alergia. Hospital Infantil Universitario Niño Jesús. Madrid. **Servicio de Alergia. Hospital Universitario Puerta de Hierro. Majadahonda. Madrid
| Resumen
El exceso de diagnóstico no confirmado de hipersensibilidad a fármacos constituye un problema relevante en la práctica clínica, por la limitación terapéutica que implica para los pacientes. Los médicos de Atención Primaria son, a menudo, el primer punto de contacto para los niños que sufren reacciones, por lo que es importante saber evaluarlas, tratarlas, y derivar a los pacientes que requieran un estudio alergológico. |
| Abstract
The excess of unconfirmed drug hypersensitivity diagnoses is a significant clinical problem because of patient therapeutic compromise. Primary care physicians are often the first point of contact for children with drug adverse reactions, so it is important that they are able to assess and manage these patients and refer those who require |
Palabras clave: Reacciones adversas a fármaco; Hipersensibilidad a fármaco; Niño.
Key words: Adverse drug reactions; Drug allergy; Children.
Pediatr Integral 2023; XXVII (3): 162 – 172
OBJETIVOS
• Saber distinguir una reacción de hipersensibilidad del resto de reacciones adversas a medicamentos.
• Conocer los puntos claves de la historia clínica de una reacción de hipersensibilidad a medicamentos.
• Conocer los signos y síntomas de gravedad de una reacción de hipersensibilidad a medicamentos.
• Conocer las recomendaciones a dar a un paciente con sospecha de reacción de hipersensibilidad.
• Determinar cuándo derivar un paciente a atención especializada para realizar un estudio alergológico.
Alergia a medicamentos y drogas
Introducción
Las reacciones adversas a medicamentos (RAM) tipo A son aquellas reacciones previsibles y relacionadas con los efectos farmacológicos conocidos del propio fármaco. Las RAM tipo B son menos frecuentes y se deben a una respuesta anómala en individuos predispuestos. Las reacciones de hipersensibilidad se incluyen dentro de las reacciones tipo B.
La Organización Mundial de la Salud (OMS) define una reacción adversa a medicamento (RAM) como: una respuesta nociva, no deseada y no intencionada que se produce tras la ingesta de un fármaco a dosis utilizadas habitualmente en la especie humana para prevenir, diagnosticar o tratar una enfermedad; así como las respuestas derivadas de la dependencia, abuso y uso incorrecto de los medicamentos(1). Las RAM son un problema grave, con una incidencia en aumento a medida que se comercializan más medicamentos y se exponen más personas a ellos (Tabla I).
Las RAM tipo A (más frecuentes) no son mediadas por mecanismos inmunológicos, sino que son previsibles y relacionadas con los efectos farmacológicos ya conocidos del propio fármaco(1,2). Estas reacciones pueden aparecer en cualquier persona tratada y, por lo general, son leves.
Las RAM tipo B son menos frecuentes, no son previsibles y tampoco se relacionan con la dosis o efecto farmacológico, ya que se deben a respuestas anómalas que ocurren generalmente en una pequeña parte de la población susceptible de presentarlas(1,3). Dentro de este grupo de reacciones se encuentran las reacciones por idiosincrasia, de intolerancia y de hipersensibilidad a fármacos. Se reserva el término de reacción alérgica a aquellas reacciones de hipersensibilidad mediadas inmunológicamente(4).
Clasificación de las reacciones alérgicas a fármacos
Las RAM se pueden clasificar según el momento de aparición de los síntomas, en inmediatas o tardías. Según el mecanismo fisiopatológico se diferencian en reacciones de hipersensibilidad: tipo I (inmediatas, mediadas o no por IgE), tipo II (retardadas, mediante lisis celular o citotóxicas); tipo III (retardadas, mediante depósito de inmunocomplejos o activación de complemento); o tipo IV (retardadas, mediadas por linfocitos T activados o celular) (Tabla II).
La clasificación de las RAM es compleja, porque hay múltiples fármacos implicados y muchas presentaciones clínicas diferentes. Además, los mecanismos inmunológicos de algunas reacciones no están totalmente definidos y las clasificaciones tradicionales, basadas en la cronología entre la administración del fármaco y el inicio del desarrollo de síntomas, presentan dificultades.
Según el momento de aparición de los síntomas, se consideran reacciones de inicio temprano, mediadas por IgE, a aquellas que ocurren entre 1 y 6 horas después de la administración del fármaco, y reacciones de inicio tardío a aquellas que ocurren a partir de las 6 horas de la toma del fármaco(5).
Las reacciones de hipersensibilidad se dividen en cuatro tipos según la clasificación de Gell y Coombs, que se basa en los mecanismos fisiopatológicos subyacentes de cada reacción. Esto resulta fundamental para determinar los procedimientos diagnósticos relevantes, las opciones terapéuticas adecuadas así como para evaluar la reactividad cruzada entre medicamentos similares(2) (Tabla II).
• Tipo I: reacciones inmediatas (mediadas por IgE o no mediadas por IgE). En los últimos años se incluyen en este tipo, reacciones por liberación o activación no específica de mastocitos, aunque las cuales resultan clínicamente indistinguibles de una reacción mediada por IgE.
• Tipo II: reacciones retardadas, mediante lisis celular o citotóxicas, mediadas por anticuerpos (generalmente IgG y menos frecuentes IgM).
• Tipo III: reacciones retardadas por depósito de inmunocomplejos y activación de complemento.
• Tipo IV: reacciones retardadas, mediadas por linfocitos T activados, aunque también pueden incluir a otros tipos de células como: macrófagos, eosinófilos o neutrófilos. Las células T son capaces de generar diferentes tipos de respuesta inflamatoria, según las citocinas producidas y las otras células implicadas en la reacción; por lo que, a su vez, las reacciones de tipo IV se subdividen en 4 subtipos (IVa, IVb, IVc y IVd).
Epidemiología
La alergia a fármacos en la infancia es un problema sociosanitario cada vez mayor. Aunque es probable una sobreestimación de la epidemiología de RH a fármacos, pocas veces se confirma el diagnóstico tras el estudio alergológico.
La presencia de una alergia a fármacos en los niños supone un importante problema sociosanitario, debido a la angustia que esto puede producir en los niños, en los padres y en los propios médicos que los atienden. La ausencia de un diagnóstico correcto conlleva que algunos pacientes sean indebidamente clasificados como alérgicos a fármacos durante un tiempo indeterminado, repercutiendo en el uso de alternativas terapéuticas de segundo o tercera elección, con mayor coste sanitario asociado, así como el riesgo de desarrollar resistencias antibióticas(1,5). Muchos padres además intentan evitar la toma de algunos fármacos por antecedentes familiares de alergia a fármacos(6). La epidemiología de las RH a fármacos es globalmente poco conocida, especialmente en niños, pero puede estar sobreestimada, ya que aproximadamente el 10 % de los padres refieren, al menos, una RH a fármacos en sus hijos(7). Sin embargo, tras la realización de un estudio alergológico completo, el diagnóstico
de RH por fármacos se confirma solo en pocas ocasiones(8).
La frecuencia de las RH varía en función de la población estudiada, su edad, patrones de consumo, criterios diagnósticos y el tiempo transcurrido hasta la realización del estudio. A pesar de que cualquier fármaco puede inducir una RH, en la población pediátrica, los antibióticos, especialmente los del grupo de betalactámicos (BL), los antiinflamatorios no esteroideos (AINE) y las vacunas son los fármacos más frecuentemente implicados(2,8).
Afortunadamente, las reacciones adversas cutáneas graves son muy poco frecuentes en niños, habiendo pocas series publicadas en la literatura. Por lo general, en estas reacciones, los fármacos más frecuentes son los antibióticos BL, AINE y fármacos antiepilépticos.
Factores de riesgo
El riesgo de presentar una RH por fármacos aumenta con el uso de fármacos y la automedicación(8). En general, se considera que las RH son más frecuentes en niños diagnosticados de fibrosis quística, lo que podría explicarse por los mayores niveles de exposición a fármacos, el uso frecuente de tratamientos intravenosos y las respuestas inmunitarias específicas relacionadas con la propia enfermedad(9).
A pesar de que el género femenino se considera un factor de riesgo de presentar RH, este dato no ha podido ser documentado en la población pediátrica(8).
Las infecciones son muy frecuentes en los niños, sobre todo, las infecciones virales, y constituyen un factor de riesgo, así como un diagnóstico diferencial de las RH por fármacos. También pueden actuar como cofactores en algunos individuos susceptibles. Las aminopenicilinas pueden inducir un exantema, especialmente en niños con infección por el virus de Epstein-Barr (VEB)(8). Otros virus que constituyen factores de riesgo son el virus de la inmunodeficiencia humana (VIH) y el citomegalovirus (CMV).
La presencia de asma alérgica y la urticaria crónica son factores de riesgo significativos para las reacciones a AINE en niños.
Manifestaciones clínicas
Los síntomas más frecuentes en las reacciones adversas a fármacos en población infantil son el exantema maculopapular (EMP) no inmediato y la urticaria no inmediata. El diagnóstico diferencial fundamentalmente hay que hacerlo con el exantema infeccioso.
Reacciones inmediatas
Pueden variar según su gravedad, desde reacciones leves a reacciones graves o muy graves, incluyendo anafilaxia y shock anafiláctico.
La piel es el órgano que se afecta con más frecuencia en forma de urticaria o EMP, con o sin angioedema asociado.
La afectación respiratoria (esencialmente broncoespasmo) como única manifestación clínica es poco frecuente, limitándose casi exclusivamente a reacciones causadas por AINE (sobre todo en niños con diagnóstico previo de asma) o, más frecuentemente, como un síntoma asociado de una reacción anafiláctica(2,8,10).
Cualquier reacción mediada por IgE puede poner en riesgo la vida del paciente, ya que se puede desencadenar con pequeñas dosis del fármaco. La frecuencia de anafilaxia, aunque se considera baja, parece haberse incrementado en los últimos años, situándose entre el 5-25 % según las diferentes series publicadas en la literatura(11).
Reacciones no inmediatas
Pueden ocurrir incluso días después de haber finalizado el tratamiento con el fármaco implicado. Al igual que en las reacciones inmediatas, la piel es el órgano afectado con más frecuencia, siendo el EMP y la urticaria no inmediata las manifestaciones clínicas más frecuentes(12,13).
La afectación respiratoria, como la neumonitis inducida por fármacos, es excepcional en niños, observándose, sobre todo en relación con el uso de quimioterápicos.
Las reacciones adversas cutáneas graves (Severe Cutaneous Adverse Reactions o SCAR) son poco frecuentes en niños. Entre ellas se han descrito casos de: pustulosis exantemática aguda generalizada (PEAG: inicio agudo con aparición de pústulas <5 mm estériles y no foliculares sobre una base eritematosa); reacción de hipersensibilidad sistémica por fármacos (Drug Reaction with Systemic Symptoms o DRESS: exantema con síntomas sistémicos como: fiebre, adenopatías, eosinofilia y afectación orgánica, fundamentalmente hepática); síndrome de Stevens-Johnson (SJS: lesiones dianiformes con vesículas y ampollas asociadas a afectación de mucosas, alteración del estado general y fiebre); y necrólisis epidérmica tóxica (NET: similar al SJS con mayor afectación y despegamiento cutáneo). Los fármacos más implicados en estas reacciones son los antibióticos (BL, sulfamidas fundamentalmente), AINE y anticonvulsivantes(2).
La enfermedad del suero cursa habitualmente con síntomas cutáneos como el EMP o urticaria, con afectación sistémica como fiebre, artritis o artralgias, que habitualmente aparecen de 1-3 semanas después de la exposición al fármaco. Su fisiopatología es desconocida. Es poco frecuente, suele afectar a niños menores de 5 años y los betalactámicos (BL), especialmente el cefaclor, penicilina V y amoxicilina, son los fármacos más frecuentemente involucrados(10).
En los últimos años, se han descrito en la literatura pocos casos en pacientes pediátricos que presentan exclusivamente síntomas gastrointestinales, como náuseas, vómitos y/o diarrea, asociados a decaimiento, aproximadamente 2-4 horas tras la toma del fármaco causal y que simulan los síntomas producidos por enterocolitis inducida por alimentos (FPIES)(14). En los casos más graves puede existir hipotensión, letargia o hipotermia, que pueden llegar a producir un shock hipovolémico. Los fármacos implicados en niños se limitan hasta la fecha a amoxicilina y amoxicilina-ácido clavulánico(14).
Principales medicamentos causales de reacciones alérgicas en niños: antibióticos betalactámicos y AINE
Los antiinflamatorios no esteroideos (AINE), junto con los antibióticos betalactámicos son las dos primeras causas de reacciones de hipersensibilidad a fármacos en niños.
Antibióticos betalactámicos
La sospecha de reacción por antibióticos betalactámicos constituye aproximadamente el 80 % de las consultas por alergia a medicamentos y, junto con los AINE, son la causa más frecuente de reacciones alérgicas a fármacos en niños.
De ellos, las aminopenicilinas y, en concreto, la amoxicilina, ocupan el primer lugar, favorecido por la amplia y extensa prescripción de este antibiótico en la actualidad.
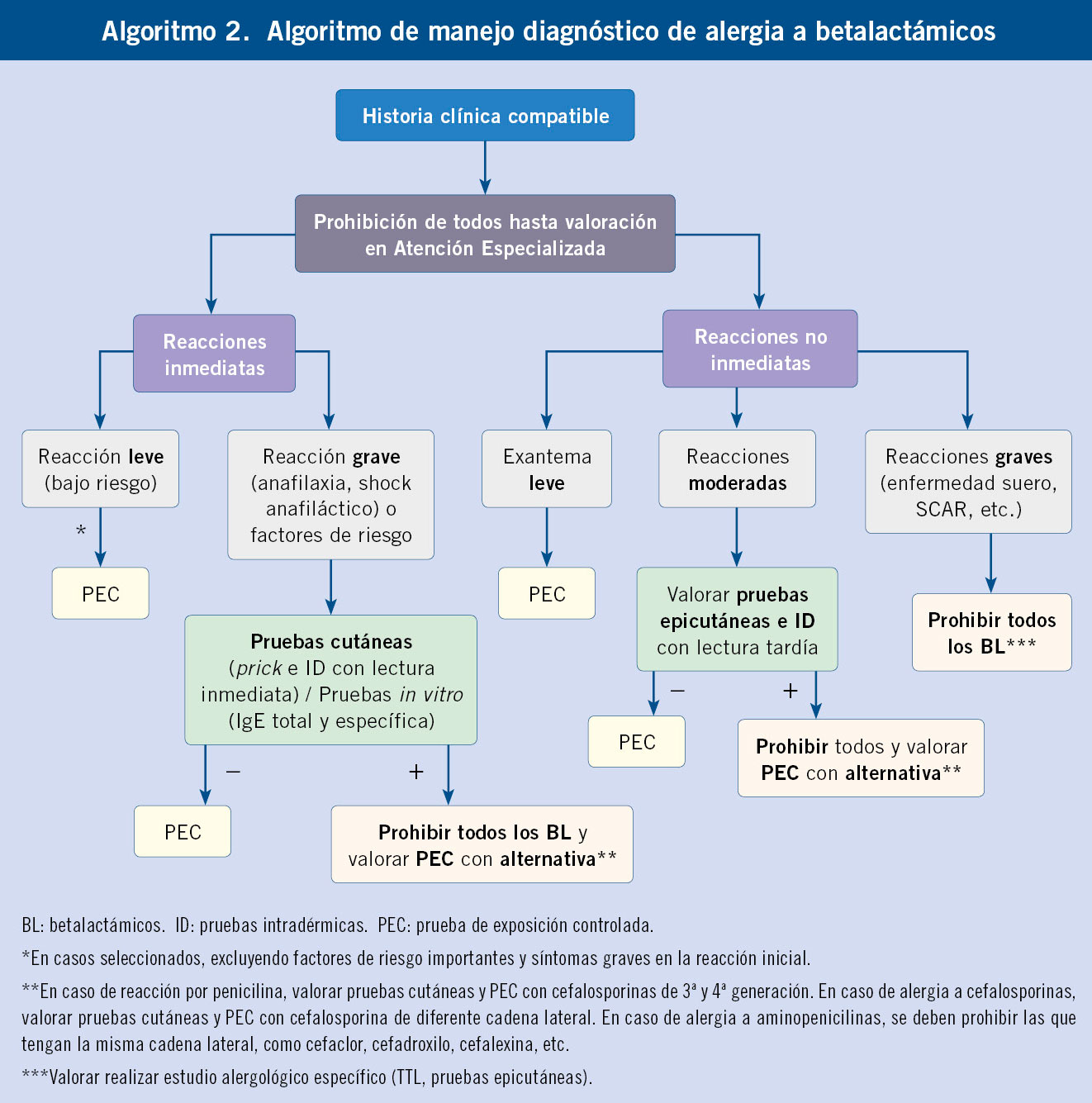
Los betalactámicos contienen un anillo tiazolidínico común y una cadena lateral que es la responsable de las diferencias entre cada grupo. Los anticuerpos IgE frente a las penicilinas pueden ser específicos frente al propio anillo betalactámico (común en todos los BL) o bien específico de cadena lateral, produciéndose en este caso reacciones selectivas. Sin embargo, hay que tener en consideración que BL de diferentes grupos pueden tener cadenas laterales idénticas (reactividad cruzada). Actualmente, lo más frecuente es la alergia selectiva a la cadena lateral sin presentar reacción con penicilina(15). Sin embargo, si la alergia está producida por el determinante mayor de la penicilina, el diagnóstico será probablemente de alergia a todas las penicilinas.
Existen pocos estudios que analicen la reactividad cruzada entre penicilinas y cefalosporinas en niños, pero se ha estimado en un 0,3-23,9 %, siendo mayor para cefalosporinas con la misma cadena lateral(16).
Antiinflamatorios no esteroideos (AINE)
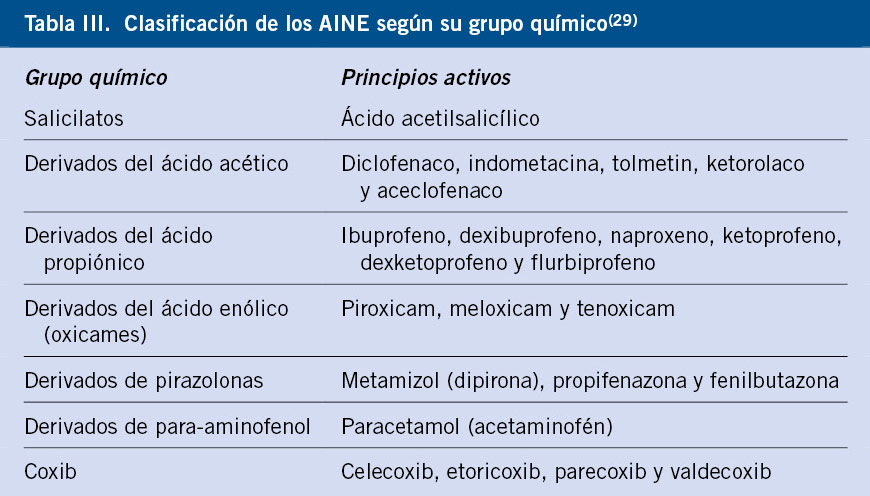
Los AINE componen un grupo de fármacos heterogéneo, empleados por su acción antiinflamatoria, antipirética, analgésica y antiagregante. Actúan mediante la inhibición de la ciclooxigenasa (COX), enzima que cataliza la conversión del ácido araquidónico en prostaglandinas. Se pueden clasificar según su composición química o según su capacidad para inhibir la COX (Tabla III).
Se distinguen dos grandes grupos de RH: los selectivos (mediados inmunológicamente, que suelen involucrar a un solo grupo de AINE) y los no selectivos o por intolerancia cruzada (más frecuente y que suele involucrar a varios grupos de AINE por la relación con la inhibición de COX-1).
Los niños menores de 10 años presentan en su mayoría reacciones por reactividad cruzada, con la presencia de cofactores, como pueden ser las infecciones víricas o el ejercicio(17).
Diagnóstico
El diagnóstico de alergia a medicamentos se basa en una minuciosa historia clínica y el estudio alergológico mediante: pruebas cutáneas, in vitro (IgE específica, test de activación de basófilos y test de transformación linfocítica) y prueba de exposición controlada (PEC) que constituye la prueba de referencia. No está indicado el estudio alergológico como screening sin reacción previa. Idealmente, se realizará el estudio alergológico 1-6 meses tras la recuperación total de la reacción inicial, ya que más adelante, el estudio pierde sensibilidad (Algoritmo 1).
Historia clínica
La historia clínica, referida por los padres en los casos de niños más pequeños y por los propios pacientes, es el primer y más importante paso a la hora de intentar diferenciar una RH de una RAM o una infección.
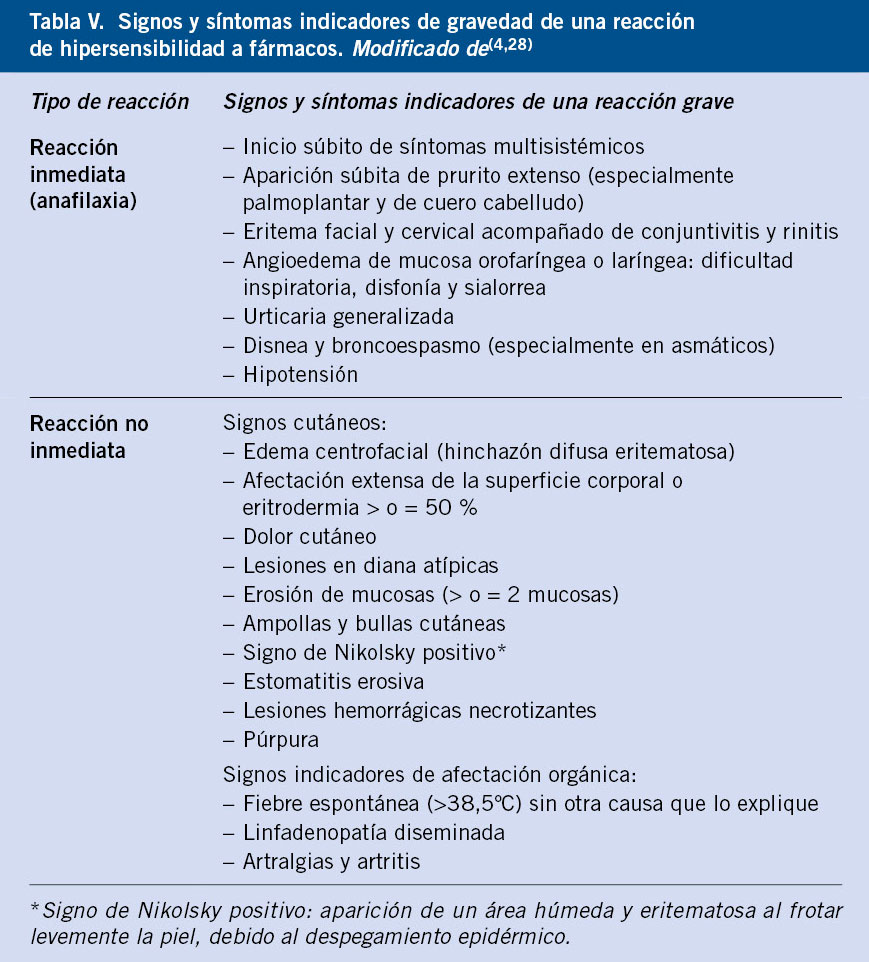
La sospecha de RH a medicamentos se confirma en pocos casos tras realizar un estudio alergológico, y cuando lo hace, es frecuente que la reacción presentada durante la prueba de exposición controlada no se corresponda con la reportada inicialmente en la historia clínica(8). Esto se puede deber a la imprecisión de los datos recogidos, la dificultad de comunicarse de los niños afectados en edades tempranas que no pueden expresarse y el tiempo hasta la valoración en consulta que, en ocasiones, ocurre años después. En las tablas IV y V se exponen respectivamente los datos más importantes en la historia clínica, así como los criterios de gravedad que conviene conocer, ya que de ello dependerá el correcto enfoque diagnóstico.
Pruebas cutáneas
Las pruebas cutáneas incluyen: pruebas intraepidérmicas o prick, pruebas intradérmicas (ID) y pruebas epicutáneas (parches). Estas pruebas resultan útiles para identificar los fármacos responsables de RH y determinar posibles alternativas terapéuticas que sean seguras. Sin embargo, la rentabilidad de las pruebas cutáneas varía según el tipo de reacción, el fármaco y el tiempo hasta la realización del estudio. Por otro lado, en muchas ocasiones, su negatividad no descarta la posibilidad de reacción y, en la mayoría de las ocasiones, es necesario realizar una PEC para conseguir el diagnóstico definitivo.
Las pruebas en prick se utilizan cuando existe una sospecha de reacción inmediata, y presentan la ventaja de ser seguras y poderse realizar con fármacos de los que no se disponga forma inyectable estéril.
Las pruebas ID se pueden utilizar, tanto en reacciones inmediatas (lectura a los 15 minutos) como en reacciones no inmediatas (lectura a las 24 y/o 48 horas). Se suelen realizar si las pruebas en prick han resultado negativas. Sin embargo, son pruebas invasivas que conllevan mayor riesgo de reacción sistémica, por lo que su uso en niños es más limitado que en adultos. Se consideran contraindicadas en las SCAR, sin embargo, algunos autores contemplan su uso de forma controlada(18).
Las pruebas epicutáneas o en parche son pruebas que se consideran seguras, aunque su rentabilidad es limitada, por lo que solo se utilizan en determinadas reacciones no inmediatas o en las SCAR como primera línea en el abordaje diagnóstico(18,19).
Antibióticos betalactámicos
Las pruebas cutáneas con antibióticos BL son las más estudiadas y con más evidencia en población infantil. Sin embargo, tienen baja sensibilidad y valor predictivo positivo, especialmente en reacciones no inmediatas y cutáneas leves(20).
Con los BL, las pruebas ID, más sensibles que las pruebas en prick, se emplean fundamentalmente para RH inmediatas. En el caso de las reacciones leves no inmediatas con BL, la sensibilidad de las pruebas ID con lectura tardía a las 48 horas es baja, aunque se ha demostrado un alto valor predictivo en caso de que resulten positivas(10). Dada su baja rentabilidad en este tipo de reacciones, se limita su uso a determinadas ocasiones(8,21).
Antiinflamatorios
En el caso de los AINE, el uso de pruebas cutáneas se limita al metamizol y, en ciertos casos, a paracetamol, en reacciones de HS selectiva, mientras que no existe evidencia suficiente que avale las pruebas de laboratorio en el caso de HS a AINE(17).
Histología
La realización de biopsias cutáneas puede ser útil en entidades graves como la PEAG y DRESS.
Pruebas in vitro
• Triptasa sérica durante el episodio agudo y basal: se emplea para el diagnóstico de la anafilaxia. Alcanza su máximo entre 60-90 minutos después del inicio de los síntomas y permanece elevado hasta 5 horas. Siempre es necesaria la determinación de triptasa basal.
• Determinación de IgE total y específica; está disponible para: amoxicilina, ampicilina, penicilina G y V, cefaclor, algunos bloqueantes neuromusculares y clorhexidina(8,21). Aunque su sensibilidad es inferior al 50 %, resulta útil en reacciones inmediatas mediadas por IgE de mayor gravedad(8).
• Otras pruebas in vitro como: el test de activación de basófilos (TAB) en reacciones inmediatas, el test de transformación linfocitaria (TTL) en reacciones no inmediatas y el estudio de cuantificación de citoquinas o productos de células T-/B (ELISPOT), requieren personal experimentado y no se realizan en la práctica clínica diaria salvo excepciones(13).
Prueba de exposición controlada
Es la prueba de referencia para confirmar o descartar el diagnostico de RH y comprobar tolerancia a alternativas terapéuticas. Consiste en la administración gradual del fármaco sospechoso hasta alcanzar la dosis terapéutica ajustada al peso. Las pautas de administración varían en función del fármaco empleado, el tipo de reacción y de la gravedad de la reacción que motiva el estudio. Se realizan cuando las pruebas realizadas previamente (pruebas cutáneas y/o in vitro) han resultado negativas, siempre y cuando el beneficio para el paciente supere el riesgo del procedimiento.
Las PEC deben realizarse solo en centros especializados, en los que se seleccionan cuidadosamente a los pacientes y se dispone de equipos, suministros y personal entrenado para gestionar la posibilidad de una reacción grave durante su realización(19).
Las PEC están contraindicadas en reacciones adversas graves como: anafilaxia, SCAR o reacciones sistémicas graves, aunque en determinados casos, cuando otros procedimientos diagnósticos, como las pruebas cutáneas o in vitro, no son concluyentes, se puede valorar la realización de una PEC con un fármaco alternativo, cuando su utilización resulta imprescindible para el paciente(11).
En niños con una reacción cutánea leve como el exantema (especialmente en reacciones tardías), se puede valorar la realización de una PEC sin necesidad de pruebas cutáneas previas, siempre que se haya descartado la presencia de algún signo o síntoma de gravedad(8,21).
En el caso de los AINE, la PEC resulta fundamental para determinar el tipo de HS y, en los casos necesarios, ofrecer alternativas terapéuticas.
En el caso de reacciones selectivas, se prohibirá el uso de todos los AINE del grupo responsable (p. ej., se prohibirá exclusivamente el uso de ácidos propiónicos, en el caso de confirmarse HS a ibuprofeno). Sin embargo, para los casos de HS por intolerancia cruzada, se debe confirmar mediante PEC cada uno de los fármacos autorizados. En general, el paracetamol a dosis terapéuticas (15 mg/kg/dosis) suele ser tolerado. Aunque, actualmente, no se ha aprobado el uso de inhibidores selectivos de la COX-2 en pacientes menores de 12 años, varios estudios avalan la seguridad del uso de: etoricoxib, celecoxib y meloxicam como inhibidor débil de COX-1, en pacientes pediátricos como alternativa(22). Otras alternativas propuestas al uso de AINE son los corticoides, potentes antiinflamatorios, junto con medidas físicas de reducción de temperatura, y los opiáceos como analgésicos.
El manejo diagnóstico de RS por BL se resume en el Algoritmo 2.
Diagnóstico diferencial
En la mayoría de los casos, resulta imposible distinguir entre un exantema inducido por un proceso infeccioso y el que es secundario a fármacos. La mayoría de las reacciones cutáneas que se producen, mientras se realiza un tratamiento con un BL, se deben a la propia infección y se ha confirmado una RH en menos del 10 % de los casos(8). De hecho, la incidencia de exantema en los niños se estima en 153,8/10.000 niños y puede ser causado: por la propia infección, por la interacción del fármaco con la infección o porque verdaderamente se trate de una reacción alérgica al fármaco(23). Las infecciones que causan este tipo de afectación con más frecuencia son: VEB, CMV, parvovirus o Mycoplasma(8,24). Una historia clínica detallada, junto con pruebas serológicas o de detección de virus mediante PCR en la fase aguda, permitirán en determinados casos, diferenciar un exantema infeccioso de una RH. El diagnóstico debe realizarse durante un mínimo de 4-6 semanas tras la resolución completa de todos los síntomas clínicos, para evitar tanto falsos positivos como falsos negativos(4).
En el diagnóstico diferencial de DRESS, se deben tener en cuenta enfermedades que cursan con: fiebre, erupción cutánea, linfadenopatías y afectación de otros órganos, como pueden ser las infecciones víricas por: VEB, parvovirus B19, sarampión, dengue o infecciones por virus Coksackie(25).
Es importante diferenciar reacciones anafilácticas de otras manifestaciones clínicas que pueden ocurrir durante la administración de medicamentos, como síndromes vasovagales o el conocido síndrome oculorespiratorio, descrito tras la administración de virus de la gripe y que se caracteriza por: conjuntivitis bilateral, edema facial y síntomas respiratorios de vías superiores(11).
Reevaluación
Se desconoce en gran medida la historia natural de la hipersensibilidad a fármacos con la mayoría de las clases de fármacos en niños. También existe información anecdótica de que algunos niños con enfermedad cutánea exacerbada por AINE pueden resolver su HS a los AINE cuando los episodios de urticaria desaparecen. Por este motivo, conviene reevaluar periódicamente a estos pacientes y valorar la posibilidad de realizar una PEC siempre en medio hospitalario y con personal entrenado(15).
Tratamiento
En caso de reacción adversa a medicamentos, es fundamental retirar el fármaco sospechoso y evitar todo fármaco que pertenezca al mismo grupo, así como reconocer aquellas reacciones graves que requieren una actuación urgente (Tabla V).
Reacciones inmediatas
En el caso de reacciones inmediatas leves, como cuadros de urticaria o angioedema, se administrarán, como primera opción, antihistamínicos, preferiblemente de segunda generación. Una reacción inmediata grave o anafilaxia se considera potencialmente mortal, por lo que requiere, como primera línea de tratamiento, la administración de adrenalina intramuscular (0,01 mg/kg
hasta 0,5 mg dosis máxima), dosis que puede repetirse a los 5-15 minutos, si la clínica persiste. En caso de parada cardiorrespiratoria, se iniciarán maniobras de reanimación y se añadirán otras medidas de soporte. Cabe destacar que la administración de antihistamínicos y corticoides sistémicos no deben usarse como tratamiento de primera línea en estos casos ni en monoterapia, ya que no revierten el edema laríngeo, el broncoespasmo ni la hipotensión(26).
Reacciones no inmediatas
En reacciones no inmediatas leves, se podrán emplear antihistamínicos, sin embargo, en EMP no complicados no se recomienda el uso de corticoides.
Las SCAR requieren un tratamiento multidisciplinar y, en ocasiones, el ingreso en unidades de cuidados intensivos. Aunque no existe un consenso claro, en cuadros de DRESS, los corticosteroides sistémicos (prednisolona 1 mg/kg/día) son el tratamiento de referencia en la fase aguda en pacientes con afectación orgánica grave. Otros fármacos empleados son ciclosporina o anti-TNF(19).
Desensibilización
En los casos confirmados de alergia a algún fármaco en los que su administración es imprescindible para el paciente, se puede valorar la realización de una desensibilización. Sin embargo, la experiencia en niños es escasa y suelen utilizarse protocolos adaptados de adultos(27).
Para los niños con pruebas alérgicas positivas tras sospecha de anafilaxia a vacunas antiinfecciosas, esta se puede administrar en dosis graduadas según el protocolo propuesto por la Academia Americana de Pediatría(11).
Función del pediatra de Atención Primaria
El médico de Atención Primaria juega un papel determinante ante un paciente con sospecha de RH a un fármaco (Tabla VI), tanto para el correcto diagnóstico de una RH, como para evitar un sobrediagnóstico perjudicial para el paciente. Lo primero será descartar que se trate de una RAM y, en caso de sospecha de RH, derivar al paciente al Servicio de Alergología con una historia clínica detallada.
Su papel radica en:
• Identificar una posible reacción de hipersensibilidad.
• Diferenciarla de una reacción de tipo A.
• Recoger minuciosamente todos los elementos necesarios para una adecuada filiación de la reacción (Tabla IV).
• Conocer los criterios de gravedad (Tabla V).
• Manejar una reacción en fase aguda, ya sea aplicando el tratamiento farmacológico adecuado o derivando al servicio de Urgencias (tratamiento de una anafilaxia).
• Suspender el fármaco sospechoso y mantener las prohibiciones con respecto al uso de los fármacos de la misma familia o grupo, hasta la valoración correspondiente en el Servicio de Alergología.
• Informar adecuadamente al paciente sobre los fármacos a evitar y las alternativas que puede emplear hasta la realización del estudio alergológico.
• Informar a los pacientes que no está indicado realizar estudio alergológico como screening(28).
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio de las autoras.
1. Rukasin CRF, Norton AE, Broyles AD. Pediatric Drug Hypersensitivity. Curr Allergy Asthma Rep. 2019; 19: 11. Disponible en: https://doi.org/10.1007/s11882-019-0841-y.
2. Park JS, Suh DI. Drug Allergy in Children: What Should We Know? Clin Exp Pediatr. 2020; 63: 203-10. Disponible en: https://doi.org/10.3345/kjp.2019.00675.
3. Trubiano JA, Stone CA, Grayson ML, Urbancic K, Slavin MA, Thursky KA, et al. The 3 Cs of Antibiotic Allergy-Classification, Cross-Reactivity, and Collaboration. J Allergy Clin Immunol Pract. 2017; 5: 1532-42. Disponible en: https://doi.org/10.1016/j.jaip.2017.06.017.
4. Demoly P, Adkinson NF, Brockow K, Castells M, Chiriac AM, Greenberger PA, et al. International Consensus on drug allergy. Allergy. 2014; 69: 420-37. Disponible en: https://doi.org/10.1111/all.12350.
5. Castells M. Drug allergy: Veni, vidi, vici-come, understand, and delabel, avoid, or desensitize. Ann Allergy Asthma Immunol. 2019; 123: 1-2. Disponible en: https://doi.org/10.1016/j.anai.2019.05.010.
6. Stone CA, Trubiano J, Coleman DT, Rukasin CRF, Phillips EJ. The challenge of de‐labeling penicillin allergy. Allergy. 2020; 75: 273-88. Disponible en: https://doi.org/10.1111/all.13848.
7. Erkoçoğlu M, Kaya A, Civelek E, Özcan C, Çakır B, Akan A, et al. Prevalence of confirmed immediate type drug hypersensitivity reactions among school children. Pediatr Allergy Immunol. 2013; 24: 160-7. Disponible en: https://doi.org/10.1111/pai.12047.
8.*** Gomes ER, Brockow K, Kuyucu S, Saretta F, Mori F, Blanca-López N, et al. Drug hypersensitivity in children: Report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016; 71: 149-61. Disponible en: https://doi.org/10.1111/all.12774.
9. Whitaker P, Naisbitt D, Peckham D. Nonimmediate β-lactam reactions in patients with cystic fibrosis. Curr Opin Allergy Clin Immunol. 2012; 12: 369-75. Disponible en: https://doi.org/10.1097/ACI.0b013e328355b849.
10. Blanca‐López N, Atanaskovic‐Markovic M, Gomes ER, Kidon M, Kuyucu S, Mori F, et al. An EAACI Task Force report on allergy to beta‐lactams in children: Clinical entities and diagnostic procedures. Pediatric Allergy and Immunology. 2021; 32: 1426-36. Disponible en: https://doi.org/10.1111/pai.13529.
11. Atanaskovic-Markovic M, Gomes E, Cernadas JR, du Toit G, Kidon M, Kuyucu S, et al. Diagnosis and management of drug-induced anaphylaxis in children: An EAACI position paper. Pediatr Allergy Immunol. 2019; 30: 269-76. Disponible en: https://doi.org/10.1111/pai.13034.
12. Brockow K, Ardern-Jones MR, Mockenhaupt M, Aberer W, Barbaud A, Caubet JC, et al. EAACI position paper on how to classify cutaneous manifestations of drug hypersensitivity. Allergy. 2019; 74: 14-27. Disponible en: https://doi.org/10.1111/all.13562.
13. Romano A, Atanaskovic‐Markovic M, Barbaud A, Bircher AJ, Brockow K, Caubet J, et al. Towards a more precise diagnosis of hypersensitivity to beta‐lactams – an EAACI position paper. Allergy. 2020; 75: 1300-15. Disponible en: https://doi.org/10.1111/all.14122.
14. Mori F, Liccioli G, Fuchs O, Barni S, Giovannini M, Sarti L, et al. Drug‐induced enterocolitis syndrome: Similarities and differences compared with food protein‐induced enterocolitis syndrome. Pediatr Allergy Immunol. 2021; 32: 1165-72. Disponible en: https://doi.org/10.1111/pai.13491.
15. López NB, Cornejo-García, JA, Pérez-Alzate D, Pérez-Sánchez N, Plaza-Serón MC, Doña I, et al. Hypersensitivity Reactions to Nonsteroidal Anti-inflammatory Drugs in Children and Adolescents: Selective Reactions. J Investig Allergol Clin Immunol. 2015; 25: 385-95.
16. Pfaar O, Bastl K, Berger U, Buters J, Calderon MA, Clot B, et al. Defining pollen exposure times for clinical trials of allergen immunotherapy for pollen-induced rhinoconjunctivitis-an EAACI position paper. Allergy. 2017; 72: 713-22. Disponible en: https://doi.org/10.1111/all.13092.
17. Kidon M, Blanca-López N, Gomes E, Terreehorst I, Tanno L, Ponvert C, et al. EAACI/ENDA Position Paper: Diagnosis and management of hypersensitivity reactions to non-steroidal anti-inflammatory drugs (NSAIDs) in children and adolescents. Pediatr Allergy Immunol. 2018; 29: 469-80. Disponible en: https://doi.org/10.1111/pai.12915.
18. Barbaud A, Castagna J, Soria A. Skin tests in the work-up of cutaneous adverse drug reactions: A review and update. Contact Dermatitis. 2022; 86: 344-56. Disponible en: https://doi.org/10.1111/cod.14063.
19. de Groot AC. Patch testing in drug reaction with eosinophilia and systemic symptoms (DRESS): A literature review. Contact Dermatitis. 2022; 86: 443-79. Disponible en: https://doi.org/10.1111/cod.14090.
20. Ponvert C, Perrin Y, Bados-Albiero A, le Bourgeois M, Karila C, Delacourt C, et al. Allergy to betalactam antibiotics in children: results of a 20-year study based on clinical history, skin and challenge tests. Pediatr Allergy Immunol. 2011; 22: 411-8. Disponible en: https://doi.org/10.1111/j.1399-3038.2011.01169.x.
21. Ibáñez MD, Rodríguez del Río P, Lasa EM, Joral A, Ruiz-Hornillos J, Muñoz C, et al. Prospective assessment of diagnostic tests for pediatric penicillin allergy. Ann Allergy Asthma Immunol. 2018; 121: 235-44.e3. Disponible en: https://doi.org/10.1016/j.anai.2018.05.013.
22. Corzo JL, Zambonino MA, Muñoz C, Mayorga C, Requena G, Urda A, et al. Tolerance to COX-2 inhibitors in children with hypersensitivity to nonsteroidal anti-inflammatory drugs. Br J Dermatol. 2014; 170: 725-9. Disponible en: https://doi.org/10.1111/bjd.12674.
23.*** Tsabouri S, Atanaskovic-Markovic M. Skin eruptions in children: Drug hypersensitivity vs viral exanthema. Pediatr Allergy Immunol. 2021; 32: 824-34. Disponible en: https://doi.org/10.1111/pai.13485.
24. Bernaola M, Morales-Cabeza C, Ibáñez-Sandín MD. De-labeling Penicillin Allergy in Pediatric Population. Curr Treat Options Allergy. 2022; 9: 234-49. Disponible en: https://doi.org/10.1007/s40521-022-00315-4.
25. Cabañas R, Ramírez E, Sendagorta E, Alamar R, Barranco R, Blanca-López N, et al. Spanish guidelines for diagnosis, management, treatment, and prevention of dress syndrome. J Investig Allergol Clin Immunol. 2020; 30: 229-53. Disponible en: https://doi.org/10.18176/jiaci.0480.
26. Nurmatov UB, Rhatigan E, Simons FER, Sheikh A. H2-antihistamines for the treatment of anaphylaxis with and without shock: a systematic review. Ann Allergy Asthma Immunol. 2014; 112: 126-31. Disponible en: https://doi.org/10.1016/j.anai.2013.11.010.
27. Rodríguez del Río P, Andión M, Ruano D, Escudero C, Méndez Brea P, Sánchez-García S, et al. Initial experience with carboplatin desensitization: A case series in a paediatric hospital. Pediatric Allergy and Immunology. 2018; 29: 111-5.
28.*** Doña I, Caubet JC, Brockow K, Doyle M, Moreno E, Terreehorst I, et al. An EAACI task force report: Recognising the potential of the primary care physician in the diagnosis and management of drug hypersensitivity. Clin Transl Allergy. 2018; 8: 16. Disponible en: https://doi.org/10.1186/s13601-018-0202-2.
29. Ortega Rodríguez NR, Doña Díaz I, Blanca López N, López San Martín M, Muñoz Román C. Hipersensibilidad a los antiinflamatorios no esteroideos. En: Dávila González IJ, Jáuregui Presa I, Olaguibel Rivera JM, Zubeldia Ortuño JM, eds. Tratado de Alergología. Ergon. 2016. p. 1551-67.
30. Armentia Medina A, Martín Armentia S. Alergia a medicamentos y drogas. Pediatr Integral. 2018; XXII: 147-54.
Bibliografía recomendada
– Gomes ER, Brockow K, Kuyucu S, Saretta F, Mori F, Blanca-López N, et al. Drug hypersensitivity in children: Report from the pediatric task force of the EAACI Drug Allergy Interest Group. Allergy. 2016; 71: 149-61. Disponible en: https://doi.org/10.1111/all.12774.
Revisión extensa del diagnóstico y manejo de reacciones de HS, específicamente en población pediátrica.
– Tsabouri S, Atanaskovic-Markovic M. Skin eruptions in children: Drug hypersensitivity vs viral exanthema. Pediatr Allergy Immunol. 2021; 32: 824-34. Disponible en: https://doi.org/10.1111/pai.13485.
Recomendado para profundizar en conocimientos sobre el diagnóstico diferencial del exantema maculopapular.
– Doña I, Caubet JC, Brockow K, Doyle M, Moreno E, Terreehorst I, et al. An EAACI task force report: Recognising the potential of the primary care physician in the diagnosis and management of drug hypersensitivity. Clin Transl Allergy. 2018; 8: 16. Disponible en: https://doi.org/10.1186/s13601-018-0202-2.
Expone de forma práctica el manejo de las reacciones de HS desde Atención Primaria. Especialmente recomendado.
| Caso clínico |
|
Niña de 3 años con antecedentes de ingreso hospitalario durante 5 días por bronquiolitis. Sin antecedentes familiares de interés. Remitida al Servicio de Alergología por sospecha de alergia a amoxicilina. En febrero de 2022, tras el diagnóstico de una otitis media aguda, se pauta tratamiento con amoxicilina 50 mg/kg/día (250 mg cada 8 horas) durante 7 días, e ibuprofeno 5 mg/kg/dosis (75 mg cada 8 horas) si fiebre o dolor. A las 24 horas de haber finalizado el quinto día de tratamiento antibiótico, precisa asistencia en Urgencias por presentar al levantarse por la mañana, lesiones cutáneas que se describen como: un exantema maculopapuloso no pruriginoso que afecta a tronco, espalda y MMII, respecta plantas de los pies y palmas de las manos. La última toma de amoxicilina antes del inicio de los síntomas había sido, al menos, 8 horas antes (la niña se acostó sin lesiones cutáneas) y la última toma de ibuprofeno había sido 48 horas antes del inicio de los síntomas. El resto de la exploración física no presentaba alteraciones, no presentaba lesiones en mucosas y la paciente permanecía afebril y con buen estado general. En Urgencias le administraron una dosis de dexclorfeniramina 0,2 mg/kg/día y se le pautó tratamiento domiciliario con el mismo jarabe antihistamínico durante 4 días, y se le retiró el tratamiento con amoxicilina. Se diagnosticó de exantema probablemente secundario a amoxicilina vs infeccioso, se le indicó evitar antibióticos betalactámicos y fue remitida a consultas de Alergología. Los síntomas se resolvieron en aproximadamente 3 días sin descamación ni lesiones residuales. Previamente, la paciente había tolerado amoxicilina y cefuroxima sin incidencias y, tras el episodio descrito, había evitado la toma de amoxicilina y otros antibióticos betalactámicos, pero había vuelto a tolerar ibuprofeno sin incidencias. Ante las características de que se trataba de una reacción leve y, a priori, tardía (inicio de los síntomas horas después de la toma del fármaco más sospechoso, amoxicilina), se planificó el estudio de alergia a fármacos y se firmó el correspondiente consentimiento informado. No se realizaron pruebas cutáneas en prick o intradermorreacción ni tampoco determinación de IgE total y específica, considerando la rentabilidad de estas pruebas complementarias en este tipo de reacción. Ante la ausencia de datos de alarma (lesiones en mucosas, ausencia de fiebre, sin lesiones residuales ni descamación y resolución de los síntomas en tres días). Se realizó directamente una prueba de exposición controlada con amoxicilina, con dosis única de 250 mg, siendo negativa. Se le pautó además tratamiento domiciliario con amoxicilina 250 mg cada 12 horas durante 5 días y, posteriormente, se confirmó la tolerancia a dicho fármaco y, por tanto, se descartó el diagnóstico de alergia a amoxicilina, confirmando que el exantema presentado fue de origen infeccioso. No se realizó prueba de exposición controlada con ibuprofeno, ya que la paciente lo había tolerado posteriormente al episodio que motivó el estudio alergológico.
|








 Allergy to medicines and drugs
Allergy to medicines and drugs 