 |
| Temas de FC |
J. de la Flor i Brú
Centro de Salud “El Serral”. ABS Sant Vicenç dels Horts-1. DAP Baix Llobregat-Litoral. ICS. Barcelona
| Resumen
La mayor parte de las faringitis son víricas. La faringitis estreptocócica no supone más de un 15% de los casos. El cuadro clínico no permite una fácil diferenciación entre faringitis vírica y bacteriana. El diagnóstico de faringitis estreptocócica debe fundamentarse siempre en técnicas de detección rápida de antígenos. La penicilina y la amoxicilina siguen siendo los antibióticos de primera elección. Las cefalosporinas deben reservarse para las faringitis recurrentes y los macrólidos para los niños alérgicos a la penicilina. |
| Abstract
Viruses are the more frequent etiologic agents of pharyngitis. Streptococcus is present in no more than 15% of the cases. Differential diagnosis between viral and bacterial pharyngitis is difficult. Diagnosis of streptococcal pharyngitis should always be based on rapid antigenic detection in the throat. Penicillin and amoxicillin remain the first antibiotic choices. Cephalosporins should only be used for recurrent pharyngitis. Macrolides are the first choice in children with penicillin allergies. |
Palabras clave: Faringitis aguda; Faringitis vírica; Faringitis bacteriana; Faringitis recurrente; Pediatría.
Key words: Acute pharyngitis; Viral Pharyngitis; Bacterial pharyngitis; Recurrent pharyngitis; Pediatrics.
Pediatr Integral 2022; XXVI (6): 340 – 347
OBJETIVOS
• Conocer la necesidad de basarse en técnicas de diagnóstico rápido antes de iniciar una terapia antibiótica en faringitis aguda.
• Conocer la necesidad de utilizar antibióticos de espectro reducido en el tratamiento de la faringitis estreptocócica y, específicamente, penicilina.
• Conocer el manejo y los criterios de derivación de las faringitis recurrentes.
Infecciones de vías respiratorias altas-1: faringitis aguda y recurrente
Introducción y epidemiología
Es importante definir correctamente el término “faringitis” y evitar confusiones terminológicas con el resfriado común.
La faringitis es la inflamación (incluyendo eritema, edema, exudado, enantema, úlceras y vesículas), generalmente debida a infección, de las membranas mucosas de la garganta. Menos frecuentemente, es debida a causas ambientales, antiguamente conocidas como faringitis “irritativas”: tabaco, polución, alérgenos, cáusticos, alimentos o líquidos muy calientes. También hay faringitis asociada a múltiples cuadros inflamatorios como: el síndrome PFAPA, la enfermedad de Kawasaki, la enfermedad inflamatoria intestinal, el síndrome de Stevens Johnson y el lupus eritematoso diseminado. Contrariamente a la creencia popular, los líquidos fríos no producen faringitis irritativas ni predisponen a la infección. Al contrario, el frío moderado actúa como analgésico para el dolor de garganta. Es un diagnóstico sobreutilizado en Atención Primaria (AP), al catalogar así, en muchas ocasiones, un resfriado común, simplemente por la visualización de una faringe congestiva. Si bien hay faringitis en cualquier infección de las vías altas y en muchas de las vías inferiores, nos referiremos a la “faringitis” sensu estricto, como la infección viral o bacteriana circunscrita a la faringe, y no a la hiperemia faríngea que se produce en el transcurso de un cuadro catarral vírico de vías altas (rinofaringitis aguda o resfriado común, gripe, laringitis) o bajas (bronquiolitis, bronquitis). A efectos prácticos, es útil diferenciar las faringitis que se producen en cuadros con participación nasal, generalmente de etiología vírica, de las faringitis en las que no hay sintomatología nasal (“faringitis seca”), y en las que la etiología puede ser bacteriana(1). Es recomendable unificar la terminología y catalogar simplemente como “faringitis”, una patología que recibe nombres distintos (amigdalitis, faringoamigdalitis, tonsilitis…). La faringitis aguda es la primera causa de utilización de antibióticos (ATB) en todas las edades y en todo el mundo.
Etiología
La mayor parte de faringitis son víricas, pese a lo cual se sigue tratando frecuentemente esta enfermedad con antibióticos. El Streptococcus pyogenes es el principal agente bacteriano causante de faringitis bacteriana primaria en Pediatría.
La mayor parte de las faringitis son víricas (65-80%) y tienen un predominio estacional (otoño-invierno-primavera). El estreptococo beta hemolítico del grupo A (EBHGA, Streptococcus pyogenes) es el agente bacteriano predominante; si bien, salvo en periodos epidémicos, en los que puede ser causa de hasta un 30% de episodios, no origina más de un 15% del total de infecciones, predominando al final del invierno y principio de primavera(2). El EBHGA es un coco Gram positivo que crece en cadenas, produciendo pequeñas colonias de color blanco a grisáceo, rodeadas de un halo de hemólisis (estreptococo hemolítico), cuando se cultivan en medio sangre-agar. Se diferencia de otros estreptococos betahemolíticos por poseer, en su pared celular, un antígeno polisacárido específico de grupo (antígeno de Lancefield). Este carbohidrato es el que detecta el test de diagnóstico rápido (TDR). A su vez, el EBHGA puede subdividirse en más de 200 serotipos por la proteína M presente en la superficie celular y por las fimbrias que se proyectan desde el borde externo celular. Se caracteriza por producir una hemólisis clara en agar sangre (hemólisis beta), rasgo bacteriológico muy importante para diferenciarlo de los estreptococos que no producen hemólisis (gamma) y de los que producen hemólisis parcial (alfa o viridans, neumococo…). Se transmite por contacto con secreciones respiratorias infectadas y por alimentos contaminados. Estreptococos betahemolíticos de los grupos C (solo el equisimilis) y G, pueden causar un cuadro clínico semejante al EBHGA, posiblemente subvalorado en su frecuencia, dado que los TDR no los detectan. El estreptococo del grupo C se ha relacionado con epidemias de faringitis en adultos jóvenes, y en epidemias transmitidas por vía alimentaria. No se ha descrito fiebre reumática asociada a estos grupos, aunque sí algún caso de glomerulonefritis(3). Muchos otros agentes bacterianos se han relacionado con faringitis, pero solo Mycoplasma pneumoniae y, posiblemente, Chlamydophila pneumoniae parecen tener algún papel secundario como agentes etiológicos en faringitis pediátrica, especialmente en casos recurrentes. Arcanobacterium hemolíticum es responsable de una forma de faringitis frecuentemente asociada a exantema escarlatiniforme, que se presenta en adolescentes y responde a macrólidos. Si bien, es frecuente el aislamiento en faringe de neumococo, Haemophilus influenzae, meningococo y estafilococo, no está establecido su papel como agentes etiológicos en faringitis. Neisseria gonorrheae puede ser raramente causa de faringitis en adolescentes sexualmente activos y en niños sometidos a abuso sexual. La difteria es una enfermedad casi olvidada en nuestro medio, que puede causar una faringitis membranosa semejante a la estreptocócica o a la mononucleosis infecciosa. Erradicada en España desde 1987, debemos tenerla en cuenta en pacientes recientemente inmigrados de países eslavos, donde se han descrito brotes epidémicos debidos a bajas coberturas vacunales. En la primavera de 2015, se declaró el primer caso de difteria en España en 30 años, en un niño no vacunado, que tuvo un desenlace fatal.
Clínica
Una valoración clínica adecuada será la principal arma que tendrá el pediatra de AP para decidir la práctica o no de un test microbiológico.
Faringitis víricas
La faringitis vírica inespecífica es aquella en la que la clínica no permite orientar el diagnóstico etiológico. Observamos simplemente una faringe hiperémica. Suele tener un inicio gradual con: fiebre moderada o ausente, faringodinia, tos irritativa de intensidad variable, pequeñas adenopatías y poca afectación del estado general. El examen de la faringe muestra hiperemia variable. El cuadro suele resolverse en 3-6 días.
En otras ocasiones, el cuadro clínico es muy sugestivo de infecciones específicas (Tabla IV):
• Puede observarse exudado semejante al purulento, que en niños de menos de 2 años (menos de 18 meses si asisten a guardería, lo que aumenta la probabilidad de infección por EBHGA) es muy sugestivo de infección por adenovirus. Puede acompañarse de exantema inespecífico, cuadro catarral y sintomatología digestiva. El adenovirus también puede causar una faringitis nodular.
• La fiebre faringoconjuntival es otra expresión clínica de la infección por adenovirus, que asocia marcada hiperemia faríngea con conjuntivitis no purulenta. Es frecuente la palpación de adenopatía preauricular. La conjuntivitis por adenovirus puede causar infiltrados corneales de larga evolución. La fiebre puede durar hasta 7 días y la conjuntivitis hasta 14. Se han descrito epidemias transmitidas en piscinas, por inoculación conjuntival a partir de agua contaminada. Las faringitis por adenovirus pueden ser confirmadas en la consulta en menos de 15 minutos con un test de inmunocromatografía que detecta el antígeno a partir de una muestra de moco obtenida por escobillado nasofaríngeo, que puede formar parte de kits diagnósticos multivíricos con gripe y VRS.
• La herpangina es una infección por enterovirus coxsackie A (6 y 16) y B y, menos frecuentemente, por enterovirus 71, echovirus y virus del herpes simple, que se caracteriza por la aparición de vesículas de 1-2 mm que posteriormente se ulceran, sin rebasar los pilares anteriores amigdalinos, con lo que hacemos el diagnóstico diferencial con la infección herpética, que sí los rebasa. El niño puede sufrir ataques recurrentes. Las infecciones por enterovirus son más frecuentes en verano y principio de otoño. En la primavera de 2016, se presentó un brote epidémico en Cataluña, asociado a los serotipos E71 y D68, con algunos casos de romboencefalitis que tuvieron una evolución fatal. La infección por enterovirus es causa frecuente de síndrome febril sin focalidad aparente y de gastroenteritis aguda, y puede confirmarse con un TDR inmunocromatográfico en una muestra de heces.
• La fiebre faringonodular, también causada por coxsackie, se caracteriza por pequeños nódulos, no ulcerativos, de color blanco o amarillento, que tienen la misma distribución que la herpangina, pero es mucho menos frecuente. El cuadro dura 1-2 semanas.
• La enfermedad boca-mano-pie (coxsackie A 16 y enterovirus 71) se caracteriza por fiebre y pequeñas úlceras en lengua y mucosa bucal, acompañadas por máculas o vesículas que no ulceran en palmas de las manos, plantas de los pies y espacios interdigitales. Pueden observarse ocasionalmente lesiones en tronco y extremidades. Las formas por enterovirus 71 son mucho más graves, con potencial afectación neurológica(4). Después de unas semanas o meses, puede observarse onicomadesis reversible en manos y pies, posibilidad de la que hay que advertir a la familia.
• La primoinfección herpética suele manifestarse con un cuadro febril acompañado de gingivoestomatitis, con vesículas que rápidamente ulceran, que afectan al paladar duro y a las encías, pero en fases iniciales puede confundirse con una faringitis vírica.
• La mononucleosis infecciosa cursa con amigdalitis exudativa. En ocasiones, la hipertrofia amigdalar es tan severa que causa obstrucción respiratoria y requiere de tratamiento con corticoides e incluso de cirugía. Puede observarse edema preesternal o periorbital. Las adenopatías son muy marcadas y puede palparse esplenomegalia. En niños pequeños, el cuadro es atípico y debe sospecharse ante toda faringitis exudativa que no responda al tratamiento antibiótico (siempre instaurado en un TDR + para estreptoco). En la actualidad, puede confirmarse en la consulta con un TDR inmunocromatográfico que detecta en 5 minutos anticuerpos heterófilos en sangre capilar, pero que puede ser negativo en menores de 5 años, en los que el diagnóstico se hará con la detección de anticuerpos contra el antígeno de la cápside viral (VCA), que aparecen más precozmente que los dirigidos contra los antígenos del núcleo.
• Pese a su rareza, no debemos olvidar que la infección aguda por el VIH (síndrome retroviral agudo) puede manifestarse como una faringitis no exudativa, con: fiebre, linfadenopatía, artralgias, mialgias, letargia y exantema maculopapular.
El tratamiento de la faringitis vírica es sintomático. El dolor de garganta puede tratarse con paracetamol o ibuprofeno. En caso de faringodinias muy intensas que no cedan a la analgesia habitual, es muy útil una tanda corta de corticoides orales.
Faringitis bacterianas
La faringitis estreptocócica es la causa más frecuente de faringitis bacteriana, pero no causa más de un 15% de todos los casos de fiebre y dolor de garganta. El principal factor de virulencia es la proteína M de superficie, que dificulta la opsonofagocitosis y condiciona la existencia de distintos serotipos, con variable tropismo tisular. Hay 220 tipos de proteína M, que generan inmunidad tipo específica, lo que explica el carácter repetitivo de las infecciones. Los tipos M causantes de faringitis rara vez dan infecciones cutáneas y viceversa. Después de la infección se desarrolla inmunidad específica de serotipo M, pero no inmunidad cruzada con otros serotipos. El EBHGA (Streptococcus pyogenes) tiene amplia expresividad clínica. Los cuadros más frecuentes son: faringitis, impétigo (cepas potencialmente nefritógenas, pero no reumatógenas), escarlatina, celulitis y celulitis perianal. Menos frecuentes son: vulvovaginitis, neumonía, artritis séptica, osteomielitis, meningitis y fascitis necrotizante. No hay que olvidar las secuelas no supurativas (fiebre reumática y glomerulonefritis). El EBHGA puede estar presente asintomáticamente en faringe (estado de portador), recto y vagina en 10-15% de niños en edad escolar, pero en periodos epidémicos hasta un 50% de niños pueden estar colonizados. Estos niños no desarrollan respuesta inmunitaria ni tienen riesgo de presentar fiebre reumática o glomerulonefritis. Su capacidad de transmisión es baja.
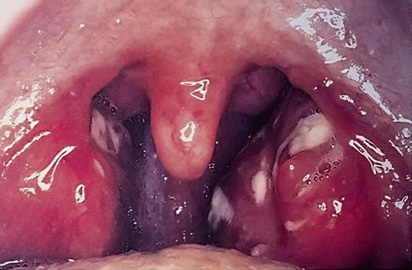
La faringitis por EBHGA es más frecuente entre los 5-15 años (“edad del estreptococo”). Tiene un periodo de incubación de 2-5 días y un inicio brusco, con fiebre alta, frecuentemente superior a 39ºC. La faringodinia es intensa y puede preceder a la aparición de la fiebre y de los signos inflamatorios faríngeos, lo que dificulta el diagnóstico, pero tiene un alto valor predictivo en niños con faringitis estreptocócica recurrente. Las adenopatías tonsilares pueden ser de gran tamaño. El niño puede estar prostrado, con cefalea, vómitos y, en ocasiones, meningismo. No es excepcional la presencia de un dolor abdominal intenso, por adenitis mesentérica, que plantee dudas diagnósticas con el abdomen agudo e incluso provoque apendicectomías blancas. La faringe suele presentar marcada hiperemia, con afectación variable de las amígdalas, que frecuentemente presentan un exudado blanquecino, que no es patognomónico de infección bacteriana (Fig. 2).
Figura 2. Faringitis estreptocócica (observación personal).
Es frecuente que la úvula participe de la inflamación. Sin embargo, la presencia de una uvulitis circunscrita, con gran tumefacción, fiebre alta y mal estado general, en niños de menos de 3 años no correctamente inmunizados, debe hacernos sospechar la posibilidad de infección por Haemophilus influenzae invasivo (Hib), y derivar al niño al hospital para descartar meningitis. En la actualidad, en nuestro medio, con coberturas vacunales frente a Hib casi universales, una uvulitis con buen estado general es casi patognomónica de infección estreptocócica. La presencia de petequias en paladar blando y/o úvula es también muy sugestiva, pero no patognomónica de infección estreptocócica. Debe valorarse toda la clínica en su contexto, puesto que es sorprendente la gran disociación que puede haber entre el aspecto de la faringe y la etiología de la enfermedad. La presencia de sintomatología catarral acompañante (rinitis, tos, ronquera, conjuntivitis no purulenta), de mialgias y diarrea, siempre se ha considerado como sugestiva de infección vírica, pero en estudios de detección antigénica, no ha mostrado correlación suficiente con un resultado negativo. La frecuente yuxtaposición de sintomatología entre faringitis víricas y bacterianas hace obligada, en caso de duda, la práctica de un test objetivo.
Otras formas clínicas de faringitis
• Arcanobacterium hemolíticum es causa de faringitis en niños mayores de 10 años. Es especialmente frecuente entre los 15-18 años, franja en la que puede suponer el 2,5% de todos los casos. Cursa con una faringitis exudativa similar a la estreptocócica. En el 50% de casos presenta un rash escarlatiniforme. A nivel práctico, la presencia de faringitis y un exantema sugestivo de escarlatina en un niño mayor de 10 años, con TDR negativo, debe hacernos sospechar esta etiología y tratar el caso con un macrólido, puesto que este germen no responde a la penicilina.
• Síndrome de Lemierre: rara complicación de la faringitis causada por fusobacterium necrophorum, consistente en tromboflebitis de la vena yugular. Sin embargo, la infección por fusobacterium spp. puede suponer hasta un 10% de faringitis en adolescentes y adultos jóvenes y, generalmente, cursa con clínica leve e indistinguible de la faringitis estreptocócica(5). Excepcionalmente, puede ser muy grave con cuadro séptico y disnea debida a émbolos sépticos pulmonares.
• Síndrome PFAPA: acrónimo inglés de fiebre periódica, estomatitis aftosa, faringitis y adenopatías. Es un cuadro recurrente, no excepcional si se piensa en él, de causa desconocida, posiblemente infecciosa. Es más frecuente en menores de 5 años. No responde a antibióticos. Se han comunicado buenos resultados con corticoides (1 o 2 dosis de prednisona) y con cimetidina. La amigdalectomía ofrece buenos resultados en la prevención de las recurrencias y se especula que algunos casos pueden ser debidos a déficit de vitamina D, cuya suplementación reduciría el número y gravedad de los ataques(6).
• Escarlatina: en la actualidad, se presenta con clínica poco florida, incluso, en ocasiones, sin fiebre. Estos exantemas escarlatiniformes con clínica atípica presentan frecuentemente frotis faríngeo positivo. Es producida por la toxina pirogénica (anteriormente conocida como eritrogénica) del EBHGA, de la que existen 3 clases: A (la más frecuente), C y SSA, con desarrollo de inmunidad específica. Se han descrito 12 tipos distintos de toxina pirogénica, por lo que un niño puede presentar, por tanto, diversos episodios de escarlatina. Es rara en lactantes, probablemente por la acción protectora de anticuerpos transplacentarios contra la toxina. La escarlatina aparece en personas sin antitoxina. Hay cierta superposición clínica con la enfermedad de Kawasaki, que debe sospecharse ante toda escarlatina que no responda al antibiótico.
Complicaciones
Se observa actualmente un leve aumento de la frecuencia de las mismas, o bien por un cambio en la agresividad del EBHGA o, posiblemente, por la reducción del tratamiento antibiótico de las faringitis.
Disminuyeron radicalmente con la generalización de los antibióticos, pero en la actualidad, estamos asistiendo a un aumento de las mismas.
• Absceso periamigdalino: generalmente producido por EBHGA y, más raramente, por estreptococo alfa-hemolítico y del grupo D, neumococo y anaerobios. La amígdala afectada protruye medialmente y el pilar anterior amigdalino se desplaza hacia delante. Hay desplazamiento de la úvula y el paladar blando. Si no se trata puede evolucionar hacia el absceso faríngeo lateral, que puede comprometer la vía aérea y erosionar la arteria carótida. Debe derivarse al niño al hospital para recibir tratamiento endovenoso. Es más frecuente en adolescentes y adultos jóvenes.
• Absceso retrofaríngeo: generalmente producido por EBHGA y, más raramente, por estafilococo. El niño se presenta con hiperextensión del cuello, disfagia, salivación y disnea. Puede parecer un crup. La visualización de la faringe muestra tumoración faríngea posterior unilateral en menos del 50% de casos. El niño debe ser derivado para recibir tratamiento endovenoso y, en ocasiones, desbridamiento quirúrgico. Puede resolverse sin cirugía en un 50% de casos. Afecta más a niños <4 años(7).
• Complicaciones supurativas: la otitis media y la adenitis cervical son relativamente frecuentes. La celulitis es más rara. La sepsis es excepcional.
• Complicaciones no supurativas: la fiebre reumática en nuestro medio ha sido excepcional en los últimos años. Aparece una media de 18 días después de la infección. La aparición de glomerulonefritis postestreptocócica no está influenciada por la utilización de ATB, tarda en aparecer una media de 10 días después de la infección faríngea, y de 3 semanas si el origen es cutáneo. Se ha descrito un trastorno obsesivo-compulsivo transitorio relacionado con faringitis estreptocócica, en niños de 5-11 años (síndrome PANDAS). Se especula que por un mecanismo autoinmune de reacción de anticuerpos contra el estreptococo y contra el tejido cerebral, aunque recientemente se ha cuestionado mucho la existencia de esta asociación.
Diagnóstico
Debe basarse en técnicas de detección rápida de antígeno estreptocócico, actualmente disponibles en la AP en toda España.
La diferenciación entre faringitis bacteriana y faringitis vírica es compleja. La valoración conjunta y cuidadosa de toda la sintomatología y semiología descrita anteriormente, aún hecha por un pediatra experimentado, tiene una correlación muy pobre con la confirmación microbiológica. La faringitis estreptocócica se ha considerado clásicamente rara antes de los 3 años y excepcional antes del año. Sin embargo, en niños que asisten a guardería, puede presentarse a partir de los 18 meses, especialmente en brotes epidémicos. En la actualidad, parece desplazarse hacia edades más precoces. No es excepcional la infección estreptocócica del niño pequeño e incluso del lactante, que no se manifiesta en forma de faringitis, sino de un cuadro llamado fiebre estreptocócica infantil o estreptococosis, de difícil reconocimiento, que se manifiesta en el niño de menos de 6 meses por: fiebre inferior a 39ºC, hiperemia faríngea y rinorrea mucoserosa, con impetiginización de las narinas, que se diagnostica habitualmente como resfriado común; y en el niño de 6 meses a 3 años con: fiebre inferior a 39,5ºC, rinorrea, hiperemia faríngea y mayor afectación del estado general, con vómitos, anorexia y adenopatías generalizadas, cuadro que se presenta con carácter intermitente durante 4-8 semanas. Se han propuesto muchas escalas clínicas para la valoración adecuada de la etiología de la faringitis, pero ninguna ha mostrado suficiente sensibilidad-especificidad para la toma de decisiones. La más utilizada es la escala de Centor(8), diseñada para adultos y adaptada a la edad pediátrica por McIsaac. Otorga un punto a cada uno de los siguientes signos: temperatura superior a 38ºC, ausencia de tos, adenopatías dolorosas, exudado y edad entre 3-14 años. Se considera sugestiva de infección bacteriana una puntuación igual o superior a 2 o 3, según las guías, pero muchos TDR+ cursan con puntuaciones más bajas. Además, puntuaciones superiores a 4, cursan con la presencia de EBHGA solo en un 70% de casos. En nuestra opinión, esta escala no tiene ninguna utilidad, ya que se basa en un estudio con graves déficits metodológicos, 3 de los 5 ítems que valora son de interpretación subjetiva y, por lo tanto, no presenta consistencia interobservador, puntúa la ausencia de tos (síntoma muy frecuente en faringitis estreptocócica si se indaga por él, pero no manifestado frecuentemente como motivo de consulta, que suele ser la fiebre y/o el dolor de garganta), y no valora signos tan predictivos, como la uvulitis o la escarlatina. Creemos que en la toma de decisiones sobre hacer o no TDR, hay que sustituir su uso por la intención de tratar(9,10):
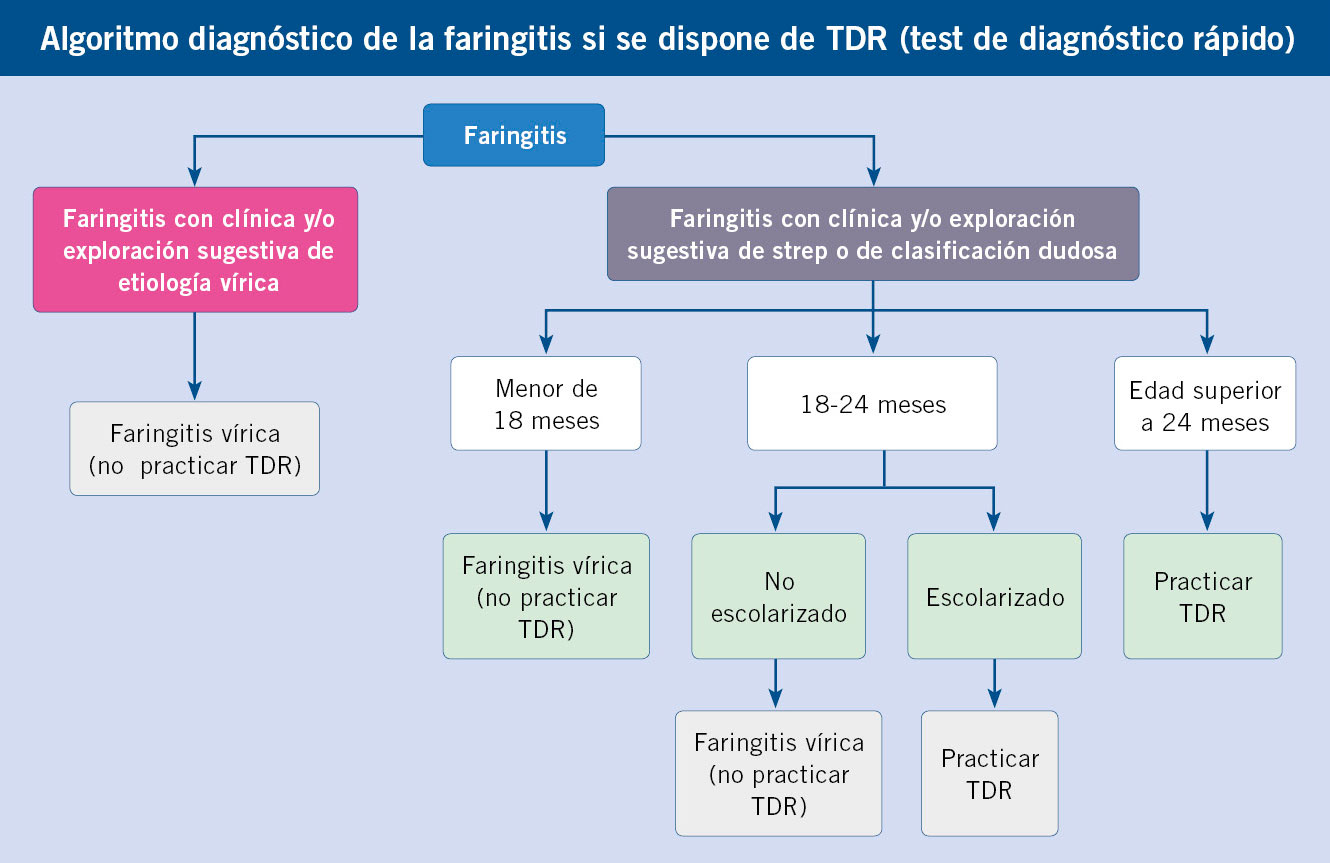
• Practicar TDR cuando pensamos que se trata de una faringitis estreptocócica o tenemos dudas razonables, dado que un 50% de estos casos no van a ser causados por EBHGA. Es decir, en ausencia de TDR utilizaríamos ATB.
• Practicar TDR siempre que haya uvulitis o escarlatina.
• No practicar TDR cuando pensamos que se trata de una faringitis vírica, puesto que la capacidad de predicción clínica es muy superior en este caso, y la presencia de un TDR+ correspondería probablemente a un estado de portador, y no a la etiología de la faringitis. Es decir, en ausencia de TDR no utilizaríamos ATB. La única excepción estaría en caso de un contacto doméstico con faringitis estreptocócica.
El cultivo de frotis faríngeo ha sido considerado generalmente el patrón oro del diagnóstico de la faringitis estreptocócica, pero su resultado diferido le resta utilidad práctica en nuestra cultura asistencial. Los nuevos TDR basados en inmunocromatografía han mostrado sensibilidades hasta del 95%, comparables al cultivo(11), aunque estas sensibilidades dependen fundamentalmente de una técnica adecuada de recogida de la muestra.
Cuando evaluamos a un niño con faringitis aguda, debemos valorar cuidadosamente los aspectos clínicos y epidemiológicos antes de practicar un TDR. Si van en contra de la etiología estreptocócica, la baja probabilidad de un resultado positivo que, además, posiblemente reflejaría un estado de portador (15% de niños en edad escolar), y la escasa incidencia actual de fiebre reumática (FR) y otras complicaciones graves secundarias a la infección por Streptococcus pyogenes en nuestro medio, no justificaría el coste de la utilización indiscriminada del test ante cualquier proceso de faringodinia/hiperemia faríngea, mayoritariamente de causa viral. En cambio, la valoración pre-test de una supuesta alta probabilidad clínica y/o epidemiológica de faringitis estreptocócica, tiene muchos falsos positivos, incluso hecha por pediatras muy experimentados, por lo que el test estaría indicado fundamentalmente en estos casos, con el objetivo de utilizar adecuadamente los ATB, reduciendo sensiblemente su uso. En un estudio(11), de correlación entre predicción pre-test de la etiología de la faringitis y resultado del test rápido, la capacidad de predicción por la clínica fue únicamente del 57,67%. La utilización sistemática de TDR supuso un ahorro de ATB en el 54,55% de casos, y la utilización de ATB en casos en los que sin test no se hubiera hecho en el 22%.
Los TDR son, en la actualidad, más económicos que el cultivo tradicional del frotis faríngeo en agar sangre de oveja y, además, ofrecen una rapidez que permite reducir la diseminación del EBHGA y favorecer la incorporación rápida del niño a su actividad normal, factores ambos que, aunque más difíciles de cuantificar que el coste del test, tienen un impacto económico indudable. Además, detectan antígeno estreptocócico (carbohidrato C de la pared celular) hasta 48 horas después de iniciado el tratamiento ATB, lo que permite suspender, en este plazo, tratamientos incorrectos previos administrados empíricamente.
Tratamiento
La penicilina oral sigue siendo el tratamiento de primera elección. Las cefalosporinas deben reservarse a situaciones de fracaso terapéutico o recidiva. Los macrólidos son el tratamiento de elección en alergia a la penicilina.
El tratamiento ATB produce una discreta mejoría clínica, reduciendo el periodo sintomático en 12-24 horas, disminuye el periodo de contagio y la reducción es drástica en la frecuencia de complicaciones supurativas y de FR. En cambio, no disminuye el riesgo de glomerulonefritis. Sin embargo, algunos estudios han apuntado la posibilidad de que un tratamiento precoz puede comprometer la respuesta inmunitaria y facilitar las recidivas. Para una adecuada prevención de la fiebre reumática es suficiente con iniciar el tratamiento en los 10 primeros días de iniciado el proceso. Este concepto, bien explicado y comprendido por la familia, puede ser de aplicación práctica, sobre todo, en niños con faringitis recurrente.
La penicilina sigue siendo el tratamiento de primera elección, puesto que su actividad frente EBHGA es universal. En los últimos años, se ha comunicado una tendencia creciente de fracasos en la erradicación, pero no en la respuesta clínica. Esta tasa se considera en torno al 30%. Este hecho se ha intentado explicar por factores, tales como: incumplimiento terapéutico, estado crónico de portador, eliminación de la flora protectora de estreptococos alfahemolíticos (que compiten con el EBHGA por el nicho ecológico) por el tratamiento antibiótico, tolerancia del EBHGA a la penicilina (concentración bactericida mínima más de 4 veces superior a la concentración inhibitoria mínima), etc. La teoría más aceptada es la de la copatogenicidad indirecta, según la cual, gérmenes cohabitantes de la faringe y productores de betalactamasa (HI) inactivan la penicilina. Diferentes metaanálisis han coincidido en sugerir la superioridad de las cefalosporinas en la respuesta bacteriológica, pero no así en la respuesta clínica. Sin embargo, en muchos de los estudios analizados, hay errores metodológicos, y no se justifica por el momento la sustitución sistemática de la penicilina por otras opciones de más amplio espectro, pero sí su consideración en casos seleccionados.
La penicilina V, sal potásica de la fenoximetilpenicilina, es el tratamiento más recomendable en Pediatría, considerando su eficacia, precio, buena tolerancia y espectro limitado(12). Tiene una buena absorción, que permite obtener niveles plasmáticos semejantes al de la inyección intramuscular. Su sabor amargo puede dificultar el cumplimiento. La presentación en sobres constituye otro problema para su utilización en niños pequeños, que difícilmente aceptan el fármaco antes de los 5-6 años. La pauta simplificada de tratamiento ha mejorado mucho el cumplimiento terapéutico, sin disminuir la eficacia en la respuesta clínica ni en la erradicación bacteriológica:
• En niños de menos de 27 kg: 250 mg cada 12 horas durante 10 días.
• En niños de más de 27 kg: 500 mg cada 12 horas durante 10 días.
La penicilina V debe administrarse una hora antes o 2 horas después de las comidas y debe insistirse a la familia sobre la necesidad de prolongar el tratamiento durante 10 días, única forma documentada de prevenir la FR, para lo que es muy importante que dispensemos la cantidad de medicamento necesaria para completar la pauta. Es obligado aislar al niño durante 24 horas desde el inicio del tratamiento antibiótico, periodo en el que es contagioso. Se ha demostrado que el inicio del tratamiento antibiótico 48 horas después del diagnóstico mejora la erradicación bacteriológica sin comprometer la prevención de la fiebre reumática. La inflamación de las amígdalas es superior a partir de las 48 horas y ello favorece la penetración del antibiótico. El pediatra deberá contraponer este hecho al retraso en la incorporación a la escuela que comporta la aplicación de esta recomendación.
La penicilina benzatina es dolorosa y debe reservarse a pacientes de alto riesgo de no cumplimiento o con intolerancia evidente a la vía oral:
• Niños de menos de 27 kg: 600.000 ui. IM dosis única.
• Niños de más de 27 kg: 1.200.000 ui. IM dosis única.
En niños que no acepten la penicilina V, la mejor opción es la amoxicilina:
• 50 mg/kg/día en 3 dosis, durante 10 días. Estudios recientes muestran que la dosis total diaria fraccionada en dos tomas es equivalente a tres. Se ha comunicado que una sola toma de 50 mg/kg (máximo 1 g) durante 10 días, es equivalente a dos tomas sin aumentar los efectos secundarios digestivos(12).
En niños alérgicos a la penicilina, debe utilizarse un macrólido. La elección del mismo dependerá de la tasa de resistencias locales de EBHGA a los macrólidos. Si es elevada (>20%), deberá ser preferentemente de 16 átomos, con la utilización de Josamicina: 50 mg/kg/día en dos dosis, durante 10 días.
En busca de mejorar el cumplimiento, se han propuesto varias pautas que reduzcan el número de dosis y/o los días de tratamiento. Cefuroxima axetil 5 días es equivalente a 10 días. Cefpodoxima proxetil, 2 dosis diarias durante 5 días se ha mostrado incluso superior a la penicilina. Ceftibuteno, dosis única diaria durante 5 días ha mostrado también su eficacia. Azitromicina, 1 dosis diaria (12 mg/kg) durante 5 días o 20 mg/kg/día durante 3 días (dosis dobles a las recomendadas para otras patologías) es equivalente a penicilina, pero su utilización quedará supeditada a que las tasas de resistencias locales sean bajas. Hay que recomendar reservar estas opciones para situaciones especiales en las que, por motivo de horarios familiares, actividad del niño, etc., parezca imprescindible su utilización. No debe utilizarse nunca Cotrimoxazol, que no es útil en la erradicación de EBHGA.
Faringitis recurrente; faringitis de repetición; amigdalectomía
Es una situación frecuente, pero probablemente sobrevalorada y sobretratada. La amigdalectomía puede ser un último recurso en casos muy seleccionados y poco frecuentes.
La faringitis recurrente se define como un nuevo ataque en un periodo inferior a 1 mes de un episodio tratado correctamente con antibióticos. Esta situación es muy frecuente en la actualidad (20% de faringitis EBHGA experimentan recurrencia a los 30 días y 33% a los 60 días). La obtención de un resultado positivo en un test rápido o cultivo, plantea la diferenciación entre un estado de portador con faringitis vírica intercurrente (situación más frecuente) o una auténtica nueva faringitis por EBHGA. Si la valoración clínica orienta hacia la segunda posibilidad, puede sospecharse copatogenicidad por gérmenes productores de betalactamasa y utilizar un antibiótico de 2ª línea. Diversas opciones han demostrado su eficacia en esta indicación: amoxicilina + ácido clavulánico, cefadroxilo (30 mg/kg/día en 1 o 2 dosis), cefalosporinas de 2ª o 3ª generación o macrólidos. Estos últimos estarían especialmente indicados en caso de faringitis de repetición, dado el posible papel etiológico de bacterias atípicas. La Academia Americana de Pediatría (criterios de Paradise) define como faringitis de repetición (13) la presencia de 7 infecciones documentadas con pruebas objetivas en un año, o 5 anuales en dos años consecutivos, o 3 anuales en 3 años consecutivos. Si confirmamos un estado de portador de EBHGA en niños con faringitis de repetición y valoramos la necesidad de su erradicación, el tratamiento recomendado es la clindamicina, 20 mg/kg/día en 3 dosis, durante 10 días (máximo 1,8 g/día). El niño con faringitis estreptocócicas de repetición, sea o no portador, puede beneficiarse en casos seleccionados de un estudio de portadores familiar, con el tratamiento de erradicación de los contactos identificados, que puntualmente puede ser la solución definitiva.
No puede concluirse un capítulo de faringitis sin referirse a la amigdalectomía. Las indicaciones actuales(15) se han reducido a casos de hipertrofia severa que dificulte la respiración (causa fundamental de la apnea obstructiva del sueño que, en la actualidad, puede confirmarse con estudios de polisomnografía) o faringitis de repetición, con infecciones de frecuencia y severidad que lleguen a afectar seriamente la vida normal del niño. De cualquier manera, hay que individualizar el caso, conocer que el tamaño de las amígdalas se reduce a partir de los 6-8 años y recordar que, a medida que el niño crezca, se irá reduciendo el número de episodios, y que no se ha demostrado concluyentemente que la extirpación de las amígdalas reduzca el número de ataques a largo plazo, dificultando, en cambio, el diagnóstico.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Cherry JD. Pharyngitis. En: Cherry JD, Harrison JG, Kaplan SL, Steinback WJ, Hotez PJ. Textbook of pediatric infectious diseases. Saunders Elsevier. 8ª ed. Philadelphia; 2018. p. 108-15.
2.*** Tanz RR. Acute pharyngitis. En: Kliegman RM, Blum NJ, Shah SS, St. Geme III, Tasker RC, Wilson KM. Nelson textbook of pediatrics. 21ª ed. Elsevier. Philadelphia; 2020. p. 2192-96.
3.** Sande L, Flores AR. Group A, group C, and group G beta-hemolytic streptococcal infections. En: Cherry JD, Harrison JG, Kaplan SL, Steinback WJ, Hotez PJ. Textbook of pediatric infectious diseases. Saunders Elsevier. 8ª ed. Philadelphia; 2018. p. 813-22.
4. Hu Y, Jiang L, Peng HL. Clinical analysis of 134 children with nervous system damage caused by enterovirus 71 infection. Pediatr Infect Dis J. 2015; 34: 718-23.
5. Kupalli K, Livorsi D, Talati NJ, Osborn M. Lemierre’s sydrome due to fusobacterium necrophorum. Lancet Infect Dis. 2012; 12: 808-15.
6. Esposito S, Bianchini S, Fattizo M, Baggi E, Marchisio P, Rigante D. The enigma of periodic fever, aphtous estomatitis, pharyngitis and adenitis syndrome. Ped Infect Dis J. 2014; 33: 650-2.
7. Pappas DE, Owen Hendley J. Retropharyngeal abscess, lateral pharyngeal (parapharyngeal) abscess and peritonsillar cellulitis/abscess. En: Kliegman RM, Blum NJ, Shah SS, St. Geme III, Tasker RC, Wilson KM. Nelson textbook of paediatrics. 21ª ed. Elsevier. Philadelphia; 2021. p. 2197-8.
8. Fine QAM, Nizet V, Mandel KD. large-scale validation of the Centor and Mc Issac scores to predict group A streptococcal pharyngitis. Arch Inter Med. 2012; 172: 847-52.
9. De la Flor i Brú J, Marès-Bermúdez J. Ús, desús i mal ús del test de diagnòstic ràpid per a estreptococ. Pediatr Catalana. 2019; 79: 139-43.
10. Piñeiro Pérez R, Álvez González F, Baquero-Artigao F, Cruz Cañete M, de la Flor i Bru J, Fernández Landaluce A, et al. Actualización del documento de consenso sobre el diagnóstico y tratamiento de la faringoamigdalitis aguda. An Pediatr (Barc). 2020. Disponible en: https://doi.org/10.1016/j.anpedi.2020.05.004.
11.* De la Flor J. Utilización sistemática de test de diagnóstico rápido en una consulta de Pediatría extrahospitalaria-Atención primaria: en el camino hacia un futuro de máxima resolución. Pediatria Catalana. 2009; 69: 75-84.
12. Lennon DR, Farrell E, Martin DR, Stewart JM. Once-daily amoxicillin vs twice-daily penicillin V in group A B-heamolytic streptococcal pharyngitis. Arch Dis Child. 2008; 93: 474-8.
13. American Academy of pediatrics: Group A streptococcal infections. Pickering LK, Baker CJ, Kimberlin DW, et al.: Redbook. 2012. Report of the committee on infectious diseases. p. 668-80.
14. Ramos SD, Mukerji S, Pine H. Tonsillectomy and adenoidectomy. Pediatr Clin N AM. 2013; 60: 793-807.
15. Burton MJ, Glasziou PP. Tonsillectomy or adeno-tonsillectomy versus no surgical treatment for chronic/recurrent acute tonsillitis (review). Cochrane Database Sys Rev. 2009; (1): CD001802.
Bibliografía recomendada
– Arnold JC, Nizet V. Pharyngitis. En: Long SS, Prober CG, Fischer M. Principles and practice of pediatric infectious diseases. 5ª ed. Elsevier. Philadelphia; 2017. p. 202-8.
Actualizada revisión en un texto de referencia.
– Hersh AL, Jackson MA, Hicks LA. Principles of judicious antibiotic prescribing for upper respiratory tract infections in pediatrics. Pediatrics. 2013; 132: 116-154.
– Maes JA. Acute pharyngitis in children. En: Bajaj L, Hambidge SJ, Kerby G, Nyquist AC. Berman’s pediatric decision making. 5ª ed. Elsevier. Philadelphia; 2011. p. 150-154.
El mejor texto de algoritmos pediátricos, imprescindible para el pediatra práctico.
– Nassef CH, Ziemer C, Morrell DS. Hand-foot-and-mouth-disease: a new look at a classic viral rash. Curr Opin Pediatr. 2015; 27: 486-91.
– Shulman ST, Reuter CH. Group A Streptococcus. En: Kliegman RM, St. Geme III J. Nelson textbook of pediatrics. 21ª ed. Elsevier. Philadelphia; 2020. p. 1440-5.
– Wetmore RF. Tonsils and adenoids. En: Kliegman RM, St. Geme III JW. Nelson textbook of pediatrics. 21ª ed. Elsevier. Philadelphia; 2020. p. 2198-202.
– Cherry JD. Pharyngitis. En: Cherry JD, Harrison JG, Kaplan SL, Steinback WJ, Hotez PJ. Textbook of pediatric infectious diseases. Saunders Elsevier. 8ª ed. Philadelphia; 2018. p. 108-15.
Revisión actualizada en un texto clásico de referencia en infectología pediátrica.
– Tanz RR. Acute pharyngitis. En: Kliegman RM, Blum NJ, Shah SS, St. Geme III, Tasker RC, Wilson KM. Nelson textbook of pediatrics. 21ª ed. Elsevier. Philadelphia; 2020. p. 2192-96.
Texto fundamental de la Pediatría mundial. De obligada lectura para cualquier pediatra de AP.
– Sande L, Flores AR. Group A, group C, and group G beta-hemolytic streptococcal infections. En: Cherry JD, Harrison JG, Kaplan SL, Steinback WJ, Hotez PJ. Textbook of pediatric infectious diseases. Saunders Elsevier. 8ª ed. Philadelphia; 2018. p. 813-22.
Completa revisión sobre el estreptococo en un texto de referencia en la infectología pediátrica.
– De la Flor J. Utilización sistemática de test de diagnóstico rápido en una consulta de Pediatría extrahospitalaria-Atención primaria: en el camino hacia un futuro de máxima resolución. Pediatria Catalana. 2009; 69: 75-84.
Estudio en una consulta de AP, para determinar el rendimiento y operatividad de los test de diagnóstico rápido. Se han mostrado imprescindibles para el diagnóstico de faringitis estreptocócica.
| Caso clínico |
|
Acude a la consulta un niño de 14 años sin antecedentes relevantes. Presenta un proceso febril de 72 horas de duración, con temperatura de 39,5 ºC, asociado a: faringodinia, vómitos, dolor abdominal, decaimiento y malestar general. Consultó hace 12 horas al servicio de urgencias del hospital de referencia y aporta un informe en el que consta un diagnóstico clínico de “faringitis”, sin ninguna prueba microbiológica. Se le prescribió amoxicilina. La madre le ha administrado 2 dosis. A la exploración física, destaca la presencia de gran hiperemia faríngea con exudado blanquecino amigdalar, petequias en paladar blando y adenopatías submandibulares dolororosas. Practicamos un test inmunocromatográfico de detección rápida de antígeno estreptocócico que es negativo.
|


 Upper respiratory tract infections-2: otitis media (etiology, symptoms and diagnosis; complications and treatment); recurrent acute otitis media and chronic otitis media; external otitis
Upper respiratory tract infections-2: otitis media (etiology, symptoms and diagnosis; complications and treatment); recurrent acute otitis media and chronic otitis media; external otitis 