 |
| Historia de la Medicina y la Pediatría |
M. Zafra Anta*, V.M. García Nieto**
*Servicio de Pediatría del Hospital Universitario de Fuenlabrada, Madrid. Miembro del Grupo de Historia de la Pediatría de la AEP. **Coordinador del Grupo de Historia de la Pediatría de la AEP. Director de Canarias Pediátrica
Pediatr Integral 2022; XXVI (4): 259.e1 – 259.e9
Enfermedades pediátricas que han pasado a la historia (10). Síndrome de la talidomida: descubrimiento, tragedia y enseñanzas
Prólogo
La talidomida fue un fármaco sintetizado en 1953 y comercializado desde 1957 en Alemania y hasta en 50 países, como sedante e hipnótico no barbitúrico. También se indicó para el tratamiento de náuseas y vómitos durante el embarazo. En 1961 se descubrió la asociación de la talidomida con una embriopatía grave. Se comunicó paralelamente por Lenz y Knapp en Alemania Federal (pediatras) y por McBride, obstetra en Australia.
La comercialización de la talidomida es el prototipo de error irreparable con un fármaco de consecuencias globales.
Talidomida. Historia de la molécula, investigación inicial, indicaciones y distribución
La historia de la talidomida comenzó a finales de los años 50. La talidomida (alfa-N-phthalimido-glutarimida o N-[2,6-dioxo-3-piperidil]-ftalimida) fue sintetizada en 1953 por Wilhem Kunz, de la farmacéutica suiza CIBA, durante la búsqueda de nuevos antibióticos. No encontraron los resultados deseados y fue cedida al laboratorio alemán Chemie Grünenthal en 1954(1,2).
Grünenthal había sido fundada en 1946. Fue la primera empresa en fabricar la penicilina en Alemania tras finalizar la Segunda Guerra Mundial (referencia en web, Grünenthal). Grünenthal desarrolló el fármaco como un sedante no barbitúrico, que fue aprobado para su comercialización en Alemania en octubre de 1957, sobre todo con el nombre de Contergan®. Si bien, en 1957, se presentaba en algunas fichas técnicas con las más diversas indicaciones: irritabilidad, falta de concentración, pánico escénico, eyaculación precoz, tensión menstrual, trastornos menopáusicos, miedo a los exámenes, trastornos funcionales del estómago, ansiedad, hipertiroidismo, enfermedades febriles infecciosas y tuberculosis. Incluso se recomendó para niños que fueran “inusualmente inquietos”.
Además de sedante, se encontró que combatía las náuseas de diverso origen. Su primera campaña publicitaria de distribución en Alemania, se dirigió especialmente a la epidemia de gripe de ese año (de hecho se comercializó, junto con otros componentes, con el nombre de Grippex®)(2). La pandemia de gripe de 1957-1958 fue una de las más intensas y mortíferas tras la de 1918; también conocida como gripe asiática (referencia en web, CDC).
Desde los años 20 y hasta mediados los 50, el mercado de los sedantes, ansiolíticos e hipnóticos estaba dominado por los barbitúricos, muy utilizados, pero con una elevada capacidad adictiva y un rango terapéutico estrecho. Los barbitúricos eran muy conocidos, además, por su uso para el suicidio (casos notables fueron el del escritor Stephan Zweig y su mujer, en 1942; posteriormente, Marilyn Monroe en 1962). Grünenthal comercializó en 1957 el Contergan®, asegurando que no era adictivo, que no tenía efectos tóxicos incluso con ingestas elevadas con intento infructuoso de suicidio, y que no tenía efectos adversos. Entonces en esa década, en el mercado de los sedantes se introdujeron en clínica: en 1954, el meprobamato (Dapaz® y otras marcas); en 1957, la talidomida; y, en 1960, se introduciría la primera benzodiacepina, el clordiazepóxido (Librium®)(3).
La promoción de la talidomida por parte de la compañía alemana, consiguió rápidamente un enorme éxito comercial. Incluyó anuncios en prensa, distribución publicitaria a médicos y otros recursos. Hay estimaciones de que en Alemania, hacia 1959, había hasta un millón de consumidores habituales del fármaco. En algunos estados alemanes se vendía sin receta. A partir del 14 de abril de 1958, Distillers Biochemicals Ltd, una industria escocesa de bebidas y de farmacia-bioquímica, tras firmar un contrato con Grünenthal, comenzó a producir la talidomida y a distribuirla en Gran Bretaña y Australia, con el nombre de Distaval®. Distillers era muy conocida. Desde 1942 operaba en su planta de Speke (Reino Unido), que fue de las dos primeras fábricas de Europa en producir penicilina.
Grünenthal había realizado experimentos con monos, perros y conejos, que recibieron el medicamento durante varias semanas, así como con roedores embarazadas. Posteriormente, se vio que las dosis habían sido muy altas y, además, fuera del periodo teratogénico, de la “fase sensible”. También se vería, años después, que los roedores tenían menos sensibilidad a los efectos teratogénicos de la talidomida(4). Entonces, en Alemania, no se realizaba un control estatal de la investigación con fármacos. Precisamente, no se exigiría el control estatal en dicho país hasta después de 1961.
Más de 50 medicamentos en el mundo contenían en su composición talidomida. Se comercializaría bajo diferentes denominaciones: Isomin® en Japón, Softenon® en otros países de Europa, y también otros nombres: Asmaval®, Tensival®, Valgis® y Valgraine®(2). En muy pocos años llegó a ser el tercer medicamento en ventas del mundo. Si bien, no se autorizó en algunos países, concretamente en la URSS, EE.UU. y Francia, por la detección de neuropatía periférica como efecto indeseable. En España se comercializó formando parte de medicamentos con varios principios activos, entre ellos: Imidan®, Varilal®, Softenon® y Notosediv®.
Desde finales de 1959, empezaron a surgir quejas de efectos secundarios con la talidomida del tipo polineuritis, con parestesias en piernas y manos tras la ingesta durante meses, con afectación sensorial y motora(5) y, también, trastornos gastrointestinales.
Tragedia de la talidomida. Síndrome de talidomida
A finales de los años cincuenta y principios de los sesenta, en Alemania, los obstetras y, sobre todo, los pediatras, observaron un aumento dramático de la incidencia de recién nacidos con extremidades acortadas y malformadas, a veces, asociadas a otras alteraciones, especialmente de la región craneal, pero sin sospechar, inicialmente, la causa(6,7). Ya, en una reunión de una sociedad pediátrica alemana, en octubre de 1960, Kosenow y Pfeiffer comunicaron dos casos de niños nacidos con alteraciones óseas graves y otras deformidades(1,2). Uno de los primeros en llamar la atención sobre el elevado número de casos de este “nuevo” síndrome, fue el profesor de Pediatría Hans Rudolf Wiedemann (1915-2016), siendo director del Krefeld Children’s Hospital. En 1961 sería nombrado catedrático de Pediatría de la universidad de Kiel. En 1960 observó en su entorno, que de 13 recién nacidos con malformaciones, nueve de ellos tenían amelia o focomelia. Wiedemann, en una búsqueda retrospectiva, encontró hasta 100 casos en niños nacidos desde 1959. Ante esta perspectiva, escribió un artículo en el que afirmaba que esas malformaciones debían ser producidas por una causa exógena, pero no identificó una sospecha definida. La publicación apareció el 16 de septiembre de 1961 y fue la primera llamada de atención publicada sobre lo que luego se llamaría “la catástrofe de la talidomida”(8,9).
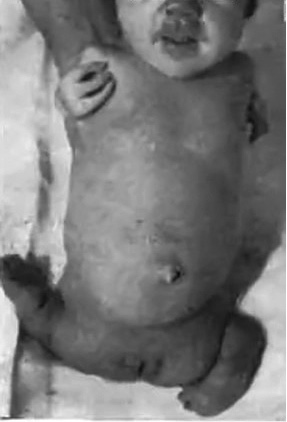
En las reuniones de radiología de la Clínica Universitaria de Pediatría de Hamburgo-Eppendorf, se presentaban los casos significativos, entre otros, por parte de Claus Knapp Boetticher (1928-). Allí trabajaban Lenz y Knapp. Widukind Lenz (1919-1995) había visto el primer caso de malformaciones de extremidades en junio de 1961(6,7). Véase la figura 1 para un caso, español de 1962(10). Entre 1952 y 1961, Lenz trabajó en el Departamento de Pediatría de la Universidad de Hamburgo (Alemania). Allí era consultor de alteraciones perinatales. Revisaron los casos previos. En efecto, parecía que se trataba de algo completamente inusual, aunque no existía ningún registro de malformaciones congénitas en Alemania, ni estadísticas antiguas.
Figura 1. Caso de una malformación del tipo focomelia. La imagen está tomada de un artículo de casos español publicado en 1962(10).
En las investigaciones actuales, se sabe que la frecuencia global de defectos congénitos se sitúa, en todos los países y grupos humanos, entre el 2 y el 3% en el momento del nacimiento(11), aunque puede ser menor de un 1%, si hay detección prenatal y posibilidad de una interrupción voluntaria del embarazo. Las cifras se acercan incluso hasta un 6-7% de los nacidos, si se incluyen otras alteraciones que no son detectables, sino posteriormente al periodo neonatal. La gran mayoría de los defectos congénitos, individualmente, por su baja frecuencia de presentación, cumplen la definición actual de enfermedad rara.
Síndrome de focomelia. Las alteraciones al nacer más evidentes que observaron los médicos alemanes y, también, Lenz y Knapp, consistían en alteraciones en las extremidades, con el acortamiento o desaparición de los elementos proximales, pero con persistencia de los dedos y las manos. Se le puso el estereotipado nombre de focomelia, por su similitud con la foca, el mamífero marino. También, se presentaban otras anomalías de: orejas, oídos, órganos internos, genitales y corazón. Se estimaron que más de 10.000 niños en el mundo nacieron con malformaciones(6,7,12,13), aunque la cifra exacta no ha sido determinada.
En el servicio de Pediatría de Hamburgo, dirigido por K.H. Schäfer, Lenz y Knapp propusieron investigar el origen, con un estudio epidemiológico y un cuestionario con preguntas a los padres de los casos nacidos. Hicieron un formulario de recogida de datos como: lugar de residencia de Hamburgo, lo que comían, medicamentos (los más habituales), etc. La mayoría eran preguntas abiertas para no forzar la respuesta en este estudio retrospectivo. Lenz y Knapp fueron juntos a las entrevistas(12) (Fig. 2).
 |
 |
|---|---|
Figura 2. Widukind Lenz, a la izquierda de la imagen, en Alsdorf-Alemania, en un juicio a la talidomida en 1968. Claus Knapp, a la derecha, a finales de los años 50(2).
En los primeros días de recogida de datos, un padre, psicólogo, les dijo que lo único que había tomado su mujer era talidomida. No se había preguntado previamente por este fármaco. Rehicieron el formulario de preguntas y repitieron la entrevista, continuando con otros padres. Resultó que la mayoría de las afectas lo habían tomado, y todas podían haberlo hecho, teniendo el medicamento en su casa o en casa de la vecina. A veces, se tomaba de una forma no controlada (incluso se disponía del fármaco en platos en el lugar de trabajo, en la fábrica). A través de la encuesta, en menos de dos semanas (concretamente, el 11 noviembre de ese 1961), Lenz y Knapp ya tuvieron la firme sospecha de que la talidomida era la implicada si se había administrado entre la 3ª y la 6ª semana de gestación (días 34-50 después de la fecha de última regla), que denominaron “fase o periodo sensible”(6,7,12). La mortalidad asociada se consideró hasta del 40% durante el primer año de vida, por la asociación a otras malformaciones viscerales(7,14).
Lenz comunicó telefónicamente el 13 de noviembre de ese año estas observaciones al fabricante –Grünenthal–, y les recomendó la retirada del agente, con el conocimiento del servicio de Pediatría de Hamburgo. Fueron necesarios diez días más de intensas discusiones con los representantes de la empresa productora, de las autoridades sanitarias y de los expertos, antes de que el medicamento fuera retirado. Se consiguió, en gran parte, por presión de la opinión pública, debido a los informes que se filtraron a la prensa esos días. Además, Lenz presentó preliminarmente el estudio en una reunión de la sociedad local de Pediatría en Dusseldorf el 19 de noviembre(6,7,15).
Al mismo tiempo, en noviembre de 1961, Distillers Ltd de Londres, recibió información desde Australia de los posibles efectos teratogénicos de la talidomida, por el estudio de William McBride (1927-2018)(16). La retirada del medicamento determinó en unos meses, la caída drástica de casos nuevos, hasta su desaparición.
En la primavera de 1961, William McBride, un ginecólogo-obstetra australiano que trabajaba en el Crown Street Hospital (Sídney), asistió al nacimiento de tres niños con focomelia, un defecto al nacimiento muy raro. Tras un tiempo revisando los historiales médicos de las embarazadas, sospechó que la talidomida era la única causa común asociada de esos nacimientos. McBride era el único médico que la utilizaba en el hospital cuando surgieron los problemas, lo que permitió identificar rápidamente su posible relación con los defectos de nacimiento. De hecho, ese año, un representante de la empresa Distillers, le había propuesto probar el fármaco en algunas pacientes. Llamó a los proveedores de su ciudad en Australia, de Distillers Ltd, y les expuso sus preocupaciones. Se retiró de la farmacia de su hospital. Envió en julio de 1961, una carta al editor al The Lancet(16,17) pero, inicialmente, no fue aceptada. Intentó verificar la capacidad teratogénica con animales, pero no lo logró, pues en su hospital no había los medios adecuados. Tras insistir de nuevo a Distillers de Australia, esta solo lo comunicaría en noviembre a la central de Gran Bretaña.
Así pues, el 27 de noviembre Grünenthal retiró la talidomida del mercado en Alemania, y en diciembre ocurrió lo mismo en Gran Bretaña. Además, en ese mes, tuvo lugar la publicación en The Lancet, de la carta de McBride, que contaba con tres párrafos solo y con la nota editorial al pie, en la que podía leerse que la compañía había retirado la venta del fármaco hasta que se realizaran más investigaciones(17). En algunos países como: Bélgica, Brasil, Canadá, Italia y Japón, la talidomida siguió vendiéndose durante varios meses(18,19). En España se retiró de la venta en enero de 1963.
Fue una actuación decidida y rápida de Lenz, al que se le tenía como un científico muy cauto y crítico(15,18,19). Sin embargo, una vez que este se convenció de que los daños teratogénicos eran debidos a la talidomida, sabía que cada día que dudaba, más fetos podían resultar perjudicados. Lenz intervino decisivamente en la retirada del fármaco: la presión directa a la farmacéutica; la presentación de los estudios científicos en Reuniones científicas de Pediatría en Alemania; la publicación en la prensa científica; y la presión de los medios de comunicación en Alemania, Inglaterra y Estados Unidos. Knapp se trasladó en 1962 a vivir a España, colaboró en publicaciones con Lenz y presentó la alerta en España, en congresos y en revistas científicas(12) (Fig. 3).
Figura 3. Imagen propiedad del primer autor de este artículo. Primera página de una separata del artículo pionero de Lenz y Knapp(20), alertando sobre la embriopatía por talidomida. Con dedicatoria del propio profesor Knapp.
Algún autor atribuyó cierto retraso en comunicar de forma eficaz el efecto teratogénico de la talidomida, por: “el mal manejo de su original de una revista, por la dilación defensiva de los fabricantes, por la falta de instalaciones experimentales en su hospital, por contacto poco útil con un académico, y por la falta de comprensión de que la cooperación con experimentadores científicamente capacitados era necesaria, McBride no había conseguido hacer llegar su mensaje de advertencia con prontitud a la profesión médica”(21). Hay que tener en cuenta que alertó sobre un efecto adverso grave producido por un fármaco indicado por él mismo y que, con posterioridad a la publicación de The Lancet en diciembre de 1961, trabajó activamente para demostrar y difundir el efecto teratogénico de la talidomida(16) (Tabla I).
La tragedia de la talidomida no afectó a EE.UU.
La talidomida nunca fue aprobada en EE.UU. y, con ello, este país se libró de la tragedia.
En ello fue decisiva la aportación de Frances Oldham Kelsey (1914-2015), funcionaria-médico de la Administración de Alimentos y Medicamentos de EE.UU. (FDA). Había sido designada para evaluar la solicitud del laboratorio de aprobar la talidomida en ese país a principios de la década de 1960. Parecía una tarea fácil su aprobación, pues ya 20 países lo habían hecho, pero Kelsey exigió al laboratorio que aclarara aspectos de su farmacocinética y farmacodinámica, así como los mecanismos y el impacto de las reacciones adversas sobre la neuropatía inducida por talidomida, que empezaban a aparecer en el año 60 (referencia en web, Rodríguez)(4,5). A pesar de una extraordinaria presión ejercida por el patrocinador, Kelsey exigía más informes. Mientras el promotor atendía esta petición, la frecuencia cada vez mayor de informes de focomelia eclipsó cualquier preocupación relativa a la neuropatía (referencia en web, Rodríguez).
También entonces, en el primer semestre de 1962, Helen Broke Taussig (1898-1986) pionera cardióloga pediátrica en EE.UU., de gran prestigio, hizo una campaña para evitar la introducción de la talidomida en su país(22). Se dice que una de sus alumnas le alertó sobre las descripciones de malformaciones congénitas que se estaban produciendo en Alemania. A principios de 1962, Alois Beuren, de Gottingen (Alemania), informó a Taussig de que, en su país, había una epidemia de focomelia, seguramente causada por la administración de un fármaco durante el embarazo. Entonces, ella se trasladó a Europa y visitó, a lo largo de seis semanas, los principales centros médicos de Alemania e Inglaterra. Cuando regresó a los EE.UU., estaba plenamente convencida de que la talidomida había sido la causante. Desplegó todas sus influencias para que el gobierno tomara medidas, mostrando imágenes de los niños afectados que le había proporcionado W. Lenz en Hamburgo, y otros colegas que reconocieron el papel que había jugado la talidomida(23,24).
La opinión pública y la prensa americana vieron lo cerca que habían estado de una gran tragedia si no hubiera sido por la importancia del trabajo de Kelsey, que frenó durante meses la aprobación de la talidomida (referencia en web, Rodríguez). La historia debutó en la primera página de The Washington Post el 15 de julio de 1962, escrita por el reportero Morton Mintz. Vinieron, a continuación, una oleada de artículos de seguimiento sobre el control de fármacos en The New York Times, Saturday Review, Life y otros medios de comunicación de la época. Con esta presión, se modificó la Ley Federal de 1938 sobre medicamentos y cosméticos y se dictó la ley de 1962, que reforzó el control sobre la experimentación de medicamentos en seres humanos, se exigía el consentimiento informado y se cambió la regulación de nuevos fármacos. Las empresas debían notificar las reacciones adversas a los medicamentos. Kelsey estuvo presente en la creación de ambas leyes de salud pública. El 7 de agosto de 1962 recibió un galardón de manos del presidente de EE.UU. John F. Kennedy (Fig. 4), el President’s Distinguished Civilian Service Award (referencia en web, Rodríguez).
Figura 4. Noticia en la prensa española, Diario de Burgos. De avisos y noticias, 12 de agosto de 1962, año LXXII, nº 22102. Disponible en: https://prensahistorica.mcu.es/es/catalogo_imagenes/grupo.do?path=2000937445.
En 1975, la FDA elaboró la clasificación de medicamentos para su uso en el embarazo en 5 categorías de riesgo (establecido en orden creciente por las letras A, B, C, D o X), de acuerdo con la capacidad de teratogenicidad en función del tipo de estudios realizados y de la información disponible(14). Esta estratificación del riesgo fetal se mantuvo hasta el año 2010. La FDA modificó este reglamento y decidió eliminar el sistema de categorías A, B, C, D y X y reemplazarlo por un resumen de los riesgos de usar el medicamento durante el embarazo y la lactancia, aportando los datos que lo respaldan e información relevante para facilitar la prescripción y el asesoramiento a las mujeres.
Las agencias reguladoras han avanzado en la mejora de las estrategias para incrementar el conocimiento del uso racional de medicamentos en la gestante y la mujer lactante pero, todavía, se necesita mucho más. Hay que reconocer la importancia de la colaboración internacional. La salud del niño comienza con la salud de la madre(25). La FDA está comprometida con la protección y la salud pública de la mujer embarazada, asegurando la disponibilidad de terapias seguras y eficaces. También, se esfuerza por dar información oportuna, precisa y con la base científica necesaria para utilizar los medicamentos para mantener y mejorar su salud(26).
Mecanismo de acción de la talidomida. Farmacocinética
Desde los años 60 se ha investigado mucho sobre el mecanismo íntimo de acción de la talidomida, sus efectos y propiedades(2,4). No se conoce todavía todo acerca de cómo se produce la teratogénesis y otros efectos. También se ha visto que la talidomida administrada durante la gestación, más allá del “periodo sensible”, puede afectar al desarrollo y maduración cerebral, en defectos asociados a epilepsia y autismo(4). Con posterioridad a la retirada del medicamento, se objetivó que la talidomida, como otras muchas sustancias en biología, es una mezcla racémica de isómeros ópticos, que son especulares (un enantiómero dextrógiro-D y otro levógiro-L). Solo el enantiómero-L es teratógeno, mientras que el D es el que actúa con efecto sedante(11,27). Sin embargo, en condiciones fisiológicas, el organismo transforma uno en el otro; por lo que, aunque se hubiera administrado solo la D-talidomida, en el suero se encontrarían ambos y no se hubiera evitado el efecto teratogénico.
Se puede pensar que las investigaciones previas a la comercialización de la talidomida, desde el punto de vista actual, no eran suficientemente completas. Sin embargo, esas correspondían al estándar de entonces. Una ulterior revisión de los trabajos experimentales realizados con este fármaco, reveló que se habían publicado y malinterpretado datos toxicológicos insuficientes y erróneos.
En los años 90 se propuso que la talidomida podía ser mutagénica y dar lugar a herencia transmisible(28). En primer lugar, sus efectos teratogénicos pueden ser fenocopias de síndromes no fácilmente distinguibles, como el de Holt-Oram. Estudios epidemiológicos posteriores han demostrado que no es mutagénica(4).
La tecnología actual de nanopartículas a las que se fija un fármaco, permite estudiar sus dianas de acción(2). Esto ha llevado a caracterizar una diana intracelular responsable del efecto teratogénico y anticancerígeno de la talidomida. Esta diana se denomina cereblon. La forma L liga más firmemente a cereblon y actuaría aumentando el efecto teratogénico y anticancerígeno. Cereblon forma un complejo de ubiquitina ligasa E3 con la proteína de unión al ADN dañado, que reduciría los niveles de ciertos factores de crecimiento de fibroblastos que regulan el crecimiento de las extremidades y otros grupos celulares(2).
De hecho, la talidomida tiene actividad terapéutica favorable para muy distintos trastornos, además de ser sedante no barbitúrico. Es inhibidor del factor de necrosis tumoral alfa (TNF), produce una degradación del ARN mensajero, lo que conlleva que este fármaco tenga efectos antiinflamatorios e inmunomoduladores. Es inhibidor de la angiogénesis. Disminuye la fagocitosis monocitaria y estimula las células T. Influye sobre la quimiotaxis leucocitaria(2,27).
En 1965 se encontró accidentalmente, que tenía eficacia para el tratamiento de la lepra, concretamente en el eritema nodoso leproso. El hallazgo fue realizado por J. Sheskin, que lo indicó como sedante y calmante en un paciente con lepra y objetivó una gran mejoría de su proceso desde el día siguiente de administración(4,11). En 1979 se empezó a utilizar para el síndrome de Behçet, desde 1988 para la enfermedad de injerto contra huésped y en determinadas patologías asociadas al SIDA. La talidomida y sus análogos, lenalidomide y pomalidomide, tienen efectos similares, pero también teratogénicos. En 1994, por sus propiedades antiangiogénicas, se empezó a utilizar en cánceres, como el mieloma múltiple. Se está utilizando con eficacia terapéutica también para trastornos como: enfermedad de Crohn, psoriasis, artritis reumatoide, carcinoma hepatocelular y otros tipos de cáncer, epilepsia refractaria y otras enfermedades cutáneas.
Sin embargo, solo pronunciar el nombre de talidomida genera alarma. Ello dificulta la utilización por sus efectos terapéuticos para muchas enfermedades graves. Su uso en España es solo como terapia alternativa, no en primera opción, de forma intrahospitalaria y bajo normas muy estrictas(11,14).
Diagnóstico diferencial del síndrome de talidomida
La embriopatía por talidomida puede no ser fácil de distinguir de otras enfermedades con defectos al nacer(4,11), y que no tienen relación con la ingesta de dicho fármaco. Véase:
• Mutaciones de los genes SALL4 (causa el síndrome de Okihiro) o TBX5 (causa el síndrome de Holt-Oram). Ambos genes se expresan en las extremidades y sus mutaciones determinan una deformidad y reducción en las extremidades.
• Mutación de los genes ESCO2 (Establishment of Sister Chromatid Cohesion 2). Causa el síndrome de Roberts o “pseudotalidomida” con tetrafocomelia y alteraciones faciales y en órganos internos. También por mutación del ESCO2 estaría el SC-focomelia.
• Otros síndromes: anomalía de Poland, Brachmann-de Lange, fémur-peroné-cúbito, hipoglosia-hipodactilia, trombopenia-tetrafocomelia/aplasia radial (TAR) y otros.
En la revisión de Martínez Frías ML(11), se hace un estudio comparativo y se concluye empíricamente, con los datos del ECEMC, que no todos los tipos de malformaciones observadas en los niños expuestos prenatalmente a talidomida son atribuibles a dicho fármaco.
Talidomida en España
Las primeras alertas en medios científicos pediátricos sobre la embriopatía por talidomida en España, se publicaron en 1962(10,12).
A la Revista Española de Pediatría, Carbonell et al., remitieron en fecha 5 de julio de 1962, dos casos de focomelia, con una descripción clínica excelente. El primer paciente había ingresado para un estudio pediátrico en el Instituto de Puericultura de la Casa Provincial de Maternidad de Barcelona en junio de dicho año. Constaba que la madre había tomado Softenon® para el insomnio durante el primer trimestre de la gestación. El otro caso fue un ingreso de la calle en mayo de 1962, en la inclusa de dicho Instituto de Puericultura, por lo que sus antecedentes gestacionales no se podían conocer.
En el II Congreso de la Sociedad de Pediatría de Naciones Latinas, en septiembre de 1962, en Sevilla, presidido por el profesor Suárez, tuvo lugar una conferencia de Knapp sobre la embriopatía debida a talidomida, conferencia dada para alertar a los pediatras de lengua española. En Sevilla, Knapp y Lenz reclamaron además que se creara un registro de malformaciones. Se hizo eco de esta noticia la prensa, ABC (23 de septiembre de 1962, p. 95). La conferencia al congreso fue publicada en la Revista Española de Pediatría en 1963(12).
Para hacer una aproximación al impacto de este tema en la población general, hemos realizado un estudio en la prensa histórica digitalizada: hemeroteca de la BNE, hemeroteca de prensa histórica y de ABC y La Vanguardia.
Las primeras noticias en ABC aparecieron en el ABC de Sevilla (“sobre la talidomida en Inglaterra”; 19 de julio de 1962, p. 18) y en el ABC de Madrid (9 de agosto de 1962, p. 29), citando a Jesús García Orcoyen (1903-1988), Director general de Sanidad, que manifestó, oficialmente, que entonces solo había dos casos en España.
En el Diario de Burgos, se muestra el impacto en EE.UU. a través de una foto de Kelsey (Fig. 4).
El profesor Carlos del Castillo publicó una revisión del impacto de la talidomida en La Vanguardia y en ABC. La Vanguardia ofreció noticias sobre ella a partir del 3 agosto de 1962 en la página 11(27). En el artículo se detallan los primeros casos de niños con malformaciones en Irlanda. En La Vanguardia, el 18 de septiembre de 1962, en la página 14, se divulgó una lista con los medicamentos que contenían esta sustancia en cada país.
El Dr. J. Álvarez Sierra, colaborador sanitario de ABC, expuso y comentó la noticia sobre la mención de la talidomida y su embriopatía asociada, en el Congreso de Pediatría de septiembre de 1962, celebrado en Sevilla (ABC, 23 de septiembre de 1962, p. 95).
En La Vanguardia, bajo el título: “mayor control del Gobierno en la producción y expendición de fármacos en los Estados Unidos de América”, reflejaba esta realidad y, además, incluía una alusión a la necesidad de realizar tal tarea legislativa en España (La Vanguardia, 5 de octubre de 1962, p. 21).
El llamado “Caso de Lieja” ocurrido en Bélgica, desde 1961 se abrió un importante debate ético y moral a raíz de la absolución judicial (“Fallo de Lieja”) a los padres en un caso de eutanasia realizada sobre una recién nacida afectada con malformaciones graves (La Vanguardia, 13 de octubre de 1962, p. 16; y ABC, Madrid, 11 de noviembre de 1962, p. 120).
Del Castillo concluye, subjetivamente, sobre las noticias de prensa de ABC y La Vanguardia, subrayando que ABC trató el tema de manera bastante superficial y poco crítica. Sus redactores lo enfocaron más desde un punto de vista ético y religioso, mientras que en La Vanguardia lo abordaron desde una perspectiva más estadística y médica(27). La prensa contribuyó a dar a conocer el problema.
No hay datos oficiales sobre los niños que nacieron en España con malformaciones fruto de la talidomida. Sabemos que medicamentos con este principio activo estuvieron accesibles en el mercado español desde 1957 hasta que fueron retirados en 1963(27) (referencia en web Riquelme).
Durante el Franquismo, oficialmente, se ocultó en parte el tema, y con la Democracia tampoco los diversos gobiernos han solucionado el reconocimiento e indemnización a los afectados, que padecen graves secuelas desde hace más de 60 años. En la actualidad, solo 24 personas han recibido algún tipo de reconocimiento institucional e indemnización.
En 2004 se fundó la Asociación de Víctimas de la Talidomida en España (AVITE)(14). Entonces se dio comienzo, de forma institucional-asociativa, a la lucha de estas personas por el reconocimiento sanitario de su situación (disponible en: https://www.avite.org/). El presidente y el vicepresidente de la AVITE son José Riquelme y Rafael Basterrechea. En España, inicialmente, AVITE reconocía 184 casos(14). Se calcula que son muchos más.
AVITE realizó una entrevista a Claus Knapp, donde se ofrece una valiosa información biográfica y sobre el descubrimiento de la embriopatía por talidomida, está disponible en redes (referencia en web, Riquelme-AVITE) (Fig. 5).
Figura 5. Knapp en 2013, en el centro, entrevistado por AVITE (captura de pantalla, referencia en web, Riquelme-AVITE).
El primer autor de este artículo tuvo oportunidad de entrevistar al profesor Knapp en su casa, en 2014. De las investigaciones de esa fecha, surgió una comunicación en forma de póster al Congreso de la AEP de Bilbao de 2015, resaltando la presencia de un español en el descubrimiento de la embriopatía por talidomida(29).
Aprendizaje y consecuencias del efecto teratogénico de la talidomida y su investigación
Algunas consecuencias de la embriopatía por talidomida, su conocimiento e investigación, se comentan en la tabla II.
Como registro de malformaciones en España está el ECEMC (Estudio Colaborativo Español de Malformaciones Congénitas). Se trata de una red temática, multidisciplinar y cooperativa. Fue creado en 1976 por la profesora María Luisa Martínez-Frías. Es de adhesión voluntaria por parte de las maternidades. Cubre más de un 20% de los partos en España. El grupo del ECEMC, desde 1991, mantiene dos servicios de información sobre teratógenos, dirigidos a profesionales sanitarios y a población general (SITTE-Servicio de Información Telefónica sobre Teratógenos) y otro para la población general (SITE-Servicio de Información Telefónica para la Embarazada). Información en: https://www.isciii.es.
En el desarrollo de nuevos fármacos tiene gran importancia la investigación en animales. Los antiviviseccionistas se quisieron apropiar de la propaganda del hecho de que no se descubriera el efecto teratogénico en la investigación animal inicial. Esto se citó ampliamente en cartas a la prensa y en debates en Internet. Hay que recordar constantemente al público hechos como estos, antes de que se vean inundados por una retórica errónea(1).
Epílogo
Grünenthal tardó más de 50 años en pedir oficialmente disculpas a las víctimas de la talidomida y a sus familias. Lo hizo el 31 de agosto de 2012, a través de Harald Stock, jefe ejecutivo.
La excelente monografía de Hinoshita y el Research Group de Japón, aporta una guía de apoyo a los pacientes supervivientes con afectación por la talidomida, con las últimas investigaciones en diagnóstico y tratamiento rehabilitador. Ofrece URL y direcciones de información en web, en diversos países del mundo sobre el tema(2).
Respecto de los pioneros descubridores de la embriopatía queremos concluir lo siguiente:
• Claus Knapp. Creemos que ha tenido poco reconocimiento oficial, como se puede ver en la tabla II. No ha tenido apenas trascendencia histórica su investigación pionera junto con Lenz. En España, en parte por su apellido alemán, ni se ha mencionado en revisiones exhaustivas sobre el tema de la talidomida. Es un pediatra y radiólogo pionero en muchas de las actividades que ha desarrollado.
• William McBride. Sus estudios subrayan la importancia de publicar y de hacer difusión pública de efectos adversos de las terapias médicas, aunque sea el propio clínico el implicado inicialmente en ellos.
• Widukind Lenz. Es considerado como un eminente científico y médico humanitario. Su vida cambió con la talidomida. Dedicó muchos esfuerzos toda su vida a las víctimas. Él decía de sí mismo que se consideraba más un estudioso (académico, erudito) que un científico investigador(18,19), a pesar de ser un pionero en genética humana.
En el discurso que pronunció con motivo de su 70º cumpleaños, dijo: “Estoy agradecido… de que, a lo largo de mi vida, haya sido capaz de recibir y dar confianza… La confianza no excluye la capacidad de criticar… Es la base de toda confianza”. No podemos estar más de acuerdo.
Bibliografía
1. Botting JH. The history of thalidomide. In: Botting RM, editor. Animals and medicine: the contribution of animal experiments to the control of disease. London: OpenBook Publishers; 2015. p. 183-98. Disponible en: https://www.jstor.org/stable/j.ctt15m7ng5.23?seq=5.
2. Hinoshita F. 2020 Guide for the management of thalidomide embryopathy. Center Hospital of the National Center for Global Health and Medicine (NCGM). Tokyo, Japan. 2021. Disponible en: http://thalidomide-embryopathy.com/common/data/pdf/guide_2020_en.pdf.
3. López-Muñoz F, Álamo C, Cuenca E. La “década de oro” de la psicofarmacología (1950-1960): trascendencia histórica de la introducción clínica de los psicofármacos clásicos. Psiquiatría.com. 2000; 4, 25 páginas. Disponible en: https://psiquiatria.com/bibliopsiquis/la-decada-de-oro-de-la-psicofarmacologia-1950-1960-trascendencia-historica-de-la-introduccion-clinica-de-los-psicofarmacos-clasicos.
4. Vargesson N. Thalidomide Embryopathy: An Enigmatic Challenge. ISRN Developmental Biology. 2013; ID 241016, 18 páginas. Disponible en: http://dx.doi.org/10.1155/2013/241016.
5. Florence AL. Is thalidomide to blame? Br Med J. 1960; 2: 1954.
6. Lenz W. La experiencia de la Talidomida. Bol ECEMC Rev Dismor Epidemiol. 1993; 4: 11-20.
7. Lenz W. A short history of thalidomide embryopathy. Teratology. 1988; 38: 203 15.
8. Wiedemann HR. Hinweis auf eine derzeitige Häufung hypo- und aplastischer Fehlbildungen der Gliedmassen. Med Welt. 1961; 37: 1863-66.
9. García Nieto VM. ¿Quién fue Wiedemann? Humanidades en Pediatría. Epónimos en Pediatría. Canar Ped. 2008; 32: 141-3.
10. Carbonell Juanico M, Balanzó Cabot E, Dexeus Trias de Bes JM. Consideraciones sobre dos casos de focomelia. Embriopatía por talidomida. Rev Esp Pediatr; 1962: p. 697-715.
11. Martínez-Frías ML. Talidomida: 50 años después. Med Clin (Barc). 2012; 139: 25-32.
12. Knapp K, Lenz W. Embriopatía por talidomida. Rev Esp Pediatr. 1963; 19: 39-45.
13. Shah RR. Importance of Publishing Adverse Drug Reaction Case Reports: Promoting Public Health and Advancing Pharmacology and Therapeutics. Drug Saf Case Rep. 2017; 4: 1-10.
14. Papaseit E, García-Algar O, Farré M. Talidomida: una historia inacabada. An Esp. 2013; 78: 283-87.
15. Opitz JM, Wiedemann HR. In Memoriam: Widukind Lenz, 1919-1995. American Journal of Medical Genetics. 1996; 65: 142-5.
16. Genzlinger N. William McBride, Who Warned About Thalidomide, Dies at 91. Obituaries. New York Times. 2018. Disponible en: https://www.nytimes.com/2018/07/15/obituaries/william-mcbride-who-warned-about-thalidomide-dies-at-91.html.
17. McBride WG. Thalidomide and congenital abnormalities. Letter to editor. The Lancet. 1961; 278: 1358.
18. Vogel F. Widukind Lenz-An Encomium. Am J Med Genet. 1990; 37: 352-5.
19. Vogel F. Widukind Lenz (February 4, 1919-February 25,1995). Eur J Hum Genet. 1995; 3: 384-7.
20. Lenz W, Knapp K. Die thalidomid-embryopathie. Deutsche Medizinische Wochenschrift, Stuttgart. 1962; 87: 1232-42.
21. Humphrey GF. Scientific fraud: The McBride case. Judgment. Medicine, Science and the Law. 1994; 34: 299-306.
22. García Nieto VM. ¿Quién fue Taussig? Humanidades en Pediatría. Epónimos en Pediatría. Can Ped. 2008; 32: 217-20.
23. Taussig HB. A study of the German outbreak of phocomelia. The thalidomide syndrome. JAMA. 1962; 180: 1106-14.
24. Taussig HB. Phocomelia and thalidomide. Am J Obstet Gynecol. 1962; 84: 979. Carta a Editor de HB Taussig 1962. Disponible en: https://www.ajog.org/article/0002-9378(62)90079-0/pdf.
25. Nooney J, Thor S, de Vries C, Clements J, Sahin L, Hua W, et al. Assuring Access to Safe Medicines in Pregnancy and Breastfeeding. Clin. Pharmacol. Ther. 2021; 110: 941-45.
26. Wesley BD, Sewell CA, Chang CY, Hatfield KP, Nguyen ChP. Prescription medications for use in pregnancy-perspective from the US Food and Drug Administration. Am J Obst Gynecol. 2021; 225: 21-31.
27. Del Castillo Rodríguez C, Delia Motorga E, Lozano Esteban MJ, Basante Pol R. La talidomida en España según ABC y La Vanguardia Española (1957-1963). En: Moreno Toral E, Ramos Carrillo A, González Bueno A (eds.). Ciencia y profesión: el farmacéutico en la historia. Sevilla, Universidad Internacional de Andalucía, 2018. ISBN 978-84-7993-338-8. Disponible: en: https://dspace.unia.es/bitstream/handle/10334/5463/21_La_talidomida.pdf.
28. McBride WG. Thalidomide may be a mutagen. BMJ. 1994; 308: 1635.
29. Zafra Anta MA, Knapp Boetticher C, García Nieto VM, Gorrotxategi Gorrotxategi P, Ponte Hernando F, De Arana Amurrio JI. Historia del descubrimiento de la asociación embriopatía y talidomida. Knapp, un español codescubridor. Libro del Congreso de la AEP, Bilbao; 2015. p. 698-9.
Referencias en web
– CDC. 1957-1958 Pandemic (H2N2 virus). Última revisión el 2 de febrero de 2019. Disponible en: https://www.cdc.gov/flu/pandemic-resources/1957-1958-pandemic.html.
– Historia del laboratorio Grünenthal. Disponible en: https://www.grunenthal.com/en/about-us/history.
– Noticia de Knapp. Lección magistral en Montepríncipe en 2019. Foto con Alfonso Delgado. Disponible en: https://www.hmhospitales.com/prensa/noticias/lecci%C3%B3n-magistral-del-dr-claus-knapp-en-hm-montepr%C3%ADncipe.
– El País. Entrevista a Knapp. 2013. Disponible en: https://elpais.com/sociedad/2013/10/18/actualidad/1382124838_004545.html.
– Riquelme J. Entrevista a Klauss Knapp, realizada el 28 junio de 2013, Madrid; subida a Youtube el 21 de octubre de 2013. Avite.org. Colaboración con BertoStudio y Antonio Fidel Madrid. Disponible en: https://www.youtube.com/watch?v=kcWKH1QC9Wg&ab_channel=AviteTV.
– Rodríguez M. Frances Oldham Kelsey (1914-2015). La heroína que con un “no” salvó a una generación de bebés de una tragedia en EE.UU. (y cómo su legado está más vigente que nunca). BBC News Mundo. 2020. Disponible en: https://www.bbc.com/mundo/noticias-53240752.






 Adolescence. Epidemiological situation. Most frequent pathology. Transition
Adolescence. Epidemiological situation. Most frequent pathology. Transition 