|
 |
V. Martínez Suárez*, J. Dalmau Serra**
*Servicio de Salud del Principado de Asturias. Universidad de Oviedo. **Ex Coordinador del Comité de Nutrición de la AEP
Pediatr Integral 2020; XXIV (6): 351 – 355
Hipovitaminosis D, ¿una epidemia real?
“ Con los valores de corte propuestos los estudios provenientes de diferentes países han estimado que el estado deficitario está bastante extendido tanto niños como adultos de todas las edades. Pero solo en los próximos años tendremos una valoración más fiable y que nos ayude a dar una respuesta más precisa a la pregunta que nos hemos planteado”
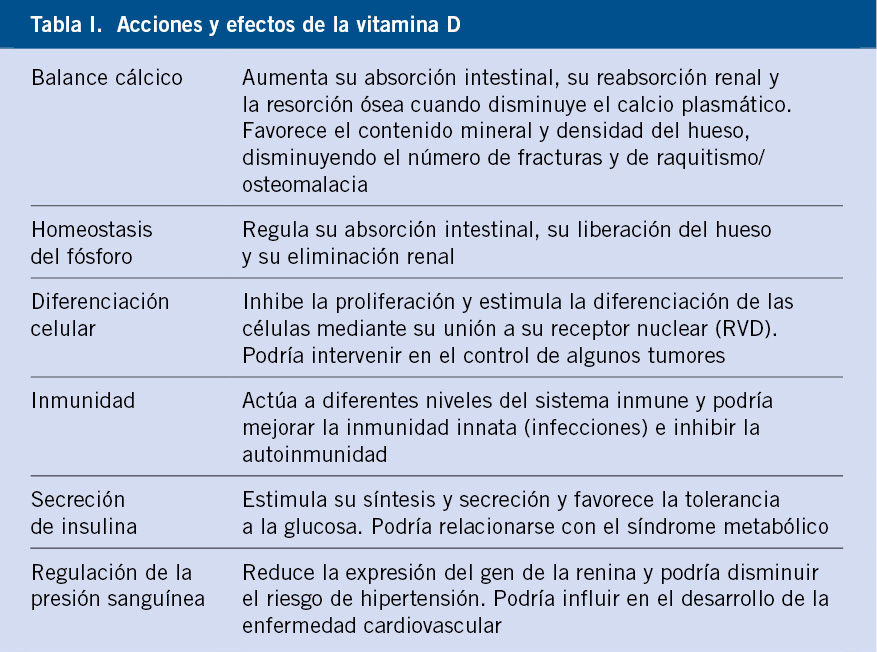
El papel de la vitamina D (VD) en la mineralización esquelética fue la primera de sus funciones reconocidas. Su principal efecto sobre la salud ósea consiste en mantener el balance positivo de calcio necesario para dar contenido mineral al hueso en formación y para el desarrollo de la placa de crecimiento. En situación de deficiencia el hiperparatiroidismo secundario favorecerá una liberación de calcio esquelético para mantener sus niveles séricos, lo que en el niño se traduce en el desarrollo de raquitismo y osteomalacia. Además, dado que el pico de masa ósea alcanzado en edades tempranas de la vida se acepta como un predictor de riesgo de osteoporosis en la edad adulta, optimizar desde la infancia los factores modificables que puedan afectar a la masa ósea –incluido el estado de VD– se considera un objetivo de salud(1). Pero aparte de sus funciones en el metabolismo del hueso el nivel de esta vitamina puede influir en el desarrollo posterior de algunas enfermedades crónicas y modificar el riesgo de padecerlas. No obstante, existe acuerdo general sobre la necesidad de nuevos estudios para determinar la importancia de estas otras funciones(2).
La definición de su estado deficitario, sus requerimientos en relación con objetivos de salud, evitar deficiencias mediante una nutrición correcta o suplementación adecuada, la atención a las condiciones de riesgo de hipovitaminosis y el diagnóstico precoz de los estados carenciales, son temas que han concitado gran atención en los últimos años, lo que se ha traducido en un gran auge de publicaciones médicas sobre el tema, un rápido incremento de los estudios solicitados sobre el estado de VD y en reevaluaciones de las recomendaciones dietéticas. También en el ámbito comercial ha tenido lugar un aumento en las ventas de suplementos y de nuevos productos alimenticios fortificados.
Síntesis y efectos de la vitamina D
La vitamina D2 (ergocalciferol) se obtiene de algunos vegetales mientras que la vitamina D3 (colecalciferol) se sintetiza principalmente en la piel. El 7-dehidrocolesterol (provitamina D; presente en los estratos basal y espinoso de la epidermis) se convierte en previtamina D tras la exposición a la radiación ultravioleta B (UV-B), luego se isomeriza a colecalciferol y es transportada por la proteína de unión a la vitamina D (DBP) al hígado, donde la vitamina D 25-hidroxilasa microsómica cataliza su conversión en hidroxivitamina D (25-OH VD, calcidiol o calcifediol), la forma de almacenamiento y la molécula que se cuantifica cuando solicitamos niveles de VD. Esta 25-OH VD es transportada al riñón por la DBP para adquirir un nuevo radical hidroxilo por acción de la 25-hidroxivitamina D 1-α hidroxilasa citocrómica, convirtiéndose en 1,25 dihidroxivitamina D [1,25 (OH)2 VD] o calcitriol, la forma activa de VD.
La síntesis de VD y sus niveles plasmáticos varían según el tiempo de exposición a la radiación solar, las horas del día y estación del año, la edad, la pigmentación de la piel (raza/etnicidad del individuo), la superficie expuesta y la aplicación de protectores solares. Y está regulada estrechamente por los niveles plasmáticos de calcio y fósforo, la hormona paratiroidea (PTH) y otros factores identificados más recientemente, como las fosfatoninas (FGF23).
Quesada y Calañas(3) señalan que el colecalciferol no es una “vitamina”, sino un nutriente principal del “sistema endocrino de la vitamina D” (SEVD) que sirve como sustrato para la síntesis de calcitriol, con alta afinidad por su receptor nuclear (VDR) y que estimula o reprime entre 100 y 1.200 genes. El calcitriol se inactiva en otros metabolitos en un proceso controlado por el gen CYP24A1. Tanto el VDR como las enzimas para la activación y catabolismo de la VD se expresan en la mayoría de células y tejidos del organismo, con múltiples acciones además de las consabidas y tradicionales esqueléticas (Tabla I)(4).
Al entrar al núcleo de una célula, la 1,25-(OH)2 VD se une al VDR y recluta otro receptor nuclear conocido como receptor del ácido retinoico X (RXR). Esta molécula de calcitriol unida al complejo VDR/RXR se liga a pequeñas secuencias de ADN conocidas como “elementos de respuesta a vitamina D” (VDREs) e inicia una cascada de interacciones moleculares que modulan la transcripción de genes específicos mediadores de sus principales efectos.
Definición del estado deficitario
El rápido incremento de estudios epidemiológicos ha motivado que en los últimos años la deficiencia de VD haya sido calificada de pandemia, estimándose para Europa unos costos directos e indirectos asociados que ascienden a cientos de miles de millones de euros(5,6). Pero definir el estado de hipovitaminosis D en el niño y establecer el correspondiente significado clínico es todavía un tema de estudio y gran controversia. Existen discrepancias tanto para delimitar los criterios diagnósticos como para unificar los estándares técnicos de su determinación; tampoco se puede precisar cuáles pueden ser los niveles deseables que logren sus efectos extra óseos y cuándo la suplementación puede ser beneficiosa en los mismos.
Sabemos que la medida de la 1,25-(OH)2 VD aporta poca información por su fino control fisiológico. Sus concentraciones séricas son con frecuencia normales en niños con un estado deficiente debido al hiperparatiroidismo secundario y a su reposición por incremento de la síntesis renal. Información adicional sobre la adecuación de la homeostasis de calcio y VD se puede obtener con la medida de la concentración de PTH, aunque en la actualidad el mejor indicador se considera la concentración sérica de 25-OH VD, ya que no es regulada y refleja la ingesta dietética de vitamina D2 o D3 y la síntesis cutánea de D3. Sin embargo, no existe consenso sobre sus concentraciones óptimas y la delimitación de su estado deficitario (Tabla II).
Resulta relevante el que estudios recientes no hayan podido encontrar valores umbral de 25-OH VD relacionados con la supresión de la PTH y la absorción óptima del calcio. Un análisis de corte transversal no encontró límite para la supresión incluso con concentraciones superiores a 70 ng/ml(7). Esto contradice los resultados de la Encuesta Nacional de Salud y Examen de Nutrición de los EE.UU. (NHANES 2003-2006) que estimó la supresión máxima de la PTH con concentraciones de 25-OH VD de 40 ng/ml y mayores(8). Además, ambos estudios identificaron evidencia de hiperparatiroidismo leve (PTH sérica > 65 pg/ml) en individuos con niveles de 25-OH VD muy por encima de los 20 ng/ml, cuestionando el uso de la PTH como un indicador fiable de la insuficiencia de VD. Por otra parte, en mujeres adultas con estado de VD insuficiente (< 20 ng/ml) y suplementadas con dosis diarias de vitamina D3 de 400 a 4.800 UI se observó poco cambio (6%) en la absorción de calcio respecto al grupo control con un rango de 20 a 66 ng/ml(9), lo que puede ayudar a interpretar algunos datos incongruentes observados en los niños.
Estudios de suplementación en adultos de latitudes templadas indican que se requieren ingestas de VD de 800-1.000 UI/día para alcanzar niveles de 25-OH VD sérica de por lo menos 30 ng/ml(10). Sumado a ello, se ha señalado que las concentraciones de 25-OH VD total pueden no reflejar adecuadamente la biodisponibilidad y suficiencia de la vitamina(11), lo que refuerza la necesidad de evidencia adicional para mejorar la determinación del estatus de la VD en algunas poblaciones(12).
No obstante, las Academias Nacionales de Ciencias de los EE.UU. a través de su Instituto de Medicina (IOM) afirman en un documento de 2011(13) que aunque el nivel sérico de 25-OH VD no está validado como sustituto de resultados en salud, puede servir como referencia; y concluye que es razonable considerar 20 ng/ml como el límite inferior de normalidad para casi toda la población. Aun así, sigue habiendo controversia respecto a las concentraciones deseables y podría resultar simplista la pretensión de ofrecer un umbral único de suficiencia para todos los niños. Tras una cuidadosa revisión de la evidencia afirman que niveles de 16 ng/ml cubren los requerimientos de aproximadamente la mitad de la población y niveles de 20 ng/ml los del 97,5% de la misma. Los datos acerca de los beneficios de niveles séricos más altos son escasos, en particular los que hacen referencia a los efectos a largo plazo de concentraciones altas mantenidas de forma crónica. En adultos la correlación inversa entre los niveles de 25-OH VD y PTH ha permitido aceptar la frontera para la deficiencia en 20 ng/ml, cifra por encima de la cual la PTH deja de descender y se establece una meseta(14). Esta correlación se ha descrito también en niños mayores y adolescentes, pero en lactantes está menos clara. Y si bien no hay datos disponibles para extrapolar este concepto a la población infantil, esa cifra tiende a aplicarse también a los niños de cualquier edad.
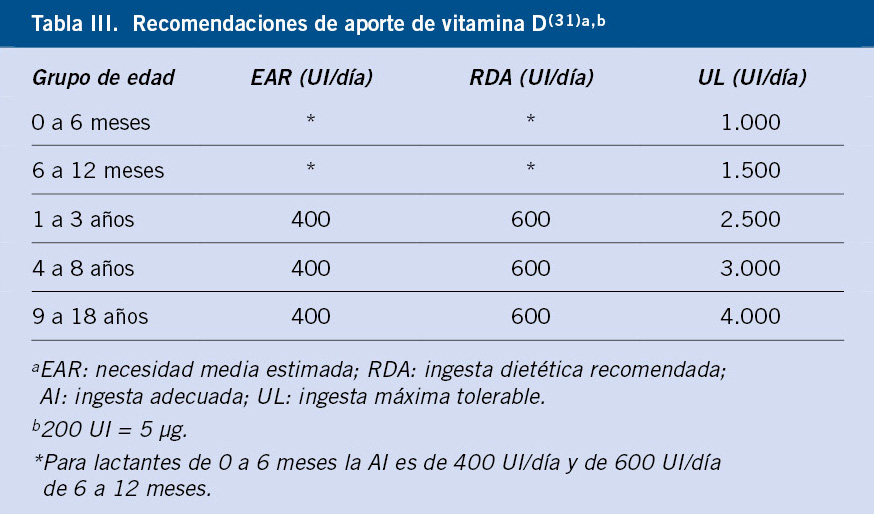
Diferentes Comités de Nutrición, como el de la Asociación Española de Pediatría (AEP)(15), la ESPGHAN(16) y la Autoridad Europea de Seguridad Alimentaria (EFSA)(17), aceptan como concentración adecuada la superior a 20 ng/ml, que se conseguiría con aportes de 400 UI/día (AI: ingesta adecuada)) en niños de 0 a 12 meses, y de 600 UI/día (RDA: ingesta dietética recomendada)) en niños y adolescentes de 1 a 18 años (Tabla III).
Diferentes estudios españoles han documentado ingestas inferiores a estas recomendaciones, especialmente en niños pequeños y adolescentes. Por ello debe insistirse en que el pediatra debe asegurar que todos los niños sanos reciban una ingesta adecuada de vitamina, ya sea con alimento o como suplemento farmacológico, y valorar en la población de riesgo el administrar dosis superiores si fuera necesario.
En adultos, la Sociedad de Endocrinología estadounidense ha propuesto para la hipovitaminosis D valores similares a los definidos en niños(10). Sin embargo, estos rangos se apoyan en estudios observacionales y no en ensayos controlados aleatorios.
Otra cuestión de interés. La amplia variación en los resultados de medición de la 25-OH VD representa un problema para evaluar de manera fiable la dimensión de la hipovitaminosis D y proponer guías de actuación clínica que resulten útiles. Hay una notable disparidad metodológica en su determinación y en los biomarcadores de referencia, con datos de sensibilidad y especificidad diferentes, de homogeneidad de las poblaciones de estudio y sobre la influencia en la formación epidemiológica de factores condicionantes del estado de VD. También se maneja información procedente de un número muy escaso de ensayos clínicos aleatorizados en los diferentes grupos de edad y con objetivos bien definidos. Todo ello hace que muchos estudios resulten difícilmente comparables (Tabla IV).
Esta preocupación ha llevado a crear el Programa de Estandarización de Vitamina D (VDSP)(18), cuyos objetivos incluyen:
1. Estandarizar a nivel mundial la medición de la concentración de 25-OH VD en las encuestas nacionales de salud.
2. Evaluar conjuntamente cualquier diferencia observada en las mismas.
3. Extender los esfuerzos de homogeneización a los ensayos clínicos y a los laboratorios clínicos, comerciales y de investigación.
4. Promover la uniformidad en la medida de los metabolitos emergentes del estado de la VD.
5. Facilitar el intercambio de datos para optimizar la atención al paciente y las estrategias de salud pública.
Desde el punto de vista práctico puede hacerse otro comentario sobre este apartado: basándose en las informaciones de estudios que han tenido como referencia los valores de mayor consenso, actualmente deben aceptarse como indicaciones para realizar una evaluación del estado de VD y considerarse grupos de riesgo principales en la población infantil los que aparecen resumidos en las tablas V y VI.
¿Existe un problema real?
Según los criterios actuales la hipovitaminosis D está presente en toda la población europea, con tasas de prevalencia preocupantes y que requieren acciones desde una perspectiva de salud pública. Su valoración atendiendo a objetivos de salud refuerza esa percepción a cualquier edad. La dirección que tome cualquier estrategia sanitaria general dependerá de decisiones políticas, pero debe apuntar a una prudente exposición a la luz solar (suficiente y segura) y a garantizar la ingesta que proteja frente su deficiencia a la mayoría de la población.
Tiene que insistirse en que la cuantificación del problema parte de informaciones muy variadas y de una gran dispersión de datos, con frecuencia en niños que varían entre el 1 y el 78%. Así, el Comité Científico Asesor sobre Nutrición del Reino Unido(19) informó que el 22-24% de los adultos de 19 a 64 años y 17-24% de más de 65 años tenían deficiencia de VD. Es frecuente en el resto del mundo, incluso en países de climas soleados, como Australia y Nueva Zelanda(20). En los Estados Unidos el 47% de los bebés afroamericanos y el 56% de los caucásicos tienen deficiencia de VD, mientras que las cifras en Irán, Turquía y la India superan el 90%. En EE.UU. el déficit afecta al 35% de la población adulta, mientras que en Pakistán, India y Bangladesh llega al 80%. Si segregamos los datos pertenecientes a los ancianos en Estados Unidos alcanza el 61%, frente al 90% en Turquía, el 96% en India, el 72% en Pakistán y el 67% en Irán(21).
En nuestro país se han publicado numerosos estudios poblacionales. En escolares de entre 10 y 14 años(22), se halló una prevalencia de niveles insuficientes de VD del 45,2%, con más frecuencia en niñas en edad puberal y con un mayor índice de masa corporal (IMC). En una investigación llevada a cabo en diferentes países González-Gross et al. comunicaron en el nuestro, que alrededor del 80% de la muestra tenía niveles sub óptimos (39% tenía niveles insuficientes, 27% deficientes y 15% severamente deficientes). Observaron además que las concentraciones de VD aumentaban con la edad y mostraban tendencia a disminuir según el IMC, con notables diferencias geográficas(23). En una muestra de niños aragoneses sanos (78,5% varones y edad media de 7,2 años) se encontró una concentración media de VD de 26 ng/ml, con un 73% en niveles insuficientes. Se observó además en el grupo con hipovitaminosis un predominio de varones, también de mayor IMC y presencia de fototipos extremos (piel oscura), así como padres inmigrantes. También presentaban mayor riesgo de hipovitaminosis los que no habían realizado profilaxis durante el primer año de vida(24). En una muestra de 283 niños asturianos la media fue de 20,1 ng/ml, con el 8,8% mayor de 30, el 38,5% entre 20-20,9 ng/ml y el 52,7% inferior a 20 ng/ml, y sin relación entre los niveles plasmáticos y la ingesta de VD, el tiempo al aire libre, el IMC, ni el sexo, pero sí con los niveles de sus madres durante la gestación(25). Y en Navarra se halló una alta prevalencia de deficiencia de VD en niños de 3 a 15 años, especialmente en los meses de primavera (75,3%)(26).
En resumen, con los valores de corte propuestos los estudios provenientes de diferentes países han estimado que el estado deficitario está bastante extendido y que tanto niños como adultos de todas las edades están en riesgo elevado de insuficiencia y deficiencia. En los próximos años tendremos una valoración más fiable y que nos ayude a dar una respuesta más precisa a la pregunta que nos hemos planteado. Desde un enfoque práctico y coherente con los datos disponibles, tendríamos que administrar suplementación a los pacientes que la necesitan, buscando mantener niveles séricos de 25-OH VD entre 20 y 50 ng/ml(27), ya que niveles más altos son innecesarios, estarían por encima del umbral nutricional necesario y podrían favorecer efectos secundarios. Por último, debemos recordar que siempre es necesario indicar un aporte adecuado de calcio como complemento de estas medidas.
Bibliografía
1. Alonso M, Redondo MP y Comité de Nutrición de la Asociación Española de Pediatría. Nutrición infantil y salud ósea. An Pediatr (Barc). 2010; 72: 80e1-80e11.
2. Martínez V, Dalmau J. Vitamina D: más allá de sus efectos sobre el metabolismo óseo. Pediatr Integral. 2013; 17(10): 728-33.
3. Quesada JM, Calañas A. Las piezas del puzle de la “vitamina D” empiezan a encajar: da a los que necesitan. Nutr Hosp. 2020; 37: 4-5.
4. Bouillon R, Marcocci C, Carmeliet G, Bikle D, White JH, Dawson-Hughes B, et al. Skeletal and extraskeletal actions of vitamin D: current evidence and outstanding questions. Endocr Rev. 2019; 40: 1109-51.
5. Cashman KD, Dowling KG, Škrabáková Z, González-Gross M, Valtueña J, De Henauw S, et al. Vitamin D deficiency in Europe: pandemic? Am J Clin Nutr. 2016; 103: 1033-44. doi:10.3945/ajcn.115.120873.
6. Grant WB, Cross HS, Garland CF, Gorham ED, Moan J, Peterlik M, et al. Estimated benefit of increased vitamin D status in reducing the economic burden of disease in western Europe. Prog Biophys Mol Biol. 2009; 99:104-13.
7. Valcour A, Blocki F, Hawkins DM, Rao SD. Effects of age and serum 25-OH-vitamin D on serum parathyroid hormone levels. J Clin Endocrinol Metab. 2012; 97: 3989-95.
8. Looker AC, Johnson CL, Lacher DA, Pfeiffer CM, Schleicher RL, Sempos CT. Vitamin D status: United States, 2001-2006. NCHS Data Brief. 2011; 59: 1-8.
9. Gallagher JC, Yalamanchili V, Smith LM. The effect of vitamin D on calcium absorption in older women. J Clin Endocrinol Metab. 2012; 97: 3550-56.
10. Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011; 96: 1911-30.
11. Alonso MA, Martínez V, Dalmau J. Deficiencia de vitamina D: un reto diagnóstico. Acta Pediatr Esp. 2016; 74: 189-96.
12. Powe CE, Evans MK, Wenger J, Zonderman AB, Berg AH, Michael Nalls M, et al. Vitamin D-binding protein and vitamin D status of black Americans and white Americans. N Engl J Med. 2013; 369: 1991-2000.
13. Institute of Medicine of the National Academies. Dietary Reference Intakes or calcium and vitamin D, 2011. En: www.iom.edu/vitamind.
14. Hollis BW. Circulating 25-hydroxyvitamin D levels indicative of vitamin D sufficiency: implications for establishing a new effective DRI for vitamin D. J Nutr. 2005; 135: 317-22.
15. Martínez V, Dalmau J, Moreno-Villares JM, Gil-Campos, Moráis A, Moreno-Aznar LA, et al, en nombre del Comité de Nutrición de la Asociación Española de Pediatría (AEP). Vitamina D y salud infantil: claves para el pediatra general. Pediat Integral. 2013; XVII: 70-72.
16. Braegger C, Campoy C, Colomb V, Decsi T, Domellof M, Fewtrell M, on behalf of the ESPGHAN Committee on Nutrition. Vitamin D in the Healthy European Paediatric Population. J Pediatr Gastroenterol Nutr. 2013; 56: 692-701.
17. EFSA, 2017. Dietary Reference Values for Nutrients. Summary Report 92 pp https://www.efsa.europa.eu/sites/default/files/2017 _09_DRVs_summary_report.pdf.
18. Sempos CT, Vesper HW, Phinney KW, Thienpont LM, Coates PM. Vitamin D status as an international issue: national surveys and the problem of standardization. Scand J Clin Lab Invest Suppl. 2012; 243: 32-40.
19. Scientific Advisory Committee on Nutrition (2016) https://www.gov.uk/government/publications/sacn-vitamin-d-and-health-report (accessed August 17).
20. Nowson CA, McGrath JJ, Ebeling PR, Haikerwal A, Daly RM, Sanders KM, et al. Vitamin D and health in adults in Australia and New Zealand: a position statement. Med J Aust. 2012; 196: 686-7.
21. Palacios C, González L. Is vitamin D deficiency a major global public health problem? J. Steroid Biochem. Mol. Biol. 2014; 144: 138-45.
22. Ruiz-Ocaña P, Carrasco-Fernández C, Sáez-Benito A, Novalbos-Ruiz JP, Lechuga AM. Niveles de vitamina D al final de la estación invernal en una población escolar sana. Rev Esp Endocrinol Pediatr. 2014; 5: 19-27. Doi. 10.3266/ RevEspEndocrinolPediatr. pre2014.Mar.214.
23. González-Gross M, Valtueña J, Breidenassel C, Moreno LA, Ferrari M, Kersting M, et al. Vitamin D status among adolescents in Europe: the Healthy Lifestyle in Europe by Nutrition in Adolescence study. Br J Nutr. 2012; 107: 755–64.
24. Martínez I, García R, Calmarza P, de Arriba A, Rodríguez G, Labarta JI. Deficiencia de vitamina D en niños aragoneses sanos. Nutr Hosp. 2018; 35: 782-8 DOI: http://dx.doi.org/10.20960/nh.1592.
25. Rodríguez-Dehli AC, Riaño-Galán I, Fernández-Somoano A, Navarrete-Muñoz EM, Espada M, Vioque J, et al. Hipovitaminosis D y factores asociados a los 4 años en el norte de España. An Pediatr. 2017; 86: 188-96. DOI: 10.1016/j.anpedi.2016.02.003
26. Durá-Travé T, Gallinas-Victoriano F, Chueca MJ, Berrade-Zubiri S. Deficiencia de vitamina D en escolares y adolescentes con un estado nutricional normal. Nutr Hosp. 2015; 32: 1061-6. DOI:10.3305/nh.2015.32.3.9316.
27. NIH Office of Dietary Supplements. Fact sheet for Health Professionals: Vitamin D. Available from: https://ods.od.nih.gov/factsheets/VitaminD-HealthProfessional.
28. American Academy of Pediatrics. Dietary reference intakes for calcium and vitamin D. Pediatrics. 2012; 130: 1424.
29. Misra M, Pacaud D, Petryk A, Collett-Solberg PF, Kappy M. Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. Vitamin D deficiency in children and its management: review of current knowledge and recommendations. Pediatrics. 2008; 122: 398-417.
30. Munns CF, Shaw N, Kiely M, Specker BL, Thacher TD, Ozono K, et al. Global consensus recommendations on prevention and management of nutritional rickets. J Clin Endocrinol Metab. 2016; 101: 394-415.
31. Martínez V, Moreno JM, Dalmau J y Comité de Nutrición de la AEP. Recomendaciones de ingesta de calcio y vitamina D: posicionamiento del Comité de Nutrición de la AEP. An Pediatr (Barc). 2012; 77: 57.e1-e8. doi:10.1016/j.anpedi.2011.11.024.