|
| Temas de FC |
C. Cebrián Muíños
Profesora asociada de Ciencias de la Salud en la Universidad de Salamanca. Médico adjunto del Servicio de Cirugía Pediátrica – Complejo Asistencial Universitario de Salamanca
| Resumen
La patología testicular y escrotal está muy presente en la práctica diaria del pediatra y ocupa una parte importante del quehacer cotidiano del cirujano pediátrico. El presente artículo pretende resumir y actualizar, desde un punto de vista práctico, los conceptos y recomendaciones en la patología testicular y escrotal pediátrica más importante. La exploración física, así como la anamnesis y, en algunos casos, la ecografía escrotal, permitirán hacer un diagnóstico certero de la mayor parte de la patología escrotal. El manejo adecuado y precoz de la criptorquidia (antes de los 18 meses) será crucial en la evolución gonadal, desde el punto de vista de: desarrollo del teste, riesgo de torsión y probabilidad de desarrollo de tumores. El varicocele se define como una dilatación venosa anormal del plexo pampiniforme del cordón espermático y la tendencia en su manejo es conservadora. Los tumores testiculares en la edad pediátrica tienen unas características y un comportamiento muy diferente a los del adulto, que hacen que, en la actualidad, se preconice un abordaje mucho más conservador de las masas testiculares infantiles. El quiste epididimario es una masa quística que aparece en el epidídimo, de naturaleza benigna, pero que puede generar sintomatología. Por último, se describen las características del hidrocele en la edad pediátrica, sus rasgos distintivos y manejo. |
| Abstract
Testicular and scrotal conditions are frequent in the pediatrician ́s daily practice and they are also a main part of the pediatric surgeon ́s day-to-day activity. This article summarizes and updates concepts and guidelines in testicular and scrotal pediatric pathologies from a practical point of view. Physical examination, history taking and, in some cases, scrotal US will allow to achieve an accurate diagnosis for most scrotal conditions. Adequate and prompt management of cryptorchidism (before 18 months of age) will be crucial for gonadal prognosis in terms of testicular development and risk of torsion and malignancy. Varicocele is an abnormal dilatation and tortuosity of the venous components within the spermatic cord, where conservative management remains the mainstay. Testicular tumors in children have very different features and behavior to those in adults, thus leading to a less aggressive approach in its treatment in this age group. An epididymal cyst is a cystic mass formed in the epididymis, of benign nature but may be symptomatic. Finally, the characteristics and management of hydrocele in the pediatric age group are herein discussed. |
Palabras clave: Criptorquidia; Varicocele; Tumores testiculares; Quistes epididimarios; Hidrocele.
Key words: Cryptorchidism; Varicocele; Testicular tumors; Epididymal cysts; Hydrocele.
Pediatr Integral 2019; XXIII (6): 271 – 282
Criptorquidia y patología testículo-escrotal en la edad pediátrica
Criptorquidia
Concepto y epidemiología
La criptorquidia puede ser congénita, por mal descenso testicular, o adquirida, de etiología poco esclarecida.
Hablamos de criptorquidia cuando un testículo se encuentra permanentemente ausente de la bolsa escrotal a los 6 meses de edad (o edad corregida en prematuros)(1,2). Comprende la ausencia congénita del teste, así como el mal descenso testicular. Los testes mal descendidos han detenido su trayecto en algún punto de su migración hacia el escroto. Pueden haberse quedado retenidos a nivel de la cavidad abdominal o pueden ser palpables en la región inguinal, que es la localización más frecuente en los testes no descendidos(3).
Puede ser unilateral (leve predominio del lado izquierdo) o bien bilateral (hasta en un 10% de los casos).
Las complicaciones de la criptorquidia consisten en menor fertilidad y riesgo de malignización. Dado que se trata de una malformación asintomática, es particularmente relevante hacer hincapié en la importancia del diagnóstico y tratamiento precoz. La situación anatómica normal del teste en el escroto proporciona unas condiciones de temperatura y ambiente peculiares al teste y es sabido que la orquidopexia precoz mejora el pronóstico. No menos importante es el objetivo de alojar la gónada en un lugar fácilmente accesible a la exploración y futura auto-exploración del paciente en la adolescencia y edad adulta, lo cual permitirá el diagnóstico precoz de una eventual tumoración testicular.
La criptorquidia es la anomalía congénita genital más frecuente. Aparece en el 3% de los recién nacidos a término y esa cifra se eleva hasta el 33-45% en prematuros o pacientes con peso inferior a 2.500 g al nacimiento. La mayoría descienden espontáneamente durante los primeros 6 meses de vida, haciendo que la incidencia de criptorquidia al año de edad disminuya hasta el 1%. El descenso espontáneo del teste más allá del año de vida es muy improbable(1,3). Dentro de las criptorquidias, el 80% serán testes palpables y el 20% testes no palpables.
Cabe mencionar una situación diferente, que es la criptorquidia adquirida, en la que un testículo aparentemente bien situado en escroto durante la primera infancia, va quedándose fuera del escroto con el transcurso de los años, a lo largo de la edad escolar. La tasa de criptorquidia adquirida se ha cifrado en un 2%(3).
La criptorquidia puede presentarse asociada con: otras anomalías urológicas, como hipospadias o válvulas de uretra posterior; defectos del tubo neural, como parálisis cerebral; y formando parte de síndromes (Prune-Belly, Prader-Willi, Kallman, Noonan…).
Embriología
El descenso testicular es un proceso complejo, resultado de la interacción de factores hormonales y mecánicos. Presenta una fase abdominal y otra inguinal.
El descenso testicular es un proceso complejo y parcialmente desconocido. La migración testicular resulta de una interacción de múltiples factores (endocrinos, paracrinos, mecánicos y de crecimiento). Cualquier desviación del proceso normal puede resultar en una criptorquidia.
Todo comienza cuando la cresta gonadal indiferenciada se diferencia a testículo en la semana 6-7ª (gen SRY). Comienza a formarse la gónada en lo que será el retroperitoneo.
Podemos diferenciar dos etapas importantes en la migración testicular: la fase abdominal y la inguinal. La fase abdominal es andrógeno-independiente y mediada por la hormona descendina. El testículo permanece en el abdomen, cerca del anillo inguinal profundo hasta su descenso a través del canal inguinal en el tercer trimestre.
El paso por el canal inguinal (semana 22-28ª) se produce por interacción de factores mecánicos, hormonales y neurotransmisores, entre los que se encuentran: la persistencia del conducto peritoneo-vaginal (CPV), cambios en la presión abdominal, regresión del gubernaculum, efecto de los andrógenos, gonadotropinas, factor inhibidor mulleriano, etc.(1,3).
El conducto peritoneo-vaginal es una estructura embriológica que forma una evaginación del peritoneo que acompaña al teste en su migración. La parte más distal formará parte de las cubiertas testiculares (vaginal testicular) y la zona media, entre el peritoneo y la vaginal testicular debe obliterarse totalmente al completarse la migración testicular, dando lugar a un remanente fibroso. Al no completarse el proceso normal de alojamiento del teste en escroto, no suele producirse un cierre del CPV, de manera que la mayoría de testes criptorquídicos presentarán una persistencia del CPV (también llamada “hernia acompañante”, generalmente sin manifestación clínica) que se repara quirúrgicamente en el momento de la orquidopexia.
Diagnóstico
Exploración física
El diagnóstico de la criptorquidia se basa en la exploración física. Las pruebas de imagen no aportan datos relevantes de cara al manejo.
El diagnóstico de la criptorquidia es eminentemente clínico y la exploración concluyente será la palpación meticulosa de la región inguino-escrotal. La inspección inicial orienta en datos, como la hipoplasia escrotal (típico de criptorquidia) o hipertrofia del teste contralateral, frecuente en los testes únicos. En caso de anomalías en la inspección genital (transposición peno-escrotal, hipospadias, micropene), será necesaria valoración por endocrinología, pruebas hormonales y cariotipo. Los hallazgos en la palpación serán determinantes en catalogar un teste como: normal o criptorquídico, así como indicar la vía de abordaje del teste (inguinotomía o laparoscopia).
La exploración debe hacerse, en condiciones ideales: con el paciente relajado, en una sala con temperatura adecuada y con paciencia y detenimiento. Merece la pena dedicar tiempo a esta exploración que será decisiva en el diagnóstico y manejo. La exploración tradicional se realiza con el paciente en decúbito supino y en cuclillas.
Una exploración detallada de la zona nos ofrecerá información de la presencia del teste, su tamaño (normal, hipotrófico, atrófico), así como de los elementos del cordón espermático. Explorando al paciente desde su derecha, la mano izquierda debe localizar y fijar el cordón espermático a nivel de la rama del pubis (canal inguinal) y con la mano derecha, palparemos cuidadosamente desde la espina ilíaca a lo largo del canal inguinal hacia el escroto, desplazando suavemente las estructuras subcutáneas hasta localizar el testículo. Una vez localizado, intentaremos descender el teste hacia el escroto y observar si permanece en la bolsa. El teste, en la edad pediátrica, no tiene por qué permanecer todo el tiempo en la bolsa escrotal. Es importante enfatizar que el teste infantil es un órgano pequeño que puede ser expulsado de la bolsa tras la contracción vigorosa del músculo cremáster, en pacientes con reflejo cremastérico fácilmente reproducible. Un teste que es palpable fuera del escroto, pero en la manipulación desciende a la bolsa sin tensión y permanece allí mientras no se active el reflejo cremastérico, se considera un testículo normal en niños, que no precisa más seguimiento que las revisiones protocolizadas del niño sano por su pediatra de Atención Primaria(4,5).
Sin embargo, si el testículo no puede ser descendido hasta la bolsa o bien cuando alcanza la bolsa inmediatamente reasciende, estamos ante un testículo mal descendido o criptorquídico que precisará tratamiento quirúrgico.
En caso de que no palpemos testículo a nivel inguino-escrotal (20% de las criptorquidias), podemos encontrarnos ante dos situaciones: ausencia congénita del teste o teste maldescendido intraabdominal. Para discriminar entre estas situaciones, es imprescindible practicar una exploración laparoscópica que será diagnóstica y eventualmente terapéutica en el mismo acto quirúrgico(6).
La palpación inguinal en pacientes obesos puede ser muy compleja. La primera maniobra previa a cualquier abordaje quirúrgico en quirófano es la palpación bajo anestesia. Hasta un 18% de testes no palpables en la consulta se hacen palpables bajo anestesia general(1).
Pruebas de imagen
La ecografía o la RMN carecen de utilidad en el manejo de la criptorquidia(1,2,4). La ecografía para el diagnóstico de criptorquidia ofrece una sensibilidad del 45% y una especificidad del 78%. En el caso del teste palpable, no van a ofrecer más información que la palpación detallada y, en el caso del teste no palpable, no poseen una sensibilidad suficiente para discriminar un pequeño teste (sensibilidad muy escasa para estructuras de partes blandas menores de 1 cm) en el interior de la cavidad abdominal. La RMN es una exploración que precisa sedación en niños y, en caso de ser negativa (no se evidencia teste), no exime de realizar una laparoscopia. En resumen, un resultado negativo en las pruebas de imagen, no es diagnóstico de ausencia de testículo.
Pruebas endocrinológicas
En general, no están indicados test hormonales en el manejo de la criptorquidia unilateral. Sin embargo, en los casos de criptorquidia bilateral, es imprescindible una valoración por endocrinología pediátrica. Una situación peculiar es la criptorquidia bilateral no palpable. En esta situación, el diagnóstico diferencial se establece entre: teste intraabdominal bilateral, anorquia, síndrome de insensibilidad a andrógenos o anomalía cromosómica. Si la FSH y LH basales están elevadas en un niño menor de 9 años, debemos sospechar anorquia. En caso de FSH y LH normales, se puede realizar la prueba de estimulación de B-hCG: si se produce una elevación de testosterona, indica que existe tejido testicular funcionante y es obligatoria una exploración laparoscópica. Sin embargo, aun cuando no hay una elevación adecuada de la testosterona, podemos encontrarnos ante testes no funcionantes intraabdominales y es preciso igualmente explorar la cavidad abdominal para descartar la presencia de restos testiculares. El test de estimulación de B-hCG no distingue entre teste normal no palpable o remanentes testiculares atróficos funcionantes. En definitiva, con independencia de los resultados en las pruebas hormonales, en las criptorquidias no palpables será precisa una laparoscopia, único procedimiento considerado válido en la actualidad, para descartar la presencia de tejido testicular, normal, atrófico, funcionante o no en la cavidad abdominal(1,3).
Manejo
Calendario quirúrgico
La corrección quirúrgica de la criptorquidia debe realizarse entre los 12 y los 18 meses.
Se recomienda realizar la orquidopexia entre los 12-18 meses (European Society of Pediatric Urology), ya que la posibilidad de descenso espontáneo a partir de los 12 meses es ínfima(2,4,5). La orquidopexia precoz: reduce el riesgo de torsión testicular, facilita la exploración testicular, mejora la función endocrinológica del testículo, disminuye el riesgo de malignización y confiere un aspecto normal al escroto.
Tratamiento hormonal
El tratamiento hormonal no puede sustituir al tratamiento quirúrgico en la criptorquidia(1,2). Estudios recientes han valorado la administración de LHRH y hormona liberadora de gonadotropinas como tratamiento coadyuvante a la orquidopexia para mejorar la fertilidad(7,8).
Abordaje quirúrgico y técnicas (Algoritmo 1 al final de artículo)
Teste palpable
Para el teste palpable en canal inguinal, el abordaje estándar es la inguinotomía, para realizar la liberación del teste a estructuras circundantes y la disección del cordón espermático. A continuación, a través de una incisión escrotal, se crea una neobolsa escrotal subdartros, donde se fijará el testículo. La técnica de Bianchi aborda estos testes por una incisión a nivel de la raíz escrotal (Fig. 1).
Figura 1. Orquidopexia por vía inguinal.
Teste no palpable
En el teste no palpable se realizará una laparoscopia(1,2,9). De esta manera, se puede establecer un diagnóstico certero. Podemos encontrarnos antes diversas situaciones, a saber:
• Ausencia del teste: en la cavidad abdominal no se encuentra teste, generalmente se visualizan las estructuras del cordón formadas que se afilan hasta desaparecer (vanishing testis). Se apunta a una posible etiología isquémica (accidente vascular prenatal) para este cuadro clínico (1,3,7,9).
• Teste atrófico intraabdominal: cuando el aspecto macroscópico del testículo intraabdominal es manifiestamente anómalo (atrófico), se recomienda la extirpación, ya que el pronóstico del órgano, en caso de lograr la pexia, es muy pobre y no se debe dejar alojado en el abdomen, por el riesgo de malignización, donde además, no será accesible a la palpación para el cribado precoz de masas testiculares.
• Teste intraabdominal de aspecto viable: se iniciarán las maniobras para el descenso y pexia del mismo en la bolsa escrotal. La técnica más extendida de orquidopexia laparoscópica es la técnica de Mininberg en un tiempo, que fija el teste al escroto en un solo acto quirúrgico. A veces, la tensión sobre los vasos sanguíneos tras la orquidopexia puede causar compromiso vascular en el teste y condicionar atrofia a medio plazo. Para los casos de testes situados muy altos o con pedículos muy cortos (no susceptibles de orquidopexia laparoscópica en un tiempo), se emplea la técnica en dos tiempos de Fowler-Stephens. Se basa en la existencia de un triple aporte sanguíneo del teste (vasos espermáticos, arteria deferencial y aferencias del gubernaculum) y secciona los vasos espermáticos en el primer tiempo. Al cabo de unas semanas, se realiza el segundo tiempo con una laparoscopia que permite valorar si el teste sigue viable tras la sección y ya más libre de fijaciones, se puede descender en este segundo tiempo a escroto.
Pronóstico
Fertilidad
El pronóstico de fertilidad en pacientes con criptorquidia unilateral, es comparable a la población general.
El teste no descendido, así como el órgano contralateral de un paciente con criptorquidia es histológicamente anormal, según estudios realizados en biopsias testiculares tomadas en el momento de la orquidopexia(1,4). Desde el punto de vista clínico, el seminograma de los pacientes con historia de maldescenso testicular muestra parámetros subóptimos. Sin embargo, y a pesar de estos hallazgos, la tasa de infertilidad de los pacientes con antecedente de criptorquidia unilateral es comparable a la población general (10%), sin embargo, cuando la criptorquidia es bilateral, la tasa de infertilidad es superior.
La infertilidad aumenta cuanto más alta es la localización del teste: los pacientes con teste intracanalicular o intraabdominal tienen mayores tasas de infertilidad que los pacientes con testes inguinales.
Los estudios referentes a fertilidad en pacientes pediátricos son difíciles y exigen tiempos de observación muy prolongados, lo cual dificulta la homogeneidad del tratamiento y comparabilidad de las muestras. Recientemente, han comenzado ensayos clínicos con terapia coadyuvante con LHRH tras orquidopexia, que parecen mejorar la tasa de fertilidad. Un estudio similar muestra mejoría de la fertilidad en pacientes tratados precozmente con hormona liberadora de gonadotropinas previa a orquidopexia(2,7).
Riesgo de malignización
El riesgo de malignización en la criptorquidia depende de la localización original del testículo y de la edad de la corrección quirúrgica.
La criptorquidia incrementa el riesgo de presentar un tumor testicular en la edad adulta, en una proporción poco clara hasta el momento (se han apuntado datos desde 2 a 8 veces más que la población general). El riesgo de malignización varía en función de la localización original del teste criptorquídico; así, es del 1% para testes inguinales y del 5% para intraabdominales. Otro factor que incide en el riesgo de malignización es el momento de la corrección quirúrgica, de manera que las criptoquidias corregidas después de los 13 años presentan el doble de riesgo de malignización que las corregidas antes de esa edad(4).
El tipo de tumor más frecuente en testes que quedan retenidos (sin tratar) en el abdomen es el seminoma (74%); sin embargo, en los tumores aparecidos sobre testes criptorquídicos adecuadamente tratados mediante orquidopexia, independientemente de su localización original, son predominantemente tumores de células germinales no seminomatosos (63%).
Existen dos teorías para explicar el incremento del riesgo de tumores en testes criptorquídicos: la primera se basa en el potencial carcinógeno del ambiente en que se encuentra un teste no descendido. La otra teoría atribuye el riesgo de malignización a una disgenesia testicular, postulando que existe una etiología hormonal o disgenética, que favorece simultáneamente la criptorquidia y el tumor testicular. En pacientes con criptorquidia, el 20% de los tumores aparecen en el teste contralateral normodescendido; es decir, el teste normodescendido en un paciente con criptorquidia unilateral presenta igualmente un importante riesgo relativo de malignización(1,4,7).
Aspectos cosméticos y psico-sociales
En el caso de ausencia congénita de testículo o necesidad de orquidectomía por atrofia, se ofrece al paciente y a la familia la posibilidad de la colocación de una prótesis testicular que restituya el aspecto anatómico normal del escroto. En general, suele implantarse una prótesis de tamaño pequeño en la primera infancia, para minimizar la hipoplasia escrotal. Esta se recambiaría en torno a la pubertad, por una de tamaño más acorde con el teste adulto.
Varicocele
Concepto
El varicocele es muy frecuente: hasta el 15% de los varones adolescentes lo presentan.
El varicocele implica una dilatación y tortuosidad anormal de las venas del plexo pampiniforme del cordón espermático a nivel del escroto, que es el plexo venoso responsable del drenaje sanguíneo de las venas: testicular, pudenda y cremastérica. La gran mayoría (85-95%) aparecen en el hemiescroto izquierdo, ya que la anatomía del drenaje de la vena espermática en la vena renal izquierda, formando un ángulo de casi 90º con la vena renal, obliga a un flujo venoso muy vertical en contra de la gravedad. Sin embargo, en el lado derecho, la vena espermática drena en la vena cava inferior en un ángulo mucho más suave Se desconoce la etiología de este tipo de varicoceles primarios e idiopáticos, pero se cree que un mecanismo de incompetencia valvular de las venas puede estar implicado en la fisiopatología(10,11).
Es muy frecuente, aproximadamente, el 15% de los adolescentes varones presentan varicocele. Sin embargo, solo el 10-15% de los varones con varicocele presentan problemas de fertilidad(11-13).
Aunque sí se ha relacionado el varicocele con disminución del volumen testicular ipsilateral o con deterioro del espermiograma, no hay evidencias del efecto del varicocele sobre las tasas de fertilidad o de paternidad.
Diagnóstico
El paciente con varicocele puede estar asintomático o consultar por molestias, pesadez o pinchazos a nivel del escroto. La valoración del varicocele debe comenzarse con el paciente en bipedestación. Si a la inspección se hace visible un aumento de tamaño del hemiescroto con masa de elementos tortuosos paratesticulares, nos encontramos ante un varicocele grado III (visible). Pediremos al paciente que realice maniobra de Valsalva para evidenciar varicoceles leves, solo palpables con Valsalva (grado I). La exploración continúa en decúbito supino. Esta maniobra ayuda a discriminar los varicoceles idiopáticos o primarios que disminuirán considerablemente de intensidad en decúbito, de aquellos secundarios a obstrucción de la vena cava inferior, que apenas se modifican con el cambio de posición.
Si el varicocele es derecho, persiste en decúbito supino y se ha instaurado de forma muy aguda, entonces habrá que descartar obstrucción (trombosis, masa abdominal…) de la vena cava inferior mediante ecografía Doppler abdominal.
En la palpación, encontraremos una masa blanda escrotal retrotesticular, compuesta por múltiples elementos tortuosos (venas dilatadas) que, clásicamente, se describe con aspecto de “bolsa de gusanos”.
Es importante valorar el tamaño testicular con el orquidómetro o mediante ecografía(11,13,14).
El diagnóstico diferencial se establece con las masas escrotales indoloras, tales como: tumores testiculares, hidroceles, quistes de epidídimo, etc.
Clasificación (Tabla I)
El grado de varicocele no presenta correlación con la infertilidad en estudios en adultos.
Existen varias clasificaciones, radiológicas y clínicas. Reseñamos aquí la clasificación clínica más extendida y aceptada por la European Society for Paediatric Urology. Hablaremos de varicocele subclínico o grado 0 cuando se trata de un varicocele detectado en una exploración ecográfica, pero imperceptible en la exploración física. El grado I será un varicocele palpable exclusivamente en Valsalva, el grado II es palpable sin maniobra de Valsalva en bipedestación y el grado III es un varicocele evidente a la inspección, esto es, visible a través de la piel escrotal (Tabla I).
El grado de varicocele no guarda correlación con infertilidad o anomalías en el espermiograma en adultos. Los estudios realizados en adolescente, relacionando grado de varicocele y tamaño testicular, han tenido resultados discrepantes.
Manejo y tratamiento
El tratamiento del varicocele se reserva para casos sintomáticos o con atrofia testicular ipsilateral.
Indicación quirúrgica
No existen pautas definidas y establecidas para el tratamiento del varicocele en la infancia. Las indicaciones de tratamiento activo (embolización, cirugía abierta por vía inguinal o técnicas laparoscópicas) son controvertidas y no hay evidencia de qué grupo de pacientes se beneficiarían de una corrección del varicocele. En la actualidad, se restringe el tratamiento quirúrgico para aquellos varicoceles que sean sintomáticos (pesadez, dolor), bilaterales o que condicione hipotrofia del teste afecto (diferencia de volumen mayor del 20% o 2 mL entre el teste afecto y el sano), así como alteraciones en el espermiograma en adultos.
La gravedad del grado de varicocele no parece ser crucial en la decisión terapéutica, aunque algunos autores preconizan el tratamiento activo para los casos de grado III, incluso asintomáticos. Igualmente, se han utilizado parámetros de flujo retrógrado valorado con Doppler (>38 cm/s), como factores predictivos de hipotrofia testicular, pero, de nuevo, no existe evidencia de que esto implique deterioro de la tasa de fertilidad(14,15).
El retraso del crecimiento del teste puede ser reversible con la corrección del varicocele en el adolescente o incluso de forma espontánea durante la pubertad en varicoceles sin tratar (manejo conservador)(13-15).
Algunos estudios apuntan a que los niveles de LH y FSH basales pueden ser más predictivos de disfunción testicular que el volumen del teste, lo que sugiere la idea de valorar los niveles hormonales antes de tomar una decisión quirúrgica, pero no existen guías clínicas detalladas al respecto.
Los estudios para evaluar la fertilidad y paternidad en pacientes pediátricos son muy difíciles de diseñar y de llevar a cabo, debido al prolongadísimo tiempo de estudio requerido.
Los esfuerzos se centran ahora en intentar identificar los factores que caracterizan a los pacientes de riesgo (parámetros seminales, volumen testicular, flujo retrógrado, niveles hormonales…) para tratar precozmente a esos pacientes sin incurrir en el sobretratamiento de un problema muy común en la adolescencia y que, en el 80% de los varones, no acarrea problemas de fertilidad ni síntomas(12,16).
Opciones de tratamiento
Las opciones de tratamiento son principalmente tres:
• Tratamiento endovascular con embolización de las venas espermáticas.
• Cirugía abierta por vía inguinal o subinguinal microquirúrgica.
• Técnicas laparoscópicas de ligadura en bloque de plexo pampiníforme suprainguinal (técnica de Palomo), o bien técnicas con conservación de los linfáticos del plexo.
No existe evidencia de la superioridad de una técnica sobre las otras en la población pediátrica; si bien, en adultos, la tasa de éxito y complicaciones son más favorables en el abordaje microquirúrgico. Las complicaciones del tratamiento del varicocele incluyen: recidiva del varicocele (hasta 30%, dependiendo de la técnica), hidrocele secundario a sección de drenaje linfático (hasta 17%) o atrofia testicular(13,14,16).
Tumores testiculares
Concepto y epidemiología
Los tumores testiculares primarios son raros en los niños, el 2% de todos los tumores sólidos.
Como neoplasia escrotal, podemos encontrar tumores testiculares (del parénquima testicular y epidídimo) y paratesticulares, que no se originan estrictamente en el testículo, sino en las cubiertas escrotales o el cordón espermático. De los tumores paratesticulares malignos, el rabdomiosarcoma es el más frecuente(1,17,18).
Entre las masas testiculares, podemos diferenciar: tumores testiculares metastásicos (principalmente, leucemias y linfomas) o primarios. Nos ceñiremos a los tumores originados en la gónada.
Los tumores testiculares son infrecuentes en niños y suponen aproximadamente el 2% de todos los tumores sólidos en niños. Aparece en 0,5 a 2 por cada 100.000 menores de 18 años y esta cifra ha permanecido estable en contraposición con el incremento de incidencia constatado en la población adulta(18,19).
Existen dos picos de incidencia a lo largo de la edad pediátrica: el principal en lactantes en torno a 24 meses y otro en la pubertad.
Los pacientes prepuberales constituyen un grupo con características epidemiológicas, histológicas y pronósticas muy distintas a las del grupo post-puberal y adulto. La proporción de tumores testiculares benignos en niños es muy superior a la encontrada en los adultos. Esto hace que el manejo de los tumores testiculares en pacientes prepúberes difiera del recomendado en adolescentes y adultos, y se preconice de forma creciente la cirugía conservadora en algunos casos. La diseminación linfática retroperitoneal es muy rara en niños(17).
La estirpe histológica más frecuente entre los tumores testiculares primarios en la infancia es el teratoma prepuberal (benigno), seguido del tumor del Saco vitelino prepuberal. En recién nacidos y lactantes menores de 6 meses, el tipo histológico más frecuente es el tumor de la granulosa(19,20).
Los varones con anomalías como: disgenesia gonadal, alteraciones del desarrollo sexual, hipovirilización, tumor testicular contralateral o antecedentes de cáncer testicular en familiares de primer grado, tienen un riesgo incrementado de tumores gonadales.
Clínica y diagnóstico
La forma de presentación típica del tumor testicular es una masa testicular indolora sin signos de flogosis escrotal. Es frecuente que se registre un antecedente de traumatismo que actúa como acontecimiento que favorece el hallazgo del tumor. Excepcionalmente, el tumor puede ocasionar una torsión testicular y presentarse como un escroto agudo.
En la exploración física, encontraremos una masa delimitada o bien el teste globalmente aumentado de tamaño, con una consistencia pétrea y transiluminación concordante con masa sólida. Hasta un 20% pueden asociar hidrocele ipsilateral que puede dificultar la exploración(17,19).
Los tumores con actividad hormonal (células de Leydig) pueden producir pubertad precoz o ginecomastia.
Entre los estudios complementarios se solicitará: eco-doppler testicular y analítica sanguínea con marcadores tumorales (AFP y b-hCG).
• Ecografía: ofrece una sensibilidad cercana al 100%. Los tumores benignos aparecerán como masas bien definidas y poco vascularizadas. En general, las lesiones anecoicas quísticas sugieren benignidad. Estos hallazgos pueden ser útiles en el planteamiento de una cirugía conservadora.
• Marcadores tumorales: son útiles no solo en el diagnóstico, sino también para el seguimiento del tumor.
– La alfa-fetoproteína (AFP) es una glucoproteína producida por: el saco vitelino fetal, el hígado y el tracto gastrointestinal. Se encuentra elevada en el 90% de los casos de tumor del saco vitelino. La vida media de la AFP es de 5,5 días y los valores normales en adulto (menores de 10 ng/mL) no se alcanzan hasta los 10 meses de edad. Sus niveles se normalizarían al mes de la extirpación completa del tumor.
– β-hCG es una glucoproteína producida por carcinomas embrionarios y teratomas mixtos. Su vida media son 24 horas y normalmente no se detecta en varones (valores <5 UI/L).
• TC/RMN: solo tras el diagnóstico anatomo-patológico de tumor testicular maligno de alto riesgo, estará indicado realizar un TC o RMN para estudio de enfermedad a distancia (estadiaje).
• No se debe realizar biopsia por punción de las masas testiculares, pues se puede favorecer la diseminación tumoral.
Clasificación (Tabla II)
El teratoma tipo pre-puberal es el tipo histológico más común en pacientes pre-púberes.
Se clasifican en 7 grupos, según la clasificación anatomo-patológica de la Organización Mundial de la Salud 2016 (Tabla II):
1. Tumores de células germinales derivados de neoplasia de las células germinales in situ (NCGIS).
2. Tumores de células germinales no relacionados con NCGIS.
3. Tumores de los cordones sexuales-estroma gonadal.
4. Tumores que contienen elementos de células germinales y de los cordones sexuales/estroma gonadal.
5. Tumores misceláneos.
6. Tumores hemato-linfoides.
7. Tumores de los conductos y la rete testis.
La nueva clasificación divide los teratomas y los tumores del saco vitelino en tipo prepuberal (mejor pronóstico) y tipo postpuberal. En niños, existe un claro predominio (75%) de tumores de células germinales no relacionados con NCGIS, principalmente el teratoma de tipo prepuberal y el tumor de saco vitelino de tipo prepuberal. Los tumores de origen estromal (tumor de células de Sertoli, de Leydig de la granulosa juvenil) son benignos en edad pediátrica y suponen el 15% de los casos.
Los tumores malignos se diseminan por vía linfática y hematógena. La diseminación por vía linfática a los ganglios retroperitoneales solo ocurre en el 4-6%. Aparecen metástasis por vía hematógena en el 9% de los niños (frente al 60% de los adultos), el asiento más frecuente de estas es el pulmón(17,19,20).
A continuación, detallamos las características de los tipos más frecuentes de tumor testicular pediátrico.
Teratoma
El teratoma tipo pre-puberal es la estirpe histológica más frecuente en tumores testiculares en edad pediátrica. En niños, suelen ser benignos, aunque si aparecen en adultos, pueden ser malignos.
Histológicamente, se componen de 3 capas de tejido embrionario: ectodermo, endodermo y mesodermo.
Puede presentar tejido bien diferenciado como: cartílago, hueso, grasa, etc., y un componente quístico. Eso les confiere una apariencia ecográfica muy heterogénea con calcificaciones en su interior.
Se diferencian dos subtipos: el prepuberal, que tiene un comportamiento indolente y puede manejarse mediante tumorectomía, preservando tejido testicular de la gónada afecta; y el postpuberal, que es más agresivo y precisa orquidectomía inguinal radical.
Si en el estudio histológico de la pieza se evidencian elementos inmaduros o cambios puberales, deberá realizarse orquidectomía radical.
Tumor del saco vitelino (yolk sac tumor)
También llamados tumores del seno endodérmico. Aparecen principalmente en los primeros 2 años de vida. Se diferencian igualmente en dos tipos: pre-puberal y post-puberal. En niños, tienen un comportamiento bastante indolente, metastatizan por vía hematógena (principalmente al pulmón) y las metástasis a ganglios del retroperitoneo son muy raras (<5%).
Típicamente, presentan elevación de la alfa-fetoproteína.
Histológicamente, se caracterizan por presentar cuerpos de Schiller-Duval.
Incluso en estadios avanzados, el tumor responde bien a quimioterapia y la supervivencia global se acerca al 99%.
Tumor de células de Leydig
Es uno de los más frecuentes dentro del grupo de células no germinales.
El pico de incidencia se sitúa entre los 5 y los 9 años.
La tríada clínica característica incluye: masa testicular unilateral, pubertad precoz y niveles elevados de 17-cetoesteroides.
Histológicamente, se caracterizan por un hallazgo patognomónico que son los cristales de Reinke y se encuentran en el 40% de los pacientes.
Presentan un comportamiento benigno y permiten cirugía conservadora.
Tumor de células de la granulosa
Es igualmente benigno y puede manejarse mediante cirugía conservadora.
Debemos sospechar este tumor en neonatos con masa testicular, niveles normales de AFP y hallazgos ecográficos de masa compleja, multiseptada con partes quísticas.
Tumor de células de Sertoli
Muy raro. Aunque no tienen tanta actividad hormonal como los tumores de células de Leydig, algunos pacientes pueden presentar ginecomastia. En menores de 5 años, suelen tener un comportamiento benigno y permiten cirugía conservadora. Sin embargo, en mayores de 5 años, es preciso estadiaje y valoración de enfermedad a distancia, ya que su comportamiento es más virulento.
Gonadoblastoma
Generalmente relacionado con alteraciones intersexuales, aparecen sobre gónadas disgenéticas. Los pacientes son típicamente 46,XY fenotípicamente mujeres (síndromes de feminización testicular con testes intraabdominales, que sufren virilización en la pubertad). Hasta un tercio de los pacientes presentan lesiones bilaterales. El componente de células germinales implica un 10% de riesgo de malignización.
Los testes en localización escrotal tienen menor tendencia a malignizar y pueden ser sometidos a vigilancia y palpación con facilidad, lo que facilita la detección precoz de tumores.
Seminoma
Es excepcional en niños; pero, sin embargo, es el tipo de tumor testicular más frecuentemente encontrado en adultos que han presentado criptorquidia. Se trata con orquidectomía y radioterapia retroperitoneal.
Tratamiento
El tratamiento tradicional era la orquidectomía, pero ante el comportamiento benigno de la mayoría de tumores testiculares pediátricos, se tiende a un tratamiento conservador de la gónada en situaciones concretas.
Cirugía
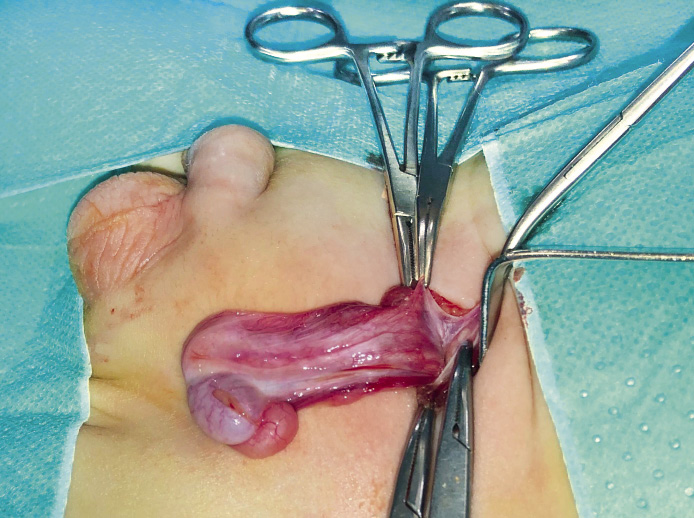
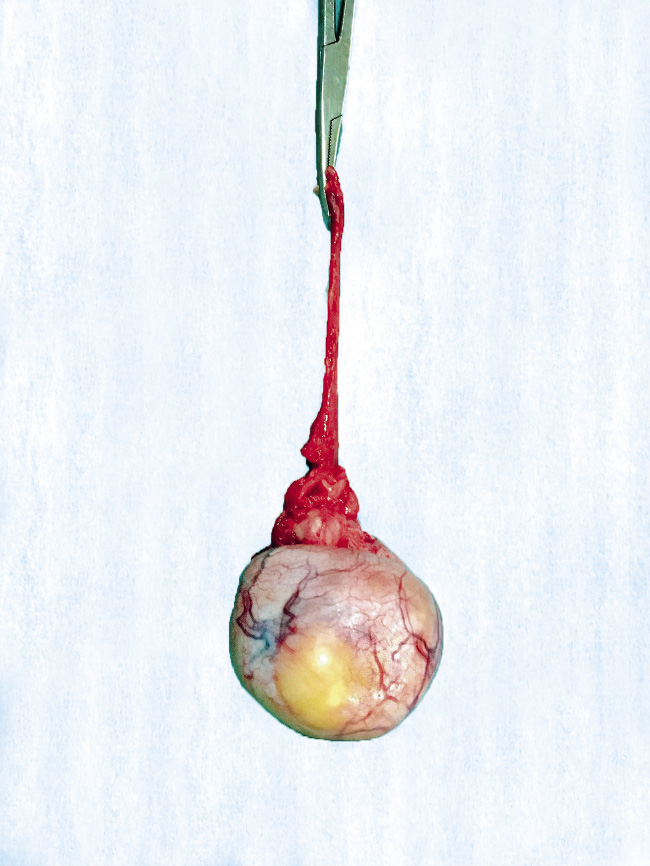
Tradicionalmente, el tratamiento estándar para los tumores testiculares ha sido la orquidectomía radical por abordaje inguinal con clampaje precoz del cordón espermático(1,23). En los últimos años, a la vista del comportamiento benigno de los tumores testiculares en niños, se está preconizando la cirugía conservadora (tumorectomía) en algunos casos seleccionados. Los criterios para considerar una cirugía conservadora incluyen: el tamaño del tumor (menor de 2 cm) y la negatividad de los marcadores tumorales. Algunos grupos plantean realizar una biopsia intraoperatoria y, en función del resultado, pasar en el mismo acto quirúrgico a realizar tumorectomía, si se informa como tumor benigno o bien orquidectomía, si el resultado fuera de malignidad(21-24) (Fig. 2).
Figura 2. Tumor testicular: orquidectomía por teratoma de tipo prepuberal de 5 cm.
Quimioterapia
Todos los pacientes diagnosticados de tumor testicular deben ser valorados por una unidad de Oncología Pediátrica. En función del resultado anatomopatológico del tumor, se hará necesario estudio de extensión y quimioterapia postoperatoria; por ejemplo, en tumores mixtos con componente de: coriocarcinoma, carcinoma embrionario o en seminomas.
Pronóstico
El pronóstico del tumor testicular primario en edad prepuberal es muy bueno.
El pronóstico global del tumor testicular prepuberal es muy bueno, con una supervivencia a los 5 años que se acerca al 99%(17,18,24).
Factores de riesgo para tumor testicular
• Criptorquidia: la criptorquidia implica un riesgo aumentado de tumor testicular. La corrección quirúrgica de la criptorquidia no anula el riesgo de presentar un tumor testicular a lo largo de la vida, pero lo disminuye y, además, facilita en alto grado la posibilidad de autoexploración y de detección precoz de una masa que aparece sobre el testículo ya situado a nivel escrotal(1,4,18,20).
• Disgenesia gonadal, hipovirilización.
• Microlitiasis testicular: las calcificaciones o microlitiasis testicular pueden ser: focales, multifocales o difusas (>5 microlitiasis), igualmente pueden presentarse uni o bilateralemente.
Recientemente, se ha descrito una relación entre microlitiasis testicular y tumores testiculares (concomitante en 15-46% de los pacientes), pero se encuentran incidentalmente también en el 5% de los varones sanos jóvenes. El riesgo de desarrollar cáncer en niños con microlitiasis testicular no está bien estudiado hasta el momento, pero parece que existen pacientes con bajo riesgo y alto riesgo de desarrollar tumor testicular. Los pacientes con microlitiasis que, además, presentan: historia de criptorquidia, teste atrófico o distrófico, anomalías cromosómicas conocidas y tumor testicular contralateral, podrían presentar riesgo aumentado de cáncer testicular y necesitan autoevaluación periódica y exploración escrotal y ecografías periódicas(25).
Quistes epididimarios
Concepto y epidemiología
Los quistes epidimarios son benignos y aparecen principalmente en mayores de 10 años. Se recomienda tratamiento conservador y seguimiento con ecografías, salvo que produzcan dolor o crezcan por encima de los 10 mm de diámetro.
Son dilataciones quísticas del epidídimo, cuyo tamaño suele oscilar entre 2 y 20 mm. Los quistes de epidídimo son poco frecuentes en la infancia y la mayoría de casos se diagnostican a partir de los 10 años. Son lesiones congénitas, pero suelen hacerse evidentes en torno a la adolescencia, posiblemente en relación con el comienzo de estímulo hormonal. Aparecen en cualquier zona del epidídimo, con cierta preferencia por la cabeza. Pueden ser múltiples y bilaterales (20% de los casos, aproximadamente)(26,27).
Clínica y manejo
Aproximadamente, la mitad de ellos son asintomáticos y se encuentran como hallazgo casual en una ecografía escrotal solicitada por otra causa. Si dan síntomas, estos pueden ser dolor o pesadez escrotal. Otras veces, el paciente consulta porque se ha palpado una masa en la zona superior de la bolsa escrotal (masa indolora). Excepcionalmente, pueden presentarse como un cuadro de escroto agudo, debido a sangrado o torsión del quiste. En la exploración, encontraremos una masa de consistencia media (no indurada) en la zona superior de la bolsa, sobre el testículo, a nivel del epidídimo, no dolorosa. La confirmación diagnóstica se hará mediante ecografía, que evidenciará una masa anecoica con refuerzo posterior, dependiente del epidídimo(26,28).
El diagnóstico diferencial debe establecerse con patología benigna como hidrocele (líquido alrededor del teste) o espermatocele. El espermatocele nunca aparece antes de la pubertad y asienta exclusivamente en la cabeza del epidídimo, y su contenido es un líquido espeso que contiene espermatozoides y, en el caso del quiste epididimario, su contenido es un líquido seroso claro. Se ha postulado que el espermatocele representa la forma del adulto del quiste de epidídimo(27,28) (Tabla III).
Manejo
Se trata de lesiones benignas cuya tasa de complicación es muy baja. En su evolución, pueden disminuir de tamaño o incluso regresar por completo. No existe consenso acerca del manejo adecuado. En lesiones pequeñas, se suele recomendar tratamiento conservador con seguimiento ecográfico, ya que generalmente no presentan grandes cambios de tamaño y la probabilidad de complicaciones es mínima. En lesiones mayores de 10 mm de diámetro que ocasionen síntomas y no tienden a regresar en el seguimiento o bien crecen, se recomienda quistectomía quirúrgica. El tratamiento mediante aspiración del quiste con escleroterapia se ha utilizado en adultos, pero no se ha estudiado su aplicación en edad pediátrica(27-29).
Hidrocele
Concepto
El hidrocele es un acúmulo de líquido alrededor del testículo. Es indoloro y no origina lesión para el testículo.
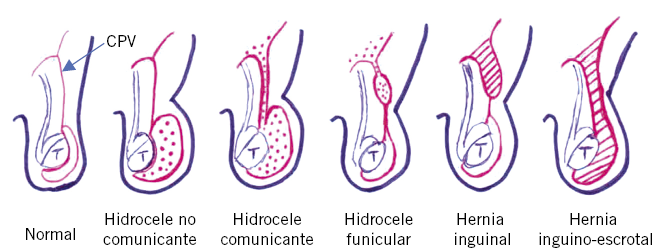
El hidrocele es una colección de líquido alrededor del testículo, contenida entre las capas visceral y parietal de la vaginal testicular, o bien en algún punto del cordón espermático en el interior del conducto peritoneo-vaginal (CPV). El CPV es una evaginación del peritoneo que está íntimamente relacionada con el proceso de migración testicular. El teste se forma en el retroperitoneo y debe migrar hasta situarse en la bolsa escrotal. En ese trayecto, se acompaña de esta proyección de peritoneo de forma tubular, el CPV(1,30).
Una vez que el teste alcanza su posición definitiva en la bolsa, la parte más distal del CPV formará la vaginal testicular y el resto de la estructura, desde orificio inguinal profundo hasta entrada del escroto, debe obliterarse por completo. Si una cantidad variable de líquido peritoneal queda atrapada en la vaginal una vez cerrado el CPV, puede dar lugar a un hidrocele no comunicante. Por otro lado, si el CPV no se ocluye y se fibrosa adecuadamente, persistirá una comunicación anormal entre el peritoneo y el escroto, a través de la cual podría introducirse líquido peritoneal, dando lugar a un hidrocele comunicante, o bien vísceras abdominales, dando lugar a una hernia inguinal indirecta.
Clasificación
Los hidroceles se clasifican en comunicantes y no comunicantes.
• Los comunicantes son debidos a un fallo en el cierre embriológico del CPV. Se desconoce el momento exacto del cierre del CPV, pero se cree que este ocurre también a lo largo del primer año de vida. Se ha visto que hasta el 40-60% de neonatos pueden tener el CPV permeable y, en hallazgos en autopsia de adultos, se encuentra en solo el 5% de los casos. Su tratamiento será quirúrgico a partir de los 2 años de edad. Se trata del mismo fallo embriológico que da origen a la hernia inguinal indirecta del niño, de la que solo difiere en el calibre de la comunicación (si la comunicación es amplia, dará síntomas como hernia, con paso de asas de intestino o epiplon; si la comunicación es estrecha, solo permitirá el paso de líquido peritoneal y originará un hidrocele comunicante). Es congénito, pero puede ponerse de manifiesto en cualquier momento sin causa subyacente, o bien de forma secundaria a cualquier proceso que incremente la presión intraabdominal o la presencia de líquido peritoneal (peritonitis, colocación de válvula de derivación ventrículo-peritoneal, ascitis…)(31).
• Los no comunicantes no tienen comunicación con el peritoneo y son muy frecuentes en neonatos y autolimitados en los primeros 2 años de vida. En este caso, el líquido que rodea el teste ha quedado atrapado en la vaginal tras la obliteración del CPV en el proceso de la migración testicular. Fuera de los dos primeros años de vida, los hidroceles no comunicantes pueden ser: idiopáticos (adolescente, por un desequilibrio entre la producción de líquido y la capacidad reabsortiva de la vaginal escrotal) o secundarios a torsión testicular, torsión de apéndice testicular, orquido-epididimitis, traumatismo o tumor testicular.
Formas de presentación y diagnóstico
El quiste funicular o hidrocele del cordón es una forma de hidrocele que se presenta como masa redondeada de consistencia firme en algún punto del recorrido del cordón espermático.
Típicamente, se presentan como un aumento de tamaño de un hemiescroto o del escroto y la región inguinal, asintomático, totalmente indoloro y que puede conferir una tonalidad violácea al escroto(30,32,33). Puede aparecer de forma bilateral. La transiluminación será típicamente traslúcida. Existen diferentes tipos de hidrocele que presentan características clínicas y evolutivas diferentes que pasamos a detallar (Fig. 3):
Figura 3. Esquema de patología de fallo de obliteración del conducto peritoneo-vaginal (CPV). Leyenda: T: testículo. Punteado: líquido peritoneal. Rayado: contenido abdominal.
• Hidrocele no comunicante: se presenta de forma estable y constante (no oscilante), con una tendencia progresiva a la disminución en los primeros meses de vida. Cuando aparece en adolescentes (hidrocele no comunicante tipo del adulto) no tiende a desaparecer. En la exploración, podemos encontrar un aumento de volumen escrotal de consistencia blanda que rodea el teste e incluso impide la palpación de la gónada, al estar rodeada de una gran cantidad de líquido.
• Hidrocele comunicante: se manifiesta de manera característica con un patrón oscilante, de forma que el aumento de tamaño del hemiescroto se hace patente principalmente al final del día, tras la actividad física intensa, o se incrementa en el contexto de infecciones víricas, mientras que desaparece o mejora con el decúbito y tras el descanso nocturno.
• Hidrocele o quiste funicular o quiste del cordón: es un acúmulo de líquido en una zona concreta del CPV en un tramo de su trayecto desde el orificio inguinal profundo hasta la vaginal escrotal, debido a una obliteración incompleta del mismo. Por lo tanto, se trata de un tipo concreto (una presentación clínica peculiar) del hidrocele comunicante. En este caso, el hidrocele se manifiesta como un quiste de líquido, bien a nivel inguinal (donde puede confundirse con hernia inguinal), o bien a nivel escrotal (sobre el teste), con consistencia más firme, debido a la existencia de una obliteración parcial que confina el líquido a una zona concreta del CPV en vez del relleno de la vaginal escrotal. En este caso, la consistencia más tensa e incluso la localización inguino-escrotal del hidrocele puede hacer dudar en el diagnóstico diferencial con hernia inguinal indirecta, en ese caso, la clínica (el hidrocele es asintomática y la hernia incarcerada suele ocasionar dolor) y la ecografía pueden ser de utilidad para el diagnóstico.
El diagnóstico es clínico, mediante la anamnesis (para describir las características paradigmáticas del hidrocele comunicante) y la exploración física. En caso de un hidrocele que parece no comunicante en un niño mayor de 2 años, puede estar indicada la realización de una ecografía para descartar patología subyacente (tumor).
Manejo
El manejo del hidrocele será conservador hasta los dos años. Los hidroceles que persistan más allá de esa edad serán comunicantes y precisan cirugía para ligadura del conducto peritoneo-vaginal persistente.
El hidrocele en el recién nacido y durante los primeros 18-24 meses de vida, se trata de manera conservadora, puesto que no origina síntomas y no supone un riesgo de complicaciones. El grueso de los hidroceles que aparecen en neonatos serán no comunicantes y autolimitados, tienden a desaparecer en los primeros dos años de vida. Si persiste más allá de esta edad, estaremos ante un hidrocele comunicante. El hidrocele comunicante precisa tratamiento quirúrgico electivo mediante inguinotomía para sección del CPV persistente y fenestración concomitante de las cubiertas testiculares. Los hidroceles secundarios a infecciones, traumatismos o tumores (reactivos) generalmente se resolverán espontáneamente, cuando se solvente la patología primaria(30,33).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Holcomb GW, Murphy PJ, Ostlie DJ. Ashcraft ‘s Pediatric Surgery. 6ª Edición Saunders-Elsevier 2014. p. 689-700. ISBN 978-1-4557-4333-9.
2. Radmayr C, Dogan HS, Hoebeke P, Kocvara R, Nijman R, Silay. Management of undescended testis: European Association of Urology/European Society for Paediatric Urology Guidelines. J Ped Urol. 2016; 12: 335-43.
3. Barthold JS, González R. The epidemiology of congenital cryptorchidism, testicular ascent and orchiopexy. J Urol. 2003; 170: 2396-401.
4.*** Haid B, Rein P, Oswald J. Undesceded testes: diagnostic algorithm and treatment. Eur Urol Focus. 2017; 3: 155-7.
5. Guven A, Kogan BA. Undescended testis in older boys. Further evidence that ascending testes are common. J Ped Surg. 2008; 43: 1700-4.
6. Kokorowski PJ, Routh JC, Graham DA. Variations in timing of surgery among boys who underwent orchidopexy por cryptorchidism. Pediatrics. 2010; 126: e576-82.
7. Kolon TF, Herndon CD, Baker LA. Evaluation and treatment of cryptorchidism: AUA guideline. J Urol. 2014; 192: 337-45.
8. Vincel B, Verkauskas G, Bilius V, Dasevicius D, Malcius D, Jones B, et al. Gonadotropin-releasing hormone agonist corrects defective mini-puberty in boys with cryptorchidism: a propspective randomized study. Biomed Res Int. 2018; 2018: 4651218.
9. Espósito C, Damiano R, González Sabin MA. Laparoscopy-assisted orchidopexy: an ideal treatment for children with intraabdominal testis. J endourol. 2002; 16: 659-62.
10. Skoog SJ, Roberts KP, Goldstein M, Pryor JL. The adolescent varicocele: what’s new with an old problem in young patients? Pediatrics. 1997; 100: 112.
11. Macey MR, Owen RC, Ross SS, Coward RM. Best practice in the diagnosis and treatment of varicocele in children and adolescents. Ther Adv Urol. 2018; 10: 273-82.
12. Locke JA, Noparast M, Afshar K. Treatment of varicocele in children and adolescents: a systematic review and meta-analysis of randomized controlled trials. J Ped Urol. 2017; 13: 437-45.
13. Kolon TF. Evaluation and management of the adolescent varicocele. J Urol. 2015; 194: 1194-201.
14. Guarino N, Tadini B, Bianchi M. The adolescent varicocele: the crucial role of hormonal tests in selecting patients with testicular disfunction. J Pediatr Surg. 2003; 38: 120-3.
15. Kolon TF, Clement MR, Cartwright L, Bellah R, Carr MC, Canning DA, et al. Transient asynchronous testicular growth in adolescent males with varicocele. J Urol, 2008; 180: 1111-4.
16. Barroso JU, Andrade DM, Novaes H, Netto JM, Andrade J. Surgical treatment of varicocele in children with open and laparoscopic Palomo technique: a systematic review of the literatura. J Urol. 2009; 181: 2724-8.
17. Friend J, Barker A, Khosa J, Samnakay N. Benign scrotal masses in children: some new lessons learned. J Ped Surg. 2016; 51: 1737-42.
18. Caballero Mora FJ, Muñoz Calvo MT, García Ros M, Rodríguez de Alarcón, Fernández Pérez ML, Casco F, et al. Tumores testiculares y paratesticulares en la infancia y adolescencia. An Pediatr. 2013; 78: 6-13.
19. Moch H, Cubilla AL, Humphrey PA, Reuter VE, Ulbright TM. WHO Classification of tumors of urinary system and male genital organs. Tumors of the testis and paratesticular tissue. Lyon: International Agency for Research on Cancer; 2016.
20. Chung JM, Lee SD. Overview of pediatric testicular tumors in Korea. Korean J Urol. 2014; 55: 789-96.
21.*** Romo Muñoz MI, Núñez Cerezo V, Doré Reyes M, Vilanova Sánchez A, González Peramato P, López Pereira P, et al. Tumores testiculares en la edad pediátrica: indicaciones de la cirugía conservadora. An Pediatr. 2018; 88: 253-8.
22. Borghesi M, Brunocilla E, Schiavina R, Gentile G, Dababneh H, Della Mora L, et al. Role of testis sparing surgery in the conservative management of small testicular masses: Oncological and functional perspectives. Actas Urol Esp. 2014; 39: 57-62.
23. Emre S, Ozcan R, Elicevik M, Emir H, Soylet Y, Buyukunay C. Testis sparing surgery for Leydig cell pathologies in children. J Pediatr Urol. 2017: 51, e-1.e4.
24. Caldwell BT, Saltzman AF, Maccini MA, Cost NG. Appropriateness for testis-sparing surgery based on the testicular tumor size in a pediatric and adolescent population. J Pediatr Urol. 2019; 15: 70.e1-70.e6.
25. Trout AT, Chow J, McNamara ER, Darge K, Ramírez Grueso R. Association between testicular microlithiasis and testicular neoplasia: large multicenter study in a pediatric population. Radiology. 2017; 285: 576-83.
26. Chillón Sempere FS, Domínguez Hinarejos C, Serrano Durba A, et al. Quistes epidimarios en la infancia. Arch Espa Urol. 2005; 58: 325-8.
27.*** Erikci V, Hosgor M, Aksoy N, Chen JJ, Steinhardt GF. Management of epididymal cysts in childhood. J Ped Surg. 2013; 48: 2153-6.
28. Posey ZQ, Ahn HJ, Junewick J, Chen JJ, Steinhardt GF. Rate and associations of epididymal cysts on pediatric scrotal ultrasound. J Urol. 2010; 184: 1739-42.
29. Bleve C, Conighi ML, Bucci V, Costa L, Chiarenza SF. Torsion of huge epididymal cyst in a 16-year-old boy: case report and review of the literatura. Pediatr Med Chir. 2018; 40: 162.
30. Palmer LS. Hernias and hidroceles. Pediatr Rev. 2013; 34: 457-64.
31. Jiménez Cabanillas MV, Vetter-Laracy S, Cobo P, Roca Jaume A. Meconial hidrocele as first sign of acute intestinal perforation in preterm baby. Arch Dis Chil Fetal Neonatal. 2019; 104: F169-170.
32. Espósito C, Escolino M, Turrà F, Roberti A. Current concepts in the management of inguinal hernia and hidrocele in pediatric patients in laparoscopic era. Semin Pediatr Surg. 2016; 25: 232-40.
33. Lau ST, LEEYh, Caty MG. Current management of hernias and hidroceles. Semin Pediatr Surg. 2007; 16: 50-7.
34. Luis Huertas AL, Espinosa Góngora R, Muñoz Calvo MT. Patología del descenso testicular. Pediatr Integral. 2014; XVIII(10): 718-28.
Bibliografía recomendada
– Haid B, Rein P, Oswald J. Undesceded testes: diagnostic algorithm and treatment. Eur Urol Focus. 2017; 3: 155-7.
Resumen muy esquemático y práctico de las recomendaciones de manejo de la criptorquidia de la ESPU (European Society of Pediatric Urology) y la AUA (American Urological Association). Resalta la importancia creciente que se otorga a la criptorquidia adquirida y el papel del pediatra en el reconocimiento precoz de esta entidad.
– Tumores testiculares en la edad pediátrica: indicaciones de la cirugía conservadora. Romo Muñoz MI, Núñez Cerezo V, Dore Reyes M, Vilanova Sánchez A, González-Peramato P, López-Pereira P, Martínez Urrutia MJ. An Pediatr. 2018; 88: 253-8.
En este artículo, se hace una revisión de los casos de tumores testiculares infantiles intervenidos en el Hospital La Paz en 15 años. Estudian las características y evolución, y proponen las condiciones que debe reunir un caso de tumor testicular en edad pediátrica para llevar a cabo cirugía conservadora de la gónada.
– Management of epididymal cysts in childhood. Erikci V, Hosgor M, Aksoy N, Okur O, Yildiz M, Dursun A, et al. J Ped Surg. 2013; 48: 2153-6.
Revisión retrospectiva de todas las ecografías escrotales realizadas en su centro en 4 años. Se encontraron 49 pacientes con quiste de epidídimo. Se detalla el manejo y el seguimiento de los pacientes y se evidencia una tendencia a la involución espontánea. Se recomienda reservar el tratamiento quirúrgico para los casos que generen dolor testicular importante o que crezcan en la evolución por encima de 10 mm.
| Caso clínico |
|
Varón de 3 años de edad que acude a consulta por la aparición de una tumoración escrotal derecha hace 1 mes. La madre refiere que ha notado que la tumoración algunos días presenta un volumen menor que otros. Es un niño sano, nacido a término y sin antecedentes de interés salvo otitis medias de repetición. No refiere: dolor inguino-escrotal, vómitos, cojera o síntoma alguno asociado a la tumoración. No ha presentado: síndrome general, astenia, pérdida de apetito ni fiebre. En la exploración, encontramos ambos testes en bolsa escrotal; y sobre el teste derecho, se palpa una masa firme (no pétrea), redondeada, bien definida y móvil, de unos 2 cm de diámetro. La transiluminación es translúcida.
|