|
| Temas de FC |
M.L. Alonso Álvarez*, R. Mínguez Verdejo**
*Coordinadora Unidad Multidisciplinar de Sueño y Ventilación , Dr. J. Terán Santos. Hospital Universitario de Burgos. Centro de Investigación Biomédica en Red de Enfermedades Respiratorias (CIBERES). **Pediatra de Atención Primaria. Centro de Salud de Algemesí. Valencia
| Resumen
Los trastornos respiratorios del sueño en la infancia constituyen una entidad prevalente y con consecuencias importantes, sobre todo, en la esfera neurocognitiva. El síndrome de apnea hipopnea del sueño (SAHS) en la infancia constituye uno de los trastornos respiratorios del sueño, la hipoxia intermitente, asociada a la fragmentación del sueño, producen una respuesta inflamatoria sistémica y el subsiguiente daño multisistémico. La hipertrofia adenoidea y amigdalar es una de las causas frecuentes en la primera infancia y la obesidad infantil ha provocado un aumento en la prevalencia de esta patología. Tampoco debemos olvidar que algunos pacientes, diagnosticados de trastorno de atención con hiperactividad, pueden tener como causa fundamental esta entidad. El retraso en el diagnóstico, provocará importantes secuelas, como en la esfera neurocognitiva, en estos niños. El papel del pediatra de Atención Primaria es fundamental en el diagnóstico y derivación para su mejor tratamiento. |
| Abstract
Sleep disordered Breathing (SDB) in childhood is a prevalent entity with important consequences especially in the neurocognitive sphere. Obstructive Sleep Apnea Syndrome in childhood (pediatric OSA) is a SDB, where intermittent hypoxia and sleep fragmentation lead to a systemic inflammatory response and subsequent multisystem damage. Another common cause in early childhood is adenoid and tonsillar hypertrophy, influenced by the increase in prevalence of childhood obesity. Furthermore, some children diagnosed as attention-deficit hyperactivity disorder could have this entity as a main cause. Diagnosis delay will lead to neurocognitive consequences in these children. The role of the primary health care pediatrician is essential in the diagnosis and referral for its best management. |
Palabras clave: SAHS infantil; Síndrome de apnea-hipoapnea del sueño infantil; Ronquido; Diagnóstico y tratamiento del SAHS infantil
Key words: Obstructive sleep apnea in children, sleep- disordered breathing, pediatric OSA, infant, obstructive sleep apnea, pediatric, snoring, diagnosis and treatment
Pediatr Integral 2018; XXII (8): 422 – 436
Trastornos respiratorios del sueño. Síndrome de apnea-hipoapnea del sueño en la infancia
Introducción
Los trastornos respiratorios del sueño (TRS) describen un conjunto de alteraciones que incluyen, según la última clasificación International Classification of Sleep Disorders – Third Edition (ICSD-3)(1), 4 tipos:
• Trastornos de apnea obstructiva del sueño (dos subtipos: del adulto y de la infancia).
• Trastornos de apnea central del sueño.
• Trastornos de hipoventilación relacionados con el sueño.
• Trastornos de hipoxemia relacionados con el sueño.
En este artículo vamos a tratar especialmente el primer grupo en la infancia, el síndrome de apnea-hipopnea obstructiva del sueño (SAHS). El SAHS es una alteración de la respiración durante el sueño, caracterizada por una obstrucción parcial, prolongada, de la vía aérea superior y/u obstrucción intermitente completa, que interrumpe la ventilación normal durante el sueño y los patrones normales del sueño(2).
Desgraciadamente, esta patología está muy infradiagnosticada. El retraso en el diagnóstico conlleva importantes complicaciones: disminución del rendimiento intelectual, problemas de comportamiento, hipersomnia diurna, retraso del desarrollo psicomotor, falta de crecimiento, hipertensión arterial y Cor Pulmonale(3).
Uno de los aspectos del SAHS al que se le ha dado más importancia en los últimos años, es el de su papel en el desarrollo de alteraciones neuropsicológicas, y se ha comprobado que los niños con SAHS son más propensos a tener problemas de aprendizaje, atención y desarrollo neurocognitivo(4).
Se estima que el uso de los servicios sanitarios que realizan los niños afectos de TRS no diagnosticados y no tratados incrementa en un 20% el número de visitas, con reducción del gasto sanitario después de su tratamiento(3).
El síntoma más común de los TRS es el ronquido durante el sueño. Es importante preguntar en las revisiones de salud sobre este síntoma. Es posible que un niño que inicialmente presenta un ronquido simple, empeore presentando un SAHS que precise tratamiento.
Es importante preguntar, en las revisiones de salud, sobre el síntoma ronquido y tenerlo anotado como diagnóstico codificado en las historias de salud (CIE 9: 786.09).
Actualmente, se cuestiona la inocuidad del ronquido y algunos estudios han encontrado asociación entre el ronquido habitual y trastornos neurocognitivos (falta de atención, hiperactividad, problemas de conducta o rendimiento escolar).
Prevalencia
La prevalencia del ronquido habitual se sitúa en un 7,45% (95% CI 5,75-9,61) y la del síndrome de apneas-hipopneas durante el sueño (SAHS) se sitúa entre el 1 y 5%, con un pico de incidencia máxima entre los 2 y 6 años(2,3).
La prevalencia del SAHS en población infantil obesa, se sitúa entre el 21,5 y el 46,6%, como se demostró en el estudio NANOS, primer estudio prospectivo que valora la prevalencia del SAHS en niños obesos de la comunidad y no en población clínica(5).
Fisiopatología
El niño presenta una serie de características anatómicas, fisiológicas y madurativas de la vía aérea superior (VAS), diferentes a las del adulto. La faringe debe ser colapsable para facilitar la salivación y el habla, sin embargo, esta colapsabilidad puede ser un obstáculo para la respiración. Durante la inspiración, se produce una presión negativa que favorece el colapso de los tejidos hacia el interior, que se contrarresta por la acción de los músculos dilatadores faríngeos. La faringe simula un modelo de resistor de Starling, de forma que cualquier factor que disminuya el tamaño faríngeo o aumente la compliance faríngea, puede favorecer el desarrollo de eventos respiratorios obstructivos. Así, la presión crítica (Prcrit), utilizada como medida objetiva de colapsabilidad de la VAS, es mayor (es decir, menos negativa) en niños con SAHS que en niños con ronquido primario(2,6).
La patogenia del SAHS infantil es multifactorial, siendo la conjunción de factores anatómicos y funcionales que, interactuando con factores ambientales y genéticos, conducen a un desequilibrio de la Vía Aérea Superior (VAS) traducido en un aumento de la colapsabilidad de la misma, que conduce a una alteración de la respiración y de la ventilación normal durante el sueño.
Factores anatómicos
La hipertrofia del tejido linfático de la vía aérea superior, particularmente la hipertrofia adenoidea y amigdalar en la edad infantil, supone la causa más frecuente de SAHS(2,3,6). Las amígdalas y las adenoides son mayores con respecto a las estructuras que las contienen entre los 3 y 6 años de edad, coincidiendo con un pico de incidencia máxima del SAHS en la infancia. En estudios realizados con Resonancia Magnética Nuclear (RMN)(6), se muestra como las medidas volumétricas obtenidas de las adenoides y las amígdalas de los niños con SAHS son significativamente mayores que las obtenidas en niños control. No obstante, es necesario considerar que no todos los niños con hipertrofia adenoamigdalar desarrollan SAHS.
Otra causa de estrechamiento de la VAS son las alteraciones cráneo-faciales, como: la micrognatia, la retrognatia o la hipoplasia mandibular o mediofacial, que suelen ir asociadas a síndromes malformativos como: el síndrome de Pierre–Robin, el síndrome de Treacher–Collins, el síndrome de Down, el síndrome de Crouzon o el síndrome de Apert, entre otros; patologías en las que la incidencia de SAHS está aumentada, sobre todo, en los niños menores de 2 años de edad(7).
Factores funcionales
Relacionados con la hipotonía faríngea del sueño REM y el control neurológico anómalo. La inmadurez neuromuscular, que conduce a hipotonía faríngea, es una de las teorías propuesta como mecanismo fisiopatológico del colapso dinámico inspiratorio de las estructuras supraglóticas que tiene lugar en la laringomalacia. La laringomalacia es una anomalía congénita frecuente en el recién nacido, presentando trastornos respiratorios obstructivos hasta en un 26% y, por tanto, causa frecuente de SAHS en niños menores de 2 años(7).
Factores genéticos
El SAHS es una patología heterogénea que engloba diferentes fenotipos que, a su vez, son influenciados por el efecto de: la obesidad, la edad, la raza y la comorbilidad, argumentando fuertemente la naturaleza poligénica del SAHS. En un estudio reciente, el índice apnea hipopnea por hora de sueño (IAH) se asoció significativamente con polimorfismo en el receptor GPR83 de la proteína G, una proteína expresada en múltiples regiones cerebrales de relevancia en el SAHS, como: el núcleo hipogloso, el núcleo motor dorsal del vago y el núcleo del tracto solitario(8).
La obesidad
En los últimos años, la obesidad ha adquirido rangos epidémicos afectando a todas las edades, incluida la edad infantil. Todos los mecanismos fisiopatológicos descritos previamente para niños no obesos, serían también aplicables para niños con obesidad, pero además, la obesidad en sí misma puede producir estrechamiento faríngeo, debido al depósito de tejido adiposo entre los músculos y en el tejido blando de la vía aérea superior (VAS). La interrelación entre obesidad e hipertrofia amigdalar en la patogenia del SAHS infantil, ha sido evaluada en el estudio NANOS(5), demostrándose que la hipertrofia adenoamigdalar y la obesidad son factores de riesgo independientes de SAHS infantil. Por otro lado, se ha sugerido una interacción recíproca entre obesidad y SAHS, y así, la obesidad predispone al SAHS, y el SAHS en sí mismo, puede también contribuir a la patogénesis de la obesidad. El SAHS se ha asociado con resistencia a la leptina y aumento de los niveles de grelina, favoreciendo la obesidad(6).
Clasificación
La clasificación que recoge el amplio abanico de posibilidades etiológicas es la propugnada por Arens(9), que clasifica el SAHS infantil en cuatro fenotipos distintos:
• SAHS fenotipo I: hipertrofia adenoamigdalar.
• SAHS fenotipo II: craneofaciales.
• SAHS fenotipo III: neurológicos.
• SAHS fenotipo IV: obesos.
Comorbilidades
Las consecuencias inmediatas de la obstrucción de la vía aérea superior durante el sueño son: cambios en la presión intratorácica, hipoxemia intermitente, fragmentación del sueño e hipoventilación alveolar, asociándose con importante morbilidad, con afectación de diferentes órganos y sistemas; de ahí, la importancia de un diagnóstico precoz y de un tratamiento adecuado del SAHS infantil.
Alteraciones del crecimiento
El retraso en el crecimiento o estancamiento ponderal es una de las manifestaciones clínicas del SAHS en la infancia, sin embargo, es necesario tener en cuenta que realmente se trata de una consecuencia de la presencia de un SAHS no tratado, siendo su origen multifactorial(3).
Morbilidad cardiovascular
Hipertensión arterial sistémica: recientemente se ha demostrado que la presencia de un IAH (índice de apneas/hipopneas) > 5/hora, se asocia a aumentos de la TA sistólica y diastólica(10). Los niños con SAHS presentan niveles más altos de tensión arterial diastólica nocturna y una disregulación de la tensión arterial, con aumento de la variabilidad de la TA.
• Alteraciones de la geometría y de la estructura del ventrículo izquierdo y derecho: cuando se comparan: niños sanos, niños con ronquido habitual sin apneas y niños con SAHS, se encuentran diferencias significativas en estos parámetros, implicándose al péptido natriurético (BNP) como uno de los factores relacionados con estos cambios(6).
• Disfunción endotelial: la disfunción endotelial es considerada como un precursor temprano de aterosclerosis y se ha comprobado que en los niños con SAHS, la respuesta hiperémica post-oclusiva revela deterioro de la función endotelial y, en los niños en los que concurren SAHS y obesidad, la magnitud de la disfunción endotelial es mayor(11).
• Hipertensión pulmonar: una de las primeras complicaciones descritas del SAHS en niños fue la hipertensión pulmonar y el cor pulmonale. Las desaturaciones de oxígeno durante el sueño inducen vasoconstricción pulmonar, pudiendo conducir a elevación de la presión a nivel de la arteria pulmonar. Sin embargo, los mecanismos por los cuales, solo en determinados casos graves, se desarrolla hipertensión pulmonar no son aún, suficientemente conocidos(2,3,7,10).
Morbilidad neurocognitiva del SAHS
La hipoxia intermitente se ha relacionado con efectos deletéreos sobre las funciones neuronales e intelectuales.
• Trastornos del comportamiento, como: trastornos de conducta, labilidad emocional, ansiedad y síntomas depresivos, son más frecuentes en niños con trastornos respiratorios del sueño (TRS)(2,3,10).
• Inatención e hiperactividad: los TRS en los niños se asocian con aumento de frecuencia de síntomas de inatención e hiperactividad (conducta TDAH-like) y, por otro lado, los niños con déficit de atención e hiperactividad presentan aumento de la frecuencia de TRS(10).
• Déficits cognitivos: los TRS del sueño en niños se han asociado a un aumento de la prevalencia de déficit cognitivo y dificultades académicas. El estudio CHAT (A Randomized Trial of Adenotonsillectomy for Childhood Sleep Apnea)(12) es el primero y, hasta el momento, único estudio controlado, randomizado, realizado en población infantil, que valora los cambios neurocognitivos en los niños diagnosticados de SAHS y tratados con adenoamigdalectomía, frente a los niños no tratados en lista de espera. Se incluyeron 464 niños entre 5 y 9 años y, aunque el tratamiento quirúrgico demostró: mejoría significativa en los parámetros respiratorios del sueño, sintomatología clínica, calidad de vida y comportamiento, la mejoría en la esfera cognitiva no alcanzó significación estadística. Sin embargo, es necesario tener en cuenta que este estudio no incluyó niños menores de 5 años, ni SAHS moderado-grave con desaturaciones importantes y el seguimiento fue solo de 7 meses.
• La excesiva somnolencia diurna asociada al SAHS en los niños, ha sido valorada fundamentalmente mediante valoración subjetiva por medio de cuestionarios validados, siendo pocos los estudios realizados con medidas objetivas, como el test de latencias múltiples del sueño (MSLT); sin embargo, cuando se han utilizado estas medidas objetivas, se muestra un aumento de la somnolencia diurna en niños con SAHS y, sobre todo, en niños obesos con SAHS, y la magnitud de la reducción de la latencia al sueño se ha asociado con medidas de inflamación sistémica, como el TNF-Alfa(6,10).
Enuresis nocturna
Los niños con SAHS presentan una alta prevalencia de enuresis nocturna(10). En la relación del SAHS y la enuresis, se han postulado como mecanismos patogénicos: la presencia de arousals y fragmentación del sueño, así como la alteración de la secreción hormonal, como el BNP (péptido natriurético auricular), y así en niños con SAHS se han comunicado niveles elevados de BNP matutino(6).
Morbilidad endocrino-metabólica
El término síndrome metabólico se define como: la asociación de resistencia a la insulina, dislipemia, hipertensión arterial y obesidad, siendo un claro factor de riesgo cardiovascular. La presencia de TRS puede aumentar hasta 6,5 veces la probabilidad de desarrollar síndrome metabólico en relación con los niños que no presentan trastornos respiratorios durante el sueño(2,6,10).
En los niños pequeños prepuberales, el SAHS se asocia a un aumento de la resistencia a la insulina, fundamentalmente cuando concurren SAHS y obesidad(2,3,6), y los estudios que han valorado el efecto del tratamiento del SAHS sobre los parámetros metabólicos aportan resultados discordantes. Así, mientras que el estudio CHAT no encuentra mejoría en las lipoproteínas circulantes en niños de 5-9 años con SAHS después del tratamiento quirúrgico de adenoamigdalectomía, estudios recientes muestran mejoría en los niveles de colesterol total, HDL-colesterol y LDL-colesterol, tanto en niños obesos como en no obesos(6).
Es necesario tener en cuenta que la población infantil es población en continuo crecimiento y desarrollo y, por tanto, sujeta a cambios endocrino-metabólicos, lo cual justifica en parte los resultados discordantes encontrados en los estudios realizados, estando influenciado por la edad, el estado puberal y la concurrencia de obesidad.
Inflamación
Los ciclos repetidos de hipoxia, reoxigenación y restauración de la ventilación durante los periodos de obstrucción de la vía aérea superior, están implicados en la producción de estrés oxidativo e inflamación. Las evidencias científicas actuales demuestran que el SAHS actúa como una entidad desencadenante de mediadores inflamatorios. Los niños con SAHS presentan aumento de citokinas proinflamatorias como: la IL-6, el interferón γ y el TNF-α. La proteína C reactiva, reactante de fase aguda producida en el hígado, emerge como un fuerte e independiente predictor de morbilidad cardiovascular. Se ha demostrado que, en los niños con SAHS, la proteína C reactiva se correlaciona con la severidad de la enfermedad y desciende después del tratamiento efectivo, aunque también es necesario tener en cuenta que no todos los niños con SAHS presentan aumento de los niveles de proteína C reactiva, habiéndose relacionado con variantes genéticas(13).
En cuanto a la morbilidad relacionada con el SAHS, es importante considerar que no todos los niños con SAHS desarrollan comorbilidad, lo cual puede estar relacionado con la existencia de una determinada susceptibilidad individual mediada genéticamente.
Clínica
Los pacientes que presentan SAHS muchas veces pasan desapercibidos; pues, en muchas ocasiones, los padres no consultan por esta patología y los pediatras deberemos estar atentos a distintos síntomas que pueden presentarse. Los síntomas de estos niños los podemos clasificar en: nocturnos, diurnos y asociados a la hipertrofia amigdalar (Tabla I).
Hay diferencias en la sintomatología en los niños obesos, más parecido al SAHS del adulto, presentando más frecuentemente: somnolencia diurna asociada y menores síntomas de hiperactividad.
Diagnóstico en Atención Primaria
El diagnóstico de sospecha de los TRS se debería iniciar desde los primeros controles de salud incluidos en el programa del niño sano. Así, la Academia Americana de Pediatría recomienda que, en los controles de salud, se investigue el sueño en todos los niños. Si el niño presenta ronquido y síntomas o hallazgos clínicos sugestivos de SAHS, se iniciará la escalada diagnóstica específica de TRS. Para ello, es útil el cuestionario de BEARS (Tabla II) y, si se detecta ronquido, utilizar el cuestionario de Chervin (Tabla III)(14).
Añadir un cuestionario específico de apnea del sueño, incrementa la probabilidad diagnóstica (de un 26% por historia clínica a un 53% con un cuestionario específico)(3,14,15).
La evaluación de un niño con sospecha clínica de SAHS debe incluir: la historia clínica general y específica de sueño, así como la exploración física completa y de la esfera otorrinolaringológica, con especial atención a la anatomía craneofacial y de la vía aérea superior(2,3,10,15).
Historia y anamnesis
• Antecedentes familiares (SAHS, hábito tabáquico, alergias). Posición habitual durante el sueño. Presencia e intensidad del ronquido. Evidencia de pausas nocturnas. Preocupación paterna sobre la respiración del niño. Respiración bucal. Despertares nocturnos frecuentes. Enuresis secundaria. Cambios escolares o conductuales. Excesiva somnolencia diurna (no predice SAHS en niños pequeños, sí en obesos).
• Cuestionario PSQ de Chervin (Tabla III): para niños de entre 2-18 años, con una línea de corte 33% con sensibilidad 0,85 y especificidad 0,87. Valora entre otras cosas, la calidad de vida del niño antes y después de la intervención.
Exploración clínica
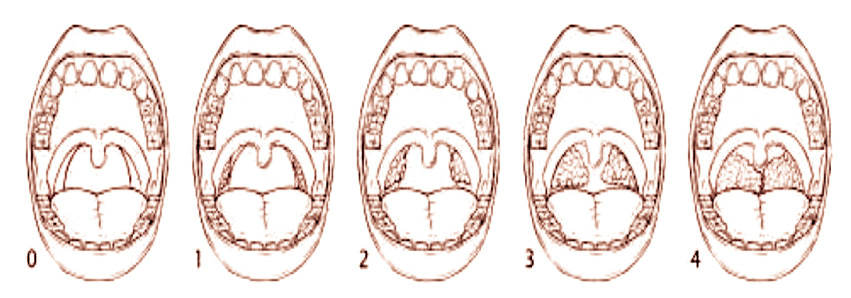
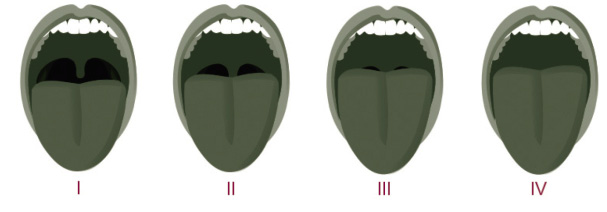
• Anatomía craneofacial y vías respiratorias altas, valorando: la presencia de respiración bucal, facies adenoidea, hipertrofia amigdalar (Fig. 1), Mallampati (Fig. 2), retrognatia, maloclusión, maxilar estrecho y macroglosia.
Figura 1. Valoración de la hipertrofia amigdalar: la hipertrofia amigdalar se define clásicamente en 4 grados, de 0 a IV, en función del grado de obstrucción del espacio inter-amigdalino, de 0% a 100%.
Figura 2.
Puntuación modificada de Mallampati: valoración del espacio libre entre amígdalas según la escala o clasificación de Mallampati. Esta escala analiza la anatomía de la cavidad oral para predecir la facilidad de intubación.
• Clase I: total visibilidad de las amígdalas, úvula y paladar blando.
• Clase II: visibilidad del paladar duro y blando, porción superior de las amígdalas y úvula.
• Clase III: son visibles el paladar duro y blando y la base de la úvula.
• Clase IV: solo es visible el paladar duro.
• Exploración cardiopulmonar, valorando: la presencia de posible desplazamiento impulso máximo, soplo sugestivo de regurgitación tricuspídea observación del trabajo respiratorio, cianosis, variabilidad de la frecuencia cardiaca, medida de la tensión arterial sistólica y diastólica, descripción del patrón y frecuencia respiratoria y presencia de pectus excavatum.
• Somatometría y cambios recientes.
Criterios diagnósticos
Los siguientes criterios diagnósticos (Algoritmo 1) han sido publicados en 2011(3), en el Documento de Consenso del Síndrome de Apneas hipopneas durante el Sueño en niños, y los clasifica en criterios mayores y criterios menores:
• Cuando un roncador habitual presenta 4 criterios mayores o 3 criterios mayores + 2 criterios menores, debe ser derivado al otorrinolaringólogo y/o a unidad de sueño. Estos criterios serían menos aplicables en niños más pequeños o con comorbilidades (enuresis, hiperactividad o problemas de aprendizaje).
• Otros autores (Kadmon G, Chung SA, Shapiro CM) aconsejan un cuestionario sencillo I’M SLEEPY (Tabla IV, adaptadas al castellano), que presenta una alta sensibilidad (82%) y una más modesta especificidad (50%).
Ante un diagnóstico de SAHS infantil, debemos anotarlo con código diagnóstico (CIE 9: 327.23) para el adecuado seguimiento.
Pruebas complementarias
• Radiografía lateral de faringe y cefalometría: no indicada para el diagnóstico de SAHS, pues estando el niño despierto y en bipedestación, no se observaría el colapso de la vía aérea.
• Audio y videograbación en el hogar: en el SAHS, en la mayoría de las ocasiones, la exploración e inspección durante la vigilia es completamente normal y se hace necesaria la observación del niño durante el sueño. Esto se realiza mediante una videograbación que se realiza durante media hora, con la cabeza y el tórax del niño visibles, sin ropa que impida observar los movimientos respiratorios. Suele realizarse sobre las 5 a 5 y media de la mañana o cuando los padres hayan observado con anterioridad una mayor incidencia de alteraciones respiratorias. Se valora según el score de Sivan (Tabla V).
Tiene una sensibilidad del 94% y una especificidad del 68%, presentando una alta correlación con la polisomnografía (84%). Las puntuaciones de vídeo >10 fueron altamente predictivos de SAHS, mientras que los puntuaciones <5 se asociaron con la normalidad. En niños con score entre 6-10, se debería realizar una polisomnografía (PSG). Es importante visualizar el vídeo en pantalla grande, pues si se visualiza en el móvil, pueden no ser tan llamativas las retracciones torácicas y la puntuación sería menor.
• La nasofaringoscopia con endoscopio flexible nos permite valorar la localización de la región de la obstrucción y, actualmente, prácticamente ha sustituido a la radiografía lateral de cráneo.
También, hay que estar atento en el seguimiento de ciertas patologías que no son frecuentes, pero en las cuales, la prevalencia del SAHS es mayor:
• Malformaciones craneofaciales, con retrognatia, micrognatia, macroglosia o hipoplasia mediofacial.
• Enfermedades neuromusculares: enfermedad de Duchenne, parálisis cerebral infantil, poliomielitis, traumatismo craneoencefálico o tumores cerebrales.
• Otras enfermedades: de depósito (Cushing, mixedema, Hurler, Hunter), metabolopatías, laringomalacia, drepanocitosis o asma.
Diagnóstico en laboratorio de sueño
Todas las guías clínicas y consensos existentes establecen que el diagnóstico de certeza del SAHS en niños, requiere la realización de un estudio de sueño(2,3,7,10,15).
En el año 2011, el Documento de Consenso del síndrome de apneas-hipopneas durante el sueño en niños(3), plantea una estrategia diagnóstico-terapéutica en la que se incluyen la historia clínica y la exploración física, como herramientas que ayudarán a la priorización de la realización de estudios de sueño y a establecer un abordaje diagnóstico-terapéutico.
En el año 2015, la Task-Force Europea(10) realiza una revisión sistemática de la literatura desde 1970 a diciembre del 2014, y de nuevo se establece la necesidad de realización de un estudio de sueño para establecer el diagnóstico y graduar la severidad del SAHS en población infantil, planteando al igual que el Documento de Consenso, una estrategia de abordaje diagnóstico-terapéutico en la que, además, se incluyen poblaciones de riesgo diferentes a la hipertrofia adenoamigdalar y/o obesidad (como síndrome de Down, malformaciones craneofaciales o enfermedades neuromusculares, etc.).
Polisomnografía nocturna (PSG)
El método diagnóstico de elección del SAHS en los niños sigue siendo, hoy en día, la Polisomnografía Nocturna (PSG) vigilada, realizada en laboratorio de sueño.
La PSG nocturna consiste en el registro continuo y supervisado del estado de vigilia y de sueño espontáneo, mediante el registro de variables neurofisiológicas y cardiorrespiratorias. Requiere un entorno específico adecuado para la edad infantil y adaptarse al horario de los niños, además de personal entrenado, tanto en la realización de la técnica como en su interpretación. En el año 2006, se publican los valores polisomnográficos de normalidad en niños y, en 2007, la American Academy of Sleep Medicine (AASM) publica los criterios para: la identificación de apneas y su clasificación, hipopneas, limitaciones al flujo, hipoventilación nocturna y de respiración periódica en niños, siendo actualizados estos criterios en el 2012 y en el 2015(16). Estos criterios permiten una valoración cuantitativa objetiva de los trastornos respiratorios del sueño y de los patrones de sueño, sin embargo, la estratificación en categorías de severidad ha sido realizada de forma empírica. El IAH: número de apneas obstructivas, centrales, mixtas e hipopneas por hora de sueño, es el parámetro polisomnográfico más utilizado para la descripción de la severidad del SAHS, otro parámetro utilizado es el RDI (Respiratory Disturbance Index), que englobaría el número de apneas obstructivas, centrales y mixtas, hipopneas y RERAS (respiratory events related arousals) por hora de sueño.
Un índice de apneas de 1 es estadísticamente significativo, sin embargo, se ha utilizado como punto clínicamente relevante el IAH correspondiente a más de 3 desviaciones estándar de los valores normales de IAH en niños sanos. En los últimos años, se establece la importancia de tratar al paciente no únicamente en función de los valores obtenidos del estudio de sueño, sino englobados en el conjunto de severidad de síntomas, factores de riesgo y presencia de morbilidad relacionada con el SAHS, que permitan establecer una adecuada estrategia diagnóstico-terapéutica.
Actualmente, se consideran dos definiciones de puntos de corte en niños entre 2-18 años(10):
• Definición 1: IAH obstructivo ≥ 2/hora de sueño o un índice de apnea obstructiva por hora de sueño ≥ 1 en presencia de síntomas sugestivos de TRS e hipertrofia adenoamigdalar, con o sin obesidad y sin otras anomalías.
• Definición 2: utilizada en la mayoría de los estudios publicados, SAHS definido como: síntomas de trastornos respiratorios del sueño en combinación con IAH ≥ 1/hora de sueño.
Poligrafía respiratoria (PR)
La PSG no es una técnica al alcance de todos los centros, por tanto, es necesaria la búsqueda de técnicas diagnósticas alternativas. Los sistemas portátiles o de poligrafía respiratoria (PR) son sistemas diseñados inicialmente para su utilización en el domicilio y que típicamente incluyen la medida de variables cardiorrespiratorias, pero no de variables neurofisiológicas, debiendo incluir: flujo oronasal (generalmente, medido con termistor y/o cánula nasal), esfuerzo respiratorio (torácico y/o abdominal), saturación de oxígeno por pulsioximetría, posición corporal, ronquido y frecuencia cardiaca. La limitación principal de la PR es que carece de parámetros neurofisiológicos y, por tanto, no permite conocer la estructura de sueño y tampoco la diferenciación del sueño y la vigilia, pudiendo conducir a una infraestimación. La PR ha sido validada para su utilización en niños(17) y así se refleja en el Documento de Consenso para Diagnóstico y Tratamiento del SAHS infantil(2) y la Task-Force Europea(10), que reconocen la utilidad diagnóstica de la PR, siempre que sea realizada en el marco de Unidades de Sueño debidamente acreditadas y con polígrafos validados en población infantil. Su principal indicación sería el estudio de pacientes con alta o baja probabilidad de padecer un SAHS, mientras que los pacientes con probabilidad media y aquellos con comorbilidad asociada o resultados dudosos se deberán realizar una PSG completa.
En los últimos años, se han realizado importantes esfuerzos en la investigación de pruebas diagnósticas alternativas a la PSG, como: las grabaciones audio-vídeo, cuestionarios, radiografía lateral de cuello, pulsioximetría, poligrafía respiratoria y marcadores plasmáticos y urinarios. La validez diagnóstica de estas técnicas fue analizada en una revisión sistemática, obteniendo elevada precisión diagnóstica: la poligrafía cardiorrespiratoria y los biomarcadores(18).
Técnicas diagnósticas prometedoras, actualmente en investigación y que en el futuro nos ayudarán en el diagnóstico del SAHS infantil son: la determinación de biomarcadores y la pulsioximetría mediante la utilización de redes neurales.
Tratamiento
El esquema de tratamiento del SAHS obstructivo en niños, siguiendo el Consenso Español y la Task-Force Europea se muestra en el algoritmo 2.
Estaría indicado tratamiento independientemente de la presencia o no de morbilidad asociada, si en el estudio de sueño (PSG o poligrafía respiratoria validada) presenta un IAH ≥ 5/hora de sueño.
Cuando el IAH se sitúa entre 1 y 5, se debe valorar la presencia de morbilidad asociada: cardiovascular, neurocognitiva, enuresis, retraso o fracaso del crecimiento, descenso de la calidad de vida o la presencia de factores de riesgo para la persistencia de trastornos respiratorios del sueño.
El tratamiento de elección del SAHS en los niños es quirúrgico (adenoamigdalectomía)(2,3,10,15).
Tratamiento quirúrgico
La adenoamigdalectomía es el tratamiento de elección para los TRS en el niño y obtiene la normalización de los trastornos respiratorios, de la sintomatología diurna y la reversión en muchos casos de las complicaciones asociadas al SAHS. La eficacia de la adenoamigdalectomía es de aproximadamente el 78% en el SAHS infantil(19), sin embargo, esta eficacia es variable en los estudios publicados, dependiendo de las poblaciones incluidas y del criterio utilizado para establecer el diagnóstico y la tasa de éxito quirúrgico (variando entre 27,2-66,3%), y son aún menores en población infantil obesa (12-49%)(5,10) El estudio CHAT demostró que el tratamiento quirúrgico mejora de forma significativa los parámetros respiratorios del sueño, la calidad de vida y el comportamiento. El riesgo posquirúrgico pediátrico oscila entre el 0 y el 1,3%, sin embargo, en los niños con SAHS, se han encontrado tasas de entre el 16-27%(2,3,10), con mayor incidencia de complicaciones respiratorias (9,4%), hasta 5 veces más frecuentes que en los niños sin SAHS. Por ello, se recomienda monitorización en el postoperatorio en los casos de mayor riesgo: edad menor de 3 años, anomalías craneofaciales, retraso de crecimiento, obesidad, parálisis cerebral, cor pulmonale y/o graves alteraciones en el estudio polisomnográfico previo a la intervención quirúrgica.
Determinados grupos poblacionales presentan aumento de riesgo de SAHS residual, recomendándose reevaluación clínica en todos los niños SAHS después de la cirugía.
Otros tratamientos quirúrgicos, como la tonsilotomía, no muestra diferencias significativas en la resolución del SAHS cuando se compara con la tonsilectomía y, sin embargo, el riesgo de recurrencia del SAHS es significativamente mayor(6,7).
Otras técnicas quirúrgicas estarían indicadas únicamente en casos seleccionados. La cirugía craneofacial se ha mostrado útil en niños con alteraciones craneofaciales sindrómicas. La traqueotomía es eficaz en el tratamiento del SAHS, pero se asocia con peor calidad de vida y problemas psicosociales, además de las complicaciones asociadas. En la práctica clínica, las cirugías craneofaciales y la traqueotomía únicamente estarían indicadas ante SAHS grave con contraindicación o fracaso de otros tratamientos quirúrgicos o no quirúrgicos(6,7,10).
CPAP (presión positiva continua sobre la vía aérea)
Constituye la segunda línea de tratamiento del SAHS en la infancia(2,3,10), el tratamiento con CPAP estaría indicado ante: SAHS residual tras adenoamigdalectomía, SAHS relacionado con obesidad, alteraciones craneofaciales o enfermedades neuromusculares añadidas a la hipertrofia adenoamigdalar o sin hipertrofia adenoamigdalar(2,3,7,10).
La titulación de presión de CPAP en niños es necesario realizarla con PSG nocturna(2,3,10) y es necesaria la realización de controles periódicos, puesto que son niños en crecimiento, y los requerimientos en presión y el ajuste de la mascarilla cambian con el crecimiento y el desarrollo, siendo muy importante la detección precoz de efectos secundarios derivados del tratamiento.
La CPAP no es un tratamiento curativo, lo cual implica que su aplicación debe ser continuada, por ello obtener un adecuado cumplimiento resulta imprescindible.
El estudio de los factores predictores de adherencia al tratamiento con CPAP en niños muestra que el uso durante la primera semana de tratamiento predice su utilización a largo plazo. Técnicas de reforzamiento y conductuales han demostrado ser eficaces para mejorar la adherencia a la CPAP.
El tratamiento con cánulas nasales de alto flujo puede ser una alternativa al tratamiento con CPAP, requiriéndose actualmente más estudios.
Oxigenoterapia
El tratamiento con oxígeno en niños con SAHS puede ocasionar aumento de los niveles de CO2 por ello no se debe administrar oxígeno a los niños con SAHS, sino es asociado a monitorización cardiorrespiratoria o en presencia de soporte ventilatorio(3).
Tratamiento conservador
En todo niño obeso, la dieta es una de las primeras medidas terapéuticas, aunque, incluso en niños obesos con hipertrofia adenoamigdalar, la primera opción de tratamiento es la adenoamigdalectomía(2,3,6,10). Se ha demostrado la eficacia de la pérdida de peso como tratamiento en adolescentes obesos, sin embargo, no hay estudios en este sentido en niños obesos más pequeños.
Tratamiento farmacológico
El tratamiento con corticoides tópicos nasales y/o antagonistas de receptores de leucotrienos, administrados durante 6-12 semanas, reduce la severidad del SAHS leve-moderado, con respuesta menos favorable en los niños obesos o mayores de 6 años(6,10), y es eficaz en el SAHS residual post adenoamigdalectomía.
Tratamiento ortodóntico
En pacientes seleccionados con alteraciones craneofaciales, procedimientos ortodóncicos, como la expansión rápida del maxilar, que aumenta el diámetro transverso del paladar duro, pueden ser eficaces. La Cochrane concluye que los dispositivos intraorales son beneficiosos como tratamiento coadyuvante en niños con SAHS no sindrómicos o con alteraciones craneofaciales, sin embargo, aún faltan estudios que valoren la respuesta al tratamiento ortodóncico con respecto a las consecuencias del SAHS(2,3,6,10,20).
El objetivo del tratamiento del SAHS infantil es la completa resolución de los TRS y no debe enfocarse desde la perspectiva de una única opción de tratamiento, sino que debe ser un tratamiento individualizado y, en muchos casos, en niveles y combinado, que conduzcan a la resolución de los trastornos respiratorios del sueño.
Seguimiento
Todo niño con SAHS debe ser reevaluado después de cada tratamiento.
Todo niño con SAHS debe ser reevaluado clínicamente a los 6-12 meses de tratamiento, valorando: síntomas, calidad de vida, morbilidad cardiovascular y neurocognitiva, enuresis y patrón de crecimiento(3) (Algoritmo 3).
• Los estudios de sueño estarían indicados en el seguimiento del SAHS infantil(3,10):
- En población de riesgo de persistencia del SAHS: niños que presentaran SAHS grave, previo a cirugía y en aquellos que, aunque no fueran SAHS grave, persistan factores de riesgo de SAHS o persistan síntomas de SAHS tras la cirugía.
- En SAHS leve, que hayan recibido tratamiento con corticoides tópicos y/o tratamiento con antagonistas de leucotrienos.
En cuanto a cuándo realizar el estudio de sueño, estaría indicado a partir de las 6 semanas del tratamiento quirúrgico de adenoamigdalectomía, a las 12 semanas del tratamiento con corticoides tópicos y/o antileucotrienos, a los 12 meses del tratamiento con expansión rápida del maxilar o antes, si los síntomas persisten, y a partir de los 6 meses del tratamiento con dispositivos orales(10).
Durante el seguimiento, puede estar indicada la realización de técnicas de evaluación de la vía aérea superior, sobre todo, en los casos de recidiva del SAHS y en SAHS residual:
• La tomografía axial computarizada (TAC) y resonancia magnética nuclear (RMN) pueden ser útiles en casos seleccionados, sin embargo, su utilidad y relación coste-eficacia es controvertido, no siendo recomendable su realización de forma habitual.
• La fibroendoscopia durante el sueño inducido por drogas (DISE), tiene el propósito de evaluar de manera dinámica, la vía aérea en la posición supina durante un estado de sueño inducido. Permite evaluar otras posibles causas de SAHS como: la laringomalacia, la hipertrofia de la amígdala lingual o la glosoptosis y, actualmente, se propone como parte de la rutina para determinar el origen de la obstrucción de la vía aérea en los niños con persistencia de enfermedad tras adenoamigdalectomía.
Los factores identificados hasta el momento, como factores de riesgo de SAHS residual son: obesidad, SAHS severo prequirúrgico con un IAH > 20/hora de TST (TST: tiempo total de sueño), edad > 7 años, Mallampati grado III-IV, raza afro-americana, asma, anomalías craneofaciales, anomalías cromosómicas, como la trisomía 21, y enfermedades neuromusculares.
La ganancia de peso post-tratamiento del SAHS es uno de los factores de riesgo que es necesario monitorizar y controlar; en el estudio CHAT, encuentran mayor aumento del IMC en los niños después de adenoamigdalectomía que en los niños en lista de espera, Los niños con rápido aumento de peso post-operatoriamente tienen más riesgo de recurrencia apnea obstructiva del sueño.
Los TRS pueden resolverse espontáneamente, en el estudio CHAT, un 42% de los niños en lista de espera mostró normalización de su IAH a los 5 meses, esta mejoría puede deberse al crecimiento de la vía aérea o a la regresión del tejido linfoide, pero faltan datos de seguimiento a más largo plazo.
Factores de riesgo identificados para la persistencia del SAHS no tratado, incluyen: obesidad y aumento del percentil IMC, género masculino, severidad del SAHS con un IAH obstructivo > 5, raza afroamericana y condiciones complejas subyacentes, como: alteraciones cromosómicas, enfermedades neuromuscular o anomalías craneofaciales.
Es necesario considerar que hay importantes variaciones fenotípicas en términos de morbilidad específica para cada grado de severidad del SAHS y, en esta línea, las investigaciones recientes se centran en la identificación de biomarcadores para la caracterización de fenotipos y predicción del éxito del tratamiento, que conducirá a la individualización del tratamiento.
Función del pediatra de Atención Primaria en el SAHS
El papel del pediatra de Atención Primaria es fundamental, pues él será el responsable del diagnóstico precoz de esta patología. En las revisiones de salud, se interrogará en relación al ronquido. Si fuera el caso, habría que utilizar un cuestionario específico de diagnóstico y realizar una visita programada para indicar a la familia la importancia del despistaje de esta enfermedad, y una exploración detenida en este sentido. Para ello, es muy útil la realización de vídeo que nos pondrá en evidencia: las pausas respiratorias, los microdespertares y el esfuerzo respiratorio. Así, el diagnóstico será más preciso y la derivación al ORL o a la unidad de sueño, con mayor número de datos clínicos. El tratamiento correcto evitará las complicaciones. Hay ciertas patologías que se asocian al SAHS: obesidad, niños con retraso de crecimiento, niños hiperactivos, síndrome de Down, alérgicos, niños con reflujo gastroesofágico, rinitis alérgica, asma, pacientes con malformaciones craneofaciales o también síndromes genéticos. Tampoco hay que olvidar el seguimiento correcto de estos pacientes, de ahí la importancia en la codificación correcta, tanto del ronquido como del SAHS, incluso después del tratamiento, pues existen recidivas.
Los pediatras de Atención Primaria tienen un papel esencial en la detección precoz del SAHS infantil y, por lo tanto, en la prevención de las complicaciones y secuelas a largo plazo.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. American Academy of Sleep Medicine. International classification of sleep disorders. 3rd ed. Darien, IL: American Academy of Sleep Medicine; 2014.
2.** Marcus CL, Brooks LJ, Draper KA, Gozal D, Halbower AC, Jones J, et al. American Academy of Pediatrics. Diagnosis and management of childhood obstructive sleep apnea syndrome. Pediatrics. 2012; 130: 576-84. doi: 10.1542/peds.2012-1671. Epub 2012 Aug 27. PMID:22926173.
3.*** Alonso-Álvarez ML, Canet T, Cubell-Alarco M, Estivill E, Fernández-Julián E, Gozal D, et al. Documento de Consenso del síndrome de apneas-hipopneas durante el sueño en niños (versión completa). Arch Bronconeumol. 2011; 47: 2-18.
4.** Hunter SJ, Gozal D, Smith DL, Philby MF, Kaylegaian J, Kheirandish-Gozal L. Effect of Sleep-disordered breathing severity on cognitve performance measures in a large community cohort of young school-aged children. Am J Respir Crit Care Med. 2016; 194: 739-47.
5.** Alonso-Álvarez ML, Cordero-Guevara JA, Terán-Santos J, González-Martínez M, Jurado-Luque MJ, Corral-Peñafiel J, et al. Obstructive sleep apnea in obese community-dwelling children: the NANOS study. Sleep. 2014; 37: 943-9. doi: 10.5665/sleep.3666. PMID: 24790273.
6. Dehlink E, Tan HL. Update on paediatric obstructive sleep apnoea. J Thorac Dis. 2016; 8: 224-35.
7.*** Kaditis AG, Alonso-Álvarez ML, Boudewyns A, Abel F, Alexopoulos EI, Ersu R, et al. ERS Statement on obstructive sleep disordered breathing in 1 to 23 month-old children. Eur Respir J. 2017; 50: 1700985. doi: 10.1183/13993003.00985-2017.
8. Kheirandish-Gozal L, Gozal D. Genotype-Phenotype interactions in pediatric obstrucive sleep apnea. Respir Physiol Neurobiol. 2013; 189: 338-43.
9. Arens R, Muzumdar H. Childhood obesity and obstructive sleep apnea syndrome. J Appl Physiol. 2010; 108: 436-44.
10.*** Kaditis AG, Alonso-Álvarez ML, Boudewyns A, Alexopoulos EI, Ersu R, Joosten K, et al. Obstructive sleep disordered breathing in 2- to 18-year-old children: diagnosis and management. Task-Force Report. ERS Statement. Eur Respir J. 2016; 47: 69-94. doi: 10.1183/13993003.00385-2015. Epub 2015 Nov 5. PMID: 26541535.
11.* Gozal D, Kheirandish-Gozal L. Cardiovascular morbidity in obstructive sleep apnea. Oxidative stress, inflammation and much more. Am J Respir Crit Care Med. 2008; 177(4): 369-75. Epub 2007 Nov 1. PMID: 17975198.
12.*** Marcus CL, Moore RH, Rosen CL, Giordani B, Garetz SL, Taylor HG, et al. Childhood Adenotonsillectomy Trial (CHAT). A randomized trial of adenotonsillectomy for childhood sleep apnea. N Engl J Med. 2013; 368: 2366-76. doi: 10.1056/NEJMoa1215881. Epub 2013 May 21. PMID: 23692173.
13. De Luca Canto G, Pacheco-Pereira C, Aydinoz S, Major PW, Flores-MIR C, Gozal D. Biomarkers associated with obstructive sleep apnea and morbidities: a scoping review. Sleep Med. 2015; 16: 347-57. doi: 10.1016/j.sleep.2014.12.007. Epub 2015 Jan 15. PMID: 2547333.
14. Versión española del Pediatric Sleep Questionnaire. Un instrumento útil en la investigación de los trastornos del sueño en la infancia. Análisis de su fiabilidad. An Pediatr (Barc). 2007; 66: 121-8.
15.*** Grupo de trabajo de la Guía de Práctica Clínica sobre Trastornos del Sueño en la Infancia y Adolescencia en Atención Primaria. Guía de Práctica Clínica sobre Trastornos del Sueño en la Infancia y Adolescencia en Atención Primaria. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Unidad de Evaluación de Tecnologías Sanitarias de la Agencia Laín Entralgo; 2011. Guías de Práctica Clínica en el SNS: UETS n.º 2009/8. (Fecha de acceso: 28 de junio de 2018). Disponible en:
http://www.guiasalud.es/GPC/GPC_489_Trastorno_sue%C3%B1o_infadol_Lain_Entr_compl.pdf.
16. Berry RB, Brooks R, Gamaldo CE, Harding SM, Lloyd RM, Marcus CL and Vaughn BV for the American Academy of Sleep Medicine. The AASM Manual for the Scoring of Sleep and Associated Events: Rules, Terminology and Technical Specifications, Version 2.2. www.aasmnet.org. Darien, Illinois: American Academy of Sleep Medicine, 2015.
17. Alonso-Álvarez ML, Terán-Santos J, Ordax Carbajo E, Cordero-Guevara JA, Navazo-Egüia AI, Kheirandish-Gozal L, et al. Reliability of home respiratory polygraphy for the diagnosis of sleep apnea in children. Chest. 2015; 147: 1020-8. doi: 10.1378/chest.14-1959. PMID25539419.
18. Brockmann PE, Alonso-Álvarez ML, Gozal D. Diagnosing Sleep Apnea-Hypopnea Syndrome in Children: Past, Present, and Future. Arch Bronconeumol. 2018; 54: 303-5. doi: 10.1016/j.arbres.2018.01.002. Epub 2018 Feb 13.
19. Lim J, McKean MC, Hearne BJ. Whithdrawn: Adenotonsillectomy for obstructive sleep apnoea in children. Cochrane Database Syst Rev. 2015; (9): CD003136. doi: 10.1002/14651858.CD003136.pub3. PMID: 26418217.
20. Camacho M, Chang ET, Song SA, Abdullatif J, Zaghi S, Pirelli P, et al. Rapid maxillary expansion for pediatric obstructive sleep apnea: A systematic review and meta-analysis. Laryngoscope. 2017; 127: 1712-9. doi: 10.1002/lary.26352. Epub 2016 Oct 31. Review. PMID: 27796040.
21. Russi Delfraro ME, Sans Capdevila O. Trastornos respiratorios durante el sueño. El niño con enfermedad crónica: papel del sueño en la evolución. Pediatr Integral. 2010; XIV(9): 737-43.
Bibliografía recomendada
- Consenso Español: Luz Alonso-Álvarez M, Canet T, Cubell-Alarco M, Estivill E, Fernández-Julián E, Gozal D, et al; Sociedad Española de Sueño; Área de Sueño de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Consensus document on sleep apnea-hypopnea syndrome in children (full version). Sociedad Española de Sueño. El Área de Sueño de la Sociedad Española de Neumología y Cirugía Torácica (SEPAR). Arch Bronconeumol. 2011; 47: 0, 2-18. doi: 10.1016/S0300-2896(11)70026-6. Epub 2011 Jun 22. PMID:22682520.
El Documento de Consenso del síndrome de apneas-hipopneas durante el sueño en niños publicado en 2011, vigente en el momento actual, es el primer documento elaborado por especialistas procedentes de diferente ámbitos de la medicina de sueño de nuestro país y avalado por 5 sociedades médicas. En este documento, se realiza una revisión de la literatura, abarcando: los aspectos de definición, fisiopatología, comorbilidad relacionada con el síndrome de apneas-hipopneas del sueño en niños y un abordaje diagnóstico y terapéutico que se inicia desde Atención Primaria, aportando una estrategia no basada únicamente en los valores obtenidos de los estudios de sueño, sino también, teniendo en cuenta la comorbilidad asociada y la selección del tratamiento más adecuado. Dentro de esta estrategia diagnóstico-terapéutica, se incluye también el seguimiento y control después del tratamiento.
- Task-Force Europea: Kaditis AG, Alonso-Álvarez ML, Boudewyns A, Alexopoulos EI, Ersu R, Joosten K, et al. Obstructive sleep disordered breathing in 2- to 18-year-old children: diagnosis and management.Task-Force Report. ERS Statement. Eur Respir J. 2016; 47: 69-94. doi: 10.1183/13993003.00385-2015. Epub 2015 Nov 5. PMID: 26541535.
The European Respiratory Society (ERS) Scientific Committee aprobó el desarrollo de este documento de diagnóstico y tratamiento de los trastornos respiratorios del sueño en niños en abril del 2012, con la participación de expertos de diferentes países europeos. Inicialmente, se realizó una revisión sistemática de la literatura y la calidad de los artículos fue graduada de I-IV de acuerdo a “The American Academy of Neurology Clinical Practice Guideline Process Manual”. Inicialmente, se revisaron 15.149 artículos y fueron utilizadas 362 referencias para la preparación del documento ERS Task-Force. Las características fundamentales de la Task-Force Europea es que se refiere a todo el espectro de trastornos respiratorios del sueño de carácter obstructivo en los niños de 2 a 18 años, abarcando desde el ronquido primario a la apnea obstructiva del sueño. La Task-Force describe paso a paso, el abordaje diagnóstico terapéutico, estructurada en 7 partes que abarcan desde los factores de riesgo para el desarrollo de trastornos respiratorios del sueño al abordaje diagnóstico y terapéutico con reconocimiento de la morbilidad y trastornos coexistentes con los TRS.
– CHAT (A Randomized trial adenotonsillectomy for childhood sleep apnea): Marcus CL, Moore RH, Rosen CL, Giordani B, Garetz SL, Taylor HG, et al; Childhood Adenotonsillectomy Trial (CHAT). A randomized trial of adenotonsillectomy for childhood sleep apnea. N Engl J Med. 2013; 368: 2366-76. doi: 10.1056/NEJMoa1215881. Epub 2013 May 21. PMID: 23692173.
El estudio CHAT es el primer y único estudio randomizado-controlado realizado en población infantil, cuyo objetivo principal es valorar la eficacia del tratamiento quirúrgico de adenoamigdalectomía frente a no tratamiento en niños con síndrome de apneas-hipopneas durante el sueño. La principal aportación del estudio es la demostración de la efectividad del tratamiento quirúrgico y, aunque el objetivo principal era demostrar el impacto neurocognitivo y no se alcanzó significación estadística, sí se demostró: la mejoría de los síntomas, de las variables polisomnográficas, calidad de vida y comportamiento. Asimismo, en este estudio se demuestra cómo la población infantil obesa y los niños con SAHS más grave, presentan mayor riesgo de persistencia de SAHS tras el tratamiento quirúrgico. Este estudio es el único randomizado y constituye un referente.
- Estudio nanos: Alonso-Álvarez ML, Terán-Santos J, Navazo-Egüia AI, Martínez MG, Jurado-Luque MJ, Corral-Peñafiel J, et al; Spanish Sleep Network. Treatment outcomes of obstructive sleep apnoea in obese community-dwelling children: the NANOS study. Eur Respir J. 2015; 46: 717-27. doi: 10.1183/09031936.00013815. Epub 2015 Jun 11. PMID: 26065566.
El estudio NANOS es el primero en la literatura que valora la prevalencia de SAHS en población infantil obesa de la comunidad y no en población clínica, como eran los estudios existentes previamente. Este estudio demuestra que la obesidad en sí misma es un factor de riesgo de SAHS en población infantil. El tratamiento de elección del SAHS infantil es la adenoamigdalectomía, pero además, es necesario tener en cuenta que otras opciones terapéuticas también pueden ser necesarias. En este estudio se demuestra, además, que los resultados del tratamiento en población infantil obesa son peores, con mayor riesgo de persistencia del SAHS después de tratamiento, siendo: la edad, el índice de apneas-hipopneas en el momento del diagnóstico y la obesidad, los factores relacionados con persistencia de enfermedad.
- Guía de trastornos del sueño en la infancia y la adolescencia: Grupo de trabajo de la Guía de Práctica Clínica sobre Trastornos del Sueño en la Infancia y Adolescencia en Atención Primaria. Guía de Práctica Clínica sobre Trastornos del Sueño en la Infancia y Adolescencia en Atención Primaria. Plan de Calidad para el Sistema Nacional de Salud del Ministerio de Sanidad, Política Social e Igualdad. Unidad de Evaluación de Tecnologías Sanitarias de la Agencia Laín Entralgo; 2011. Guías de Práctica Clínica en el SNS: UETS Nº 2009/8.
Se trata de una Guía de Práctica Clínica dirigida especialmente para Pediatría, en la que se abordan los diferentes trastornos del sueño, incluyendo los trastornos respiratorios del sueño. En esta Guía, se realiza una graduación de la evidencia existente, que permite trasladar el conocimiento a la práctica clínica, incluyendo la descripción de las técnicas necesarias para el diagnóstico en cada uno de los niveles asistenciales, abarcando desde la historia clínica y exploración física hasta la realización de estudios de sueño, utilizando la estrategia diagnóstica-terapéutica descrita en el Consenso del 2011.