| Temas de FC |
J.A. Madrid*, G. Pin Arboledas**, M.C. Ferrández Gomariz***
*Laboratorio de Cronobiología. IMIB-Arrixaca, Universidad de Murcia. CIBERFES, Instituto de Salud Carlos III. España. **Coordinador Unidad Pediatría Integral y Unidad de Sueño. Hospital Quironsalud. Valencia. ***Pediatra de Atención Primaria. Tenerife. Grupo de sueño de la SEPEAP
| Resumen
El sistema circadiano está constituido por un conjunto de estructuras que generan, coordinan y sincronizan el ritmo de sueño-vigilia y el resto de los ritmos circadianos, tanto internamente como con el ambiente, sincronizando la fase de los diferentes ritmos con el ciclo de luz-oscuridad natural. Este sistema está compuesto por: marcapasos centrales, osciladores periféricos, un reloj molecular, retina, glándula pineal y vías de entrada y de salida de información. Durante el primer semestre de la vida, van apareciendo y madurando los diferentes ritmos circadianos en el lactante. Destaca la influencia de la interacción sincrónica madre-hijo como elemento preventivo de la cronodisrupción. En ese aspecto, el papel del pediatra de Atención Primaria, como educador sanitario, es de enorme importancia. Cada individuo tiene un ritmo circadiano endógeno; de tal manera que, según el momento de actividad y descanso, de dormir y despertar, pueden existir diferentes variaciones (cronotipos). Existe un cronotipo matutino que se duerme y se despierta muy temprano y que está más alerta, con más capacidad de trabajo y ejercicio por la mañana y un cronotipo vespertino en el que todos estos procesos se retrasan, ya que se duermen y se despiertan muy tarde. La mayoría de la población se encuentra en algún punto intermedio entre ambos cronotipos. |
| Abstract
The circadian system is constituted by a set |
Palabras clave: Ritmo circadiano; Sueño-vigilia; Cronotipo
Key words: Circadian rhythm; Sleep-wake; Chronotype
Pediatr Integral 2018; XXII (8): 385 –395
Organización funcional del sistema circadiano humano.
Desarrollo del ritmo circadiano en el niño.
Alteraciones del ritmo vigilia-sueño. Síndrome de retraso de fase
Organización funcional del sistema circadiano humano
La vida en la Tierra no se manifiesta de forma constante a lo largo del día. Los animales, las plantas e incluso los organismos unicelulares varían su actividad con un ritmo sincronizado al ciclo de rotación de 24 horas del planeta. Esto ocurre gracias a la presencia de un reloj circadiano que, en organismos superiores, debido a su complejidad, es considerado un auténtico sistema medidor del tiempo, el sistema circadiano.
El sistema circadiano está constituido por un conjunto de estructuras que generan, coordinan y sincronizan el ritmo de sueño-vigilia y el resto de los ritmos circadianos, tanto internamente (organizando los diferentes ritmos biológicos en el organismo y en cada una de sus células), como con el ambiente, sincronizando la fase de los diferentes ritmos con el ciclo de luz-oscuridad natural. Este sistema está compuesto por: un marcapasos central, osciladores periféricos, un reloj molecular, retina, glándula pineal y vías de entrada y de salida de información.
Marcapasos y osciladores circadianos
El núcleo supraquiasmático es el marcapasos central, pero todos los tejidos y órganos poseen su propio oscilador circadiano (osciladores periféricos).
El principal regulador de los ritmos circadianos son los núcleos supraquiasmáticos (NSQ), localizados en el hipotálamo anterior(1,2). La actividad eléctrica de cada neurona individual de los NSQ puede oscilar con un período de aproximadamente 24 h en respuesta a la actividad de un reloj molecular que comprende varios bucles de retroalimentación positivos y negativos, generados por la expresión rítmica de genes de reloj y sus proteínas correspondientes.
Las neuronas de los NSQ parecen organizarse en grupos o “clusters”, cuya actividad oscilante está internamente sincronizada, activándose cíclicamente con un periodo propio y ligeramente diferente a las 24 h. En el embrión, pueden aparecer ritmos circadianos como consecuencia de las señales sincronizadoras enviadas por la madre a través de la placenta; sin embargo, tras el nacimiento, este patrón circadiano es sustituido por un ritmo ultradiano. Esto ocurre como consecuencia de que cada cluster está desacoplado de los demás, lo que favorece la aparición del patrón ultradiano a partir de diferentes patrones circadianos desacoplados entre sí. Con la edad, aumenta progresivamente el grado de acoplamiento entre clusters, produciendo finalmente un patrón circadiano maduro. Por último, al final de la vida, de nuevo se produce un progresivo desacoplamiento, volviendo a emerger el patrón ultradiano(3). La actividad física y la exposición al ciclo natural de luz-oscuridad favorecen el acoplamiento interno en el NSQ.
Además del marcapasos central, todos los tejidos y órganos poseen su propio oscilador circadiano (osciladores periféricos) con una fase específica que, en condiciones fisiológicas, está orquestada por los NSQ. El mantenimiento de un orden temporal adecuado y preciso de los ritmos generados por diferentes osciladores circadianos es una condición necesaria para preservar un estado saludable. Sin embargo, bajo ciertas condiciones, los osciladores periféricos pueden desacoplarse del NSQ y se comportan como osciladores autónomos, generando su propia estructura circadiana. Esta característica apoya la teoría de que el sistema circadiano se comporta como una red resonante y no tanto como un sistema jerárquico. Los relojes periféricos permitirán que los tejidos y órganos individuales respondan de manera diferente a las señales generadas por el NSQ y reaccionen selectivamente a algunas señales ambientales, como el tiempo de alimentación.
Entradas al sistema circadiano: zeitgebers
El marcapasos circadiano debe ajustarse periódicamente por la acción de ciertos factores ambientales, denominados sincronizadores o zeitgebers.
La actividad de los NSQ es suficiente para que aparezcan los ritmos circadianos. Sin embargo, para que estos ritmos puedan sincronizarse con los ciclos ambientales, el marcapasos circadiano debe ajustarse periódicamente por la acción de ciertos factores ambientales, denominados sincronizadores o zeitgebers, que oscilan rítmicamente con un periodo de 24 horas y que, en conjunto, actúan como las entradas al reloj. Entre estos sincronizadores, el más importante es el ciclo de luz-oscuridad, aunque los horarios de las comidas, la actividad física, los horarios de sueño y los contactos sociales también actúan como sincronizadores(4).
La información fótica se transmite al NSQ a través del tracto retinohipotalámico, formado por axones originados en una subpoblación de células ganglionares de la retina, que no participan en la formación de imágenes conscientes. Estas células contienen un fotopigmento, melanopsina, cuya sensibilidad es máxima a la luz azul de 460-480 nm, que no está presente en bastones y conos(5). La presencia de estas células fotosensibles, que se proyectan al NSQ, explica por qué los ritmos circadianos de ratas ciegas (sin conos y bastones) permanecen sincronizados con el ciclo de luz-oscuridad ambiental(6).
Salidas del sistema circadiano: melatonina
Uno de los mediadores humorales del NSQ mejor caracterizados es la melatonina. Esta hormona interviene en la regulación del sueño y en los ritmos circadianos.
El NSQ utiliza: señales físicas (temperatura), neurales (conexiones selectivas del SNA simpático y parasimpático) y humorales (glucocorticoides y melatonina), para transmitir su información temporal a otras estructuras cerebrales que participan, por ejemplo, en la regulación del ritmo de sueño y vigilia. Uno de los mediadores humorales del NSQ mejor caracterizado es la melatonina. Esta hormona interviene en la regulación del sueño y en los ritmos circadianos y estacionales(7). Su síntesis está bajo una doble regulación, ya que responde a la estimulación noradrenérgica del NSQ, activada durante la noche subjetiva, pero a la vez, está sujeta a la acción inhibitoria directa de la luz. La producción de esta hormona muestra un ritmo circadiano marcado, con niveles plasmáticos bajos durante el día y con un pico durante la noche, independientemente de las características nocturnas o diurnas del organismo(8). Por lo tanto, la melatonina también se conoce como: “la hormona de la oscuridad”.
La melatonina ejerce numerosas funciones fisiológicas y muestra efectos pleiotrópicos en todo el organismo. Participa en la regulación de los ritmos circadianos mediante la modulación de la actividad eléctrica de los NSQ y mediante el ajuste de la fase del reloj circadiano. Estos efectos cronobiológicos de la melatonina están mediados por sus interacciones con los receptores de membrana MT1/MT2(9). Así, mientras la activación de MT1 modula la actividad eléctrica de los NSQ, parece que la de los receptores MT2 está implicada en el ajuste de fase de los ritmos. Efectos que dependen: del momento circadiano, la duración de la exposición y la sensibilidad de los receptores a la melatonina. Así, cuando la melatonina exógena se administra durante la tarde al comienzo de la noche, induce un avance en la fase del reloj circadiano; por el contrario, se observan retrasos en los ritmos circadianos, cuando la melatonina se administra al final de la noche o en las primeras horas del día. Además de su papel como cronobiótico(10), la melatonina tiene propiedades antitumorales, neuroprotectoras, inmunomoduladoras, antiinflamatorias y antioxidantes(9,11). Los efectos protectores de la melatonina frente al estrés oxidativo pueden estar mediados parcialmente por su interacción con la enzima quinona reductasa 2 y los receptores RORα, así como por su capacidad para actuar como un bloqueante directo de los radicales libres(12).
La actividad de los NSQ generando ritmos circadianos y su capacidad para responder a algunos de estos ritmos está estrechamente unida. Por ejemplo, los ritmos de sueño-vigilia se pueden considerar como una salida de los NSQ, pero, a su vez, este ritmo determina: la exposición a la luz, el tiempo de alimentación y el ejercicio físico, todos ellos considerados como zeitgebers del sistema circadiano. De acuerdo con Roenneberg(13,14), podemos llamar a estos ritmos, que son a la vez entrada y salida del sistema circadiano, zeitnehmers (del alemán “tomador del tiempo”). Además del ritmo sueño-vigilia, la melatonina y la actividad física pueden considerarse también como zeitnehmers.
El reloj molecular circadiano
Cada célula porta un reloj molecular interno que, gracias a la acumulación y degradación de ciertas proteínas, asegura la periodicidad de procesos tan importantes como el sueño o el hambre.
Tanto en los NSQ como en los relojes periféricos, cada célula se comporta como un oscilador circadiano autónomo. A nivel celular, los osciladores circadianos son el resultado de la existencia de ciclos de retroalimentación positivos y negativos, en los cuales los productos de la expresión de determinados genes (genes reloj) inhiben su propia transcripción, generando una ritmicidad de alrededor de 24 horas(15). Los principales componentes que se han identificado en el reloj de los mamíferos son: los genes Clock y Bmal1, como elementos positivos, y los genes Per (Per1, Per2 y Per3) y los criptocromos (Cry1 y Cry2), como elementos negativos(16).
El componente positivo del circuito de retroalimentación está integrado por las proteínas CLOCK y BMAL1, que heterodimerizan en el citoplasma y se trasladan al núcleo, donde activan la transcripción de genes reloj (Per, Cry, Rev-Erbα) y genes controlados por reloj (clock controlled genes o CCG), entre los que se incluyen: genes reguladores clave del ciclo celular y del metabolismo. Los CCG representan aproximadamente el 10% del genoma, dependiendo del tejido.
El circuito de retroalimentación negativa comprende los heterodímeros PER: CRY, que se translocan al núcleo donde suprimen su propia transcripción al inhibir la actividad de CLOCK y BMAL1. Mientras tanto, la proteína REV-ERBα suprime la transcripción de Bmal1 al unirse a los elementos que conforman la respuesta a Rev-erbα/ROR presente en su promotor. En consecuencia, los niveles de ARN de Bmal1 disminuyen, mientras que los de Per y Cry aumentan. Cuando los heterodímeros CRY: PER suprimen su propia transcripción a nivel nuclear (al actuar sobre CLOCK-BMAL1), también inhiben la transcripción de Rev-erbα, permitiendo que se active la transcripción de Bmal1.
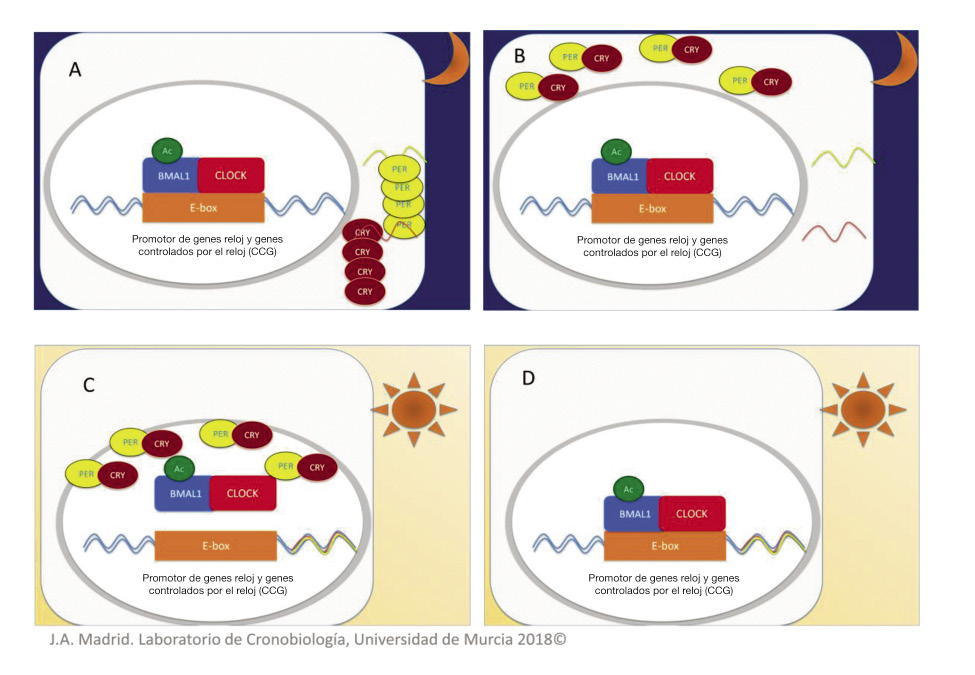
La frecuencia aproximada de 24 horas del reloj molecular se deriva principalmente de modificaciones postraduccionales, como la fosforilación y la ubiquitinación, procesos que afectan la estabilidad y la translocación de los genes del reloj al núcleo. De esta manera, la caseína quinasa 1 épsilon (CK1ε) y la caseína quinasa 1 delta (CK1ð) son los factores críticos que modulan el funcionamiento del reloj. La importancia de estas modificaciones postraduccionales de los componentes del reloj queda demostrada por estudios que muestran que las mutaciones en CK1ε tienen un efecto sobre la periodicidad circadiana. CK1ε fosforila las proteínas PER, por lo que no están disponibles inmediatamente para formar dímeros, lo que lleva a un ciclo circadiano con un período más largo. Cuando este gen muta y la proteína muestra una actividad de fosforilación reducida, las proteínas PER se internalizan en el núcleo más rápidamente, acortando el ciclo (Fig. 1).
Figura 1. Esquema del funcionamiento del reloj molecular. A. Durante la noche, los factores de transcripción BMAL1 y CLOCK se unen a una secuencia de ADN E-BOX favoreciendo la expresión de los genes reloj Per y Cry. B. Estos genes dan lugar a la síntesis de las proteínas PER y CRY, que dimerizan espontáneamente y se acumulan en el citoplasma de la célula. C. Al comenzar el día, los dímeros PER-CRY translocan al interior del núcleo donde producen el desacoplamiento de BMAL1 y de CLOCK, de modo que dejan de expresarse los genes Per y Cry. D.Al final del día, los dímeros PER-CRY son degradados y comienza un nuevo ciclo mediante el acoplamiento de BMAL1 y de CLOCK. Estos factores de transcripción no solo regulan la expresión de genes reloj, sino que también modulan la expresión de aproximadamente un 10-20% de todo el genoma de las células, lo que permite organizar sus actividades siguiendo un orden temporal preciso. J.A. Madrid. Laboratorio de Cronobiología, Universidad de Murcia 2018©
Cronodisrupción
La alteración mantenida en el orden temporal interno de los ritmos de variables fisiológicas, bioquímicas y comportamentales es causa de la aparición de diversas patologías.
Con el término “cronodisrupción” (CD) o disfunción circadiana, se denomina la alteración mantenida en el orden temporal interno de los ritmos de variables fisiológicas, bioquímicas y comportamentales, que es causa de la aparición de diferentes patologías o que predispone a ellas, no necesariamente relacionadas con el sueño. También se considera CD: la alteración persistente de la relación normal de fase entre los ritmos circadianos y los ciclos ambientales de 24 h. Entre las patologías que aparecen o empeoran en relación con la CD se encuentran: la obesidad, la diabetes, la hipertensión, el insomnio, los trastornos cognitivos y afectivos, ciertos tipos de cáncer, como el colorrectal, el de mama y el de próstata, el envejecimiento acelerado y el deterioro del sistema inmunitario(4). En el caso de la población joven, la CD se asocia a estados depresivos, distimia y falta de motivación.
Desde un punto de vista práctico, la CD se detecta como una reducción de la amplitud de los ritmos, a veces, incluso como la pérdida total de los mismos, mientras que en otros casos, se caracteriza por una desincronización interna, que es un desfase anómalo entre diferentes ritmos que deben mantenerse sincronizados entre sí, para que los procesos fisiológicos se mantengan inalterados.
Una de las causas de CD está relacionada con la privación de sueño o con la alteración en el momento en el que este ocurre. Tal y como se ha publicado recientemente en la revista Science(17), el sueño dirige uno de los ritmos cerebrales de mayor amplitud: el de la activación del sistema linfático, responsable de la retirada de componentes químicos y estructurales (beta-amiloide, alfa-sinucleína…). Para que este proceso sea eficaz, es necesario un tiempo y profundidad mínimo de sueño.
Desarrollo del ritmo circadiano en el niño
Introducción
El ambiente en la que un animal es criado en sus primeras etapas vitales, puede tener un fuerte impacto en sus ritmos circadianos durante su vida posterior.
En la vida intrauterina hay evidencias del inicio del funcionamiento del marcapasos endógeno, así como de la aparición tanto del sueño tranquilo como del sueño activo, durante las últimas 10 semanas de la gestación(18). A pesar de ello, los ritmos circadianos de la madre predominan y trasmiten las variaciones al feto, de manera que desde el tercer trimestre del embarazo y las primeras semanas de vida extrauterina, el sistema circadiano inmaduro del feto y del lactante se sincroniza con el medio ambiente a través de las influencias maternas. Esta influencia materna va cediendo su influjo a lo largo del tiempo de manera progresiva, mientras se incrementan las influencias del medio ambiente, especialmente de la luz en un ser humano que nace con unos ritmos escasamente desarrollados, debido a la inmadurez de los sistemas neurológicos de control.
En general, al inicio de la vida extrauterina, los ritmos predominantemente son ultradianos. Posteriormente, y mediante el estudio de los patrones de actividad/inactividad de manera continua con la técnica de monitorización ambulatoria de actigrafía, se ha podido detectar un ritmo circadiano a la edad postconcepcional de 34 semanas.
Con la misma técnica de monitorización y mediante estudios longitudinales de la díada madre-lactante, a la edad de 3, 6, 9 y 12 semanas se ha detectado el establecimiento de un ritmo circadiano alrededor de las 12 semanas de vida; de manera que, en general, durante estas 12 primeras semanas de vida, los ritmos circadianos del lactante que gobiernan diferentes funciones fisiológicas adquieren su mayor desarrollo.
Los padres como marcadores externos principales
En el desarrollo de estos ritmos circadianos del lactante, son de vital importancia los patrones de actividad que constituyen la representación crítica de la sincronía fisiológica de la pareja madre-hijo, como predictores de la autorregulación posterior del lactante. La madre se constituye en el primer “zeigeber” del lactante y puede manipular el medio ambiente donde este se desarrolla, especialmente la exposición a la luz y, al mismo tiempo y de manera recíproca, la actividad del lactante modifica los ritmos circadianos de la madre.
Esta interacción sincrónica madre-hijo es un precursor básico de la organización e integración fisiológica, cognitiva, emocional y conductual del lactante y, especialmente, de sus ritmos circadianos. En ese sentido y con estudio mediante actigrafía, la correlación postnatal precoz adecuada y rítmica entre madre e hijo se asocia a un tipo de patrón diurno rítmico del niño, mientras que alteraciones en esta sincronización, se relacionan con dificultades de alimentación y a un desarrollo de ritmos circadianos y patrón de sueño erráticos.
Pocos estudios han examinado el desarrollo longitudinal de los ritmos circadianos del lactante, así como los cambios paralelos que se producen en los ritmos circadianos de la madre o la coordinación entre ambos, a pesar de que la coordinación temporal del lactante y su madre representa un claro ejemplo de sincronía biológica, un elemento básico para una adecuada interacción entre ambos y uno de los fundamentos de la capacidad de autorregulación del lactante. Durante las primeras etapas de la vida, el binomio madre-hijo es un claro ejemplo del concepto de “sistema adaptativo complejo” , constituyendo una red dinámica de sistemas que actúan en paralelo de manera interconectada y que se complementan mutuamente; de manera que, un sistema (el niño) no puede ser entendido sin la presencia del otro (la madre) y sus interrelaciones.
Así pues, los ritmos del sueño varían según el ambiente en el que se desarrolla el niño y según los ritmos trasmitidos por los cuidadores. Así, se ha estudiado el desarrollo del ritmo circadiano de vigilia/sueño mediante actigrafía realizada en lactantes con el mismo ambiente, pero con ritmos externos regulares o ritmos externos irregulares. A las 27 semanas, el patrón diurno de vigilia/sueño está bien establecido en los dos. Posteriormente, en el lactante, en el que desde su nacimiento se mantiene un determinado ritmo de alimentación, exposición a la luz…,aparece el patrón circadiano estable muy rápidamente, mientras que en el lactante en el que, por diversas razones, los ritmos exteriores son más irregulares, se retrasa la aparición del ritmo circadiano diario. A pesar de que en la semana 27 ya aparece un patrón nictameral, la variabilidad de los ritmos vigilia/sueño en el lactante con ritmos exteriores irregulares es mayor. De manera que, la maduración de los patrones es diferente como respuesta a la irregularidad de los ritmos externos, si bien desconocemos la varianza de la aparición del ritmo circadiano atribuible a las diferencias genéticas y/o al comportamiento ambiental(19). Teniendo en cuenta estos factores, la mayoría de los estudios coinciden en que el desarrollo de los ritmos de sueño-vigilia y de temperatura durante las 24 horas se desarrollan aproximadamente desde la edad de tres meses, con una disminución significativa de la media de 24 horas de la temperatura de la piel a los 3 meses de edad y la aparición de ritmo de temperatura entre las 10 y las 12 semanas de edad, disminuyendo los ritmos ultradianos y aumentando paulatinamente los componentes circadianos hasta alcanzar a los 5-6 meses de edad un ritmo circadiano de una manera paralela a la maduración de determinadas estructuras del Sistema Nervioso Central y previa al establecimiento del ritmo circadiano de la vigilia/sueño.
Cronología de la consolidación de los diferentes ritmos circadianos
En la figura 2, se muestra la edad de consolidación de diferentes ritmos circadianos en el lactante desarrollado en un ambiente rítmico.
Figura 2. Edad media de consolidación de los diferentes ritmos circadianos. Tomada con permiso de: Ardura J, et al. Desarrollo del sistema circadiano en el R.N. En: Cronobiología Básica y Clínica. Ed: J.A. Madrid, A. Rol del Lama. Editec@Red, Madrid 2006.
La influencia de factores externos (tipo de alimentación, desarrollo del vínculo, horas y momento de la exposición a la luz y el tipo de la misma…) están todavía por dilucidar, aunque es de suponer que su relevancia no será pequeña.
Los ritmos circadianos de los prematuros son menos robustos que los que muestran los controles de la misma edad cronológica, caracterizándose por presentar una menor regularidad, mayor fragmentación y menor amplitud que los controles. Sin embargo, la mayoría de estas diferencias desaparecen cuando se corrige la edad de los prematuros, con la excepción de la persistencia del adelanto de la hora del sueño nocturno al mes y los tres meses y de la hora de la siesta a los seis meses observada en los prematuros(20).
Conclusión
Si bien, el desarrollo de los ritmos circadianos es innato y endógeno, el papel materno como elemento zeitgeber durante el último trimestre del embarazo, junto con el entorno durante los primeros 4-6 meses de edad, es básico para el buen desarrollo de la ritmicidad del lactante. El pediatra de Atención Primaria, como educador sanitario, es un elemento básico de prevención de la cronodisrupción.
Alteraciones del ritmo vigilia-sueño
Cronotipos
Cada individuo tiene un ritmo circadiano endógeno; de tal manera que, según el momento de actividad y descanso, de dormir y despertar, pueden existir diferentes variaciones (cronotipos). Existe un cronotipo matutino, que se duerme y se despierta muy temprano y que está más alerta, con más capacidad de trabajo y ejercicio por la mañana, y un cronotipo vespertino, en el que todos estos procesos se retrasan, ya que se duermen y se despiertan muy tarde. El cronotipo influye en los hábitos y estos pueden inducir adaptaciones metabólicas. La mayoría de la población se encuentra en algún punto intermedio entre ambos cronotipos(21).
Alteraciones del ritmo circadiano
Vivimos en un entorno cíclico de 24 horas y, por lo tanto, casi todos los seres vivos presentan ritmos de 24 horas en sus funciones, pero los ritmos biológicos son endógenos, por lo que en cada ser vivo existe una estructura capaz de organizar las funciones fisiológicas del organismo en función del ciclo día-noche y que tiene la capacidad de sincronización para adaptarse a las condiciones ambientales y adoptar el mismo periodo que el medio ambiente (relación estable de fase), pero si existe una alteración en los sistemas de mantenimiento del tiempo circadiano, podemos encontrarnos con diferentes tipos de problemas de sueño de origen circadianos, como es: el síndrome de retraso de fase (SRF), relativamente frecuente en edad pediátrica, que puede ir o no acompañado de jet lag social y que se desarrollará extensamente en el siguiente apartado. Otros trastornos circadianos, más propios de la edad adulta, son: el síndrome de avance de fase, que consiste en que la persona no puede mantenerse despierta en horarios vespertinos y nocturnos en donde la mayoría de la gente aún está activa, de manera que se duerme pronto, mientras que se despierta en la madrugada sin poder volver a conciliar el sueño; el trastorno del ritmo de sueño irregular; ritmo diferente a las 24 horas (o ritmo en curso libre, propio de invidentes, patología prequiasmática); trabajo por turnos… jet lag social(22). En la figura 3, se muestran los principales trastornos de sueño de origen circadiano.
Figura 3. Principales trastornos de sueño de origen circadiano. Para cada alteración cronobiológica, se muestra: el perfil de melatonina (línea roja), el periodo de sueño (barra naranja), la fase de oscuridad (rectángulo azul oscuro y la fase de luz (rectángulo amarillo). La corrección de los trastornos de sueño de origen circadiano requiere la sincronización previa del sistema circadiano. Forzar el inicio de sueño sin una corrección cronobiológica puede derivar en un insomnio psicofisiológico (en el caso del retraso de fase).
El síndrome de retraso de fase (SRF)
El Síndrome de la Fase del Sueño Retrasada (SFSR), conocido en inglés como Delayed Sleep Phase Syndrome (DSPS) o Delayed Sleep Phase Disorder (DSPD) se define como: la presencia de un tiempo de inicio y finalización del sueño retrasado más de dos horas en relación con los tiempos de sueño aceptables social o convencionalmente (en el SRF, el inicio del sueño suele ser entre las 23,30 y las 5,30). Existe dificultad para dormir en las horas aceptadas socialmente, pero una vez el sueño se inicia, este es de características normales. Con frecuencia, presentan problemas socio-laborales-escolares, ya que sus horas más activas en los aspectos físico e intelectual suelen ser después de la medianoche(22).
El SRF fue descrito por primera vez en 1981, por el doctor Elliot D. Weitzman y su equipo del Montefiore Medical Center, en 30 de 450 pacientes atendidos por insomnio primario y en los que se había probado distintos tratamientos sin éxito(23).
Es difícil conocer la prevalencia del síndrome de retraso de fase, debido a diferentes criterios de definición, diagnóstico y método de evaluación, así como ubicación geográfica o factores socioeconómicos y culturales, aunque el trastorno se considera más prevalente en los adolescentes, variando según los diferentes estudios entre un 3,3 y un 8,4%(24).
Fisiopatología
En la adolescencia, se dan una serie de circunstancias que favorecen la pérdida de horas de sueño y que convierten a los adolescentes en un grupo de edad con déficit crónico de sueño.
Diferentes factores pueden estar implicados, tanto conductuales y psicológicos como biológicos, entre estos últimos, fundamentalmente: la genética, las respuestas individuales a la luz y la homeostasis del sueño.
Entre los factores genéticos, se han descubierto una serie de mutaciones en diferentes genes circadianos que podrían estar involucrados. Se ha descrito una forma hereditaria en la que existe una variación de codificación dominante en el gen del reloj circadiano central (mutación en el gen CRY1 clock, que crea un inhibidor transcripcional con afinidad mejorada para las proteínas activadoras circadianas Clock y Bmal1) y se alarga el período de los ritmos circadianos.
Algunos investigadores han sugerido que la fisiopatología puede implicar un período circadiano intrínseco más largo que el habitual, que es de aproximadamente 24 horas, además de un retraso en la secreción endógena de melatonina.
Otras explicaciones se basan en anomalías en la curva de fase de respuesta a la luz. Así, por ejemplo, tanto la hipersensibilidad retiniana a la luz vespertina o a la matutina que retrasan o adelantan el ritmo circadiano, respectivamente, podrían ser alguno de estos factores.
Otros factores de riesgo asociados tienen que ver con la edad y el género. La tendencia a acostarse tarde y dormir más los fines de semana es común en los adolescentes, y más entre los varones que entre las chicas. Algunos estudios han mostrado que la aparición del SRF es rara entre las personas mayores y que los pacientes diagnosticados de SRF señalaron el inicio de sus síntomas durante la niñez o adolescencia. En este sentido, existe una tendencia fisiológica al retraso de fase que antecede incluso al inicio de la pubertad.
Entre los cambios que existen al llegar a la adolescencia, quizás uno de los más importantes es el de las características de su sueño. El preadolescente tiende a dormirse a una hora relativamente temprana y con una latencia de sueño generalmente corta, pero cuando empieza la pubertad el ritmo vigilia- sueño se retrasa y la latencia de sueño se alarga.
A medida que maduran los estadios de Tanner, suceden algunas cosas importantes en la fisiología del sueño: las necesidades de sueño permanecen constantes, pero la duración de cada estadio de sueño varía a lo largo de la maduración de los estadios(25-27).
Aspectos de la organización familiar: los adolescentes están en una etapa en la que necesitan momentos para estar solos sin que nadie los moleste y esto solo pueden darse una vez que sus padres ya se han acostado. Solo en el 9% de los adolescentes de 14 años, los padres continúan controlando los horarios de acostarse en los días escolares.
Los horarios no coinciden con su fase circadiana: nuestra sociedad transmite la sensación al adolescente de que dormir es perder el tiempo y oportunidades para hacer cosas, haciendo más difícil que el adolescente entienda y acepte los cambios biológicos y sus necesidades de sueño. El 40% de los adolescentes españoles dispone de algún tipo de aparato electrónico (TV, ordenador, tablet, móvil o consola en su dormitorio).
Aspectos grupales: tienden a hacer lo mismo que el resto, lo que está de moda. Cuando los adolescentes y/o su ambiente no entienden estos cambios fisiológicos y se resisten o los ignoran, presentan problemas para ajustarse a su nuevo ritmo biológico(28).
Clínica
En el adolescente, el periodo del reloj biológico tiende a alargarse: su día no es de 24 horas, sino de 25 o más, mientras sus horarios escolares generalmente permanecen estables o incluso se adelantan.
Entre las características del sueño del adolescente que se asocian al SRF, se encuentra el inicio de sueño tardío de manera persistente, generalmente después de medianoche. Con frecuencia, el adolescente es calificado de “vago”, ya que se resiste a levantarse, muestra un rendimiento deficitario a nivel escolar de concentración y bajo estado de ánimo.
El retraso en su reloj biológico justifica su gran dificultad para despertarse a la hora requerida, para realizar actividades sociales y/o académicas, con disminución del nivel de alerta por las mañanas, y la dificultad persistente para iniciar el sueño en una hora más temprana. Aunque esporádicamente consigan dormirse a una hora más temprana, su tendencia al retraso de fase se mantiene, hecho que se observa especialmente durante los fines de semana, en los que su sueño se retrasa y alarga su duración, fenómeno conocido como jet lag social.
Con frecuencia, muestra una sintomatología propia de insomnio si se le obliga a acostarse a una hora temprana, somnolencia diurna excesiva por el déficit crónico de sueño y escasa dificultad para mantener la continuidad del sueño.
Para el diagnóstico, son precisas una serie de circunstancias que se exponen en la tabla I.
Diagnóstico diferencial
Es fundamentalmente con el insomnio (insomnio aprendido secundario a las dificultades para iniciar el sueño), síndrome de piernas inquietas, mala higiene de sueño, estilo de vida, fobia escolar, alteración psiquiátrica: depresión, ansiedad (v. algoritmo al final del artículo).
Tratamiento
El objetivo general en el tratamiento de este trastorno es lograr la resincronización entre el ritmo endógeno y el horario socialmente aceptable para dormir.
El primer paso del tratamiento es educar sobre una correcta higiene del sueño, favorecer cambios saludables en el estilo de vida y tratar las comorbilidades psiquiátricas y médicas, si las hubiere.
Y, aunque el nivel de evidencia no sea alto, los pilares del tratamiento son: la higiene de sueño, el uso controlado de zeitgebers (el más importante es la luz), la cronoterapia y el uso de melatonina(24). Las recomendaciones de la guía de práctica clínica se exponen en la tabla II.
A la hora de planificar el tratamiento, es necesario determinar, mediante agendas de sueño realizadas durante dos semanas con horario libre (días libres sin necesidades laborales/ escolares y sin despertarlos): la fase de sueño (fracción del ritmo que transcurre a partir de un momento convencional), la temperatura corporal mínima (TCM), que suele aparecer aproximadamente 2 horas antes del despertar, así como el momento de inicio de la secreción de melatonina bajo luz tenue (DLMO), que se puede realizar mediante la detección de melatonina salivar, y que suele ser aproximadamente 2-3 horas antes del inicio del sueño.
La forma práctica de aplicar la luminoterapia es: exposición lumínica durante 1- 2 h empezando 1 hora después de la TCM. Se puede ir avanzando la exposición lumínica media hora cada día o cada dos días, hasta alcanzar la hora deseada. Una vez alcanzada la hora deseada, se mantiene la terapia lumínica, al menos, 7 días (incluido fin de semana). La luz del sol suele ser la más eficaz. En invierno, se puede utilizar luz de lámparas ricas en espectro azul (la luz amarilla no contribuye al avance de fase).
La cronoterapia consiste en retrasar o adelantar progresivamente la hora de acostarse hasta que se alcanza la hora deseada. Al avanzar la hora de despertar, no suele producirse de manera inmediata un avance en la hora de inicio de somnolencia, así que durante el inicio de la terapia, el paciente estará con déficit de sueño y somnolencia diurna. Se recomienda que no se hagan siestas; si no hay más remedio, se permitirá una siesta de no más de 15 minutos, al menos, 6 horas antes de la hora de acostarse (las siestas de 10 minutos alivian la somnolencia por un período de 3 horas, sin interferir en el sueño nocturno).
Para la administración de melatonina hay que tener en cuenta, entre otros factores, la hora circadiana. En la tabla III, se expone una guía orientativa para su uso.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Stephan FK, Zucker I. Circadian rhythms in drinking behavior and locomotor activity of rats are eliminated by hypothalamic lesions. Proc Natl Acad Sci USA. 1972; 69: 1583-6.
2. Moore RY, Eichler VB. Loss of a circadian adrenal corticosterone rhythm following suprachiasmatic lesions in the rat. Brain Res. 1972; 42: 201-6.
3. Brown TM, Piggins HD. Electrophysiology of the suprachiasmatic circadian clock. Prog Neurobiol. 2007; 82: 229-55.
4. Garaulet M, Madrid JA. Chronobiology, genetics and metabolic syndrome. Curr Opin Lipidol. 2009; 20: 127-34.
5. Berson DM, Dunn FA, Takao M. Phototransduction by retinal ganglion cells that set the circadian clock. Science. 2002; 295: 1070-3.
6. Lax P, Otalora BB, Esquiva G, Rol M de L, Madrid JA, Cuenca N. Circadian dysfunction in P23H rhodopsin transgenic rats: effects of exogenous melatonin. J Pineal Res. 2011; 50: 183-91.
7. Hardeland R, Madrid JA, Tan DX, Reiter RJ. Melatonin, the circadian multioscillator system and health: the need for detailed analyses of peripheral melatonin signaling. J Pineal Res. 2012; 52: 139-66.
8. Vivanco P, Ortiz V, Rol MA, Madrid JA. Looking for the keys to diurnality downstream from the circadian clock: role of melatonin in a dual-phasing rodent, Octodon degus. J Pineal Res. 2007; 42: 280-90.
9. Perumal SR, Srinivasan V, Maestroni GJ, Cardinali DP, Poeggeler B, Hardeland R. Melatonin: Nature’s most versatile biological signal? FEBS J. 2006; 273: 2813-38.
10. Arendt J, Skene DJ. Melatonin as a chronobiotic. Sleep Med Rev. 2005; 9: 25-39.
11. Pandi-Perumal SR, Trakht I, Srinivasan V, et al. Physiological effects of melatonin: role of melatonin receptors and signal transduction pathways. Prog Neurobiol. 2008; 85: 335-53.
12. Galano A, Tan DX, Reiter RJ. Melatonin as a natural ally against oxidative stress: a physicochemical examination. J Pineal Res. 2011; 51: 1-16.
13. Roenneberg T, Merrow M. Molecular circadian oscillators: an alternative hypothesis. J Biol Rhythms. 1998; 13: 167-79.
14. McWatters HG, Bastow RM, Hall A, Millar AJ. The ELF3 zeitnehmer regulates light signalling to the circadian clock. Nature. 2000; 408: 716-20.
15. Ko CH and Takahashi JS Molecular components of the mammalian circadian clock. Hum Mol Genet. 2006; 2: 271-7.
16. Reppert SM, Weaver DR. Coordination of circadian timing in mammals. Nature. 2002; 418: 935-41.
17. Xie L, Kang H, Xu Q, Chen MJ, Liao Y, Thiyagarajan M, et al. Sleep drives metabolite clearance from the adult brain. Science. 2013; 342: 373-7.
18. Mirmiran M, Maas YG, Arigno RL. Development of fetal and neonatal sleep and circadian rhythms. Sleep Med Rev. 2003; 7: 321-34.
19.* Ardura J, et al. Desarrollo del sistema circadiano en el R.N. En: Cronobiología Básica y Clínica. Ed: J.A. Madrid, A. Rol del Lama. Madrid 2006.
20.* Silvia Fuentes Hernández. Estudio de maduración de los ritmos circadianos de temperatura y movimiento en prematuros como marcadores precoces del desarrollo neurológico. Tesis Doctoral. Universidad de Murcia. 2017.
21. Gombert M. Carrasco-Luna J. Pin-Arboledas G. Codoñer-Franch P. Circadian Rhythm Variations and Nutrition in Children. J Child Sci. 2018; 8: e60-e66.
22. American Academy of Sleep Medicine. The international classification of sleep disorders. 3rd ed. Darien (IL): American. Academy of Sleep Medicine. 2014; 190.
23. Elliot D. Weitzman, MD; Charles A. Czeisler, MD, PhD; Richard M. Coleman, PhD; et alArthur J. Spielman, PhD; Janet C. Zimmerman, PhD; William Dement, MD, PhD; Charles P. Pollak, MD Delayed Sleep Phase SyndromeA Chronobiological Disorder With Sleep-Onset Insomnia. Arch Gen Psychiatry. 1981; 38: 737-46. doi:10.1001/archpsyc.1981.
24.* Nesbitt Alexander D Delayed sleep-wake phase disorder. J Thorac Dis. 2018; 10: S103-S111.
25. Patke A, Murphy PJ, Onat OE, et al. Mutation of the Human Circadian Clock Gene CRY1 in Familial Delayed Sleep Phase Disorder. Cell. 2017; 169: 203-15 e13.
26. Saxvig IW, Wilhelmsen-Langeland A, Pallesen S, et al. Objective measures of sleep and dim light melatonin onset in adolescents and young adults with delayed sleep phase disorder compared to healthy controls. J Sleep Res. 2013; 22: 365-72.
27. Gradisar M, Gardner G, Dohnt H. Recent worldwide sleep patterns and problems during adolescence: a review and meta-analysis of age, region, and sleep. Sleep Med. 2011; 12: 110-8.
28. Carskadon MA. Sleep in adolescents: the perfect storm. Pediatr Clin North Am. 2011; 58: 637-47.
29. Merino Andreu M, Hidalgo Vicario MI. Hipersomnia. Somnolencia diurna excesiva y alteraciones del ritmo circadiano en pediatría. Pediatr Integral. 2010; XIV(9): 720-34.
Bibliografía recomendada
- Cronobiología Básica y Clínica. Ed: J.A. Madrid, A. Rol del Lama. Editec@Red, Madrid 2006.
Se trata de un libro elaborado por el Laboratorio de Cronobiología de la Universidad de Murcia, que explica con un lenguaje asequible a los no cronobiólogos los puntos básicos de la Cronobiología.
- Matilde Zornoza. Influencia de la diabetes gestacional en el desarrollo psicomotor y la regulación de los ritmos circadianos durante el primer año de vida. Tesis Doctoral. Universidad de Murcia. 2014.
El objetivo de esta tesis doctoral se centró en conocer, si el neurodesarrollo y la regulación de los ritmos circadianos de los niños pueden estar influidos por la presencia de diabetes gestacional materna (GDM). Además, se desarrolló una técnica para el registro del ritmo circadiano de temperatura periférica en recién nacidos.
- Silvia Fuentes Hernández. Estudio de maduración de los ritmos circadianos de temperatura y movimiento en prematuros, como marcadores precoces del desarrollo neurológico. Tesis Doctoral. Universidad de Murcia. 2017.
Tesis doctoral que valora la aparición de los ritmos circadianos en el pretérmino, según el ambiente en el que se desarrolla.
| Caso clínico |
|
Los padres de un niño de 13 años consultan porque va mal en clase, la profesora cree que tiene algún problema (¿déficit de atención?), ya que lo encuentra despistado y, a veces, se duerme en clase. En la última evaluación, ha suspendido 4 asignaturas y lo encuentran algo decaído, menos hablador. Creen que esto se debe al cambio de amigos y a que está todo el día con el móvil. Consideran que tiene un cambio importante de conducta y quieren que se derive al psicólogo. En la anamnesis realizada al paciente, este nos cuenta que últimamente le cuesta mucho levantarse, se encuentra cansado, tiene la primera clase a las 8, es de matemáticas y no se entera mucho. Come bien, hace ejercicio (algo más que antes, ya que quiere aumentar la musculatura). No ha estado enfermo en los últimos meses. No toma ningún tratamiento. No consume nada. Desde hace un tiempo (no recuerda), cuando se va a acostar no tiene sueño y aprovecha para ver cosas en internet, chatear con los amigos o ver alguna película en la TV de su cuarto. El padre nos cuenta que a él le cuesta dormirse. La exploración física es normal. La analítica general que incluye: estudio de hierro y hormonas tiroideas es normal. También se solicita una Agenda de sueño (insistimos en que sea agenda libre durante 2 semanas y que incluya los fines de semana), se le proporciona la agenda que incluye actividad física y uso de tecnología (Fig. 4). Figura 4. En esta agenda, vemos como inicia el sueño entre la 1:00 y las 2:00 h, no se despierta durante toda la noche. En el tiempo que ha estado haciendo esta agenda, se levanta descansado y bien, pero este horario es incompatible con su actividad normal de clase. Cuando empiece la clase nuevamente, no se podrá levantar a las 12:00 h. También se observa un uso constante de tecnología antes del inicio de sueño, así como ejercicio físico en las horas previas al mismo.
|