|
| Temas de FC |
A. Gómez Farpón, C. Granell Suárez, C. Gutiérrez Segura
Servicio de Cirugía Pediátrica. Hospital Universitario Central de Asturias
| Resumen
Las anomalías congénitas del riñón y del tracto urinario, conocidas con el acrónimo inglés CAKUT, se caracterizan por un conjunto de anomalías estructurales y funcionales que afectan al riñón, sistema colector, vejiga y/o uretra, como: agenesia renal, displasia renal multiquística, hidronefrosis, estenosis de la unión pielo-ureteral, reflujo vésico-ureteral, duplicidad del sistema colector, megauréter, válvulas de uretra posterior y riñón en herradura. Representan el 20-30% de las malformaciones congénitas diagnosticadas en el periodo prenatal y el 30-60% de las causas de enfermedad renal crónica avanzada en el niño. Muchas de estas entidades se relacionan con una alteración del desarrollo embrionario con una base genética, muchas de ellas aún desconocidas. |
| Abstract
Congenital anomalies of the kidney and urinary tract (CAKUT) are characterized by structural and functional abnormalities of kidney, collecting system, bladder and/or urethra such as renal agenesis, multicystic kidney disease, hydronephrosis, ureteropelvic junction obstruction, vesicoureteral reflux, duplex collecting system, megaureter, posterior urethral valves and horseshoe kidney. They have been identified in 20% to 30% of all fetal congenital anomalies and account for 30–60% of cases of end-stage renal disease in children. Many of these conditions are related to maldevelopment of the kidney and urinary tract and are thus the result of anomalous genetic mechanisms, some of which are understood and others of which are not. |
Palabras clave: CAKUT; Hidronefrosis; Displasia renal multiquística; Reflujo vésico-ureteral; Obstrucción ureteral
Key words: CAKUT; Hydronephrosis; Multicystic dysplastic kidney; Vesico-Ureteral reflux; Ureteral obstruction
Pediatr Integral 2017; XXI (8): 498 –510
Malformaciones nefrourológicas
Introducción
Las anomalías congénitas del riñón y del tracto urinario (CAKUT) son una de las anomalías congénitas más frecuentes en el periodo prenatal. Aunque suelen tener un curso benévolo, un pequeño porcentaje presenta complicaciones médicas serias, constituyendo la principal causa de enfermedad renal crónica (ERC) avanzada en la infancia.
Las anomalías congénitas del riñón y del tracto urinario se conocen con el acrónimo inglés CAKUT (Congenital Anomalies of the Kidney and Urinary Tract), el cual hace referencia a un grupo heterogéneo de malformaciones secundarias a una alteración en el desarrollo embrionario del sistema renal y urinario (Tabla I).
Su importancia radica en su prevalencia, ya que constituyen cerca del 20-30% de todas las anomalías detectadas en el periodo prenatal, con una incidencia del 5-10 por cada 1.000 recién nacidos vivos (RNV), y en su trascendencia clínica, ya que a pesar de que la mayoría cursan de manera asintomática, suponen la principal causa de ERC avanzada en la infancia, evolucionando a ella en un 30-60% de los casos(1).
Etiología
La evaluación inicial de un niño con CAKUT debe incluir una historia personal y familiar detallada de patologías nefrourológicas y extrarrenales (diabetes, sordera, coloboma, hiperuricemia…).
La etiología de las CAKUT es multifactorial y compleja, y en muchos aspectos las causas permanecen desconocidas.
Causa genética
Las alteraciones genéticas y epigenéticas están implicadas en el desarrollo anormal del sistema renal y urológico, lo cual queda demostrado por los siguientes hechos:
• Existen más de 500 síndromes genéticos que asocian CAKUT, algunos con mutaciones genéticas claramente estudiadas, como es el caso: del síndrome branquio-oto-renal (EYA1 y SIX1), el síndrome de Fraser (FRAS1), el síndrome de Ehlers-Danlos o el síndrome de Townes-Brocks (SALL1), entre otros.
• En el 10-50% de los pacientes con CAKUT, existe agregación familiar, con diferente expresión clínica en una misma familia y gravedad variable.
• Los test genéticos realizados a niños con CAKUT aislada y sin antecedentes familiares muestran mutaciones genéticas en el 10-17% de los casos.
Factores ambientales
Por sí mismos los factores genéticos no pueden explicar la totalidad de las CAKUT. Algunos factores que han sido implicados en la génesis de estas malformaciones son: la exposición a teratógenos (IECAS o ARAII), la deficiencia de vitamina A o la diabetes mellitus en la mujer gestante, especialmente en las primeras 20 semanas de gestación.
Embriología
Para entender las malformaciones renales congénitas es muy útil conocer el desarrollo embrionario, pues ambos están íntimamente ligados.
Dependiendo del momento cronológico en el que se produzca la lesión, se producirán diferentes alteraciones, lo que explica el amplio espectro fenotípico de las CAKUT.
En el embrión existen 3 sistemas renales primitivos: el primero o pronefros, que involuciona; el mesonefros, que aparece a la cuarta semana de gestación y constituirá el conducto de Wolff, encargado de participar en la formación del aparato genital masculino y la yema ureteral; y el metanefros, que dará lugar al riñón definitivo. Para que esto tenga lugar, es necesario que interaccionen mutualmente el metanefros y la yema ureteral. Cualquier fallo a este nivel conducirá a una CAKUT. De este modo, si la yema ureteral no se forma, se producirá una agenesia renal. Si emergen 2 yemas ureterales, se producirá una duplicación pieloureteral. Si la yema no se ramifica correctamente, no se organizará adecuadamente el número de nefronas y derivará en una hipoplasia y, si la interacción es anómala, en una displasia renal. Los uréteres derivan del conducto mesonéfrico de Wolff en la 5ª semana de gestación y finalizan su oclusión y recanalización en la 9ª. Una inserción perpendicular en la musculatura vesical en vez de oblicua, predispondrá a reflujo vésico-ureteral (RVU). Por último, los riñones se localizan inicialmente en la pelvis y migran gradualmente a su posición definitiva lumbar en la 8ª semana de gestación. Cualquier alteración en la migración, evaginación ectópica de la yema ureteral o fallo de vascularización puede derivar en un riñón ectópico.
Diagnóstico
No existe ninguna prueba complementaria que permita, por sí sola, diagnosticar inequívocamente la obstrucción. Por ello, es importante interpretar de forma conjunta las diferentes pruebas, especialmente a lo largo del tiempo.
Ecografía
Cualquier alteración en el parénquima renal, independientemente del grado de dilatación del tracto urinario (DTU), se clasifica como riesgo elevado de uropatía (DTU P3). Una ecografía pre o posnatal normal, con imágenes renales y vesicales normales, no descarta un RVU.
La ecografía constituye la prueba de imagen de elección para el diagnóstico y seguimiento de la DTU por su accesibilidad, información y falta de radiación. Existen múltiples sistemas de clasificación, con mucha variación entre los distintos métodos y también interobservador, destacando:
• Diámetro ántero-posterior de la pelvis (DAP): es el diámetro máximo de la porción intrarrenal de la pelvis, medido en el plano transverso. Idealmente se debe medir en decúbito prono, ya que la dilatación es máxima en esta posición, no obstante, es más importante que todo el seguimiento se realice utilizando la misma posición que ir modificándola. Es un método cuantitativo, objetivo y reproducible, pero que como dato aislado resulta insuficiente. Se utiliza especialmente en la ecografía prenatal. Diferencia dos etapas gestacionales, cuyos puntos de corte en mm para considerar DTU son:
- 2º trimestre (16-27 semanas): ≥4 mm.
- 3º trimestre (28-32 semanas): ≥7mm → Leve (7-8.9), moderada (9-15) y grave (>15).
• El sistema de gradación de la SFU (Society of Fetal Urology) es un método semicuantitativo(2). Tiene en cuenta la DTU (pelvis y cálices) y el adelgazamiento cortical, de modo que en función de estos, diferencia 5 grados, desde el grado 0, o ausencia de hallazgos patológicos hasta el grado 4. Presenta dificultad para diferenciar un adelgazamiento cortical difuso de uno segmentario y para discernir claramente entre un grado 3 de un grado 4. A través de su página, está disponible un recurso educativo de imágenes y para el cálculo del grado de dilatación(3) (http://cevlforhealthcare.org/cevl/Products/Urology/SFU-GradingSystem/mobile/index.html).
• En el año 2014, varias sociedades, entre ellas las americanas de radiología, ginecología, urología y nefrología pediátrica, elaboraron un método de gradación que aúna ambos sistemas mediante la descripción de 6 parámetros ecográficos (Tabla II) para la valoración de la DTU pre y posnatal, con la particularidad de que cada estadio se relaciona con el riesgo y probabilidades de cirugía, lo que facilita los algoritmos diagnósticos para un manejo más uniforme(4).
Estos autores abogan por el término “dilatación del tracto urinario” (UTD urinary tract dilatation), evitando usar otros más ambiguos como: hidronefrosis, caliectasia o pelviectasia. Esta clasificación distingue entre distintos grados de dilatación ante (A) y posnatal (P), a mayor riesgo de uropatía cuando mayor es el número(5). Prenatalmente, no se tiene en cuenta la dilatación calicial por la difícil diferenciación entre periférica y central, por lo que existen 3 grados (normal, DTU A1, DTU A2-3) en contraposición con las 4 categorías posnatales (normal, DTU P1, DTU P2, DTU P3) (Tabla III).
En el periodo posnatal, cualquier dilatación piélica aislada <10 mm se considera normal. En este periodo, e independientemente de la edad, una dilatación de la pelvis renal entre 10-15 mm o una dilatación calicial central son catalogadas como DTU P1. Si el DAP es >15 mm, hay dilatación calicial central y periférica o dilatación ureteral, estamos ante una DTU P2 (riesgo intermedio de uropatía). En este caso, la apariencia y grosor cortical, así como la vejiga serán normales. Siempre predomina el hallazgo más patológico, esto significa que, aunque el DAP sea <15 mm (P1), si existe dilatación calicial periférica (P2), el grado es P2 (riesgo intermedio). Si la ecogenicidad o el grosor del parénquima renal están alterados o existen alteraciones vesicales, ascendemos automáticamente a una DTU P3 (riesgo elevado de uropatía) (Tabla IV).
Finalmente, la ecografía no es útil para descartar un RVU de alto grado, no remplazando a la Cistouretrografía miccional seriada (CUMS) como prueba complementaria en el diagnóstico del RVU(6).
Renograma
Permite valorar la función que realiza cada riñón y la eliminación renal.
• El aclaramiento renal no puede ser estimado por esta técnica, solo el aclaramiento relativo que realiza cada riñón, es decir, la función renal diferencial (FRD). Esta se calcula entre el primer y segundo minuto de la administración del radiotrazador y, en ese momento, se puede evaluar también el tamaño y la posición renal. Se considera una FRD deteriorada cuando es <40%. En este punto, es básico recordar que la FRD es un estudio comparativo; es decir, se asume que conjuntamente ambos sistemas renales poseen una función total del 100%, viendo cuánto contribuye cada uno. Por lo tanto, en pacientes monorrenos o con afectación bilateral, este parámetro no es útil.
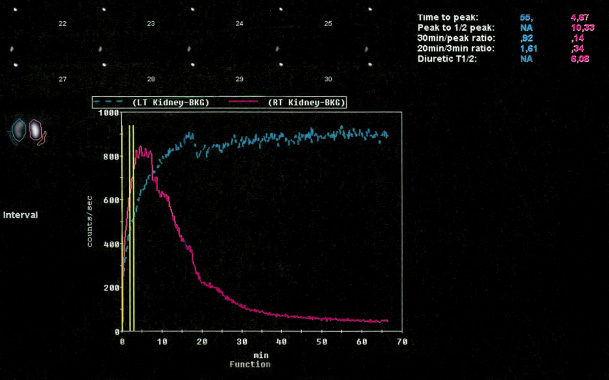
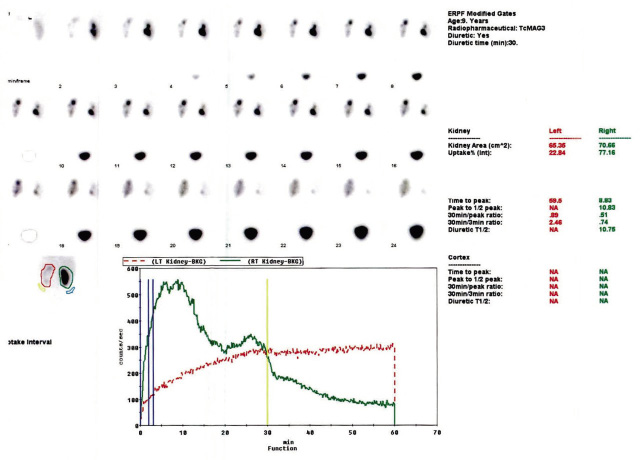
• Para ver la eliminación, se observa cómo desaparece el radiotrazador del área renal, para lo que se deben interpretar las curvas de eliminación y los parámetros. El radiotrazador preferido es el mercapto-acetil-triglicina marcado con Tc99 (Tc99m-MAG3), especialmente en neonatos y pacientes con afectación de la función renal. Se comienza por un renograma simple, sin diurético y, si la curva es dudosa, se hace un renograma diurético mediante la administración de furosemida (F) a razón de 1 mg/kg (máx. 40 mg, salvo pacientes obesos, con FRD disminuida o uso crónico de diuréticos). En el protocolo F+20, el diurético se da a los 20 minutos de la administración del radiotrazador, cuando la pelvis está completamente llena, en el protocolo F0 simultáneamente con este, y en el F-15, 15 minutos antes. En el seguimiento debe siempre usarse el mismo protocolo, y los 3 son equivalentes para indicar obstrucción. El tiempo medio (T1/2) es el tiempo en el cual la actividad desciende a la mitad respecto a la actividad máxima. Un T1/2 inferior a 10 minutos traduce la ausencia de obstrucción, uno mayor a 20 min suele sugerir obstrucción y entre 10 y 20 minutos el resultado es equívoco (Fig. 1).
Figura 1. Curvas de eliminación del renograma diurético (protocolo F+20).
No obstante, existen muchas variables que pueden artefactar el resultado y ofrecer un resultado obstructivo, como una vejiga repleccionada o un niño poco hidratado (Tabla V).
Respecto a esto, es importante explicar a los padres y al niño todo el procedimiento para una mejor cooperación. No siempre es necesario cateterizar la vejiga, solo: en casos dudosos, si es necesario descartar patología vesical (ureterohidronefrosis, RVU, vejiga neuropática, vejiga de baja capacidad o presencia de válvulas de uretra posterior -VUP-) o tras acabar el estudio para ver el efecto de la micción en la eliminación renal, si el paciente no puede miccionar de forma espontánea. Por otro lado, el niño debe de ingerir unos 250-500 ml de agua o zumo antes de la prueba, reservando la sueroterapia intravenosa para casos seleccionados. El estudio suele realizarse en decúbito supino, lo que provoca un enlentecimiento de la eliminación renal, por lo que antes de concluir el estudio es recomendable cambiar al paciente a bipedestación durante 10-15 minutos para favorecer el efecto de la gravedad. Estas imágenes posmiccionales o poscambios posturales pueden ser útiles para excluir obstrucción piélica o en el uréter distal.
Cistouretrografía miccional seriada (CUMS)
Continúa siendo la técnica gold-estándar para valorar la anatomía vesical y uretral, así como detectar y graduar la severidad del RVU(7). En caso de DTU A2-3 de carácter bilateral en un varón, si se confirma la dilatación de alto grado posnatalmente, se debe realizar una CUMS en los primeros días de vida para descartar una obstrucción uretral (VUP).
Su realización actualmente está limitada, dependiendo de las series consultadas, a DTU P3, SFU grado 4 o DAP ≥ 10 mm, con el fin de minimizar el riesgo derivado de la exposición radiológica de las gónadas, especialmente a los ovarios. Precisa cateterización uretral y administración concomitante de profilaxis antibiótica el día previo, el mismo día de la prueba y el posterior para disminuir el riesgo de infección del tracto urinario (ITU). Técnicamente, la vejiga se va llenado lentamente de contraste, monitorizando el llenado y también el vaciado para descartar RVU y visualizar la anatomía. Se deben tomar: una imagen en AP con la vejiga a baja replección, para valorar un posible ureterocele; otra a replección por encima de la capacidad esperada por la edad; otra oblicua durante la micción, para valorar divertículos, la unión urétero-vesical y descartar RVU a alta presión; y, por último, tras la micción, para cuantificar el residuo postmiccional(8). Es importante diagnosticar no solo un RVU a nivel ureteral, sino también el reflujo intrarrenal.
Otras pruebas complementarias
• La UIV (urografía intravenosa) y la TC son pruebas poco frecuentes en la edad pediátrica por su efecto ionizante.
• UroRMN: aunque resulta una prueba muy completa, al ofrecer información anatómica y funcional precisa en el mismo estudio y carecer de radiación, no está muy extendida, debido a la necesidad de sedación en niños pequeños y a que es una técnica compleja y muy costosa.
• DMSA (gammagrafía renal con ácido dimercaptosuccinico Tc-99m): permite conocer la FRD y diagnosticar defectos de captación parenquimatosos secundarios a cicatrices pospielonefríticas si se realiza 6 meses tras la ITU. En la fase aguda, detecta zonas de hipoperfusión por edema intersticial. Es muy sensible y muy poco específica, por lo que un DMSA negativo traduciría un riesgo <1% de RVU de alto grado.
• Urosonografía miccional (USM): trata de remplazar a la CUMS como prueba para detectar y graduar el RVU al no radiar y permitir visualizar la anatomía, con las limitaciones de que: precisa sondaje uretral; es una técnica que consume tiempo al radiólogo (pues se hace una ecografía inicial y otra tras instilar un contraste no ionizante –SonoVue®– recientemente aprobado por la Agencia Europea del Medicamento); precisa conocer la técnica; se suelen requerir varios ciclos de llenado/vaciado para incrementar la sensibilidad de la prueba; y no está actualmente aprobada para valorar la anatomía uretral en el varón. No obstante, su implantación progresiva promete mayores avances y probablemente pueda sustituir a la CUMS, como actualmente se ha empezado a hacer en el protocolo de seguimiento del RVU ya diagnosticado.
• Cistografía isotópica indirecta (CII) y, por tanto, sin sondaje uretral, forma parte del renograma diurético. Tiene una sensibilidad del 75% y una especificidad del 90%. Precisa colaboración del paciente y que este tenga control de esfínteres.
• Cistografía isotópica directa (CID), en este caso, no precisa sondaje, pero no ofrece información anatómica de la vejiga ni de la uretra. Puede valorarse como prueba de seguimiento tras cirugía.
Clasificación
1. Malformación del parénquima renal: hipoplasia, agenesia renal y displasia (incluyendo la displasia renal multiquística -DRMQ-).
2. Anomalías relacionadas con la migración de los riñones: ectopia renal y anomalías de fusión (riñón en herradura).
3. Anomalías en el desarrollo del sistema colector: estenosis pieloureteral (EPU), duplicidad pielo-ureteral, megauréter primario, uréter ectópico, ureterocele y VUP.
Hipoplasia renal
Existe un número disminuido de nefronas, las cuales son estructuralmente normales. Macroscópicamente es un riñón de pequeño tamaño (< 2 SD) y no existen cicatrices renales que sugieran un origen adquirido. Puede coexistir la displasia con la hipoplasia, lo que se conoce como hipodisplasia renal. La trascendencia clínica dependerá del número de nefronas al nacimiento y, en muchas ocasiones, es un hallazgo casual.
Displasia renal multiquística
Si la ecografía no es concluyente, o se aprecian anomalías vesicales o renales contralaterales, debe completarse el estudio radiológico con una CUMS y un DMSA.
Representa la forma más severa de displasia renal. Es una enfermedad no hereditaria que se caracteriza por múltiples quistes renales de tamaño variable, no comunicados entre sí, sin parénquima renal funcionante. La pelvis renal no es visible, lo que la diferencia ecográficamente de una EPU congénita obstructiva grave, como tampoco lo es el uréter, el cual suele estar atrésico. Afecta a uno de cada 1.000-4.000 RNV, más frecuentemente varones y con predilección por el lado izquierdo. Su presentación más habitual es en el screening neonatal, y representa la segunda causa de masa abdominal en el neonato (la primera sería la hidronefrosis).
Es importante seguir al paciente, puesto que hasta un 40% tienen malformaciones nefrourológicas asociadas en el riñón contralateral, del cual depende la función renal, y su alteración se relaciona con un mayor riesgo de ERC. Lo más habitual es que se trate de un RVU, generalmente de bajo grado, seguido en frecuencia de una EPU. Hace años se realizaba un manejo más activo, con ecografía, CUMS para descartar RVU contralateral, DMSA para confirmar la ausencia de captación renal, e incluso RMN, si el diagnóstico diferencial con EPU era dudoso. Actualmente, si la ecografía no muestra alteraciones en el riñón contralateral, la vejiga es normal y clínicamente el paciente está asintomático, las guías clínicas sugieren que se puede plantear la ecografía como única prueba complementaria; puesto que, aunque es una prueba poco rentable como indicador de RVU, la mayoría de los casos que no son diagnosticados por ecografía en la DRMQ, suelen ser de bajo grado, con un alto porcentaje de resolución espontánea(9). Por otro lado, de una nefrectomía sistemática en el pasado, justificada por el riesgo de hipertensión arterial (HTA) y degeneración maligna, se tiende actualmente a un seguimiento a largo plazo por el bajo riesgo demostrado de HTA y la falta de relación causal probada entre la DRMQ y el tumor de Wilms. Un 20-75% de las DRMQ involucionan, especialmente cuando son menores a 5 cm y en los primeros años de vida, de modo que si el paciente no desarrolla clínica, como ITU, HTA, proteinuria o alteración de la función renal, no sería imperativo el seguimiento ecográfico anual, pudiendo espaciarse(10). La indicación de nefrectomía profiláctica ha quedado obsoleta.
Estenosis pieloureteral
La DTU es un hallazgo prenatal frecuente, presente en el 1-5% de todas las gestaciones. En la mayoría de los casos, la dilatación es transitoria y fisiológica, de modo que no siempre es sinónimo de obstrucción. La diferenciación entre una DTU y una EPU presenta, en ciertas ocasiones, dificultad.
Epidemiología
La EPU es la causa más común de DTU prenatal. Es dos veces más frecuente en el lado izquierdo, predomina ligeramente en varones y en el 10-40% es bilateral.
Etiología
Las EPU pediátricas son fundamentalmente congénitas, pudiendo encontrar excepcionalmente algún caso adquirido secundario a cálculos, tumores o cirugías, lo cual es mucho más típico en los adultos. A su vez, las causas congénitas pueden dividirse en: intrínsecas, mucho más frecuentes, producidas por un segmento ureteral adinámico e hipoplásico; o extrínsecas, características de niños mayores, debido a factores mecánicos que comprimen el uréter proximal, como vasos polares, angulaciones de la unión o pólipos.
Clínica
Actualmente, el diagnóstico suele ser prenatal, con menos del 20% de pacientes diagnosticados posnatalmente tras una ITU febril o, en menor medida, por hematuria tras un traumatismo banal sobre una pelvis dilatada o dolor abdominal cólico asociado a náuseas/vómitos, típico de niños mayores y conocido este cuadro como crisis de Dietl, generalmente por dilatación piélica secundaria a factores extrínsecos.
Diagnóstico
Ecografía: toda DTU prenatal debe estudiarse posnatalmente. La ecografía debe realizarse transcurridas, al menos, 48 horas, ya que debido a la oliguria fisiológica del recién nacido, nos puede infraestimar el grado de dilatación. Solo en caso de oligoamnios prenatal, obstrucción uretral, DTU bilateral de alto grado (o unilateral en paciente monorreno) o si existe duda de que se realice un seguimiento posnatal, se podría realizar antes. La dilatación es un proceso dinámico, que puede fluctuar con el tiempo y variar según las condiciones a las que esté sometido el paciente (hidratación, vaciamiento vesical y posición del niño). En un 15% de los niños con dilataciones prenatales con una ecografía posnatal normal, la dilatación reaparece, por lo que se recomienda repetir la ecografía si existe diagnóstico prenatal, aunque la primera ecografía haya sido normal (Algoritmo). Según la clasificación de DTU, si existe diagnóstico prenatal de DTU antes de las 32 semanas, se debe repetir la ecografía en la semana 32 de gestación o más adelante. Si la ecografía es normal, no se deben realizar estudios posnatales. Si la DTU persiste y se clasifica como DTU A1, se debe realizar una ecografía entre las 48 horas y el mes de vida, repitiéndola entre el 1º y 6º mes de vida para confirmar que no se producen cambios y dar de alta al paciente. Si se clasifica como A2-3, o riesgo incrementado de uropatía, se debe seguir periódicamente mediante ecografía prenatal y, posnatalmente, se debe realizar la ecografía entre las 48 horas de vida y el mes de vida valorando, según los hallazgos, qué grado de DTU posnatal nos encontramos. En el caso de encontrarnos con una DTU P1, equivalente a un grado 1 y 2 de la SFU, se debe repetir la ecografía cada 1-6 meses, si nos hallamos con una DTU P2 (SFU 3) el seguimiento se acorta a 1-3 meses, y en el supuesto de estar ante una DTU P3, similar a un SFU 4, se recomienda realizar controles ecográficos mensuales, además de solicitar una CUMS para descartar RVU y pautar profilaxis antibiótica por el riesgo de patología obstructiva y/o RVU. La indicación de MAG-3 actualmente queda a criterio del clínico, aunque en muchas series cuando la DTU es ≥15 mm se recomienda solicitar un MAG-3 y valorar remitir al paciente a un centro con cirugía pediátrica, pues en este caso existe una alta probabilidad de encontrarnos con una EPU(4).
Renograma: no debe realizarse antes del mes de edad, ya que el riñón es funcionalmente inmaduro y, preferiblemente, debería retrasarse hasta los 3 meses de edad, puesto que en neonatos y lactantes pequeños el filtrado glomerular renal (FGR) es menor, lo que puede dar una curva obstructiva en ausencia de obstrucción. En este aspecto, es más útil un renograma no obstructivo, el cual sí permite descartar obstrucción en esta etapa. Si no es posible esperar hasta los 3 meses, hemos de ser muy cautos al interpretar el renograma. En ocasiones, son necesarios varios renogramas a diferentes intervalos durante el seguimiento, que vayan mostrando una disminución de la FRD o una obstrucción persistente acompañada de adelgazamiento de la corteza renal con incremento de la DTU. Por ello, es importante estandarizar bien la técnica, evitando variaciones o situaciones que puedan alterar el resultado final e impedir la comparación de los estudios.
Manejo médico-quirúrgico
Profilaxis antibiótica: el riesgo de ITU en la DTU deriva de la existencia de RVU o de uropatía obstructiva. Las guías más recientes recomiendan profilaxis antibiótica (amoxicilina 10-15 mg/kg/día o una cefalosporina de primera generación, como cefalexina o cefadroxilo) hasta descartar estos supuestos en casos de DTU severas (SFU grado 4 o DTU P3), con posturas más controvertidas en dilataciones moderadas.
Indicación quirúrgica: es quizás la parte más controvertida al no existir una prueba única que diagnostique fidedignamente la obstrucción(11).
• Clínica: dolor abdominal recurrente (muchas veces con DTU intermitente por causas extrínsecas) o ITU de repetición (especialmente si van acompañadas de cicatriz postpielonefrítica en el DMSA).
• FRD <40% o disminución de la FRD > 10%.
• Curva obstructiva con DTU de alto grado (SFU 3-4) persistente o en aumento(12).
Tratamiento(13)
• Pieloplastia desmembrada de Anderson-Hynes: continúa siendo el tratamiento gold-estándar. Cada vez más centros han adoptado la laparoscopia (vía abdominal) o en menor medida, la retroperitoneoscopia al manejo de esta patología, en detrimento del abordaje abierto, lo que ha mejorado el resultado estético y disminuido la estancia hospitalaria.
• Endourología: permite la realización de una pielografía retrógrada pudiendo descartar otras malformaciones asociadas. Con este procedimiento, se consigue vencer la estenosis con un balón de dilatación de alta presión o con un balón de corte.
Seguimiento postoperatorio
Se intentará en la medida de lo posible realizar únicamente con ecografía; si bien, en los procedimientos endourológicos y en la pieloplastia laparoscópica, no se remodela la pelvis (no se extirpa de forma generosa parte de la pelvis redundante como se suele hacer en la cirugía abierta, únicamente se extirpa la unión obstruida) lo que provoca que la disminución de la dilatación pélvica en el postoperatorio no sea tan llamativa.
Duplicidad renal
Un sistema doble se define como un riñón con 2 pelvis y cálices renales y su anatomía y presentación clínica es tan diversa que conduce a escenarios terapéuticos muy variables.
La duplicación puede ser incompleta, en la que hay un uréter bífido, o completa, en la que los 2 uréteres drenan en la vejiga por un orificio independiente siguiendo la ley de Weigert-Meyer: el uréter del polo renal inferior entra en la vejiga en su posición normal en el trígono, con un trayecto intravesical más directo y corto el cual favorece el RVU, y el uréter del polo superior se inserta en la vejiga medial e inferior a su ubicación normal, a veces, ectópicamente en la uretra posterior o en el aparato genital y otras finalizando en un ureterocele (UTC).
Megauréter
La clasificación de Smith en 4 categorías, según exista o no obstrucción y/o RVU, continúa siendo la más utilizada.
Si la DTU es a nivel ureteral superior a 7 mm, se le conoce como megaureter (MU), independientemente de que vaya acompañado o no de dilatación del sistema colector alto y sin hacer referencia a la obstrucción o el RVU. Para su diagnóstico son esenciales: la ecografía; la CUMS, para descartar RVU o DTU secundarias, por ejemplo a VUP; y el MAG-3, para ver la eliminación renal. En función del MAG-3, nos encontraremos con:
• MU no obstructivo ni refluyente, el más frecuente. Si se observa un drenaje adecuado en el MAG-3 en el primer año de vida, se debe hacer un manejo conservador, ya que hasta el 85% de ellos suelen remitir(12).
• MU no obstructivo, pero refluyente, el cual se explicará en el apartado de RVU.
• MU obstructivo y refluyente. Sin duda, este grupo representa el mayor desafío diagnóstico. Menos del 5% de los pacientes presentan esta forma clínica en la que coexiste el RVU y la obstrucción, en el cual el trayecto tunelizado urétero-vesical es anormal y la orina refluye al uréter, pero es incapaz de volver a la vejiga.
• MU obstructivo no refluyente. Se le conoce como megauréter obstructivo primario (MOP) y obedece a una estenosis vésico-ureteral (EVU).
En el MU el riesgo de ITU es mayor que en la EPU, especialmente en los primeros 6 meses de vida, por lo que se recomienda profilaxis antibiótica. Actualmente, los criterios de cirugía para el MU sin RVU están muy acotados, ya que el drenaje suele mejorar en los primeros meses de vida. En el último panel de expertos del Reino Unido, las indicaciones de intervención quirúrgica incluyen(14):
• Al diagnóstico, si la FRD es menor al 40% asociado a ureterohidronefrosis (UHN) masiva.
• Durante el seguimiento, si se produce un deterioro de la FRD > 5%, si existen sintomatología (ITUs febriles y/o dolor) o si se constata un incremento progresivo de la UHN.
Ureterocele
En Pediatría, suele asociarse al uréter del pielón superior de un sistema doble, produciendo obstrucción y deterioro/anulación de la función renal de ese hemirriñón.
Es el resultado de la dilatación quística del segmento intravesical del uréter. Se clasifican, según su localización y manejo, en:
• UTC intravesical: típico de adultos varones sin predominio por una lateralidad y frecuentemente bilateral. Suele encontrarse en el trígono y asociarse a un sistema renoureteral simple.
• UTC ectópico: es el que nos interesa, más frecuente en niñas en el lado izquierdo y únicamente bilateral en el 10% de los casos. Suele situarse distalmente al trígono (en el cuello vesical o uretra) y se asocia a un sistema renoureteral doble.
La forma más frecuente de presentación es una ITU en los primeros meses de vida o en una ecografía prenatal. En el diagnóstico, la ecografía se ha convertido en la prueba fundamental, ya que es capaz de visualizar la DTU a nivel piélico y ureteral, así como el UTC intravesical. La CUMS se debe realizar siempre, ya que en más del 50% de los casos, el pielón inferior ipsilateral y el 25% del contralateral tienen RVU. El DMSA permite valorar la función del hemirriñón superior y el MAG-3 la eliminación cuando se sospecha obstrucción.
La mayoría de pacientes precisan cirugía. La primera opción es la punción endoscópica, con un éxito del 90% en los UTC intravesicales y 50% en los ectópicos y, si esta falla, se debe realizar una reconstrucción por cirugía abierta. En caso de anulación funcional del pielón superior, el procedimiento de elección es la heminefrectomía, habitualmente por cirugía mínimamente invasiva.
Uréter ectópico
Un uréter que desemboca en cualquier otra parte que no sea el trígono vesical, es considerado ectópico (UE). Más del 90% de los casos se asocian a duplicidad renoureteral, dependiendo del hemirriñón superior.
En la mujer, los sitios usuales para su desembocadura son: el cuello vesical, la uretra, el vestíbulo y la vagina, por lo que clínicamente suele debutar como incontinencia urinaria. En el varón, los UE suelen drenar en: uretra prostática, utrículo prostático, vesícula seminal, conducto deferente o conducto eyaculatorio, manifestándose principalmente como orquioepididimitis de repetición.
Si el sistema renal del UE está funcionalmente anulado, se recomienda heminefrectomía y, si tiene función cirugía reconstructiva, como la ureteropielostomía, ureteroureterostomía o el reimplante ureteral.
Reflujo vésico-ureteral
Se define como el paso retrógrado no fisiológico de orina desde la vejiga al uréter. Es una de las entidades más comunes en urología pediátrica y tiene un espectro de severidad que va desde un hallazgo incidental autolimitado hasta una condición asociada con pielonefritis, cicatrices renales, hipertención e incluso ERC. Esta variabilidad plantea una enorme controversia sobre el diagnóstico óptimo y las estrategias de tratamiento.
Prevalencia
Muchos niños con RVU cursan de manera asintomática, con una incidencia estimada del 1%; si bien, trabajos más recientes sitúan la incidencia en niños sanos entre un 20-40%, especialmente en los primeros años de vida(15). En pacientes con DTU, la prevalencia de RVU es del 16%, y en pacientes con ITU, oscila entre un 18-38%. Esta va disminuyendo con la edad del niño, con una tasa de resolución espontánea del 10-15%/año.
Diagnóstico
Actualmente, el objetivo principal es la identificación de la población de riesgo de ITUs recurrentes y daño renal en lugar de simplemente detectar RVU. Definiendo los factores de riesgo para cada paciente (Tabla VI), es posible identificar a este subgrupo(16). Los estudios de imagen incluyen: ecografía renal y vesical, CUMS, CID y ecocistografía.
Pacientes con DTU prenatal
La ecografía es la primera herramienta de evaluación. Es raro que los lactantes con 2 ecografías sucesivas normales entre el primer y segundo mes de vida presenten RVU y, si existiese, suele ser de bajo grado. No obstante, la ausencia de DTU no descarta RVU y el grado de DTU no es un indicador fiable de la presencia de RVU. Por ello, la CUMS se recomienda en: DTU bilaterales de alto grado, duplicidades renales con DTU, UTC, dilatación ureteral o vejigas anormales, porque la probabilidad de RVU es mucho mayor en este grupo, así como los pacientes con DTU que comiencen con ITU(12).
Niños tras su primera ITU febril
Los niños con ITU febriles y alteraciones renales/vesicales en la ecografía tienen mayor riesgo de desarrollar cicatrices renales, por lo que se debe descartar RVU. Las guías europeas recomiendan una CUMS tras la primera ITU febril en menores de 2 años.
Ante una primera ITU febril en un niño entre 0-2 años, las guías europeas recomiendan un manejo más activo mediante CUMS. En cambio, las guías inglesas y americanas, con el fin de disminuir los estudios invasivos, solo recomiendan la CUMS en casos concretos(15). La guía inglesa NICE (National Institute for Health and Care Excellence) lo hace en menores de 6 meses si la ecografía muestra alteraciones, ITU recurrente o ITU atípica (enfermedad grave, flujo urinario bajo, masa abdominal/renal, elevación de creatinina, septicemia, falta de respuesta al tratamiento antibiótico tras 48 horas, organismo diferente a E. coli) y en menores de 3 años para casos seleccionados (DTU en la ecografía, flujo urinario bajo, no E. coli o historia familiar de RVU)(17). La Academia Americana de Pediatría la limita a niños entre 2 meses y 2 años si la ecografía muestra DTU, cicatrices renales u otros hallazgos sugerentes de RVU de alto grado o uropatía obstructiva, así como clínica atípica(18). No obstante, incluso dentro de la misma Academia, la Sección de Urología se ha mostrado recelosa de este protocolo(19).
Una alternativa es el enfoque “arriba-abajo” (top-down approach)(20). En él, se lleva a cabo inicialmente un DMSA en el momento de la IU febril para determinar la presencia de pielonefritis, que es seguida por una CUMS si el DMSA revela afectación renal. Sin embargo, la alta sensibilidad de la prueba hace que se diagnostiquen muchos casos como de factor predisponente, con una probabilidad de RVU si el DMSA es positivo del 49%; por lo que, actualmente, no se la considera una buena prueba de screening(6).
Hermanos y descendientes
El screening de hermanos o descendientes asintomáticos es controvertido. A pesar de no haber evidencia, se recomienda informar a los padres de que los hermanos y descendientes tienen una alta prevalencia de RVU, realizar ecografía para el cribado de hermanos y CUMS si hay evidencia de cicatrices renales en la ecografía o historia de ITU, y no cribar a pacientes mayores que hayan adquirido la continencia, pues no hay ningún valor añadido en el diagnóstico de RVU.
Niños con RVU y disfunción vesical e intestinal (DVI)
La detección de una DVI es esencial en el tratamiento del RVU, ya que estos pacientes con DVI corren mayor riesgo de desarrollar ITU y cicatrices renales. Además, la resolución del RVU es más precoz si se corrige la DVI. En caso de sintomatología compatible (urgencia, incontinencia, estreñimiento…), se debe realizar una anamnesis detallada, incluyendo diario miccional, así como uroflujometrías y residuo postmiccional. Si está disponible, la videourodinamia permite el estudio simultáneo de la dinámica vesical y el RVU, siendo de interés en pacientes con espina bífida o VUP con el fin de aunar varias pruebas invasivas.
Tratamiento
Hay dos enfoques, el conservador (observación, profilaxis) y el quirúrgico, cuya elección se basará en los factores de riesgo anteriormente descritos (Tabla VII).
Tratamiento no quirúrgico
El objetivo de la terapia conservadora es la prevención de la ITU febril. Se basa en que la resolución espontánea del RVU en los primeros años es casi del 80% en los grados I y II y del 30-50% en los grados III-V, algo inferior en caso de afectación bilateral, y en que el RVU no daña el riñón cuando los pacientes están libres de infección y tienen una función vésico-intestinal normal. El enfoque conservador incluye el seguimiento, la profilaxis antibiótica intermitente o continua, la rehabilitación de la vejiga si existe disfunción vesical y la circuncisión preventiva, ya que esta es eficaz para reducir el riesgo de ITU en niños sanos.
Respecto a la profilaxis, esta puede no ser necesaria en todos los pacientes con RVU, puesto que el beneficio es nulo o mínimo en los RVU de bajo grado. En RVU grado III-IV previene las ITUs recurrentes, pero su utilidad en la prevención del daño renal no está clara. Los que han demostrado obtener más beneficio son los niños continentes con disfunción vesical.
Tratamiento quirúrgico
Puede realizarse mediante inyección endoscópica de sustancias de volumen o reimplante ureteral intra o extravesical.
• Tratamiento endoscópico: es una alternativa a la profilaxis antibiótica a largo plazo y a la cirugía abierta. Mediante cistoscopia, se inyecta un material en la submucosa intramural del uréter que eleva el orificio ureteral y el uréter distal, lo que estrecha la luz e impide el RVU, mientras que todavía permite su flujo anterógrado.
• Cirugía abierta: existen varias técnicas, todas ellas comparten el principio básico de alargamiento de la parte intramural del uréter, aumentando su trayecto submucoso. Todas han demostrado baja tasa de complicaciones y excelente porcentaje de éxito (92-98%).
• Cirugía laparoscópica y robótica: actualmente existen muchas series que muestran la viabilidad de estas técnicas con resultados comparables a la cirugía abierta. La principal deficiencia son las dificultades técnicas con tiempos operatorios más largos que dificultan
una mayor aceptación. Se necesitan estudios adicionales para definir las tasas de éxito, los costes y los beneficios globales. Por lo tanto, en la actualidad, no se puede recomendar el procedimiento laparoscópico como un procedimiento de rutina. Se puede ofrecer como una alternativa a los padres en centros donde haya experiencia establecida.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Palacios Loro ML, Segura Ramírez DK, Ordoñez Álvarez FA, Santos Rodríguez F. Congenital anomalies of the kidney and urinary tract. A vision for the paediatrician. An Pediatr (Barc). 2015; 83: 442.e1-5.
2.*** Hodhod A, Capolicchio JP, Jednak R, et al. Evaluation of Urinary Tract Dilation Classification System for Grading Postnatal Hydronephrosis. J Urol. 2016; 195: 725-30.
3. Liu D, Palmer B, Maizels M, Herndon A, Chaviano A. CEVL training to SFU grade pediatric hydronephrosis: a guide for pediatric caregivers. J Pediatr Urol. 2015; 11: 52-3.
4.*** Nguyen HT, Benson CB, Bromley B, et al. Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). J Pediatr Urol. 2014; 10: 982-98.
5.*** Chow JS, Koning JL, Back SJ, et al. Classification of pediatric urinary tract dilation: the new language. Pediatr Radiol. 2017; 47: 1109-15.
6.** Shaikh N, Spingarn RB, Hum SW. Dimercaptosuccinic acid scan or ultrasound in screening for vesicoureteral reflux among children with urinary tract infections. Cochrane Database Syst Rev. 2016; 7: CD010657.
7. Sánchez Abuín A, del Cañizo López A, Aguilar Cuesta R, Molina Vázquez ME. Indicaciones quirúrgicas en patología urológica pediátrica. Pediatr Integral. 2014; XVIII(10): 739-49.
8.** Frimberger D, Mercado-Deane MG; Section on Urology; Section on Radiology. Establishing a Standard Protocol for the Voiding Cystourethrography. Pediatrics. 2016; 138: 5.
9. Whittam BM, Calaway A, Szymanski KM, et al. Ultrasound diagnosis of multicystic dysplastic kidney: is a confirmatory nuclear medicine scan necessary? J Pediatr Urol. 2014; 10: 1059-62.
10.** Sarhan OM, Alghanbar M, Alsulaihim A, et al. Multicystic dysplastic kidney: Impact of imaging modality selection on the initial management and prognosis. J Pediatr Urol. 2014; 10: 645-9.
11.** Babu R, Rathish VR, Sai V. Functional outcomes of early versus delayed pyeloplasty in prenatally diagnosed pelvi-ureteric junction obstruction. J Pediatr Urol. 2015; 11: 63.e1-5.
12.*** Tekgül S, Dogan HS, Hoebeke P, et al. Guidelines on Paediatric Urology. European Society for Paediatric Urology. 2016. ISBN: 978-90-79754-98-4.
13.*** Gutiérrez Segura C, Gómez Farpón Á, Granell Suárez C. Anomalías congénitas del riñón y del tracto urinario. Pediatr Integral. 2013; XVII(6): 391-401.
14.** Farrugia MK, Hitchcock R, Radford A, Burki T, Robb A, Murphy F. British Association of Paediatric Urologists. British Association of Paediatric Urologists consensus statement on the management of the primary obstructive megaureter. J Pediatr Urol. 2014; 10: 26-33.
15. Tullus K. Vesicoureteric reflux in children. Lancet. 2015; 385: 371-9.
16. Snodgrass WT, Shah A, Yang M, Kwon J, Villanueva C, Traylor J, et al. Prevalence and risk factors for renal scars in children with febrile UTI and/or VUR: a cross-sectional observational study of 565 consecutive patients. J Pediatr Urol. 2013; 9: 856-63.
17. National Institute for Health and Clinical Excellence. Urinary tract infection in under 16s: diagnosis and management NICE guideline CG54. 2007.
18. Subcommittee on Urinary Tract Infection. Reaffirmation of AAP Clinical Practice Guideline: The Diagnosis and Management of the Initial Urinary Tract Infection in Febrile Infants and Young Children 2–24 Months of Age. Pediatrics. 2016; 138: 6.
19. Wan J, Skoog SJ, Hulbert WC, Casale AJ, Greenfield SP, Cheng EY, et al. Executive Committee, Section on Urology, American Academy of Pediatrics. Section on Urology response to new Guidelines for the diagnosis and management of UTI. Pediatrics. 2012; 129: e1051-3.
20. Zhang X, Xu H, Zhou L, Cao Q, Shen Q, Sun L, et al. Accuracy of early DMSA scan for VUR in young children with febrile UTI. Pediatrics. 2014; 133: e30-8.
Bibliografía recomendada
- Nguyen HT, Benson CB, Bromley B, et al. Multidisciplinary consensus on the classification of prenatal and postnatal urinary tract dilation (UTD classification system). J Pediatr Urol. 2014; 10: 982-98. doi: 10.1016/j.jpurol.2014.10.002.
Representa el eje vertebral del cambio realizado a la hora de interpretar las ecografías pre y posnatales.
- Chow JS, Koning JL, Back SJ, et al. Classification of pediatric urinary tract dilation: the new language. Pediatr Radiol. 2017; 47: 1109-15. doi: 10.1007/s00247-017-3883-0.
Basada en el artículo anterior, ejemplifica con múltiples imágenes ecográficas cómo se valora y se cataloga actualmente la DTU.
- Tekgül S, Dogan HS, Hoebeke P, et al. Guidelines on Paediatric Urology. European Society for Paediatric Urology. 2016. ISBN: 978-90-79754-98-4. http://uroweb.org/wp-content/uploads/EAU-Guidelines-Paediatric-Urology-2016-1.pdf.
Última guía europea de urología pediátrica que sintetiza los principales dogmas de la especialidad.
- National Institute for Health and Clinical Excellence. Urinary tract infection in under 16s: diagnosis and management NICE guideline CG54. 2007.
Está guía está actualmente vigente. Se espera su actualización para finales de septiembre, aunque las recomendaciones de este texto siguen en pie. https://www.nice.org.uk/Guidance/cg54.