 |
| Temas de FC |
F. Fernández Carrión, E. González Salas
Unidad de Urgencias y Cuidados Intensivos Pediátricos. Hospital Clínico Universitario de Salamanca
| Resumen
El traumatismo craneoencefálico (TCE) es una de las primeras causas de muerte e incapacidad en niños en países desarrollados y uno de los motivos más frecuentes de consulta en Pediatría. Cualquier TCE puede producir lesiones intracerebrales (LIC); por lo que, una vez que ha ocurrido, nuestro objetivo será identificar a los pacientes con LIC o con riesgo de desarrollarla, y evitar en la medida de lo posible, que ese daño inicial aumente. Para ello, disponemos de guías clínicas aceptadas universalmente, que nos ayudan a proporcionar las mejores medidas de prevención del daño secundario y de tratamiento del TCE en niños. La gravedad del TCE se establece fundamentalmente con la escala de Glasgow, siendo la mayoría casos leves. La tomografía craneal (TC) es la prueba diagnóstica de referencia, aunque en ausencia de factores de riesgo de LIC, la observación clínica en TCE leves es una alternativa válida a la realización de una prueba de imagen. Conocer la fisiopatología del TCE y, cómo factores, como: la hipoxia, la hipercapnia, la hipotensión arterial o la hipertensión intracraneal, pueden aumentar la lesión cerebral, nos permitirá optimizar la estabilización inicial y conseguir con ello mejorar el pronóstico y la supervivencia del niño con TCE grave. |
| Abstract
Traumatic brain injury (TBI) is one of the leading causes of death and disability in children in developed countries and one of the most frequent reasons for consultation in Pediatrics. Any TBI can produce intracerebral lesions (ICL); therefore, once it has occurred, our goal will be to identify patients with ICL or at risk of developing it, and to prevent, as far as possible, that initial damage from increasing. To achieve this, we have universally accepted clinical guidelines, which help us to provide the best measures for the prevention of secondary damage and treatment of TBI in children. The severity of TBI is established mainly with the Glasgow scale, being the majority mild. Cranial tomography (CT) is the reference diagnostic test, although in the absence of risk factors for ICL, clinical observation in mild TBI is a valid alternative to performing an imaging test. Knowing the pathophysiology of TBI and how factors such as hypoxia, hypercapnia, hypotension, or intracranial hypertension can increase brain injury, will allow us to optimize initial stabilization and thereby, improve prognosis and survival of the child with severe TBI. |
Palabras clave: Traumatismo craneoencefálico; Pediátrico; Cuidados prehospitalarios.
Key words: Traumatic brain injury; Pediatric; Prehospital emergency care.
Pediatr Integral 2024; XXVIII (1): 7 – 16
OBJETIVOS
• Conocer la fisiopatología básica del TCE.
• Entender cómo el tratamiento del TCE se basa en dicha fisiopatología.
• Adquirir estrategias para optimizar los recursos diagnósticos ante un TCE.
• Adquirir los conocimientos necesarios para proporcionar el tratamiento inicial más adecuado al niño con TCE grave, y con ello mejorar su pronóstico y supervivencia.
Traumatismo craneoencefálico
Introducción
El traumatismo craneoencefálico (TCE) continúa siendo una de las primeras causas de muerte e incapacidad en niños a nivel mundial.
El TCE se puede definir como: la lesión de la estructura y/o de la función del encéfalo, secundaria a un traumatismo o fuerza mecánica externa, con o sin afectación craneal apreciable, con o sin afectación visible en las pruebas de imagen.
A pesar de los avances en las medidas de prevención y tratamiento de los últimos años, continúa siendo una de las principales causas de morbilidad y mortalidad en la infancia en países desarrollados y un problema sanitario importante, dada su elevada incidencia en niños y jóvenes y la posibilidad de secuelas que origina. Sin embargo, desde mediados de los años ochenta, se ha estabilizado la tasa de supervivencia, y gracias a los avances en el conocimiento: de la fisiopatología, de la neuromonitorización y de la farmacología, tenemos la posibilidad de mejorar la evolución clínica del paciente a corto y largo plazo.
La mayoría de TCE en niños son leves, patología habitualmente banal que presenta pocas probabilidades de complicaciones posteriores. En el caso de TCE moderado o grave, el riesgo de que haya LIC es mayor. Dado que el traumatismo ya ha ocurrido, nuestros objetivos serán evitar todos los factores que pueden empeorar el daño inicial, e identificar a los pacientes con riesgo de desarrollar LIC. Para ello, disponemos de diversos protocolos y guías clínicas aceptadas universalmente(1-4). Precisamente, desde la última revisión del tema en Pediatría Integral(5), se ha publicado la tercera edición de las guías de atención al TCE grave en niños de la Brain Trauma Foundation(1) y, aunque no hay grandes cambios respecto a las anteriores, consideramos que es una patología suficientemente importante en Pediatría para actualizar periódicamente.
Epidemiología
La incidencia de TCE en España ha disminuido en los últimos años, aunque a nivel mundial ha aumentado. El TCE es más frecuente en niños entre 0 y 4 años (caídas) y en adolescentes (deportes, tráfico, autolesiones).
A pesar de que en España el número total de TCE ha disminuido en los últimos años y ha pasado a ser la segunda causa de mortalidad en mayores de un año tras el cáncer, continúa siendo una enfermedad muy importante por su elevada incidencia, prevalencia y morbimortalidad. Es una de las patologías más frecuentes en los Servicios de Urgencias Pediátricos, con dos picos de incidencia: niños entre cero y cuatro años y adolescentes. Es más frecuente en varones en todos los grupos de edad. En niños que han sufrido un politraumatismo, entre el 60-80 % presentan TCE, y de ellos, el 10 % un TCE grave. La mortalidad oscila según series entre el 12 y el 33 %, siendo mayor en los menores de 1 año, aunque globalmente los niños tienen una mortalidad inferior a la del adulto. Hasta el 80 % de niños con TCE grave presentan algún tipo de secuela cognitiva.
Es difícil conocer la incidencia exacta de TCE, que probablemente esté infraestimada al no ser una enfermedad que se declara, pero disponemos de algunos trabajos que estiman su evolución en los últimos años: en EE.UU. la incidencia global en todas las edades aumentó en 2013 respecto a 2007(6), siendo ese año en niños entre 0-4 años de 1.590 por 100.000 y año, y en adolescentes de 1.080 por 100.000 y año. Otro estudio que estima la incidencia mundial(7) encuentra que, en 2016, hubo casi 28 millones de nuevos TCE en el mundo, con un aumento de la incidencia global respecto al año 1990 del 8 %. Aunque no especifica por edades, según estos datos, en España, en 2016, hubo unos 130.000 TCE, disminuyendo la incidencia un 16 % respecto al año 1990. Según datos del Instituto Nacional de Estadística (disponibles en www.ine.es), en España ingresan al año unos 4.400 menores de 14 años por TCE, suponiendo en torno al 1,3 % de todas las hospitalizaciones en Pediatría y, según la misma fuente, en el año 2021, fallecieron por caídas, accidentes o suicidio con traumatismo, 242 menores entre 1 y 19 años, lo que supondría casi el 25 % de todas las muertes en esa franja de edad.
En cuanto a la etiología(6), las caídas son la causa más frecuente a nivel mundial. Por edades, en neonatos serán los partos traumáticos e instrumentales la principal causa de TCE. En lactantes, las caídas, el maltrato y los accidentes de tráfico. Mientras, en escolares y adolescentes, los accidentes y caídas relacionadas con el deporte, y los accidentes de tráfico son las principales causas, llamando la atención el aumento de TCE en adolescentes y adultos jóvenes secundarios a autolesiones o intento de suicidio, en los últimos años.
Fisiopatología
Tras el daño cerebral inicial o primario, existen factores que lo aumentan (daño secundario), muchas veces evitables. Conocer la fisiopatología del TCE, nos ayudará a proporcionar el tratamiento inicial más adecuado al niño con TCE grave.
Los niños, sobre todo, los neonatos y lactantes, son más susceptibles de sufrir un TCE grave que los mayores o adultos, debido a algunas características propias de la edad, como: la mayor relación de superficie de la cabeza respecto al cuerpo, huesos craneales más delgados y deformables, músculos cervicales más débiles o un cerebro todavía con la mielinización en desarrollo y con un flujo sanguíneo y consumo de oxígeno hasta el doble que en adultos.
El impacto puede trasladar al contenido craneal diferentes fuerzas mecánicas: impacto directo, aceleración y desaceleración, movimientos de translación (con desplazamiento de la masa encefálica respecto al cráneo) o de rotación, o incluso impactos penetrantes, originando lesión de las estructuras encefálicas mediante diferentes mecanismos complejos e interrelacionados entre sí.
Daño cerebral primario o lesión primaria
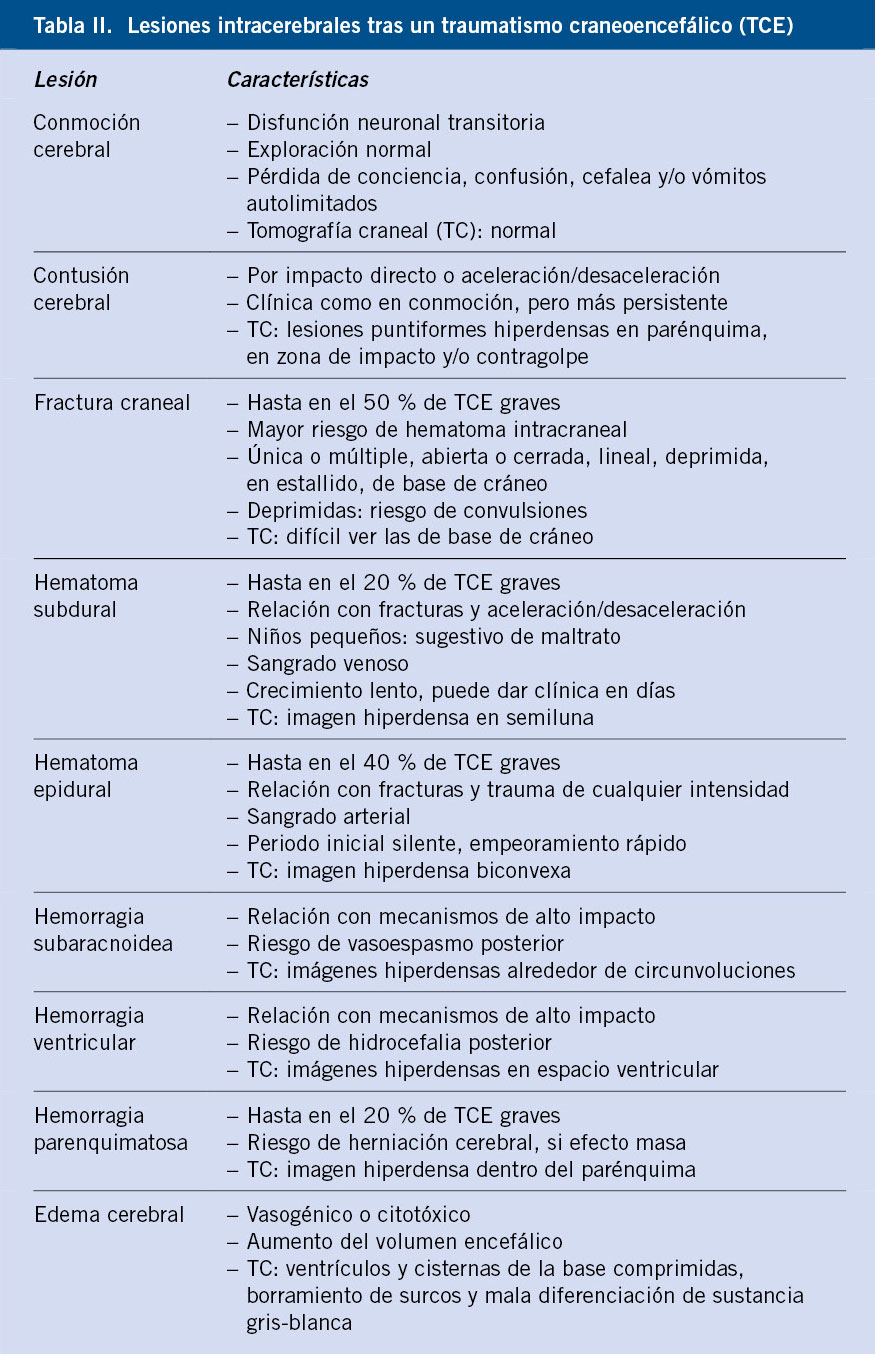
Lesiones nerviosas y vasculares producidas inmediatamente por la agresión mecánica, en relación directa con la magnitud de la energía del traumatismo (masa y velocidad al cuadrado). El cambio brusco de presión puede originar fracturas, contusiones o hematomas, tanto en la zona del impacto como en la opuesta o contragolpe.
Daño cerebral secundario o lesión secundaria
Lesiones cerebrales que se producen después del impacto, tanto a nivel celular como extracelular, favorecidas por alteraciones sistémicas o intracraneales que pueden aumentar la lesión primaria. El daño neuronal inicial puede liberar neurotransmisores excitadores que producirán: despolarización de las membranas celulares, disrupción mitocondrial, estrés oxidativo y alteración de la síntesis de ATP, al mismo tiempo que se crea un gradiente osmótico que favorece el edema citotóxico celular. Por otro lado, el daño endotelial puede conducir a un edema vasogénico a nivel extracelular, y la rotura de la barrera hematoencefálica también permite la llegada de células pro-inflamatorias que activan y potencian la cascada inflamatoria y el edema citotóxico(8).
Autorregulación cerebral
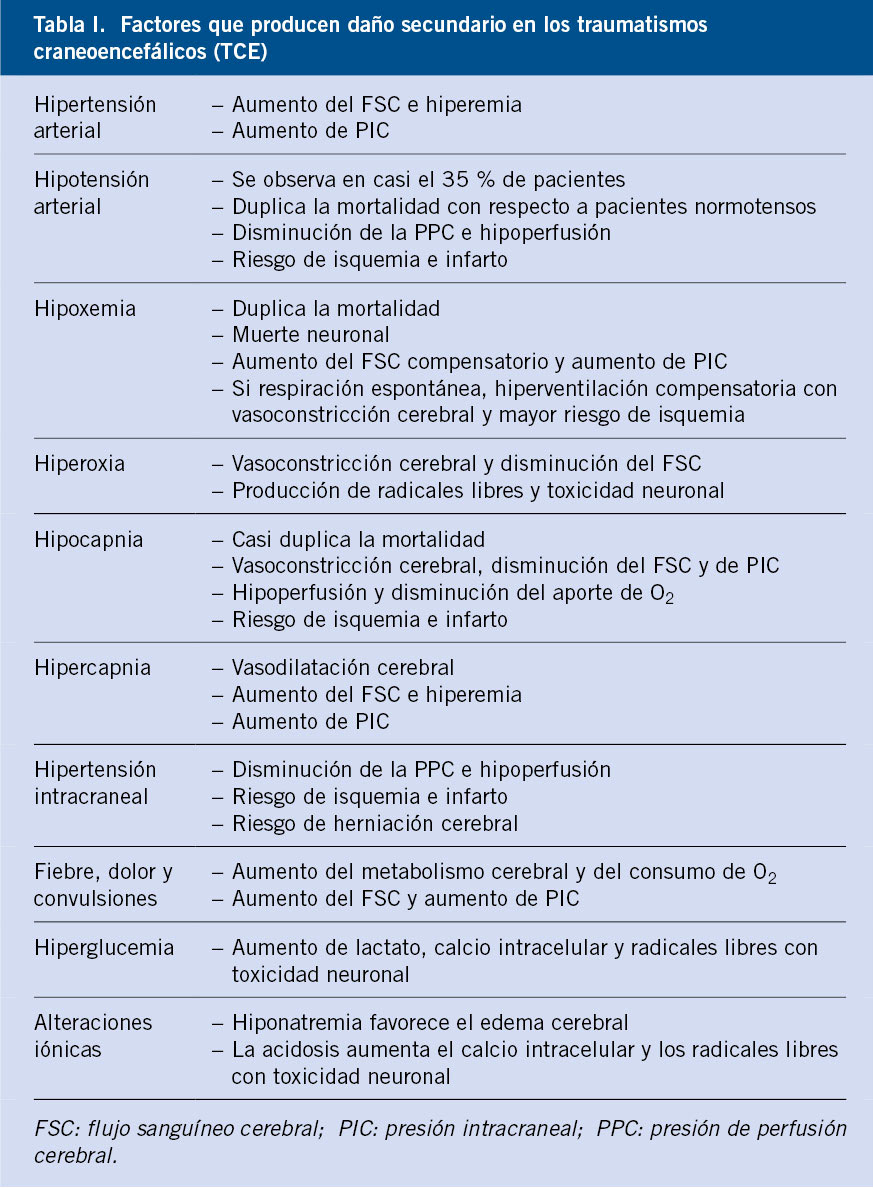
La autorregulación cerebral es la capacidad que tiene el cerebro de mantener un flujo sanguíneo cerebral (FSC) constante a pesar de los cambios en la presión arterial media (PAM), gracias a que las arteriolas cerebrales cambian su diámetro en respuesta a los cambios de PAM. De este modo, el aporte de oxígeno y nutrientes se mantiene constante. En casos de patología neurológica aguda, esa autorregulación se altera, de modo que el FSC va a depender, en mayor medida, de la PAM; de modo que, si hay hipertensión arterial, habrá más riesgo de FSC elevado o hiperemia y hemorragia, y si hay hipotensión arterial, más riesgo de FSC disminuido e isquemia.
Presión de perfusión cerebral (PPC)
En cualquier órgano, la presión de perfusión es equivalente a la diferencia entre la presión de entrada o arterial y la de salida o venosa, y esa diferencia de presiones es responsable del flujo sanguíneo(9). En el encéfalo, la presión de entrada es igual a la PAM a nivel de la carótida interna, mientras que la de salida es equivalente a la presión en las venas corticales, que refleja la presión intracraneal (PIC). De este modo, podemos calcular la PPC mediante la diferencia entre PAM y PIC: PPC = PAM – PIC. En niños con TCE, se aconseja mantener una PPC superior a 40 mmHg en pequeños, 50 mmHg en escolares y, en adolescentes, entre 50-60 mmHg como en adultos(10). Esto es fundamental, porque el cerebro tiene poca capacidad para almacenar oxígeno y glucosa; de modo que, si se perfunde mal, podría haber daño neuronal en pocos minutos.
Factores que aumentan el daño secundario
Diversas alteraciones intracraneales o sistémicas pueden producir daño secundario, exacerbando el daño inicial (Tabla I). Si somos capaces de evitarlas o tratarlas precozmente, conseguiremos mejorar el pronóstico del paciente.
Clínica
La clínica es muy variable, desde asintomáticos hasta coma e, incluso, herniación cerebral, dependiendo, en gran medida, de la severidad del traumatismo y de la presencia de lesiones intracerebrales.
La clínica tras un TCE es muy variable y, aunque depende en gran medida de la severidad del traumatismo o de la presencia de LIC, no siempre existe una correlación lineal entre ellas. El paciente puede estar asintomático, presentar solo cefalea o algún vómito, o bien clínica de hipertensión intracraneal (HIC) e, incluso, signos de herniación cerebral. Hay que tener en cuenta que, en lactantes, la sintomatología puede ser inespecífica, y más tardía, al tener suturas y fontanelas abiertas que les permiten tolerar inicialmente las LIC ocupantes de espacio(11).
Los síntomas y signos más típicos tras un TCE son: amnesia, cefalea, agitación o irritabilidad, tendencia al sueño, vómitos, convulsiones, pérdida de conciencia, cefalohematomas, fracturas palpables y signos de fractura de base de cráneo (otorrea, rinorrea, otorragia o hemotímpano, hematomas periorbitarios u ojos en mapache, y hematoma retroauricular o signo de Battle).
La pérdida de conciencia mayor de 5 segundos o la cefalea intensa o progresiva son factores de riesgo de LIC. Respecto a los vómitos, síntoma que genera más controversia en cuanto a la indicación de una prueba de imagen, se ha visto que la mayoría de los pacientes con vómitos aislados, sin otro factor de riesgo acompañante, no tienen LIC(3). Sí que implican mayor riesgo de lesión: si son repetitivos y no ceden, si comienzan de modo tardío o si ocurren en mayores de 2 años.
Las convulsiones pueden ser inmediatas tras el traumatismo, precoces (en los primeros 7 días) o tardías. Las crisis inmediatas se producen como consecuencia del impacto directo, por despolarización de la corteza cerebral, y suelen producir hipertonía generalizada y/o movimientos clónicos. Las crisis precoces se suelen relacionar con: hematomas intracraneales, contusiones cerebrales, alteraciones electrolíticas o vasculares, y suelen ser crisis parciales simples con generalización secundaria.
Si hay HIC o una LIC con efecto masa, puede haber desplazamiento de zonas del cerebro a través de distintas estructuras, provocando una herniación cerebral. Aquí podemos encontrar: hemiparesia, midriasis uni o bilateral, descenso rápido del nivel de conciencia, parálisis de pares craneales o posturas de decorticación o descerebración. La tríada clásica de Cushing (hipertensión arterial, bradicardia y bradipnea) no siempre está presente y, además, suele ser tardía. En lactantes, aunque no siempre, se puede apreciar una fontanela anterior a tensión y alteración de la mirada conjugada superior.
El paradigma del daño lesional primario por aceleración/desaceleración es el daño axonal difuso, donde se alteran el citoesqueleto y los axones tras la activación de la cascada inflamatoria, sobre todo, a las 24-48 horas del trauma. Sospechar en pacientes sin LIC en TC, ni HIC clínica o en monitorización, y que siguen en coma.
El TCE grave puede conllevar complicaciones sistémicas. Además de sospechar siempre lesión cervical hasta que se descarte, puede haber: alteraciones del ritmo cardiaco, hiperactividad simpática (agitación, distonías, fiebre, taquicardia, hipertensión, sudoración), edema pulmonar neurogénico o coagulopatía, entre otros.
Tipos de lesiones
El traumatismo puede provocar diferentes lesiones intracerebrales, que determinan en gran medida la clínica, gravedad y pronóstico (Tabla II). La mitad de los niños tendrán más de un tipo al mismo tiempo(12). Son indicativas de mal pronóstico: la hemorragia subaracnoidea, la hemorragia ventricular y, sobre todo, el edema cerebral en el TC inicial(13).
Clasificación y diagnóstico
El TCE se clasifica mediante la escala de Glasgow, la clínica y la presencia de lesiones intracerebrales.
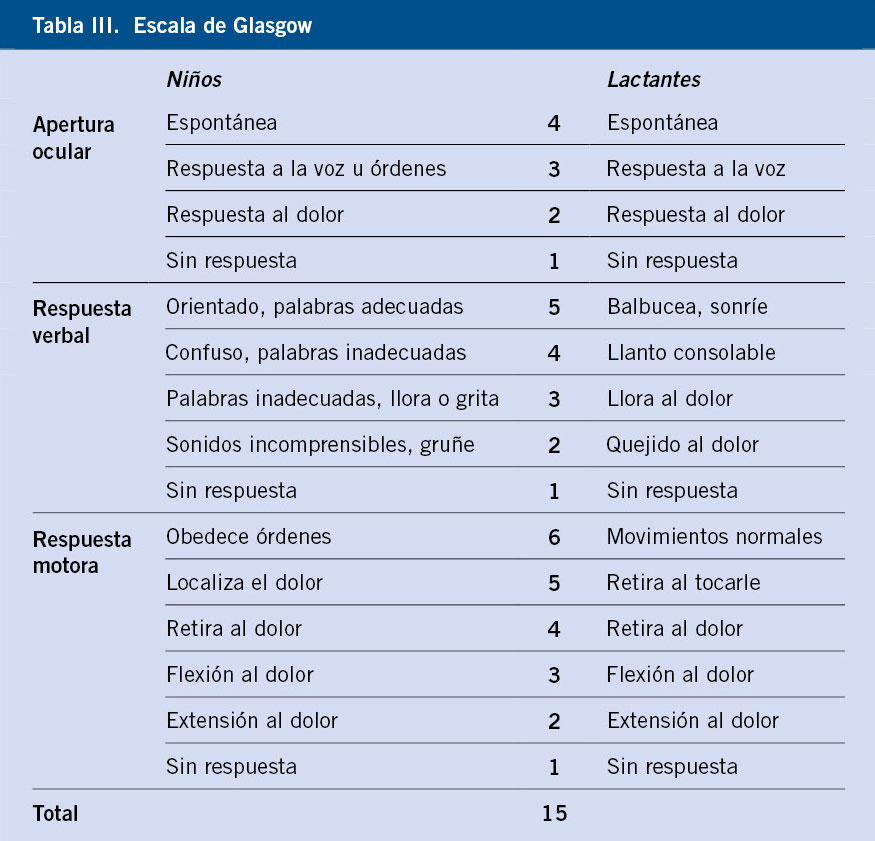
Desde que se introdujo en 1974, la escala de Glasgow (Tabla III) constituye la forma habitual de clasificación del TCE(12), gracias a su simplicidad y facilidad de uso, y a la buena correlación entre la puntuación inicial y el pronóstico final. La valoración motora es la de mayor importancia pronóstica.
Existe una escala adaptada para lactantes. Pero no solo utilizaremos la puntuación de Glasgow para clasificar el traumatismo, sino que también tendremos en cuenta la clínica y los hallazgos en la neuroimagen. Esta clasificación no es universal, sino que es muy variable según guías y protocolos. Teniendo en cuenta todo ello, podemos clasificar el TCE como:
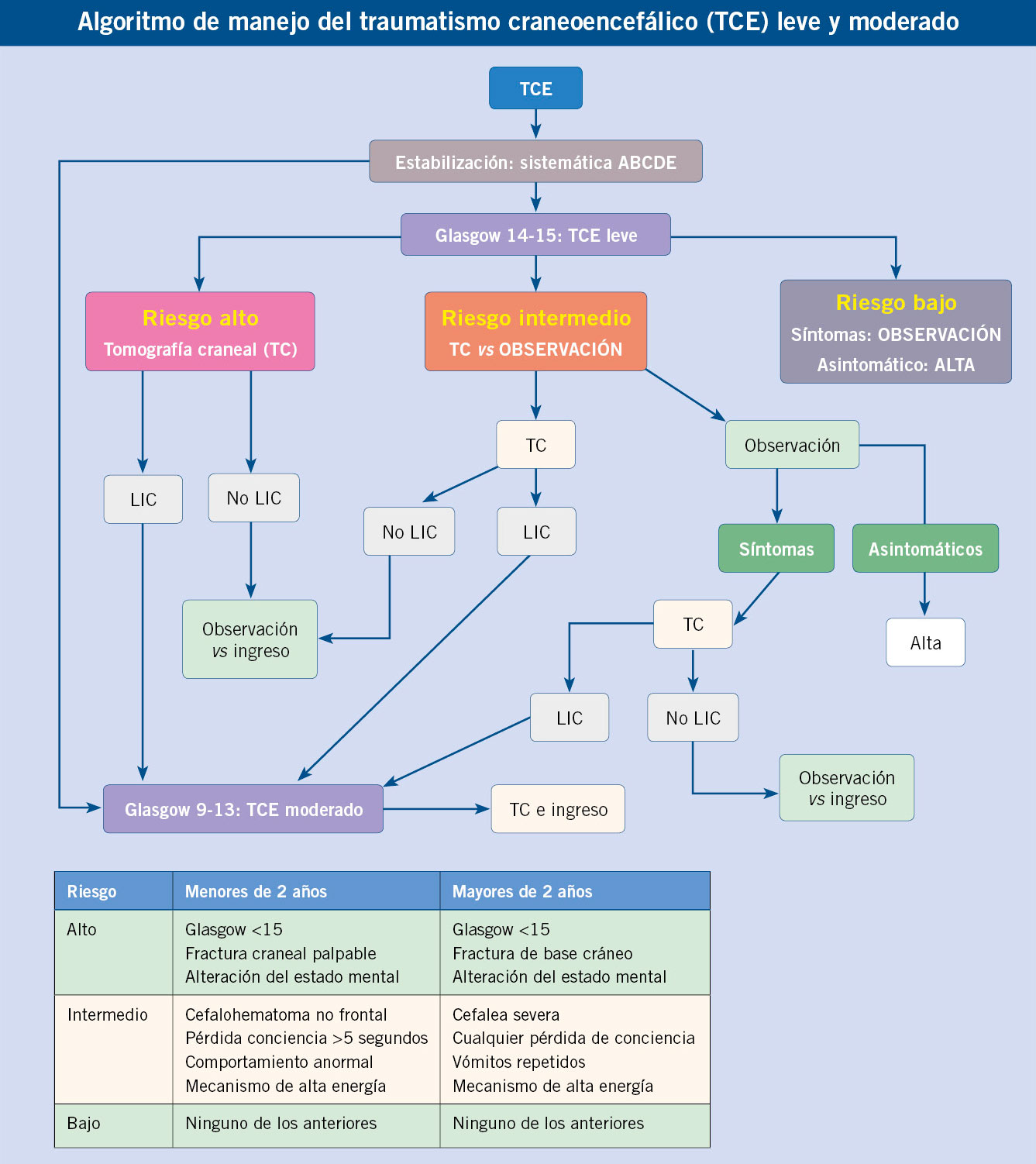
• TCE leve: Glasgow de 14-15. Sin alteración del estado mental o alteración transitoria. Puede haber: pérdida de conciencia, amnesia o desorientación, vómitos o cefalea, todo ello de modo transitorio y que se resuelve espontáneamente. Neuroimagen sin LIC (si la tiene, lo consideraremos TCE moderado).
• TCE moderado: Glasgow 9-13. Alteración del estado mental, pérdida de conciencia de mayor duración, amnesia postraumática, tendencia al sueño, vómitos repetidos, cefalea mantenida o progresiva, convulsiones postraumáticas o déficit neurológico focal. Neuroimagen con o sin lesión en TC.
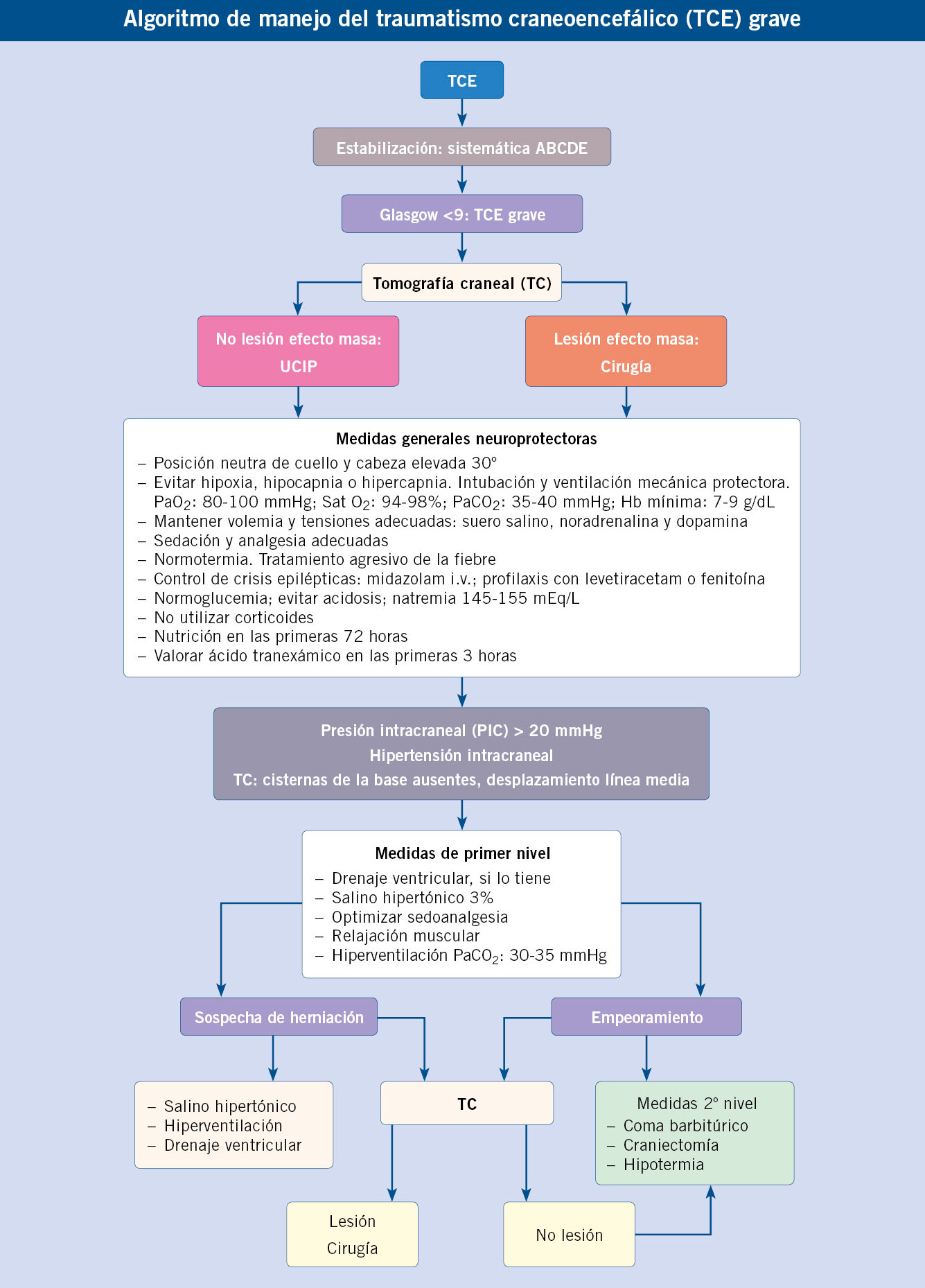
• TCE grave: Glasgow <9.
Diagnóstico
La tomografía craneal es la prueba diagnóstica de elección, aunque no está indicado en todos los niños con TCE de modo sistemático.
Los objetivos principales en la valoración de un niño con TCE son la estabilización inicial para prevenir el daño secundario y descartar LIC que precise intervención neuroquirúrgica urgente. Para ello, es fundamental realizar una anamnesis y exploración física completas, además de pruebas complementarias.
Anamnesis
Historia detallada del episodio, mejor por los testigos del accidente: lugar y tiempo transcurrido, mecanismo y trauma de alta energía (atropello; accidentes con muerte de otro pasajero, vuelta de campana o eyección; impacto severo; caída mayor de 1 metro en lactantes o mayor de 1,5 metros en mayores de 2 años). Recoger la evolución desde el traumatismo: pérdida de conciencia y duración, amnesia del episodio, convulsiones, nivel de conciencia, etc. Recabar antecedentes personales y familiares (enfermedades, coagulopatías o fármacos anticoagulantes, malformaciones vasculares, válvula de derivación ventrículo-peritoneal, etc.). Si historia incongruente o tardanza en consultar, valorar la posibilidad de maltrato(11).
Exploración física
Exploración neurológica completa, recordando siempre la posibilidad de lesión de la columna cervical, explorando las apófisis espinosas (movilidad, dolor) y déficits motores o sensitivos. Evaluar: nivel de conciencia, tamaño y reactividad de pupilas, pares craneales, reflejos y movilidad. Exploración de la cabeza buscando hematomas, heridas, crepitación o depresión de huesos y signos de fractura de base de cráneo. Los hematomas pueden ser subcutáneos, subgaleales sin respetar suturas y blandos, o subperiósticos respetando suturas y duros(11). Cualquier cefalohematoma en niños menores de 3 meses, los no frontales en menores de 2 años, o los mayores de 3-4 cm en cualquier niño, implican mayor riesgo de LIC.
Pruebas complementarias
Además de realizar una analítica completa con: hemograma, bioquímica, gasometría, coagulación y pruebas cruzadas, la neuroimagen es fundamental, siendo la TC la prueba gold estándar. No se recomienda realizar radiografía de cráneo en niños con TCE(4).
La sensibilidad para detectar fracturas lineales es solo del 63 %, y no detecta LIC. Además, si se sospecha la existencia de una fractura por la exploración física, estaría indicado realizar TC. Sí que estaría indicado hacer una serie ósea, si sospecha de maltrato. En lactantes pequeños, se puede realizar una ecografía transfontanelar para detectar lesiones hemorrágicas precozmente, pero su sensibilidad para otras lesiones no es buena, por lo que no exime de realizar una TC, si se considera indicado.
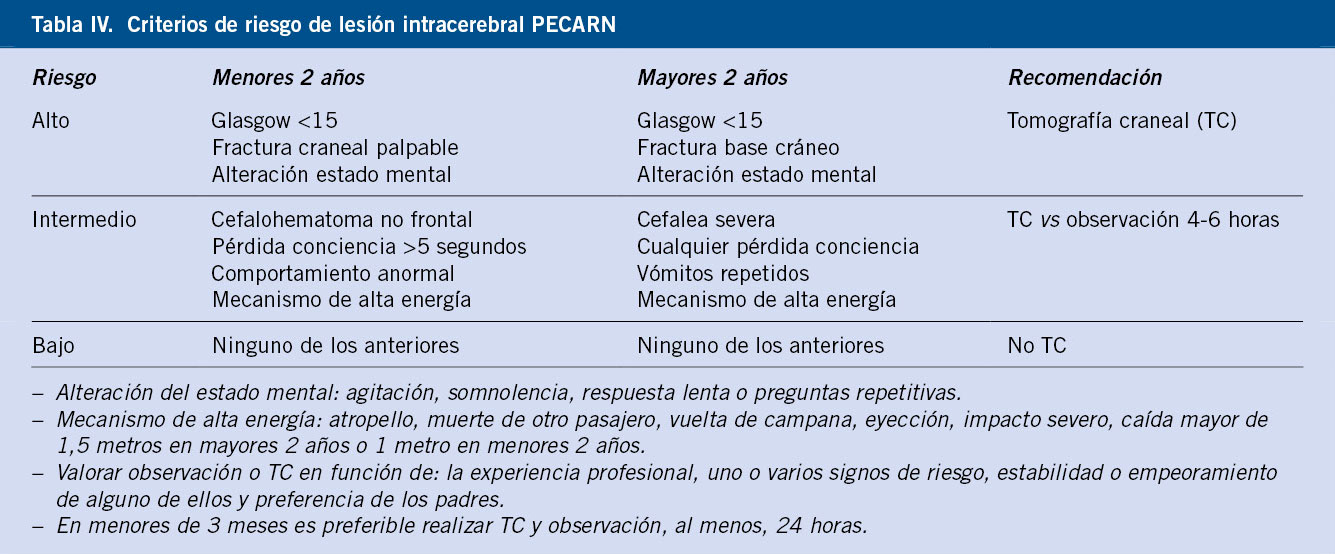
La TC es la prueba de elección para el diagnóstico y el seguimiento. Sin embargo, no está exento de riesgos a largo plazo, debido a la radiación y el riesgo secundario de cáncer a lo largo de la vida. Mientras que en el TCE moderado (LIC hasta en 27 %) o grave (LIC hasta en 65 %) está indicado siempre (valorar si es necesario TC cervical al mismo tiempo), la controversia surge en el TCE leve, ya que un 5 % de los niños según series, tendrán alguna LIC en la TC(12). Por los posibles riesgos que supone, no se debe hacer una TC sistemáticamente a todos los niños con TCE leve, sino solo a aquellos con mayor riesgo de tener una LIC. Para ello, disponemos de algoritmos de decisión para predecir la existencia de LIC en función de la presencia o no de factores de riesgo, que han demostrado ser eficaces en la detección de dichas lesiones, y que nos ayudan a decidir cuándo solicitar una TC en el niño con TCE leve. Los más conocidos son: PECARN(3) (Pediatric Emergency Care Applied Research Network), CATCH (Canadian Assessment of Tomography for Childhood Head injury) y CHALICE (Children’s Head injury Algorithm for the prediction of Important Clinical Events), siendo quizás el primero, el más utilizado y el que tiene mayor sensibilidad para detectar lesiones(14) (Tabla IV).
La resonancia magnética no está indicada como prueba inicial, dadas las ventajas de la TC y, además, tiene menos sensibilidad para fracturas de cráneo. Sin embargo, hay centros que la utilizan de elección, realizando una secuencia rápida de 6-7 minutos(15). Útil para la valoración posterior o si sospecha de lesión axonal difusa o lesión medular.
Manejo del TCE leve o moderado
El objetivo principal, tras estabilizar al paciente, será identificar a los niños con TCE leve que tienen factores de riesgo para tener una lesión intracerebral, a los cuales se hará una tomografía craneal. En TCE moderado siempre está indicada la tomografía craneal.
Un TCE leve aparentemente banal y asintomático puede acabar en un cuadro severo. Este hecho, el que el TCE sea un proceso dinámico que puede cambiar en minutos u horas, nos obliga a mantener una estrecha monitorización neurológica, vigilando el nivel de conciencia, reactividad pupilar, focalidad o aparición de cualquier signo sugerente de HIC.
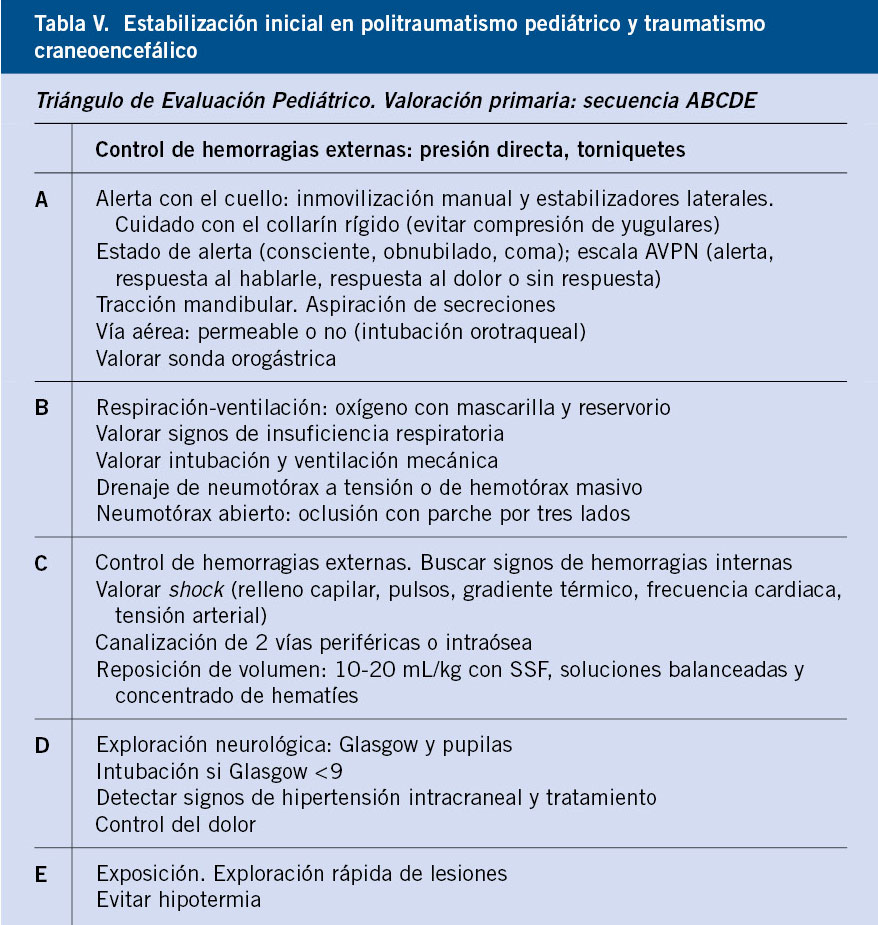
La evaluación y tratamiento del niño con TCE debe seguir las pautas del manejo del politraumatismo pediátrico(16): una evaluación inicial siguiendo la secuencia ABCDE (Tabla V), donde el objetivo es identificar y tratar cualquier lesión o situación con riesgo vital inmediato y, tras ella, una evaluación secundaria exhaustiva donde se valoren todas las lesiones del paciente y se inicie su tratamiento(17).
Una vez estabilizado, y siempre asegurando una analgesia adecuada, en casos de TCE leve nos guiaremos con los criterios PECARN(3) para decidir la actitud a seguir. Si el TCE es moderado, se hará siempre TC e ingreso para monitorización neurológica:
• En TCE leves sin factores de riesgo de LIC y paciente asintomático, valorar el alta proporcionando a los cuidadores una hoja con recomendaciones para la observación clínica domiciliaria y con los signos de alerta que deben tener en cuenta para consultar de nuevo (disponible en: https://seup.org/hojas-informativas/).
• En TCE leves con factores de riesgo de LIC, se haya realizado o no TC (en ese caso, si no hay LIC), se puede valorar el alta tras observación clínica de, al menos, 4-6 horas, si el paciente está asintomático y con exploración neurológica normal, y los cuidadores están capacitados para una correcta valoración en domicilio. Si no se ha realizado TC y los cuidadores no están capacitados, o domicilio lejano al centro sanitario, valorar prolongar la observación algunas horas.
• En TCE leves con factores de riesgo de LIC, se haya realizado o no TC y, aunque este sea normal, si siguen con síntomas o con exploración neurológica patológica tras observación de, al menos, 6 horas, prolongar dicha observación o valorar ingreso.
• En niños menores de 3 meses con TCE leve y factores de riesgo, se aconseja realizar TC y prolongar la observación, al menos, 24 horas(3).
• En TCE leves con factores de riesgo de LIC, en los que se realiza TC y se objetiva LIC, ya hablaríamos de TCE moderado, que requiere ingreso para monitorización neurológica (salvo fractura lineal como único hallazgo y paciente asintomático tras 4-6 horas de observación, donde se podría valorar el alta)(18).
Tratamiento del TCE grave
El tratamiento del TCE grave es secuencial, con medidas generales y neuroprotectoras, medidas de primer y de segundo nivel, muchas de las cuales se pueden y se deben iniciar a nivel prehospitalario.
El tratamiento del TCE grave en niños se basa en las recomendaciones de las guías de la Brain Trauma Foundation, cuya tercera edición se publicó en 2019(1-2). El tratamiento es secuencial, con: unas medidas generales y neuroprotectoras: unas medidas de primer nivel, que se van utilizando en función de la clínica y de la PIC, en caso de que esté monitorizada; y otras de segundo nivel, que se aplican si no hay respuesta a todo lo anterior. Aunque se aconseja el tratamiento guiado por la PIC, no hay evidencia de que tenga mejores resultados que guiado solo por clínica y neuroimagen. Disponemos de protocolos de actuación para el manejo del TCE grave con y sin monitorización de PIC de adultos, pero que se pueden adaptar a Pediatría(19-20). Se resume ahora el tratamiento del TCE grave, ya que la mayoría de las medidas iniciales y algunas de primer nivel se pueden y se deben aplicar en cualquier entorno, desde el primer momento tras el trauma.
Medidas generales y neuroprotectoras en TCE grave
• Posición adecuada del paciente. Cabeza en posición centrada y elevada 20-30º, para favorecer el drenaje venoso de la cabeza. Elevación contraindicada en caso de shock o lesión cervical (aquí utilizar posición anti-Trendelenburg).
• Evitar la hipoxia, hipocapnia o hipercapnia. Intubación con pauta rápida (posibles opciones: etomidato 0,3 mg/kg i.v. + rocuronio 1 mg/kg i.v.; fentanilo 1 mcg/kg i.v. + ketamina 2 mg/kg i.v. + rocuronio 1 mg/kg i.v.). Ventilación mecánica protectora (volumen 6-8 mL/kg, PEEP inicial 5 cmH2O y titular hasta 10 cmH2O, si hipoxemia con FiO2 100 %). Mantener PaO2 entre 90-100 mmHg (sin monitorización, SatO2 94-98 %). Mantener PaCO2 en torno a 35-40 mmHg (sin monitorización, frecuencia respiratoria en respirador adecuado para la edad). Evitar anemia, Hb mínima: 7-9 g/dL.
• Mantener volemia y la PAM. Volumen con soluciones isotónicas (SSF o soluciones balanceadas y hemoderivados secuencialmente). Si precisa inotrópicos, valorar noradrenalina o dopamina en función del tipo de shock.
• Sedación y analgesia adecuadas [RASS -5 (RASS: Escala de Agitación y Sedación de Richmond)]. Analgesia con: cloruro mórfico 5-40 mcg/kg/h, fentanilo 1-2 mcg/kg/h o remifentanilo 0,1-1 mcg/kg/min. Sedación con midazolam 0,1-0,2 mg/kg/h. Utilizar bolos suplementarios previos a manipulaciones a dosis mínimas efectivas, para evitar hipotensión (fentanilo, aunque también midazolam, puede dar hipotensión y disminuir la PPC).
• Control de temperatura. Tratamiento agresivo de la fiebre. Evitar hipotermia. Si escalofríos o temblores, valorar relajación muscular (con relajación solo podremos valorar cambios neurológicos con el estado de las pupilas y constantes vitales).
• Control de crisis comiciales. Tratamiento con midazolam 0,1 mg/kg i.v. Valorar tratamiento profiláctico en caso de TCE grave, y siempre que se utilice relajación muscular. Levetiracetam, dosis de choque 50 mg/kg i.v. en 15 minutos, mantenimiento posterior 50-60 mg/kg/día cada 12 h; o fenitoína, dosis de choque 20 mg/kg i.v. en 20 minutos, mantenimiento posterior 5-7 mg/kg/día cada 12 h.
• Control de la glucemia. Mantener entre 80-200 mg/dL. Si hiperglucemia, perfusión continua de insulina 0,02-0,1 UI/kg/h.
• Control de alteraciones electrolíticas y metabólicas. Mantener leve hiperosmolaridad sérica y sodio entre 145-155 mEq/L.
• Corticoides. Contraindicados, aumenta la mortalidad.
• Nutrición precoz tras estabilización.
• En niños, no hay evidencia suficiente de que el ácido tranexámico, en las primeras 2-3 horas tras el trauma, mejore el pronóstico (en adultos podría reducir la mortalidad en pacientes con TCE leve o moderado), pero hay guías como las NICE (National Institute for Health and Care Excellence)(18) que lo recomiendan en niños con TCE moderado o grave en las primeras 2 horas: si no hemorragia extracraneal, bolo 15-30 mg/kg i.v. en 10 minutos; si hemorragia extracraneal, bolo igual seguido de perfusión 2 mg/kg/hora, al menos, 8 horas.
Medidas de primer nivel en TCE grave
Si la PIC es mayor de 20 mmHg durante más de 5 minutos a pesar de las medidas anteriores, pasaremos a una serie de actuaciones llamadas de primer nivel:
• Drenaje ventricular. Si el paciente lo tiene tras cirugía, drenaje controlado de LCR en función de la PIC.
• Terapia hiperosmolar. Única terapia en las guías con nivel de evidencia II.
– Salino hipertónico 3 % (90 mL de SSF + 10 mL de ClNa 20 %): 2-5 mL/kg i.v. en 10 min cada 2-4 horas, o perfusión 0,1-1 mL/kg/h en dosis ascendente hasta conseguir PIC < 20 mmHg. Efecto osmótico reduciendo la PIC y aumentando la PPC, con poco efecto diurético, por lo que el volumen intravascular se mantiene. Intentar no superar natremia de 160-170 mEq/L más de 72 horas.
– Manitol 0,25-0,5 g/kg i.v. en 10 min. No se aconseja en las últimas guías (utilizar si no se dispone de salino hipertónico). Diurético osmótico, asumiendo que la barrera hematoencefálica está intacta. Reduce la PIC, pero no aumenta la PPC. Produce un exceso de diuresis que puede dar hipovolemia e hipotensión.
• Relajación muscular. Siempre optimizar sedoanalgesia previamente. Rocuronio 0,5-1 mg/kg/h para reducir la presión intratorácica y disminuir las demandas metabólicas.
• Hiperventilación moderada. PaCO2 30-35 mmHg, como última opción. Contraindicado si lesiones isquémicas.
Medidas de segundo nivel en TCE grave
• Coma barbitúrico.
• Hipotermia moderada 32-35ºC (sin evidencia).
• Craniectomía descompresiva.
Función del Pediatra de Atención Primaria
Además del seguimiento posterior del niño que ha sufrido un TCE y tiene o no secuelas, es importante recordar que, en muchas ocasiones, hasta en el 25 % de los casos(17), los familiares o testigos del traumatismo acuden con el niño en primer lugar a un centro no hospitalario por cercanía, sin esperar a que sea atendido in situ por un equipo de emergencias. O que cualquiera de nosotros puede ser testigo de un accidente, ya sea en ciudad o en carretera. Por ello, cualquier pediatra debe estar preparado para atender inicialmente a un niño con TCE de cualquier gravedad y, de este modo, ser capaz de comenzar las medidas terapéuticas más adecuadas, y con ello mejorar el pronóstico.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.*** Kochanek PM, Tasker RC, Carney N, Totten AM, Adelson PD, Seldon NR, et al. Guidelines for the Management of Pediatric Severe Traumatic Brain Injury, Third edition: Update of the Brain Trauma Foundation Guidelines. Pediatr Crit Care Med. 2019; 20: S1-S82.
2.*** Kochanek PM, Tasker RC, Bell MJ, Adelson PD, Carney N, Vavilala MS, et al. Management of Pediatric severe Traumatic Brain Injury: 2019 Consensus and Guidelines-Based Algorithm for First and Second Tier Therapies. Pediatr Crit Care Med. 2019; 20: 269-79.
3.*** Kuppermann N, Holmes JF, Dayan PS, Hoyle JD, Atabaki SM, Holubkov R, et al. Identification of children at very low risk of clinically-important brain injuries after head trauma: a prospective cohort study. Lancet. 2009; 374: 1160-70.
4. Lumba-Brown A, Yeates KO, Sarmiento K, Breiding MJ, Haegerich TM, Gioia GA, et al. Centers for Disease Control and Prevention Guideline on the Diagnosis and Management of Mild Traumatic Brain Injury Among Children. JAMA Pediatr. 2018; 172: e182853.
5. Hernández Rastrollo R. Traumatismos craneoencefálicos. Pediatr Integral. 2019; XXIII: 6-14. Disponible en: https://www.pediatriaintegral.es/publicacion-2019-01/traumatismos-craneoencefalicos-2/.
6. Taylor CA, Bell JM, Breiding MJ, Xu L. Traumatic brain injury-related emergency department visits, hospitalizations, and deaths-United States, 2007 and 2013. MMWR Surveill Summ. 2017; 66: 1-16.
7. Global, regional, and national burden of traumatic brain injury and spinal cord injury, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet Neurol. 2019; 18:56-87.
8. Raith EP, Reddy U. Critical care management of adult traumatic brain injury. Anaesth Intensive Care Med. 2023; 24: 333-9.
9. Carter EL. Applied cerebral physiology. Anaesth Intensive Care Med. 2022; 23: 797-801.
10. Bussolin L, Falconi M, Leo MC, Parri N, DE Masi S, Rosati A, et al. The management of pediatric severe traumatic brain injury: Italian Guidelines. Minerva Anestesiol. 2021; 87: 567-79.
11. González Balenciaga M. Traumatismo craneal. Protocolos diagnósticos y terapéuticos en urgencias de Pediatría (SEUP), 3ª ed. 2019. Disponible en: https://seup.org/protocolos/.
12. Quayle KS, Powell EC, Mahajan P, Hoyle JD Jr, Nadel FM, Badawy MK, et al. Epidemiology of blunt head trauma in children in U.S. emergency departments. N Engl J Med. 2014; 371: 1945-7.
13. Goubran D, Batoo D, Linton J, Shankar J. Inicial CT imaging predicts mortality in severe traumatic brain injuries in pediatric population-A systematic review and meta-analysis. Tomography. 2023; 9: 541-51.
14. Babl FE, Borland ML, Phillips N, Kochar A, Dalton S, McCaskill M, et al. Accuracy of PECARN, CATCH, and CHALICE head injury decision rules in children: a prospective cohort study. Lancet. 2017; 389: 2393-402.
15. Figaji A. An update on pediatric traumatic brain injury. Childs Nerv Syst. 2023; 39: 3071-81.
16. Da Dalt L, Parri N, Amigoni A, Nocerino A, Selmin F, Manara R, et al. Italian guidelines on the assessment and management of pediatric head injury in the emergency department. Ital J Pediatr. 2018; 44: 7. Disponible en: https://doi.org/10.1186/s13052-017-0442-0.
17.** Bubb L, Masters J. Trauma and burns in children. Anaesth Intensive Care Med. 2023; 24: 674-83.
18.** Head Injury: assessment and early management. NICE guidelines. 2023. Disponible en: https://www.nice.org.uk/guidance/ng232.
19. Hawryluk GWJ, Aguilera S, Buki A, Bulger E, Citerio G, Cooper DJ, et al. A management algorithm for patients with intracranial pressure monitoring: the Seattle International Severe Traumatic Brain Injury Consensus Conference (SIBICC). Intensive Care Med. 2019; 45: 1783-94.
20. Chesnut RM, Temkin N, Videtta W, Petroni G, Luján S, Pridgeon J, et al. Consensus-based management protocol (CREVICE Protocol) for the treatment of severe traumatic brain injury based on imaging and clinical examination for use when intracranial pressure monitoring is not employed. J Neurotrauma. 2020; 37: 1291-9.
Bibliografía recomendada
– Kochanek PM, Tasker RC, Carney N, Totten AM, Adelson PD, Seldon NR, et al. Guidelines for the Management of Pediatric Severe Traumatic Brain Injury, Third edition: Update of the Brain Trauma Foundation Guidelines. Pediatr Crit Care Med. 2019; 20: S1-S82.
Tercera edición de las guías de la Brain Trauma Foundation sobre el manejo del traumatismo craneoencefálico grave en niños, actualizando la evidencia científica disponible. Imprescindibles para el manejo correcto de dichos pacientes.
– Kochanek PM, Tasker RC, Bell MJ, Adelson PD, Carney N, Vavilala MS, et al. Management of Pediatric severe Traumatic Brain Injury: 2019 Consensus and Guidelines-Based Algorithm for First and Second Tier Therapies. Pediatr Crit Care Med. 2019; 20: 269-79.
Novedad en la tercera edición de las guías de la Brain Trauma Fondation sobre el traumatismo craneoencefálico grave en niños, se proponen unos algoritmos de actuación basados en dichas guías.
– Kuppermann N, Holmes JF, Dayan PS, Hoyle JD, Atabaki SM, Holubkov R, et al. Identification of children at very low risk of clinically-important brain injuries after head trauma: a prospective cohort study. Lancet. 2009; 374: 1160-70.
Estudio prospectivo con niños con TCE leve, en el que se determinan los criterios de riesgo para tener una lesión intracerebral (criterios PECARN), y según estén presentes o no, solicitar una TC o mantener en observación.
– Bubb L, Masters J. Trauma and burns in children. Anaesth Intensive Care Med. 2023; 24: 674-83.
Buena actualización sobre el manejo inicial del politraumatismo pediátrico, recordando las actuaciones durante la evaluación primaria y secundaria para estabilizar al niño politraumatizado.
| Caso clínico |
|
Usted trabaja en un Centro de Salud de una zona rural, donde acuden unos padres con su hijo de 10 años, porque estaba escalando un árbol y se ha caído desde unos 2 metros de altura. Estaba con un amigo que les ha avisado y les ha contado que, al caerse, Pablo no le contestaba y que hizo unos movimientos raros durante un rato. Cuando llegan los padres al lugar, Pablo está confuso y no se acuerda de lo que ha pasado, por lo que le montan en coche y le acercan al Centro de Salud. Cuando llega, han pasado unos 20 minutos desde la caída. El niño tiene una herida parietal derecha y parece que el hueso de alrededor crepita. Está confuso, no sabe qué le ha pasado y refiere cefalea. A la exploración, no le parece encontrar ningún dato de focalidad neurológica, con unas pupilas iguales y reactivas. Al hacer la escala de Glasgow, el resultado es 14 (O4, M6, V4).
|

 Acute abdomen
Acute abdomen 