 |
| Temas de FC |
E. Dorado Ceballos, M. Susanna Calero
Unidad de Alergia, Inmunología y Neumología Pediátrica. Parc Taulí Hospital Universitari de Sabadell. Barcelona
| Resumen
La alergia a proteína de leche de vaca (APLV) es la alergia alimentaria más frecuente en el menor de 2 años. Está mediada por mecanismos inmunológicos (mediados y no mediados por IgE). La clínica más frecuente en la APLV IgE mediada es la cutáneo-mucosa, aunque también pueden estar implicados el aparato digestivo y respiratorio; la forma más grave es la anafilaxia. En la APLV no IgE mediada, la clínica más habitual es la digestiva (proctocolitis, enterocolitis y enteropatía). El diagnóstico de la APLV IgE mediada se basa en una anamnesis y exploración física detalladas. El estudio incluye la realización del prick test y/o IgE específica sérica. Es preciso mostrar causalidad. El patrón oro es la prueba de provocación oral. Para el diagnóstico de la APLV no IgE mediada, las únicas herramientas necesarias son la anamnesis detallada y la respuesta a la prueba de exclusión-provocación. El tratamiento consiste en la dieta de evitación de las proteínas de leche de vaca. Para ello, se emplea: la lactancia materna, las fórmulas extensamente hidrolizadas, las fórmulas elementales o fórmulas adaptadas de arroz o soja. Una opción de tratamiento más proactiva es la inmunoterapia oral, indicada en aquellos pacientes que no consigan la tolerancia espontánea. |
| Abstract
Cow’s milk allergy (CMA) is the most common food allergy up to 2 years of age. It is mediated by immunological mechanisms (mediated or not mediated by IgE). Skin is the most frequent organ involved in IgE-mediated CMA, although patients may show digestive and/or respiratory manifestations. Anaphylaxis is the most severe manifestation. In non-IgE-mediated CMA, digestive symptoms are the most common (proctocolitis, enterocolitis, enteropathy). The diagnosis of IgE-mediated CMA is based on a careful history and physical examination. It also includes the performance of prick test and/or serum specific IgE. It is necessary to demonstrate causality. The oral challenge test is the gold standard. An allergy-focused clinical history and elimination-food challenge tests are the only tools available to diagnose non-IgE-mediated CMA. The treatment consists of dietary avoidance of cow’s milk proteins. For this, breastfeeding and alternative formulas as extensively hydrolyzed formulas, elemental formulas, or formulas adapted from rice or soy are recommended. A more proactive treatment option is oral immunotherapy, indicated in those patients who do not achieve spontaneous tolerance. |
Palabras clave: Alergia alimentaria; Alergia a proteína de leche de vaca IgE mediada; Alergia a proteína de leche de vaca no IgE mediada; Inmunoterapia oral.
Key words: Food allergy; IgE-mediated cow’s milk allergy; Non-IgE-mediated cow’s milk allergy; Oral immunotherapy.
Pediatr Integral 2023; XXVII (2): 81 – 90
OBJETIVOS
• Diferenciar la alergia a proteína de leche de vaca de otras reacciones adversas a la leche.
• Saber identificar las manifestaciones clínicas de la alergia a proteína de leche de vaca.
• Comprender la patogenia de la alergia a proteína de leche de vaca.
• Saber cómo se realiza el diagnóstico de la alergia a proteína de leche de vaca.
• Entender el tratamiento actual de la alergia a proteína de leche de vaca.
Alergia e intolerancia a la proteína de leche de vaca
Introducción
La alergia alimentaria es una reacción de hipersensibilidad a un alimento, mediada por mecanismos inmunológicos. La prevalencia ha aumentado en los países occidentales, afectando hasta un 10 % de la población.
En 2001, la Academia Europea de Alergología e Inmunología Clínica (EAACI) publica una nueva clasificación y denomina “reacción de hipersensibilidad” a la presencia de signos o síntomas objetivos y reproducibles, iniciados con la exposición a un estímulo debido a una dosis tolerada habitualmente por los individuos. En concordancia, la EAACI propone que la reacción adversa a alimentos se denomine “hipersensibilidad a alimentos”(1).
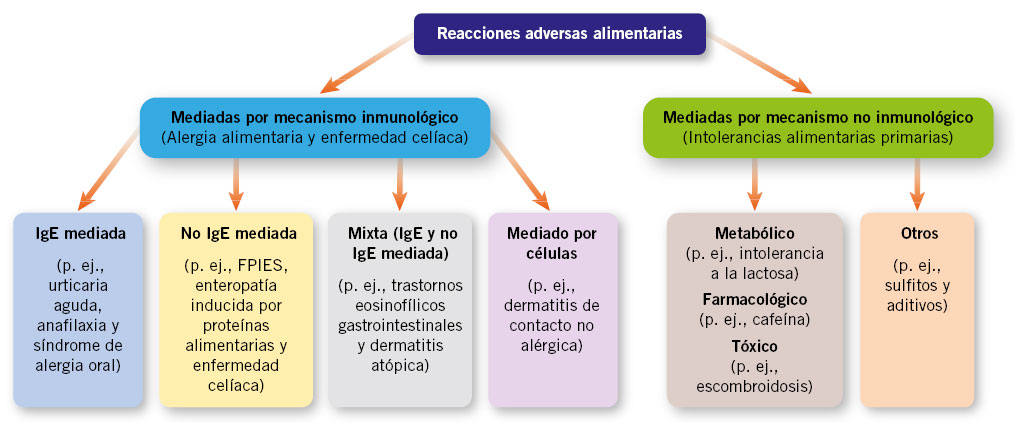
Las reacciones adversas alimentarias se clasifican en mediadas por mecanismo inmunológico y no inmunológico (Fig. 1).
Figura 1. Clasificación de las reacciones adversas alimentarias. Abreviaturas: FPIES (Síndrome de enterocolitis inducida por proteínas alimentarias), IgE (Inmunoglobulina E). Adaptada de: Anvari et al., 2019 con modificaciones(8).
La alergia a alimentos es una reacción de hipersensibilidad a un antígeno alimentario específico, habitualmente inofensivo para la población sana, que está mediada por mecanismos inmunológicos y surge en un individuo susceptible. La hipersensibilidad a alimentos no alérgica (intolerancia alimentaria) es una reacción adversa mediada por mecanismos no inmunológicos (tóxico, farmacológico, metabólico o idiopático)(2,3).
En el pasado, las alergias e intolerancias se confundían entre sí, debido a su similitud clínica. Además, el mismo alimento suele ser el responsable de estos dos tipos de reacciones, lo que dificulta el diagnóstico.
La alergia alimentaria es muy común en todo el mundo y se está convirtiendo en un importante problema de salud pública. La prevalencia ha aumentado significativamente en las últimas dos décadas en los países occidentales, afectando hasta un 10 % de la población(4). Es más común en niños (8 %) que en adultos (10 %)(3).
En nuestro medio y durante la edad pediátrica, los alimentos implicados en la alergia alimentaria, en orden de frecuencia son: las proteínas de huevo (39,1 %) y leche (32,3 %), seguidas del pescado (11,3 %), los frutos secos (18,8 %) y las frutas (12 %)(5).
La tolerancia es la respuesta inmunitaria normal a la ingesta de alimentos; sin embargo, no se conoce por qué, en algunas personas, se produce un cambio en esta respuesta, apareciendo la reacción de hipersensibilidad. Se conocen una serie de factores que pueden estar implicados en la aparición de alergia alimentaria, con interacción entre factores genéticos y ambientales: sexo varón, raza (asiática o negra), predisposición hereditaria (asociación familiar, HLA, genes específicos), dermatitis atópica, déficit de vitamina D, bajo consumo de ácidos grasos omega-3 poliinsaturados, consumo reducido de antioxidantes, obesidad y aumento de higiene(6).
Hay una serie de factores relacionados con el individuo y con el antígeno que pueden facilitar la tolerancia o la sensibilización(7-8):
• Dosis de antígeno. Bajas dosis inducen la producción de células T reguladoras que promueven la tolerancia vía mecanismo de supresión; este mecanismo también interviene ante alta dosis de antígeno.
• Forma de antígeno. El alimento sólido sensibiliza más que el soluble; la comida procesada o sometida a unas determinadas condiciones de temperatura también puede incrementar una respuesta de tipo Th2.
• Edad de exposición. La introducción precoz en cantidades adecuadas de un alimento suele inducir tolerancia.
• Vía de entrada. La exposición extraintestinal, como la vía cutánea, tiende a aumentar la sensibilización.
• Edad. La sensibilización a alimentos es más frecuente en la edad pediátrica, quizá por una maduración retrasada de los mecanismos protectores intestinales.
• Factores genéticos. Hay susceptibilidad genética que facilita el desarrollo de alergia alimentaria.
• Microbiota. El ambiente microbiano en el intestino puede facilitar la respuesta de tolerancia; Lactococcus y Citrobacter pueden encontrarse en menor cantidad en pacientes con alergia alimentaria(3). Hay mayor riesgo de alergia alimentaria en el recién nacido si el parto es por cesárea.
• Exposiciones que afectan el medio ambiente intestinal. Lactancia materna (favorece la tolerancia), tratamiento con fármacos antiácidos (favorece la sensibilización) y uso de inhibidores de la Cox-2 (favorece la pérdida de tolerancia en estudios experimentales).
En ocasiones, para que suceda una reacción alérgica, es necesaria la presencia de cofactores, como pueden ser: ejercicio físico, infecciones víricas, fiebre, antiinflamatorios no esteroideos, estrés, deprivación de sueño, alcohol y menstruación. Para que suceda la reacción alérgica, es preciso que el individuo sea alérgico a un alimento y que lo ingiera junto con la presencia del cofactor(5).
Alergia a proteína de leche de vaca
En los últimos 5 años, desde la última revisión publicada en esta revista(9), se han publicado nuevos documentos acerca de alergia a proteínas de leche de vaca IgE y no IgE mediada, de consenso entre las diferentes sociedades científicas de ámbito nacional (SEICAP, SEGHNP, AEPap, SEPEAP)(5,10-12) y europeo (EAACI)(13).
La leche de vaca (Bos domesticus) es un alimento consumido en grandes cantidades en todos los grupos de edad, en forma líquida o procesada, cruda y cocinada. Las proteínas de leche de vaca son el primer antígeno no homólogo que el niño ingiere en cantidades importantes(10). La leche de vaca y los productos lácteos son la principal fuente de proteínas, calorías y calcio en la dieta de los niños menores de 2 años. Con lo cual, su eliminación en la dieta plantea un riesgo de deficiencias nutricionales(13).
La alergia a proteína de leche de vaca (APLV) está mediada por mecanismos inmunológicos, que pueden ser mediados y no mediados por IgE. Debe existir una relación directa entre la ingestión de las proteínas de leche de vaca y la aparición de los síntomas. Es importante diferenciar la alergia a proteína de leche de vaca de otras reacciones adversas a la leche, como la intolerancia a la lactosa(10).
Epidemiología
La APLV aparece en los primeros meses de vida y es la alergia alimentaria más frecuente en el lactante y el niño pequeño.
La APLV suele iniciarse durante el primer año de vida. Afecta a un 2 % de los niños menores de 4 años y constituye la alergia alimentaria más frecuente en el lactante y el niño pequeño(10).
Patogenia
La sensibilización más frecuente es a la caseína (proteína termoestable). La leche de vaca tiene reactividad cruzada con la leche de otros mamíferos.
La leche de vaca (LV) contiene aproximadamente 30 a 35 g de proteínas por litro, con más de 40 proteínas diferentes. Todas son alérgenos potenciales y la mayoría de los pacientes están sensibilizados a varias de ellas(10,13).
Las proteínas se segregan en 2 fracciones: el coágulo que contiene aproximadamente el 80 % de las proteínas (caseínas) y el suero que contiene aproximadamente el 20 % de las proteínas (seroproteínas o proteínas lactoséricas). Las características de los alérgenos principales presentes en la LV se detallan en la tabla I.
Las caseínas, la beta-lactoglobulina y la alfa-lactoalbúmina son considerados alérgenos mayores (más del 50 % de las personas con APLV están sensibilizadas a estas proteínas)(13).
Las seroproteínas, especialmente la beta-lactoglobulina, son termosensibles y la cocción modifica su alergenicidad. Esto explica la mejor tolerancia de la leche procesada a altas temperaturas, como los horneados(14), o sometida a procesos de fermentación y acidificación que disminuyen la cantidad de seroproteína intacta(15).
Es importante recordar que la LV tiene una elevada reactividad cruzada (>90 %) con la leche de cabra y oveja. Por el contrario, la reactividad cruzada es muy baja (<5 %) con la leche de burra, yegua, búfala o camella(13).
Clínica
La clínica más frecuente en la APLV IgE mediada es la cutánea y la más grave es la anafilaxia; la más frecuente en la APLV no IgE mediada es la clínica digestiva.
APLV IgE mediada
En la APLV IgE mediada, el inicio de los síntomas suele ser durante el primer año de vida, coincidiendo con la introducción de fórmula adaptada en su alimentación, tras un periodo de lactancia materna. En el 60 % de las ocasiones, aparecen los síntomas tras la primera toma y, rara vez, se inician después de la semana de introducir la fórmula adaptada(7).
La clínica se inicia tras la ingesta del alimento y, con menor frecuencia, tras el contacto cutáneo, directo o indirecto (caricias o besos de alguien que ha manipulado LV). Raramente, y solo si existe una ingesta elevada de LV en la dieta de la madre, el inicio de síntomas puede darse durante la lactancia materna exclusiva, debido a la presencia de proteínas de LV en la leche materna(7).
La APLV IgE mediada se manifiesta con reacciones de hipersensibilidad tipo I: la clínica aparece de forma inmediata, desde el momento de la ingesta hasta dos horas tras la toma de LV. Las manifestaciones clínicas son: clínica cutánea (70-75 %), digestiva (13-34 %), respiratoria (1-8 %), afectación de más de un órgano (26 %) y anafilaxia grave (1-4 %)(7,9).
• Clínica cutánea. Son las manifestaciones más frecuentes. Incluye eritema con o sin urticaria aguda o angioedema; estas manifestaciones leves pueden preceder a otras de mayor intensidad.
• Clínica digestiva. Se puede presentar como rechazo del biberón, junto con llanto e irritabilidad, sin otras manifestaciones de enfermedad. También, con síndrome de alergia oral (edema en labios, prurito oral, edema en lengua, molestias a la deglución). A nivel del estómago y del intestino delgado, se traduce en: náuseas, vómitos más o menos profusos y dolor abdominal de tipo cólico. En intestino grueso: dolor abdominal, diarrea y, ocasionalmente, heces con sangre. El 50 % de los niños con síndrome de intestino corto presentan APLV.
• Clínica respiratoria (rinoconjuntivitis aguda, broncoespasmo, edema de glotis). No suelen presentarse aislados, sino acompañando a otras manifestaciones sistémicas. La rinoconjuntivitis aguda es frecuente durante la prueba de provocación.
• Anafilaxia. Es la manifestación más grave de APLV. Asocia inicio rápido de síntomas cutáneos (urticaria local o generalizada, angioedema), digestivos (síndrome de alergia oral, dolor abdominal, vómitos o diarrea), respiratorios (en el 80 % de los casos: disnea, broncoespasmo, estridor, hipoxemia), cardiovasculares (en el 20 % de las reacciones: hipotensión, síncope, shock) y neurológicos (temblores, confusión, convulsiones y síncope); en un lactante puede pasar más desapercibida y presentar palidez e hipotonía.
APLV no IgE mediada
La APLV no IgE mediada es generalmente debida a reacciones de inmunidad celular (hipersensibilidad tipo IV); aunque, en la mayoría de los casos, no pueda demostrarse la implicación de un mecanismo inmunológico. Aproximadamente, hasta un 60 % de los casos de APLV estarían producidos por mecanismos no mediados por IgE(11,12).
El inicio de los síntomas suele ser retardado, tras 2 horas o incluso días después de la ingesta del alérgeno. Los cuadros más habituales son digestivos y, aunque existen entidades bien definidas como la enterocolitis inducida por proteínas alimentarias (FPIES), la proctocolitis alérgica o las enteropatías, en muchos casos se presentan como cuadros más inespecíficos que afectan a lactantes en las primeras semanas de vida (reflujo gastroesofágico [RGE], cólico y estreñimiento característicamente no respondedores a medidas o tratamientos habituales)(11,12).
• Proctocolitis alérgica: se presenta típicamente en neonatos y lactantes de 2-8 semanas de vida. La clínica habitual consiste en sangrado rectal que, con frecuencia, se asocia a deposiciones blandas con mucosidad acompañante. No existe afectación del estado general del niño, ni estancamiento o pérdida ponderal.
• Enterocolitis por proteínas de leche de vaca (FPIES): se desarrolla antes de los 9 meses. El cuadro clínico típico es la forma aguda, y consiste en vómitos profusos que suelen acompañarse de palidez y letargia, y que aparecen de forma retardada a la ingesta de fórmula artificial (habitualmente unas 2 horas después). En los casos más graves puede causar deshidratación o incluso shock hipovolémico. Algunos pacientes presentan diarrea acuosa de inicio en las 5-10 horas siguientes a la ingesta y que habitualmente se resuelve en un plazo de 24 horas. Los casos de FPIES en bebés alimentados con lactancia materna son anecdóticos (no llegan al 5 % del total), por lo que esta parece tener un papel protector.
• Enteropatía por proteínas de leche de vaca: afecta en su mayoría a lactantes menores de un año. Se presenta como un cuadro de diarrea crónica profusa que aparece semanas después de la introducción de la LV. Más de la mitad de los casos presentan estancamiento ponderal, distensión abdominal y malabsorción intestinal.
Otras manifestaciones clínicas:
• Dermatitis atópica: la APLV se asocia con frecuencia a la dermatitis atópica, un problema muy común en los primeros meses de vida que se manifiesta en brotes que pueden parecer que empeoran o coinciden con la ingesta de las proteínas de la LV. Esto puede llegar a confundir sobre cuál es el origen del cuadro clínico. En estos casos, si la dermatitis atópica es la única manifestación clínica, se puede realizar una dieta de eliminación durante 2-3 semanas, seguida de una prueba de exposición controlada, para confirmar que la leche de vaca es la causa del problema, antes de excluir este alimento de la dieta(7).
• Síndrome de Heiner: hemorragia alveolar difusa inducida por proteínas de LV. Es una enfermedad poco frecuente, con infiltrados pulmonares recurrentes asociados con tos crónica, fiebre recurrente, taquipnea, sibilancias y pérdida de peso. En la radiografía de tórax hay infiltrado parcheado, con atelectasias, condensación y adenopatías hiliares y, en la analítica, se encuentran precipitinas a proteínas de leche de vaca(9).
Diagnóstico
Para el diagnóstico de APLV es esencial una anamnesis y una exploración física detalladas. Las pruebas complementarias (prick test y/o IgE específica) están orientadas a demostrar el mecanismo inmunológico IgE mediado. Se confirma mediante la prueba de provocación oral.
APLV IgE mediada
Anamnesis
Para el diagnóstico clínico es esencial elaborar una anamnesis detallada, en especial del episodio que ha sugerido APLV: la edad al comienzo de los síntomas, el tiempo transcurrido entre la ingesta de leche y la aparición de los síntomas, la clínica y si han existido cofactores (fiebre, infecciones en el caso de los lactantes)(10).
Es importante recoger datos acerca de los antecedentes personales o familiares de atopia (asma, rinitis, conjuntivitis, alergia a alimentos o fármacos) y el tipo de alimentación recibida (lactancia materna o artificial, presencia de biberones esporádicos)(10).
La anamnesis debe completarse con una exploración física detallada y, si existen síntomas digestivos, búsqueda de signos de malabsorción o malnutrición.
Pruebas complementarias
Orientadas a mostrar el mecanismo inmunológico IgE mediado. Una prueba cutánea o sérica positiva a leche solo indica sensibilización, debe existir causalidad para poder indicar que el niño es alérgico. Los tipos de pruebas a realizar son:
• Pruebas cutáneas intraepidérmicas o prick test (prueba in vivo): pueden realizarse con extractos estandarizados de la proteína y sus fracciones proteicas o con el alimento en fresco o procesado. La sensibilidad de las pruebas cutáneas muestra una gran variabilidad (41-100 %), debido a la variabilidad en la edad y el tipo de clínica de los distintos estudios. Si se utiliza leche entera y sus principales proteínas para efectuar las pruebas cutáneas tienen un valor predictivo negativo (VPN) del 97 %(10).
En pacientes con dermografismo o dermatitis atópica a los cuales no es posible efectuar pruebas cutáneas, es imprescindible realizar la determinación de IgE específica para su diagnóstico.
• Determinación de IgE específica frente a proteínas de leche de vaca, completa y sus fracciones proteicas (prueba in vitro): se realiza en el laboratorio, habitualmente mediante técnicas de CAP system o inmuno-CAP-ISAC.
Se han establecido puntos de corte de IgE específica a leche que orientan la probabilidad de tener una prueba de provocación positiva. Valores superiores a 2,5 KUI/l de IgE específica tienen un valor predictivo positivo de un 90 %, por lo que podría obviarse la prueba de provocación. También el valor de la IgE específica a leche y sus fracciones proteicas son de utilidad para el seguimiento de niños diagnosticados de APLV. El diagnóstico molecular o por componentes permite prever factores de persistencia o gravedad de la APLV, por lo que nos ayuda a orientar mejor el pronóstico y el tratamiento(10).
La rentabilidad clínica de la determinación de IgE específica sérica en el diagnóstico de la alergia inmediata a proteínas de leche de vaca es similar a la de las pruebas cutáneas.
• Prueba de provocación oral o prueba de exposición controlada: el patrón oro, de referencia para confirmar la existencia de APLV, es la provocación doble ciego controlada con placebo; sin embargo, en Pediatría suelen hacerse pruebas de provocación abiertas o con el alimento enmascarado. La prueba de provocación debe efectuarse siempre en medio hospitalario, preparado con recursos materiales y personal entrenado para tratar una anafilaxia grave y realizar una reanimación avanzada. Debe efectuarse un registro detallado de la cantidad administrada, la hora de administración y las incidencias que ocurran en el periodo de observación. La positividad de la prueba de provocación suele ser inmediata, pero se recomienda un control tras unos días de estar ingiriendo proteínas de leche de vaca, especialmente si ha estado un tiempo prolongado con dieta de exclusión(10).
En el algoritmo 1 al final del artículo, se puede visualizar el diagnóstico de APLV IgE mediada.
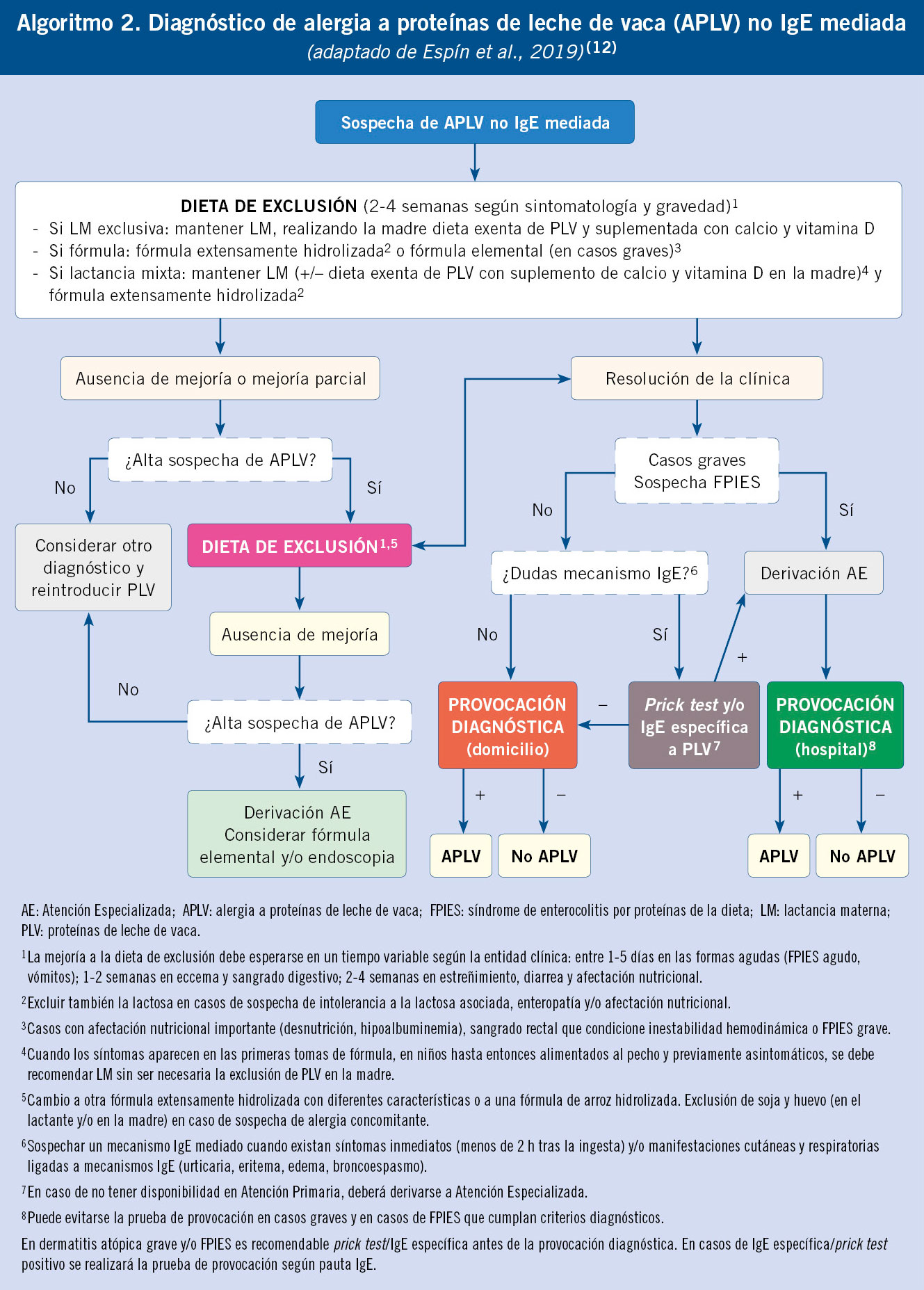
APLV IgE no mediada
Las pruebas cutáneas con extractos y la determinación de IgE específica son característicamente negativas, por lo que no se recomienda su realización para el diagnóstico de estas entidades, siendo la historia clínica detallada y la respuesta a la prueba de exclusión-provocación de las proteínas sospechosas (retirada de estas y reintroducción posterior), las únicas herramientas necesarias para su diagnóstico. La primera sirve de base para sospechar estas patologías, mientras que la segunda es obligatoria para establecer el diagnóstico de certeza(12).
Respecto a la endoscopia, no está indicada su realización para efectuar el diagnóstico de alergia alimentaria no mediada por IgE. Solo debe valorarse su indicación cuando existan dudas en el diagnóstico, para descartar la presencia de otra patología asociada en pacientes con sintomatología crónica que no responden a la dieta de exclusión y en casos en los que se sospeche la existencia de un trastorno eosinofílico primario, quedando la indicación a criterio del gastroenterólogo(12).
En el algoritmo 2 al final del artículo, se puede visualizar el diagnóstico de APLV IgE no mediada.
Historia natural y pronóstico
La APLV suele tener buen pronóstico, con la adquisición de tolerancia espontánea hasta un 90 % de los casos a los 6 años.
La APLV tiene buen pronóstico. Alrededor de un 40 % de los niños adquieren tolerancia espontánea al año de vida, el 70 % a los 2 años y hasta el 90 % a los 6 años. Un pequeño grupo de pacientes no adquiere tolerancia espontánea, siendo además el grupo con mayor riesgo de sufrir reacciones más graves. Son factores de mal pronóstico: la persistencia de clínica a los 5 años de edad, inicio antes del mes de vida, presencia de síntomas con cantidades pequeñas de leche (<10 ml), tener una IgE específica a caseína elevada de forma persistente, no tolerar leche en formato horneado y presentar otras patologías alérgicas (otra alergia alimentaria, asma o rinoconjuntivitis alérgica)(7,9,10,12,13).
Tratamiento
La dieta de exclusión de la PLV sigue siendo un pilar fundamental del tratamiento. Actualmente, los tratamientos de inducción de tolerancia oral con ITO (inmunoterapia oral con alimentos) son una realidad en la práctica clínica habitual de centros de referencia y representan una opción de tratamiento activo adecuada para pacientes seleccionados.
El único tratamiento hasta hace una década era la dieta de exclusión de la PLV y sigue siendo un pilar fundamental. Es de vital importancia explicar bien al paciente, las familias y cuidadores, que la dieta debe ser estricta. La PLV se encuentra frecuentemente como alérgeno oculto en otros alimentos y que, por tanto, se debe prestar especial atención al etiquetado de productos envasados y posibles contaminaciones(12). La dieta estricta de evitación, en ocasiones, no es necesaria.
La PLV es habitualmente la primera proteína exógena introducida en la dieta en los lactantes que no toman lactancia materna exclusiva (LME). La PLV y sus derivados de consumo habitual (lácteos, quesos, etc.) representan la fuente principal de proteínas, calorías y calcio en la dieta de los menores de 2 años de edad. Por ello, hacer una dieta de eliminación es un riesgo de déficits nutricionales(18). Se recomienda seguir la lactancia materna tanto tiempo como sea posible. No se recomienda dieta de exclusión de PLV a la madre lactante, solo en casos excepcionales. Si precisan de una fórmula adaptada, se recomendará con preferencia una fórmula extensamente hidrolizada (proteínas por debajo de los 5.000 KDa) de caseínas o de proteínas séricas. Otras opciones son las fórmulas de soja o hidrolizadas de arroz. Se reservarán las fórmulas muy altamente hidrolizadas (semi-elementales) o fórmulas de aminoácidos (elementales) en aquellos lactantes que no toleren las fórmulas previas.
• Fórmulas de PLV extensamente hidrolizada (FEH). Están compuestas a base de caseína, seroproteínas o ambas. La hidrólisis de las mismas se obtiene por calor, método enzimático o ambos. Son la opción más frecuentemente utilizada. Se recomienda en todas las edades, menores y mayores a 6 meses. En el mercado existen preparados con y sin lactosa. En lactantes con afectación del estado nutricional se valorará utilizar FEH enriquecidas en triglicéridos de cadena media(10,12).
• Fórmulas de arroz (parcialmente hidrolizadas). Han demostrado ser eficaces y seguras. Las proteínas de arroz tienen menor valor biológico, pero son uno de los alimentos menos alergénicos. Se hidroliza por proteólisis enzimática. Estas fórmulas deben ser suplementadas con aminoácidos esenciales (lisina, treonina, triptófano y arginina), además de hierro y zinc. No contienen lactosa. Son una opción en todas las edades (también menores de 6 meses) y en familias veganas. Faltan estudios nutricionales a largo plazo(10).
• Fórmulas de soja. Son una opción en lactantes mayores a 6 meses y familias veganas. No deben usarse si presentan clínica digestiva, en enteropatías, malabsorción o nefropatías(10,12).
• Fórmulas elementales o de aminoácidos. Están indicadas en aquellos casos que no toleren ninguna de las opciones previas. En casos graves, con afectación nutricional importante o con sangrado rectal que condicione inestabilidad hemodinámica, son la primera opción terapéutica(9,12). Estas fórmulas están compuestas a base de: aminoácidos sintéticos (L-aminoácidos), esenciales y no esenciales, grasas vegetales y polímeros de glucosa, sin lactosa y suplementadas con oligoelementos y vitaminas.
Las fórmulas parcialmente hidrolizadas no son una opción. Tampoco son una buena alternativa la leche de otros rumiantes como la cabra o la oveja, pues las proteínas de estas tienen un alto grado de homología con la PLV, estimándose un riesgo de reactividad cruzada de >90 % entre estas especies(12,13,16). Por el contrario, la reactividad cruzada con especies como el burro, yegua, camello o dromedario es muy baja (<5 %) y, aunque su consumo no es frecuente en nuestro medio, podrían ser toleradas y, una buena alternativa en algunos casos(12,16). Las bebidas vegetales a partir de soja, arroz, almendra, quinoa, chufa o avena tienen un escaso valor nutricional con bajo contenido proteico y energético, a diferencia de las fórmulas vegetales diseñadas específicamente para lactantes, por ello nunca deben ser sustitutivas de las fórmulas descritas(12). No es preciso retirar la carne de ternera cocinada de la dieta.
Se ha observado que cuando el alimento es procesado a altas temperaturas (alimentos horneados con leche), el potencial alergénico de algunas proteínas de la leche disminuye. Así, algunos pacientes con perfiles concretos de sensibilización (especialmente baja o negativa IgE específica a caseína) pueden tolerar alimentos horneados. En estos casos, se recomienda no retirar trazas de PLV ni estos alimentos de la dieta. De esta forma se puede seguir una dieta de evitación a la PLV no tan restrictiva. Aunque faltan más estudios, parece que la introducción de productos horneados en la dieta de pacientes con APLV puede acelerar la tolerancia a leche fresca. En el caso de los pacientes con APLV no IgE mediada, se ha propuesto la reintroducción de la PLV progresiva, utilizando productos horneados (ver apartado seguimiento).
Seguimiento
El seguimiento es distinto si la alergia es IgE o no IgE mediada. En la alergia IgE mediada se establecen controles periódicos bianuales. Debe valorarse cada caso y realizar prueba de exposición controlada (PEC), para valorar la persistencia o resolución de la APLV. Decidir realizar la PEC en un momento u otro dependerá: de la gravedad de la clínica, del valor de la IgE específica sérica, de las pruebas cutáneas y del patrón de sensibilización. El objetivo es evitar las dietas de exclusión prolongadas de forma innecesaria.
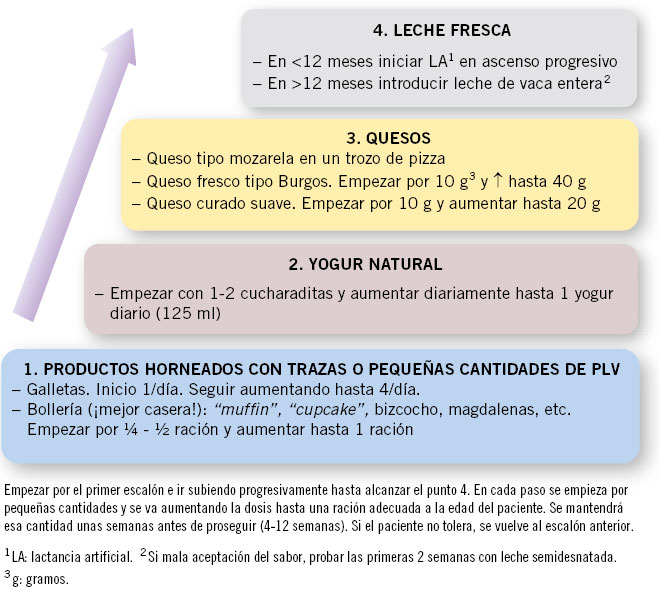
En el caso de la APLV no IgE mediada con síntomas leves (RGE, cólicos, estreñimiento, proctocolitis), pueden desarrollar tolerancia a los 3-6 meses y se puede realizar la PEC en domicilio, siguiendo la “escalera de la leche” (Fig. 2).
Figura 2. Ejemplo de “escalera de la leche”. Prueba de exposición gradual a proteínas de leche de vaca (PLV) para realizar en alergia a PLV (APLV) IGE no mediada.
Este es un patrón de reintroducción gradual propuesto para realizar en domicilio, con pautas y seguimiento marcadas por el pediatra referente, ya sea desde atención especializada o primaria. En los casos de enteropatía grave o FPIES, es adecuado esperar a los 12, 18 o, incluso, 24 meses en los casos graves, realizando la PEC en el hospital(10,12).
Inmunoterapia oral (ITO)
La dieta de exclusión de la PLV es una opción válida, aunque puede ser difícil. La ingesta accidental es frecuente, especialmente en alimentos procesados, con riesgo de anafilaxia en algunos pacientes. En la última década se han realizado múltiples avances en los protocolos de ITO, siguiendo regímenes diferentes que radican en el ascenso gradual de dosis de PLV. Este año 2022 se ha publicado una actualización de las guías DRACMA (Diagnosis and Rationale for Action against Cow’s Milk Allergy) de la World Allergy Organization (WAO) sobre estos avances en el manejo de la APLV, encontrándose los cambios más relevantes en la inmunoterapia oral a alimentos en la APLV IgE mediada(16). Hasta el momento, la ITO era considerada en esta guía como una opción no recomendada en la práctica clínica habitual. Sí era una opción recomendada en la guía de SEICAP y SCAIC(17).
La ITO es un tratamiento activo y consiste en la administración diaria de pequeñas cantidades de leche con incrementos progresivos. Consta de dos fases: una primera fase de ascenso y una segunda fase de mantenimiento. La cantidad de leche se aumenta gradualmente hasta una dosis máxima establecida (variable según el protocolo, habitualmente 200 o 250 ml) o bien, hasta la dosis máxima tolerada. La fase de ascenso suele durar entre 3-9 meses, dependiendo del protocolo y tolerancia del paciente. La duración óptima de la fase de mantenimiento no está bien definida. Es importante diferenciar entre desensibilización y adquisición de tolerancia. Decimos que un paciente está desensibilizado, cuando precisa de la ingesta de una dosis diaria del alimento para no desencadenar una reacción adversa, es decir, no puede discontinuar el tratamiento. La tolerancia se logra cuando puede ingerirse un alimento sin tener que administrarlo de forma repetida. Definimos que la tolerancia es espontánea, cuando esta se adquiere sin ITO, y es tolerancia inducida después de una ITO.
El objetivo de la ITO es reducir el riesgo de reacciones adversas, especialmente la anafilaxia, en casos de ingesta accidental de pequeñas cantidades de leche (<5 ml). El objetivo secundario es poder consumir PLV sin mirar etiquetas ni hacer dieta de evitación.
La adherencia a este tratamiento es compleja. El principal efecto adverso de la ITO es el riesgo incrementado de reacciones graves tipo anafilaxia, que es mayor que en las dietas de evitación de PLV. Requiere de la toma de leche diaria por un largo periodo de tiempo y acudir semanalmente al hospital para realizar los ascensos de dosis hasta llegar a la fase de mantenimiento. Existen cofactores que incrementan el riesgo de reacción, a menudo difíciles de controlar en la población pediátrica: fiebre, AINEs, emociones o actividad física, entre otros. Se deben explicar todas las opciones al paciente y a la familia y cuidadores, y tomar una decisión conjunta individualizada, basada en cada caso en particular. La elección de realizar una dieta exenta de PLV o un ITO debe ser, en última instancia, del paciente y la familia.
Antes de iniciar una ITO a leche, el diagnóstico debe ser confirmado (clínica reciente compatible con APLV IgE mediada con pruebas de prick o IgE específicas positivas o demostración por pruebas de exposición controlada [PEC]). Se debe educar al paciente y familia sobre la correcta administración de dosis, prevención de reacciones y tratamiento de reacciones alérgicas (incluida técnica de administración e indicación de adrenalina).
Faltan estudios para: definir la duración mínima de la fase de mantenimiento, establecer el periodo necesario de seguimiento una vez finalizada la ITO, identificar marcadores inmunológicos de riesgo y respuesta, e implementar protocolos estandarizados y validados para pacientes con alto riesgo de reacciones sistémicas, entre otros(17).
La mayoría de protocolos de ITO se realizan directamente con leche fresca. Se han publicado trabajos de ITO con horneados que contienen leche con harinas. Faltan estudios con protocolos estandarizados (temperatura, dosis inicio, escalada de dosis, etc.) para establecer eficacia y seguridad de esta modalidad de ITO y la comparación con la ITO con leche fresca(16,17).
ITO con adyuvantes
En ocasiones, no es posible inducir tolerancia con ITO, porque aparecen reacciones graves. En estos casos podemos añadir un adyuvante al tratamiento para minimizar las reacciones adversas. Las principales indicaciones de uso son en aquellos pacientes con anafilaxia o en aquellos que no podemos aumentar la dosis de leche en la fase de ascenso por reacciones repetidas. Algunos grupos lo usan para hacer una pauta más rápida de ascenso. El adyuvante que se usa hasta la actualidad es el omalizumab.
El omalizumab es un anticuerpo monoclonal anti-IgE, que se une a IgE circulante. Provoca un descenso de IgE libre y receptores de alta afinidad para la IgE. Su uso para ITO es controvertido y se encuentra fuera de ficha técnica. La EAACI refiere que su uso puede ser considerado en aquellos pacientes con reacciones sistémicas, como parte de una ITO con un programa más largo con una fase de ascenso más lenta(13). En las guías DRACMA recomiendan su uso al inicio de la ITO con leche fresca, aunque matizan que la evidencia es baja y que faltan estudios para definir efectos a largo plazo, duración del tratamiento, elección de pacientes candidatos y estudios de coste-beneficio(16).
Prevención
Las medidas de prevención primaria de la APLV han sido muy controvertidas las últimas dos décadas. Inicialmente, se abogaba por la utilización de FEH como suplemento ocasional de la LM en niños con riesgo atópico. A partir del 2015 aparecieron varios estudios que indican que la introducción temprana de alimentos potencialmente alergénicos (leche, huevo y cacahuete) disminuyen el riesgo de alergia y, desde entonces, se recomienda la introducción precoz independientemente del riesgo atópico(13,16). La evidencia es menos clara respecto a la prevención de la APLV. La EAACI publica en 2021, la recomendación de evitar la ingesta de leche de fórmula adaptada como suplementos a la LM en recién nacidos <7 días de vida(18). Por el contrario, las sociedades americanas y canadiense: American Academy of Allergy Asthma and Immunology (AAAAI), American College of Allergy Asthma and Immunology (ACAAAI) y la Canadian Society for Allergy and Clinical Immunology (CSACI) concluyen la no recomendación del uso rutinario de cualquier fórmula hipoalergénica para la prevención de alergia(19). El grupo de trabajo español compuesto por: SEICAP, la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), la Sociedad Española de Neonatología (SENEO) y Asociación Española de Pediatría (AEP) redacta un documento de consenso en el año 2022(20), concluyendo que en caso de precisar algún tipo de suplementación de la LM durante la primera semana de vida, esta no debe realizarse de forma sistemática con fórmulas extensamente hidrolizadas o exentas de proteínas de leche de vaca para la prevención de la APLV.
Sí hay consenso claro en la recomendación de la lactancia materna por los beneficios claros para la madre y el lactante, hasta los 4-6 meses de edad de forma exclusiva, siguiendo las recomendaciones de la Organización Mundial de la Salud (OMS).
Evitar la ingesta de los alimentos más alergénicos, como huevo, leche o pescado, durante la gestación, no ha demostrado reducir el riesgo de alergia alimentaria; por consiguiente, la madre no debe realizar ninguna dieta especial durante la gestación ni la lactancia. Es importante advertir del uso inadecuado e injustificado de dietas durante la gestación y la lactancia que, junto a problemas nutricionales, pueden conducir a la pérdida de tolerancia en lactantes de riesgo alérgico(12,18).
Función del pediatra de Atención Primaria
En Atención Primaria (AP) se establece la sospecha diagnóstica y el diagnóstico en la APLV no IgE mediada. También la orientación diagnóstica en el caso de la APLV IgE mediada, que quedará pendiente de confirmación por pruebas complementarias anteriormente explicadas. Igualmente, se inicia el tratamiento de la dieta de exclusión y la elección de la mejor leche sustitutiva en función de cada paciente y familia. Es absolutamente esencial la coordinación entre atención especializada y AP para un correcto manejo de la APLV de nuestros pacientes, especialmente en aquellos casos más complejos. Los pediatras de AP establecen un vínculo con las familias y el paciente que es definitorio, y es con ellos con los que mantienen un seguimiento más próximo y accesible.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio de las autoras.
1.** Johansson SG, Hourihane JO, Bousquet J, Bruijnzeel-Koomen C, Dreborg S, Haahtela T, et al. Position paper. A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force. Allergy. 2001; 56: 813-24.
2. De Martinis M, Sirufo MM, Suppa M, Ginaldi L. New Perspectives in Food Allergy. Int J Mol Sci. 2020; 21: 1474. DOI: 10.3390/ijms21041474.
3. Seth D, Poowutikul P, Pansare M, Kamat D. Food Allergy: A Review. Pediatr Ann. 2020; 49: e50-e58. DOI: 10.3928/19382359-20191206-01.
4. Osborne NJ, Koplin JJ, Martin PE, Gurrin LC, Lowe AJ, Matheson MC, et al; HealthNuts Investigators. Prevalence of challenge-proven IgE-mediated food allergy using population-based sampling and predetermined challenge criteria in infants. J Allergy Clin Immunol. 2011; 127: 668-76.e1. Disponible en: https://doi.org/10.1016/j.jaci.2011.01.039 PMID:21377036.
5. Valdesoiro Navarrete L, Vila Sexto L. Alergia a alimentos mediada por IgE. Protoc diagn ter pediatr. 2019; 2: 185-94.
6. Sicherer SH, Sampson HA. Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment. J Allergy Clin Immunol. 2014; 133: 291-307; DOI: 10.1016/j.jaci.2013.11.020.
7.*** Martorell-Aragonés A, Echeverría-Zudaire L, Alonso-Lebrero E, Boné-Calvo J, Martín-Muñoz MF, Nevot-Falcó S, et al; Food allergy committee of SEICAP (Spanish Society of Pediatric Allergy, Asthma and Clinical Immunology). Position document: IgE-mediated cow’s milk allergy. Allergol Immunopathol (Madr). 2015; 43: 507-26. DOI: 10.1016/j.aller.2015.01.003.
8. Anvari S, Miller J, Yeh CY, Davis CM. IgE-Mediated Food Allergy. Clin Rev Allergy Immunol. 2019; 57: 244-60. DOI: 10.1007/s12016-018-8710-3.
9. Lapena López de Armentia S, Hierro Delgado E. Alergia a proteínas de leche de vaca. Pediatr Integral. 2018; XXII: 76-86.
10. Valdesoiro Navarrete L, Boné Calvo J, Plaza Martín AM. Alergia IgE mediada a proteínas de leche de vaca. Protoc diagn ter pediatr. 2019; 2: 207-15.
11. Claver Monzón A, Pinto Fernández C. Alergia alimentaria no mediada por IgE. Protoc diagn ter pediatr. 2019; 2: 195-206.
12.*** Espín-Jaime B, Díaz-Martín JJ, Blesa-Baviers LC, Claver Monzón A, Hernández Hernández A, García Burrielf JI, et al. Alergia a las proteínas de leche de vaca no mediada por IgE: documento de consenso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), la Asociación Española de Pediatría de Atención Primaria (AEPAP), la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y la Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP). An Pediatr (Engl Ed). 2019; 90: 193.e1-11. Disponible en: http://dx.doi.org/10.1016/j.anpedi.2018.11.007.
13. Hoffmann-Sommergruber K, Hilger Ch, Santos A, de las Vecillas L, Dramburg S. Molecular Allergology User’s Guide 2.0. Cow’s milk allergy. EAACI; 2022. p. 285-294.
14. Pascual CY, Crespo JF, Pérez PG, Esteban MM. Food allergy and intolerance in children and adolescents, an update. Eur J Clin Nutr. 2000; 54: S75-8.
15. Ehn BM, Ekstrand B, Bengtsson U, Ahlstedt S. Modification of IgE binding during heat processing of the cow’s milk allergen beta-lactoglobulin. J Agric Food Chem. 2004; 52: 1398-403.
16. Brozek JL, Firmino RT, Bognanni A, Arasi S, Ansotegui I, Assa’ad AH, et al. World Allergy Organization (WAO) Diagnosis and Rationale for Action against Cow’s Milk Allergy (DRACMA) Guideline update – XIV – Recommendations on CMA immunotherapy. World Allergy Organization Journal. 2022; 15: 100646. Disponible en: http://doi.org/10.1016/j.waojou.2022.100646.
17. Martorell A, Alonso E, Echeverría L, Escudero C, García-Rodríguez R, Blasco C, et al. Oral immunotherapy for food allergy: A Spanish guideline. Egg and milk immunotherapy Spanish guide (ITEMS GUIDE). Allergologia et Immunopathologia. 2017; 45: 508-18. Disponible en: http://dx.doi.org/10.1016/j.aller.2017.05.002.
18. Halken S, Muraro A, de Silva D, Khaleva E, Angier E, Arasi S, et al. European Academy of Allergy and Clinical Immunology Food Allergy and Anaphylaxis Guidelines Group. EAACI guideline: Preventing the development of food allergy in infants and young children (2020 update). Pediatr Allergy Immunol. 2021; 32: 843-58. DOI: 10.1111/pai.13496.
19. Fleischer DM, Chan ES, Venter C, Spergel JM, Abrams EM, Stukus D, et al. A Consensus approach to the primary prevention of food allergy through nutrition: Guidance from the American Academy of Allergy, Asthma, and Immunology, American College of Allergy, Asthma, and Immunology and the Canadian Society for Allergy and Clinical Immunology. J Allergy Clin Immunol Pract. 2021; 9: 22-43e4.
20. Díaz Martina JJ, Blesa Baviera L, Campoy Folgoso C, Espín Jaime B, Leis Trabazo MR, del Castillo MM, et al. Asociación española de Pediatría. Documento de consenso en la prevención primaria de alergia a proteínas de leche de vaca en lactantes menores de 7 días de vida. Anales de Pediatría. 2002; 97: 59.e1-59.e7. Disponible en: https://doi.org/10.1016/j.anpedi.2022.05.003.
Bibliografía recomendada
– Johansson SG, Hourihane JO, Bousquet J, Bruijnzeel-Koomen C, Dreborg S, Haahtela T, et al. Position paper. A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force. Allergy. 2001; 56: 813-24.
Documento de posición elaborado por la EAACI (European Academy of Allergy and Clinical Immunology). Revisa y actualiza los términos de las reacciones alérgicas y procesos relacionados.
– Martorell-Aragonés A, Echeverría-Zudaire L, Alonso-Lebrero E, Boné-Calvo J, Martín-Muñoz MF, Nevot-Falcó S, et al; Food allergy committee of SEICAP (Spanish Society of Pediatric Allergy, Asthma and Clinical Immunology). Position document: IgE-mediated cow’s milk allergy. Allergol Immunopathol (Madr). 2015; 43: 507-26.
Documento de posición sobre alergia a proteínas de leche de vaca IgE mediada, elaborado por la SEICAP, con propuesta de un algoritmo diagnóstico.
– Espín-Jaime B, Díaz-Martín JJ, Blesa-Baviers LC, Claver Monzón A, Hernández Hernández A, García Burrielf JI, et al. Alergia a las proteínas de leche de vaca no mediada por IgE: documento de consenso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), la Asociación Española de Pediatría de Atención Primaria (AEPAP), la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y la Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP). An Pediatr (Engl Ed). 2019; 90: 193.e1-11. Disponible en: http://dx.doi.org/10.1016/j.anpedi.2018.11.007.
Documento de consenso sobre la alergia a proteínas de leche de vaca no IgE mediada, elaborado por la SEGHNP, AEPAP, SEPEAP y SEICAP, con el objetivo de unificar las pautas de actuación del abordaje de niños con dicha patología.
| Caso clínico |
|
Niño de 8 años que acude a consulta por presentar urticaria generalizada y prurito cutáneo después de probar un yogur de leche de oveja. Está diagnosticado de APLV IgE mediada desde los 7 meses de vida. Hasta el momento, ha realizado dieta exenta de proteínas de leche de vaca en todos sus formatos (leche, yogur, horneados, trazas…) sin ninguna reacción accidental. No presenta otras alergias alimentarias conocidas ni otros antecedentes de interés.
|



 Eosinophilic disease of the esophago-gastro-intestinal tract
Eosinophilic disease of the esophago-gastro-intestinal tract