 |
| Temas de FC |
F.A. Ordóñez Álvarez, A. Pérez Pérez, L.R. Díaz Anadón
Nefrología Pediátrica. Hospital Universitario Central de Asturias. Oviedo
| Resumen
El hallazgo de una proteinuria no es excepcional en las consultas pediátricas. En la mayor parte de las ocasiones, los pacientes son valorados de forma inicial en Atención Primaria y, afortunadamente, una alta proporción de aquellos padecerán procesos benignos y transitorios que no exigirán más allá que la confirmación de su desaparición. Por el contrario, en una minoría de casos, la proteinuria podrá asociarse a patologías graves y mostrarse de manera persistente, por lo que el pediatra general debe poseer los conocimientos básicos encaminados a: identificar este signo clínico, dirigir su valoración en las etapas iniciales y colaborar posteriormente en su seguimiento a largo plazo. El objetivo fundamental de su manejo será diferenciar aquellos pacientes que pueden ser controlados por el propio pediatra o, por el contrario, deben ser valorados en el ámbito hospitalario, ya sea de forma urgente o programada. Se presenta en el capítulo un breve repaso de la metodología dirigida a la detección de proteinuria, una clasificación de sus diferentes tipos y un esquema de manejo práctico secuencial basado en sus manifestaciones. En la segunda parte del capítulo se resume un tema amplio como es el síndrome nefrótico idiopático, subrayando los aspectos de mayor interés clínico y práctico para el pediatra de Atención Primaria. |
| Abstract
Proteinuria is nothing exceptional in pediatric consultations. The majority of patients are initially assessed in primary care and, fortunately, a high proportion of those will have transient and benign diseases that do not require more than the confirmation of its disappearance. Conversely, in a minority of cases proteinuria may be associated with severe pathologies and persistently manifest, hence, general pediatricians must acquire the basic knowledge to identify this clinical finding, direct its assessment in the initial stages, and subsequently collaborate in its long-term follow-up. The fundamental objective of its management will be to differentiate patients who can be controlled by their primary care physician or those that should be assessed at the hospital setting, either in a scheduled appointment or urgently. This manuscript presents a brief review of the methodology aimed at the detection of proteinuria, a classification of its different types and a scheme of sequential practical management based on its manifestations. The second part of the manuscript summarizes a topic as broad as idiopathic nephrotic syndrome, highlighting the aspects of greatest clinical and practical interest to the general pediatrician. |
Palabras clave: Proteinuria; Síndrome nefrótico; Proteinuria ortostática; Cociente proteína/creatinina; Tira reactiva orina.
Key words: Proteinuria; Nephrotic syndrome; Orthostatic proteinuria; Protein/creatinine ratio; Urine test strip.
Pediatr Integral 2022; XXVI (8): 472 – 481
OBJETIVOS
• Identificar la proteinuria mediante las herramientas diagnósticas disponibles en Atención Primaria, básicamente, tira reactiva de orina y cociente proteína/creatinina en micción aislada.
• Distinguir las causas transitorias de proteinuria.
• Conocer otras causas de proteinuria que pueden ser manejadas desde Atención Primaria.
• Conocer las indicaciones principales por las que una proteinuria debe ser remitida a Nefrología Pediátrica.
• Tener en mente el diagnóstico de síndrome nefrótico y las principales definiciones dentro de su espectro.
• Conocer las situaciones clínicas del síndrome nefrótico que pueden ser manejadas con la colaboración del pediatra de Atención Primaria y las principales indicaciones para remitir a Atención Especializada.
Proteinuria. Síndrome nefrótico
Proteinuria
Introducción
En el contexto clínico más habitual, la proteinuria aparece de forma transitoria, traduce condiciones de carácter benigno y se resuelve de forma espontánea, sin ningún tipo de intervención médica.
Aun cuando supone un dato de potencial relevancia clínica, por cuanto puede traducir una manifestación de enfermedades graves, es un signo reconocido de progresión de enfermedad renal y un factor independiente de riesgo cardiovascular, la presencia de proteinuria en la edad pediátrica suele asociarse de forma habitual a condiciones benignas y transitorias.
Programas de cribaje en población escolar y adolescentes, han descrito positividad para proteinuria en una tira reactiva de orina en hasta el 10 % de los examinados, pero, al igual que en el caso de la hematuria, este porcentaje desciende significativamente si se considera como un hallazgo permanente, ya que solo en el 0,1 % de los casos persiste tal anomalía después de un año de seguimiento(1). La prevalencia aumenta con la edad, es máxima en la adolescencia y más alta en el sexo femenino.
Definición y tipos de proteinuria
Se define como proteinuria patológica a aquella superior a la pérdida fisiológica de proteínas en la orina. Se describen diferentes tipos de proteinuria, en función del mecanismo fisiopatológico responsable.
En condiciones normales, existe una pérdida urinaria fisiológica de proteínas, constituida por proteína de Tamm-Horsfall, albúmina, β2-microglobulina, transferrina, inmunoglobulinas y otras. Como consecuencia, se considera normal una proteinuria < 100 mg/m2/día o < 4 mg/m2/h (< 12 mg/m2/h en lactantes) en orina recolectada de 24 horas o < 0,2 mg/mg en niños mayores de 2 años (< 0,5 mg/mg en lactantes), mediante la determinación de un cociente proteína/creatinina en una micción aislada, habitualmente la primera de la mañana.
Se describen cuatro tipos de proteinuria, en función del mecanismo fisiopatológico responsable: glomerular, tubular, por sobreproducción o sobrecarga y por afectación postrenal. Los dos últimos son muy poco frecuentes en niños(2).
• Proteinuria glomerular. Supone un marcador de daño glomerular que resulta del aumento en la permeabilidad de la pared capilar del glomérulo al paso de macromoléculas. Está formada en su mayoría por albúmina. Es secundaria a patologías glomerulares, pero también existen situaciones no patológicas por excreción aumentada de proteínas que no responden a un defecto de la estructura renal o función.
• Proteinuria tubular. Menos frecuente que la proteinuria glomerular. Está asociada a un aumento de la excreción de proteínas de bajo peso molecular (β2-microglobulina, α1-microglobulina, proteína ligada a retinol) y se produce por un defecto de reabsorción de estas proteínas en el túbulo proximal. Suelen ser de intensidad ligera o moderada y pueden reflejar alteraciones congénitas o adquiridas en el túbulo renal, generalmente debidas a enfermedades tubulointersticiales. La proteína tubular más medible habitualmente es la β2-microglobulina, cuyos valores de normalidad no deben de exceder de los 400 mg/l después de los 3 meses de edad.
Algunos pacientes pueden presentar proteinurias mixtas, glomerular y tubular. En esta situación es útil analizar la relación entre albúmina y β2-microglobulina urinarias. Los valores normales de este cociente se encuentran entre 30-200 mg/mg, de tal forma que valores inferiores a 30 mg/mg corresponden a proteinurias tubulares, mientras que en las proteinurias glomerulares puede alcanzar cifras entre 1.000-15.000 mg/mg.
• Proteinuria por sobrecarga. Secundaria a sobreproducción de una proteína específica a un nivel que excede la capacidad de reabsorción tubular, como por ejemplo en: hemólisis intravascular (hemoglobina libre, no ligada a haptoglobina), rabdomiólisis (mioglobina) o leucemias mielomonocíticas agudas (lisozima).
• Proteinuria post-renal. Asociada a infecciones urinarias, nefrolitiasis o tumores del tracto urinario. Mecanismo poco definido.
Causas
En general, la gran mayoría de las proteinurias son de origen glomerular y traducen fenómenos benignos y transitorios.
Una clasificación etiológica simple de los diferentes tipos de proteinuria, que posteriormente se comentarán, se presenta en la tabla I(3).
Métodos de detección
Aunque inicialmente suele detectarse mediante tira reactiva de orina, el hallazgo de proteinuria obliga a confirmarla, asegurar su persistencia y cuantificarla a través de exámenes adicionales en casos seleccionados.
En la práctica clínica diaria la proteinuria es detectada habitualmente con métodos semicuantitativos, aunque para su evaluación y manejo definitivos será preciso utilizar técnicas de cuantificación de las proteínas en orina.
Métodos semicuantitativos
Incluyen la tira reactiva de orina y el método turbidométrico, pero este último no se emplea en la práctica clínica habitual. La tira reactiva mide la concentración de albúmina y algunas otras proteínas, como la lisozima. Se basa en la reacción colorimétrica de la orina con el azul de tetrabromofenol, de la que se obtiene una escala de intensidades de verde que se correlaciona con la intensidad de albuminuria en la muestra, entre indicios (15-30 mg/dl) y 4+ (> 1.000 mg/dl). Es un buen método para valoración inicial, pero no es útil para cuantificar la intensidad de la proteinuria, ya que su resultado depende de la concentración urinaria (la orina concentrada sobreestima la proteinuria y la orina diluida la subestima). Pueden considerarse patológicas proteinurias >1+ en orinas con densidad < 1.015 o > 2+ con densidad > 1.015. Las trazas o indicios de proteínas no suelen implicar una situación patológica. No detecta proteinuria tubular y puede ser difícil de valorar en caso de color anormal de la orina, inducido por algunos alimentos o fármacos. Es muy específica, pero no sensible a bajos niveles de excreción de albúmina, por lo que no detecta la microalbuminuria. Los factores relacionados con falsos positivos y negativos se recogen en la tabla II(4).
Métodos cuantitativos
Cociente proteína/creatinina y albúmina/creatinina en muestra aislada de orina
Presentan una aceptable correlación con la proteinuria de 24 horas, siempre y cuando exista una buena función renal. Es preferible medirlo en una muestra obtenida en primera hora de la mañana y mantener esta misma recomendación en sucesivas determinaciones si pretendemos obtener información evolutiva de la proteinuria, por cuanto la excreción de proteínas varía significativamente a lo largo del día, en función de factores ortostáticos y de ejercicio(5). Como se ha indicado previamente, el valor normal de la relación proteína/creatinina es < 0,2 mg/mg (< 20 mg de proteína/mmol de creatinina) en niños mayores de 2 años y < 0,5 mg/mg (< 50 mg de proteína/mmol de creatinina) en lactantes y niños pequeños de 6-24 meses. El valor normal del cociente albúmina/creatinina en niños mayores de 6 años es < 30 mg/g (< 3 mg/mmol). Este cociente es preferiblemente utilizado para cuantificar microalbuminuria, mientras el cociente proteína/creatinina está indicado cuando se sospeche una proteinuria superior a este rango.
Orina de 24 horas
Representa el método de referencia para cuantificar proteinuria, albuminuria y microalbuminuria. En la práctica, queda habitualmente restringida a pacientes continentes que ya presentan alteraciones en la tira reactiva de orina o en los cocientes proteína/creatinina o albúmina/creatinina. Se expresa como mg/m2/h, o bien, como mg/m2/día y se consideran patológicos valores > 4 mg/m2/h (> 12 mg/m2/h en lactantes) o > 100 mg/m2/día. La correcta recogida de orina puede ser estimada cuantificando la creatinina urinaria en 24 horas y comparándola con la creatinina en orina esperada. En niños > 3 años los valores normales de creatinina en orina son de 15-20 mg/kg/día, en lactantes entre 12-14 mg/kg/día y de 10,9 ± 3,4 mg/kg/día en el recién nacido a término.
Métodos cualitativos
El análisis cualitativo de las proteínas urinarias puede ser necesario para diferenciar la proteinuria de origen glomerular o tubular. Permite la medición selectiva de las proteínas tubulares β2-microglobulina, proteína ligada al retinol, α1-microglobulina y lisozima, cuyos niveles serán 10 a 100 veces más altos de lo normal en casos con proteinurias de origen tubular. Mención especial merece la microalbuminuria, signo precoz de afectación glomerular en situaciones que cursan con hiperfiltración, como la hipertensión arterial, nefropatía diabética o nefropatía cicatricial. La excreción fisiológica normal de albúmina en niños sanos de 2 a 16 años es < 30 mg/día/1,73 m2. La excreción persistente de albúmina entre 30-300 mg/día/1,73 m2 (30-300 mg/g de creatinina en micción aislada) se denomina incremento moderado de albuminuria, formalmente denominada microalbuminuria.
Evaluación práctica de la proteinuria
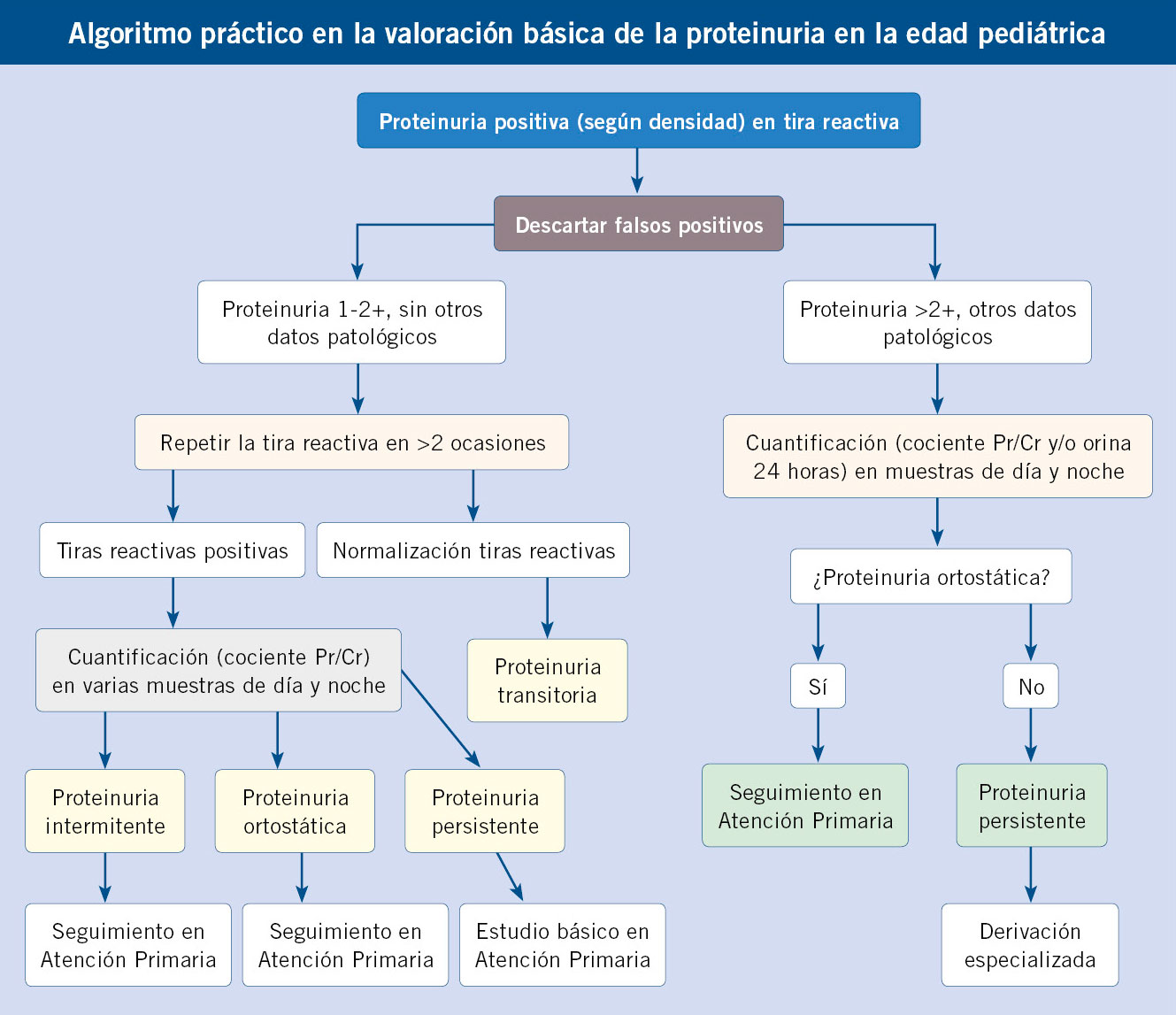
El manejo clínico pasa por descartar inicialmente la posibilidad de causas benignas, en especial en pacientes asintomáticos con proteinuria aislada, y realizar un estudio detallado en los casos, afortunadamente menos frecuentes, con proteinuria persistente u otros datos clínicos patológicos asociados.
El interrogatorio sobre las circunstancias clínicas presentes, antecedentes personales y familiares y exploración física, resultan de especial trascendencia y remitimos a la referencia De Lucas C, Izquierdo E. 2022. En la valoración de las proteinurias es sumamente importante seguir una sistemática bien establecida, lo que permite, entre otros, minimizar los estudios complementarios necesarios(6).
Primer paso: exclusión de falsos positivos y confirmación de la proteinuria
Como se ha comentado previamente, en la mayor parte de los casos el diagnóstico inicial de una proteinuria recae en una tira reactiva de orina. Una proteinuria positiva mediante este método exige inicialmente la exclusión de factores relacionados con falsos positivos (ya comentados previamente en este capítulo). Una vez excluidos aquéllos, es obligada su confirmación, ya sea mediante los cocientes urinarios proteína/creatinina o albúmina/creatinina o en orina de 24 horas.
Segundo paso: descartar la posibilidad de proteinurias de carácter benigno
Este paso debe considerarse especialmente si nos encontramos ante un paciente asintomático y con proteinuria como único dato clínico patológico. A diferencia de las proteinurias persistentes en la que se han excluido factores ortostáticos, que deben ser interpretadas como un dato clínico potencialmente grave y valoradas de forma adecuada, las proteinurias “benignas” no requieren evaluaciones diagnósticas profundas. Incluye 3 posibilidades diagnósticas: transitoria, intermitente idiopática y ortostática.
Proteinuria transitoria
Es una causa muy frecuente de proteinuria en la infancia. Muestra habitualmente una magnitud leve. Está motivada por cambios en la presión intraglomerular y permeabilidad capilar que no reviste significación patológica y que, por tanto, traduce únicamente una anomalía funcional. Remite varios días después del cese del factor causal, lo que exige su demostración objetiva. Aparece en cuadros febriles, ejercicio físico intenso, hipovolemia, deshidratación, insuficiencia cardiaca, infecciones, estrés emocional, administración de adrenalina, cirugía abdominal y exposición a frío intenso, aunque también está descrita una forma idiopática sin relación aparente con ninguno de los factores enumerados previamente. En la práctica, ante el hallazgo de una proteinuria de baja cuantía (1-2+ en tira reactiva), asintomática, aislada y con exploración física normal en un niño sin evidencia previa de afectación renal, resulta razonable valorar inicialmente la posibilidad de que se trate de un fenómeno transitorio y autolimitado. Aunque la proteinuria inducida por el ejercicio suele desaparecer precozmente (de forma habitual en 48 horas), otras formas transitorias de proteinuria, como la inducida por fiebre, pueden tardar semanas en negativizarse.
Proteinuria intermitente idiopática
Se presenta como una proteinuria independiente de la posición corporal en, al menos, un 50 % de las muestras de orina recogidas al azar, pero no en todas. La mayoría de los pacientes son jóvenes, menores de 30 años y tienen pruebas de función renal y tensión arterial normales. Los estudios de seguimiento a largo plazo indican que la evolución de estos pacientes, en ausencia de enfermedades sistémicas asociadas, es favorable.
Proteinuria ortostática o postural
Supone la presencia de proteinuria, constante o intermitente, en posición erecta, y su normalización durante el reposo. No suele exceder de 1 g/m2/día en orina minutada ni presentar un cociente proteína/creatinina superior a 1 mg/mg. Es más frecuente en individuos adolescentes altos, con hiperlordosis lumbar y con tendencia la hipotensión ortostática. Es una causa muy frecuente de proteinuria en edad pediátrica (supone hasta el 60 % de la proteinuria en niños y el 75 % en adolescentes), pudiendo llegar a estar presente hasta en el 2-5 % de los adolescentes(7). Su diagnóstico exige, idealmente con varias determinaciones, la cuantificación por separado de la proteinuria emitida durante el periodo de actividad normal y tras el reposo en cama, teniendo la precaución de recomendar orinar al paciente a las 2 horas de acostarse, micción que debe añadirse al periodo de día, asegurar un periodo mínimo de 8 horas de decúbito y permanecer tumbado hasta que se obtenga la muestra de orina de la mañana. Obviamente, existirá proteinuria durante el periodo diurno de actividad y desaparecerá en la primera micción de la mañana. Idealmente, debe evitarse el ejercicio físico intenso en el día previo a esta valoración. Aunque la proteinuria ortostática puede ser persistente, su pronóstico es excelente y tiende a remitir con la edad. No obstante, se aconseja mantener controles anuales en estos pacientes hasta confirmar su desaparición, con vistas a descartar una progresión de la afectación glomerular. Algunos estudios describen una elevada prevalencia de síndrome del cascanueces entre los casos de proteinuria ortostática(8).
Tercer paso: valorar las proteinurias persistentes
Toda proteinuria confirmada en la que se ha descartado un carácter intermitente, transitorio u ortostático exige un estudio diagnóstico detallado, comenzando por su cuantificación mediante un método adecuado(3,6,9). La valoración inicial en esta situación pasará por tratar de clasificarla, por un lado, como proteinuria originalmente de causa renal (primaria) o secundaria a patologías sistémicas.
En ambos casos, la proteinuria puede ser asintomática, por lo general, detectada casual y aisladamente en un paciente sin otros datos clínicos asociados (situación menos habitual), o acompañarse de sintomatología, incluyendo: síntomas generales no específicos (fiebre, pérdida de peso, etc.), síntomas generales específicos (artritis, púrpura, exantema, etc.) o signos/síntomas urinarios específicos (hematuria, disuria, oliguria, hipertensión, insuficiencia renal, etc.).
Ante una situación de proteinuria persistente se realizará en primer lugar un sedimento de orina, buscando otros signos de enfermedad glomerular y/o parenquimatosa, tales como hematuria, cilindros hemáticos, piuria y/o leucocituria. La presencia de un sedimento urinario activo sugiere una respuesta inmunitaria glomerular o intersticial y probablemente asocia afectación de la función renal. También puede ayudarnos a diagnosticar una infección de orina asociada a la proteinuria. Si es así, normalmente la proteinuria desaparecerá al tratar la infección.
El estudio inicial en sangre debe incluir hemograma y bioquímica con función renal (creatinina, urea), electrolitos, colesterol, triglicéridos, albúmina y proteínas totales. Si se necesita una estimación más precisa del filtrado glomerular se puede calcular el aclaramiento de creatinina con orina de 24 horas. La determinación de antiestreptolisinas O (ASLO) y el estudio inmunológico, incluyendo complemento (C3, C4), anticuerpos antinucleares (ANA), anticuerpos anti-citoplasma de neutrófilos (ANCA), anticuerpos anti-membrana basal glomerular e inmunoglobulinas, son datos analíticos básicos a considerar ante la sospecha diagnóstica de glomerulonefritis aguda o enfermedad reumatológica. El estudio infeccioso (virus de hepatitis B y C y HIV) deberá considerarse en función de los datos clínicos asociados (evidencia de enfermedad hepática, exposición a HIV).
El estudio de imagen de la proteinuria persistente pasa casi de forma exclusiva por la realización de una ecografía renal, que se debe realizar en todos los pacientes con sospecha de afectación estructural renal y descarta alteraciones como la presencia de dilataciones, asimetrías renales, obstrucción o algunas cicatrices. Además, aporta información para una posible biopsia, ya que está contraindicada en un riñón único y en riñones pequeños cicatriciales. Únicamente, en casos bien seleccionados, podrían estar indicadas otras pruebas de imagen, preferentemente cistografía (anomalías ecográficas o historia de infecciones urinarias de repetición asociadas) o gammagrafía renal (cicatrices renales y valoración de función renal diferencial).
La biopsia renal no debe ser rutinariamente indicada en el estudio de las proteinurias. Su papel en pacientes con proteinuria persistente aislada y asintomática es controvertido y se reserva, por lo general, para casos con proteinuria > 500 mg/m2/día o ≥ 0,5 mg/mg durante 6-12 meses, presencia de sedimento activo o signos de progresión de enfermedad renal. Por el contrario, en pacientes sintomáticos con proteinuria, la biopsia renal adquiere un mayor protagonismo(10).
En el algoritmo al final del artículo, se sugiere una estrategia general en el manejo inicial de la proteinuria en la edad pediátrica.
Función del pediatra de Atención Primaria
Desde Atención Primaria será posible la evaluación y el manejo de una buena parte de los niños a los que se les haya detectado proteinuria.
Las funciones pueden resumirse en las siguientes:
• Confirmar o descartar a corto plazo una proteinuria detectada mediante tira reactiva de orina en pacientes sin otros datos clínicos significativos.
• Conocer otros métodos de detección de proteinuria, con el mismo objetivo que el indicado previamente.
• Conocer, diagnosticar y controlar los diferentes tipos de proteinuria considerados como benignos (transitoria, intermitente, ortostática).
• Derivar precozmente a Atención Especializada proteinurias persistentes, casos sintomáticos y/o asociados a patologías sistémicas.
Síndrome nefrótico
Definición
Proteinuria en rango nefrótico + hipoalbuminemia ± edemas son los criterios que definen el síndrome nefrótico.
El síndrome nefrótico (SN) se define por la tríada de proteinuria en rango nefrótico (≥ 3+ en tira reactiva o índice proteína/creatinina > 2 mg/mg en la primera micción de la mañana, o bien, > 40 mg/m2/h o > 50 mg/kg/día en orina de 24 horas), hipoalbuminemia (< 2,5 g/dl) y edemas(11). Si bien el edema es el signo guía de la enfermedad, su presencia no es obligatoria.
Clasificación y epidemiología
El SN idiopático es la forma más frecuente y debuta en >12 meses de edad. En sujetos de menor edad se debe sospechar causa genética.
El SN constituye la enfermedad glomerular más frecuente en la infancia. En función de su etiología, se clasifica en primario y secundario. El SN secundario es muy poco frecuente en la edad pediátrica y adquiere mayor relevancia en la edad adulta. Entre sus posibles causas se encuentran infecciones (virus hepatitis B y C, sífilis, VIH, etc.), fármacos (AINE, litio, bisfosfonatos, etc.), otras nefropatías (nefropatía IgA, nefropatía lúpica, glomerulonefritis membranosa, etc.) y neoplasias, como el linfoma Hodgkin(12). Generalmente, la evolución del SN vendrá ligada a la de su causa.
En la edad pediátrica predomina, en cambio, el SN primario. Este, a su vez, en función de la edad de presentación, se clasifica en congénito (<3 meses de edad), infantil (3-12 meses) e idiopático (12 meses-12 años)(13). La mayoría de los casos que debutan antes de los 12 meses son de base genética, no responden a inmunosupresores y tienen mal pronóstico, con evolución frecuente a enfermedad renal terminal en la infancia. Dada su complejidad, estos pacientes requieren un manejo especializado y multidisciplinar(12).
El síndrome nefrótico idiopático (SNI) es, con diferencia, la forma más común de SN en la infancia (más del 90 % de los casos) y en el que se centrará este capítulo. Se presenta a partir del año de edad y tiene una incidencia anual de 2-7 casos/100.000 niños, con un pico entre los 2 y 6 años de vida. La incidencia es mayor durante los meses de invierno, en sujetos de raza asiática, en varones en etapa prepuberal y en poblaciones con nivel socioeconómico bajo(12). Se define SNI ante un SN con hallazgos histológicos de enfermedad de cambios mínimos (ECM), glomeruloesclerosis focal y segmentaria (GEFS) o proliferación mesangial en la microscopía óptica. La mayoría de los pacientes con SNI presentará una ECM, que habitualmente (>90 %) responde a corticoides(12), por lo que el diagnóstico suele ser clínico en la mayoría de los casos y no es necesaria la biopsia renal, salvo en circunstancias concretas. Por tanto, en la práctica clínica habitual no se suele distinguir entre ECM y SNI.
Etiopatogenia
El aumento de permeabilidad de la membrana de filtración glomerular resulta en la pérdida masiva de proteínas por la orina y el desarrollo de edema.
La ECM se considera principalmente una podocitopatía. Las alteraciones podocitarias y de los componentes del diafragma de hendidura conllevarían un aumento de la permeabilidad glomerular para proteínas plasmáticas (principalmente albúmina), lo que resulta en proteinuria selectiva masiva. Si bien hay diversos mecanismos propuestos a nivel molecular(12,14) y parece que pueda existir una base inmune (dada la respuesta a tratamiento inmunosupresor y la relación de la proteinuria con episodios infecciosos y reacciones alérgicas)(12), la patogénesis completa es aún desconocida. Se postula, asimismo, la presencia de un factor circulante mediador de la proteinuria, pero, a pesar de que hay varias moléculas candidatas(14), esta hipótesis está aún por confirmar. Recientemente, se ha descrito, además, la posible participación de otros componentes de la membrana de filtración glomerular, como el endotelio capilar(15).
Manifestaciones clínicas
Además del edema, el SN se puede acompañar de manifestaciones digestivas, respiratorias, fenómenos trombóticos e infecciones, entre otras.
El debut del SNI suele estar precedido por una infección, habitualmente del tracto respiratorio superior. El signo clínico guía es la presencia de edema, que típicamente es progresivo y deja fóvea. Inicialmente, suele ser de predominio matutino en zona periorbitaria, a medida que aumenta la retención de líquidos se hace más evidente y puede aparecer en otras localizaciones, principalmente en zonas declives (zonas declives, como miembros inferiores y zona sacra en decúbito). Se relaciona inversamente con la albúmina sérica. En casos graves puede llegar a ser generalizado (anasarca) y asociarse a derrame pleural (con posible disnea y compromiso respiratorio) y ascitis.
Puede acompañarse de síntomas digestivos como diarrea (por edema de la mucosa intestinal) o dolor abdominal, frecuente por la ascitis e hipoperfusión intestinal. En caso de que este se asocie a fiebre, se deberá sospechar una peritonitis, dada la mayor susceptibilidad que tienen estos pacientes.
La mayoría de los pacientes suelen estar normovolémicos y con una presión arterial normal. En casos de hipovolemia grave puede haber hipotensión, poco frecuente. La presencia de taquicardia, frialdad acra, dolor abdominal, oliguria y relleno capilar lento orienta hacia la presencia de hipovolemia, que deberá tenerse en cuenta para su manejo clínico.
La complicación trombótica más común es la trombosis venosa profunda de extremidades y se asocia al uso de catéteres venosos centrales. Otras localizaciones, como vena renal o sistema nervioso central, o la trombosis arterial son menos frecuentes. El riesgo trombótico aumenta en niños mayores.
Hallazgos de laboratorio
El perfil analítico del SN está dominado por la presencia de proteinuria de rango nefrótico, hipoalbuminemia e hiperlipemia.
La proteinuria en el SN no solo es masiva, sino que además es selectiva (albuminuria). Puede haber microhematuria hasta en un 20-30 % de los pacientes. La presencia de macrohematuria sugiere trombosis de vena renal asociada u otra glomerulopatía. En sangre existe hipoproteinemia (< 6 g/dl) e hipoalbuminemia (< 2,5 g/dl). La función renal suele ser normal, aunque puede existir una elevación de la creatinina debida a hipovolemia u otros factores. El daño renal mantenido debe orientarnos a una complicación o a otras enfermedades glomerulares. Es frecuente la presencia de hiponatremia, por estimulación de la ADH (hormona antidiurética) debida a la hipovolemia. La hiperlipemia es un rasgo característico, con elevación de colesterol total y LDL y, posteriormente, de los triglicéridos, si la proteinuria persiste. La trombocitosis y el aumento del hematocrito (por hemoconcentración) son frecuentes. Los estudios de extensión iniciales indicados en el debut de un SNI se describen en la tabla III.
Historia natural
El SNI responde mayoritariamente al tratamiento con corticoides. No obstante, las recaídas son muy frecuentes y se relacionan con su pronóstico.
La mayor parte de los niños con SNI responde al tratamiento esteroideo. No obstante, un 80-90 % presentarán recaídas, la mayoría en los primeros meses tras el debut, siendo el riesgo de recaídas mayor a menor edad. Las recaídas se suelen asociar a procesos infecciosos y, en ocasiones, a la vacunación. Un 40-50 % desarrollarán córtico-dependencia y un 20 % son córtico-resistentes. Las definiciones precisas de estas categorías clínicas se detallan en la tabla IV(11). El SNI córtico-sensible se ha considerado tradicionalmente una enfermedad limitada a la edad pediátrica. Sin embargo, aunque la mayoría de los niños llega a la edad adulta en remisión, hasta un tercio presentará enfermedad activa en edad adulta, más en caso de córtico-dependencia o recaídas frecuentes(16).
Tratamiento
Los objetivos del tratamiento son el control de las manifestaciones asociadas a la proteinuria (tratamiento sintomático) y alcanzar la remisión (tratamiento de base).
Tratamiento sintomático
El edema se maneja habitualmente con restricción moderada de sal y de líquidos (pérdidas insensibles de 400 ml/m2/día + diuresis) en función de su gravedad. Se deberá realizar un balance hídrico exhaustivo, evitando los líquidos intravenosos y la inmovilización en lo posible. Los diuréticos tienen indicación solo en casos graves donde no existe evidencia de hipovolemia. En caso de edema refractario o incapacitante (anasarca, compromiso respiratorio), puede estar indicada la infusión de seroalbúmina intravenosa, con mucha precaución por el alto riesgo de edema pulmonar. El tratamiento hipolipemiante (estatinas), la profilaxis antibiótica y la profilaxis antitrombótica no están indicados de manera rutinaria(11,17,18).
Tratamiento de base
El pilar fundamental de tratamiento del SNI son los corticoides, que están indicados en todos los casos, salvo ante la sospecha de SN genético o sindrómico(11,17). La buena respuesta a corticoides y la presentación en una edad típica (de 1 a 10-12 años) sugieren una ECM subyacente, por lo que, en la práctica clínica, es innecesaria una biopsia renal diagnóstica cuando la evolución es típica. El tratamiento esteroideo se iniciará, de manera empírica, sin necesidad de confirmación histológica. Las indicaciones de biopsia renal se muestran en la tabla III. Las recaídas se tratan también con corticoides, aunque con pautas más cortas(11,17,18). En la tabla V se describe una de las pautas más habituales de la terapia esteroidea(11), aunque puede haber variaciones entre diferentes centros y países.
La fase de retirada progresiva de los esteroides es una práctica extendida, aunque la mayor parte de las guías nacionales e internacionales no establecen su necesidad. Durante el tratamiento con corticoides se deberá prestar atención a la aparición de efectos adversos (hipertensión arterial, aspecto cushingoide, hirsutismo, hiperglucemia, dislipemia, complicaciones oftalmológicas, alteraciones del comportamiento, etc.) y se deberá asegurar un aporte adecuado de calcio y vitamina D(18).
En el SN con recaídas frecuentes, para mantener la remisión, se puede pautar tratamiento de mantenimiento prolongado con corticoides a días alternos a dosis bajas (≤ 0,5 mg/kg, buscando la dosis mínima eficaz), si son bien tolerados(11). En estos mismos pacientes que no estén recibiendo tratamiento con corticoides, o que estén con corticoides a días alternos, se recomienda la administración de ciclos cortos (5-7 días) de corticoide diario a 0,5 mg/kg/día durante los episodios infecciosos (principalmente infecciones de vías respiratorias superiores) para la prevención de recaídas(11,19).
Tratamientos ahorradores de esteroides
En caso de SN dependiente de corticoides o con recaídas frecuentes en el que sean necesarias dosis más altas de corticoides o aparezcan efectos secundarios, se deberá iniciar un tratamiento ahorrador de esteroides(11,18). No existe consenso ni evidencia suficiente para recomendar una estrategia terapéutica universal actualmente, por lo que la elección del fármaco adecuado debe fundamentarse en las características del paciente y del fármaco (conociendo adecuadamente su perfil de toxicidad) y la experiencia personal. Se deberán tener en cuenta las preferencias del paciente. Dentro del arsenal terapéutico disponible se encuentran los inmunosupresores: ciclofosfamida, micofenolato de mofetilo, anti-calcineurínicos (ciclosporina A y tacrolimus), rituximab (usado habitualmente en caso de fracaso de los anteriores) y levamisol (antihelmíntico no comercializado actualmente en nuestro país, disponible como medicación extranjera)(11,17,18).
Consideraciones respecto a la inmunosupresión
Se debe actualizar y completar el calendario vacunal en todos los niños con SNI cuando sea posible. Las vacunas de virus vivos están contraindicadas mientras reciban tratamiento inmunosupresor.
Dado que todos los niños con SNI van a recibir tratamientos inmunosupresores en algún momento de su evolución, se debe asegurar el cumplimiento del calendario vacunal cuando sea posible. La vacunación puede desencadenar una recaída de SNI, pero la protección que ofrecen supera el riesgo largamente. Estos pacientes deberán recibir un esquema de vacunación antineumocócica que incluya, además de la VNC13 (conjugada), la VNC23 (polisacarídica, indicada a partir de los 2 años de vida). Entre ambas vacunas es necesario un intervalo mínimo de 8 semanas(18,20). Se deberá, además, indicar la vacuna antigripal anual al paciente y a sus convivientes. Si la tasa de anticuerpos anti-varicela del paciente no es protectora, se deberá administrar dosis de refuerzo cuando la situación lo permita(18).
Las vacunas se pueden administrar en pacientes en remisión si tienen una dosis de prednisona <1 mg/kg/día(18). No es recomendable vacunar durante las recaídas, por cuanto el tratamiento inmunosupresor, aun en casos en que no contraindique la vacunación, puede disminuir la respuesta inmunitaria. Están contraindicadas las vacunas de virus vivos (varicela y triple vírica) en pacientes que reciben tratamiento inmunosupresor o tratamiento esteroideo ≥ 2 mg/kg/día durante, al menos, 14 días (≥ 20 mg/día en niños de más de 10 kg)(18,20), desde 4 semanas antes de iniciar el tratamiento hasta 1 mes tras suspender corticoides, micofenolato o anti-calcineurínicos, 3 meses tras suspender ciclofosfamida y 12 meses tras suspender rituximab.
Si está contraindicado vacunar al paciente, se recomienda vacunar a los contactos familiares para disminuir el riesgo de transmisión al paciente inmunodeprimido(18,20).
Función del pediatra de Atención Primaria
Idealmente, el pediatra de Atención Primaria tiene que estar implicado en el control y manejo de los pacientes nefróticos.
Pueden resumirse en las siguientes:
• Supervisar los controles domiciliarios periódicos de proteinuria con tira reactiva para detección de recaídas, adelantando los controles en caso de procesos infecciosos o vacunación.
• Valorar, en pacientes con recaídas frecuentes, la profilaxis de recaídas mediante la administración de prednisona 0,5 mg/kg/día o equivalente durante 5-7 días en los episodios infecciosos.
• Favorecer la adherencia terapéutica de estos pacientes y monitorizar los efectos adversos de los tratamientos empleados, sobre todo de los corticoides.
• Asegurar el cumplimiento del calendario vacunal de estos pacientes, teniendo en cuenta la necesidad de vacunación antineumocócica (VNP13 + VNP23) y antigripal anual, y prestando especial atención a las vacunas de virus vivos, indicando su administración cuando sea posible.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio de los autores.
1. Vehaskari VM, Rapola J. Isolated proteinuria: analysis of a school-age population. J Pediatr. 1982; 101: 661-8.
2.** Ariceta G. Clinical practice: proteinuria. Eur J Pediatr. 2011; 170: 15-20.
3.** Ordóñez FA. Hematuria, proteinuria: actitud diagnóstica. Pediatr Integral. 2017; XXI: 518-28.
4.*** De Lucas C, Izquierdo E. Proteinuria. Protoc diagn ter pediatr. 2022; 1: 81-92. Disponible en: https://www.aeped.es/documentos/protocolos-diagnosticos-y-terapeuticos-nefrologia-pediatrica.
5.*** Rovin BH. Assessment of urinary protein excretion and evaluation of isolated non-nephrotic proteinuria in adults. En: UpToDate, Lam AQ (Ed), UpToDate, Waltham, MA.
6.*** Leung AK, Wong AH, Barg SS. Proteinuria in Children: Evaluation and Differential Diagnosis. Am Fam Physician. 2017; 95: 248-54.
7. Brandt JR, Jacobs A, Raissy HH, Raissy HH, Kelly FM, Staples AO, et al. Orthostatic proteinuria and the spectrum of diurnal variability of urinary protein excretion in healthy children. Pediatr Nephrol. 2010; 25: 1131-7.
8. Ragazzi M, Milani G, Edefonti A, Edefonti A, Burdick L, Bianchetti MG, et al. Left renal vein entrapment: a frequent feature in children with postural proteinuria. Pediatr Nephrol. 2008; 23: 1837-9.
9.** Hogg RJ, Portman RJ, Milliner D, Lemley KV, Eddy A, Ingelfinger J. Evaluation and management of proteinuria and nephrotic syndrome in children: recommendations from a Pediatric Nephrology Panel established at the National Kidney Foundation Conference on proteinuria, albuminuria, risk, assessment, detection, and elimination (PARADE). Pediatrics. 2000; 105: 1242-9.
10. Hama T, Nakanishi K, Shima Y, Shima Y, Mukaiyama H, Togawa H, et al. Renal biopsy criterion in children with asymptomatic constant isolated proteinuria. Nephrol Dial Transplant. 2012; 27: 3186-90.
11.*** Rovin BH, Adler SG, Barratt J, Bridoux F, Burdge KA, Chan TM, et al. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney International. 2021; 100: S1-276.
12.*** Noone DG, Iijima K, Parekh R. Idiopathic nephrotic syndrome in children. Lancet. 2018; 392: 61-74.
13. Rees L, Bockenhayer D, Webb NJA, Punaro MG, editores. Paediatric Nephrology. 3ª Ed. Oxford University Press; 2019. p. 227-30.
14. Cara-Fuentes G, Clapp WL, Johnson RJ, Garin EH. Pathogenesis of proteinuria in idiopathic minimal change disease: molecular mechanisms. Pediatr Nephrol. 2016; 31: 2179-89.
15. Bauer C, Piani F, Banks M, Ordoñez FA, de Lucas-Collantes C, Oshima K, et al. Minimal Change Disease Is Associated With Endothelial Glycocalyx Degradation and Endothelial Activation. Kidney International Reports. 2022; 7: 797-809.
16. Korsgaard T, Andersen RF, Joshi S, Hagstrøm S, Rittig S. Childhood onset steroid-sensitive nephrotic syndrome continues into adulthood. Pediatr Nephrol. 2019; 34: 641-8.
17.*** Kidney Disease: Improving Global Outcomes (KDIGO) Glomerular Diseases Work Group. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney Int. 2021; 100: S1-S276.
18.*** Román Ortiz E. Síndrome nefrótico pediátrico. Protoc diagn ter pediatr. 2022; 1: 317-37. Disponible en: https://www.aeped.es/documentos/protocolos-diagnosticos-y-terapeuticos-nefrologia-pediatrica.
19. Abeyagunawardena AS, Thalgahagoda RS, Dissanayake PV, Abeyagunawardena S, Illangasekera YA, Karunadasa UI, et al. Short courses of daily prednisolone during upper respiratory tract infections reduce relapse frequency in childhood nephrotic syndrome. Pediatr Nephrol. 2017; 32: 1377-82.
20.** Manual de Vacunas en línea de la AEP. Capítulo 14: Vacunación en niños inmunodeprimidos o tratamiento inmunosupresor. Publicado por el Comité Asesor de Vacunas de la AEP. Disponible en https://vacunasaep.org.
Bibliografía recomendada
– Ariceta G. Clinical practice: proteinuria. Eur J Pediatr. 2011; 170: 15-20.
Revisión sencilla de aspectos diagnósticos y características clínicas de la proteinuria desde una perspectiva eminentemente práctica.
– De Lucas C, Izquierdo E. Proteinuria. Protoc diagn ter pediatr. 2022; 1: 81-92. Disponible en: https://www.aeped.es/documentos/protocolos-diagnosticos-y-terapeuticos-nefrologia-pediatrica.
Protocolo docente actualizado promovido por la Asociación Española de Pediatría y la Asociación Española de Nefrología Pediátrica.
– Leung AK, Wong AH, Barg SS. Proteinuria in Children: Evaluation and Differential Diagnosis. Am Fam Physician. 2017; 95: 248-54.
Revisión teórica estructurada, incluyendo medidas generales a nivel diagnóstico y terapéutico.
– Rovin BH, Adler SG, Barratt J, Bridoux F, Burdge KA, Chan TM, et al. KDIGO 2021 Clinical Practice Guideline for the Management of Glomerular Diseases. Kidney International. 2021; 100: S1-276.
Guía de práctica clínica KDIGO 2021 para el manejo de enfermedades glomerulares. Incluye un capítulo completo dedicado al síndrome nefrótico pediátrico. Cita bibliográfica de cabecera en la patología, con especial énfasis en su tratamiento esteroideo e inmunosupresor.
– Román Ortiz E. Síndrome nefrótico pediátrico. Protoc diagn ter pediatr. 2022; 1: 317-37. Disponible en: https://www.aeped.es/documentos/protocolos-diagnosticos-y-terapeuticos-nefrologia-pediatrica.
Protocolo docente recientemente publicado y promovido por la Asociación Española de Pediatría y la Asociación Española de Nefrología Pediátrica.
– Manual de Vacunas en línea de la AEP. Capítulo 14: Vacunación en niños inmunodeprimidos o tratamiento inmunosupresor. Publicado por el Comité Asesor de Vacunas de la AEP. Disponible en: https://vacunasaep.org.
Documento del Comité Asesor de Vacunas de la Asociación Española de Pediatría sobre pacientes inmunodeprimidos. Útil para conocer las pautas de inmunización correctas en pacientes bajo tratamiento esteroideo o de otros inmunosupresores.
| Caso clínico |
|
Usted tiene en su cupo de Atención Primaria un niño de 6 años de edad con un trasplante renal normofuncionante realizado a los 3 años. La patología de base de su enfermedad renal crónica terminal fue una necrosis cortical secundaria a un shock hemorrágico neonatal. Recibe pauta habitual de triple inmunosupresión con prednisona, tacrolimus y micofenolato de mofetilo, sin modificaciones recientes de dosis. En una revisión programada en el hospital de referencia, se detecta proteinuria de 2 cruces en la tira reactiva de orina, no identificada anteriormente. No refieren incidencias desde la revisión previa, aunque desde hace unos días presenta un cuadro catarral de vías altas, sin fiebre. Exploración física Peso: 24,1 kg (+0,34 DE). Talla: 114,3 cm (–0,77 DE). Superficie corporal: 0,87 m2. Tensión arterial: 106/56 mm Hg. Sin edemas periféricos aparentes. Sin dificultad respiratoria. ACP con ruidos transmitidos de vías altas. Abdomen normal. ORL: leve congestión faringoamigdalar. Exámenes complementarios Hemograma: hemoglobina: 12,9 g/dl; leucocitos: 12.000/mcl; plaquetas: 459.000/mcl. Bioquímica sanguínea: glucosa: 78 mg/dl; creatinina: 0,47 mg/dl (previa, 0,48 mg/dl); urea: 40 mg/dl (previa, 38 mg/dl); sodio: 141 mEq/l; potasio: 4,7 mEq/l; cloro: 102 mEq/l; calcio: 10,12 mg/dl; fosfato: 5,26 mg/dl; magnesio: 1,63 mg/dl; urato: 3,1 mg/dl; colesterol: 172 mg/dl; triglicéridos: 64 mg/dl; proteínas totales: 6,6 g/dl; albúmina: 4,6 g/dl. Niveles valle de tacrolimus: 5,2 ng/ml (rango normal). Orina (micción aislada): proteínas 3 cruces, sedimento normal, cociente proteína/creatinina 0,87 mg/mg. Evolución inicial Dado que el paciente reside a casi dos horas del centro hospitalario de referencia, el nefrólogo pediátrico donde se controla el paciente se pone en contacto con usted para que acuda a su consulta de Atención Primaria durante los próximos días, con vistas a repetir la tira reactiva de orina y entregar una muestra de orina de 24 horas en su Centro de Salud. La tira reactiva de orina demuestra proteinuria de 2-3 cruces en 3 determinaciones realizadas, siendo negativas en otras dos muestras. Orina de 24 horas: volumen 850 ml/24 h, creatinina 395 mg/24 h, proteínas totales 0,578 g/24 h. El nefrólogo pediátrico programa una nueva consulta hospitalaria una semana después y se repite el estudio analítico. Hemograma: hemoglobina: 12,7 g/dl; leucocitos: 9.700/mcl; plaquetas: 336.000/mcl. Bioquímica sanguínea: glucosa: 99 mg/dl; creatinina: 0,49 mg/dl; urea: 37 mg/dl; sodio: 138 mEq/l; potasio: 4,5 mEq/l; cloro: 101 mEq/l; calcio: 10,2 mg/dl; fosfato: 4,9 mg/dl; magnesio: 1,77 mg/dl; urato: 3,8 mg/dl; colesterol: 179 mg/dl; triglicéridos: 74 mg/dl; proteínas totales: 6,6 g/dl; albúmina: 4,5 g/dl. Niveles valle de tacrolimus: 5,5 ng/ml (rango normal). Orina (micción aislada): proteínas 2 cruces, sedimento normal, cociente proteína/creatinina 0,99 mg/mg. Ecografía doppler de injerto renal: sin alteraciones. Evolución posterior Ante la normalidad de las pruebas analíticas y de la ecografía doppler se mantiene actitud conservadora. Se vuelve a citar en consulta dos semanas después, indicándole a la familia que recoja en el domicilio la primera micción de la mañana. En esta se realiza una tira reactiva de orina (proteinuria negativa) y un cociente proteína/creatinina (0,18 mg/mg) y se solicita una nueva muestra en la propia consulta (proteínas 3 cruces, cociente proteína/creatinina 0,95 mg/mg). El resto de analítica realizada ese día se mantiene estable. Durante las posteriores revisiones, se indica a la familia que de manera sistemática acudan a la consulta con una muestra de orina de la primera micción de la mañana obtenida en el domicilio, siendo negativas para proteinuria en todas ellas. De forma intermitente, las determinaciones de orina en consulta también han sido negativas, aunque ocasionalmente presenta proteinuria de 2-3 cruces y cocientes proteína/creatinina patológicos.
|






 Hypercalciuria and hypocitraturia. The concept of prelithiasis in Pediatrics
Hypercalciuria and hypocitraturia. The concept of prelithiasis in Pediatrics 