 |
| Temas de FC |
V.M. García Nieto*, T. Moraleda Mesa**, P. Tejera Carreño***
*Sección de Nefrología Pediátrica del Hospital Universitario Nuestra Señora de Candelaria, Santa Cruz de Tenerife. **Servicio de Pediatría del Hospital Universitario Poniente, El Ejido. Almería. ***Sección de Nefrología Pediátrica del Hospital Universitario Materno-Infantil, Las Palmas de Gran Canaria
| Resumen
La litiasis renal es una situación patológica multifactorial donde se produce una alteración de las condiciones naturales de cristalización de la orina. Hay sustancias en la orina que, al estar elevadas, favorecen la formación de cálculos (favorecedores: calcio, oxalato, ácido úrico, cistina) y otras que lo harán en el caso de encontrarse reducidas (inhibidores: citrato, magnesio). El diagnóstico metabólico se puede realizar en orina de 24 horas o determinando los cocientes urinarios en la primera orina del día. La prelitiasis es aquella situación en la que aún no se han formado los cálculos, pero en la que se detecta una anomalía metabólica potencialmente causante de su formación. La prelitiasis puede presentarse en forma de hematuria macro o microscópica, leucocituria estéril, disuria, polaquiuria, urgencia miccional, enuresis nocturna, dolor abdominal recurrente, proteinuria discreta e infecciones urinarias. Morfológicamente, puede observarse cristaluria en el sedimento urinario o partículas hiperecogénicas móviles en la ecografía vesical. El cociente calcio/citrato es un buen argumento para determinar si existe un riesgo litogénico elevado. El tratamiento se basará fundamentalmente en una serie de normas dietéticas protectoras y, en el caso de no mejorar la sintomatología clínica o de presentar cálculos, se optará por medidas farmacológicas (tiazidas, sales de citrato, bifosfonatos). |
| Abstract
Renal lithiasis is a multifactorial pathological situation where alteration of the natural conditions of urine crystallization occurs. There are substances in the urine that, when elevated, favor the formation of stones (promoters: calcium, oxalate, uric acid, cystine) and others that will do so if they are reduced (inhibitors: citrate, magnesium). The metabolic diagnosis can be made in 24-hour urine or by determining urinary ratios in the first urine of the day. Prelithiasis is a situation where stones have not yet formed, but where a metabolic abnormality potentially causing stone formation is detected. Prelithiasis may present as macro- or microscopic hematuria, sterile leukocyturia, dysuria, pollakiuria, urinary urgency, nocturnal enuresis, recurrent abdominal pain, mild proteinuria and urinary tract infections. Morphologically, crystalluria may be seen in the urinary sediment or mobile hyperechogenic particles on bladder ultrasound. The calcium/citrate ratio is a good argument for determining whether there is an elevated lithogenic risk. Treatment will be based primarily on a series of protective dietary guidelines and, if clinical symptoms do not improve or if stones are present, pharmacological measures (thiazides, citrate salts, bisphosphonates) will be chosen. |
Palabras clave: Hipercalciuria idiopática; Hipocitraturia; Prelitiasis; Riesgo litiásico.
Key words: Idiopathic hypercalciuria; Hypocitraturia; Prelithiasis; Lithogenic risk.
Pediatr Integral 2022; XXVI (8): 492 – 500
OBJETIVOS
• Conocer las bases morfológicas y metabólicas de la litiasis renal en la infancia.
• Entender qué factores favorecen la formación de cálculos y cuáles son protectores.
• Aprender los métodos funcionales renales necesarios para saber si la concentración de una sustancia implicada en la urolitiasis está alterada.
• Conocer los síntomas y signos que se asocian con la prelitiasis en niños y la mejor forma de diagnosticarla.
• Realizar una adecuada orientación terapéutica desde el inicio del seguimiento de los pacientes con litiasis o prelitiasis.
• Conocer el significado y la importancia de la determinación de la calciuria y la citraturia.
Hipercalciuria e hipocitraturia. El concepto de prelitiasis en Pediatría
Litiasis renal
La litiasis renal es una situación patológica multifactorial. Los cálculos se pueden producir: por un exceso de la concentración de sustancias favorecedoras, por una reducción de la concentración de inhibidores de la cristalización, por la existencia de nucleantes heterogéneos y por la existencia de cavidades renales de baja eficacia urodinámica. Si se dispone del cálculo se debe estudiar su composición química. Además, se debe determinar la concentración urinaria de calcio, oxalato, ácido úrico, cistina, magnesio y citrato.
Generalidades
La litiasis renal puede definirse como una alteración de las condiciones naturales de cristalización de la orina. Los factores que participan en la formación de los cristales pueden ser muy diversos y, por este motivo, la litiasis renal es una situación patológica multifactorial. El tiempo que se requiere para generar un cristal depende fundamentalmente: de su propia naturaleza, de la sobresaturación de la disolución (exceso de soluto en la disolución: fuerza impulsora de la cristalización), de la presencia de partículas sólidas preexistentes (los llamados nucleantes heterogéneos) y de la presencia de inhibidores de la cristalización. Estos últimos son sustancias que debido a su estructura química interaccionan con el núcleo o las caras del cristal, interfiriendo notablemente en su formación o/y desarrollo, reduciendo o previniendo los procesos de cristalización. Todas las orinas humanas están sobresaturadas con respecto al oxalato cálcico(1), de tal modo que el grado de sobresaturación resulta más elevado en los individuos con hipercalciuria y/o hiperoxaluria. La orina humana puede contener además una amplia variedad de nucleantes heterogéneos, tales como: agregados proteicos, epitelios renales alterados o bacterias. Es evidente que el tiempo es una variable muy importante en estos procesos de formación de cristales. Así, es evidente que al aumentar el tiempo de permanencia de la orina en el tracto urinario (principalmente en las vías altas), se incrementa la posibilidad de que los procesos de cristalización conduzcan a la formación de cálculos renales. La existencia de cavidades renales de baja eficacia urodinámica constituye un importante factor de riesgo del desarrollo de cálculos. De hecho, se ha demostrado que los factores morfoanatómicos pueden jugar un importante papel en la calculogénesis. Así, se explicaría que un paciente recidivante, en el que es de suponer que la orina tendrá la misma composición en los dos riñones, solo forme cálculos en uno de ellos(1). Cuando el desarrollo de cristales se produce en la vejiga urinaria, normalmente se eliminan sin dificultad en forma de cristaluria asintomática.
Clasificación de los cálculos renales
Cada tipo de cálculo se forma debido a unos factores etiológicos específicos que se pueden deducir a partir de su composición, así como de la macro y la microestructura del mismo(1).
Independientemente de su composición química, los cálculos renales pueden clasificarse de manera amplia en dos grandes categorías: cálculos formados sobre las paredes renales (unidos a las papilas), en los que claramente se distingue la zona de unión al epitelio, y cálculos desarrollados en las cavidades renales (sin zona de unión al epitelio).
Someramente, la composición habitual y frecuencia de los cálculos es la siguiente(1):
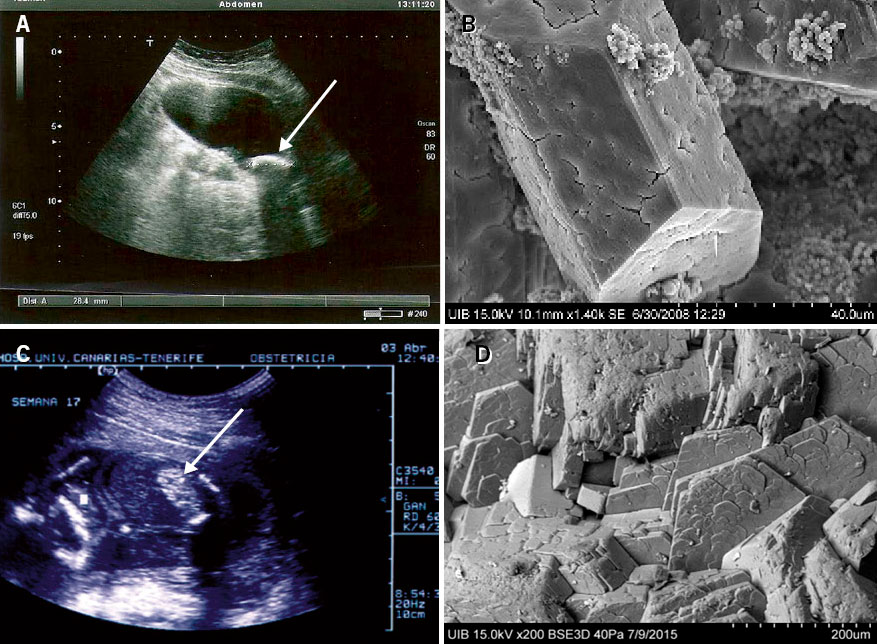
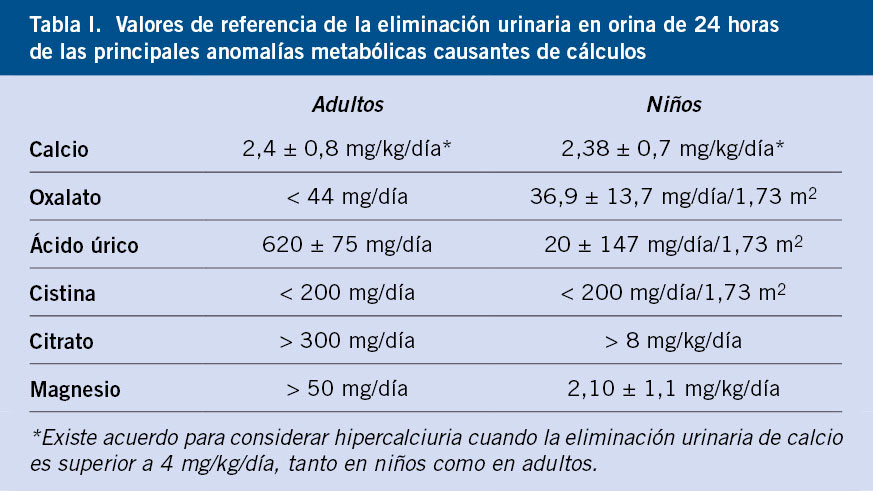
• Cálculos de oxalato cálcico dihidrato (33,8 % de las litiasis). Se observan especialmente en pacientes con hipercalciuria y/o con el cociente calcio/citrato elevado(2) (Figs. 1A y 1B).
Figura 1. Paciente con hipercalciuria idiopática: A. Cálculo ecográfico con la sombra sónica característica (flecha blanca). B. Cálculo de oxalato cálcico dihidrato. Vista al microscopio electrónico de barrido con la típica morfología en punta de lanza. Su superficie muestra signos de inicio de disolución en un proceso de transformación en oxalato cálcico monohidrato. Paciente con oxalosis tipo 1: a los 23 meses de edad, tuvo una insuficiencia renal aguda obstructiva por cálculos bilaterales que precisó la colocación bilateral de sendos catéteres doble J. C. Cálculo enclavado en la unión vesicoureteral (flecha negra). D. Cálculo de oxalato cálcico monohidrato. Se observa la típica estructura columnar compacta propia de estos casos. Imágenes de microscopia electrónica procedentes del Laboratori d’Investigació en Litiasi Renal, Universitat de les Illes Balears, Palma de Mallorca (Dr. Félix Grases).
• Cálculos de oxalato cálcico monohidrato de cavidad (16,4 % de las litiasis). Se forman en zonas de las vías urinarias donde la orina queda en situación de estasis (cavidades de baja eficacia urodinámica) junto a hiperoxaluria (Figs. 1C y 1D) o a un déficit de inhibidores de la cristalización.
• Cálculos de oxalato cálcico monohidrato papilar (12,9 % de las litiasis). Se asocian con hiperoxaluria o a un déficit de inhibidores de la cristalización.
• Cálculos de ácido úrico (8,2 % de las litiasis) o mixtos de oxalato cálcico monohidrato y ácido úrico (2,6 % de las litiasis). Se observan en pacientes con orinas ácidas e hiperuricosuria.
• Cálculos de hidroxiapatita (fosfato cálcico) (7,1 % de las litiasis) o de oxalato cálcico dihidrato e hidroxiapatita (11,2 % de los cálculos). Se crean en pacientes con orinas alcalinas, hipercalciuria y/o déficit de inhibidores de la cristalización, como la hipocitraturia (cociente calcio/citrato elevado)(2), particularmente en la acidosis tubular renal.
• Cálculos de fosfato amónico magnésico o estruvita (4,1 % de las litiasis). Se producen en infecciones urinarias causadas por gérmenes ureolíticos, como Proteus mirabilis (Figs. 2A y 2B).
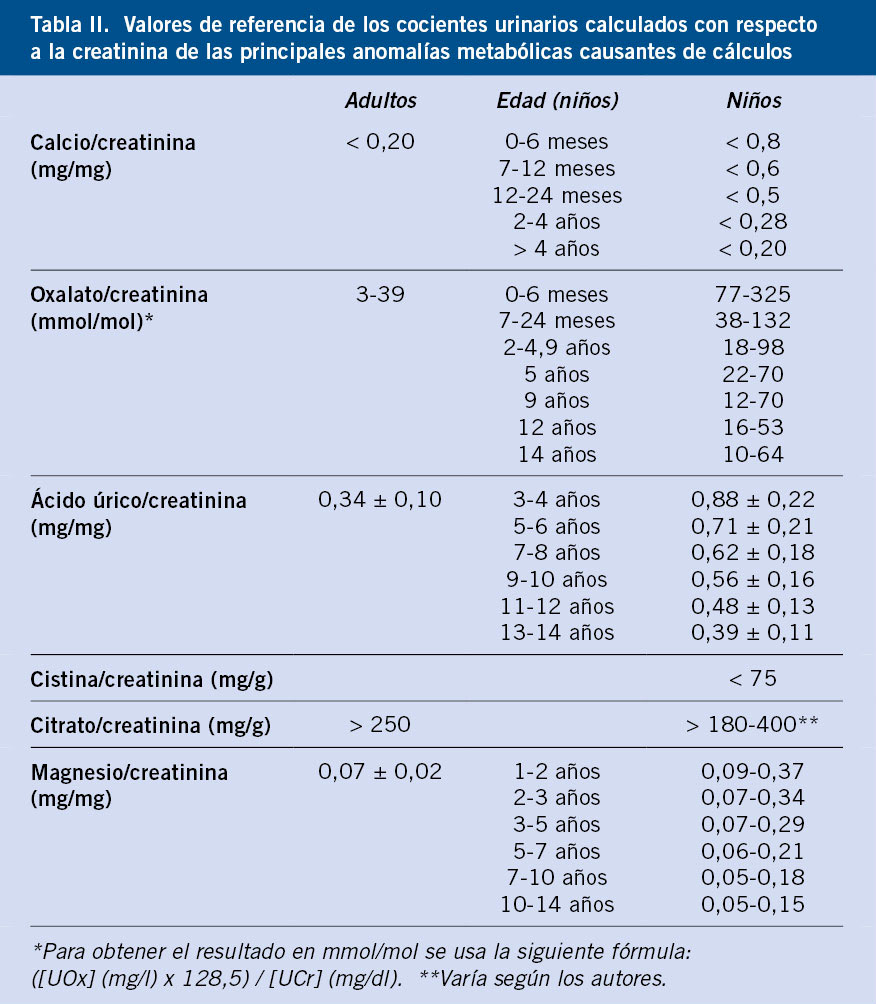
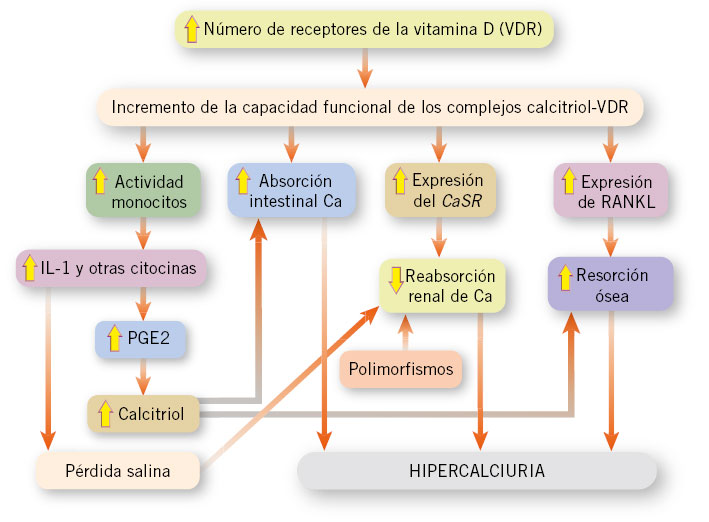
Figura 2. Paciente diagnosticada al nacer de mielomeningocele en cuya evolución tuvo varios urocultivos positivos a Proteus mirabilis y Citrobacter: A. Cálculo vesical (flecha blanca) que precisó extracción quirúrgica. B. Se observaron grandes cristales de fosfato amónico magnésico (estruvita) y algunas zonas de esferulitos de hidroxiapatita. En las caras del cristal de estruvita se observan las marcas en “Y” que permiten su rápida identificación. Niño con cistinuria: C. Durante la gestación se detectaron en los controles ecográficos fetales una hiperecogenicidad del colon (flecha blanca) en ausencia de otras anomalías intestinales, compatible con cristales de cistina. D. Cristales de cistina con la típica morfología hexagonal. Imágenes de microscopia electrónica procedentes del Laboratori d’Investigació en Litiasi Renal, Universitat de les Illes Balears, Palma de Mallorca (Dr. Félix Grases).
• Cálculos de cistina (1,1 % de las litiasis) propios de la tubulopatía proximal simple, cistinuria (Figs. 2C y 2D).
Anomalías metabólicas causantes de cálculos
En la práctica clínica suelen determinarse las concentraciones de: calcio, ácido úrico, oxalato, cistina, citrato y magnesio. Los cuatro primeros favorecen la formación de cálculos cuando su concentración en la orina es elevada (favorecedores). En cambio, citrato y magnesio propician su formación cuando sus cantidades urinarias son reducidas (inhibidores). Aunque no se determinan en la práctica diaria, además del citrato y el magnesio, otras sustancias como pirofosfato, ciertos glicosaminoglicanos, nefrocalcina y fitato, actúan inhibiendo la formación de los cristales de oxalato de calcio y de fosfato de calcio. El fitato, presente en la cáscara de los cereales y en las legumbres, es un potente inhibidor de la cristalización.
Los solutos mencionados más arriba pueden medirse en orina de 24 horas (Tabla I) o en muestras aisladas de orina.
Se debe confirmar que la recogida horaria urinaria es correcta mediante el cálculo de la eliminación urinaria de creatinina (normal: 14-26 mg/kg/día). En la actualidad, cada vez se usan más los cocientes urinarios por su facilidad en la recogida de las muestras, especialmente, en la infancia y porque la concentración, especialmente, de calcio y citrato, pueden variar en distintos momentos del día(3). Por esta razón, algunos de nosotros preferimos en niños, determinar los cocientes urinarios en dos muestras de orina recogidas en dos periodos, a saber, de noche (antes de la cena) y en la primera orina de la mañana. En todo caso, los cocientes urinarios son muy útiles, especialmente, en el seguimiento de los pacientes (Tabla II). En el caso particular del ácido úrico se ha propuesto calcular el índice de excreción, por lo que debe determinarse tanto en sangre como en orina. La fórmula es: ([ácido úrico]u × [creatinina]p)/[creatinina]u. Se consideran elevados unos valores superiores a 0,53 mg/100 ml FGR (Filtrado glomerular renal).
Hipercalciuria idiopática
La hipercalciuria idiopática es la causa más frecuente de cálculos, tanto en niños como en la edad adulta. La concentración de calcio urinario debe estar elevada en ausencia de hipercalcemia. Puede debutar en forma de litiasis, pero con frecuencia asocia síntomas diversos (prelitiasis) como: hematuria, síntomas miccionales, infección urinaria y dolor abdominal. La causa ha sido muy discutida durante décadas, pero es probable que se deba a un incremento del número de receptores de la vitamina D. La ecografía renal es mandatoria, pero no lo es la densitometría ósea. Es importante saber que no se trata de una enfermedad, sino de una anomalía metabólica. Por ello, el tratamiento debe ser dietético intentando incrementar la concentración urinaria de los factores protectores y de reducir la de calcio.
Definición
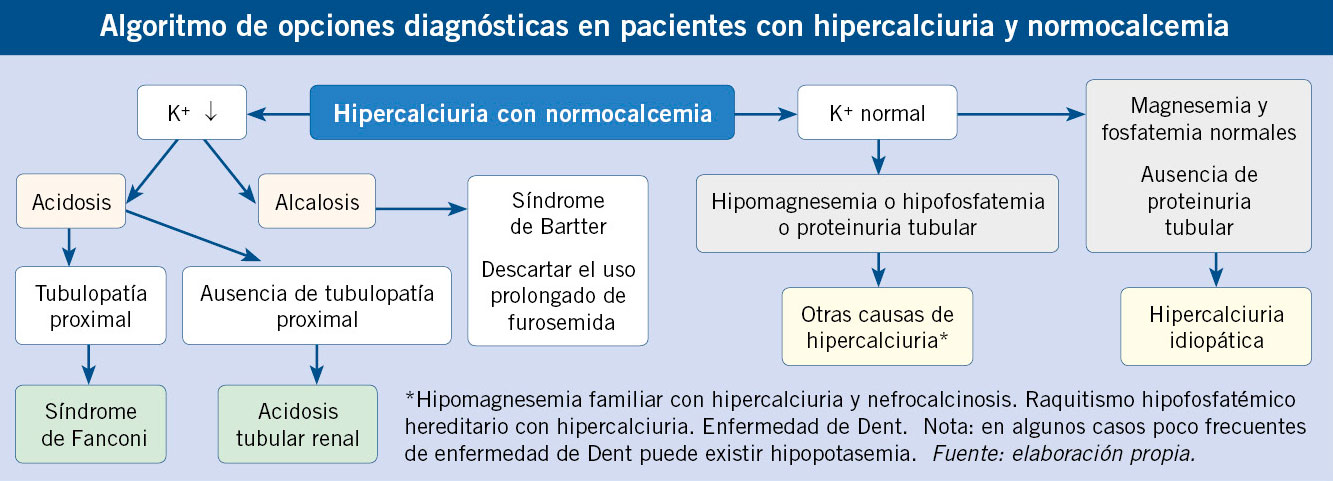
La hipercalciuria idiopática (HI) se define como aquella situación clínica en la que se comprueba un incremento en la eliminación urinaria de calcio, en ausencia de hipercalcemia y de otras causas conocidas de hipercalciuria (Algoritmo). Es la causa más frecuente de litiasis renal, tanto en la edad pediátrica como en la adulta (alrededor del 40 % en series de niños y del 60 % en las de adultos). La HI es una de las anomalías metabólicas más frecuentes en el ser humano, de tal modo que se han referido tasas de prevalencia en población sana, según los países, entre 0,6 y 12,5 %. En España, las tasas de prevalencia descritas oscilan entre 3,8 y 7,8 %(4).
Clínica
Inicialmente, la HI solo se asoció con cólicos nefríticos y expulsión de cálculos. En las últimas décadas, su diagnóstico ha sido mucho más frecuente que antaño, debido a que se ha conocido que puede debutar en la edad pediátrica con síntomas muy diversos en ausencia de la formación de cálculos renales. En este sentido, en 1981, tres grupos pediátricos diferentes publicaron que la hematuria macro o microscópica podía ser una manifestación de HI y, por tanto, ser un dato precursor de la capacidad potencial de padecer cólicos nefríticos años más tarde. El autor del tercero de estos trabajos, Moore, registró que los niños afectos de HI podían debutar, aparte de con litiasis, con otros síntomas o signos como: disuria, leucocituria estéril, enuresis nocturna, polaquiuria, urgencia miccional e, incluso, proteinuria discreta(5). Poco después, se publicaría la asociación entre infección de vías urinarias (IVU) e HI(6).
Posteriormente, se confirmó en diversos trabajos la relación entre microhematuria o hematuria macroscópica (color de la sangre y, en muchas ocasiones, al final de la micción) y la presencia de HI, de tal modo que del 25 al 42 % de los niños remitidos a centros de referencia por hematuria tienen HI. No obstante, la hematuria no es específica de la HI, puesto que otras anomalías metabólicas causantes de litiasis, como hiperuricosuria o hiperoxaluria, pueden asociarse con hematuria. La producción de hipercalciuria experimental durante corto tiempo no se acompaña de hematuria, por lo que se supone que cualquier anomalía metabólica causante de litiasis puede producir microcristales, una lesión del epitelio tubular renal y hematuria secundaria. Además, un grupo del Hospital 12 de octubre de Madrid ha descrito la asociación de hipercalciuria, hiperuricosuria y nefrolitiasis con nefropatía de las membranas basales finas(7). La presencia de dolor abdominal recurrente “no típico de cólico renal” se ha asociado, asimismo, con HI.
Mención especial merece la asociación entre HI e IVU. En 1987, Cervera et al., miembros del Hospital Gregorio Marañón de Madrid, publicaron que la frecuencia de IVU en sus pacientes con HI era de 48,9 %(6), lo que contrasta con la prevalencia estimada de IVU en población general que es del orden de 1-2 % en varones y de 3-5 % en niñas. Esos datos iniciales fueron confirmados posteriormente en varios trabajos. Del mismo modo y a la inversa, se ha descrito que la frecuencia de hipercalciuria en series de niños con IVU oscila entre el 20 y 44 %. En un trabajo reciente publicado por nuestro Grupo hemos observado que la frecuencia de prelitiasis (incluyendo el cálculo del cociente calcio/citrato) en niños con IVU por Escherichia coli era de 47,5 % y existía una historia familiar positiva para urolitiasis en el 68,3 % de los casos(8). En ese artículo postulamos que los niños con prelitiasis, de alguna forma deben tener una capacidad defensiva constitutiva reducida frente a esas bacterias. En este sentido, es muy significativa nuestra observación de una mayor frecuencia de cicatrices renales en los niños con prelitiasis, en relación con aquellos con un estudio metabólico urinario normal(8).
Teorías patogénicas. Las ratas hipercalciúricas
Durante el último tercio del siglo pasado se sucedió la enunciación de distintas teorías patogénicas de la HI que intentaban explicarla a partir de la existencia de una pérdida urinaria tubular renal de calcio, un aumento de su absorción intestinal, o bien, un incremento de la resorción ósea, además de un origen dietético ligado a un exceso en la ingesta de sodio y/o de proteínas. Todas estas teorías han sido repasadas en una publicación reciente firmada por nuestro Grupo(9). En 1990, Pacifici et al. demostraron que los monocitos sanguíneos aislados de pacientes con HI producían una cantidad incrementada de citocinas, tales como: la interleucina-1α (IL-1), el factor estimulante de colonias de los granulocitos-macrófagos y el factor de necrosis tumoral-α (TNF-α). Un incremento de la actividad de estas citocinas tendría la capacidad de reducir la densidad mineral ósea de los pacientes con HI. No obstante, no se conocía la razón por la que los monocitos eran estimulados para incrementar la producción de citocinas.
En 1979, se describió la existencia de ratas con hipercalciuria espontánea (genetic hypercalciuric stone-forming, GHS). Al favorecer el cruzamiento entre ellas se comprobó un sucesivo incremento de la calciuria en las siguientes generaciones. En busca del mecanismo de la hipercalciuria, Bushinsky y Favus observaron que las ratas de la cuarta generación tenían una marcada eliminación urinaria de calcio gracias a la existencia de un incremento de la absorción intestinal de calcio, si bien los niveles de calcitriol eran normales. Cuando se sometió a las ratas a una dieta reducida en calcio, se comprobó un descenso de la calciuria, aunque sin normalizarse, lo que sugería que el incremento en la absorción intestinal de calcio era un mecanismo que explicaba, al menos en parte, la hipercalciuria observada en estos animales. En 1993, se demostró que en estos existía un incremento en el número de receptores de la vitamina D (VDR) del intestino(10), lo que favorecía un aumento de la capacidad funcional de los complejos calcitriol-VDR que explicaba, por ende, el incremento en el transporte intestinal de calcio previamente descrito. A continuación, se comprobó que, en estos animales, existía una respuesta incrementada de los VDR a mínimas dosis de calcitriol, lo que implica que no eran necesarios niveles muy elevados del mismo para amplificar su respuesta e incrementar sobremanera la calciuria. En efecto, Krieger et al. mostraron que ese incremento de la sensibilidad al calcitriol se expresaba, asimismo, en los huesos de esos animales induciendo una mayor resorción ósea(11), con lo que parecía demostrarse que el hueso juega, asimismo, un papel en el desarrollo de la hipercalciuria. Más tarde, se comprobó que en las ratas GHS existe, asimismo, un defecto en la reabsorción tubular renal de calcio.
En resumen, las ratas hipercalciuricas tienen muchos datos en común con los humanos con HI, a saber: niveles normales de calcemia, hiperabsorción intestinal de calcio, incremento de la resorción ósea y un defecto en la reabsorción tubular renal de calcio. Además, sus niveles de calcitriol son normales, del mismo modo que la mayoría de los pacientes con HI.
En 2004, Favus et al. demostraron que los monocitos periféricos de los humanos con HI tienen un incremento del número de VDR(12), es decir, lo mismo que se había observado previamente en las ratas hipercalciúricas(10).
En la figura 3 se muestra la propuesta de un esquema fisiopatológico de la HI, en el que se indica que la causa de la HI estaría en relación con la existencia de un incremento del número de VDR, tanto en las células intestinales y óseas (osteoclastos) como en los monocitos periféricos.
Figura 3. Esquema fisiopatológico de la hipercalciuria idiopática (HI) en el que se muestra que la causa de la HI estaría en relación con la existencia de un incremento del número de receptores para la vitamina D, tanto en las células intestinales y óseas (osteoclastos), como en los monocitos periféricos. VDR: receptor de la vitamina D; CaSR: receptor sensible a calcio; IL-1: interleucina-1α PGE2: prostaglandina E2; RANKL: factor nuclear kappaB (NF-κB).
Elaboración propia. García-Vao Bel CM, García-Nieto VM, Teixeira Trindade AA. Hipercalciuria idiopática. En: Nefrología Pediátrica. Exeni R, García-Nieto V, Medeiros M, Santos F, eds. Oviedo: Ediciones de la Universidad de Oviedo; 2021. p. 999-1004.
Diagnóstico y exámenes complementarios
La determinación de la calciuria en orina de 24 horas en pacientes continentes, es el criterio estándar para el diagnóstico de hipercalciuria. El diagnóstico se realiza si la calciuria es superior a 4 mg/kg/día y se confirma en una segunda determinación o si se observa un valor elevado del cociente calcio/creatinina en orina aislada (Tabla II). En un ambiente familiar de hipercalciuria y/o litiasis renal pueden obviarse o retrasarse las determinaciones sanguíneas; puesto que, habitualmente, serán normales. No obstante, para confirmar que un paciente con hipercalciuria tiene una HI, deben ser normales los niveles sanguíneos de calcio, sodio, potasio, cloro, fosfato, magnesio y PTH intacta, así como el equilibrio ácido base (Algoritmo).
La ecografía renal es mandatoria para descartar la existencia de litiasis, microcálculos (concreciones de menos de tres milímetros de diámetro sin sombra acústica), nefrocalcinosis y malformaciones asociadas, ya que muchas malformaciones renales se acompañan de hipercalciuria.
Si se han producido fracturas o existen dolores óseos frecuentes, estaría indicada la realización de una densitometría ósea. Es necesario ser precavidos antes de valorarse el tratamiento farmacológico ante una pérdida de masa ósea; puesto que, en muchos casos, especialmente a partir de la pubertad, se asiste a una mejoría espontanea de la densidad mineral ósea(13).
Tratamiento
En nuestra opinión, la HI no es una enfermedad sino una “anomalía metabólica” o, mejor, una característica metabólica constitutiva que se hereda como el color de la piel, el número de dedos de la mano o la talla final. En este sentido, lo que los pacientes con HI heredarían es la disponibilidad de tener en sus células un mayor número de VDR que las personas con calciurias normales. Aunque transmiten la condición a su descendencia, muchas personas no forman cálculos ni tienen reducción de la masa ósea o permanecen asintomáticas durante largos periodos de tiempo(9). Por esta razón, no se puede considerar una enfermedad stricto sensu, aunque pueda predisponer en algunos casos a la formación de cálculos renales, a la aparición de infecciones urinarias y al desarrollo de osteopenia a largo plazo. Esta es razón fundamental por la que el uso de tratamiento farmacológico prolongado debe ser seleccionado.
La normalización de la calciuria no debe ser un objetivo universal en el tratamiento de estos niños, ya que puede reducirse espontáneamente a lo largo de los años y/o que se puede evitar la formación de cálculos con una dieta rica en factores protectores. En muchos casos, la calciuria se mantiene elevada a pesar de unas normas dietéticas correctas. Más bien, el objetivo del tratamiento dietético debe ser reducir el riesgo de cristalización, lo que se consigue incrementado el volumen urinario y reduciendo el valor del cociente calcio/citrato (v. más adelante). Debe evitarse en la medida de lo posible crear conciencia de enfermedad, de tal modo que las recomendaciones dietéticas no deben ser exhaustivas. La ampliación del ejercicio físico es muy beneficiosa para mejorar la densidad mineral ósea.
Al diagnóstico, salvo síntomas graves, debe insistirse en las normas dietéticas, en vías de conseguir un incremento en la ganancia de factores protectores de la formación de cálculos, mediante un aumento de la ingesta de agua, frutas (sobre todo, cítricos ricos en citrato), verduras (aportan agua y magnesio), pescado azul (por su riqueza en ácidos grasos ω-3) y cereales integrales (por su riqueza en fitato) (Tabla III).
Existe, además, un producto comercializado a base de fitato (Broken®). En ocasiones, es difícil conseguir que los niños litiásicos o prelitiásicos beban suficiente agua, porque muchos de ellos tienen una capacidad de concentración permanentemente estimulada. Este hecho es de difícil interpretación salvo en aquellos con hiperhidrosis palmoplantar; en estos casos, se debe estimular el consumo de frutas y verduras que son ricas en agua en su composición. Respecto al agua de bebida no son precisas las aguas a/hipomineralizadas. Basta que no sean hipermineralizadas (“aguas duras”).
Para reducir los factores favorecedores de la formación litiásica, debe evitarse el exceso de consumo de sal y proteínas (Tabla III).
El tratamiento farmacológico debe reservarse para dos circunstancias. En primer lugar, cuando existen datos clínicos marcados como: disuria mantenida, hematuria macroscópica frecuente, o bien, cólicos nefríticos de repetición. En segundo lugar, cuando en la ecografía se observan cálculos o nefrocalcinosis. Incluso, ante la presencia de microcálculos, podría estar indicado el tratamiento dietético, al menos durante un año, para observar la evolución. Se dispone de cuatro tipos de preparados, a saber: citrato potásico, tiazidas, bifosfonatos y los productos comercializados a base de fitato.
Las sales de citrato (Acalka®, solución de Shohl, Polycitra, Polycitra K) no normalizan la calciuria salvo que exista un defecto de acidificación, pero forman complejos con el calcio y la formación de sales de oxalato y de fosfato cálcicos. Se debe optar como diana terapéutica, mantener un índice calcio/citrato <0,33 mg/mg. En niños, hemos usado la administración de una única dosis nocturna (“los cálculos se forman de noche”) con buenos resultados.
En caso de no tolerarse el citrato o de no producirse una mejoría, se sustituye por hidroclorotiazida: 1,5-2,5 mg/kg en dosis única matutina. Las tiazidas estimulan el transporte transcelular de calcio en el túbulo contorneado distal. Hay que recordar que pueden tener efectos secundarios como: hipopotasemia, hipomagnesemia y aumento de los niveles plasmáticos de glucosa, urato, colesterol y LDL. Su uso no debería ser prolongado.
En casos de osteopenia severa se ha probado el efecto antirresortivo de los bifosfonatos en adultos y en adolescentes hipercalciúricos con desmineralización ósea. Además, se reduce la calciuria.
Nosotros utilizamos los productos comercializados a base de fitato (Broken®) administrados por las noches en los casos en los que existe una duda razonable sobre si iniciar o no tratamiento farmacológico, como es el caso de los microcálculos para observar la evolución durante un corto plazo o en el caso de que no se toleren los preparados a base de citrato.
El concepto de prelitiasis. El cociente calcio/citrato
El concepto de prelitiasis, aunque no se ha generalizado, incluye a los pacientes portadores de anomalías metabólicas causantes de cálculos antes de que tengan clínica de cólico nefrítico. Es un término básicamente pediátrico e incluye a los niños con hipercalciuria e hipocitraturia, puesto que las otras causas de cálculos habitualmente debutan con la clínica propia de los cálculos renales. La forma más sencilla de despistaje de prelitiasis es la determinación del cociente calcio/citrato en la primera orina del día. Valores del cociente calcio/citrato superiores a 0,33 indican que la orina es potencialmente litógena, con independencia de la edad y del momento de la recogida de la orina.
Desde principios de los años 80 del pasado siglo, los pediatras hemos aprendido a identificar a los niños portadores de anomalías metabólicas causantes de cálculos en una fase de la vida en la que aún no les ha dado tiempo a formarlos ni a desarrollarlos. Esta situación, casi especifica de la edad pediátrica, ha sido denominada “prelitiasis”(3,14). El término ha sido en cierta forma contestado, puesto que no todas las personas portadoras de anomalías metabólicas potencialmente causantes de cálculos, los forman a largo plazo. No obstante, creemos que es un término descriptivo y válido.
Alexander Randall (1883-1951), el célebre urólogo americano descriptor de las placas que llevan su nombre, utilizó el término “silencio sintomático” que podría equipararse en cierta forma con el de la prelitiasis. Así, escribió que: “Un cálculo renal es conocido clínicamente tan solo después de que su crecimiento haya alcanzado lo que podíamos llamar su madurez. Es evidente el hecho de que este crecimiento ha requerido tiempo, así como también lo es que durante este tiempo ha habido un silencio sintomático”.
Como se ha indicado en las líneas precedentes, los niños con HI pueden debutar con síntomas o signos como: hematuria macro o microscópica, leucocituria estéril, disuria, polaquiuria, urgencia miccional, incontinencia urinaria, enuresis nocturna, orinas turbias, dolor abdominal recurrente(4) o infección urinaria(6,8,14).
La expresión morfológica de la prelitiasis concurriría con la visión repetida del mismo tipo de cristales en el sedimento urinario y con el hallazgo de partículas hiperecogénicas móviles en la ecografía vesical que pueden ser trasunto de hematíes, leucocitos o de cristales en la orina(15); hemos comprobado que esta cristaluria puede asociarse a hipercalciuria o a hipocitraturia. La relación entre estas dos últimas anomalías metabólicas es compleja y una cuestión pendiente de resolver; ya que, en ocasiones, pueden coincidir al mismo tiempo en ausencia de un defecto de la capacidad de acidificación renal. Además, con mucha frecuencia, se observa que los niños con HI, al acercarse a la adolescencia, normalizan la eliminación urinaria de calcio y muestran, de modo concurrente, hipocitraturia(13). En ocasiones, en adultos que han eliminado cálculos y que son padres de niños con HI se observa que, únicamente, son portadores de hipocitraturia. Parece, por tanto, como si ambas anomalías metabólicas tuvieran, de algún modo, algún nexo en común.
El diagnóstico de la condición de prelitiasis es, pues, otra versión de la medicina preventiva, puesto que tras su detección se pueden tomar medidas dietéticas y/o farmacológicas para evitar la progresión a la enfermedad litiásica.
La forma más sencilla de despistaje de prelitiasis es la determinación del cociente calcio/citrato en la primera orina del día. La orina es particularmente litógena cuando existe un desequilibrio entre el componente favorecedor (calcio) y el protector (citrato). Este desequilibrio es más patente de noche, puesto que junto al aumento de la osmolalidad urinaria por la falta de ingesta de líquidos durante el sueño se suma, en muchos casos, un incremento de la calciuria por un cierto incremento de la resorción ósea y una reducción de la citraturia como consecuencia de la acidosis fisiológica leve nocturna, que es consecuencia de la formación de cetoácidos dada la falta de ingesta calórica(3,16). Por ello, la primera orina del día que recoge el testimonio de lo sucedido por la noche debe estudiarse necesariamente de forma independiente. Valores del cociente calcio/citrato superiores a 0,33 indican que la orina es potencialmente litógena, con independencia de la edad y del momento de la recogida de la orina(17). Así, en un estudio de nuestro Grupo antes citado, el cociente calcio/citrato correspondiente a la orina de la noche estaba incrementado en el 37,5 % de las muestras y, en cambio, el mismo cociente, en la primera orina del día, estaba elevado en el 80 % de los casos. Este era el único parámetro calculado que se relacionaba, además, con la existencia de antecedentes familiares de litiasis(3). Una situación particular puede ocurrir, preferentemente en la adolescencia, cuando la citraturia puede estar reducida y, asimismo la calciuria, con lo que la orina no será litógena al mostrar una relación calcio/citrato normal.
Hipocitraturia
La hipocitraturia se aprecia con frecuencia en pacientes con litiasis renal. Puede observarse de forma aislada o asociada a hipercalciuria. Es un potente inhibidor de la cristalización. En ocasiones no es posible saber la causa de la hipocitraturia, aunque debe descartarse principalmente acidosis metabólica, una dieta con exceso de proteínas, fibrosis quística, malabsorción intestinal y obesidad.
El citrato actúa como un inhibidor de la formación de cálculos de calcio al formar un complejo soluble, lo que disminuye la disponibilidad del calcio iónico libre necesario para la cristalización de oxalato o de fosfato cálcicos. El citrato, también, actúa como un inhibidor directo de la agregación de cristales de calcio y de su crecimiento(18); por tanto, un citrato urinario reducido puede ser una causa importante de litiasis cálcica.
En general, la acidosis metabólica se acompaña de hipocitraturia y la alcalosis de hipercitraturia(19).
La frecuencia de hipercalciuria y, sobre todo, de hipocitraturia en casos de acidosis tubular renal es muy elevada. El citrato es un marcador muy sensible de acidosis metabólica(19). Cuando el pH de la célula tubular proximal se reduce, se estimula la actividad del cotransportador de dicarboxilatos NADC1 (sodium-dependent dicarboxylate transporter 1) localizado en la membrana apical del túbulo proximal, con lo que pasa más citrato al interior de la célula. El citrato participa en el ciclo de Krebs en las mitocondrias, con lo que se produce CO2 y H2O, proceso en el que se consumen tres iones H+, una reacción equivalente a generar bicarbonato.
Otras causas de hipocitraturia, además de la acidosis metabólica, son: el tratamiento con acetazolamida o tiazidas, la depleción de potasio, la inanición, la fibrosis quística, la malabsorción intestinal y la obesidad. La ingesta excesiva de proteínas también favorece su aparición por la sobrecarga ácida que ocasiona. No obstante, en ocasiones, no se detecta ninguna causa conocida (hipocitraturia idiopática). En la insuficiencia renal crónica, una reducción de la citraturia puede ser indicativa de una acidosis intracelular susceptible de iniciar un tratamiento precoz alcalinizante. Como ya se ha indicado antes, con cierta frecuencia se observa hipocitraturia asociada a HI, en ausencia de defecto de acidificación.
Nosotros hemos observado en algunos casos que tras el uso de citrato, los microcálculos ecográficos pueden desaparecer. No debe olvidarse que en 1857, Spiller observó que el ácido cítrico tiene una especial capacidad de mantener en solución al calcio. En presencia de citrato, el calcio no es precipitado por carbonato, fosfato ni oxalato. Cuando algunos de estos precipitados se han formado, pueden ser llevados nuevamente a solución por citrato adicional.
Función del pediatra de Atención Primaria
Una anamnesis apropiada, una exploración física correcta y la realización de pruebas de función renal básicas pueden conducir al pediatra de Atención Primaria al diagnóstico de HI. Este, puede realizar el control posterior tras recomendar unas normas dietéticas adecuadas. La presencia de anomalías morfológicas (cálculos ecográficos) o de clínica sugestiva, sería indicación de remisión del paciente a un Centro especializado en Nefrología Infantil.
Como ha quedado reflejado en el artículo, la HI es la causa más frecuente de litiasis, tanto en la infancia como en la edad adulta, aunque lo más habitual es que sea asintomática o presente síntomas de prelitiasis (hematuria, síntomas miccionales, dolor abdominal…). Desde Atención Primaria es importante sospecharla ante dicha sintomatología y realizar las pruebas pertinentes para su diagnóstico. Aunque está estandarizada la recogida de orina de 24 horas, podría ser suficiente de manera inicial con una determinación de los cocientes calcio/creatinina y calcio/citrato en una muestra de la primera orina de la mañana, cuyos resultados deben confirmarse en una muestra posterior.
Una vez realizado el diagnóstico, será preciso proporcionar las medidas dietéticas ya referidas, tanto si el paciente está asintomático y ha sido un diagnóstico casual, como si presenta clínica asociada. Dichas indicaciones serán fundamentales para disminuir la sintomatología, así como para prevenir la formación de litiasis renal en el futuro.
Teniendo en cuenta que la HI es una entidad cuya causa es multifactorial, pero en la que juega un papel primordial la genética, no hay que obsesionarse con conseguir la normalización de la calciuria. Lo fundamental será, sobre todo, tratar de aumentar los niveles de inhibidores de la cristalización en la orina (citrato y magnesio), recomendando ingerir alimentos ricos en los mismos, así como en fitato (presente en cereales y legumbres), que es también un potente inhibidor de la cristalización.
Salvo que existan complicaciones, los niños con HI pueden ser controlados por los pediatras de Atención Primaria.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio de los autores.
1.*** Grases Freixedas F, Costa-Bauzá A. Mecanismos de la formación de los cálculos renales. En: Nefrología Pediátrica. Exeni R, García-Nieto V, Medeiros M, Santos F, eds. Oviedo: Ediciones de la Universidad de Oviedo. 2021. p. 977-90.
2.** Lumbreras J, Rodrigo MD, Prieto RM, Costa-Bauzá A, Sanchis P, Espinosa N, et al. Comparing different morpho-compositional groups of kidney stones in a Pediatric Renal Lithiasis Registry. Pediatr Nephrol. 2021; 36: 3352.
3. García Nieto VM, Pérez Bastida XI, Salvador Cañibano M, García Rodríguez VE, Monge Zamorano M, Luis Yanes MI. Quantification of the risk of urinary calcium stone formation in the urine collected at 2 times of the day in a group of children studied to rule out prelithiasis. Nefrologia (Engl Ed). 2018; 38: 267-72.
4. Penido MG, Tavares MS. Beyond kidney stones: Why pediatricians should worry about hypercalciuria. World J Clin Pediatr. 2021; 10: 137-50.
5. Moore ES. Hypercalciuria in children. Hypercalciuria in children. Contr Nephrol. Basel: Karger. 1981; 28: 20-32.
6.** Cervera A, Corral MJ, Gómez Campdera FJ, De Lecea AM, Luque A, López Gómez JM. Idiopathic hypercalciuria in children. Classification, clinical manifestations and outcome. Acta Paediatr Scand. 1987; 76: 271-8.
7. Praga M, Martínez MA, Andrés A, Alegre R, Vara J, Morales E, et al. Association of thin basement membrane nephropathy with hypercalciuria, hyperuricosuria and nephrolithiasis. Kidney Int. 1998; 54: 915-20.
8. Sotoca Fernández J, O’Hagan M, Arango Sancho P, Luis Yanes MI, García Nieto V. A family history of renal lithiasis in children diagnosed of urinary tract infection by Escherichia coli. An Pediatr (Barc). 2018; 88: 204-8.
9.** García Nieto VM, Luis Yanes MI, Tejera Carreño P, Pérez Suárez G, Moraleda Mesa T. The idiopathic hypercalciuria reviewed. Metabolic abnormality or disease? Nefrologia (Engl Ed). 2019; 39: 592-602.
10.*** Li XQ, Tembe V, Horwitz GM, Bushinsky DA, Favus MJ. Increased intestinal vitamin D receptor in genetic hypercalciuric rats. A cause of intestinal calcium hyperabsorption. J Clin Invest. 1993; 91: 661-7.
11. Krieger NS, Stathopoulos VM, Bushinsky DA. Increased sensitivity to 1,25(OH)2D3 in bone from genetic hypercalciuric rats. Am J Physiol. 1996; 271: C130-5.
12.** Favus MJ, Karnauskas AJ, Parks JH, Coe FL. Peripheral blood monocyte vitamin D receptor levels are elevated in patients with idiopathic hypercalciuria. J Clin Endocrinol Metab. 2004; 89: 4937-43.
13.*** Pérez-Suárez G, Luis-Yanes MI, Martín-Fernández de Basoa MC, Sánchez-Almeida E, García-Nieto VM. Evolution of bone mineral density in patients with idiopathic hypercalciuria: a 20-year longitudinal study. Pediatr Nephrol. 2021; 36: 661-7.
14. Kamińska A, Jung A. Results of the treatment of pre-urolithiasis state in children with recurrent urinary tract infections. Pol Merkur Lekarski. 2000; 8: 209-10.
15. Luis Yanes MI, López Figueroa A, Arango Sancho P, Tejera Carreño P, Monge Zamorano M, Aracil Hernández D, et al. Ultrasonography findings of echogenic material in the bladder of a pediatric cohort. Pediatr Nephrol. 2018: 33: 1980.
16.** Mir C, Rodríguez A, Rodrigo D, Sáez-Torres C, Frontera G, Lumbreras J, et al. Analysis of urine composition from split 24-h samples: use of 12-h overnight samples to evaluate risk factors for calcium stones in healthy and stone-forming children. J Pediatr Urol. 2020; 16: 371.e1-e7.
17. Srivastava T, Winston MJ, Auron A, Alon US. Urine calcium/citrate ratio in children with hypercalciuric stones. Pediatr Res. 2009; 66: 85-90.
18. Tekin A, Tekgul S, Atsu N, Sahin A, Ozen H, Bakkaloglu M. A study of the etiology of idiopathic calcium urolithiasis in children: hypocitruria is the most important risk factor. J Urol. 2000; 164: 162-5.
19. Brennan S, Hering-Smith K, Hamm LL. Effect of pH on citrate reabsorption in the proximal convolute tubule. Am J Physiol. 1988; 255: F301-6.
20. González-Lamuño Leguina D. Hipercalciuria. Pediatr Integral. 2017; XXI: 529-40.
Bibliografía recomendada
– Grases Freixedas F, Costa-Bauzá A. Mecanismos de la formación de los cálculos renales. En: Nefrología Pediátrica. Exeni R, García-Nieto V, Medeiros M, Santos F, eds. Oviedo: Ediciones de la Universidad de Oviedo; 2021. p. 977-90.
Capítulo recientemente escrito por uno de los Grupos más expertos en litiasis de nuestro país. Se revisa de forma muy didáctica los complejos mecanismos y las causas que intervienen en la formación de los cálculos renales.
– Li XQ, Tembe V, Horwitz GM, Bushinsky DA, Favus MJ. Increased intestinal vitamin D receptor in genetic hypercalciuric rats. A cause of intestinal calcium hyperabsorption. J Clin Invest. 1993; 91: 661-7.
El estudio de las ratas hipercalciuricas permitió sospechar que comparten mecanismos en su fisiopatología con la HI del humano. El hallazgo de un incremento en el número de receptores de la vitamina D fue fundamental en este sentido.
– Pérez-Suárez G, Luis-Yanes MI, Martín-Fernández de Basoa MC, Sánchez-Almeida E, García-Nieto VM. Evolution of bone mineral density in patients with idiopathic hypercalciuria: a 20-year longitudinal study. Pediatr Nephrol. 2021; 36: 661-7.
Este trabajo ha permitido conocer por primera vez que la eliminación urinaria de calcio en la HI no es permanente y que, en ocasiones, se sustituye por hipocitraturia. Este estudio ha permitido conocer, asimismo, que la pérdida de masa ósea que se observa en algunos pacientes con HI mejora espontáneamente en la adolescencia y en adultos jóvenes, sobre todo en mujeres.
| Caso clínico |
|
El paciente de 7 años de edad (peso: 23 kg, talla: 118,5 cm) fue enviado por un cuadro clínico, iniciado 12 días antes, consistente en hematuria macroscópica al final de la micción, que no se acompañaba de fiebre ni de disuria. Acudieron inicialmente a su médico que prescribió la administración de penicilina intramuscular y al no ceder la hematuria terminal, nos fue remitido. La exploración física era normal salvo un soplo sistólico I/VI de características funcionales en el foco mitral. Entre los antecedentes personales cabe destacar que ha sido sometido a adenoidectomía y amigdalectomía. La madre ha padecido dos cólicos nefríticos. La hematuria macroscópica cedió a los dos días del ingreso, permaneciendo con microhematuria persistente (8-10 leucocitos por campo, 20-25 hematíes por campo). El urocultivo fue negativo y el hemograma normal (Hb: 14 g/dl). La bioquímica general fue normal (creatinina: 0,5 mg/dl, ácido úrico: 3,5 mg/dl, calcio: 10 mg/dl), incluidos proteinograma, inmunoglobulinas y serología de hepatitis B. Los niveles de complemento fueron C3: 97 mg/dl y C4: 16 mg/dl. El frotis faríngeo fue negativo. La ecografía renal fue normal. El volumen de la orina de 24 horas que se entregó en el laboratorio fue de 500 ml. En esa muestra, la concentración de creatinina fue 60 mg/dl y la de calcio 17 mg/dl. Además, magnesio: 6,2 mg/dl; ácido úrico: 47,6 mg/dl y citrato 300 mg/l.
|





 Hypercalciuria and hypocitraturia. The concept of prelithiasis in Pediatrics
Hypercalciuria and hypocitraturia. The concept of prelithiasis in Pediatrics 