 |
| Regreso a las bases |
F. Centeno Malfaz, B. Salamanca Zarzuela
Unidad de Cardiología Pediátrica. Servicio de Pediatría. Hospital Universitario Río Hortega. Valladolid
| Resumen
Las cardiopatías congénitas se deben a un trastorno en la morfogénesis del corazón, por lo general, durante el período de organogénesis, comprometiendo la función del sistema cardiovascular, antes, durante o después del nacimiento. En el humano, la morfogénesis cardíaca ocurre entre la tercera y sexta semana del desarrollo intrauterino. El sistema cardiovascular es el primero en alcanzar una madurez funcional durante el desarrollo embrionario. Evoluciona fundamentalmente a partir de la lámina esplácnica del mesodermo lateral. La tabicación intracardiaca comienza el día 27 y termina el día 37, y ocurre en distintas regiones. El sistema de conducción deriva también del mesénquima cardiogénico. El día 23 el corazón empieza a latir en sentido cefalocaudal. A partir del día 24, la sangre ya circula por todo el embrión. |
| Abstract
Congenital heart disease is due to a disorder in the morphogenesis of the heart, usually during the period of organogenesis, compromising the function of the cardiovascular system, before, during or after birth. In humans, cardiac morphogenesis occurs between the third and sixth week of intrauterine development. The cardiovascular system is the first to reach functional maturity during embryonic development. It evolves mainly from the splenic lamina of the lateral mesoderm. Intracardiac septation begins on day 27 and ends on day 37 and occurs in different regions. The conduction system is also derived from the cardiogenic mesenchyma. On day 23 the heart begins to beat in the cephalocaudal direction. From day 24 onwards, the blood already circulates throughout the embryo. |
Palabras clave: Embriología cardiaca; Anatomía cardiaca; Morfogénesis; Cardiopatía congénita.
Key words: Cardiac embryology; Cardiac anatomy; Morphogenesis; Congenital heart disease.
Pediatr Integral 2021; XXV (8): 438 – 442
Embriología básica cardíaca
Introducción
Las cardiopatías congénitas(1) se deben a un trastorno en la morfogénesis del corazón, por lo general, durante el período de organogénesis, comprometiendo la función del sistema cardiovascular, antes, durante o después del nacimiento; por lo cual, repercuten en el funcionamiento y desarrollo del resto del organismo.
Primeras fases del desarrollo
Tras la fecundación, a partir de la división del cigoto, comienzan a diferenciarse los tipos de células que componen el cuerpo humano. Cada periodo prenatal posee características específicas:
• El periodo de blástula abarca desde el día 14 hasta la tercera semana de embarazo. En esta etapa, la nutrición se realiza por difusión. Aproximadamente, a los 15 días de la fecundación, tiene lugar la gastrulación, y el disco bilaminar que formaba el cigoto pasa a estar formado por tres hojas blastodérmicas. El epiblasto, formado por las células más ventrales, formará el ectodermo. Desde esta capa se invaginarán células hacia el hipoplasto situado dorsalmente para dar lugar al endodermo. Las células que quedan entre ambas capas nuevas, formarán el mesodermo.
• El periodo embrionario, de la cuarta a la octava semanas, se produce la organogénesis. A partir de este momento, se establecerá la circulación sanguínea. Los agentes teratógenos tienen su mayor influencia durante esta fase. Las agresiones en este momento darán lugar a malformaciones, disrupciones o displasias.
• El periodo fetal se inicia en la octava semana y se prolonga hasta el nacimiento. Se caracteriza por el crecimiento y desarrollo de las estructuras previamente formadas. Las agresiones en este periodo, se manifiestan como deformidades o enfermedades fetales.
Desarrollo cardiovascular en el periodo embrionario
El desarrollo del sistema cardiovascular en el ser humano comienza a aparecer hacia la mitad de la tercera semana del desarrollo intrauterino, cuando el embrión ya no es capaz de satisfacer sus necesidades nutritivas por mecanismos primitivos. Al inicio, las sustancias nutritivas se difunden desde la sangre materna al interior de una serie de canalículos, y la circulación de los líquidos por estos canales se realiza por difusión y osmosis. Posteriormente, se formará el corazón como elemento impulsor principal.
En el humano, la morfogénesis cardíaca ocurre entre la tercera y sexta semana del desarrollo intrauterino. El sistema cardiovascular es el primero en alcanzar una madurez funcional durante el desarrollo embrionario(2). Evoluciona fundamentalmente a partir de la lámina esplácnica del mesodermo lateral y recibe una contribución importante de células de las crestas neurales y una considerable inducción del endodermo en sus etapas iniciales.
El corazón se inicia en la placa cardiogénica del mesodermo embrionario con la formación del tubo cardíaco y termina con la formación del corazón definitivo.
Hacia el 19 día de vida, surgen en la hoja esplácnica cardiógena del mesodermo unas agrupaciones celulares llamadas wolffianos que forman dos cordones macizos bilaterales y simétricos, a ambos lados de la línea primitiva a nivel del nodo primitivo. Posteriormente, crearán puentes entre ellos a modo de red, hasta fusionarse completamente (Fig. 1).
Formación del tubo cardiaco (Fig. 2)
El día 22 este esbozo se ahueca y forma el tubo cardiaco. La porción cefálica se pliega ventral caudal y hacia la derecha, mientras que la porción auricular caudal en dirección dorso craneal y hacia la izquierda, formando el asa cardiaca que se completa a los 28 días. En esta fase del desarrollo, se diferencian las primeras dilataciones:
• Una porción bulboventricular o segmento arterial, con dos segmentos:
- El bulbo arterial que formará en su tercio proximal la porcion trabeculada del ventrículo derecho. La porción media o cono arterial formará los infundíbulos y la parte distal los tractos de salida de los ventrículos.
- El ventrículo primitivo del que surgirán los dos ventrículos. La unión entre el ventrículo y el bulbo cardíaco se denomina surco bulboventricular o agujero interventricular primario.
• Porción auriculosinusal o segmento venoso, dará lugar a la aurícula común y, posteriormente, las aurículas. Inicialmente, se encuentra fuera de la cavidad epicárdica.
• La unión auriculoventricular donde se encontrará el futuro canal auriculoventricular, en este momento, es aún una región muy estrecha.
Las células que forman el tubo cardíaco conforman el futuro endocardio. Simultáneamente a los cambios estructurales del tubo cardíaco, la matriz extracelular que rodea al endotelio forma la hoja mioepicárdica, separada de la pared endotelial por la gelatina cardíaca, que dará lugar al miocardio y al epicardio o pericardio visceral(3).
No existen una correlación exacta de una mutación de un gen y un defecto cardíaco aislado concreto. Existen varias familias de factores de transcripción, desde las fases iniciales que evidencian la regionalización de los grupos celulares (Pitx2 se expresa en cresta precardíaca izquierda, pero no en la derecha, Irx4 y HRT determinan las regiones en sentido ántero-posterior) y la diferenciación de las mismas (la familiar GATA determina la especificación de las células a tejido miocárdico, bHLH [basic hélix-loop-helix], son específicos de la musculatura estriada y su expresión se modifica de forma asimétrica en las distintas cámaras ventriculares).
Defectos en las fases iniciales de la embriogénesis, durante la regionalización de los grupos celulares, darán lugar a ectopia cordis o síndromes de heteroataxia.
Tabicamiento cardiaco
La tabicación intracardiaca comienza el día 27 y termina el día 37 y ocurre en distintas regiones.
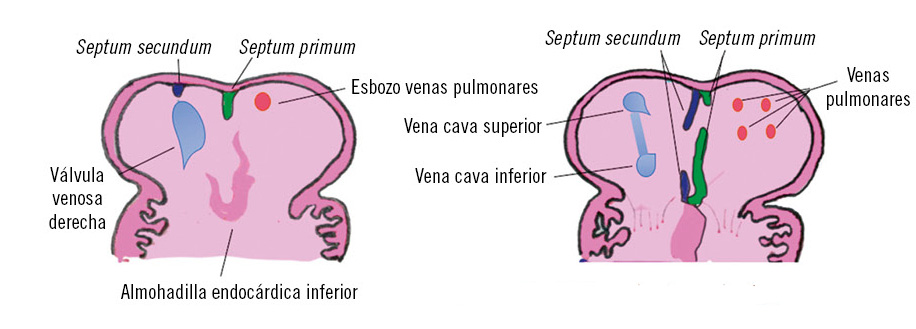
Tabicamiento auricular (Fig. 3)
Al final de la cuarta semana, desde el techo de la aurícula común, crece una cresta falciforme denominada septum primum en dirección hacia la cruz cordis, dejando un orificio entre ambas estructuras denominado septum primum.
Desde las almohadillas endocárdicas, crece otra cresta celular que cierra el ostium primum. En la porción superior del septum primum, aparecen perforaciones que van a formar el ostium secundum, que corresponde al agujero oval foramen permeable o conducto de Botal(4).
La aurícula derecha aumenta de tamaño al incorporarse la prolongación sinusal. La aurícula izquierda primitiva también aumenta de tamaño y su pared posterior entra en contacto con los esbozos pulmonares en desarrollo, para terminar formando las cuatro venas pulmonares.
Al final de la formación del tubo cardíaco, las paredes lisas comienzan a formar trabéculas en torno al agujero interventricular primario.
Los defectos de tabicación, tanto auriculares como ventriculares, son el tipo más frecuente de cardiopatía congénita. Factores de transcripción NKX2, TBX5 y GATA4, están implicados en estos procesos.
Una resorción excesiva del septum primum o el desarrollo insuficiente del septum secundum darán lugar a una comunicación interauricular ostium secundum. La ausencia de tabicación total auricular dando lugar a un corazón trilocular biventricular. El cierre precoz del agujero oval provoca hipertrofia del corazón derecho e hipoplasia del izquierdo.
Desarrollo del seno venoso
A mediados de la cuarta semana, el futuro corazón recibe sangre de dos prolongaciones izquierda y derecha, cada una de las cuales recibe, a su vez, sangre de la vena vitelina u onfalomesentérica, la vena umbilical y la vena cardinal. En la quinta semana, se oblitera la vena onfalomesentérica y, en la décima semana, la cardinal común de ese lado, convirtiéndose la prolongación izquierda en la vena oblicua izquierda y el seno coronario.
En el lado derecho, se oblitera en la quinta semana la vena umbilical. Posteriormente, la prolongación derecha se incorpora a la aurícula derecha para formar la parte lisa de esta aurícula.
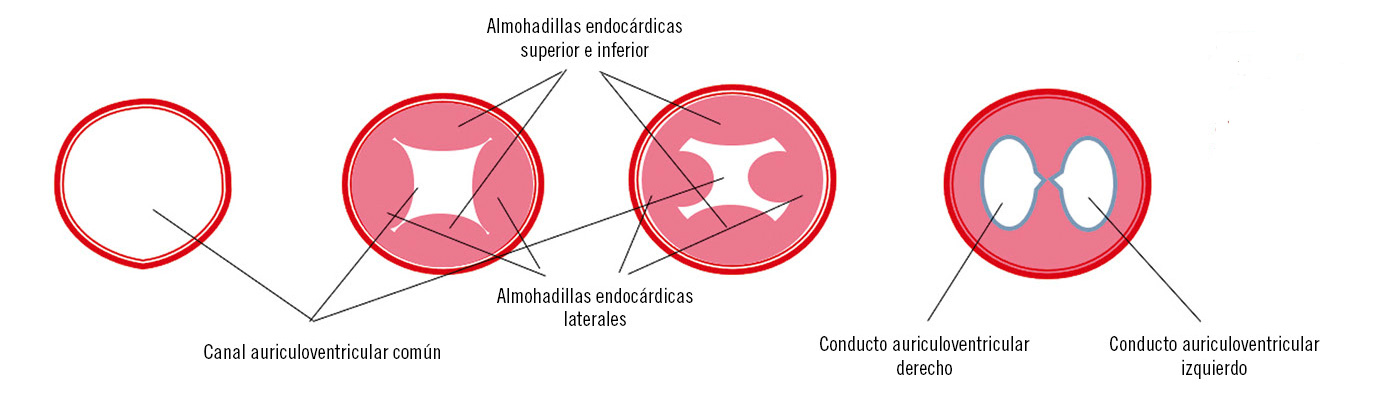
Tabicamiento del canal auriculoventricular (Fig. 4)
Inicialmente, el canal auriculoventricular va a comunicar con el ventrículo izquierdo primitivo y está separado del bulbo cardíaco por el reborde bulboventricular; posteriormente, crecerá hacia la derecha para comunicarse con ambos ventrículos. Al final de la cuarta semana, se formarán dos rebordes mesenquimáticos llamados almohadillas endocárdicas auriculoventriculares superior e inferior, que crecen para fusionarse a la quinta semana, formando los orificios auriculoventriculares. Posteriormente, aparecen las almohadillas auriculoventriculares laterales que formarán las futuras válvulas mitral y tricúspide, y los músculos papilares. El tejido muscular será sustituido por tejido conectivo cubierto de endocardio.
Cuando las almohadillas endocárdicas no se fusionan, darán lugar a un canal auriculoventricular. Si lo hacen de forma parcial, provocaran una comunicación interauricular ostium primum y/o una comunicación interventricular perimembranosa, según las almohadillas afectadas.
La obliteración del orificio auriculoventricular derecho, junto con la fusión o ausencia de las valvas de la tricúspide, provocará una atresia tricúspidea.
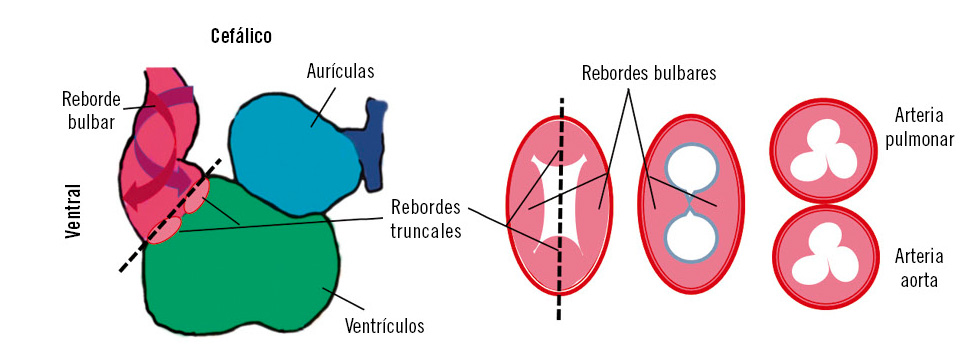
Tabicamiento del tronco arterioso y del cono arterial (Fig. 5)
La tabicación del bulbo arterial se produce al final de la quinta semana, cuando aparecen dos crestas bulbares que crecen desde la parte alta del bulbo hacia el saco aórtico, formando una espiral que corresponde al tabique aórtico pulmonar, dividiendo al tronco en un canal aórtico y otro pulmonar.
De forma simultánea, crecen en el cono arterial otros dos rebordes o almohadillas similares por las paredes dorsal derecha y ventricular izquierda, que van a crecer y a unirse de manera distal, dividiendo el cono arterial en una porción anterolateral que va a formar el infundíbulo del ventrículo derecho y una porción posteromedial que va a formar el infundíbulo del ventrículo izquierdo.
La división desigual del cono es el origen de la tetralogía de Fallot, que es el defecto más frecuente de esta región. Si estos rebordes descienden en línea recta, en vez de en espiral, se producirá una trasposición de los grandes vasos. Cuando estos rebordes no descienden completamente o no se fusionan entre sí, la malformación que se produce es el truncus arterioso; puesto que también participan en la formación de la parte superior de los ventrículos, ambas alteraciones se acompañan con frecuencia de comunicación interventricular.
El gen GATA6 y el cofactor TFAP-2β se han relacionado con los defectos del tracto de salida que se encuentran en la tetralogía de Fallot. La deleción 22q11 es la responsable de los defectos de los tractos de salida que se encuentran en el síndrome de Di George, el velocardiofacial y la anomalía conotrunca-cara.
En la fase final del tabicamiento del tronco, aparecen dos tubérculos que formarán las válvulas semilunares pulmonar y aórtica respectivamente.
Si las válvulas semilunares se fusionan a una distancia variable, se producirán atresia valvular aórtica o pulmonar, según la región afectada. Si la fusión es completa, aparecerán atresia valvular aórtica o atresia de la válvula pulmonar.
La ausencia del ligando JAGGED-1 o la inhibición de la señalización NOTCH 1-4 se han relacionado con defectos de formación de la aorta y de su tracto de salida. Estas alteraciones se han encontrado también en el síndrome de Alagille, que asocia estenosis pulmonar. El 50% de los pacientes con síndrome de Noonan, que asocian estenosis pulmonar con displasia de la válvula pulmonar, presentan ganancia de función del gen PTPN11.
Tabicamiento de los ventrículos
El tabique interventricular definitivo está formado por tres porciones:
1. La inferior deriva de células que se expanden desde el tabique primitivo muscular en la cuarta semana.
2. La anterosuperior deriva de la proliferación de las crestas bulbares.
3. La membranosa anteroposterior deriva de la almohadilla endocárdica. El espacio que comunica ambos ventrículos, entre el borde libre del tabique interventricular muscular y las almohadillas endocárdicas, disminuye de tamaño cuando termina de formarse el tabique del cono, con el crecimiento de la almohadilla endocárdica inferior, transformándose en la porción membranosa del tabique interventricular.
Defectos en la unión de las diferentes porciones, dará lugar a comunicaciones interventriculares.
Formación del sistema de conducción
El sistema de conducción deriva también del mesénquima cardiogénico. El día 23, el corazón empieza a latir en sentido cefalocaudal. Inicialmente, el marcapasos se encuentra en la porción caudal del tubo cardíaco izquierdo. Más tarde, esta función la asume el seno venoso y, al incorporarse este a la aurícula derecha, el tejido de marcapasos se halla próximo a la desembocadura de la cava superior, formando el nodo sinoauricular. De manera que lo primero que late es el bulbo arterial, la aurícula y el seno venoso. El nodo auriculoventricular y el haz de His derivan, por un lado, de la pared izquierda del seno venoso y, por otro, de las células del canal auriculoventricular. A partir del día 24, la sangre ya circula por todo el embrión.
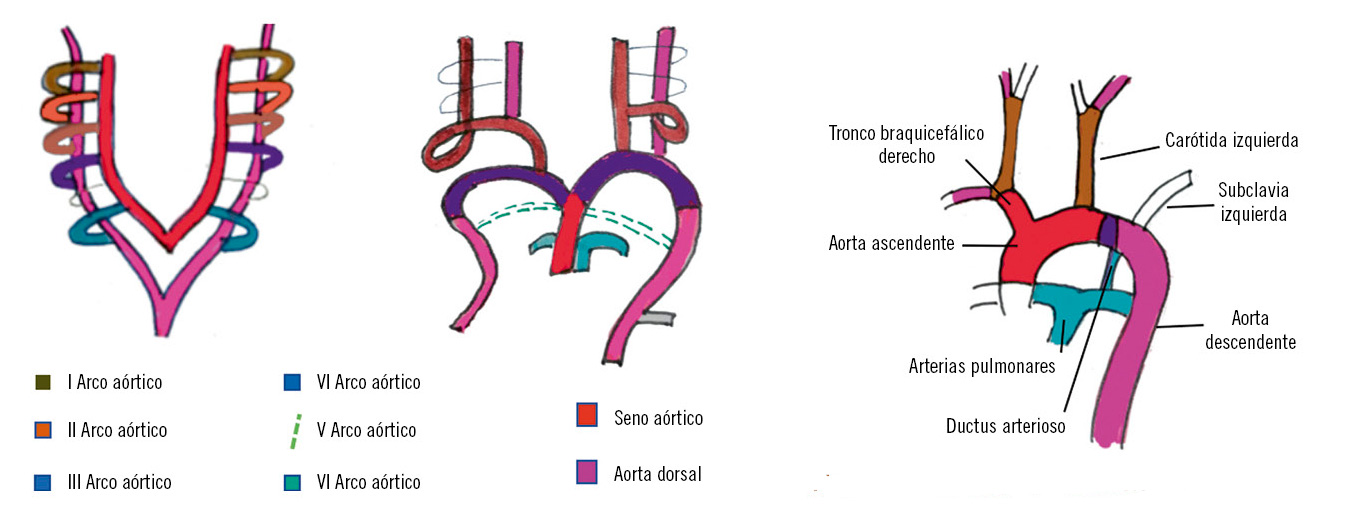
Desarrollo del sistema vascular (Fig. 6)
Entre la cuarta y la quinta semanas de desarrollo, se forman los arcos faríngeos, cada uno con su propio nervio craneano y su propia arteria. Estas arterias nacen del saco aórtico, que envía una rama a cada nuevo arco, de forma secuencial, de craneal a caudal, dando lugar a cinco pares de arterias, denominados arcos aórticos. El arco V o no se forma o sufre luego una regresión, permaneciendo los arcos I, II, III, IV y VI.
El tercer arco aórtico forma la carótida primitiva y la primera porción de la carótida interna, el resto de carótida interna se forma por la porción craneal de la aorta dorsal; la carótida externa es un brote del tercer arco aórtico. Del sexto arco nace una rama hacia el esbozo pulmonar que dará lugar al segmento proximal de la arteria pulmonar derecha y desde su lado izquierdo el conducto arterioso. El gen GATA6 se ha relacionado con la persistencia del ductus arterioso.
Existen distintas teorías sobre la alteración embriológica exacta que da lugar a la coartación y a la hipoplasia de arco aórtico(5-8). La teoría hemodinámica explicará esta patología por las alteraciones del flujo sanguíneo a nivel del istmo aórtico durante la vida fetal, tratando asimismo de explicar las malformaciones del tracto de salida izquierdo que se asocian con frecuencia (hipoplasia de la aorta, del VI y/o su tracto de salida, de la válvula mitral, lesiones estenóticas de la válvula aórtica…). La teoría embriogénica encuentra el origen en un desarrollo anormal del segmento derivado del cuarto arco faríngeo izquierdo en su progresión cefalocaudal, de modo que la falta de migración en sentido cefálico de la arteria subclavia izquierda se originaría en el lugar de la coartación, lo que daría lugar a una retracción cuando el ductus se cierra. Y, por último, la teoría que se basa en el crecimiento anormal del tejido ductal dentro de la aorta, lo que apoyaría el papel de este tejido en la forma más común: la coartación yuxtaductal.
Bibliografía
1. Bajolle F, Zaffran S, Bonnet D. Bases moléculaires des cardiopathies congénitales humaines. Arch Mal Coeur Vaiss. 2007; 100: 484-9.
2. Portela Torrón F. Embriología, anatomía quirúrgica, evolución. Cir Cardiov. 2014; 21: 74-8.
3. Falanga G, Carerj S, Oreto G, Khandheria BK, Zito C. How to Understand Patent Foramen Ovale Clinical Significance: Part I. J Cardiovasc Echogr. 2014; 24: 114-21.
4. Franco D, Domínguez J, de Castro MP, Aránega A. Expresión génica en el miocardio embrionario. Rev Esp Cardiol. 2002; 55: 167-84.
5. Gómez-Gómez M, Danglot-Banck C, Santamaría-Díaz H, Riera-Kinkel C. Desarrollo embriológico y evolución anatomofisiológica del corazón. Rev Mex Pediatr. 2012; 79; 144-50.
6. Calderón-Colmenero J, Curi-Curi PJ. Desarrollo embriológico del sistema cardiovascular. Tratado de Pediatría Cruz. 11ª ed. Editorial Panamericana. Madrid. 2014. Cap. 325. p. 1662-7.
7. Centella Hernández T, Stanescu D, Stanescu S. Coartación aórtica. Interrupción del arco aórtico. Cir Cardiov. 2014; 21: 97-106.
8. Thomas Sadler. Sistema cardiovascular. Embriología Médica de Langman. 14ª Edición. Editorial Panamericana. Madrid. 2019.



 Syncope
Syncope