|
| Temas de FC |
D. Clemente Garulo
Unidad de Reumatología pediátrica. Hospital Niño Jesús
| Resumen
Las conectivopatías son un grupo heterogéneo de enfermedades ocasionadas por la inflamación de diversas estructuras corporales debido a una desregulación del sistema inmune. Entre ellas, encontramos: el lupus eritematoso sistémico (la conectivopatía más frecuente), la dermatomiositis juvenil, la esclerodermia, la enfermedad mixta del tejido conectivo y la enfermedad de Sjögren. Su incidencia es baja en la infancia, siendo en muchas ocasiones difícil realizar un diagnóstico en los primeros momentos de la enfermedad, ya que los síntomas y signos pueden ser inespecíficos y aparecer durante el transcurso de semanas o meses. La presencia de una afectación en múltiples órganos, sin una causa aparente y asociado a ciertas manifestaciones clínicas especificas (exantema malar, pápulas de Gottron, fenómeno de Raynaud, esclerodactilia), debe hacer sospechar una conectivopatía. El diagnóstico de confirmación se establece mediante una combinación de criterios clínicos y analíticos, como la presencia de anticuerpos antinucleares y otros autoanticuerpos. Es importante su reconocimiento precoz para iniciar un tratamiento adecuado sin demora, que incluye el uso de corticoides y fármacos inmunosupresores, y mejorar el pronóstico de los pacientes a largo plazo. |
| Abstract
Connective tissue diseases are a heterogeneous group of disorders caused by inflammation of different body structures due to dysregulation of the immune system. Among them, we find systemic lupus erythematosus (the most common), juvenile dermatomyositis, sclerodermia, mixed connective tissue disease and Sjögren syndrome. Its incidence is low in childhood, being in many cases difficult to make a diagnosis in the early stages of the disease because symptoms and signs may be nonspecific and appear over the course of weeks and months. The presence of multi-system involvement associated to certain clinical features (malar rash, Raynaud ́s phenomenon, Gottron ́rash, sclerodactyly) should alert of a connective tissue disease. Confirmation of the diagnosis is established by a combination of clinical and analytical criteria, like the presence of anti- nuclear antibodies and other autoantibodies. |
Palabras clave: Conectivopatías; Lupus eritematoso sistémico; Dermatomiositis juvenil; Esclerodermia pediátrica
Key words: Connective tissue diseases; Systemic lupus erythematosus; Juvenile dermatomyositis; Pediatric scleroderma
Pediatr Integral 2017; XXI (3): 207–218
Conectivopatías
Introducción
Las conectivopatías son enfermedades poco habituales en la infancia. Es importante saber reconocer los rasgos principales de cada una de ellas para poder iniciar un tratamiento adecuado sin demora y mejorar el pronóstico de los pacientes.
Las conectivopatías constituyen un grupo heterogéneo de enfermedades de causa desconocida. Están ocasionadas por una alteración en la inmunidad adquirida, apareciendo autoanticuerpos y/o células T autorreactivas frente a diversas estructuras corporales. Son enfermedades poco habituales en la infancia, con un predominio del sexo femenino y tendencia a aparecer en adolescentes o preadolescentes. Se caracterizan por una afectación multisistémica sin una causa aparente, con síntomas y signos variables que pueden aparecer simultáneamente o de forma insidiosa durante el transcurso de semanas o meses. Los síntomas iniciales son inespecíficos en muchos casos (fiebre, astenia, anorexia o pérdida de peso) y debe establecerse un diagnóstico diferencial con infecciones (víricas y bacterianas), neoplasias (especialmente procesos linfoproliferativos) y otras enfermedades inflamatorias (vasculitis). La aparición de ciertas manifestaciones clínicas (exantema malar, úlceras orales, pápulas de Gottron, fenómeno de Raynaud, esclerodactilia) asociadas a síntomas constitucionales y una afectación multisistémica, debe hacer pensar en una conectivopatía. El diagnóstico de confirmación se establece mediante una combinación de criterios clínicos y analíticos, como la presencia de anticuerpos antinucleares (ANA) y otros autoanticuerpos. Entre las conectivopatías, encontramos: el lupus eritematoso sistémico (la más frecuente), la dermatomiositis juvenil, las esclerodermias localizada y sistémica, la enfermedad mixta del tejido conectivo y el síndrome de Sjögren(1). El pediatra de Atención Primaria debe saber reconocer estas enfermedades y derivar a los pacientes a unidades especializadas de forma precoz, para iniciar el tratamiento que permita el control de la enfermedad y mejorar el pronóstico de los pacientes a corto y largo plazo. Además, el pediatra de Atención Primaria tiene un papel fundamental en la detección de las recaídas, la monitorización de efectos adversos de los tratamientos y en las actividades preventivas de estos pacientes.
Lupus eritematoso sistémico
El lupus eritematoso sistémico (LES) es una enfermedad autoinmune crónica de causa desconocida, ocasionada por la presencia de autoanticuerpos e inmunocomplejos que afectan a múltiples órganos y sistemas. Dada su similitud con la enfermedad en adultos, para establecer el diagnóstico pueden utilizarse los mismos criterios de clasificación del American Collegue of Rheumatology (ACR), siendo necesaria la presencia simultánea o progresiva de ≥ 4 de los 11 criterios propuestos (Tabla I)(2).
Epidemiología
La incidencia anual en niños y adolescentes es de 0,36-0,9 por cada 100.000 niños y la prevalencia, muy variable según etnicidades, es de 3,3-24 por cada 100.000 niños. La edad de aparición habitual es entre los 12-16 años, siendo rara por debajo de los 10 años y excepcional por debajo de los 5 años. Es más frecuente en niñas (80%) y en asiáticos, afroamericanos y latinos(3).
Etiopatogenia
La causa es desconocida, siendo fundamental en su desarrollo una disfunción del sistema inmune que aparece en pacientes predispuestos genéticamente y sobre el que actúan factores ambientales.
Aunque la causa del LES sigue siendo desconocida, en su desarrollo es fundamental una disfunción del sistema inmune que va a condicionar la aparición de múltiples autoanticuerpos dirigidos contra antígenos nucleares, incluyendo: los anticuerpos antinucleares (ANA), los anticuerpos antinucleares extraíbles (ENA) y los anticuerpos anti-ADN de doble cadena. Los inmunocomplejos resultantes van a activar las células dendríticas y estimular la producción de interferón-α que, a su vez, estimula la diferenciación de los linfocitos B en células plasmáticas, incrementando la producción de autoanticuerpos y la formación de nuevos inmunocomplejos. Alteraciones en la apoptosis o muerte celular programada, pueden contribuir al desarrollo de los autoanticuerpos frente a las estructuras nucleares. Otros factores contribuyentes son: el aumento de las citoquinas proinflamatorias INFα, IL-6, IL-10, IL-12 e IL-18, mutaciones en los receptores inhibidores de las células T que conducen a la hiperactividad y pérdida de tolerancia de las mismas, y otras alteraciones en monocitos, células NK e inmunoglobulinas.
La predisposición genética es mayor en el LES que se inicia durante los primeros años de vida, que en el que se inicia durante la edad adulta, siendo habitual una historia familiar de autoinmunidad. Los hermanos de pacientes con LES juvenil tienen un riesgo entre 10-20 veces mayor de desarrollar la enfermedad. La deficiencia homocigota de complemento (C1q, sobre todo, y C1r, C1s, C4 y C2) y otras enfermedades monogénicas pediátricas (p. ej., síndrome Aicarde-Goutières, espondiloencondrodisplasia…) están asociadas al desarrollo de LES.
Entre los factores ambientales que pueden tener un papel en el inicio de la enfermedad, encontramos: la luz ultravioleta, algunas infecciones (VEB) y fármacos (procainamida, hidralazina) y hormonas (estrógenos)(4).
Manifestaciones clínicas
Las manifestaciones clínicas más frecuentes son: los síntomas constitucionales, la artritis, el exantema malar, las alteraciones hematológicas y la nefritis lúpica.
Las manifestaciones clínicas son muy variables, pudiendo inicialmente presentar síntomas inespecíficos (fatiga, anorexia, pérdida de peso y cefalea) y asociar, posteriormente, manifestaciones específicas relacionadas según los órganos afectados, así como datos de inflamación sistémica (adenopatías, hepatesplenomegalia).
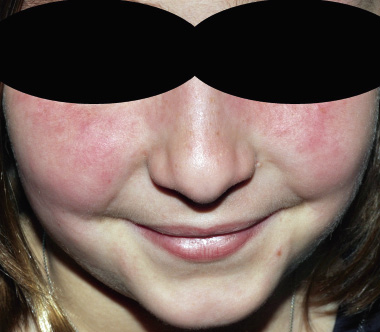
Manifestaciones mucocutáneas. Las más frecuentes son: el exantema malar en alas de mariposa (44-85%) (Fig. 1), la fotosensibilidad (35-50%), las lesiones de vasculitis cutánea en cara, palmas y plantas de los pies (16-45%) y las úlceras orales o nasales (20-40%).
Figura 1. Exantema malar (lupus eritematoso sistémico).
Otras posibles manifestaciones en niños, son: la alopecia (15-30%), los exantemas generalizados en áreas no fotoexpuestas (30%) y el fenómeno de Raynaud (6-12%). Las lesiones cutáneas subagudas y crónicas, aunque habituales en el adulto, son raras en los niños(5).
Manifestaciones musculoesqueléticas. La artritis suele ser poliarticular y simétrica, no erosiva, con afectación de grandes y pequeñas articulaciones. Las artralgias, la rigidez matutina y las mialgias son también habituales. Puede aparecer una necrosis avascular, especialmente en pacientes en tratamiento con corticoides.
Manifestaciones renales. La nefritis lúpica puede ser una de las manifestaciones iniciales y, en el 90% de los casos, aparece en los dos primeros años desde el diagnóstico. La presentación clínica es variable, desde una proteinuria mínima con una hematuria microscópica hasta el fallo renal agudo. Dado que la gravedad de la afectación glomerular puede no correlacionarse con los signos y síntomas clínicos, ante alteraciones en el sedimento de orina, es necesaria la realización de una biopsia para establecer un diagnóstico histológico según los criterios de clasificación de la Sociedad Internacional de Nefrología y Patología Renal (Tabla II)(6) y orientar el tratamiento. La glomerulonefritis proliferativa difusa (clase IV) es la forma más frecuente y también la más grave.
Manifestaciones neuropsiquiátricas. Puede afectarse tanto el sistema nervioso central (cefalea, meningitis aséptica, convulsiones, accidentes cerebrovasculares, trastornos del movimiento, síndromes desmielinizantes, mielopatía, síndromes confusionales agudos, trastornos por ansiedad, disfunciones cognitivas, psicosis y alteraciones del estado de ánimo) como el periférico (síndrome de Guillain Barré, trastornos autonómicos, neuropatías, miastenia gravis). Aunque pueden preceder al diagnóstico, normalmente aparecen durante el primer año de la enfermedad y pueden ocurrir en ausencia de actividad serológica u otras manifestaciones sistémicas. Es necesario descartar infecciones, efectos secundarios de los fármacos o alteraciones metabólicas como causa de las manifestaciones neuropsiquiátricas. La cefalea, las alteraciones del estado de ánimo, la psicosis, la disfunción cognitiva y las convulsiones son las más frecuentes. Los trastornos de movimiento (p. ej., corea), más habituales que en adultos, están asociados a menudo con la presencia de anticuerpos antifosfolípidos.
Manifestaciones hematológicas. Pueden aparecer citopenias afectando a las 3 series hematológicas. Una leucopenia leve (leucocitos 3.000-4.000/mm3) es la manifestación más frecuente (2/3 de los pacientes), normalmente a expensas de una disminución de linfocitos (<1.500/mm3), que no suele requerir tratamiento. La anemia suele ser debida al trastorno inflamatorio crónico, aunque, también puede ser secundaria a una ferropenia o a una anemia hemolítica con test de Coombs positivo. La trombocitopenia aparece en el 50% de los casos y puede ser la primera manifestación de LES. Las cifras de plaquetas son variables, pero no suele requerir tratamiento con cifras estables > 20.000/µl. Los anticuerpos antifosfolípido (anticoagulante lúpico, anticuerpos anticardiolipina y anticuerpos frente a la β2-glicoproteína I) se asocian a un estado de hipercoagulabilidad y a un aumento del riesgo de trombosis. El síndrome de activación macrofágico es otra complicación que puede aparecer en los niños con LES(7).
Manifestaciones gastrointestinales. El dolor abdominal y la diarrea son habituales, al igual que la hepatoesplenomegalia. La pancreatitis, la hepatitis autoinmune y la vasculitis intestinal son menos frecuentes.
Manifestaciones cardiopulmonares. La más frecuente es la serositis (pleuritis/pericarditis), con o sin derrame pleural/pericárdico. Muchos pacientes asintomáticos presentan alteraciones en las pruebas funcionales respiratorias. Otras posibles manifestaciones son: la miocarditis, la endocarditis estéril (de Libman-Sacks), la neumonitis intersticial, las hemorragias pulmonares y la hipertensión pulmonar.
Alteraciones en los estudios complementarios
Las pruebas de laboratorio sirven para apoyar el diagnóstico de LES y para monitorizar la actividad de la enfermedad.
El hemograma puede mostrar anemia, trombopenia o leucocitopenia (linfopenia). El test de Coombs puede ser positivo con o sin anemia hemolítica. En la bioquímica, podemos encontrar elevación de las transaminasas, LDH y CPK, así como de la urea y de la creatinina. Es habitual, la presencia de hipergammaglobulinemia. El sedimento de orina puede ser normal o presentar alteraciones variables según el tipo de nefritis lúpica. Durante los periodos de actividad, puede elevarse la velocidad de sedimentación globular (VSG), manteniendo unos valores normales de la proteína C reactiva (PCR) (excepto si se manifiesta como serositis). De este modo, la PCR puede ser útil para diferenciar infecciones intercurrentes de actividad lúpica. La característica principal del LES es la presencia de múltiples autoanticuerpos, siendo los anticuerpos antinucleares (ANA) positivos (títulos > 1/160) en la mayoría de pacientes. Aunque los ANA pueden ser positivos en niños sanos, valores por encima de 1/1.280 son muy sospechosos de LES. Los anticuerpos anti-DNA (en 75% pacientes) y los anti-Sm (en 50% pacientes) son muy específicos de LES. Otros anticuerpos que pueden encontrarse son: los anti-SS-A (Ro) y anti-SS-B(La), los anti-RNP y los anticuerpos antifosfolípido. Para monitorizar la actividad de la enfermedad, se utilizan los niveles de anti-DNA y los valores de complemento (C3 y C4), siendo estos últimos, bajos durante los periodos de actividad(8).
Tratamiento
El objetivo del tratamiento es inducir la remisión de la enfermedad, minimizar los brotes y prevenir las complicaciones a largo plazo. Los fármacos utilizados van a depender de las manifestaciones clínicas de cada paciente.
El tratamiento del LES juvenil se basa en el uso de fármacos y en la atención a medidas generales de salud. Es fundamental la educación del niño/adolescente y la familia, ya que el cumplimiento del tratamiento a largo plazo puede ser difícil, bien por miedo a efectos adversos (estrías cutáneas o aumento de peso con altas dosis de corticoides) o porque se “cansen” de estar enfermos, acudir a citas, tomar medicaciones…
Dentro de las medidas generales, es muy importante limitar la exposición al sol (radiación UVB), recomendando protección solar (SPF ≥ 30) a diario. Se debe recomendar una ingesta adecuada de calcio y suplementos de vitamina D y controlar la dieta (restricción de sodio y calorías) cuando se inicia un tratamiento con corticoides a dosis altas para evitar una excesiva ganancia ponderal. Se deben controlar y tratar los factores de riesgo cardiovascular. Especialmente los adolescentes con LES deben evitar fumar, ya que puede empeorar la actividad de la enfermedad y disminuir la eficacia de medicaciones, como la hidroxicloroquina. Hay que asegurar que el calendario vacunal ha sido completado (especialmente la inmunización contra el neumococo) y realizar un tratamiento precoz de las infecciones.
El tratamiento farmacológico más utilizado en el LES y sus indicaciones se recogen en la tabla III, debiendo individualizarse según la extensión y gravedad de la enfermedad. La dosis y duración del tratamiento con corticoides está basada en la gravedad de las manifestaciones clínicas.
Para el tratamiento de las manifestaciones cutáneas, articulares y hematológicas, las serositis y los síntomas sistémicos generales, suele utilizarse una dosis de prednisona de 0,25-0,75 mg/kg/día, preferiblemente en dosis única. Cuando existe una afectación renal grave (nefritis lúpica III o IV) o manifestaciones neuropsiquiátricas, se utilizan dosis iniciales de prednisona oral de 1-2 mg/kg/día en 1-3 dosis durante 4-6 semanas antes de disminuir la dosis de forma lenta. La administración temprana de bolos de metilprednisolona de 30 mg/kg vía intravenosa (3 días consecutivos) debe considerarse en casos graves. Las manifestaciones cutáneas pueden mejorar con pautas cortas de corticoides o inhibidores de la calcineurina tópicos(9,10).
En el algoritmo 1, se establecen las pautas de tratamiento para las distintas manifestaciones de LES. En los casos refractarios, pueden utilizarse inmunoglobulinas intravenosas, plasmaféresis o terapias biológicas dirigidas contra las células B, como rituximab (anticuerpo monoclonal anti CD-20) o belimumab (anticuerpo monoclonal anti-BLyS)(11).
Evolución y pronóstico
El LES es una enfermedad crónica que cursa con periodos de actividad y remisión, pudiendo desencadenarse exacerbaciones por factores exógenos, como: exposición solar, infecciones, intervenciones quirúrgicas… Para medir la actividad de la enfermedad, se utilizan diferentes cuestionarios, como SLEDAI (Systemic Lupus erythematosus Disease Activity Index) o el British Isles Assesment Group (BILAG), al igual que para determinar el daño acumulado se utiliza el SLICC/ACR (Systemic Lupus International Cooperating Clinics/American College of Rheumatology)(3). El LES pediátrico tiene peor pronóstico que los casos de inicio en la edad adulta, ya que presentan manifestaciones clínicas más graves y la remisión a largo plazo es poco frecuente, siendo más propensos a presentar complicaciones, debido, tanto a una mayor actividad de la enfermedad, como a los efectos adversos asociados a tratamientos más agresivos y prolongados. La mortalidad ocurre en un 5% de los casos, principalmente por complicaciones infecciosas o fracaso renal. Son factores de mal pronóstico: la afectación orgánica grave, el sexo masculino, el origen étnico afroamericano, asiático o latino y un nivel socioeconómico bajo(8-10).
Dermatomiositis juvenil
La dermatomiositis juvenil (DMJ) es una enfermedad autoinmune caracterizada por la inflamación crónica de piel y músculo estriado.
La incidencia en niños es baja (2-4 casos/millón de niños/año), con un predominio del sexo femenino y una edad media de aparición a los 7 años. Los criterios para el diagnóstico de dermatomiositis juvenil se encuentran en la tabla IV(12).
Etiopatogenia
Al igual que en otras enfermedades autoinmunes, la DMJ es el resultado de una combinación de factores ambientales (luz ultravioleta, infecciones respiratorias o gastrointestinales) que desencadena en un individuo predispuesto genéticamente (p. ej., polimorfismo TNFα-308A) una respuesta inmune anómala.
Manifestaciones clínicas
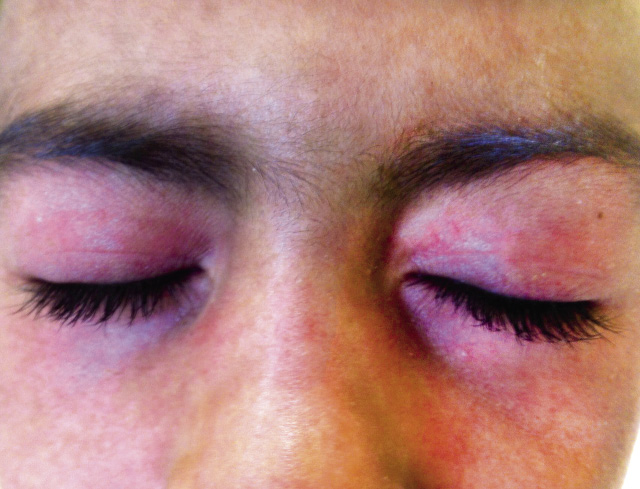
La presentación habitual de la DMJ es un cuadro de debilidad muscular asociado a un cuadro constitucional (fiebre, hiporexia, pérdida de peso) de comienzo insidioso y manifestaciones cutáneas específicas, como las pápulas de Gottron (Fig. 2) o el eritema heliotropo (Fig. 3).
Figura 2. Pápulas de Gottron (dermatomiositis juvenil).
Figura 3. Eritema heliotropo (dermatomiositis juvenil).
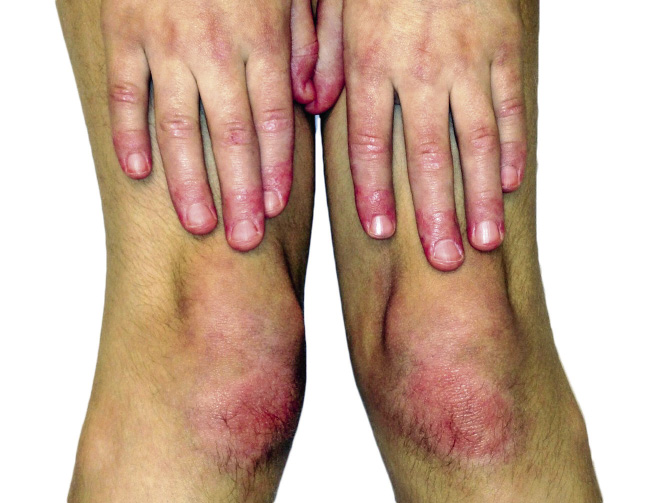
La debilidad muscular afecta a la cintura escapular (dificultad para levantar los brazos) y pélvica (dificultad para subir y bajar escaleras) y puede asociar dolor muscular con el ejercicio. El signo de Gowers (el niño trepa por sus muslos para levantarse del suelo) es positivo. En casos graves, puede aparecer disfagia o disnea por afectación de la musculatura faríngea y respiratoria. Aunque poco frecuentes, existen formas amiopáticas en las que existen las manifestaciones cutáneas características sin debilidad muscular o subclínica. Durante su evolución, puede aparecer calcinosis, asociado a enfermedad prolongada o tratada de forma insuficiente (Fig. 4), que pueden dar lugar a episodios de inflamación local aguda (Fig. 5). Otras complicaciones, son la lipodistrofia y úlceras cutáneas, asociándose estas últimas a vasculitis sistémica.
Figura 4. Calcinosis (dermatomiositis juvenil).
Figura 5. Inflamación secundaria a calcinosis en codo (dermatomiositis juvenil).
Alteraciones en los estudios complementarios
El hemograma suele ser normal al inicio de la enfermedad, aunque puede aparecer linfopenia. Las enzimas musculares (creatinquinasa, alanina aminotransferasa, aspartato amino transferasa, lactato deshidrogenasa, aldolasa) están elevadas en más del 75% de los pacientes. Los ANA suelen ser positivos, pero sus niveles no se relacionan con la actividad de la enfermedad. Aunque son poco frecuentes, pueden detectarse autoanticuerpos específicos de miositis (anti-Jo1, anti-Mi2, anti SRP) o autoanticuerpos asociados a miositis (antip155/140, anti-NXP2), siendo útiles para establecer un pronóstico, ya que se asocian con fenotipos diferenciados de DMJ(13). La resonancia magnética también puede identificar la inflamación muscular y la presencia de edema subcutáneo y es cada vez más utilizada en lugar del EMG en la evaluación inicial de pacientes con DMJ. La biopsia muscular sigue siendo necesaria para confirmar el diagnóstico en pacientes sin las alteraciones cutáneas características o con manifestaciones atípicas (debilidad muscular asimétrica, localizada o de predominio distal, atrofia muscular, fasciculaciones…) y para establecer un pronóstico según el grado de afectación. La calcinosis es fácilmente apreciable en las radiografías simples. En la capilaroscopia del lecho ungueal, se aprecia una disminución de la densidad de los capilares en casi todos los pacientes y es útil para el diagnóstico y el seguimiento. Es recomendable, la realización de una radiografía de tórax y pruebas de función pulmonar al inicio del cuadro y durante su evolución, al igual que un ECG y un ecocardiograma basales.
Tratamiento
El tratamiento se basa en la administración inicial de prednisona a dosis de 2 mg/kg/día vía oral repartido en 2-3 dosis, pudiendo administrarse previamente bolos de metilprednisolona a 30 mg/kg vía intravenosa durante 3 días en los pacientes graves. Una vez mejoren los síntomas, normalmente a las 2-4 semanas, se administra en una sola dosis y se inicia el descenso de forma progresiva, dejando una dosis de 5-10 mg/día durante, al menos, 12-24 meses. El uso de metotrexato se inicia precozmente como ahorrador de esteroides a una dosis de 15 mg/m2/semana vía subcutánea. En los casos graves o refractarios, ha demostrado su utilidad la administración de inmunoglobulinas intravenosas a dosis de 2 g/kg de forma periódica. Como terapia adyuvante de las lesiones cutáneas, puede utilizarse tratamientos tópicos (corticoides, tacrólimos, pimecrolimus) o asociar hidroxicloroquina oral a 3-6 mg/kg/día. Se deben administrar suplementos de calcio y vitamina D y recomendar protección solar. Aunque en la fase aguda se recomienda el reposo, el ejercicio físico aeróbico moderado aporta beneficios a los pacientes en remisión clínica.
Evolución y pronóstico
Durante los dos primeros años encontramos formas: monocíclicas (recuperación completa sin recidivas), policíclicas (recuperación completa con recaídas al suspender el tratamiento) y crónicas (mejoría parcial, actividad mantenida). La evaluación de la fuerza muscular se realiza mediante balances de los principales grupos musculares y el Childhood Myositis Assesment Scale (CMAS), utilizándose para monitorizar la actividad de la enfermedad diversas escalas, como el Myositis Disease Activity Assesment Tool (MDAAT). A largo plazo, la mayor parte de los pacientes realiza una vida normal, aunque no todos puedan realizar actividad física intensa y hasta un 5% puede necesitar una silla de ruedas para desplazarse. En un 25-30%, quedan contracturas articulares y atrofia muscular, como secuelas. Con los tratamientos actuales, la mortalidad se ha reducido considerablemente (solo un 1-2% de los casos, normalmente debido a complicaciones respiratorias(13-15).
Esclerodermia pediátrica
La esclerodermia agrupa a un conjunto de enfermedades caracterizadas por la fibrosis o excesivo depósito de colágeno en la piel y en otros tejidos, diferenciándose formas localizadas o sistémicas, dependiendo de la localización y extensión de la fibrosis.
La causa es desconocida, encontrándose alteraciones inmunológicas y de la regulación de los fibroblastos y de la producción de colágeno. Algunas similitudes con la enfermedad injerto contra huésped sugieren que células no propias o microquimerismo puedan estar implicadas en la patogénesis de la enfermedad. Algunos fármacos (bleomicina, bromocriptina) pueden inducir reacciones esclerodermia-like.
Esclerodermia localizada
Es la forma de esclerodermia más frecuente en la infancia, con una incidencia de 3,4 casos por cada 1.000.000 niños al año. La edad media de aparición es entre los 7-9 años, con un predominio del sexo femenino (2:1). Se caracteriza por la afectación de la piel y tejidos subyacentes (incluyendo: fascia, músculo, tendón, cápsula articular), distinguiéndose diversos subtipos según la profundidad y el patrón de afectación de las lesiones (Tabla V)(16).
La esclerodermia lineal (Fig. 6) es la forma más frecuente en niños y adolescentes (65%).
Figura 6. Esclerodermia lineal.
Manifestaciones clínicas
El cuadro comienza de manera insidiosa con un edema cutáneo localizado con bordes eritematosos o violáceos, seguido de un progresivo endurecimiento de la piel y tejidos subyacentes, con frecuencia, asociado a alteraciones de la pigmentación, alopecia y anhidrosis. En un 25% de los pacientes, existen manifestaciones extracutáneas, principalmente musculoesqueléticas (artralgias/artritis) y, en pacientes con esclerodermia lineal con afectación de cara/cuero cabelludo, manifestaciones neurológicas (cefalea, convulsiones, trastornos del comportamiento) y oculares (epiescleritis, uveítis, afectación palpebral).
Alteraciones en los estudios complementarios
El diagnóstico es clínico, no existiendo alteraciones analíticas características. Pueden detectarse ANA (23-73%), aunque sin una correlación clínica significativa, así como FR (25-40%), asociado a manifestaciones articulares.
Tratamiento
En las lesiones circunscritas superficiales con signos de actividad, puede realizarse tratamiento tópico con corticoides, inhibidores de la calcineurina (tacrólimus, pimecrolimus) o con fototerapia con luz ultravioleta (UV). En los casos en los que existe afectación profunda, que cruza articulaciones (riesgo de limitación funcional), lesiones lineales o atróficas que afectan a cara o cuero cabelludo, una progresión rápida o una distribución amplia de las lesiones y/o un fracaso a los tratamientos tópicos o terapia UV, se utilizan corticoides orales (prednisona a 0,5-1 g/kg/día) asociado a metotrexato a dosis de 10-15 mg/m2/semana vía oral o subcutánea. En los casos refractarios al metotrexato, puede utilizarse micofenolato mofetilo. Puede ser necesaria la realización de fisioterapia para mejorar contracturas articulares y cirugía plástica para la reconstrucción de alteraciones faciales.
Evolución y pronóstico
La duración media de la actividad de la esclerodermia localizada suele estar limitada a 3-5 años y la progresión a esclerosis sistémica es excepcional. El pronóstico va a depender de la superficie cutánea afectada, su localización y del grado de induración, así como de las secuelas articulares (contracturas, dismetría de extremidades, limitación de la función) y neurológicas y el impacto psicológico de la enfermedad.
Esclerosis sistémica
La esclerosis sistémica (ES) es una enfermedad muy rara en niños, con una incidencia anual de 1 paciente por cada millón de niños. La edad media de aparición es entre 7-9 años, con un predominio del sexo femenino (4:1). Se caracteriza por la afectación de piel, vasos y órganos internos. Los criterios para la clasificación de las esclerodermias sistémicas pediátricas están recogidos en la tabla VI(17).
Manifestaciones clínicas
El inicio de la enfermedad se caracteriza por el desarrollo de un fenómeno de Raynaud, asociado a: edema e induración progresiva en manos y cara, telangiectasias (cara y extremidades superiores) y alteraciones capilares en el lecho ungueal. Otras manifestaciones cutáneas son: la calcinosis o depósitos subcutáneos de calcio (codos, rodillas), las úlceras digitales y las alteraciones en la pigmentación de las zonas afectadas. Las principales manifestaciones extracutáneas son: gastrointestinales (reflujo gastroesofágico, trastornos en la motilidad digestiva), respiratorias (alteraciones en las pruebas de función pulmonar, enfermedad intersticial pulmonar, hipertensión pulmonar) y musculoesqueléticas (artralgias y artritis, sobre todo en manos).
Alteraciones en los estudios complementarios
El hemograma, la orina y los reactantes de fase aguda suelen ser normales. La mayoría de los pacientes tienen ANA (80-97%), siendo característica la positividad a los anticuerpos antitopoisomerasa (o Scl-70) y los anticuerpos anticentrómero. La radiografía simple detecta la presencia de calcificaciones, erosiones articulares y acrosteolisis. El estudio de los pacientes con síntomas de reflujo gastroesofágico incluye: una manometría, una pHmetría y, en algunos casos, una endoscopia digestiva alta. En los niños con sospecha de ES, debe realizarse en la valoración inicial: una radiografía de tórax, pruebas de función pulmonar (espirometría, difusión de la capacidad de monóxido de carbono), un ECG y un ecocardiograma. Cuando existe una alteración de las pruebas de función pulmonar, es necesario evaluar la presencia de alveolitis (fase inflamatoria de la enfermedad intersticial pulmonar) mediante un TC de alta resolución (opacidades en vidrio esmerilado) y un lavado broncoalveolar (aumento de neutrófilos y eosinófilos, además de macrófagos alveolares).
Tratamiento
El metotrexato y el micofenolato han demostrado mejorar la clínica cutánea, mientras que para la enfermedad pulmonar intersiticial se precisa el uso de ciclofosfamida. El tratamiento sintomático es fundamental, utilizándose nifedipino o iloprost para el fenómeno de Raynaud, inhibidores de la bomba de protones para el reflujo gastroesofágico y procinéticos para los trastornos de la motilidad. Algunas recomendaciones generales incluyen una protección contra el frío y los traumatismos y la adecuada hidratación de la piel. Se necesitan programas de fisioterapia para mejorar las contracturas articulares.
Evolución y pronóstico
Aunque la afectación cutánea y las contracturas articulares pueden dar a una discapacidad funcional grave, el pronóstico está determinado por la afectación cardiopulmonar y renal. En la mayoría de los pacientes, la enfermedad progresa lentamente, con una supervivencia a los 20 años del 69-82,5%(18,19).
Enfermedad mixta del tejido conectivo
La enfermedad mixta del tejido conectivo (EMTC) se caracteriza por presentar signos y síntomas de dos o más enfermedades reumáticas y la presencia de anticuerpos anti-RNP.
Es muy poco frecuente, con una edad media de inicio de 11 años y predominio en niñas (6:1). No existen unos criterios de clasificación adaptados para Pediatría.
Manifestaciones clínicas
Las manifestaciones clínicas iniciales más frecuentes son: la presencia de un síndrome constitucional asociado a fenómeno de Raynaud y la poliartritis de manos, apareciendo progresivamente manifestaciones de AIJ (sinovitis), LES (exantema malar, pleuritis, pericarditis, adenopatías), DMJ (debilidad muscular, miositis) y ES (esclerodactilia, enfermedad pulmonar intersticial, trastornos en la motilidad esofágica).
Alteraciones en los estudios complementarios
Es frecuente encontrar en el hemograma: anemia, leucopenia y/o trombocitopenia. Otras alteraciones comunes son: la hipocomplementemia, la elevación de las enzimas musculares y la presencia de FR positivo. Los títulos de ANA están elevados, siendo los anticuerpos anti-RNP a títulos altos, característicos de esta enfermedad.
Tratamiento
La mayoría de pacientes suelen responder a corticoides a dosis bajas, antiinflamatorios no esteroideos (AINEs), hidroxicloroquina o combinaciones de estas medicaciones. El fenómeno de Raynaud se trata evitando el frío y el estrés emocional y, en los casos más graves, con nifedipino. Cuando existe una afectación visceral importante, se requieren corticoides a dosis altas e inmunosupresores.
Evolución y pronóstico
El pronóstico a largo plazo es variable, siendo peor para los casos que se asemejan a LES y, especialmente, si asocian trombocitopenia e insuficiencia renal(20).
Síndrome de Sjögren
El síndrome de Sjögren se caracteriza por la inflamación de las glándulas exocrinas, principalmente glándulas salivales y lagrimales.
El síndrome de Sjögren es la enfermedad del tejido conectivo menos frecuente en la infancia. En las formas juveniles, la forma de presentación habitual es la parotiditis recurrente (75% casos), apareciendo, posteriormente, sequedad oral (dificultad para salivar durante las comidas o para hablar) y ocular, además de otras manifestaciones sistémicas variables. La sospecha diagnóstica se refuerza con la presencia de ANA y anticuerpos anti-SSA o anti-SSB en la analítica y puede confirmarse mediante el estudio anatomopatológico de biopsias de glándulas salivares menores, que demuestra un infiltrado inflamatorio linfocitario. El tratamiento suele ser sintomático: lágrimas artificiales, estimulantes de la salivación, una buena higiene dental y antiinflamatorios no esteroideos para los dolores articulares. Para el tratamiento de las manifestaciones sistémicas, se utiliza hidroxicloroquina o metotrexato. Es importante tener en cuenta durante su seguimiento, que existe un riesgo aumentado de linfoma en estos pacientes(1).
Funciones del pediatra de Atención Primaria
• Derivación precoz a atención especializada de pacientes con sospecha de conectivopatía o de una reagudización de una conectivopatía ya diagnosticada.
• Asegurar el cumplimiento del calendario vacunal de estos pacientes, prestando especial atención a la vacunación frente al neumococo, la varicela, la triple vírica y la gripe.
• Favorecer la adherencia terapéutica de estos pacientes y monitorizar los efectos adversos de los tratamientos empleados, colaborando en la realización de controles analíticos periódicos.
• Tratamiento precoz de las infecciones y otras complicaciones, así como control de los factores de riesgo cardiovascular.
Bibliografía
Los asteriscos reflejan el interés del artículo según los autores.
1.* Kumar TS, Aggarwal A. Approach to a patient with connective tissue disease. Indian J Pediatr. 2010; 77: 1157-64.
2.*** Hochberg MC. Updating the American College of Rheumatology revised criteria for the classification of systemic lupus erythematosus. Arthritis Rheum. 1997; 40: 1725.
3.** Malattia C, Martini A. Paediatric-onset systemic lupus erythematosus. Best Pract Res Clin Rheumatol. 2013; 27: 351-62.
4.* Frieri M. Mechanisms of disease for the clinician: systemic lupus erythematosus. Ann Allergy Asthma Immunol. 2013; 110: 228-32.
5.** Chiewchengchol D, Murphy R, Edwards SW, et al. Mucocutaneous manifestations in juvenile-onset systemic lupus erythematosus: a review of the literature. Pediatr Rheumatol Online J. 2015; 13: 1.
6.** Weening JJ, D´Agati VD, Scwartz MM, et al. The classification of glomerulonephritis in systemic lupus erythematosus revisited. J Am Soc Nephrol. 2004; 15: 241-50.
7.*** Arici ZS, Batu ED, Ozen S. Reviewing the recommendations for lupus in Children. Curr Rheumatol Rep. 2015; 17: 17.
8.*** Weiss JE. Pediatric systemic lupus erythematosus: more than a positive antinuclear antibody. Pediatr Rev. 2012; 33: 62-73.
9.** Levy DM, Kamphuis S. Systemic Lupus erythematosus in children and adolescents. Pediatr Clin N Am. 2012; 59: 345-64.
10.** Silverman E, Eddy A. Systemic lupus erythematosus. En: Cassidy JT, ed. Textbook of pediatric rheumatology. Saunders Elsevier, Philadelphia. 2011, p315-43.
11.* Leone A, Sciascia S, Kamal A, et al. Biological for the treatment of systemic lupus erythematosus: current status and emerging therapies. Expert Rev Clin Immunol. 2015; 11: 109-16.
12.*** Bohan A, Peter JB. Polymiositis and dermatomyositis (first of two parts). N Engl J Med. 1975; 292: 344-7.
13. Ernste FC, Reed AM. Recent advances in juvenile idiopathic inflammatory myopathies. Curr Opin Rheumatol. 2014; 26: 671-8.
14.*** Huber AM. Idiopathic inflammatory myopathies in childhood: current concepts. Pediatr Clin N Am. 2012; 59: 365-80.
15.** Rider LG, Lindsley CB, Cassidy JT. Juvenile dermatomiositis. En Cassidy JT, ed. Textbook of pediatric rheumatology. Saunders Elsevier, Philadelphia. 2011, p375-413.
16.** Laxer RM, Zulian F. Localized sclerodermas. Curr Opin Rheumatol. 2006; 18: 606-13.
17.** Zulian F, Woo P, Athreya BH, et al. The Pediatric Rheumatology European Society/America College of Rheumatology/European League against Rheumatism provisional classification criteria for juvenile systemic sclerosis. Arthritis rheum. 2007; 57: 203-12.
18.*** Torok KS. Pediatric scleroderma: systemic or localized forms. Pediatr Clin N Am. 2012; 59: 381-45.
19.** Zulian F, Cassidy JT. The systemic sclerodermas and related disorders. En: Cassidy JT, ed. Textbook of pediatric rheumatology. Saunders Elsevier, Philadelphia. 2011, p414-37.
20.** Pepmueller PH, Linsley CB, Cassidy JT. Mixed connective tissue disease and undifferentiated connective tissue disease. En: Cassidy JT, ed. Textbook of pediatric rheumatology. Saunders Elsevier, Philadelphia. 2011, p448-57.
21. Clemente D. Conectivopatías. Pediatr Integral. 2013; XVII(1): 57-65.
Bibliografía comentada
- Weiss JE. Pediatric systemic lupus erythematosus: more than a positive antinuclear antibody. Pediatr Rev. 2012; 33(2): 62-73.
Artículo de revisión con especial atención a las manifestaciones clínicas y el diagnóstico del lupus eritematoso sistémico y el papel de los pediatras en su manejo.
- Arici ZS, Batu ED, Ozen S. Reviewing the recommendations for lupus in Children. Curr Rheumatol Rep. 2015; 17: 17.
Artículo que revisa las recomendaciones para el tratamiento de las distintas manifestaciones que aparecen en el lupus eritematoso sistémico.
- Huber AM. Idiopathic inflammatory myopathies in childhood: current concepts. Pediatr Clin N Am. 2012; 59: 365-80.
Amplia revisión del tema con actualización de los métodos diagnósticos y de tratamiento en dermatomiositis juvenil.
- Torok KS. Pediatric scleroderma: systemic or localized forms. Pediatr Clin N Am. 2012; 59: 381-45.
Buena revisión de las esclerodermias pediátricas, actualizando conceptos de patogénesis, diagnóstico y tratamiento.
- Cassidy JT. Textbook of pediatric rheumatology. Philadelphia: Saunders Elsevier; 2011.
Libro de referencia de reumatología pediátrica, escrito por expertos a nivel mundial, que desarrolla de forma comprensiva todas las enfermedades reumáticas. En inglés, se puede acceder on-line.
| Caso clínico |
|
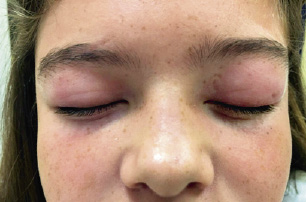
Niña de 10 años que presenta edema y eritema palpebral bilateral de un mes de evolución. Ha sido tratada con un colirio antihistamínico sin mejoría. Desde hace una semana, se queja de astenia y debilidad muscular generalizada, de predominio en cintura escapular y pelviana. Sin fiebre ni manifestaciones digestivas ni respiratorias. Antecedentes familiares Padres sanos no consanguíneos. Hermana de 4 años seguida en consulta de reumatología por fiebre periódica ya resuelta. Antecedentes personales Embarazo: diabetes gestacional, controlada con dieta. Parto a término, sin alteraciones. Periodo neonatal normal. Desarrollo psicomotor normal. Sin alergias medicamentosas. Inmunizaciones según calendario. Exploración física Aceptable estado general. Bien hidratada, nutrida y perfundida. Edema palpebral bilateral de coloración violácea (Fig. 7). Figura 7. Sin otras lesiones cutáneas. Sin adenopatías palpables. Auscultación cardiopulmonar normal. Abdomen: blando, depresible, no doloroso a la palpación, no masas ni visceromegalias. Neurológico: debilidad muscular marcada con fuerza 2/5 en deltoides, 2/5 en bíceps braquial, 3/5 en extensores de muñeca, 3/5 cuadriceps, 4/5 en extensores de tobillo, 3/5 en flexores del cuello, 3/5 en glúteo mediano y 3/5 en glúteo mayor. Exploración ORL: normal. Locomotor: sin articulaciones dolorosas, limitadas ni tumefactas. Pruebas complementarias Hemograma: leucocitos: 13.200/μL (fórmula normal), hemoglobina: 13,6 g/dl, hematocrito: 41,3%, VCM: 85,5 fL, plaquetas: 265.000/μL. Bioquímica: CK: 9.484 U/L (21-250), GOT: 373 U/L (20-57), GPT: 152 U/L (17-43), LDH: 1.236 U/L (110-295), proteínas totales: 7,3 g/dL, albúmina: 3,4 g/dL, resto normal. VSG: 27 mm/h, PCR: 2,9 mg/dL. Estudio de coagulación: normal. Sedimento de orina: normal. Inmunología: IgA: 210 mg/dL (40-250), IgG: 1.220 mg/dL (623-1581), IgM: 166 mg/dL (50-250). Complemento: C3: 98,5 mg/dL (86-184), C4: 22,9 mg/dL (16-47). Factor reumatoide < 20 UI/mL. ANA: positivo 1/160, anticuerpos anti-DNA: negativo. Anticuerpos frente a antígenos nucleares extraíbles negativos. Mantoux: 0 mm.
|