 |
| Temas de FC |
J. Miranda Barrios*, L. Sánchez García**, A. Pellicer Martínez***
*Médico interno residente de Pediatría. Hospital Universitario La Paz. Madrid / **Neonatóloga. Servicio de Neonatología. Hospital Universitario La Paz. Madrid / ***Neonatóloga. Jefe de Servicio de Neonatología. Hospital Universitario La Paz. Madrid
| Resumen
La infección congénita es la afectación del feto como consecuencia de una infección sistémica materna. Las vías de transmisión más frecuentes son la transplacentaria y el canal del parto. La etiología más común es viral, aunque hay que destacar en los últimos años un aumento de la incidencia de sífilis congénita. La mayor parte de estas infecciones son detectadas en la gestación, gracias al cribado sistemático mediante serología, así como el seguimiento del feto mediante ecografías prenatales seriadas. En ocasiones, la gestante presenta sintomatología como consecuencia de una primoinfección durante la gestación. La serología o reacción en cadena de la polimerasa, utilizada en una amplia variedad de muestras, permiten el diagnóstico de la infección fetal y neonatal. Gran parte de las infecciones congénitas son asintomáticas en el momento del nacimiento, pudiendo aparecer manifestaciones clínicas o secuelas de forma más tardía. Las que presentan síntomas al nacimiento suelen ser por afectación más grave. El tratamiento es específico para cada infección y las secuelas con afectación del neurodesarrollo y sensoriales suelen ser comunes a la mayoría. Gracias a la vacunación universal de la población, muchas de estas infecciones congénitas se han reducido de forma significativa. |
| Abstract
Congenital infection refers to fetal impairment as a consequence of a maternal systemic infection. The most frequent routes of transmission are transplacental and during vaginal delivery. The main etiology is viral, although it should be noted that, in recent years, there has been a raise in the incidence of congenital syphilis. Most of these infections are detected during pregnancy due to systematic serology screening and fetal monitoring by serial prenatal ultrasounds. Primary infection during pregnancy sometimes carries associated symptoms. Serology or polymerase chain reaction used on a wide variety of samples allows diagnosis of fetal and neonatal infection. Most congenital infections are asymptomatic at birth, with clinical picture and sequelae appearing later in the infant’s life. Symptomatic infection at birth associates a more severe involvement. Treatment is infection-specific; however, the risk of neurodevelopmental impairment or sensory involvement are common to the majority of them. Due to universal vaccination of the population, many of these congenital infections have been significantly reduced. |
Palabras clave: Infección congénita; Serología; Hipoacusia; Citomegalovirus; Sífilis; Virus herpes.
Key words: Congenital infection; Serology; Hearing loss; Cytomegalovirus; Syphilis; Herpes virus.
Pediatr Integral 2023; XXVII (7): 364 – 373
OBJETIVOS
• Actualización de las enfermedades infecciosas más comunes que la madre puede transmitir al feto durante la gestación, al nacimiento o tras el mismo.
• Conocimiento básico del microorganismo causante, patogenia, aspectos epidemiológicos, y diagnóstico en la gestante y en el feto de cada una de las infecciones. Tratamiento tanto en la gestante como en el recién nacido.
• Interpretación de las serologías a realizar en el cribado y diagnóstico de las infecciones congénitas, tanto en la madre como en el recién nacido, incluyendo el estudio de la avidez de los anticuerpos IgG, para diferenciar una infección primaria aguda de un estado de inmunidad o de infección crónica.
• Actualizar los conocimientos sobre la infección congénita por citomegalovirus, teniendo en cuenta que es la infección congénita más frecuente en los países desarrollados, conocer el proceso diagnóstico-terapéutico, así como el seguimiento más adecuado para optimizar el pronóstico a largo plazo.
• Actualizar los conocimientos sobre la infección por Treponema pallidum, debido al aumento de casos en la última década, con el fin de optimizar el manejo de la madre y del recién nacido para evitar o disminuir las secuelas.
Infecciones congénitas (TORCH y parvovirus B19)
Introducción: definición de infección congénita, mecanismos de transmisión y microorganismos implicados
La infección congénita es un término que incluye a todas las infecciones que afectan al embrión, feto o recién nacido (RN), como consecuencia de una infección sistémica materna durante la gestación.
La transmisión de la infección de la madre a su hijo puede ocurrir de forma intrauterina (siendo lo más frecuente el origen hematógeno con paso transplacentario o propagación ascendente desde vagina al líquido amniótico [LA]), en el momento del parto o perinatal (normalmente por contacto directo a través del canal del parto) o tras el mismo (postnatal, como ocurre mediante la lactancia materna).
La efectividad de la transmisión y gravedad de la enfermedad en el feto o RN depende del agente etiológico, de la edad gestacional y del tipo de infección (primoinfección vs reinfección/reactivación).
El espectro clínico de este tipo de infecciones es muy variable, desde: muerte fetal o aborto, aparición de malformaciones, parto prematuro, retraso en el crecimiento intrauterino, infección aguda al nacimiento o, incluso, ser asintomática en el periodo neonatal con aparición posterior de secuelas(1-3).
Tradicionalmente, a las infecciones de transmisión congénita se les ha denominado bajo el acrónimo TORCH, respondiendo a los principales microorganismos implicados. Sin embargo, dentro del grupo O(Others) se han incluido más microorganismos causales (Tabla I)(2).
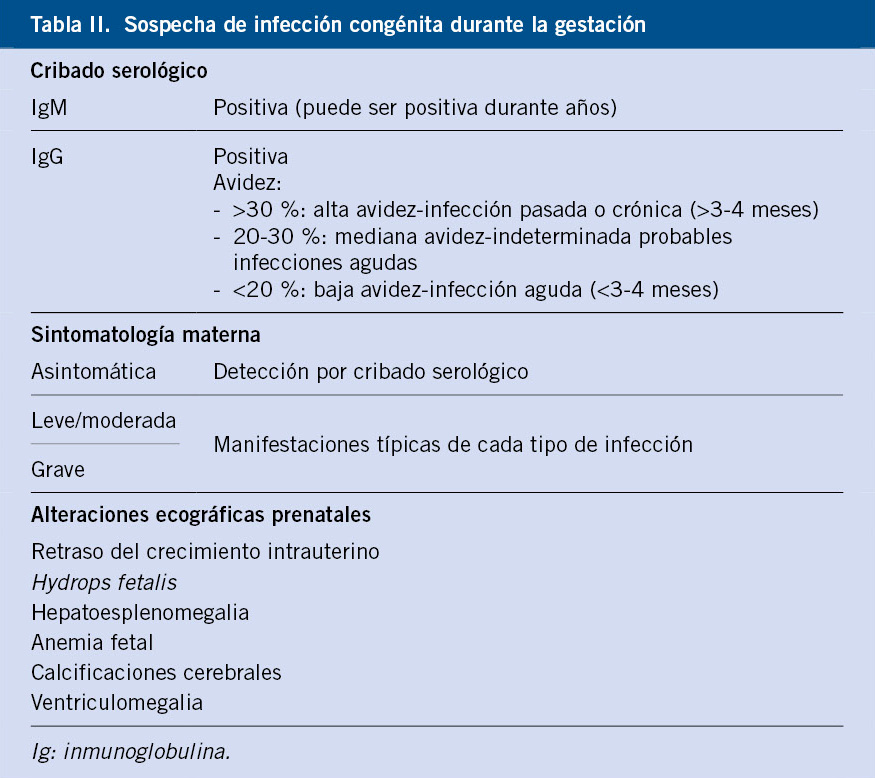
Sospecha de infección congénita durante la gestación
Lo más frecuente es mediante la detección de una seroconversión materna o de signos sugestivos de infección fetal en las ecografías prenatales (Tabla II).
En los últimos años, se ha utilizado el estudio de la avidez de los anticuerpos IgG para diferenciar la infección primaria aguda de la respuesta IgM específica mantenida en el tiempo. La reacción se basa en investigar la avidez o afinidad que tienen los anticuerpos de la clase IgG por su antígeno correspondiente. Hasta el momento, es la mejor prueba disponible para documentar el tiempo de evolución de la infección y en una sola muestra, pero tampoco aporta resultados definitivos, dado que los anticuerpos de baja avidez pueden persistir más de cinco meses e incluso un año después de haberse producido la infección(4).
Diagnóstico de laboratorio de infección congénita en el periodo neonatal
La determinación de anticuerpos específicos mediante la serología, que determina las inmunoglobulinas G, M o A, es cada vez menos usada en el periodo neonatal; ya que, en ocasiones, sus resultados son difícilmente interpretables, porque puede ocurrir que la IgM, en el caso de algunas infecciones congénitas, persista positiva sin que exista una infección aguda, o bien que la IgG todavía no haya alcanzado títulos detectables, por lo que debe interpretarse de manera combinada junto con la existencia de manifestaciones clínicas. La inmunoglobulina G atraviesa la placenta y en el neonato es positiva por transmisión pasiva materna y tarda en desaparecer aproximadamente entre 6 y 12 meses. Las inmunoglobulinas A y M no atraviesan la placenta, por lo que un título positivo en la primera semana de vida indica infección; si bien, en ocasiones, puede ser negativa.
Actualmente se ha empleado la reacción en cadena de polimerasa (PCR) en muestras de sangre, orina, lesiones cutáneas o LCR para el diagnóstico de muchas de las infecciones congénitas.
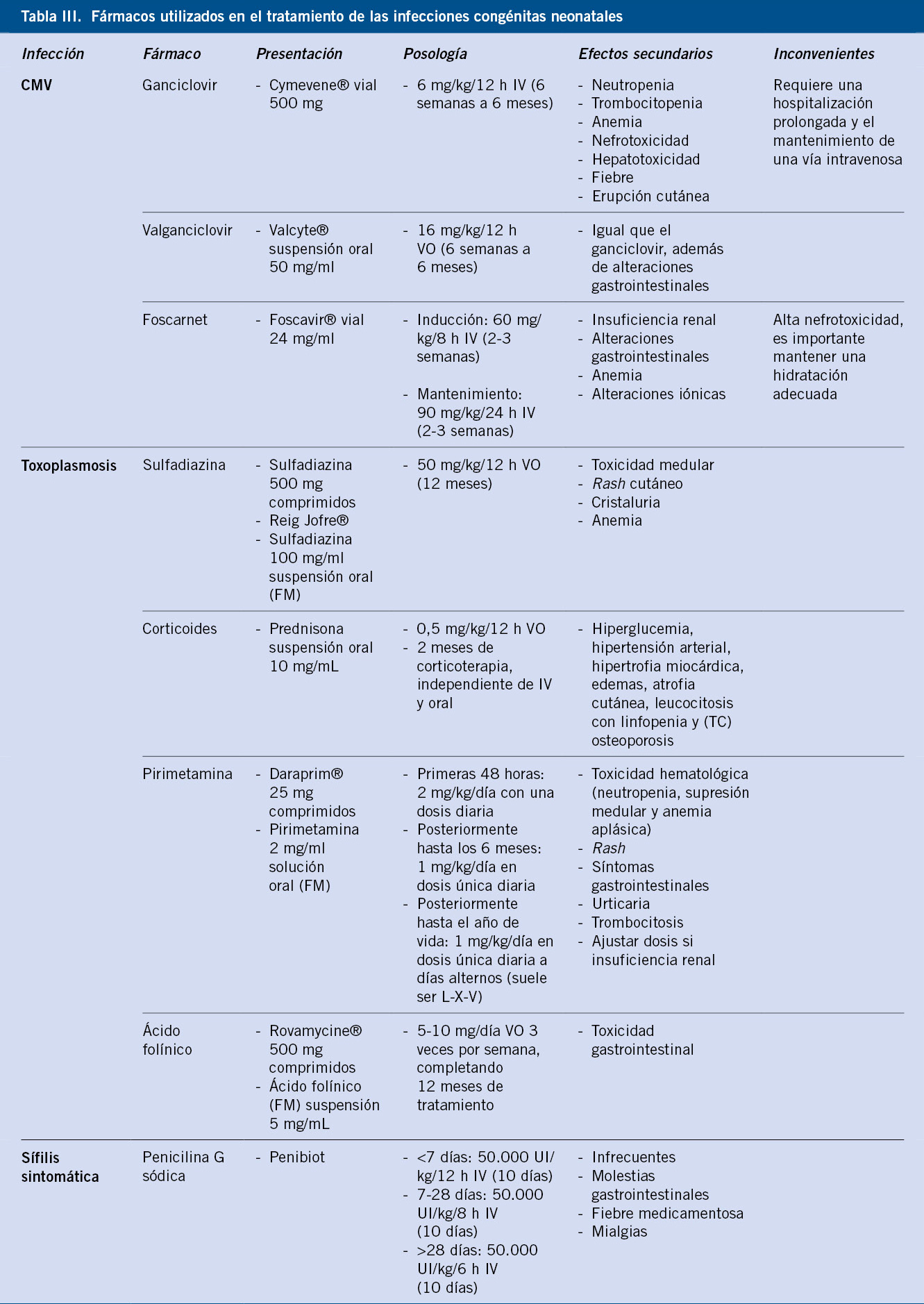
El tratamiento debe ser dirigido en cada una de las infecciones congénitas (Tabla III); de ahí, la importancia de su diagnóstico etiológico precoz(1-4).
Toxoplasmosis
La toxoplasmosis congénita es una enfermedad prevenible mediante el cribado gestacional y el establecimiento de medidas de profilaxis primaria en las gestantes seronegativas. La mayoría de los niños infectados nacen asintomáticos, pero hasta el 80 % desarrolla secuelas visuales o neurológicas durante su infancia y adolescencia.
Introducción (microbiología, patogenia y epidemiología)
Toxoplasma gondii es un parásito protozoario ubicuo que infecta a animales y humanos. La infección por toxoplasma suele ser asintomática en huéspedes inmunocompetentes. Sin embargo, puede producir una enfermedad grave, con mayor frecuencia en el contexto de inmunosupresión o infección congénita.
La toxoplasmosis congénita (TC) es la consecuencia de la transmisión fetal por vía transplacentaria de la primoinfección materna(5). La incidencia de la toxoplasmosis gestacional varía mucho de unos países a otros. En España, solo entre el 11 y el 28 % de las embarazadas presentan inmunidad frente a toxoplasma al realizar el cribado, aunque la incidencia de toxoplasmosis gestacional es del 1,9‰(6).
Infección materna
Puede ser asintomática o bien generar un cuadro mononucleósico. El diagnóstico se establece mediante la demostración de seroconversión de la IgG durante el embarazo o el aumento por 3 o más de los títulos de IgG entre 2 extracciones separadas 3-4 semanas.
La presencia de una IgM positiva, debido a su persistencia prolongada en el tiempo tras la infección aguda, no indica con seguridad que la infección haya tenido lugar durante la gestación y por ello es conveniente realizar estudio de avidez de la IgG: la presencia en el primer trimestre de una IgM positiva con IgG de baja avidez hace que la infección gestacional sea probable, por lo que debe investigarse si existe infección fetal mediante la realización de PCR en LA a partir de la semana 18. El riesgo de transmisión varía según la edad gestacional en la que se encuentre en el momento de la infección: a mayor edad gestacional, mayor riesgo de infección en el feto, pero disminuye la gravedad.
Los objetivos del tratamiento durante la gestación consisten en disminuir el riesgo de infección fetal y de las secuelas, tema controvertido. El tratamiento más habitual consiste en:
• Espiramicina: desde el momento que se documente la infección, ya que no atraviesa fácilmente la placenta y aunque no actúa sobre el feto infectado, sí se acumula en la placenta disminuyendo la transmisión un 50%.
• Pirimetamina-sulfadiazina, cuando la terapia se inicia posteriormente (≥14 semanas).
Se mantiene hasta la realización de PCR en LA (recomendable >18 semanas de gestación) y según resultado:
• Positivo: mantener tratamiento con pirimetamina-sulfadiazina más ácido folínico.
• Negativo: mantener profilaxis con espiramicina(7).
Infección neonatal
La tríada clásica de la TC consiste en: coriorretinitis, hidrocefalia y calcificaciones intracraneales, pero solo ocurre en <10 % de los casos. Otras posibles manifestaciones clínicas pueden ser: hepatomegalia, esplenomegalia, ictericia, anemia, convulsiones o microcefalia.
Los criterios diagnósticos de TC incluyen cualquiera de los siguientes:
• Persistencia de anticuerpos IgG más allá de los 12 meses de edad.
• Anticuerpos IgG y anticuerpos IgM y/o IgA positivos.
• PCR positiva en LA, sangre, líquido cefalorraquídeo (LCR) y orina.
• Anticuerpos neonatales IgG positivos e IgM e IgA negativos con evidencia serológica de infección materna aguda durante el embarazo y presencia de manifestaciones clínicas sugestivas de TC.
En el recién nacido con alta sospecha de TC por seroconversión materna y/o PCR en LA, deberán realizarse los siguientes estudios:
• Estudio microbiológico (IgM, IgG, si disponible, realizar también IgA) en la primera semana de vida.
• PCR en sangre/orina.
• Hemograma y bioquímica con función hepática y renal.
• Fondo de ojo.
• Ecografía transfontanelar.
• No es necesario realizar punción lumbar.
El tratamiento (Tabla III) debe iniciarse lo más precozmente posible y analítico muy estrecho con especial atención a la aparición de toxicidad hematológica, cutánea y renal, que consiste en:
• 12 meses de pirimetamina, sulfadiazina y ácido folínico.
• 2 meses de corticoides si coriorretinitis.
Se debe realizar seguimiento:
• Auditivo: al nacimiento y al año de vida.
• Oftalmológico: al nacimiento y cada 3 meses hasta los 18 meses(7,8).
Rubéola
La rubéola congénita es una de las infecciones que ha disminuido de forma drástica gracias a la vacunación universal de la población.
Introducción (microbiología y epidemiología)
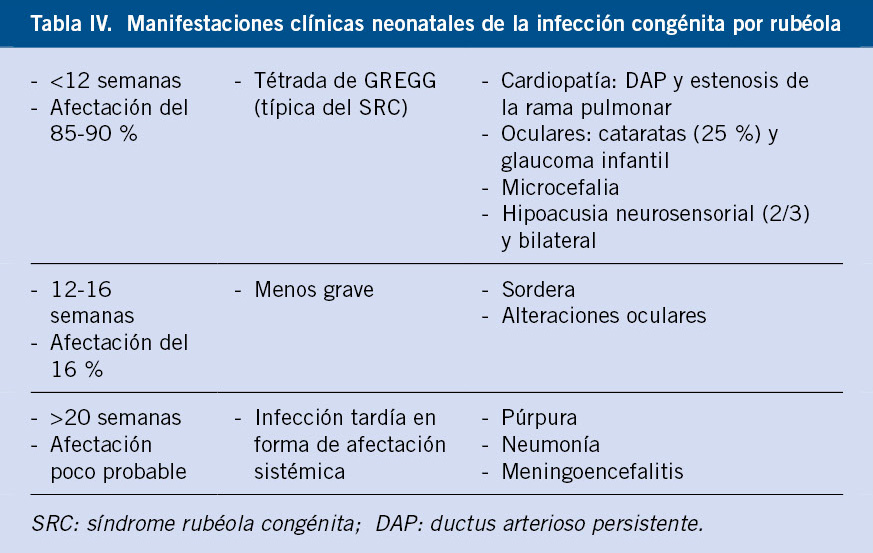
El virus de la rubéola es un virus ARN cuyo reservorio es el hombre y se transmite a través de secreciones respiratorias. A pesar de ser una enfermedad exantemática, generalmente leve, la infección durante la gestación, especialmente en el primer trimestre, puede resultar en aborto, muerte fetal(4) y el síndrome de rubéola congénita (SRC)(1,9). Según los datos del centro nacional de epidemiología (CNE), desde 1997 se han registrado 23 casos de SRC, el último de ellos en 2014. La mayoría de los casos corresponde a madres inmigrantes no vacunadas (70 %)(9). La vacunación sistemática infantil y de la mujer seronegativa, antes de la gestación, explican la existencia actual solo de casos esporádicos(1,10,11).
Infección materna y diagnóstico prenatal
Puede ser asintomática hasta en el 50 % de los casos y, en las sintomáticas, cursa con: malestar general, fiebre, cefalea, artralgias y rinoconjuntivitis, apareciendo posteriormente el exantema típico.
El diagnóstico es serológico. Solo está indicada la investigación de IgM específica en la embarazada con antecedentes de contacto con algún caso de rubéola, presencia de clínica asociada o anomalías fetales. La infección intrauterina se confirma mediante: detección de IgM en sangre fetal (obtenida después de la semana 22 por máximo rendimiento), detección directa del virus en vellosidades coriónicas o PCR en LA(9).
Infección neonatal
Ver manifestaciones clínicas neonatales de la infección congénita por rubéola en la tabla IV.
Citomegalovirus (CMV)
Introducción (microbiología y epidemiología)
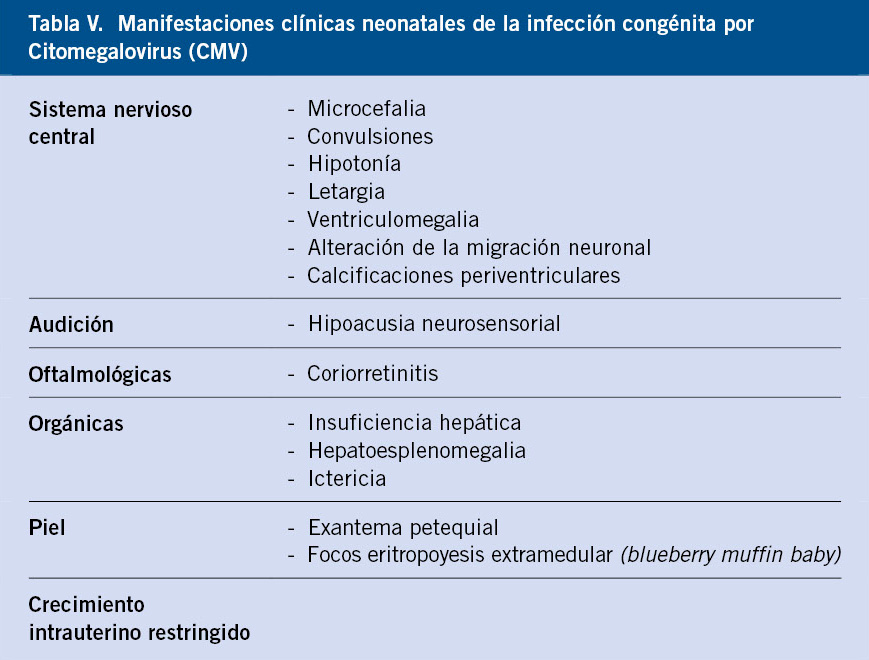
La infección por CMV es la infección congénita más frecuente en los países desarrollados. La seroprevalencia de infección en mujeres en edad fértil de entre 15-24 años es del 60 %, y en >36 años es del 95 %. Europa presenta unas tasas de prevalencia de infección congénita por CMV en torno al 0,3-0,6 % de los recién nacidos vivos. Es la causa más frecuente de hipoacusia neurosensorial congénita no genética y una de las causas más importantes de alteraciones en el neurodesarrollo(12).
Infección materna y diagnóstico prenatal
La primoinfección suele ser asintomática, aunque en un 30 % de los casos puede aparecer clínica inespecífica consistente en: fiebre, astenia, mialgias y linfoadenopatías.
El diagnóstico se realiza mediante la demostración de la seroconversión, aunque esto no es siempre posible debido a diferentes motivos. En principio, no se realiza cribado serológico sistemático a todas las embarazadas, ya que no hay evidencia sólida sobre la prevención del CMV congénito mediante ninguna intervención. La administración materna de valaciclovir para la infección primaria por citomegalovirus (CMV) reduce sustancialmente el riesgo de infección congénita por CMV, especialmente si se inicia antes de las 14 semanas de gestación y dentro de las 8 semanas posteriores a la infección materna, por ello es probable que exista una tendencia en los siguientes años a realizar un cribado en la gestante. En estos casos puede ser útil, por tanto, el estudio serológico de la IgM, la IgG y su avidez.
El diagnóstico de la infección fetal se realiza mediante la PCR en LA a partir de la semana 21 de gestación (comienza a excretar orina en líquido amniótico en la semana 19-20)(12).
Infección neonatal
El CMV congénito puede ser asintomático o sintomático (Tabla V). El diagnóstico del CMV congénito se realiza mediante PCR en una muestra de orina (o cualquier otro líquido estéril) dentro de las 3 primeras semanas de vida.
Ante un neonato con infección confirmada se realizarán las siguientes pruebas complementarias:
• Analítica con hemograma, función renal y hepática.
• PCR de CMV en sangre.
• LCR: citoquímico y PCR de CMV, únicamente en los casos sintomáticos.
• Fondo de ojo.
• Potenciales evocados auditivos de tronco cerebral.
• Ecografía cerebral.
• RM cerebral en los casos sintomáticos.
• EEG, si existe clínica neurológica o alteraciones en la neuroimagen.
• Potenciales evocados visuales de tronco cerebral (solo en el caso de que se observe una alteración del nervio óptico en el fondo de ojo o si existe una alteración en la vía visual en la RM cerebral).
El tratamiento (Tabla III) debe iniciarse lo más precozmente posible, dado que su efectividad es mayor si se inicia antes de los primeros 30 días de vida. Los CMV congénitos sintomáticos se tratarán de 6 semanas a 6 meses(12-14):
• Valganciclovir oral es el fármaco de elección hoy en día.
• Ganciclovir intravenoso está indicado en pacientes que no toleran la vía oral o cuya absorción intestinal es incierta.
Sífilis
Entidad poco frecuente, pero en los últimos años se ha registrado un aumento de casos de sífilis en Europa. El tratamiento de elección sigue siendo la penicilina. En los recién nacidos afectos existe riesgo de retraso psicomotor e hipoacusia neurosensorial, por lo que recibirán seguimiento multidisciplinar.
Introducción (microbiología y epidemiología)
La sífilis es una infección sistémica causada por Treponema pallidum. La sífilis congénita es el resultado de la transmisión fetal de la espiroqueta por vía transplacentaria o por contacto con lesiones activas en el momento del parto. Sucede tras la primoinfección materna, bien durante la fase clínica de la enfermedad o en el periodo latente(1,17). Entre 2010-2019 se notificaron 32 casos confirmados de sífilis congénita a la Red Nacional de Vigilancia Epidemiológica (RENAVE), lo que supone una tasa global de 0,76 por 100.000 nacidos vivos. La mediana de edad al diagnóstico fue de 2 días. La mayoría de los casos se encontraban asintomáticos y la manifestación clínica más frecuente fue la de hepatoesplenomegalia. El 65,6 % de las gestantes eran inmigrantes(16).
Infección materna y diagnóstico prenatal
El diagnóstico en la gestante es serológico mediante pruebas no treponémicas y treponémicas:
• Las pruebas no treponémicas o reagínicas (RPR, VDRL, ART) se basan en la detección de anticuerpos IgG e IgM. Los títulos de estos anticuerpos se correlacionan con la actividad de la enfermedad, nos permite monitorizar su evolución y la eficacia del tratamiento.
• Las pruebas treponémicas o específicas (FTA-ABS, TPHA, TPPA) se basan en la detección de anticuerpos contra un antígeno específico de la espiroqueta, por lo que se usan para confirmar el diagnóstico. Persisten toda la vida a pesar del tratamiento, por lo que no tienen ninguna utilidad para monitorización.
El cribado serológico de la embarazada está recomendado realizarse en la primera visita obstétrica, y debe repetirse durante el tercer trimestre y en el parto en las mujeres pertenecientes a grupos de alto riesgo de adquirir sífilis (adicción a drogas por vía parenteral, promiscuidad sexual e infección por VIH), que no hayan sido estudiadas previamente o que fuesen positivas en el primer trimestre.
El riesgo de transmisión vertical aumenta conforme avanza la gestación, mientras que la gravedad de la afectación fetal será mayor cuanto más precoz sea su adquisición.
El tratamiento consiste en penicilina G benzatina en dosis única en el caso de la sífilis primaria, secundaria o latente precoz (<1 año), y en una dosis semanal durante 3 semanas, en el caso de la sífilis latente tardía (>1 año) o cuando no es posible datar la primoinfección. Se considerará un tratamiento inadecuado, cuando se use un antibiótico diferente a la penicilina o se haya realizado de forma tardía (<30 días antes del parto)(17).
Infección neonatal
La sífilis congénita está compuesta por dos fases, la precoz (<2 años de vida) y la tardía (>2 años de vida). El estadio precoz puede ser fulminante en el periodo neonatal (exantema vesiculoampolloso, pénfigo palmo-plantar, ictericia por colestasis, hepatoesplenomegalia, lesiones óseas, trastornos hematológicos con citopenias de las tres series, fiebre y signos clínicos de sepsis, neumonitis, meningitis), o cursar de forma subclínica, con aparición más tardía de las manifestaciones clínicas, siendo las más típicas: la tríada de Hutchinson (dientes de Hutchinson, queratitis intersticial e hipoacusia neurosensorial).
La evaluación inicial consiste en realizar el mismo tipo de prueba en suero del recién nacido y en la madre, para comparar los títulos de anticuerpos y realizar el mismo tipo de prueba en suero del recién nacido y en la madre, normalmente RPR y serología treponémica FTA-ABS IgM (la positividad confirma la sífilis congénita). No debe usarse sangre de cordón, dado que podría estar contaminada con sangre materna. Se realizará, además:
• Hemograma con función hepática y renal.
• Estudio de LCR: citoquímico y serología no treponémica VDRL.
• Exudado de lesiones: visualización directa en campo oscuro y PCR a T. pallidum.
• Radiografía de huesos largos y de tórax (si clínica respiratoria).
• Neuroimagen ante el riesgo de neurosífilis en el periodo neonatal.
• Fondo de ojo.
• Potenciales evocados auditivos.
El tratamiento de elección sigue siendo la Penicilina (Tabla III). En el caso de RN asintomáticos con madre adecuadamente tratada, pero más de 1 mes antes del parto, o en el caso de no tratamiento materno, pero las pruebas complementarias en el RN sean normales, puede administrarse penicilina G benzatina IM 50.000 UI/kg/dosis (dosis única)(17,18).
Virus herpes simple (VHS)
La infección neonatal por VHS tiene una elevada morbimortalidad. Es por ello que es necesario mejorar el pronóstico, iniciando el tratamiento de forma precoz para disminuir el riesgo de secuelas.
Introducción (microbiología y epidemiología)
El VHS pertenece a la familia de los Herpesviridae. Existen dos tipos: VHS-1 y VHS-2. La infección por el VHS-1 acontece fundamentalmente a lo largo de la infancia, mientras que la infección por VHS-2 se relaciona con el inicio de las relaciones sexuales(19).
La incidencia estimada de la infección neonatal por VHS oscila entre 3 y 30 por cada 100.000 nacidos vivos. Se han producido cambios en la epidemiología y expresión clínica. De hecho, el VHS-1 ha sobrepasado al VHS-2 como agente viral más común en la infección neonatal, lo que ha coincidido con mayor afectación cutánea frente a periodos precedentes, donde dominaba la sintomatología asociada a la enfermedad del SNC o forma diseminada(20,21).
Infección neonatal
La infección por VHS neonatal se puede adquirir en tres periodos distintos:
1. Infección intrauterina (5 %): cursa con hidrops, alteraciones oculares, cutáneas y afectación del SNC.
2. Infección perinatal (85 %): el virus se adquiere al estar presente en el tracto genital de la mujer embarazada en el momento del parto.
3. Infecciones postnatales (10 %): por contacto directo con personas con una infección activa por VHS, como el herpes labial. Muy importante incluirla en el diagnóstico diferencial de un neonato con sepsis clínica, fallo hepático y lesiones cutáneas.
La infección perinatal y postnatal por VHS puede cursar con:
• Infección localizada de la piel, los ojos y la boca (SEM: skin-eye-mouth): se da en un 35-45 % de los casos. Puede parecer benigna al inicio, pero se asocia con un alto riesgo de progresión al SNC o enfermedad diseminada, si no se trata. Aparece generalmente a partir de la 2ª semana de vida en forma de lesiones vesiculares coalescentes o agrupadas, con una base eritematosa, y la afectación ocular inicialmente puede pasar desapercibida.
• Enfermedad del SNC (con o sin SEM): aproximadamente, en un 33 % de los casos. Puede ocurrir como resultado de diseminación retrógrada, desde la nasofaringe y los nervios olfatorios al cerebro, o por diseminación hematógena en enfermedad diseminada. Entre el 60-70 % de los recién nacidos con enfermedad del SNC por VHS tienen vesículas en la piel en algún momento del curso evolutivo de la enfermedad.
• Enfermedad diseminada: supone un 25 % de los casos y su curso clínico inicial es muy similar a la sepsis neonatal.
La terapia de supresión con aciclovir en la madre no elimina por completo el riesgo de transmisión, por lo que todo recién nacido por parto vaginal o cesárea de gestante, con lesiones activas en el momento del parto, debe ser estudiado, realizándose:
• Hemograma, bioquímica con función hepática y renal.
• Hemocultivo, ya que puede haber sobreinfección bacteriana.
• PCR en sangre y LCR.
• Serología, solo si las pruebas microbiológicas son negativas y existe alta sospecha.
• PCR +/- cultivo muestras de superficie (conjuntiva, boca, nasofaringe, recto).
• PCR +/- cultivo de lesiones cutáneas.
• Ecografía transfontanelar.
• Fondo de ojo.
• EEG convencional, en caso de que exista afectación del SNC(20,21).
El tratamiento de elección es el aciclovir en todas las formas, variando su duración según sea la afectación (Tabla III). En el caso de la afectación del SNC se recomienda repetir la PL cerca del término del tratamiento (21 días), porque se debería mantener hasta que se negativice la PCR, en el caso de que en este momento siga siendo positiva. En todas las formas clínicas se recomienda mantener un tratamiento supresor oral con aciclovir durante 6 meses. Las secuelas son principalmente neurológicas (retraso del desarrollo psicomotor, microcefalia, espasticidad, epilepsia), oculares y auditivas(21).
Parvovirus B-19 (P-B19)
Esta infección en la gestante puede resultar letal para el feto, si se adquiere en el primer trimestre. No existe tratamiento específico, más que el de soporte al nacimiento.
Introducción (microbiología y epidemiología)
El parvovirus B19 (Familia Parvoviridae) se transmite a través de secreciones respiratorias, por contacto vertical materno-fetal y a través de transfusión de hemoderivados. Tiene un especial tropismo por las células hematopoyéticas. También es capaz de infectar otros tejidos como las células miocárdicas fetales(22).
La incidencia de infección aguda por parvovirus B19 en el embarazo es del 3,3 al 3,8 %. Las tasas de infección en profesionales dedicados a la enseñanza son más altas (16 %), seguidos por los trabajadores de guarderías y amas de casa (9 %)(23).
Infección materna
Puede estar asociada con muerte o hidrops fetal. Sin embargo, no parece haber secuelas de desarrollo a largo plazo de la infección en aquellos pacientes que no desarrollan hidrops.
El diagnóstico en la gestante es serológico. El estudio de anticuerpos IgM e IgG detecta entre el 80-90 % de los pacientes con infección clínica por parvovirus B19. La PCR de LA es el gold standard para hacer el diagnóstico de infección fetal por parvovirus.
La única intervención potencialmente eficaz es la transfusión fetal intrauterina para el tratamiento de la anemia grave, aunque este procedimiento no es factible antes de las 20 semanas de gestación. Actualmente, no se recomienda el uso de inmunoglobulinas durante el embarazo(23).
Infección neonatal
En el caso de hidrops fetal se recomienda una anticipación para una adecuada estabilización neonatal inmediata, atendiendo adecuadamente la ventilación, que puede verse comprometida por: hipoplasia pulmonar, edema pulmonar, derrame pleural o ascitis. La paracentesis abdominal y la toracocentesis y la administración de hemoderivados, pueden ser necesarias antes o inmediatamente después del parto.
Zika
La infección por el virus del Zika intraútero puede provocar una restricción del crecimiento fetal y secuelas graves relacionadas con el SNC.
Introducción (microbiología y epidemiología)
El virus de Zika, perteneciente a la familia de los Flavivirus, se transmite principalmente a través de la picadura de mosquitos. Aunque los casos de enfermedad por el virus de Zika disminuyeron a partir de 2017 de manera internacional, en 2019 se notificaron los primeros casos locales de enfermedad por el virus de Zika, transmitida por mosquitos en Europa(24).
Infección materna
Tras la picadura del mosquito infectado por el virus, la sintomatología aparece tras un periodo de incubación de 3-12 días. La infección puede cursar de forma asintomática (80 % de los casos), o presentarse con: fiebre, mialgias y/o artralgias, exantema maculopapular pruriginoso, astenia, anorexia, conjuntivitis no purulenta y cefalea. Los síntomas duran entre 4 y 7 días y suelen autolimitarse.
Puesto que puede cursar de forma asintomática, debe investigarse en aquellas gestantes inmigrantes o viajeras procedentes de zonas endémicas (América central y Sudamérica, exceptuando Chile y Uruguay, India, Indonesia y Malasia). En aquellas mujeres con serología positiva, debe de realizarse un seguimiento ecográfico fetal estrecho, vigilando la aparición de: microcefalia, calcificaciones intracraneales u otras alteraciones de la neuroimagen cerebral de origen no filiado. En todos los casos de sospecha de infección materna, se debe realizar al nacimiento un estudio histopatológico y microbiológico (PCR) de la placenta. Aunque el virus Zika se ha aislado en la leche materna, no se ha comunicado transmisión por esta vía, por lo que se aconseja mantener lactancia materna(24,25).
Infección neonatal
Puede provocar una restricción del crecimiento fetal y secuelas graves en SNC: ventriculomegalia (33 %), microcefalia (24 %) y calcificaciones intracraneales (27 %).
Otras características clínicas del Zika congénito son: desproporción facial, hipertonía, hiperreflexia, convulsiones, artrogriposis, anomalías oculares e hipoacusia neurosensorial.
El riesgo de alteraciones neurológicas es mayor en infecciones en el primer trimestre.
Se realizará estudio a los recién nacidos de madres con serología de infección por Zika durante el embarazo, y a aquellos con hallazgos clínicos o de neuroimagen que sugieran Zika congénito y que tengan un vínculo epidemiológico materno que apoye una posible transmisión (incluida la exposición paterna).
Las pruebas complementarias a realizar en el neonato con sospecha de Zika congénito son:
• PCR en sangre y orina de Zika.
• Serología neonatal de Zika (IgG e IgM).
• LCR, solo se realizará en caso de que las pruebas anteriores sean negativas.
• Ecografía transfontanelar y/o RMN craneal.
• Fondo de ojo (en el primer mes de vida).
• Seguimiento auditivo por el riesgo de hipoacusia neurosensorial(25).
No existe un tratamiento específico para la infección por el virus del Zika.
Función del pediatra de Atención Primaria
• Las infecciones congénitas generalmente son diagnosticadas al nacimiento en el hospital, pero si no es así, es importante reconocer datos clínicos típicos de cada una de ellas para poder identificarla precozmente.
• La mayoría de las infecciones congénitas pueden tener manifestaciones clínicas de presentación tardía; de ahí, la importancia de un seguimiento clínico exhaustivo de estos niños, sobre todo, a nivel neurológico y auditivo.
• Los tratamientos de algunas de las infecciones congénitas son prolongados y es importante conocer y vigilar la aparición de los posibles efectos secundarios de los mismos.
Conflicto de intereses
No hay conflicto de interés en la elaboración del manuscrito. Declaración de intereses: ninguno.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio de los autores.
1.*** Badia J, Figaró C, Domingo M, Aldecoa V. Infecciones congénitas. Pediatr Integral. 2014; XVIII: 356-66. Disponible en: https://www.pediatriaintegral.es/publicacion-2014-07/infecciones-congenitas/.
2. Neu N, Duchon J, Zachariah P. TORCH infections. Clin Perinatol. 2015; 42: 77.
3. Maldonado YA, Nizet V, Klein JO, et al. Current concepts of infections of the fetus and newborn infant. En: Infectious Diseases of the Fetus and Newborn Infant, 7th ed, Remington JS, Klein JO, Wilson CB, et al (Eds). Elsevier Saunders. Philadelphia; 2011. p. 2.
4. Remington JS, Thulliez P, Montoya JG. Recent developments for diagnosis of toxoplasmosis. J Clin Microbiol. 2004; 42: 941-5.
5. McAuley JB, Boyer KM, Remington JS, McLeod RL. Toxoplasmosis. En: Feigin and Cherry’s Textbook of Pediatric Infectious Diseases, 7th, Cherry JD, Harrison GJ, Kaplan SL, et al (Eds). Elsevier Saunders. Philadelphia; 2014. p. 2987.
6.*** Baquero-Artigao F, del Castillo Martín F, Fuentes Corripio I, Goncé Mellgren A, Fortuny Guasch C, de la Calle Fernández-Miranda M, et al. Guía de la Sociedad Española de Infectología Pediátrica para el diagnóstico y tratamiento de la toxoplasmosis congénita. An Pediatr (Barc). 2013; 79: 116.e1-e16. Disponible en: https://dx.doi.org/10.1016/j.anpedi.2012.12.001.
7. Peyron F, L’ollivier C, Mandelbrot L, Wallon M, Piarroux R, Kieffer F, et al. Maternal and congenital toxoplasmosis: diagnosis and treatment recommendations of a French multidisciplinary working group. Pathogens. 2019; 8: 24. Disponible en: https://doi.org/10.3390/pathogens8010024.
8. Maldonado YA, Read JS, Committee on Infectious Diseases. Diagnosis, treatment, and prevention of congenital toxoplasmosis in the United States. Pediatrics. 2017; 139: e20163860. Disponible en: https://dx.doi.org/10.1542/peds.2016-3860.
9. Boucoiran I, Castillo E. No. 368-Rubella in pregnancy. J Obstet Gynaecol Can. 2018; 40: 1646-56. Disponible en: https://dx.doi.org/10.1016/j.jogc.2018.07.003.
10. Carlos Sanz J, de Ory F. Rubéola: el nuevo escenario de una vieja enfermedad. Enferm Infecc Microbiol Clin. 2006; 24: 36-44. Disponible en: https://dx.doi.org/10.1157/13083374.
11. Seppälä EM, Perea NL, de Mier M de VT, Echevarría JE, García AF, Calles JM. La vigilancia de la rubeola congénita: epidemiología, clínica, diagnóstico y características maternas de los recién nacidos con síndrome de rubeola congénita, España 1997-2016. Boletín Epidemiológico Semanal (BES). BES. 2018; 26: 127-37. Disponible en: https://revista.isciii.es/index.php/bes/article/view/1079.
12. Luck SE, Wieringa JW, Blázquez-Gamero D, Henneke P, Schuster K, Butler K, et al; ESPID Congenital CMV Group Meeting, Leipzig 2015. Congenital Cytomegalovirus: A European Expert Consensus Statement on Diagnosis and Management. Pediatr Infect Dis J. 2017; 36: 1205-13. Disponible en: https://journals.lww.com/pidj/fulltext/2017/12000/congenital_cytomegalovirus__a_european_expert.28.aspx.
13. Rawlinson WD, Boppana SB, Fowler KB, Kimberlin DW, Lazzarotto T, Alain S, et al. Congenital cytomegalovirus infection in pregnancy and the neonate: consensus recommendations for prevention, diagnosis, and therapy. Lancet Infect Dis. 2017; 17: e177-e188. Disponible en: https://doi.org/10.1016/S1473-3099(17)30143-3.
14.*** Chiopris G, Veronese P, Cusenza F, Procaccianti M, Perrone S, Daccò V, et al. Congenital Cytomegalovirus infection: Update on diagnosis and treatment. Microorganisms. 2020; 8: 1516. Disponible en: https://dx.doi.org/10.3390/microorganisms8101516.
15.*** American Academy of Pediatrics. Syphilis. Report of the Committee on Infectious Diseases, 29th ed, Pickering LK (Ed), American Academy of Pediatrics. Elk Grove Village, IL. 2012.
16. Hernando V, Díaz O, Algueró MR, Díaz A. Boletín Epidemiológico Semanal (BES). BES. 2020; 28: 49-54. Disponible en: https://revista.isciii.es/index.php/bes/article/view/1118.
17. Centers for Disease Control and Prevention. Syphilis (Treponema pallidum) 2018 Case Definition. Disponible en: https://ndc.services.cdc.gov/case-definitions/syphilis-2018.
18. Workowski KA, Bolan GA, Centers for Disease Control and Prevention. Sexually transmitted diseases treatment guidelines, 2015. MMWR Recomm Rep. 2015; 64: 1-137.
19. Melvin AJ, Mohan KM, Vora SB, Selke S, Sullivan E, Wald A. Neonatal Herpes Simplex Virus Infection: Epidemiology and Outcomes in the Modern Era. J Pediatric Infect Dis Soc. 2022; 11: 94-101.
20. American Academy of Pediatrics. Herpes simplex. En: Red Book: 2021-2024 Report of the Committee on Infectious Diseases, 32nd ed, Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH (Eds). American Academy of Pediatrics. Itasca, IL; 2021. p. 407-11.
21. Long SS, Pool TE, Vodzak J, Daskalaki I, Gould JM. Herpes simplex virus infection in young infants during 2 decades of empiric acyclovir therapy. Pediatr Infect Dis J. 2011; 30: 556-61.
22. Koch WC, Adler SP. Human parvovirus B19 infections in women of childbearing age and within families. Pediatr Infect Dis J. 1989; 8: 83-7.
23. Rothart HA. Human parvovirus infections. Annu Rev Med. 1990; 41: 25-34.
24.*** Petersen LR, Jamieson DJ, Powers AM, Honein MA. Zika Virus. N Engl J Med. 2016; 375: 294.
25. Kimberlin DW, Brady MT, Jackson MA, Long SS (Eds), American Academy of Pediatrics, Itasca, IL; 2018. p. 894.
Bibliografía recomendada
– Badia J, Figaró C, Domingo M, Aldecoa V. Infecciones congénitas. Pediatr Integral. 2014; XVIII: 356-66. Disponible en: https://www.pediatriaintegral.es/publicacion-2014-07/infecciones-congenitas/.
Este artículo resume la patología infecciosa de la gestante y, especialmente, del recién nacido. Al inicio del artículo se incluyen conceptos básicos de la infección congénita.
– Baquero-Artigao F, del Castillo Martín F, Fuentes Corripio I, Goncé Mellgren A, Fortuny Guasch C, de la Calle Fernández-Miranda M, et al. Guía de la Sociedad Española de Infectología Pediátrica para el diagnóstico y tratamiento de la toxoplasmosis congénita. An Pediatr (Barc). 2013; 79: 116.e1-e16. Disponible en: https://dx.doi.org/10.1016/j.anpedi.2012.12.001.
– Peyron F, L’ollivier C, Mandelbrot L, Wallon M, Piarroux R, Kieffer F, et al. Maternal and congenital toxoplasmosis: diagnosis and treatment recommendations of a French multidisciplinary working group. Pathogens. 2019; 8: 24. Disponible en: https://doi.org/10.3390/pathogens8010024.
Se trata de un artículo de consulta que resume de forma completa (manifestaciones clínicas, diagnóstico en la gestante y recién nacido, así como el tratamiento) la toxoplasmosis congénita. A la que se suma la siguiente referencia, con la nueva guía de toxoplasmosis congénita actualizada.
– Chiopris G, Veronese P, Cusenza F, Procaccianti M, Perrone S, Daccò V, et al. Congenital Cytomegalovirus infection: Update on diagnosis and treatment. Microorganisms. 2020; 8: 1516. Disponible en: https://dx.doi.org/10.3390/microorganisms8101516.
Este artículo comenta los aspectos diagnósticos (la avidez de la IgG junto a la determinación de la IgM), así como el tratamiento utilizado en los casos de citomegalovirus congénito y sus efectos secundarios y limitaciones.
– American Academy of Pediatrics. Syphilis. En: Red Book: 2021-2024 Report of the Committee on Infectious Diseases, 32nd ed, Kimberlin DW, Barnett ED, Lynfield R, Sawyer MH (Eds). American Academy of Pediatrics, Itasca, IL; 2021. p. 729-44.
Capítulo del libro centrado en el diagnóstico de la gestante y del recién nacido, así como en el tratamiento en función de la forma de presentación. También recoge los aspectos a tener en cuenta en el seguimiento del recién nacido.
– Petersen LR, Jamieson DJ, Powers AM, Honein MA. Zika Virus. N Engl J Med. 2016; 375: 294-5. Disponible en: https://www.nejm.org/doi/10.1056/NEJMra1602113.
Articulo de revisión del NEJM que resume, de forma completa, la epidemiología del virus Zika, sobre todo en estos últimos 10 años, así como la importancia de la afectación neurosensorial de los recién nacidos, cuando la infección se adquiere en la gestación.
| Caso clínico |
|
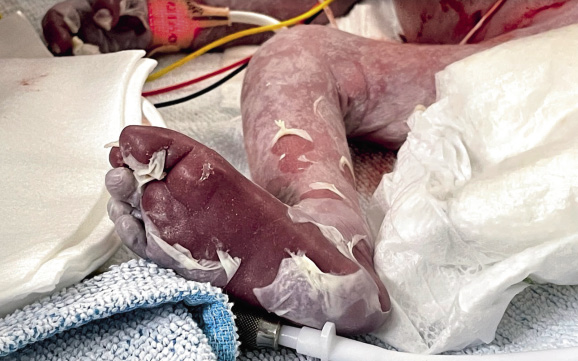
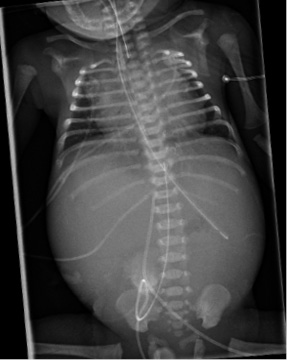
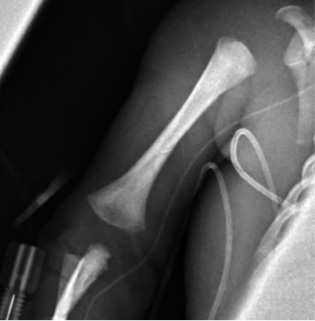
Información antenatal Madre de 19 años con serología positiva para sífilis en 1º y 2º trimestres del embarazo (RPR [+]; títulos de 1/32; hemaglutinación positiva). Consumidora de cannabis y tabaco. Embarazo parcialmente controlado. 34 semanas de edad gestacional. G1A0V1. Ecografías del primer y segundo trimestres normales. No consta ecografía del tercer trimestre. 2 dosis de maduración pulmonar. Reanimación neonatal Cesárea urgente por bradicardia fetal. Hipotónico sin esfuerzo respiratorio y mala perfusión generalizada. Se inicia ventilación con presión positiva intermitente (PPI). Bradicardia mantenida a pesar de ventilación adecuada. Recibe masaje cardíaco durante 1 minuto, sin llegar a precisar adrenalina. Se realiza intubación endotraqueal a los 3 minutos de vida. Apgar (1’/5’/10’): 4/5/7. Gasometría de cordón: pH 7,19; pCO2: 62,1 mmHg; HCO3: 23,7 mmol/L; Lactato: 5,9 mmol/L; Hb: 10,7 g/dL; Hto: 32,9 %. Se traslada a la unidad de cuidados intensivos neonatales. Exploración física a su ingreso Antropometría al nacimiento: peso 2.035 g (p30); longitud: 42 cm (p14); perímetro cefálico: 30 cm (p23). Constantes al ingreso: FC: 118 lpm; SatO2: 45 %. TA: 57/33/42 mmHg. Mal estado general. Cianótico, con lesiones vesículo-ampollosas anulares diseminadas, con pérdida de la integridad cutánea y descamación más marcada a nivel distal (Fig. 1). Mala perfusión. Auscultación cardíaca: rítmica. Auscultación pulmonar: mala entrada de aire bilateral. Abdomen distendido, con hepatomegalia severa. Figura 1. Pruebas complementarias • Analítica sanguínea: con hipertransaminasemia (valores máximos: AST: 1.585 UI/L; ALT: 441 UI/L) y colestasis (valores máximos: GGT: 287 UI/L; bilirrubina total: 11,49 mg/dL; bilirrubina directa: 8,85 mg/dL). Hb: 10,3 g/dL. Plaquetas: 23.000/mcL. Coagulopatía con tiempo de tromboplastina parcial activada (APT): 22 % e INR (índice internacional normalizado): 2,8. • Estudio sífilis congénita: amplificación genómica de úlcera genital (frotis lesión cutánea [27/09/21]): positivo para sífilis. Ampliación de T. pallidum en placenta materna (27/09/21): positivo para sífilis en placenta. Cultivo de lesión cutánea (27/09/21): estéril. Serología sífilis (27/09/21): IgG: positivo; RPR: positivo (1/64); IgM: positivo (9,06). Detección en LCR: IgG: positivo; VDLR: positivo. Serología 27/10: IgG, IgM, RPR y TTPA: positivo. • LCR: citoquímico: turbio; glucosa: 130 mg/dl; proteínas totales: 213,1 mg/dl; lactato: 22,9 mmol/l; células en LCR: 73 (66 % PMN: 48/mm3). Tinción de Gram: sin bacterias. Cultivo: estéril. Pruebas de imagen • Serie ósea: se objetiva metafisitis y osteítis metafisaria en prácticamente todos los huesos largos. El foco más evidente es el húmero derecho. Posible foco de osteítis en calcáneo derecho. Cardiomegalia. Hepatomegalia (Figs. 2 y 3). Figura 2.
Figura 3. • Ecografía transfontanelar: sin hemorragia. Hiperecogenicidad periventricular leve. • Ecografía abdominal: hepatomegalia de ecogenicidad ligeramente aumentada de manera homogénea, con algunos puntos ecogénicos en el segmento 4, milimétricos y agrupados. Bazo de aspecto globuloso de 5,4 cm. Tratamiento Penicilina G intravenosa durante 10 días a dosis de 200.000 UI/kg/día/6 horas. Evolución El paciente recibe seguimiento principalmente en el servicio de Infecciosas. Presenta, como secuela actualmente, hipoacusia neurosensorial bilateral y es portador de audífonos. Diagnóstico Sífilis congénita.
|



 Rapid microbiological diagnostic test in the Primary Care Pediatric consultation
Rapid microbiological diagnostic test in the Primary Care Pediatric consultation