|
| Temas de FC |
F.J. Mejorado Molano*, L. Soriano Guillén*
*Unidad de Endocrinología Infantil. Servicio de Pediatría. Instituto de Investigación Biomédica-Fundación Jiménez Díaz. Universidad Autónoma de Madrid. Madrid
| Resumen
La pubertad es un momento clave entre la infancia y la edad adulta. El inicio precoz de la misma puede causar problemas emocionales y una menor talla adulta. Es preciso conocer los signos que nos indican una pubertad precoz y diferenciarlos de variantes de la normalidad, como la pubertad adelantada. El origen central e idiopático es la causa más frecuente, con un predominio claramente femenino. Entre las pruebas iniciales, destaca la edad ósea que puede ser solicitada por el pediatra de Atención Primaria. El tratamiento de elección son los análogos de hormona liberadora de gonadotropinas. Es importante un seguimiento estrecho en el centro de salud de ciertos grupos de riesgo, como las niñas obesas y las niñas con antecedente de adopción internacional. |
| Abstract
Puberty is a key step between childhood and adulthood. Its early onset can cause emotional problems and shorter adult height compared to target height. It is necessary to know the signs that indicate precocious puberty and differentiate them from normal variants such as early puberty. The most frequent is idiopathic central precocious puberty, predominantly in females. One of the most important initial tests is bone age that can be requested by the Primary Care Pediatrician. The main treatment are gonadotropin-releasing hormone analogues. In Primary Care, a close monitoring of certain risk groups such as obese girls and internationally adopted girls is very important. |
Palabras clave: Pubertad precoz; Pubertad adelantada; Telarquia prematura aislada.
Key words: Precocious puberty; Early puberty; Premature thelarche.
Pediatr Integral 2020; XXIV (4): 183 – 190
Pubertad precoz y adelantada
Introducción
La pubertad precoz es aquella que se inicia antes de los ocho años en niñas y de los nueve años en niños.
La pubertad es un complejo proceso biológico de transición entre la infancia y la edad adulta, regulado por diferentes elementos, entre los que destacan: determinantes genéticos y diversos factores ambientales. Durante esta etapa, los niños y niñas desarrollarán importantes cambios corporales y conductuales para alcanzar la maduración de los caracteres sexuales secundarios, su talla adulta y la capacidad de reproducción(1).
En niñas, la pubertad se inicia con la aparición y progresión de telarquia bilateral, mientras que en los niños, viene marcada por el aumento del volumen testicular >= 4 ml). El rango de normalidad de aparición de estos caracteres sexuales secundarios viene definido por criterios estadísticos, aconteciendo entre los ocho y trece años en niñas, y entre los nueve y catorce años en niños(2,3).
Teniendo en cuenta lo anteriormente descrito, se considera pubertad precoz aquella que se inicia antes de los ocho años en niñas y de los nueve años en niños(4,5). En una situación intermedia nos encontraremos a una variante de la normalidad, como es la pubertad adelantada: aparición de caracteres sexuales secundarios entre los ocho y nueve años en niñas, y entre los nueve y diez años en niños.
Clasificación
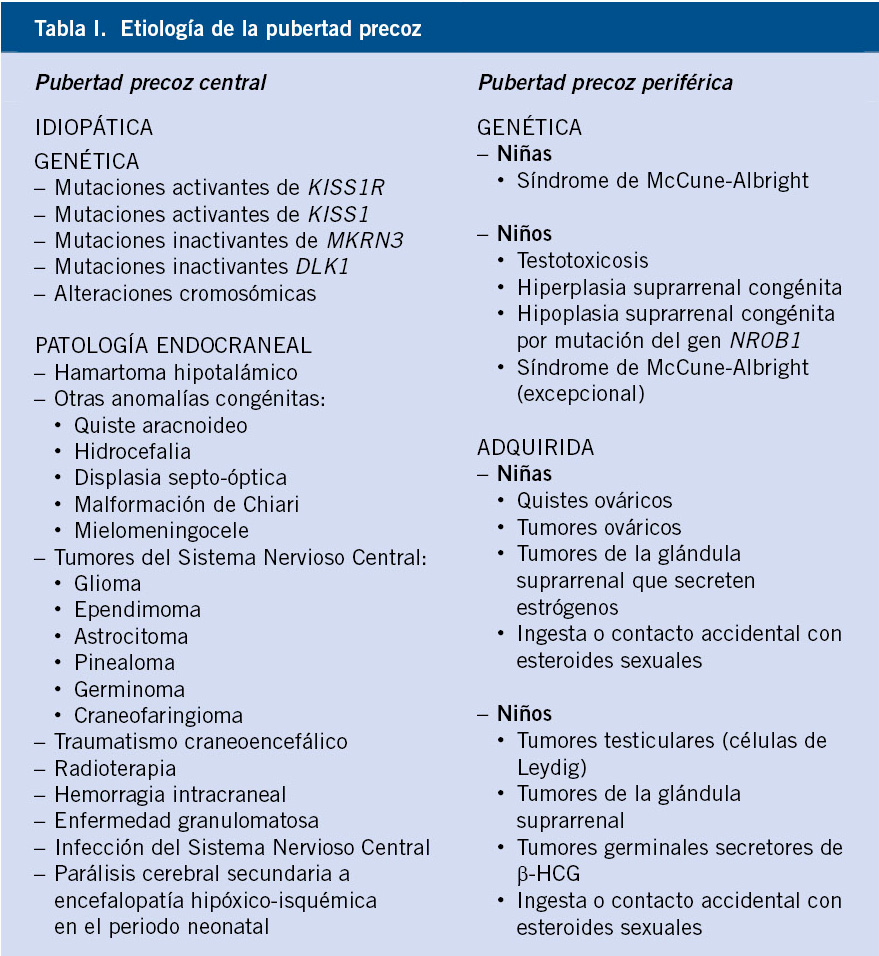
La pubertad precoz se clasifica en tres tipos(6,7) (Tabla I):
1. Pubertad precoz central (PPC) o gonadotropín-dependiente: aquella en la que hay un aumento de hormona folículo estimulante (FSH) y hormona luteinizante (LH) tras una activación precoz del eje hipotálamo-hipófisis-gónadas y la liberación de GnRH (hormona liberadora de gonadotropinas).
2. Pubertad precoz periférica (PPP) o gonadotropín-independiente: provocada por un aumento de esteroides sexuales sin objetivar elevación de FSH y LH, suprimiendo el eje sexual por retroalimentación negativa.
3. Pubertad precoz mixta (PPM) o periférica secundariamente central: se han descrito de manera anecdótica pacientes con PPP de larga evolución que, al ser tratados, frenan súbitamente la supresión del eje gonadal y este se activa con la liberación de GnRH.
Epidemiología
La pubertad precoz es una enfermedad con baja prevalencia y de predominio femenino. La gran mayoría de los casos se corresponden a pubertad precoz central.
Dentro de los tipos de pubertad precoz, se estima que la PPC constituye más del 95% de los casos frente a menos del 5% de la PPP. A su vez, dentro de la PPC, la prevalencia de patología endocraneal es claramente superior en los niños que en las niñas.
La PPC es una enfermedad relativamente rara, con una prevalencia estimada de un 0,1% y una incidencia de aproximadamente 6 casos por millón de personas y año, con un claro predominio femenino (10-25:1). Así, en los últimos años, se ha descrito un aumento notable de la incidencia anual en niñas, llegando a 25-50 casos por 100.000 niñas/año.
Finalmente, conviene puntualizar que las niñas con antecedente de adopción internacional presentan un riesgo notablemente más elevado de desarrollar PPC que las niñas de su entorno(6,7).
Comorbilidades
La consecuencia más frecuentemente asociada a la pubertad precoz es la pérdida de potencial de talla adulta secundaria a una aceleración del ritmo de crecimiento, adelanto de maduración ósea y cierre prematuro del cartílago de crecimiento. A partir de diferentes series históricas de pacientes con PPC sin tratamiento médico, se ha conocido que la talla final alcanzada por niñas era de 145-154 cm y en niños de 150-156 cm(8).
En el ámbito social y psicológico, la mayoría de estudios han sido realizados en niñas y tienen una naturaleza retrospectiva, describiéndose problemas conductuales y emocionales que aumentan: riesgo de actividad sexual temprana, consumo de drogas y trastornos de la conducta alimentaria(9).
Por último, el adelanto puberal en niñas se ha relacionado a largo plazo con un aumento de la prevalencia de obesidad y del riesgo cardiovascular, así como mayor incidencia de cáncer de mama(9).
Etiopatogenia
Pubertad precoz central
La más frecuente es la idiopática, pero en los últimos años, se han descubierto causas genéticas, como la alteración en el gen MKRN3. El hamartoma hipotalámico es la causa endocraneal más frecuente.
En la mayoría de los casos, es de origen idiopático, sobre todo en el sexo femenino. No obstante, en los últimos años, se han descubierto nuevas alteraciones moleculares que podrían explicar casos que anteriormente se hubieran catalogado de idiopáticos, más aún si existe agregación familiar. Las causas de PPC son las siguientes:
• Genéticas:
– Gen del receptor de kispeptina (KISS1R): mutación activante en heterocigosis, descrita en una única paciente adoptada en 2008(10).
– Gen de kispeptina (KISS1): alteraciones moleculares activantes de este gen en heterocigosis descritas en 2010, en tres pacientes. Actualmente, se consideran variantes de significado incierto(11).
– Gen “makorin ring finger protein 3” (MKRN3): mutaciones inactivantes en heterocigosis. Desde la primera publicación, en el año 2013, se ha convertido en la principal causa genética de PPC idiopática (PPCI), explicando el 33-46% de los casos familiares y el 0,4-5% de los casos esporádicos. Se localiza en la región crítica del síndrome de Prader-Willi (15q11-q13) y tiene impronta genómica materna; así, el gen proveniente del alelo materno no se expresa, por lo que las mutaciones heredades del padre son las causantes de PPC(12).
– Gen “delta-like noncanonical notch ligand 1” (DLK1): en 2017, se describió por primera que una deleción de este gen era causante de PPCI en cuatro niñas de la misma familia. La abuela paterna presentaba la misma mutación. Al igual que lo anteriormente descrito en MKRN3, este gen también presenta un fenómeno de impronta materna. Además, se relaciona con mayor prevalencia de obesidad(13).
• Patología endocraneal: existe gran diferencia entre sexos, ya que en varones, puede explicar entre el 30-70% de los casos, frente al 10% en niñas(14).
– Hamartoma hipotalámico: causa orgánica más frecuente. Se trata de una lesión congénita benigna, no neoplásica, que suele situarse en la base del tercer ventrículo. La pubertad precoz suele manifestarse antes de los cuatro años y puede asociarse a crisis epilépticas gelásticas (risa inapropiada).
– Tumores del sistema nervioso central como: gliomas, ependimomas y astrocitomas.
– Malformaciones del sistema nervioso central como: quistes e hidrocefalia, entre otros.
– Traumatismo craneoencefálico.
Pubertad precoz periférica
Los tumores secretores de esteroides sexuales o β-HCG pueden ser causantes de PPP(7,15).
Causas genéticas
• Síndrome de McCune-Albright (SMA): se caracteriza por la tríada de: pubertad precoz, manchas café con leche y displasia ósea. Además, puede asociar otros trastornos endocrinos. Este síndrome es producido por mutaciones activadoras somáticas postcigóticas en el gen GNAS, que codifica la subunidad α de la proteína G de membrana (20q13.32). Las mutaciones son heterocigotas y, por tanto, pueden aparecer en el alelo materno, alelo paterno o ser de novo.
• Testotoxicosis o pubertad precoz familiar del varón: debido a una mutación activante del receptor de LH (LHR) que se hereda de forma autosómica dominante. Entre el primer y cuarto año de vida, puede objetivarse la aparición de pubarquia y alargamiento del tamaño del pene, junto con incremento de la velocidad de crecimiento y unos valores sanguíneos de testosterona anormalmente elevados para la edad. A diferencia de otros cuadros de PPP en el niño, en esta patología existe un aumento del volumen testicular bilateral, pudiendo hacer sospechar en un primer momento, que se trata de una PPC. Por ello, los antecedentes familiares van a resultar de suma utilidad.
• Hiperplasia suprarrenal congénita: en niños, tanto en la forma clásica como la de presentación tardía, se manifiesta por la aparición de pubarquia/axilarquia e incremento del pene, pero no del tamaño testicular, junto a aceleración del crecimiento y adelanto de la edad ósea. En niñas, suele presentarse con signos de adrenarquia precoz sin telarquia, por lo que inicialmente no entraría en el diagnóstico diferencial de pubertad precoz.
• Hipoplasia suprarrenal congénita por mutación del gen NR0B1 (antiguo DAX1): las mutaciones en este gen pueden manifestarse como un efecto dual relativo al desarrollo puberal. Aparte de insuficiencia suprarrenal, en la adolescencia o en la etapa adulta, se manifiesta como hipogonadismo hipogonadotropo. No obstante, se han descrito casos en la infancia causantes de pubertad precoz de origen testicular.
Causas adquiridas
• Patología tumoral: en niñas, pueden existir tumores secretores de estrógenos en ovarios y, en menor medida, en la glándula suprarrenal. En este último caso, generalmente se tratará de tumores de secreción mixta (andrógenos y estrógenos). Además, los quistes ováricos funcionales benignos también pueden comportarse de esta manera. Por otra parte, en el caso de los niños, debemos descartar tumores secretores de andrógenos en testículo (tumores de células de Leydig) o en la glándula suprarrenal. La hormona gonadotropina coriónica humana (β-HCG) tiene una acción parecida a la LH sobre el testículo, por lo que tumores germinales secretores de β-HCG (hígado, cerebro, mediastino, gónadas) pueden provocar una PPP por un aumento en la síntesis de testosterona.
• De forma excepcional, se han documentado casos de ingesta o contacto accidental con esteroides sexuales.
Pubertad adelantada
Es una variante de la normalidad, donde los niños y niñas presentan un desarrollo y crecimiento acelerados desde la infancia, alcanzando generalmente una talla final normal.
La pubertad adelantada, mucho más frecuente entre las niñas, es aquella que se inicia entre los ocho y nueve años en niñas, y entre los nueve y diez años en niños, por tanto, dentro de los límites inferiores de la normalidad.
Estos niños y niñas presentan, desde edades tempranas, un crecimiento acelerado que se manifiesta por una talla por encima de su talla genética y un desarrollo temprano de los caracteres sexuales secundarios. Dentro de su entorno escolar, son niños y niñas que destacan generalmente por su altura. Finalmente, suelen alcanzar una talla final acorde con su talla genética, pero antes que los demás. En otras palabras, dejan de crecer antes que la mayoría de niños de su edad. De esta forma, conviene preparar a las familias sobre la evolución anteriormente comentada. Este punto es muy relevante a la hora de hablar con las familias, ya que estos niños y niñas no se benefician de ningún tratamiento frenador de la pubertad. En suma, se considera una variante de la normalidad(1).
Aproximación diagnóstica
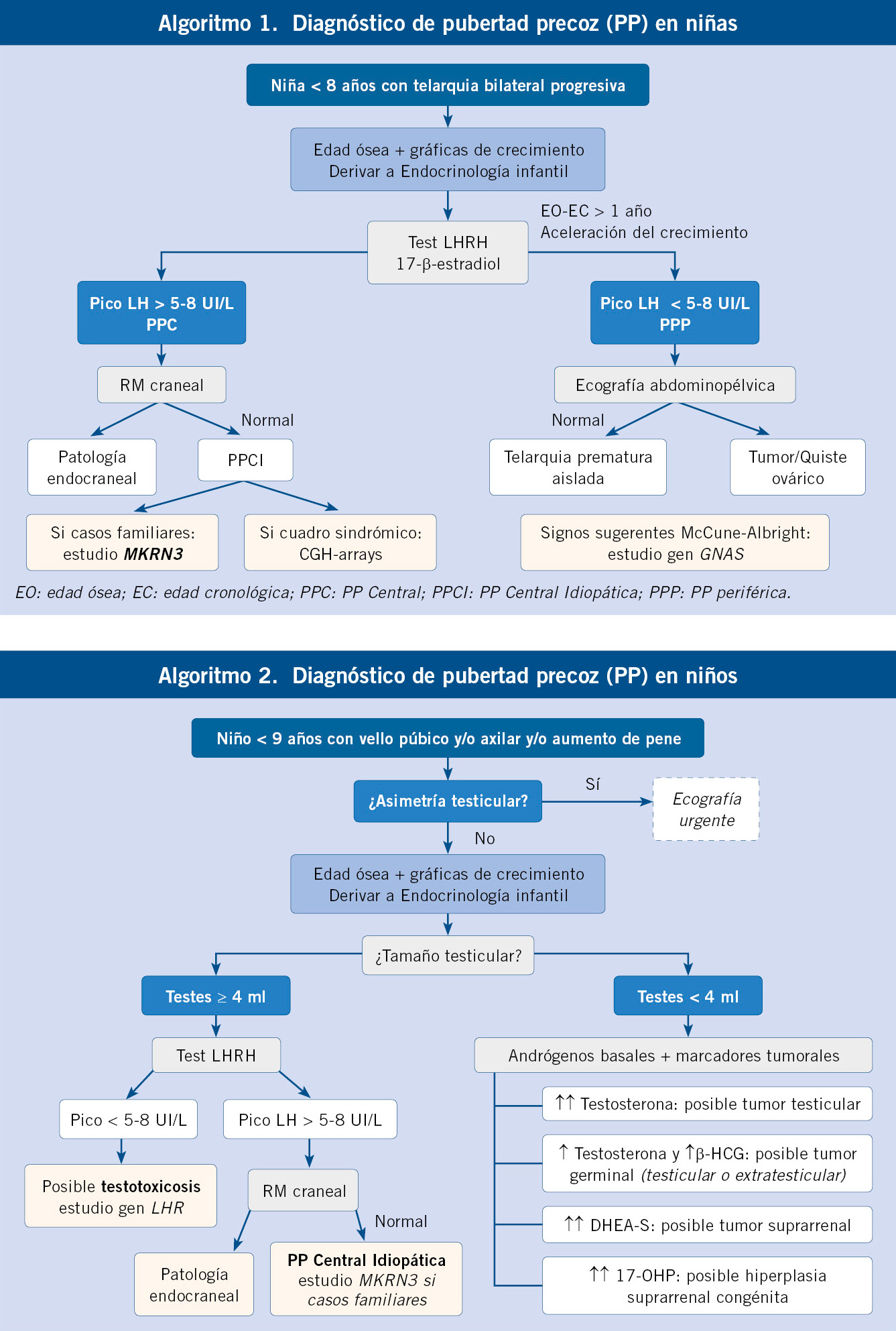
En niñas, la telarquia debe ser bilateral y progresiva, a diferencia de la telarquia prematura aislada. En niños, es importante la exploración genital para descartar una asimetría testicular y posible tumor(15) (Tablas II y III).
Anamnesis
• Niñas: el rasgo fundamental es la presencia de telarquia antes de los ocho años. Esta debe ser bilateral y progresiva, a diferencia de una variante de la normalidad como es la telarquia prematura aislada, que suele ser unilateral y fluctuante, sin cambios en la pigmentación de la areola. Junto a la telarquia bilateral y progresiva, acontece un aumento en la velocidad de crecimiento y aceleración de la edad ósea. Tampoco es raro encontrar inicio de pubarquia y/o axilarquia, normalmente tras la telarquia. La aparición de vello púbico o axilar sin otros datos de virilización ni telarquia, nos indican adrenarquia prematura y no una pubertad precoz(16).
• Niños: necesitamos interrogar sobre el aumento del tamaño testicular y de las bolsas escrotales, incremento del pene y/o aparición de vello púbico o axilar antes de los 9 años. La evolución de estos signos se acompaña de un aumento de la velocidad de crecimiento y la maduración ósea.
• En ambos sexos, resulta de suma importancia interrogar sobre sintomatología sugerente de hipertensión intracraneal como: cefalea, vómitos o alteraciones de la agudeza visual. Además, deben recogerse datos perinatales y analizar la evolución ponderoestatural en las gráficas de referencia. Además, preguntaremos sobre el posible contacto con fármacos que contengan esteroides sexuales.
• Información sobre la talla de los padres y el desarrollo de su pubertad, así como de familiares cercanos por el carácter genético y de agrupación familiar de algún tipo de PPC, como se ha descrito anteriormente.
Examen físico
• Niñas: comprobar la existencia de telarquia mediante inspección y palpación. Constatar si es uni o bilateral. En ocasiones, es difícil diferenciar entre la presencia de una verdadera telarquia o adipomastia, por lo que los cambios en la pigmentación areolar o aumento de la sensibilidad local pueden sernos de utilidad.
• Niños: la exploración genital mediante palpación, debe centrar nuestra atención. En primer lugar, para descartar la presencia de asimetría testicular, sugerente de patología tumoral. Además, un volumen testicular superior o igual a 4 ml nos debe hacer sospechar PPC, mientras que un volumen inferior a 4 ml indica un posible origen periférico.
• En niños y niñas, se recogerán los datos antropométricos, tanto en valor absoluto como en Z-score, y se calculará el índice de masa corporal (IMC) para valorar el estado nutricional. Mediante inspección, hay que prestar especial atención a la presencia de estigmas cutáneos, como manchas café con leche, y la existencia de vello púbico y/o axilar. La palpación del abdomen es importante para descartar masas abdominales y una exploración neurológica, junto a un fondo de ojo, es útil para descartar patología intracraneal.
Pruebas complementarias
La edad ósea es la prueba a realizar de entrada ante una sospecha de pubertad precoz. El test de estímulo con LHRH sigue siendo la prueba fundamental para estudiar una activación central de la pubertad (14,15,17).
Estudios de imagen
• Radiografía de mano-muñeca izquierda: suele realizarse de entrada a todos los pacientes con sospecha de pubertad precoz, para calcular la edad ósea que suele tener una aceleración marcada. Pese a lo extendido de su uso, esta prueba tiene ciertas limitaciones: se basa en la comparación de una serie de imágenes editadas hace décadas que podrían no representar a la población actual, así como una importante variabilidad intra e interobservador. También se utiliza, no en pocas ocasiones, para la predicción de talla final. Sobre este último particular, conviene aclarar que el intervalo de confianza al 95% de dicha predicción es de aproximadamente +/- 6 cm.
• Ecografía testicular: de obligada realización en niños con asimetría testicular, para descartar patología tumoral.
• Ecografía abdominopélvica: a día de hoy, presenta un doble uso. Así, ayuda a descartar patología tumoral suprarrenal y ovárica, causantes de PPP. Además, permite valorar signos de impregnación estrogénica, tales como: incremento del tamaño y volumen uterino, relación fundus/cérvix, presencia de línea endometrial y volumen ovárico.
• Resonancia magnética craneal: útil para descartar patología intracraneal.
Estudios hormonales
• En los últimos años, se han desarrollado distintas técnicas de laboratorio que utilizan anticuerpos monoclonales, permitiendo disminuir el punto de corte de determinación de hormona luteinizante (LH). Por ello, algunos autores han propuesto el uso de LH basal como método diagnóstico para diferenciar entre PPC y PPP. No obstante, a día de hoy, el test de estímulo con LHRH (hormona liberadora de gonadotropinas) a una dosis de 100 μg/m2 por vía intravenosa, sigue siendo la referencia para este cometido. El punto de corte de LH a partir del cual se confirma un origen central, oscila entre 5 y 8 UI/l, según los autores consultados; en pacientes menores de 2 años, el punto de corte se sitúa en 10 UI/l.
• En el niño, resulta de suma utilidad el uso de testosterona, puesto que valores por encima de 0,5 ng/ml sugieren una activación temprana de la pubertad. Por el contrario, en niñas, el uso de 17-β -estradiol presenta poca ayuda por su escasa sensibilidad.
Estudios genéticos
• Pubertad precoz central: ante una PPCI con varios casos familiares, se recomienda el estudio del gen MKRN3. Si este resulta negativo y hay elevada prevalencia de obesidad, podemos considerar el estudio del gen DLK1. Si nos encontramos ante un cuadro sindrómico sin etiquetar, en el cual la pubertad precoz se asocia a otras alteraciones como cardiopatía o retraso mental, sería aconsejable realizar un CGH-arrays (hibridación genómica comparada).
• Pubertad precoz periférica: si sospechamos un caso de síndrome de McCune-Albright, se debería realizar un estudio pareado de mutaciones en el gen GNAS de muestras procedentes de sangre periférica y de tejidos afectos, como la piel y ovario. En un niño con sospecha de testotoxicosis, habría que estudiar el gen del receptor de hormona luteinizante (LHR).
Tratamiento
En la PPC, los análogos de GnRH son los fármacos de elección(7,14,15,17).
Pubertad precoz central
Se utilizan análogos de hormona liberadora de gonadotropinas (análogos de GnRH). Estos compuestos estimulan continuamente las células gonadotropas hipofisarias, provocando su desensibilización (“down-regulation”) y logrando disminuir la secreción de LH y FSH.
Estos preparados se vienen utilizando desde hace más de tres décadas y han sido comercializados con diferentes formas de administración y posología. La evidencia de un gran número de series clínicas con datos a talla adulta, muestra el efecto beneficioso de estos fármacos sobre la talla final en niñas, particularmente menores de seis años con PPC. Conviene señalar que, por motivos éticos, no se han desarrollado ensayos clínicos aleatorizados. Además, los datos disponibles sobre niños son muy escasos. Teniendo en cuenta esta evidencia científica, la indicación de tratamiento con análogos de GnRH se sugeriría en:
• Niños menores de nueve años.
• Niñas menores de seis años, ya que en este grupo de edad es donde el beneficio es claramente mayor a talla adulta.
• Individualizar el inicio de tratamiento en niñas entre seis y ocho años, teniendo en cuenta: pronóstico de talla adulta con respecto a la talla genética, la maduración psicosocial de la paciente, la predicción de edad de aparición de la menarquia y la opinión de los padres. En el caso de adopción, estas niñas suelen presentar problemas de adaptación social que podrían verse perjudicadas por un marcado adelanto puberal.
No existe unanimidad científica sobre el momento más apropiado para finalizar el tratamiento. Parece evidente que prolongarlo en exceso podría empeorar las expectativas de talla final al minimizar el crecimiento residual tras su finalización. Conociendo que la media de aparición de la menarquia tras la retirada del fármaco se aproxima a los 12 meses, se sugiere plantear la retirada de los análogos de GnRH en las niñas a partir de los 10 años de edad cronológica. Por añadidura, se aconseja no continuar con dicha terapia más allá de los 12 años de edad cronológica en niños.
En Europa, el análogo de GnRH con el que se tiene mayor experiencia es la triptorelina intramuscular en forma depot mensual, a dosis de 80-120 µg/kg. En los últimos años, se vienen desarrollando varios estudios pilotos con otros fármacos, tales como: acetato de leuprolide trimestral, triptorelina semestral o implantes subcutáneos de histerelina anuales. Hasta el momento, no disponemos de datos a talla adulta y el coste de los mismos es elevado.
Los efectos secundarios del tratamiento son escasos y, en general, se tratan de reacciones locales en la zona de inyección, como eritema o celulitis, o reacciones urticariales. En niñas, se han descrito síntomas similares a la menopausia (calor, rubor, cambios de humor) y sangrado vaginal en el primer mes de tratamiento. Además, algunos autores han señalado un aumento del índice de masa corporal a largo plazo y hay dudas sobre mayor incidencia de síndrome de ovario poliquístico. El efecto sobre la densidad mineral ósea es transitorio y la fertilidad futura no parece estar afectada.
Pubertad precoz periférica
A diferencia de lo que ocurre en la PPC, los datos procedentes de la literatura científica son escasos por la baja frecuencia de los casos. Además, la mayoría de estudios publicados corresponden a grupos reducidos de pacientes, sin grupo control, en los que no en todos se dispone de datos sobre la talla final.
• Síndrome de McCune-Albright: se emplean fármacos como inhibidores de la aromatasa o inhibidores del receptor de estrógenos. Además, precisan con cierta frecuencia el uso de análogos de GnRH, al constatarse una activación central de la pubertad (PP mixta).
• Testotoxicosis:
– Inhibidor de la síntesis de testosterona, como ketoconazol.
– Inhibidor de receptor de andrógenos junto a inhibidor de aromatasa de última generación.
Función del pediatra de Atención Primaria
• Conocer los datos de sospecha de una pubertad de inicio precoz y derivar a la consulta de Endocrinología infantil. Al mismo tiempo, puede solicitar una edad ósea del paciente para su valoración en la primera consulta del hospital. Asimismo, resulta de sumo interés aportar los datos de la evolución del peso y talla de, al menos, los dos últimos años.
• En la situación concreta de un niño con asimetría testicular, sería aconsejable la solicitud de una ecografía testicular urgente desde la propia consulta del pediatra de Atención Primaria.
• Más de dos casos de PPCI en la misma familia: derivar para realizar el estudio genético del gen MKRN3 de los casos índices y, si este resulta positivo, extenderlo a los niños y niñas prepuberales de la familia para que, en el caso de confirmarse, seguir estrechamente su desarrollo y seguimiento en consultas de Endocrinología infantil.
• Prevención de grupos de riesgo con un seguimiento estrecho de la aparición temprana de caracteres sexuales secundarios, especialmente en niñas:
– Obesidad: instaurar medidas dietéticas y conductuales para alcanzar un normopeso en la etapa prepuberal, sobre todo, entre los seis y ocho años (18, 19).
– Niñas procedentes de adopción internacional: tratar de conseguir una ganancia ponderal progresiva y no excesivamente rápida tras la llegada al país de acogida (20).
Bibliografía
Los asteriscos muestran el interés del artículo a juicio del autor.
1.*** Soriano-Guillén L. Pubertad normal y variantes de la normalidad. Pediatr Integral. 2015; XIX(6): 380-8.
2. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in girls. Arch Dis Child. 1969; 44: 291-303.
3. Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Child. 1970; 45: 13-24.
4.** Carel JC, Léger J. Precocious puberty. N Engl J Med. 2008; 358: 2366-77.
5.*** Latronico AC, Brito VN, Carel JC. Causes, diagnosis, and treatment of central precocious puberty. Lancet Diabetes Endocrinol. 2016; 4: 265-74.
6.** Soriano-Guillén L, Argente J. Central precocious puberty: epidemiology, etiology, diagnosis and treatment. An Pediatr (Barc). 2011; 74: 336.e1-e13.
7.** Soriano-Guillén L, Argente J. Peripheral precocious puberty: clinical, diagnostic and therapeutical principles. An Pediatr (Barc). 2012; 76: 229.e1-10.
8.** Carel JC, Lahlou N, Roger M, Chaussain JL. Precocious puberty and statural growth. Human Reprod. Update 2004; 10: 135-47.
9.** Golub MS, Collman GW, Foster PM, Kimmel CA, Rajpert-De Meyts E, Reiter EO, et al. Public health implications of altered puberty timing. Pediatrics. 2008; 121: S218-30.
10. Teles MG, Bianco SD, Brito VN, Trarbach EB, Kuohung W, Xu S, et al. A GPR54-Activating mutation in a patient with central precocious puberty. N Engl J Med. 2008; 358: 709-15.
11. Silveira LG, Noel SD, Silveira-Neto AP, Abreu AP, Brito VN, Santos MG, et al. Mutations of the KISS1 gene in disorders of puberty. J Clin Endocrinol Metab. 2010; 95: 2276-80.
12.** Macedo DB, Silveira LF, Bessa DS, Brito VN, Latronico AC. Sexual Precocity–Genetic Bases of Central Precocious Puberty and Autonomous Gonadal Activation. Endocr Dev. 2016; 29: 50-71.
13.** Dauber A, Cunha-Silva M, Macedo DB, Brito VN, Abreu AP, Roberts SA, et al. Paternally Inherited DLK1 Deletion Associated With Familial Central Precocious Puberty. J Clin Endocrinol Metab. 2017; 102: 1557-67.
14.*** Soriano-Guillén L, Argente J. Central Precocious Puberty, Functional and Tumor-Related. Best Pract Res Clinical Endocrinol Metab. 2019. doi.org/10.1016/j.beem.2019.01.003.
15.*** Soriano-Guillén L, Argente J. Pubertad Precoz. Disponible en: IV Edición Manual de Pediatría Profesor Manuel Cruz. Madrid: Ergon S.A.; 2019. p. 798-803.
16.*** Gavela-Pérez T, Mejorado Molano FJ, Soriano-Guillén L. Adrenarquia Prematura. Adolescere. 2017; V(3): 31-42.
17.** Soriano-Guillén L, Sarafoglou K, Argente J. Precocious puberty. Precocious puberty. En: Textbook Pediatric Endocrinology and Inborn Errors of Metabolism, 2nd Edition. Editors: Sarafoglou K, Hoffmann G, Roth R. Cenveo Publisher. 2017; p. 643-61.
18.*** Soriano-Guillén L, Martínez-Villanueva J, Gavela-Pérez T, Corredor-Andrés B, Muñoz-Calvo M. Alteraciones nutricionales y endocrinológicas del adolescente. Medicine. 2018; 12: 3553-623.
19.** Gavela-Pérez T, Garcés C, Navarro-Sánchez P, López Villanueva L, Soriano-Guillén L. Earlier menarcheal age in Spanish girls is related with an increase in body mass index between pre-pubertal school age and adolescence. Pediatr Obes. 2015; 10: 410-5.
20.** Soriano-Guillén L, Corripio R, Labarta JI, Cañete R, Castro-Feijóo L, Espino R, et al. Central precocious puberty in children living in Spain: incidence, prevalence, and influence of adoption and immigration. J Clin Endocrinol Metab. 2010; 95: 4305-13.
Bibliografía recomendada
- Latronico AC, Brito VN, Carel JC. Causes, diagnosis, and treatment of central precocious puberty. Lancet Diabetes Endocrinol. 2016; 4: 265-74.
Artículo de revisión sobre el tema, por parte de autores expertos con un especial desarrollo del enfoque diagnóstico y los distintos puntos de corte del test de LHRH, entre varios grupos de estudio.
| Caso clínico |
|
Niña de 2 años y 10 meses derivada por su pediatra a la consulta de Endocrinología Infantil para valoración de telarquia fluctuante desde los 2 años y 4 meses. No se ha objetivado presencia de pubarquia ni axilarquia. En el domicilio no existen fármacos que contengan esteroides sexuales. No se aportan gráficas de crecimiento. Según nos informan los padres, aparentemente no han notado incremento de la velocidad de crecimiento. Aporta edad ósea (EO) solicitada desde su centro de salud que corresponde a tres años. Antecedentes familiares Madre: talla 160 cm y menarquia a los 11 años. Padre: talla 189 cm y desarrollo puberal normal. Sin otros casos familiares de pubertad precoz. Talla genética: 168 +/- 5 cm (percentil 90). Antecedentes personales Embarazo controlado sin incidencias. Parto eutócico a las 39 semanas, Apgar 9/10. PRN: 3.500 gramos (p50-75); LRN: 49 cm (p50-75). Periodo neonatal sin incidencias. Lactancia materna hasta los 10 meses. Diversificación alimentaria reglada y bien tolerada. Sin alergias ni ingresos previos. Exploración física a los 2 años 10 meses Peso: 15,2 kg (p75-90); talla: 98 cm (p90-97); IMC: 15,82 (p25-50). Fenotipo normal. No se palpa bocio. Sin lesiones cutáneas reseñables. Abdomen: sin visceromegalias ni distensión abdominal. Genitales externos femeninos normoconfigurados. Estadio puberal Tanner I (telarquia izquierda 1 x 1 cm, telarquia derecha 1,5 x 2 cm, sin molestias locales ni cambios en la pigmentación de la areola, sin pubarquia ni axilarquia). Pruebas complementarias Se realiza una ecografía abdominopélvica con parámetros prepuberales: útero de 28 mm de diámetro, sin línea endometrial visible, relación cuello/fundus de 1. Evolución La sospecha diagnóstica inicial fue de telarquia prematura aislada sustentada en: telarquia no progresiva sin cambios en la pigmentación de la areola, EO acorde con la edad cronológica, talla acorde con talla genética y datos prepuberales en la ecografía pélvica. Se decide seguimiento clínico. En los siguientes meses, se objetiva aumento progresivo de la telarquia, así como de la velocidad de crecimiento (8 cm en 7 meses). Ante estos hallazgos, se solicita una nueva radiografía de mano-muñeca izquierda que muestra una EO de 5 años para una EC de 3 años y 6 meses. Con estos datos, se realiza el siguiente estudio hormonal: • 17-β-estradiol de 43,7 pg/ml (<11). • Test de LHRH: LH basal 1,3 y pico de 72,5 UI/L. Con estos hallazgos, se confirma una activación central de la pubertad, motivo por el que se realiza una RM craneal que resulta normal. Con el diagnóstico de PPCI, se inicia tratamiento con análogos de GnRH, frenando la progresión de la pubertad y logrando desaceleración de la velocidad de crecimiento en los siguientes meses.
|