|
| Regreso a las bases |
J. Pozo Román
Médico adjunto del Servicio de Endocrinología Pediátrica. Hospital Infantil Universitario Niño Jesús de Madrid. Profesor Asociado de Pediatría. Universidad Autónoma de Madrid
| Resumen
La pubertad es el periodo del desarrollo en el que tienen lugar los cambios biológicos y somáticos que marcan la diferencia entre un niño y un adulto. Es un proceso madurativo, de límites imprecisos, que se inicia con la aparición de los caracteres sexuales secundarios y finaliza cuando se alcanza la talla adulta, la maduración sexual completa y la capacidad reproductora. Resulta de la reactivación del eje hipotálamo-hipófiso gonadal, pero los mecanismos neurobiológicos que regulan sus periodos de activación y quiescencia continúan siendo, en gran medida, un enigma. La edad de inicio puberal muestra una variabilidad de 4-5 años y está determinada por factores genéticos (50-80%) y ambientales, cuya influencia parece estar mediada, al menos, en parte, a través de mecanismos epigenéticos. Clínicamente, el inicio puberal lo marca la aparición y posterior desarrollo de los caracteres sexuales secundarios, que siguen una secuencia relativamente predecible y categorizada en cinco fases (estadios de Marshall y Tanner), de indudable utilidad clínica, pero cuya utilización, requiere entrenamiento. Así mismo, se produce una marcada aceleración del ritmo de crecimiento (estirón puberal) que conduce al cierre de los cartílagos de crecimiento y a la finalización de este. La pubertad se acompaña además, de cambios en la composición corporal y en las proporciones corporales que son sexualmente dimórficos. |
| Abstract
Puberty is the period in which biological and somatic changes take place so as to make the difference between a child and an adult. It is a maturation process, with imprecise limits, that begins with the appearance of secondary sexual characteristics and ends when the adult size, full sexual maturation and reproductive capacity are reached. It results from the reactivation of the gonadal hypothalamic-pituitary axis, but the neurobiological mechanisms that regulate its activation and quiescence periods remain, to a large extent, an enigma. The age of pubertal onset shows a variability of 4-5 years and is determined by genetic (50-80%) and environmental factors, the influence of which seems to be mediated, at least in part, through epigenetic mechanisms. Clinically, the pubertal onset is marked by the appearance and development of secondary sexual characteristics, which follow a relatively predictable sequence and was categorized into five phases (Marshall and Tanner stages), of undoubted clinical utility, but whose use requires training. Likewise, there is a marked acceleration of the growth rate (pubertal growth spurt) that leads to the closure of the growth epiphyseal plates. Puberty is also accompanied by changes in body composition and body proportions that are sexually dimorphic. |
Palabras clave: Pubertad normal; Inicio puberal; Eje hipotálamo-hipófiso-gonadal; Minipubertad; Estadios de Tanner.
Key words: Normal puberty; Pubertal onset; Hypothalamic-pituitary-gonadal axis; Minipuberty; Tanner stage.
Pediatr Integral 2020; XXIV (4): 231.e1 – 231.e10
Pubertad normal
Introducción y concepto
La pubertad es el periodo del desarrollo humano en el que tienen lugar los cambios biológicos y somáticos que marcan la diferencia entre la infancia y la edad adulta. Se trata de un proceso madurativo, de límites imprecisos, que se inicia con la aparición de los caracteres sexuales secundarios y finaliza, una media de 4-5 años después, cuando se ha alcanzado la talla adulta, la maduración sexual completa y la capacidad reproductora. Este proceso conlleva no solo el desarrollo gonadal y genital, sino también la aceleración del crecimiento, la modificación de la composición corporal y de las proporciones corporales, así como, el inicio de los cambios psicológicos, emocionales, sociales y mentales propios de la adolescencia(1,2).
La pubertad se considera como “normal” cuando resulta de una activación mantenida del eje hipotálamo-hipófiso-gonadal (HHG) y se inicia, según criterios puramente estadísticos, en un intervalo de edad entre ± 2-2,5 SDS (Z-score) para la media del sexo y población de referencia; en la práctica clínica: entre los 8 y 13 años en las niñas y entre los 9 y 14 años en los varones. Existen una serie de entidades clínicas, más frecuentes en niñas, que se caracterizan también por la aparición precoz de alguno de los caracteres sexuales secundarios (telarquia, pubarquia…), pero en las que no se objetiva una clara activación del eje HHG. Estas entidades clínicas se consideran como variantes normales de pubertad, aunque requieren diagnóstico diferencial con pubertades precoces periféricas o centrales; entre ellas, se incluirían, fundamentalmente: la pubarquia-adrenarquia prematura aislada, la telarquia prematura aislada y la menarquia prematura aislada.
Fisiología de la pubertad
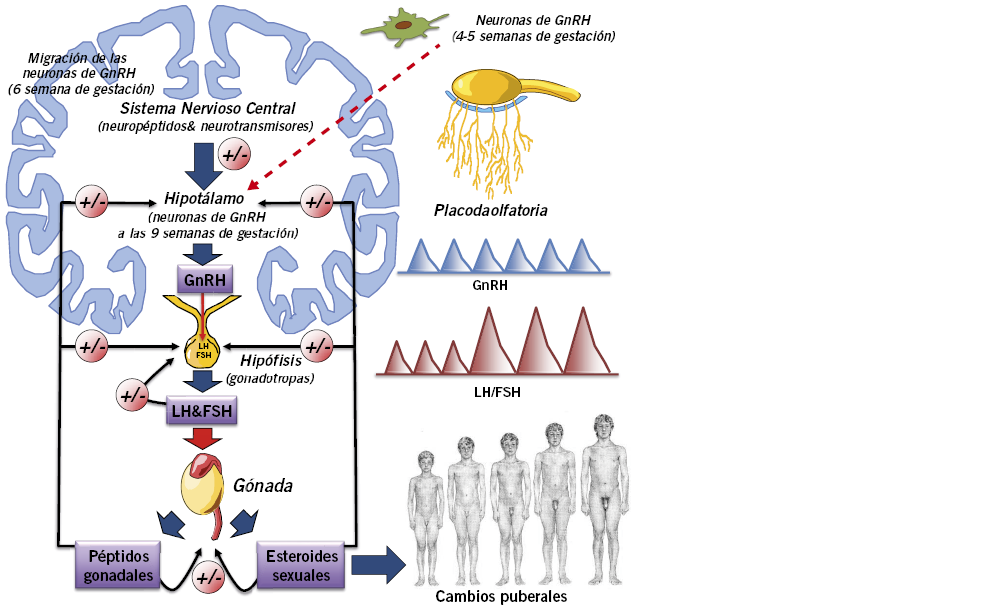
El eje HHG es el responsable del inicio de la pubertad (Fig. 1) y estaría formado, como elementos primordiales, por: las neuronas hipotalámicas productoras de GnRH (hormona hipotalámica liberadora de gonadotropinas); las células gonadotropas hipofisarias, responsables de la producción y liberación de las gonadotropinas hipofisarias (LH: hormona luteinizante, y FSH: hormona foliculoestimulante); y las propias gónadas, principales responsables de la liberación de los esteroides sexuales (ES), responsables, a su vez, del desarrollo de los caracteres sexuales secundarios(1-6).
Figura 1. Eje hipotálamo-hipófiso-gonadal (HHG). La hormona hipotalámica liberadora de gonadotropinas (GnRH) induce, en las células gonadotropas hipofisarias, la síntesis y liberación pulsátil de las gonadotropinas hipofisarias, LH (hormona luteinizante) y FSH (hormona folículo-estimulante), que actúan coordinadamente en la gónada para inducir la maduración de las células germinales (óvulos o espermatozoides) y la producción de esteroides sexuales (ES) y otros péptidos gonadales (inhibinas, activinas, progesterona, factor semejante a la insulina 3 -INSL3-, hormona antimülleriana…). ES y péptidos gonadales, así como otras hormonas circulantes (leptina, ghrelina…), ejercen a través de mecanismos de retrocontrol, acciones estimulantes e inhibidoras, a diferentes niveles del eje HHG, modulando su complejo funcionamiento; así, por ejemplo, los ES, principalmente la testosterona en el varón y estradiol en la mujer, además de ser los responsables finales del desarrollo de los caracteres sexuales secundarios, ejercen un retrocontrol negativo en hipotálamo e hipófisis, reduciendo la secreción de GnRH y LH (ver texto). Tomado con permiso de: Pozo J, Muñoz MT. Pubertad precoz y retraso puberal. Pediatr Integral. 2015; XIX(6): 389-410.
Desarrollo fetal del eje HHG
Las neuronas que producen GnRH (neuronas-GnRH) son una población especial de neuronas, en el sentido de que embriológicamente se originan fuera del sistema nervioso, a partir del ectodermo oral, en la placoda olfatoria. A partir de la 5ª-6ª semana de gestación emigran desde allí, siguiendo los axones guía de los nervios vomeronasal y olfatorio, hasta atravesar la placa cribiforme y alcanzar el cerebro anterior y, posteriormente, el hipotálamo, donde se encuentran ya establecidas alrededor de la 15 semana de gestación unas 10.000 neuronas-GnRH. Desde allí, proyectarán sus axones liberadores de GnRH hacia la eminencia media y sistema portal hipofisario. En humanos, a diferencia de los roedores, los cuerpos de las neuronas-GnRH no se localizan en un núcleo específico, sino que se encuentran dispersos principalmente en el hipotálamo mediobasal, infundibular y periventricular, formando una red neuronal difusa que coordina el generador de pulsos de GnRH(3).
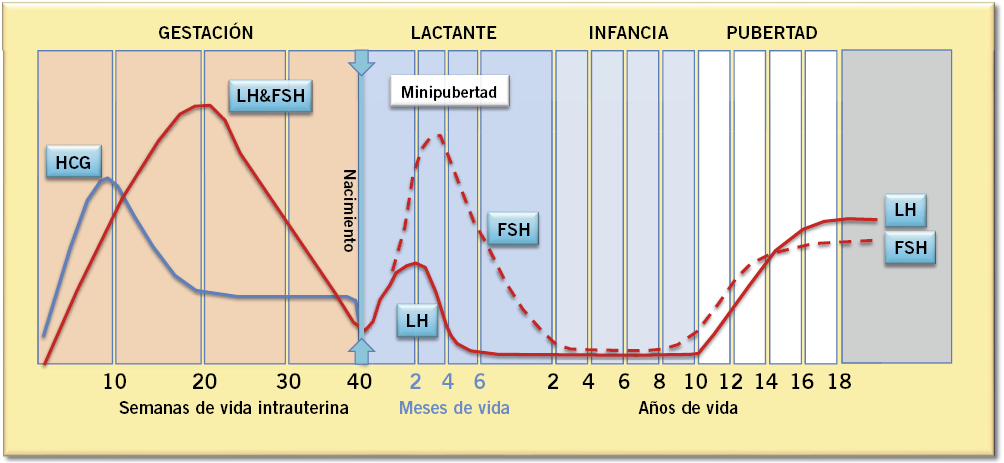
El eje HHG se activa durante el 1er trimestre de gestación, contribuyendo, a partir del 2º trimestre, al incremento del tamaño del pene y al descenso testicular en su fase inguino-escrotal (Fig. 2).
Figura 2. Evolución ontogénica del eje hipotálamo-hipófiso-gonadal en niñas. Cambios en las concentraciones de gonadotropinas: gonadotropina coriónica (HCG), hormona luteoestimulante (LH) y hormona folículo estimulante (FSH).
Posteriormente, es inhibido por el retrocontrol negativo de las hormonas placentarias, principalmente por el estradiol; de manera que, al nacimiento, el nivel sérico de gonadotropinas hipofisarias es bajo.
Minipubertad
La desaparición de los ES placentarios tras el parto permite la reactivación del eje HHG a partir de la 1ª semana de vida postnatal, que se mantendrá activo durante los primeros meses de vida, lo que se conoce como “mini-pubertad” (Fig. 2). El incremento de la secreción pulsátil de GnRH, incrementa los niveles de gonadotropinas y ES, con pico máximo entre los 1 y 3 meses. Durante este tiempo, los niveles de FSH son más elevados en niñas; mientras que, en los varones predomina la LH. Los niveles de LH y de FSH, así como los de testosterona (inducidos por la LH) disminuyen a los 6 meses en los varones; mientras que, los de FSH se mantienen elevados en las niñas hasta los 2-3 años, incluso más.
En los varones, la secreción de gonadotropinas en la minipubertad provoca: un discreto aumento del tamaño testicular; un aumento de testosterona con incremento de la actividad androgénica (aumento del pene, acné, hipertrofia de glándulas sebáceas…); y un aumento de inhibina B (marcador del número y función de las células de Sertoli), hormona antimülleriana (AMH, células de Sertoli inmaduras) y del factor semejante a la insulina 3 (INSL3, células de Leydig). Durante este periodo e inducido por la FSH, se produce una proliferación de las células de Sertoli inmaduras, que pasan de una media de 260 x 106 al nacimiento a 1500 x 106 a los 3 meses, lo que se supone que puede ser un factor crítico de la futura capacidad para la producción de espermatozoides en la edad adulta. Estas células de Sertoli inmaduras apenas expresan receptores de testosterona, por lo que permanecen inmaduras y la espermatogénesis no se inicia. En las niñas, la secreción de gonadotropinas en la minipubertad favorece, además del incremento de inhibina B y AMH, por las células de la granulosa, el desarrollo folicular ovárico, lo que favorece el hallazgo frecuente de quistes foliculares, especialmente durante el 1er año de vida, y la producción fluctuante de estradiol, que puede traducirse en un crecimiento mamario (telarquia del lactante) que, con frecuencia, tiene también un carácter oscilante.
La minipubertad supone un breve periodo de ventana, especialmente entre la 4 y la 12 semana de vida postnatal, en el que es posible estudiar hormonalmente los pacientes con sospecha de hipogonadismo hipogonadotropo congénito (HHC). Sin embargo, su significado biológico y sus consecuencias sobre la capacidad reproductora futura, así como los mecanismos que determinan la posterior quiescencia del eje HHG durante la infancia, se desconocen.
Eje HHG en la infancia y pubertad
Después de la minipubertad, el eje HHG permanece quiescente hasta el inicio de la pubertad. Inicialmente, se creyó que su inhibición era el resultado de una sensibilidad aumentada de las neuronas-GnRH a los bajos niveles circulantes de ES; sin embargo, el mantenimiento de dicha supresión en sujetos agonadales, sugiere una inhibición neural activa de la secreción pulsátil de GnRH independiente de los ES circulantes. En cualquier caso, esta inhibición no es completa, especialmente en las niñas, que muestran niveles séricos de FSH ligeramente mayores que los varones y, con frecuencia, y como consecuencia de ello, quistes foliculares ováricos, detectables ecográficamente y capaces, en ocasiones, de secretar transitoriamente cantidades clínicamente significativas de estrógenos, provocando episodios autolimitados y fluctuantes de telarquia aislada (telarquia prematura aislada).
En el periodo prepuberal tardío, unos dos años antes de que aparezcan los primeros signos clínicos de la pubertad, el eje HHG se reactiva nuevamente; de forma que, se produce un incremento progresivo de la secreción pulsátil de GnRH que provoca un aumento, inicialmente durante el sueño, de la secreción de LH y, en menor medida, de FSH por las células gonadotropas. La pulsatilidad de GnRH no solo es imprescindible para que se produzca la secreción pulsátil de gonadotropinas hipofisarias, sino que su frecuencia determina el ritmo pulsátil de LH-FSH, el ratio entre LH y FSH, y su grado de glicosilación, lo que, a su vez, modifica su estabilidad y potencia(3). A medida que la pubertad avanza, la secreción de gonadotropinas aumenta y se extiende al resto del día; así mismo, la sensibilidad de las gónadas a su estímulo se incrementa y, con ello, la producción de ES. La LH estimula a las células intersticiales (células de la teca ováricas y células de Leydig testiculares); mientras que, la FSH actúa sobre las células derivadas de los cordones sexuales (células de la granulosa en el ovario y células de Sertoli en el testículo). Ambos compartimentos gonadales son coordinados a través de mecanismos de regulación paracrinos.
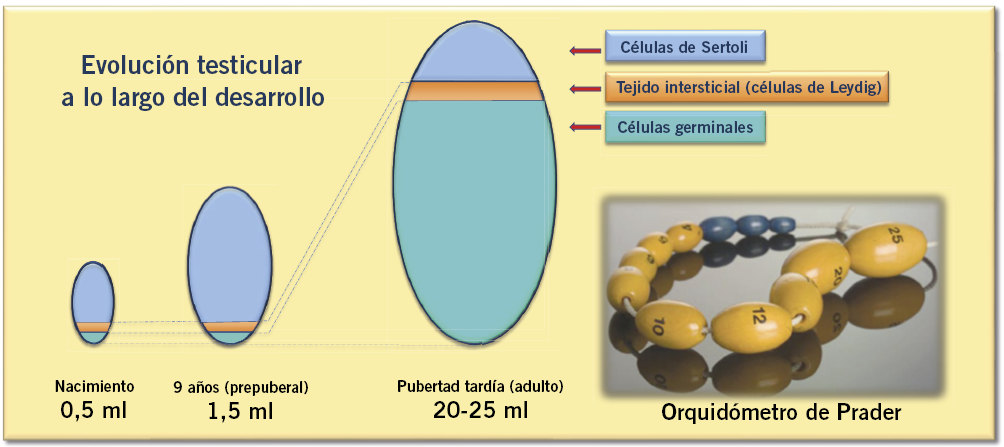
En el varón, la secreción de FSH al inicio de la pubertad estimula una segunda ola de proliferación de células de Sertoli inmaduras y de espermatogonias (células madre especializadas en diferenciarse a espermatozoides), previa a la maduración de los túbulos seminíferos, así como un aumento de los niveles de inhibina B. Por su parte, la LH estimula progresivamente a las células de Leydig e incrementa su producción de testosterona y de INL3. La acción combinada de FSH, sobre las células de Sertoli, y de LH aumentando la testosterona intragonadal, determina el inicio de la espermatogénesis y un rápido incremento del volumen testicular a expensas, sobre todo, de células germinales maduras y del aumento del diámetro de los túbulos (Fig. 3).
Figura 3. Evolución ontogénica del volumen testicular y de sus distintos componentes (Modificada de: Rey RA. Regulation of Spermatogenesis. Endocr Dev. 2003; 5: 38-55). Los túbulos seminíferos (células de Sertoli y células germinales) representan siempre el mayor componente del testículo. Desde el nacimiento y a lo largo de todo el periodo prepuberal, los túbulos seminíferos están formados fundamentalmente por las células de Sertoli; mientras que, el aumento del volumen testicular que se produce en la pubertad es debido principalmente a la proliferación de las células germinales. Orquidómetro (Andrea Prader; 1966(21)): rosario de elipsoides de madera o plástico, de tamaño progresivamente mayor, desde 1 a 25 ml, que permite, por comparación, determinar el volumen testicular. Al finalizar la pubertad, el volumen testicular suele ser ≥ 20 ml (rango 12-27 ml).
Durante el proceso y antes de que el testículo experimente un claro aumento de tamaño, los niveles de AMH disminuyen, probablemente como consecuencia del aumento de la expresión de los receptores androgénicos en las células de Sertoli.
En la mujer, la LH estimula la producción de precursores androgénicos en las células de la teca; mientras que, la FSH, además de incrementar los niveles séricos de inhibina B, es necesaria para el reclutamiento de folículos ováricos y, para inducir en las células de la granulosa, la producción de aromatasa, enzima necesaria para transformar los precursores androgénicos en estradiol. La AMH, por su parte, apenas experimenta fluctuaciones durante la pubertad femenina.
La testosterona en el varón y el estradiol en la mujer son los principales responsables del desarrollo de los caracteres sexuales secundarios. Así, entre otros muchos efectos, los estrógenos van a estimular el crecimiento de mamas, genitales y endometrio, así como la secreción de moco vaginal; mientras que, la testosterona, estimula el crecimiento de genitales masculinos, vello sexual y secreción pilo-sebácea. Ambos ES, pero especialmente el estradiol, intervienen en la aceleración del ritmo de crecimiento característico de la pubertad, el llamado “estirón puberal” (EP), tanto de forma directa, estimulando el crecimiento y maduración de las epífisis, como indirectamente, incrementando la secreción hipofisaria de hormona de crecimiento (GH) y consecuentemente de IGF-I (factor de crecimiento semejante a la insulina número I). El estirón puberal sería, por tanto, el resultado del efecto sinérgico sobre las placas de crecimiento de GH-IGF-I y ES. Andrógenos y estrógenos tienen, también, efectos diferenciales sobre el esqueleto; así, por ejemplo, los andrógenos parecen influir más en el grosor de los huesos, mientras que los estrógenos serían imprescindibles para el cierre de las epífisis y los más potentes inhibidores de la resorción ósea.
Los ES ejercen mecanismos de retrocontrol negativo en hipotálamo e hipófisis, reduciendo la secreción de GnRH y de LH; mientras que, las inhibinas controlan, en la hipófisis, la secreción de FSH a través de un asa de retrocontrol diferente. En las mujeres, a lo largo de la pubertad, se desarrolla, también, un particular mecanismo de retrocontrol positivo; de forma que, cuando el incremento mantenido de estradiol informa al hipotálamo de que el ovario está preparado para la ovulación, se produce, en la mitad del ciclo, un pico de LH (pico preovulatorio) necesario para la ovulación y, por consiguiente, para la fertilidad de la mujer. En roedores, el pico preovulatorio de LH parece ser el resultado de un incremento en la liberación de GnRH, inducido por la kisspeptina proveniente de un grupo específico de neuronas localizadas en el núcleo anteroventral periventricular del hipotálamo, presente en las hembras y prácticamente ausentes en los machos, que responderían positivamente al aumento de estrógenos (retrocontrol positivo). Sin embargo, en humanos y primates, las bases neurobiológicas del pico preovulatorio de LH permanecen por dilucidar.
Por último, recientemente, se ha puesto de manifiesto, la presencia en el hipotálamo de aromatasa, la enzima clave en la síntesis de estradiol, lo que sugiere una síntesis hipotalámica de estradiol (neuroestradiol), cuyo papel fisiológico es todavía desconocido.
Regulación del inicio de la puberal
Mecanismos neurobiológicos
Los mecanismos que regulan la puesta en marcha de la pubertad y, en general, los periodos de activación y quiescencia del eje HHG continúan siendo un enigma(6-8). Durante el periodo prepuberal, las neuronas-GnRH parecen estar sometidas a una inhibición trans-sináptica mantenida. Cuando la pubertad se inicia, esta inhibición es retirada progresivamente, permitiendo la entrada de estímulos excitatorios y el incremento en el número y amplitud de los picos secretorios de GnRH por las neuronas del núcleo infundibular del hipotálamo, fenómeno que pone en marcha la pubertad.
La kisspeptina, un péptido hipotalámico, descubierto en 2001, parece ser el principal regulador de la amplitud de los picos de GnRH y mediador de muchos otros factores implicados en la secreción de GnRH y en el inicio de la pubertad. De hecho, la interrelación entre las neuronas productoras de kisspeptina y las neuronas-GnRH es muy estrecha; un buen ejemplo de ello es que la expresión hipotalámica de los genes de kisspeptina (KISS1) y de su receptor (KISS1R) se incrementa durante la pubertad y que mutaciones inactivantes en KISS1-R impiden que la pubertad se ponga en marcha ocasionando un HHC. Un 75% de las neuronas productoras de kisspeptina cosegregan neuroquinina B y dinorfina, son las llamadas “neuronas KNDy”. Este grupo de neuronas están profusamente interconectadas entre sí, lo que sugiere la existencia de asas autorreguladoras estimuladoras (neuroquinina B) o inhibidoras (dinorfina) que regularían de forma muy fina la secreción de kisspeptina y, por ende, la secreción de GnRH. En cualquier caso, y a diferencia de otras especies, no todas las neuronas-GnRH reciben aferencias de las neuronas de kisspeptina, lo que sugiere que otras moléculas regularían el proceso de la pubertad en humanos. Así, por ejemplo, entre otros: el ácido gamma butírico (GABA), el neuropéptido Y (NPY) y el péptido RFRP-3 inhibirían la pulsatilidad de GnRH; mientras que, el glutamato y el sistema noradrenérgico la estimularían. Es probable que muchos de estos factores, sino todos, actúen “aguas arriba” de las neuronas KNDy, que serían un componente esencial de la maquinaria generadora de pulsos de GnRH, actuando como vía final de integración de factores internos y externos sobre la secreción pulsátil de GnRH. Las células de la glía contribuirían también al incremento de la secreción de GnRH durante la pubertad, mediante la liberación de factores de crecimiento que modularían su actividad.
Según la teoría de Ojeda y cols.(6), sobre esta maquinaria de generación de pulsos de GnRH, se situarían redes nodales formadas por múltiples genes codificadores de proteínas, cuyas acciones se solaparían o interaccionarían de forma jerárquica o independiente, para controlar su actividad e interrelacionar su funcionamiento con los factores genéticos o ambientales que influirían en el momento de inicio puberal. Se cree que, en esta interrelación entre factores genéticos y ambientales, estarían implicados mecanismos epigenéticos(9).
Factores genéticos y epigenéticos
La edad de inicio puberal (timing) muestra una variabilidad de unos 4-5 años entre individuos normales con condiciones de vida similares(10). Esta variabilidad parece estar determinada por factores genéticos (50-80% de la variabilidad) y ambientales, y es compatible con un patrón de herencia poligénico(11); no obstante, sus bases genéticas y los mecanismos fisiopatológicos subyacentes no han sido claramente establecidos. Un buen ejemplo de este componente genético, en el caso de las niñas, es la mayor correlación en la edad de la menarquia entre gemelas monocigoticas (r = 0,75) que entre dicigoticas o no gemelares (r = 0,31 y 0,32, respectivamente)(12).
Los estudios de asociación del genoma completo (GWAS) han puesto también de manifiesto este componente genético en el timing de la pubertad, identificando casi 400 loci relacionados con el momento de la menarquia(13). Un gran número de estos loci, especialmente en niñas, están relacionados además con el índice de masa corporal (IMC = peso/talla2) y la talla, reflejando probablemente, la estrecha relación que existe entre balance energético, crecimiento, desarrollo y fertilidad. Entre ellos, se encuentra el gen, más frecuentemente asociado con una menarquia temprana en este tipo de estudios, el LIN28B (6q21). Sorprendentemente, la asociación es menor cuando analizamos genes que han sido implicados en causas monogénicas de HHC (p. ej., FGF8, GNRH1, KAL1, KISS1…) o de pubertad precoz (p. ej., MKRN3 y DLK1). En cualquier caso, la influencia aislada de cada uno de estos genes sobre la menarquia es, en condiciones normales, escasa, y se calcula que, en conjunto, serían responsables de tan solo un 7,4% de la varianza en su edad de presentación(13).
Las diferencias en la edad de inicio puberal entre razas y etnias, al igual que ocurre entre diferentes áreas geográficas, son, probablemente, un reflejo de la combinación de factores genéticos y ambientales. Así, por ejemplo, en Europa, existe un gradiente Norte-Sur, de manera que la edad de la menarquia es mayor en los países nórdicos que en los mediterráneos; mientras que, en lo referente a las razas, la raza negra, en condiciones de vida similares, muestra una tendencia a una maduración más temprana que la raza blanca.
En los últimos años, la epigenética, entendiendo por tal, cualquier modificación de la expresión génica no atribuible a cambios en la secuencia propiamente dicha del ADN (metilación/hipometilación de ADN, modificaciones postranscripcionales de las histonas…), ha sido implicada en todas las parcelas del desarrollo, incluyendo, por supuesto, el inicio de la pubertad(8,9,14). Se ha postulado que la represión/activación de la transcripción de determinados genes, podría mediar el efecto de diferentes estímulos ambientales (nutrición, actividad circadiana, disruptores endocrinos…) sobre el inicio de la pubertad. Estudios recientes sugieren la existencia de un mecanismo dual de regulación epigenética que afectaría positiva (brazo activador) o negativamente (brazo represor) la actividad transcripcional de las neuronas implicadas en la estimulación de la secreción de GnRH(9). Uno de los mediadores principales de estas acciones, al menos, en roedores, parece ser un complejo grupo de proteínas supresoras de la transcripción, conocidas como grupo Polycomb (PcG)(8,9).
Factores ambientales
Los factores ambientales que influyen en el momento de inicio de la pubertad son múltiples(1,2,5,7,8,12,13) e incluso pueden actuar en periodos críticos de la vida muy alejados del momento de inicio puberal (intraútero o primeros años de vida). Algunos de los más conocidos son:
• Nutricionales y socioeconómicos. Una adecuada nutrición y un ambiente socioeconómico favorable se asocian a un desarrollo puberal más temprano; mientras que, condiciones nutricionales o socioeconómicas desfavorables condicionan un desarrollo puberal más tardío(1). De hecho, la mejoría en la nutrición, salud y condiciones generales de vida que se han producido en los países occidentales desarrollados desde mediados del siglo XIX hasta la actualidad, parece ser la responsable de la tendencia a una maduración más rápida, especialmente en mujeres (la menarquia se ha adelantado desde los 15-17 años a los 12,5-13 años), así como de una mayor talla adulta en ambos sexos. Ambos fenómenos, conocidos como “tendencia secular del crecimiento y desarrollo”, muestran variaciones de magnitud entre diferentes países y es objeto de debate si la tendencia secular continúa o se ha estabilizado en algunos países.
En 1970, Frish y Revelle(15), propusieron la hipótesis del “peso crítico”, sugiriendo que se requeriría un peso de, al menos, 48 kg para alcanzar la menarquia. Aunque esta hipótesis no fue confirmada, lo que sí se ha demostrado es que la nutrición es uno de los principales factores determinantes del momento de inicio puberal y, prueba de ello, como ya ha sido comentado, es que muchos de los loci implicados en la variabilidad normal del timing puberal están también relacionados con el IMC(13). Desde el punto vista hormonal, la interrelación nutrición-pubertad estaría, probablemente, mediada por la leptina liberada por los adipocitos, cuyos niveles séricos son un reflejo de la energía almacenada y se correlacionan positivamente con el IMC(3). La leptina estimularía la secreción de GnRH actuando sobre las neuronas productoras de kisspeptina y sería un factor permisivo, aunque no determinante, para el inicio de la pubertad. Otras substancias relacionadas con la ingesta y el ayuno, como: glucosa, insulina, IGF-I, ghrelina (péptido gástrico) y FGF21 (hepatoquina)(8), entre otros, podrían también actuar como fuentes de información para el hipotálamo del estado nutricional y, por ende, del control de la pubertad.
La malnutrición crónica, en general, induce un retraso puberal en ambos sexos y es, probablemente, uno de los factores responsables del retraso puberal asociado a las patologías crónicas o a la amenorrea atlética. En el otro extremo, el exceso de grasa subcutánea y el aumento del IMC durante el periodo prepuberal se asocian con un mayor riesgo de pubertad temprana, especialmente en niñas(12,16), y podrían ser uno de los factores implicados en la aceleración puberal (tendencia secular) observada en las últimas décadas en algunos países occidentales, con tasas crecientes de obesidad infantil.
• Microbiota intestinal. Un nuevo factor que ha emergido como potencialmente relevante en el control de la homeostasis y posiblemente también en el desarrollo puberal, es la microbiota intestinal; es decir, la flora microbiana que coloniza nuestro intestino(8). Durante la pubertad se pueden observar profundos cambios en la microbiota intestinal: cambio de especies aerobias y anaerobias facultativas a anaerobias; mayor abundancia en adolescentes de Bifidobacterias y Clostridium que en adultos; e, incluso, modificaciones específicas en función del género, al menos, en animales de experimentación. En estos, los cambios en la microbiota parecen ser capaces de inducir modificaciones en la producción de ES y neurotransmisores, lo que ha sugerido un potencial papel en la modulación del timing puberal(8).
• Estrés crónico. El estrés crónico parece ser capaz e inhibir el eje HHG, y sería uno de los factores implicados en el retraso puberal asociado a: enfermedades crónicas, ejercicio físico intenso-competición o conflictos bélicos, entre otras potenciales situaciones de estrés; no obstante, en muchas de ellas, es difícil separar el componente de estrés de otros componentes que, como la malnutrición, están frecuentemente presentes en estas situaciones(16).
• Condiciones de vida intrauterina. Los recién nacidos, especialmente las niñas, con bajo peso al nacimiento (PRN < 2.500 g) o pequeños para su edad gestacional (RNPEG)(17), muestran una mayor incidencia de pubertad adelantada o precoz, sobre todo, si experimentan un rápido crecimiento de recuperación en los primeros meses de vida.
• Disruptores endocrinos. Son sustancias, naturales o de síntesis, que, debido a su similitud estructural con determinadas hormonas, pueden tener efectos negativos sobre el sistema endocrino. En las últimas décadas, la industrialización ha producido un incremento gradual en el número y cantidad de contaminantes ambientales y de disruptores endocrinos (fitoestrógenos, bisfenol, pesticidas, fungicidas, ftalatos…), algunos de los cuales se ha demostrado que son capaces de producir en humanos: pubertad adelantada/retrasada o, incluso, trastornos de la diferenciación sexual, dependiendo de su mecanismo de acción (estrogénico, androgénico, antiandrogénico y antiestrogénico) y momento de actuación.
• Adopción. Los últimos 30 años han puesto de manifiesto la importancia, como causa de adelanto puberal, de la adopción internacional. Entre un 15-30% de los casos de pubertad precoz central (PPC) idiopática corresponden a niños adoptados de otros países, habitualmente en vías de desarrollo. En todos los estudios, existe un claro predominio de niñas. En el año 2010, se publicaron los primeros resultados del Registro Español de Pubertad Precoz(18), donde se observó un riesgo 25 veces mayor de desarrollar PPC idiopática entre niñas adoptadas de otros países respecto a la población nacida en España. Las causas que motivan el adelanto puberal en estas niñas son desconocidas, aunque se han sugerido distintos factores, entre ellos: la mejoría nutricional y socioeconómica, la reducción del estrés crónico y de la exposición a disruptores endocrinos, o la combinación de unas condiciones vitales adversas en la infancia temprana y de opulencia en el periodo prepuberal tardío, dos condiciones opuestas que favorecerían el desarrollo puberal temprano.
Manifestaciones clínicas de la pubertad
Desarrollo de los caracteres sexuales secundarios
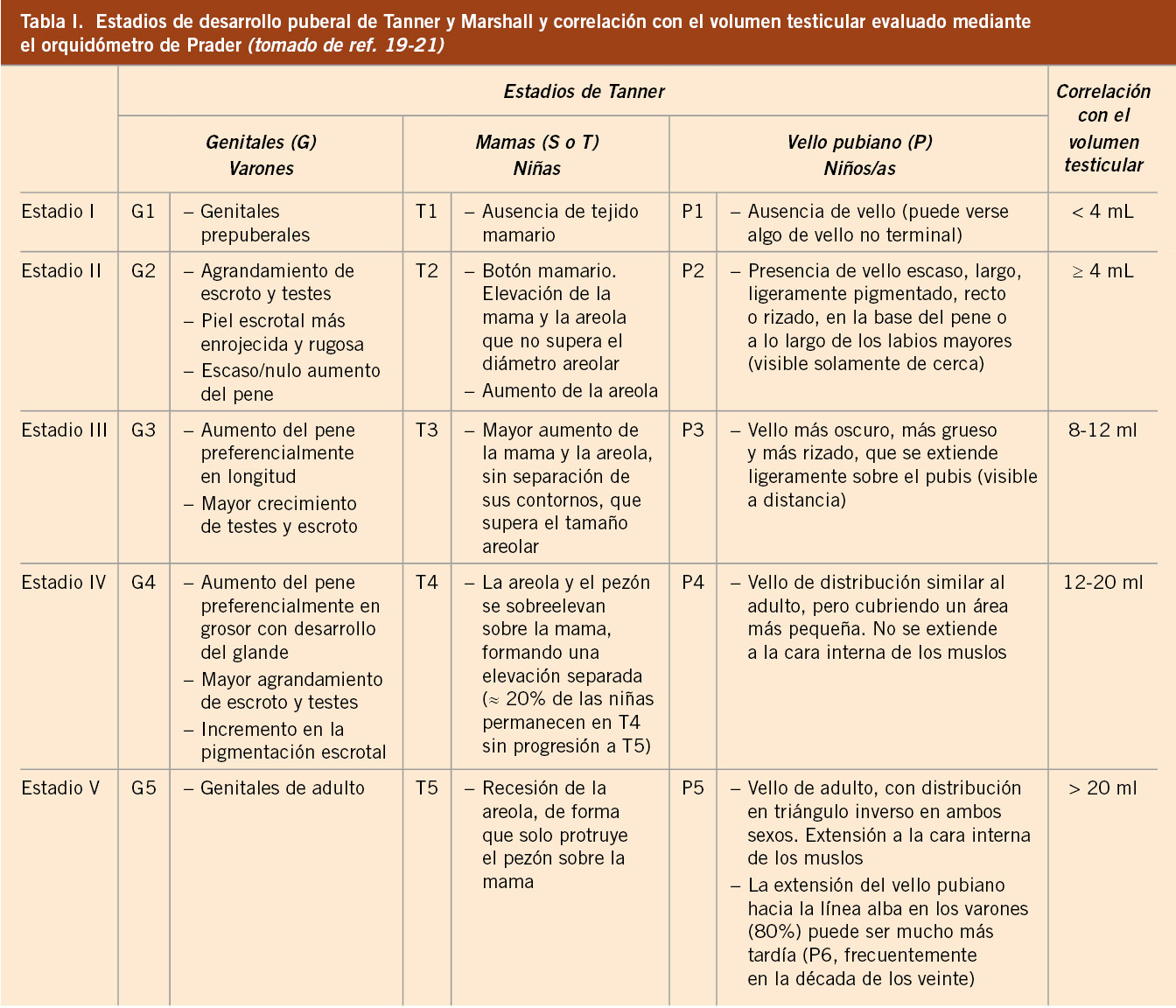
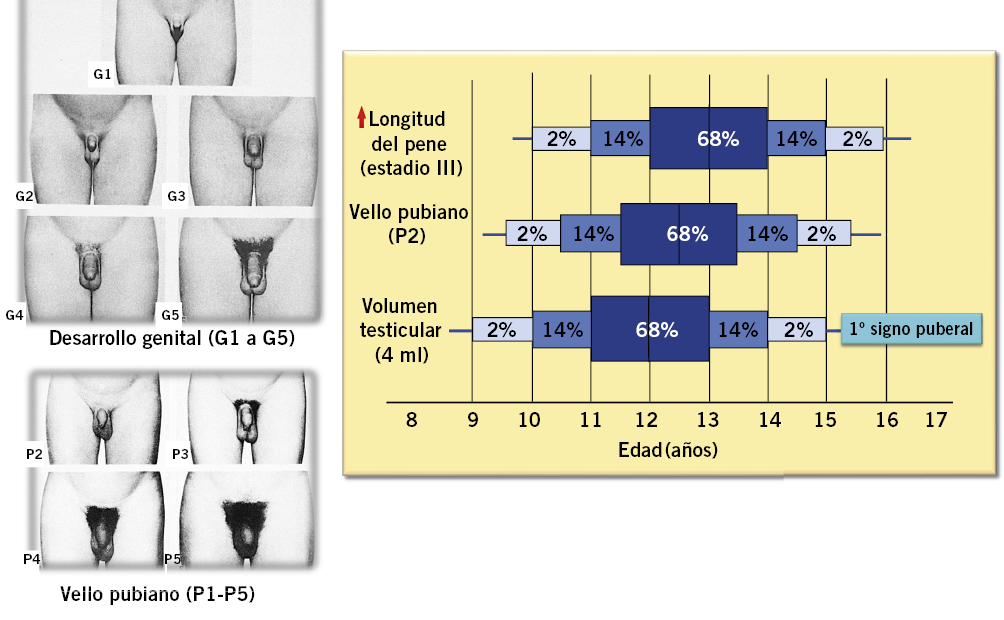
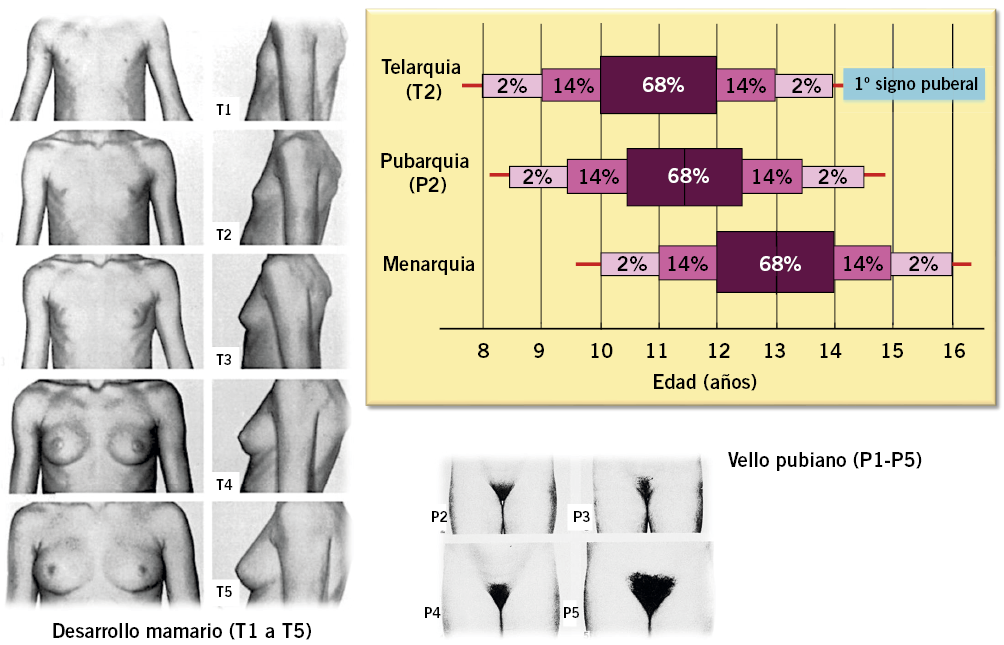
Desde el punto de vista clínico, el inicio de la pubertad lo marca la aparición y el desarrollo de los caracteres sexuales secundarios, que siguen una secuencia relativamente predecible y categorizada en cinco fases o estadios por Marshall y Tanner(19,20) a finales de la década de los sesenta (Tabla I y Figs. 4 y 5).
Figura 4. Secuencia y edades de aparición de los eventos puberales en el varón y estadios puberales de Marshall y Tanner(20).
Figura 5. Secuencia y edades de aparición de los eventos puberales en la mujer y estadios puberales de Marshall y Tanner(19).
El método solo valora el desarrollo de los genitales en el varón, de la mama en las niñas y del vello pubiano en ambos sexos. Su principal limitación es el hecho de que los estadios fueron establecidos por inspección, a partir de fotografías, y, en muchos casos, es necesaria la palpación para establecer el grado de desarrollo de determinados caracteres sexuales, como, por ejemplo: para diferenciar telarquia de adipomasia o para valorar evolutivamente el crecimiento testicular, aspecto no valorado en el estadiaje puberal por Marshall y Tanner.
En 1966, Andrea Prader(21) introdujo el orquidómetro (Fig. 3), un rosario de elipsoides de madera o plástico, de tamaño progresivamente mayor, desde 1 a 25 ml, que permite, por comparación, determinar el volumen testicular; no obstante, al igual que ocurre con el estadiaje de Tanner, su utilización requiere un cierto entrenamiento. En condiciones normales, existe una aceptable correlación entre el volumen testicular y el estadio de Tanner (Tabla I).
Al finalizar el desarrollo puberal, el volumen es en la mayoría de los casos ≥ 20 ml (rango 12-27 ml). Una discordancia marcada entre el estadio de Tanner y el volumen testicular debe hacer sospechar determinadas patologías, como: un síndrome de Klinefelter (47,XXX) o una pubertad precoz periférica (pseudopubertad precoz).
La secuencia de eventos puberales(1,2,5,22), aunque no es exactamente la misma para cada individuo, es mucho menos variable que la edad a la que estos ocurren; en cualquier caso, existe una mejor correlación entre el grado de desarrollo puberal y la edad ósea (EO) que entre este y la edad cronológica (EC). En las niñas, la telarquia o aparición del botón mamario suele ser el primer signo de desarrollo puberal, a una edad media de 10,5-11 años (intervalo de 8 a 13 años); mientras que, en los varones, el inicio puberal lo marca el incremento del volumen testicular, que alcanza o supera los 4 mL de volumen o un diámetro mayor o igual a 25 mm (estadio II), a una edad media de 11,5-12 años (intervalo de 9 a 14 años), unos 6-12 meses antes del incremento del tamaño del pene (estadio III).
Aunque existe una cierta variabilidad en la secuencia evolutiva de los caracteres sexuales secundarios, el incremento testicular en los varones y la telarquia en las mujeres (estadio II) suelen preceder en unos meses al desarrollo del vello pubiano que, por otra parte, no es un signo específico de pubertad; ya que, puede ser debido a la producción androgénica suprarrenal y preceder, en ocasiones, al inicio de la pubertad. En los varones, la ginecomastia puberal y el vello axilar suelen iniciarse en el estadio III, coincidiendo con el aumento en longitud del pene y el inicio del estirón puberal. El cambio en la voz y el vello de otras áreas corporales andrógeno-dependientes, como: pecho, cara, espalda y abdomen, suele iniciarse en la media pubertad (estadios III-IV). El vello en estas localizaciones progresa con mayor o menor rapidez a lo largo de los años, pero su distribución y magnitud dependen, en gran medida, de factores genéticos y raciales. En las niñas, la primera menstruación (menarquia) es un fenómeno tardío en la pubertad de las mujeres y suele producirse en el estadio IV, a los 12,5-13 años, unos dos años después de iniciado el desarrollo puberal (intervalo: 0,5-3 años) y cuando la edad ósea es de alrededor de 13 años. En los varones, la edad de la espermarquia, presencia de espermatozoides orina, y la 1ª eyaculación, son más difíciles de establecer; habitualmente se producen durante la fase III-IV de la pubertad. Al igual que ocurre con la menarquia, que es seguida habitualmente de ciclos anovulatorios, la espermarquia no significa necesariamente fertilidad; ya que, inicialmente, la cantidad de espermatozoides en el semen suele ser muy escasa.
Estirón puberal
Uno de los rasgos clínicos más característicos de la pubertad es la aceleración brusca que experimenta el ritmo de crecimiento, el llamado “estirón puberal” (EP). La velocidad de crecimiento (VC) que disminuye lentamente desde el nacimiento y a lo largo de todo el periodo prepuberal, alcanza su nadir justo antes del EP, en lo que se conoce como “depresión prepuberal de la VC”, un fenómeno que es especialmente llamativo en maduradores tardíos. El EP es una reciente adquisición de la especie humana y en algunas poblaciones actuales con condiciones de vida desfavorables (enfermedades crónicas, malnutrición o hipoxia por la altitud), el EP es todavía inaparente. Su aparición o el aumento de su amplitud es uno de los factores que más ha contribuido a la mejoría en el crecimiento, experimentada en los últimos 150 años (tendencia secular). En las modernas poblaciones europeas, la ganancia de talla, desde el inicio del EP hasta la finalización del crecimiento, es de unos 30-35 cm en varones y de unos 25-30 cm en mujeres (15-20% de la talla adulta)(10).
En las niñas, el inicio del EP coincide con la aparición del botón mamario (estadio II), pero el pico de VC (≈ 8-8,5 cm/año) se produce durante el estadio III. Posteriormente, la VC disminuye progresivamente hasta detenerse completamente con el cierre de los cartílagos de crecimiento; de forma que, después de la menarquia el crecimiento medio es de solo 6-7 cm (intervalo de 4-11 cm) y, cuando la EO alcanza los 15 años, el porcentaje de la talla final alcanzado es del 99%. En los varones, a diferencia de lo que ocurre en las niñas, el EP no coincide con el inicio de la pubertad, sino que se inicia más tardíamente, aproximadamente un año después (12,5-13 años), en el estadio III, y unos 2 años más tarde que en las niñas. El pico de máxima VC (≈ 10-11 cm/año) se produce en el estadio IV y la EO a la que se alcanza el 99% de la talla adulta es de 17 años.
El EP muestra un patrón distal-a-proximal: mayor crecimiento inicial de manos-pies y segmentos distales de las extremidades, seguido de la parte proximal de estas y, por último, de las partes más centrales del esqueleto. Durante la pubertad, el crecimiento del tronco es proporcionalmente mayor que el de las extremidades, lo que modifica las proporciones corporales respecto al periodo prepuberal, pero más aún cuando se acorta o alarga significativamente el crecimiento prepuberal; así, en casos de pubertad precoz, el segmento inferior es proporcionalmente más corto en relación con la talla total y, por el contrario, en pubertades retrasadas o hipogonadismos, las extremidades son proporcionalmente más largas (hábito eunucoide).
La amplitud del EP es similar en sujetos con talla familiar alta o baja, pero sí se ve afectada por el ritmo de maduración, con mayor amplitud en los maduradores rápidos y menor en los tardíos, lo que contribuye a compensar el mayor o menor número de años de crecimiento prepuberal. Los dos años más de crecimiento prepuberal que tienen los niños y la mayor amplitud de su estirón puberal determinan los 12,5-13 cm de diferencia entre la talla adulta de ambos sexos, así como la mayor longitud proporcional en los varones de las extremidades respecto al tronco (mayor periodo de crecimiento prepuberal).
Otros cambios corporales
Durante la pubertad, se produce también un dimorfismo sexual en el crecimiento en anchura del tronco, con un incremento mayor, pero más tardío, en los varones del diámetro transversal de los hombros (diámetro biacromial), y un mayor y más precoz incremento del diámetro transversal de la pelvis en las mujeres (diámetro bi-ilíaco).
El IMC y la composición corporal también experimentan modificaciones durante la pubertad bajo la influencia de ES, GH e IGF-I, y se adquiere prácticamente un 45% del contenido mineral óseo (masa ósea). El peso aumenta proporcionalmente más que la talla y, por ello, el IMC se incrementa rápidamente. Este incremento no debe interpretarse como el resultado de un incremento de la grasa corporal; ya que, aunque este se produce (16-19% en varones y 17-25% en mujeres), la mayor parte del incremento de peso corresponde a masa libre de grasa, especialmente en varones (músculo y hueso, especialmente). De ahí que, la interpretación del IMC en el periodo puberal debería hacerse con precaución y más en función del desarrollo puberal alcanzado que de la edad cronológica, para evitar así falsos diagnósticos de sobrepeso/obesidad en maduradores rápidos. La distribución de la grasa corporal también experimenta un dimorfismo sexual con mayor acúmulo intrabdominal en los varones y gluteofemoral en las mujeres.
Los cambios hormonales durante la pubertad también afectan al cerebro, promoviendo su remodelación y completando la maduración sexual y dimorfismo sexual que se inició en el periodo prenatal y en la vida postnatal temprana.
Duración de la pubertad
La duración de la pubertad (tempo) es, al igual que el momento de su inicio, muy variable, y se considera finalizada cuando se ha alcanzado la talla adulta, la maduración sexual completa y la capacidad reproductora, lo cual suele ocurrir una media de 4-5 años después de su inicio; sin embargo, clínicamente suelen utilizarse unos criterios diferentes y no muy acordes con el propio concepto de finalización de pubertad.
En las niñas, suele utilizarse como marcador de finalización puberal el inicio de las menstruaciones, aunque, en la mayoría de los casos, en el momento de la menarquia, ni se ha completado el desarrollo puberal (estadio IV de Tanner), ni se ha finalizado el crecimiento, ni se ha alcanzado plenamente la fertilidad; ya que, el porcentaje de ciclos anovulatorios durante los 2 primeros años postmenarquias es muy alto. El intervalo desde el inicio de la pubertad a la menarquia es solo de 2,4 años ± 1,1 año (media ± 1 SDS). Se ha observado una correlación negativa entre el inicio de la pubertad y la aparición de la menarquia; de forma que, las niñas que inician la pubertad más temprano tardan algo más en tener la menarquia que las niñas que maduran más tardíamente.
En los varones, la finalización de la pubertad es aún más difusa que en las niñas o, al menos, no tiene un marcador clínico tan claro, como lo es la menarquia. Suele considerarse que la pubertad se ha completado cuando se alcanza un volumen testicular de adulto (media de unos 20 mL), lo que se produce habitualmente, unos 3,2 ± 1,8 años (media ± 1 SDS) después de su inicio. No obstante, el criterio es poco fiable, dada la variabilidad normal del volumen testicular de un adulto. De hecho, algunos varones normales no superan los 12-15 mL de volumen testicular; mientras que, otros superan los 25-30 mL. Por otro lado, como en el caso de las mujeres, en ese momento, habitualmente, tampoco se ha finalizado el crecimiento ni se han desarrollado completamente los caracteres sexuales secundarios.
Bibliografía
1. Pozo J. Pubertad normal y sus variantes. En: García JJ, Cruz O, Mintegui S, Moreno JM, eds. M. Cruz Manual de Pediatría (4ª edición). Madrid: Editorial Ergon; 2020. p. 794-8. ISBN: 978-84-17194-65-9.
2. Soriano L. Pubertad normal y variantes de la normalidad. Pediatr Integral. 2015; XIX(6): 380-8.
3. Ben-Shlomo A, Melmed S. Hypothalamic regulation of anterior pituitary function. En: Melmed S, ed. The Pituitary (Fourth Edition). Cambridge (MA, USA): Academic Press, Elsevier In;. 2017. p. 23-45. ISBN: 978-0 12 804169-7.
4. Bordini B, Rosenfield RL. Normal pubertal development: part I: the endocrine basis of puberty. Pediatr Rev. 2011; 32: 223-30. doi: 10.1542/pir.32-6-223.
5. Wood CL, Lane LC, Cheetham T. Puberty: Normal physiology (brief overview). Best Pract Res Clin Endocrinol Metab. 2019; 33: 101265. doi: 10.1016/j.beem.2019.03.001.
6. Ojeda SR, Dubay C, Lomniczi A, Kaidar G, Matagne V, Sandau US, et al. Gene networks and the neuroendocrine regulation of puberty. Mol Cell Endocrinol 2010; 324: 3-11. doi:10.1016/j.mce.2009.12.003.
7. Plant TM. Neuroendocrine control of the onset of puberty. Neuroendocrinol. 2015; 38: 73-88. doi:10.1016/j.yfrne.2015.04.002.
8. Livadas S, Chrousos GP. Molecular and environmental mechanisms regulating puberty initiation: an integrated approach. Front. Endocrinol. 2019; 10: Art. 828. doi.org/10.3389/fendo.2019.00828.
9. Lomniczi A, Ojeda SR. The emerging role of epigenetics in the regulation of female puberty. En: Bourguignon JP, Parent AS, eds. Puberty from Bench to Clinic. Lessons for Clinical Management of Pubertal Disorders. Endocr Dev. Basel (Switzerland): Karger. 2016; 29; 1-16. doi: 10.1159/000438840.
10. Hermanussen M. Auxology. Studying Human Growth and development. Stuttgart (Germany): Schweizerbart Science Publishers, 2013 (ISBN 978-3-510-65278-5).
11. Zhu J, Kusa T, Chan YM. Genetics of pubertal timing. Curr Opin Pediatr. 2018; 30: 532-40. doi:10.1097/MOP.0000000000000642.
12. Willemsem RH, Dunger DB. Normal variation in pubertal timing: genetic determinants in relation to growth and adiposity. En: Bourguignon JP, Parent AS, eds. Puberty from Bench to Clinic. Lessons for Clinical Management of Pubertal Disorders. Endocr Dev. Basel (Switzerland): Karger. 2016; 29: 17-35. doi: 10.1159/000438957.
13. Day FR, Thompson DJ, Helgason H, Chasman DI, Finucane H, Sulem P, et al. Genomic analyses identify hundreds of variants associated with age at menarche and support a role for puberty timing in cancer risk. Nat Genet. 2017; 49: 834-41. doi: 10.1038/ng.3841.
14. Chen S, Refaey H, Mukherjee N, Solatikia F, Jiang Y, Arshad SH, et al. Age at onset of different pubertal signs in boys and girls and differential DNA methylation at age 10 and 18 years: an epigenome-wide follow-up study. Hum Reprod Open. 2020; 2: 1-16. doi:org/10.1093/hropen/hoaa006.
15. Frisch RE, Revelle R. Height and weight at menarche and a hypothesis of critical body weights and adolescent events. Science. 1970; 169: 397-9. doi: 10.1126/science.169.3943.397.
16. Muñoz-Calvo MT, Argente J. Nutritional and pubertal disorders. En: Bourguignon JP, Parent AS, eds. Puberty from Bench to Clinic. Lessons for Clinical Management of Pubertal Disorders. Endocr Dev. Basel (Switzerland): Karger. 2016; 29: 153-73. doi: 10.1159/000438884.
17. Verkauskiene R, Petraitiene I, Albertsson Wikland K. Puberty in children born small for gestational age. 2013; 80: 69-77. doi: 10.1159/000353759.
18. Soriano-Guillén L, Corripio R, Labarta JI, Cañete R, Castro-Feijóo L, Espino R, et al. Central precocious puberty in children living in Spain: incidence, prevalence, and influence of adoption and immigration. J Clin Endocrinol Metab. 2010; 95: 4305-13. doi: 10.1210/jc.2010-1025.
19. Marshall WA, Tanner JM. Variations in pattern of pubertal changes in girls. Arch Dis Child. 1969: 44: 291-303. doi: 10.1136/adc.44.235.291.
20. Marshall WA, Tanner JM. Variations in pattern of pubertal changes in boys. Arch Dis Child. 1970: 45: 13-23. doi: 10.1136/adc.45.239.13.
21. Prader A. Testicular size: assessment and clinical importance. Triangle; the Sandoz Journal of Medine Science. 1966; 7: 240-3. PMID: 5920758.
22. Bordini B, Rosenfield RL. Normal pubertal development: part II: clinical aspects of puberty. Pediatr Rev. 2011; 32: 281-92. doi: 10.1542/pir.32-7-2.