|
| Temas de FC |
E. Cañedo Villarroya
Departamento de Gastroenterología y Nutrición, Hospital Universitario Infantil Niño Jesús
| Resumen
Las intolerancias alimentarias son un tipo de reacción adversa a alimentos no tóxica, en la que no existe un mecanismo inmunológico implicado. En los últimos años, se ha descrito un aumento de este tipo de reacciones cuyo diagnóstico es complejo debido a: una sintomatología inespecífica y superpuesta entre diferentes entidades, la dificultad de relación de la clínica con una sustancia concreta de entre todas las que constituyen la dieta, el creciente aumento de manipulación alimentaria y de productos procesados, ultraprocesados, transgénicos, etc., cuya composición difiere sustancialmente de aquellos de los que derivan, la ausencia de biomarcadores objetivos, la reconocida relación del eje intestino-cerebro, la importancia de la microbiota y la inevitable facilidad para establecer conexiones entre alimentación y síntomas digestivos por una simple cuestión temporal no necesariamente causal. Todo esto condiciona un aumento de descripción en la literatura de “nuevos trastornos digestivos” como la sensibilidad a fructosa, intolerancia a histamina, sensibilidad a gluten no celíaca e intolerancia a FODMAPS, cuyo tratamiento pasa por dietas de restricción, para las que, a veces, existe poca evidencia, y que pueden tener además consecuencias adversas. |
| Abstract
Food intolerances are a type of adverse reaction to non-toxic foods in which there is no immune mechanism involved. In recent years, an increase in these reactions has been described; the diagnosis is complex due to: nonspecific and overlapped symptomatology between different entities, the difficulty of the clinical relationship with a specific substance among all those that constitute diet, the increase in processed, ultraprocessed, refined and transgenic products whose composition differs substantially from those from which they derive, the absence of objective biomarkers, the recognized gut- brain axis, the microbiota importance and the ease in establishing connections between food and digestive symptoms due to a temporal relationship. All this, determines an increase in the description of these “new digestive disorders” such as sensitivity to fructose, histamine intolerance, non-celiac gluten sensitivity and FODMAPS intolerance whose treatment are restriction diets for which there is little evidence in children and that could potentially have adverse consequences. |
Palabras clave: Intolerancias alimentarias; Sensibilidad a fructosa; Intolerancia a histamina; Sensibilidad a gluten no celíaca; FODMAPS; Trastornos digestivos funcionales.
Key words: Food intolerances; Sensitivity to fructose; Histamine intolerance; Non-celiac gluten sensitivity; FODMAPS; Functional gastrointestinal disorders.
Pediatr Integral 2019; XXIII (7): 356 –365
Nuevos trastornos digestivos y su relación con intolerancias alimentarias y dietas de restricción en Pediatría
Introducción
Las intolerancias alimentarias son el tipo de reacción adversa a alimentos más frecuente. No existe ni un mecanismo tóxico ni inmunológico implicado.
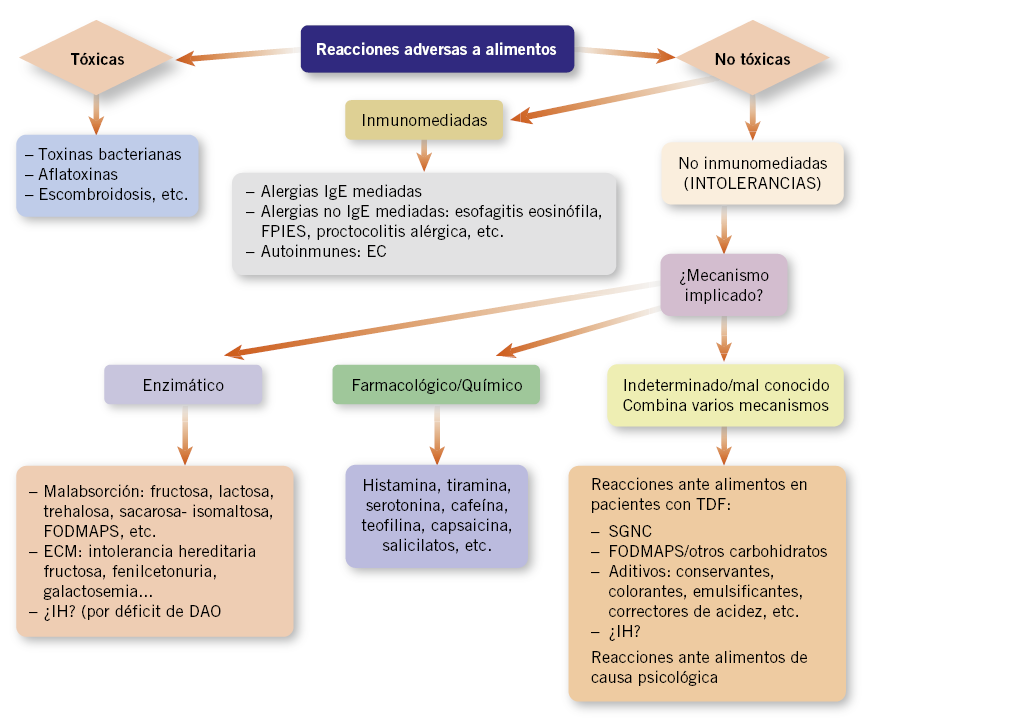
Todas las reacciones anómalas producidas por ingesta, contacto o inhalación de un alimento o componente del mismo se definen como “reacciones adversas a alimentos” y se clasifican(1,2), teniendo en cuenta el mecanismo patogénico (Fig. 1):
Figura 1. Reacciones adversas a los alimentos. Adaptado de Clasificación de la Academia Europea de Alergia e Inmunología clínica (1995)(1). FPIES (enterocolitis inducida por proteínas), EC (enfermedad celíaca), FODMAPS (fermentable oligosaccharides, disaccharides, monosaccharides and polyols), ECM (errores congénitos del metabolismo), TDF (trastornos digestivos funcionales), SGNC (sensibilidad a gluten no celíaca), HI (intolerancia a histamina).
1. Reacciones tóxicas: la reacción depende de la dosis y no de la susceptibilidad individual. Son, por tanto, predecibles. Pueden tratarse de: toxinas bacterianas (Clostridium botulinum), metales pesados, sustancias químicas (pesticidas), aflatoxinas o cantidades muy elevadas de aminas biógenas (escombroidosis).
2. Reacciones no tóxicas: causadas por sustancias no tóxicas; no son dependientes de dosis y solo afectan a personas susceptibles. En este grupo se encuentran:
• Reacciones alérgicas: existe un mecanismo inmunitario implicado. Pueden ser mediadas por inmunoglobulina E (IgE) o no.
• Reacciones de intolerancia(2): no existe un mecanismo inmunitario. Son más frecuentes que las de tipo alérgico y pueden deberse a:
- Déficits enzimáticos o de transportadores: existe una imposibilidad de metabolizar alguna sustancia por malabsorción (carbohidratos [CH]: lactosa, fructosa, sorbitol, trehalosa, etc.) o por déficits enzimáticos implicados en el metabolismo posterior a dicha absorción (intolerancia hereditaria a la fructosa, fenilcetonuria, galactosemia, etc.).
Las más frecuentes se deben a malabsorción de CH (especialmente lactosa). En los últimos años, existe un interés creciente por la fructosa y los FODMAPS (acrónimo inglés de “fermentable oligosaccharides, disaccharides, monosaccharides and polyols”) que trataremos (en ambos casos, el mecanismo de intolerancia puede ser también indeterminado). En cuanto a la fructosa, se debe evitar la confusión entre los errores congénitos del metabolismo de los que no se hablará (como la “intolerancia hereditaria a la fructosa por déficit de aldolasa B”), de la intolerancia digestiva (por malabsorción o no, como veremos después) o “sensibilidad a fructosa”(3).
- Reacciones farmacológicas o químicas: sustancias presentes en algunos alimentos pueden desencadenar reacciones gastrointestinales y neurálgicas. Son reacciones dosis y, a veces, cofactor, dependientes, por lo que no aparecen en todas las exposiciones. Sustancias frecuentemente implicadas son: aminas vasoactivas (tiramina, histamina), metilxantinas (cafeína…), capsaicina, alcohol, salicilatos, etc. Hablaremos de la intolerancia a histamina (IH).
- Reacciones indeterminadas: el mecanismo no es bien conocido o combina alguno de los anteriores. En este grupo se incluyen:
a. Aditivos: existe un listado interminable, entre los más frecuentes el glutamato monosódico abundante en la “comida china”.
b. Sensibilidad al gluten no celíaca (SGNC).
c. Intolerancia a FODMAPS y sensibilidad a fructosa.
d. Reacciones aversivas de causa psicológica o por condicionamiento pavlovliano (trastornos de conducta alimentaria).
Todas las entidades a tratar comparten:
1. La inespecificidad de su sintomatología, no solo digestiva, y superponible a algunos trastornos digestivos funcionales (TDF)(4) (dolor, flatulencia, estreñimiento o diarrea, borborigmo, meteorismo, etc.) sino, en ocasiones, también extradigestiva (cefalea, fatiga, bradipsiquia, dermatitis, etc.), que pueden formar parte de otros cuadros clínicos con los que siempre habrá que hacer diagnóstico diferencial: enfermedad celíaca (EC), enfermedad inflamatoria intestinal (EII), alergias, síndrome de sobrecrecimiento bacteriano (SIBO), etc.
2. Todas han sido implicadas en la etiopatogenia de los TDF, especialmente en los trastornos de dolor abdominal funcional (TDAF), planteándose las dietas de exclusión como una posible opción terapéutica, aunque sin clara evidencia en niños(5).
3. No existen biomarcadores adecuados (Tabla I) y el diagnóstico es clínico(6,7).
Sensibilidad a la fructosa o intolerancia digestiva a fructosa
El consumo de fructosa se ha implicado en el desarrollo de TDAF en niños, aunque los síntomas no se correlacionan con el grado de malabsorción, sino con el de sensibilidad.
Introducción
La fructosa es un monosacárido presente en la fruta y miel. Forma parte del disacárido sacarosa o “azúcar de mesa”, unido a la glucosa. Posee mayor poder endulzante que la glucosa y en las últimas décadas se utiliza cada vez más por la industria alimentaria (sobre todo, en forma de jarabe de maíz alto en fructosa), en productos procesados y ultraprocesados por ser dulce, barata y estable, y en productos anunciados como “aptos para diabéticos” por su bajo índice glucémico. Independientemente de la sintomatología digestiva relacionada con su ingesta y conocida como sensibilidad a la fructosa(3), en la actualidad, también existe una preocupación creciente, porque un consumo alarmantemente elevado en forma de dichos procesados como actualmente se describe (frente a los 15-25 g de fructosa al día en forma de fruta y verdura de una dieta de 2.000 calorías de un adolescente normal hace 30 años, se describe hoy una ingesta media de 70 g de fructosa al día, en forma de refrescos, bollería industrial, comida precocinada, etc.), se ha relacionado con desarrollo de síndrome metabólico(8).
Fisiopatología y cuadro clínico
La fructosa se absorbe en duodeno y yeyuno mediante dos transportadores (GLUT 2 y GLUT 5), aunque se han implicado otros transportadores más distalmente (GLUT 7)(6).
GLUT 2 cotransporta, mediante difusión pasiva, glucosa y fructosa en una ratio 1:1 y GLUT 5 permite la absorción independiente de fructosa mediante difusión facilitada. El mecanismo de GLUT 2 explica porqué el consumo de fructosa como sacarosa o junto con otros alimentos que aporten glucosa es mejor tolerado que la fructosa sola. Sin embargo, el consumo junto con sorbitol produce el efecto contrario, porque compite con fructosa por GLUT 5. La capacidad absortiva de fructosa es limitada, variable en distintos individuos y dependiente de numerosos factores como el que acabamos de explicar de la glucosa o sorbitol. No está bien establecido, aunque en general, los estudios indican que existe ya malabsorción en un porcentaje importante de adultos sanos con más de 50 g y de más de 1 g por kilo en niños sanos(3,6). Cuando la fructosa no es bien absorbida, tiene un efecto osmótico que puede producir diarrea. A su llegada al colon, además, será fermentada por la microbiota, generando gas (hidrógeno, dióxido de carbono o metano según el tipo de flora), que explica el borborigmo, flatulencia, dolor, diarrea o estreñimiento (cepas metanogénicas)(6). Algunos niños pueden presentar eritema perianal por heces ácidas y existen casos descritos de náuseas, vómitos y estancamiento o pérdida ponderal. La clínica no parece relacionada con el grado de malabsorción, sino con una “hiperalgesia o hipersensibilidad visceral” que presentan algunos niños, especialmente aquellos con TDAF, que podrían mejorar disminuyendo el consumo de fructosa a pesar de no tener malabsorción de la misma, o que esta no sea mayor que en niños sanos(3,9).
Diagnóstico
No existe patrón oro para el diagnóstico y el test de hidrógeno espirado tras sobrecarga de fructosa presenta muchas limitaciones:
• Solo puede realizarse en niños colaboradores.
• No está bien establecida qué dosis de fructosa debería usarse.
• No se ha demostrado que exista mayor grado de malabsorción entre niños sanos que entre aquellos con síntomas.
El diagnóstico, por tanto, es clínico: anamnesis, encuesta dietética y diagnóstico diferencial, tras lo que debería instaurarse una dieta con bajo contenido en fructosa para valorar respuesta y comprobación del empeoramiento tras reintroducción. Idealmente el procedimiento debería ser ciego y controlado con placebo. La mejoría con estas medidas puede deberse, no obstante, a otros compuestos que acompañan a la fructosa en muchos alimentos, como los fructanos u otros FODMAPS(3,6,9).
Tratamiento
La mayoría de los niños podrían mejorar su sintomatología evitando solo productos procesados con fructosa y/o sorbitol (refrescos, zumos y néctares de frutas, chocolates, bollería industrial, golosinas, mermeladas y productos en cuyo etiquetado aparezca sorbitol o E-420, miel, fructosa o sirope o jarabe de maíz), y consumiendo los productos naturales ricos en fructosa como la fruta, siempre entera, distribuida a lo largo del día y acompañada de otros alimentos, para favorecer un tránsito más lento y un aporte concomitante de glucosa. Solo en caso de no mejoría con estas medidas y si la sospecha es alta, podrían indicarse dietas más restrictivas (Tabla II).
Intolerancia a FODMAPS
La restricción en la dieta de FODMAPS a diferencia de la restricción aislada de ciertos CH por separado (lactosa, fructosa, etc.), parece más eficaz en la mejora de la sintomatología de los TDAF.
Introducción
Los TDF recientemente redefinidos según los criterios Roma IV(4) afectan hasta un 20% de escolares y adolescentes, produciendo una disminución importante de su calidad de vida. Su etiología aún desconocida, depende de múltiples factores (genética, ambiente, situación socio-emocional, experiencias tempranas, etc.), que condicionan una disregulación del eje intestino-cerebro en el que, entre otros, dieta y microbiota y las interrelaciones entre ambas, son reconocidos como posibles agentes etiopatogénicos.
Adultos y niños asocian su sintomatología con la ingesta de distintos alimentos, entre otros con CH, que además aportan la mayoría de las calorías de la dieta occidental. A diferencia de las dietas de restricción de CH por separado, los estudios demuestran con mejor evidencia(7,9), que una dieta evitando un conjunto de ellos o FODMAPS (fructosa y fructanos, lactosa, galactanos y polioles [Tabla III]) es más eficaz(9) (Cochrane concluye sin embargo, que son necesarios más estudios en niños)(5).
Fisiopatología
Se proponen 3 mecanismos, aunque para el tercero existe aún escasa evidencia(7,9).
1. Efecto osmótico de CH no absorbidos en el intestino delgado, que atrae agua produciendo distensión, dolor, diarrea, etc. La lactosa y fructosa tienen una capacidad de absorción dependiente del individuo, tipo de alimento, etc.(8) y la mayoría de fructanos, galactanos y polioles no pueden ser hidrolizados por las enzimas humanas, así que tampoco serán absorbidos.
2. Fermentación de los CH no absorbidos por la microbiota colónica, produciendo gas y con ello distensión, meteorismo, dolor, estreñimiento o diarrea…
3. Activación inmune e inflamación mucosa.
Estos mecanismos son necesarios, pero no suficientes para producir clínica, que aparecerá en caso de una “hiperalgesia o hipersensibilidad visceral” del individuo.(9,10). Los FODMAPS han sido relacionados también con dismotilidad gastrointestinal alta (náuseas y vómitos) y con clínica sistémica (fatiga, astenia), aunque los mecanismos implicados son aún desconocidos(10).
Clínica
Es superponible a la de los TDF, especialmente TDAF, pero también con los trastornos de náuseas y vómitos. Se ha descrito así mismo astenia.
Diagnóstico
Las pruebas de malabsorción no ayudan a tomar decisiones, así que será clínico(9,10).
Tratamiento
Una dieta baja en FODMAPS supone limitar muchos alimentos y, aunque existe bibliografía y guías para evitar déficits tanto en niños como en adultos [https://www.monashfodmap.com], esta es compleja y se han descrito deficiencias (calcio, fibra), y cambios en la microbiota de consecuencias no conocidas. Tras una fase de restricción inicial, deberían ir introduciéndose alimentos de manera individualizada.
Ante la falta de evidencia sólida, nos parece adecuado limitar inicialmente solo alimentos procesados ricos en polioles y fructosa, realizar comidas completas (grasa, proteína y CH para ralentizar el tránsito) y limitar lactosa si la anamnesis es compatible (sustituir leche por yogurt, distribuir ingesta de lácteos en pequeñas tomas, etc.)(9.
Intolerancia a la histamina (HI)
Es una patología controvertida y poco descrita en niños. Presenta clínica digestiva y extradigestiva y el diagnóstico es clínico tras respuesta a dieta baja en histamina, aunque la disminución de diaminooxidasa plasmática lo apoya.
Introducción
La histamina es una amina biógena con múltiples efectos a nivel gastrointestinal, genitourinario, respiratorio, cardiovascular, cutáneo, sistema nervioso central (SNC) e inmunohematológico, dependientes de 4 receptores descritos (H1-H4). La presencia de una cantidad excesiva en plasma y la sintomatología pueden ser debidas a(10,11):
• Liberación por mastocitos o basófilos tras un estímulo alérgico o no (neuropéptidos, cambios de temperatura etc.), o en una mastocitosis.
• Intoxicación alimentaria. Especialmente pescados en mal estado (escombroidosis), en los que por acción de bacterias contaminantes, su alto contenido en el aminoácido L-histidina se convierte en histamina, cuya cantidad supera los mecanismos fisiológicos de metabolización, dando lugar a un cuadro agudo clínicamente similar a una respuesta alérgica al pescado y potencialmente amenazante para la vida.
• Inadecuada metabolización de cantidades normales de histamina en alimentos o IH. Este último cuadro que será el único tratado, es controvertido, recientemente descrito y no universalmente aceptado. Es más frecuente en la mediana edad, siendo la mayoría de la bibliografía de Centroeuropa, estimándose una prevalencia del 1% de la población.
Fisiopatología y cuadro clínico
La catabolización de la histamina ingerida con alimentos se produce mediante la enzima diaminooxidasa (DAO) intestinal que actúa extracelularmente, aunque existen otros mecanismos intracelulares menos importantes. Cuando existe una disminución o funcionamiento inadecuado de la DAO: de origen genético, inflamatorio (gastroenteritis, EII, etc.), por inhibición enzimática (alcohol, fármacos u otras aminas que compiten por la DAO, como la tiramina), o por déficit de cofactores (zinc, cobre, vitamina B6 y C), la histamina aumenta en plasma y puede actuar sobre sus múltiples receptores, produciendo un cuadro clínico conocido como IH (Fig. 2).
Figura 2. Manifestaciones clínicas posibles en la intolerancia a la histamina (HI). La sintomatología es dependiente del receptor histaminérgico (H1, H2, H3 o H4) y de su localización. Figura tomada de la tesis doctoral del Dr. Antonio Rosell Camps (2015): “Aspectos clínicos y nutricionales de la intolerancia a la histamina en pacientes pediátricos con sintomatología digestiva crónica”, adaptada, a su vez, de Maintz(12).
Clínica
Puede ser aguda tras ingesta de un alimento rico en histamina, aunque es más frecuente que los síntomas sean crónicos, larvados e inespecíficos, con afectación de multitud de órganos y difíciles de relacionar con un producto concreto. En las descripciones pediátricas, lo más frecuente es la afectación digestiva en forma de dolor abdominal crónico, seguido de diarrea y vómitos, muchas veces acompañado de migraña o cefalea(12) (manifestación extradigestiva más habitual).
Diagnóstico
Es clínico de exclusión. Se basa en todo lo siguiente:
• Presencia de dos o más síntomas típicos (frecuentemente, varios órganos).
• Mejoría clínica tras dieta baja en histamina y/o antihistamínicos.
• Diagnóstico diferencial con alergias alimentarias y otras entidades.
• Provocación oral con dieta rica en histamina, idealmente de manera ciega y controlada con placebo.
Existe controversia en cuanto a la determinación de DAO plasmática. Si está disminuida (<3 kU/L) o límite (3-10 kU/L) podría ayudar al diagnóstico, aunque su normalidad no lo descarta y puede estar disminuida en personas sanas. Se propone la determinación de polimorfismos genéticos de DAO y/o medición de histamina en sangre y/o orina, pero existe aún menos bibliografía sobre su interpretación.
Tratamiento
Dependerá de la causa de la HI. A veces, es transitoria en enfermedades que provoquen inflamación intestinal o mejora al retirar medicación que inhiba la DAO.
Consiste en dieta de bajo contenido en histamina y alimentos liberadores de la misma y/o sustancias que inhiban la DAO (alcohol en adolescentes). Es compleja, y hay que limitar muchos alimentos cuyo contenido en histamina además varía en función de las bases de composición consultadas: nivel de maduración, fermentación y procesamiento (a mayor grado de procesamiento, fermentación etc. mayor cantidad de histamina y otras aminas); y respuesta individual. Por lo que los autores recomiendan realizar una dieta estricta inicialmente, con la que la sintomatología mejoraría ya en los primeros días, mantenerla un mes e ir introduciendo progresivamente distintos alimentos de manera personalizada. Podrían utilizarse antihistamínicos H1 (dexclorfeniramina) y H2 (ranitidina), y cofactores (zinc, cobre, vitamina B6 y C). En adultos, fundamentalmente para la migraña, está bien descrito el uso de DAO de origen porcino, comercializado como suplemento alimentario, aunque en niños no existen datos publicados(7,11,12).
Ante la dificultad y riesgo de dietas muy restrictivas, una buena y segura actitud, sería la retirada inicial solo de los alimentos potencialmente más implicados:
1. Conservas (especialmente de pescado y/o marisco).
2. Quesos curados.
3. Embutidos y ahumados.
4. Vegetales fermentados (chucrut, tofu, tempeh…).
5. Comida precocinada procesada y salsas comerciales.
6. Bollería industrial.
7. Alcohol.
Los siguientes alimentos a considerar serían: cítricos, tomate y espinaca (Tabla IV).
Sensibilidad al gluten no celíaca (SGNC)
La SGNC se caracteriza por síntomas gastrointestinales y extraintestinales ante la ingesta de gluten en sujetos sin enfermedad celíaca (EC) o alergia al trigo. El diagnóstico es clínico, tras respuesta a dieta y empeoramiento tras provocación.
Introducción
La SGNC es una entidad emergente. Según el consenso de Salerno(13), se caracteriza por síntomas digestivos y sistémicos relacionados con la ingesta de gluten en pacientes en los que se ha descartado EC y alergia al trigo (en dicho consenso, el diagnóstico diferencial se realiza exclusivamente con cuadros de alergia IgE dependiente). Hoy en día, sin embargo, se discute la verdadera implicación del gluten en su patogenia o la participación de otros componentes del trigo, por lo que algunos autores prefieren denominarla “sensibilidad al trigo no celíaca”(14).
Se desconoce la verdadera prevalencia, aunque parece más alta que la de EC, afectando del 0,5-13%(14) de la población, especialmente en la mediana edad, aunque también se describe en niños(15). La falta de biomarcadores adecuados y la clínica superponible a la descrita en otras intolerancias alimentarias y en los TDF (especialmente intestino irritable), hace que el diagnóstico sea complejo y controvertido. Además, teniendo en cuenta la multitud de sintomatología con la que se ha relacionado, en cuadros con escasas opciones terapéuticas exitosas como: autismo, patología neuropsiquiátrica, etc., y la posible influencia socio-comercial que publicita una dieta sin gluten como opción más saludable, es posible que existan muchos casos de autodiagnóstico que sobreestiman su prevalencia, y que se beneficiarían de una evaluación más rigurosa, son los denominados “pacientes no celíacos que evitan gluten”(16).
Fisiopatología (Tabla V)
Se desconoce la patogénesis exacta y se discute si son las proteínas del gluten u otras proteínas del trigo, como los inhibidores de la amilasa-tripsina (ATI) o las aglutininas del germen de trigo (AGT), o algún componente de los CH del trigo (FODMAPS), los causantes del cuadro clínico(14,17,18). Se sabe que no es una reacción autoinmune, como la EC, ni una reacción alérgica IgE dependiente, pero las investigaciones encuentran mecanismos inmunológicos implicados y algunos autores consideran la hipótesis de que se trate de una alergia no IgE dependiente(17). No existe tampoco consenso en cuanto a la permeabilidad intestinal en esta entidad(17). Trabajos iniciales sugieren una permeabilidad disminuida, aunque estudios más recientes encuentran un estado de activación inmune sistémica en respuesta a la translocación bacteriana secundaria a una barrera intestinal comprometida, que mejora tras una dieta exenta de trigo, y la microscopia confocal realizada durante las endoscopias, ha sido capaz de observar dichas “fugas o agujeros” en la mucosa intestinal de pacientes tras la instilación en duodeno de una suspensión de trigo, apoyando dicha hipótesis de “intestino permeable o agujereado”. Por tanto, la hipótesis que parece más plausible actualmente, es que ese aumento de la permeabilidad permitiría el paso de péptidos de gluten (gliadinas) o de otras proteínas del trigo (ATIs o AGTs), que inducirían una respuesta inmune innata e inflamación de la mucosa, con liberación de citocinas y péptidos gastrointestinales que afectarían el sistema nervioso entérico colinérgico, produciendo la sintomatología gastrointestinal característica(17,18). La clínica extradigestiva es peor explicada, aunque se relaciona así mismo con el paso de dichos péptidos al torrente sanguíneo, diferentes órganos y SNC (cruzan barrera hematoencefálica y afectan el sistema opiáceo y de neurotransmisores)(18). Los FODMAPS del trigo han sido así mismo vinculados en la fisiopatología del cuadro clínico, enfatizándose su papel regulador de la microbiota. Su fermentación bacteriana produce ácidos grasos de cadena corta, lactato y gas, que se han asociado con la clínica digestiva. Muchos autores niegan su papel en la clínica sistémica(17), aunque se hipotetiza que al ser prebióticos favorecerían cepas reductoras de sulfato, capaces de fermentar proteínas del trigo y liberar amonio y sulfuro que produjesen clínica extradigestiva (astenia)(16).
Hay autores que plantean que la SGNC sea realmente una IH(16), aunque en esta última no se ha descrito la anemia (no existen receptores de histamina que la expliquen). Los pacientes relacionarían la clínica con la ingesta de gluten/trigo, porque habitualmente estos productos se ingieren combinados con otros ricos en histamina (p. ej.: salsa de las pastas, tomate y queso de la pizza, etc.).
Clínica
Los síntomas suelen aparecer poco después del consumo de trigo, desaparecen con su retirada y reaparecen en horas o días tras la provocación. La presentación clásica en adultos, combina síntomas superponibles a los de intestino irritable (dolor abdominal, meteorismo, distensión, diarrea y/o estreñimiento…) y sistémicos: bradipsiquia (“foggy mind”), ánimo depresivo, fatiga, cefalea, dermatitis, dolor músculo-articular, anemia, etc. En niños, lo más frecuente es la sintomatología digestiva característica de TDF (sobre todo, el dolor abdominal y diarrea crónica), siendo la clínica sistémica mucho menos habitual que en adultos (lo más reportado es la astenia y cefalea, sin bradipsiquia, alteración del ánimo o dolores músculoesqueléticos)(15,19).
Se han descrito casos de: autismo, esquizofrenia, ataxia, alucinaciones, etc., relacionados con esta entidad, aunque con mucha controversia en la literatura(19).
Diagnóstico
Es clínico(13), de exclusión, y requiere comprobar la reaparición de síntomas tras provocación oral, que debería ser idealmente con una dosis estandarizada y conocida de gluten, libre de otros componentes (otras proteínas del trigo y FODMAPS), doble ciego y controlada con placebo (muy complejo en la práctica clínica habitual). Si dicha provocación fuese negativa, pero existiese clínica relacionada con la ingesta de trigo se deberían valorar: los FODMAPS, otras proteínas, el SIBO, etc., como causantes.
El HLA de susceptibilidad celíaca y los anticuerpos IgG antigliadina aparecen hasta en el 40-50% de casos (también presentes en población sana), pero no el resto de marcadores de celiaquía (antitransglutaminasa, antiendomisio…). La biopsia intestinal (aunque no siempre es necesaria), es normal o con linfocitosis moderada intraepitelial (sin aumento de linfocitos TCR gamma-delta)(18).
Tratamiento
Se desconoce si la dieta libre de gluten o trigo debería ser de por vida y si debe ser tan estricta como en la EC, así que esta será individualizada según sintomatología(19,20).
Papel del pediatra de Atención Primaria
El pediatra juega un papel clave para establecer buenos hábitos nutricionales, por los que las familias muestran mucho interés los primeros años de vida de los niños, y después les restan importancia o bien adoptan determinadas dietas (a veces, los adolescentes por su cuenta), entendiendo que son más saludables o tras la “autorrealización” de pruebas (Tabla I), publicitadas para el diagnóstico de intolerancias, o tras la consulta en internet por sus síntomas (sobre todo, digestivos), por los que tantas veces han consultado y para los que probablemente no han sentido que se les daba suficiente valor (el diagnóstico de la patología funcional, a veces, no es bien explicado por el profesional y no se abordan bien los desencadenantes emocionales, dietéticos etc., que podrían mejorar la calidad de vida).
Por todo ello, es importante conocer todos estos “nuevos trastornos”, y pensar en ellos, a pesar de la controversia, sobre todo, para evitar inadecuados “autodiagnósticos” y dietas arriesgadas(20). El mejor abordaje dietético inicial en primaria, sería la limitación de alimentos procesados y ultraprocesados por su abundancia en las sustancias implicadas en todas las entidades tratadas y otras similares (intolerancias a aditivos etc.), y la recomendación de seguimiento especializado en caso de que se plantee una dieta más restrictiva.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Bruijnzeel-Koomen C, Ortolani C, Aas K. Adverse reactions to food. European Academy of Allergology and Clinical Immunology Subcommittee. Allergy. 1995; 50: 623-35.
2.*** Montalto M, Santoro L, D’Onofrio F, Curigliano V, Gallo A, Visca D, el al. Adverse reactions to food: allergies and intolerances. Dig Dis. 2008; 26: 96-103.
3.* Hammer V, Hammer K, Memaran N, Huber WD, Hammer K, Hammer J. Relationship Between Abdominal Symptoms and Fructose Ingestion in Children with Chronic Abdominal Pain. Digestive Diseases and Sciences. 2018; 63: 1270-9.
4.* Hyams JS, Di Lorenzo C, Saps M, Shulman RJ, Staiano A, van Tilburg M. Functional Disorders: Children and Adolescents. Gastroenterology 2016; 150: 1456-68.
5. Newlove-Delgado TV, Martin AE, Abbott RA, Bethel A, Thompson-Coon J, Whear R, et al. Dietary interventions for recurrent abdominal pain in childhood. Cochrane Database Syst Rev. 2017; 3: CD010972.
6.** Lomer MC. Review article: the aetiology, diagnosis, mechanisms and clinical evidence for food intolerance. Aliment Pharmacol Ther. 2015; 41: 262-75.
7.** Tuck CJ, Biesiekierski JR, Schmid-Grendelmeier P, Pohl D. Food Intolerances. Nutrients. 2019; 11: 1684.
8.* Riveros MJ, Parada A, Pettinelli P. Consumo de fructosa y sus implicaciones para la salud; malabsorción de fructosa e hígado graso no alcohólico. Nutr Hosp. 2014; 29: 491-9.
9.** Chumpitazi BP, Shulman RJ. Dietary carbohydrates and childhood functional abdominal pain. Ann Nutr Metab. 2016; 68: 8-17.
10.*** Maintz L, Novac N. Histamine and histamine intolerance. Am J Clin Nutr. 2007; 85: 1185-96.
11.*** Kovacova-Hanuskova E, Buday T, Gavliakova S, Plevkova J. Histamine, histamine intoxication and intolerance. Allergol Immunopathol (Madr). 2015; 43: 498-506.
12.** Rosell-Camps A, Zibetti S, Pérez-Esteban G, Vila-Vidal M, Ferrés-Ramis L, García-Teresa-García E. Histamine intolerance as a cause of chronic digestive complaints in pediatric patients. Rev Esp Enferm Dig. 2013; 105: 201-6.
13. Catassi C, Elli L, Bonaz B, Bouma G, Carroccio A, Castillejo G, et al.: Diagnosis of Non-Celiac Gluten Sensitivity (NCGS): The Salerno Experts’ Criteria. Nutrients. 2015; 7: 4966-77.
14.* Barbaro MR, Cremon C, Stanghellini V and Barbara G. Recent advances in understanding non-celiac gluten sensitivity [version 1; referees: 2 approved]. 2018; (F1000 Faculty Rev): 1631.
15.* Francavilla R, Cristofori F, Castellaneta S, Polloni C, Albano V, Dellatte S, et al. Clinical, serologic, and histologic features of gluten sensitivity in children. J Pediatr. 2014; 164: 463-7.
16. Schnedl WJ, Lackner S, Enko D, Schenk M, Mangge H, Holasek SJ. Non-celiac gluten sensitivity: people without celiac disease avoiding gluten-is it due to histamine intolerance? Inflamm Res. 2018; 67: 279-84.
17.*** Catassi C, Alaedini A, Bojarski C, Bonaz B, Bouma G, Carroccio A, et al. The Overlapping Area of Non-Celiac Gluten Sensitivity (NCGS) and Wheat-Sensitive Irritable Bowel Syndrome (IBS): An Update. Nutrients. 2017; 9: pii: E1268. doi: 10.3390/nu9111268.
18.*** Molina-Infante J, Santolaria S, Montoro M, Esteve M, Fernández-Bañares F. Non-celiac gluten sensitivity: a critical review of current evidence. Gastroenterol Hepatol. 2014; 37: 362-71.
19.*** Catassi C. Gluten Sensitivity. Ann Nutr Metab. 2015; 67: 16-26.
20. Dieterich W, Zopf Y. Gluten and FODMAPS-Sense of a Restriction/When Is Restriction Necessary? Nutrients. 2019; 11: pii: E1957. doi: 10.3390/nu11081957.
Bibliografía recomendada
- Montalto M, Santoro L, D’Onofrio F, Curigliano V, Gallo A, Visca D, el al. Adverse reactions to food: allergies and intolerances. Dig Dis. 2008; 26: 96-103.
Artículo de revisión conciso, didáctico y clarificador de conceptos, acerca de la clasificación de las reacciones adversas a alimentos.
- Chumpitazi BP, Shulman RJ. Dietary carbohydrates and childhood functional abdominal pain. Ann Nutr Metab. 2016; 68: 8-17.
Revisión actualizada los mecanismos fisiopatológicos implicados en la clínica de intolerancia digestiva a los carbohidratos (no solo fructosa y FODMAPS), así como su diagnóstico y tratamiento.
- Maintz L, Novac N. Histamine and histamine intolerance. Am J Clin Nutr. 2007; 85: 1185-96.
Primera revisión en inglés (la mayoría de las publicaciones anteriores no lo son), acerca de la fisiopatología, clínica y diagnóstico de la intolerancia a la histamina, en la que se basan además muchas de las publicaciones posteriores. Merece la pena leerla para entender la patogénesis del cuadro clínico y su sintomatología.
- Kovacova-Hanuskova E, Buday T, Gavliakova S, Plevkova J. Histamine, histamine intoxication and intolerance. Allergol Immunopathol (Madr). 2015; 43: 498-506.
Revisa los diferentes cuadros clínicos en los que interviene la histamina y su diagnóstico diferencial. Añade, además, con respecto a la publicación de Maintz, algunas novedades en cuanto el diagnóstico de la intolerancia a histamina.
- Catassi C, Alaedini A, Bojarski C, Bonaz B, Bouma G, Carroccio A, et al. The Overlapping Area of Non-Celiac Gluten Sensitivity (NCGS) and Wheat-Sensitive Irritable Bowel Syndrome (IBS): An Update. Nutrients. 2017; 9: pii: E1268. doi: 10.3390/nu9111268.
Revisión muy actualizada de los últimos descubrimientos en cuanto a los mecanismos patogénicos implicados en la sensibilidad al gluten no celíaca y su relación con los distintos componentes del trigo. El artículo se centra en la sintomatología digestiva, por lo que para tener una visión más amplia del cuadro recomendamos una revisión anterior de este mismo autor y también incluida en las citas (Catassi C)(19).
- Molina-Infante J, Santolaria S, Montoro M, Esteve M, Fernández-Bañares F. Non-celiac gluten sensitivity: a critical review of current evidence. Gastroenterol Hepatol. 2014; 37: 362-71.
Aunque menos reciente que la revisión anteriormente comentada, recomendamos encarecidamente la lectura de este documento por la rigurosidad y claridad de su redacción, así como la detalladísima descripción del despistaje adecuado de la enfermedad celíaca de la que adolecen las revisiones anteriormente comentadas.
| Caso clínico |
|
Motivo de consulta Niño de 11 años con dolor abdominal periumbilical de dos años de evolución y algún vomito justo después de las comidas. No ha perdido peso y no ha faltado nunca al colegio por este motivo. Tiene deposiciones Bristol tipo 4 que alternan con tipo 6 (1-2 al día). Dice que el dolor es, al menos, dos días a la semana, pero cede sin medicación, y lo describe con una intensidad de 2-3 sobre 10. Le duele más por las tardes, dice que no lo relaciona con nada, pero este verano le ha dolido más y las deposiciones han sido más diarreicas de lo habitual. Desde que volvió al colegio ha mejorado otra vez. Exploración física Sin alteraciones. Antropometría normal con peso y talla mantenidos en su percentil habitual (p25-50). Antecedentes personales Fue valorado por dificultades de alimentación a los 5 años de vida. Tiene una alimentación restrictiva y rechaza la fruta y la verdura en general, aunque la toma en zumos y “potitos”. Ha ido mejorando en relación a acudir al comedor del centro escolar, donde sí come de todo. En casa, los padres dicen que abusa mucho de lo que más le gusta que son: galletas, embutidos, queso, pizzas y otros alimentos precocinados. Antecedentes familiares: Madre migrañosa, resto sin interés. Pruebas complementarias Análisis de sangre: marcadores de celiaquía e Ig A total, hemograma, bioquímica, vitaminas, metabolismo del hierro, proteína C reactiva y TSH. Sin alteraciones. Análisis de heces: cultivos negativos. No parásitos. Evolución Se diagnostica de TDAF (en concreto según Roma IV “intestino irritable”) y se decide actitud expectante y seguimiento. Dos años después sigue presentando la misma clínica y ha comenzado además con cefaleas ocasionales que han sido diagnosticadas de migraña. La frecuencia del dolor abdominal ha aumentado, aunque sigue siendo igual. Ha comenzado el instituto y refiere que el nivel de exigencia es mayor. La familia relaciona el empeoramiento y las migrañas con el estrés (a la madre le ocurre lo mismo cuando está nerviosa). Al preguntar sobre la alimentación, la madre nos cuenta que desde que ha pasado al instituto y ya no va al comedor escolar, come mucho peor. Está solo en casa mucho tiempo, y casi todo lo que come es comida precocinada, “comida rápida para llevar” y bollería industrial. Bebe un litro de refresco de cola al día. Se solicita actividad de DAO plasmática (9 kU/L: límite bajo de la normalidad) y se dan recomendaciones dietéticas para cambio de alimentación y consumo de alimentos naturales cocinados en casa, evitando: ultraprocesados, enlatados, fermentados, ahumados, etc. Se insiste así mismo en limitar refrescos. Un mes después, persiste la misma clínica con discreta mejoría. No ha seguido las recomendaciones dietéticas, porque dice que son complicadas y que en realidad ya se ha acostumbrado al dolor, y las cefaleas ceden bien con ibuprofeno. Se decide, por tanto, seguimiento tras insistir de nuevo en los beneficios de una alimentación adecuada, técnicas de relajación, deporte, etc., con los siguientes diagnósticos: • Trastorno de dolor abdominal funcional (intestino irritable). • Cefaleas/migrañas ocasionales. • Alimentación inadecuada con posible repercusión en los dos diagnósticos anteriores que no ha podido ser comprobada.
|