 |
| Temas de FC |
A. Montesdeoca Melián
Pediatra de Equipo de Atención Primaria; C.S. de Guanarteme. Las Palmas de Gran Canaria
| Resumen
A pesar de los grandes avances alcanzados en el control de la tosferina, gracias al uso sistemático de vacunas, esta enfermedad continúa siendo hoy en día un importante problema de salud pública en países con excelentes coberturas vacunales. Desde el año 2011, España vive una situación de epidemia de tosferina, contabilizándose los casos anuales por miles. La presentación clínica más típica de esta enfermedad se divide en tres fases (catarral, paroxística y convalecencia), las cuales no son tan reconocibles a veces, especialmente en pacientes previamente inmunizados. Los lactantes menores de 3-6 meses continúan siendo los pacientes de mayor riesgo de sufrir las complicaciones de la tosferina, por lo que las estrategias preventivas deben ir dirigidas a optimizar su protección. Los macrólidos constituyen la base del tratamiento en todas las edades. A la espera de que se descubran preparados vacunales de mayor efectividad, cabe utilizar los disponibles poniendo en marcha estrategias nuevas que aumenten su potencial preventivo (p. ej.: vacunación de la embarazada). |
| Abstract
Despite the advances achieved in the control of whooping cough by the systematic use of vaccines, the disease continues to be an important public health problem in countries with excellent vaccine coverage. Since 2011, Spain is experiencing a pertussis epidemic situation, accounting for annual cases by thousands. The most typical clinical presentation of this disease is divided into three phases (catarrhal, paroxysmal and convalescense), which sometimes are not so recognizable, especially in previously immunized patients. Infants younger than 3-6 months continue to be the patients at highest risk of suffering the complications of whooping cough, so preventive strategies should be aimed at optimizing their protection. Macrolides are the basis of treatment for all ages. While awaiting the discovery of better vaccine preparations, the available ones can be used by implementing new strategies that increase their preventive potential (eg vaccination of the pregnant women). |
Palabras clave: Tosferina; Pertussis; Epidemia; Vacunas acelulares
Key words: Whooping cough; Pertussis; Epidemic; Acellular vaccines
Pediatr Integral 2018; XXII (6): 254 –263
Tosferina
Introducción
La tosferina, conocida en la China del siglo VII como “la tos de los 100 días”, continúa siendo, catorce siglos después, un importante problema de salud pública en todo el planeta.
Es una enfermedad infecciosa que, a diferencia de otras, mata sin provocar fiebre. A pesar del inmenso descenso en la mortalidad infantil por tosferina objetivado tras el uso sistemático de las vacunas, no se ha conseguido la interrupción de la circulación en la población de su agente causal: Bordetella pertussis. En lo que se trabaja en la obtención de mejores vacunas contra la tosferina, se han puesto en marcha nuevas estrategias preventivas usando los preparados vacunales actuales (p. ej., en embarazadas), se han perfeccionado las técnicas de diagnóstico microbiológico rápido (reacción en cadena de la polimerasa o PCR), se han generalizado (a escala internacional) pautas de tratamiento común, así como criterios de ingreso y medidas de aislamiento de enfermos, y se han ideado nuevas definiciones (más actuales) para el diagnóstico clínico; todo ello en pos de proteger a los neonatos y pequeños lactantes de esta infección, para ellos, potencialmente letal.
Agente etiológico
En el año 1906, Bordet y Gengou aislaron un cocobacilo gram-negativo desconocido hasta entonces en una muestra de secreciones respiratorias de un lactante con tosferina. Este nuevo microorganismo fue denominado posteriormente Bordetella pertussis.
Aunque son nueve las especies descritas dentro del género Bordetella, son B. pertussis y, en menor medida, B. parapertussis las que tienen mayor importancia en humanos. Bordetella pertussis es la única en el género que infecta exclusivamente al ser humano y es esta especie también, la que presenta mayor dificultad para ser cultivada en el laboratorio(1).
Los antígenos patogénicamente más relevantes de B. pertussis se dividen en dos grupos:
• Relacionados con la adhesión/colonización: la pertactina (PRN), la hemaglutinina filamentosa (FHA), las fimbrias 2 y 3 (FIM), Vag8, BrkA, SphB1, el factor de colonización traqueal (TcfA) y la poco conocida cápsula polisacárida.
• Toxinas: la toxina pertúsica (TP), que entre otras funciones, puede actuar como adhesina a través de su subunidad B; la toxina tipo adenilato ciclasa (ACT), que actúa como factor antifagocítico; el lipopolisacárido (LPS), una endotoxina posiblemente también con propiedades propias de una adhesina; la toxina dermonecrótica (DNT); y la citotoxina traqueal (TCT). Aunque no se ha identificado aún, se cree que debe existir una “toxina tusígena”, responsable de los paroxismos de tos(2).
Epidemiología
La tosferina es una enfermedad altamente contagiosa, habiéndose descrito proporciones de infectados susceptibles en base a los expuestos (la mal llamada tasa de ataque) que se aproximan al 100%. En España, vivimos una epidemia desde 2011.
A diferencia de otras especies de Bordetella, B. pertussis infecta exclusivamente a humanos, no conociéndose reservorio animal alguno para este patógeno (B. parapertussis se ha aislado en ganado ovino). Se transmite tras contacto con individuos infectados a través de gotitas aerosolizadas, aunque también es posible la contaminación del ambiente o de las manos por contacto con secreciones de un individuo afecto. En el medio externo, B. pertussis apenas sobrevive unas horas. El período de incubación de la enfermedad es de 7 a 10 días (rango de 6 a 21). Es en las fases iniciales de la infección clínica, cuando el paciente es más contagioso y se sabe que la vacunación no impide la colonización nasofaríngea de B. pertussis. Ni la enfermedad natural ni la inmunización activa proporcionan protección de por vida, siendo especialmente efímera la respuesta generada tras vacunación con preparados acelulares de tosferina (DTPa y Tdpa)(1). El papel de los portadores asintomáticos se postula como importante, aunque aún no se ha aclarado su peso real en la diseminación de la infección (necesariamente menor que el de los sintomáticos). Los pacientes con tosferina se consideran contagiosos hasta que cumplen cinco días de tratamiento antibiótico apropiado. En ausencia de este tratamiento, los individuos afectos pueden contagiar la enfermedad durante 3 semanas o más.
En la era prevacunal, la incidencia de tosferina mostraba un marcado carácter cíclico, con repuntes epidémicos cada 3-5 años(3,4). Aunque estas ondas continúan observándose hoy en día, lo que ha cambiado, al menos en nuestro país desde 2011, es que el nadir situado entre los picos de incidencia se mantiene año tras año por encima del índice epidémico acumulado anual. Ello quiere decir que, en España, la enfermedad se encuentra en una situación de epidemia sostenida, siendo 2015 el año con más casos de tosferina registrados de las últimas dos décadas(5). Este aumento de la incidencia tiene una distribución bimodal por edades: 1) los lactantes menores de 3-6 meses, que por su edad no han completado la primovacunación y 2) los adolescentes/adultos, debido a la disminución de la inmunidad específica generada por la inmunización o el padecimiento de la enfermedad. Todos los expertos coinciden en que este segundo grupo representa, en la actualidad, el principal reservorio de tosferina. Algunos estudios realizados en EE.UU. revelan que hasta en el 15% de los cuadros de tos prolongada sin fiebre en adolescentes/adultos, se aísla B. pertussis como causante único del proceso. Aun así, cabe destacar que la incidencia de tosferina publicada por los servicios de vigilancia epidemiológica es muy inferior a la circulación real de B. pertussis en la comunidad, siendo la tosferina una enfermedad infradiagnosticada, especialmente en adolescentes y adultos y, por lo tanto, infracomunicada(3). Las razones que explican este infradiagnóstico son: 1) lo inespecífica que puede ser la sintomatología de la tosferina en adolescentes y adultos; 2) la falta de entrenamiento de los médicos de adultos en el reconocimiento de la enfermedad; y 3) las deficiencias propias de un sistema de notificación pasivo.
En España, la tosferina es una enfermedad de declaración obligatoria numérica desde 1982 y de declaración individualizada a partir de 1997. Al igual que en otras regiones europeas, la incidencia de tosferina aumentó considerablemente en España desde 2011, pasando de los 739 casos declarados en 2010 a los 3.088 comunicados el año siguiente (tasa de incidencia global de 6,73 x 100.000 hab./año). En 2015, la incidencia en España alcanzó su nivel más alto de los últimos años, superando las 8.000 notificaciones al Centro Nacional de Epidemiología del Instituto de Salud Carlos III (CNE)(5). En los años 2016 y 2017, se declararon en España 5.144 y 4.633 casos, respectivamente. Según estimaciones de la Organización Mundial de la Salud (OMS), 63.000 niños menores de 5 años fallecieron en 2013 por tosferina(6), la mayoría de ellos en países de bajo índice de desarrollo humano. Más del 80% de pacientes que fallecen como consecuencia de esta infección son menores de 6 meses y la mayoría de ellos la adquieren a partir de un conviviente o familiar mayor de 14 años. De 2010 a 2016, fallecieron en nuestro país 47 lactantes a causa de la infección por B. pertussis, tres veces más que los comunicados en los siete años precedentes y es muy probable que dicha cifra sea en realidad superior.
Patogenia
Consta de cuatro pasos diferenciados: 1) inoculación y adhesión al epitelio respiratorio; 2) multiplicación y evasión de las defensas del hospedador; 3) daño local; y 4) efectos sistémicos.
Tras tomar contacto con el epitelio respiratorio, la bacteria se ancla exclusivamente a las células ciliadas gracias a la acción de sus múltiples adhesinas(3). TP dificulta la migración de linfocitos y macrófagos al lugar de la infección, así como la fagocitosis. B. pertussis bloquea la expresión de defensinas locales en el árbol respiratorio, lo cual representa un mecanismo de evasión de las defensas del hospedador. El daño local es producto de la acción de varios factores de virulencia (TCT, DNT, ACT). No se conoce exactamente qué es lo que ocasiona los paroxismos de tos y algunos autores postulan la existencia de una “toxina tusígena” que está aún por descubrirse(3). El efecto sistémico más relevante que tiene la infección por B. pertussis (virtualmente el único de importancia, ya que no se produce nunca bacteriemia) es la exagerada linfocitosis inducida por TP. Este efecto no se observa en la infección por B. parapertussis, ya que no genera TP. Todos los pacientes que experimentan una primoinfección por B. pertussis en la infancia, presentan cierto grado de linfocitosis, algo que no se observa en individuos con anticuerpos circulantes (ya sea por vacunas, paso transplacentario o enfermedad pasada). Las manifestaciones sistémicas graves de la tosferina son debidas a la acción de la TP, la cual se relaciona con: la aparición de hiperlinfocitosis, hipertensión pulmonar refractaria, estimulación de los islotes pancreáticos, shock cardiogénico y fallo multiorgánico. La complicación sistémica más grave de la tosferina es la encefalopatía, la cual se postula pueda ser producida por la hipoxia cerebral secundaria a la hipoxemia generada en los repetidos paroxismos de tos, aunque esto está aún por aclararse.
Por técnicas de ELISA, se han demostrado anticuerpos específicos contra muchas de las proteínas conocidas de B. pertussis. Estos anticuerpos se detectan tras la infección natural y, con la excepción de la IgA, también tras la inmunización. B. pertussis se replica tanto intra como extracelularmente, tras contactar con el epitelio respiratorio. Por ello, a parte de la inmunidad humoral, la respuesta celular inicial mediada por macrófagos, células dendríticas, natural killer, la producción de IFN-gamma, IL-17 e IL-10 (regulador) y la activación de linfocitos Th1 y Th17, es de suma relevancia para luchar contra este patógeno(2). Las vacunas acelulares generan también respuesta celular, pero a expensas fundamentalmente de células tipo Th2, la cual es menos efectiva en el aclaramiento de B. pertussis.
Manifestaciones clínicas
Las manifestaciones clínicas de la infección por B. pertussis pueden variar desde la ausencia de síntomas hasta el clásico “síndrome pertúsico”, con paroxismos de tos, vómito y gallo, pasando por cuadros con sintomatología indistinguible de un catarro común. En neonatos, son especialmente temibles las apneas al debut.
La expresión clínica dependerá de diversos factores, entre los que destacan: edad de la primoinfección, inmunización previa o infección pasada, presencia de anticuerpos transmitidos de forma pasiva, grado de exposición y tamaño del inóculo, sexo, factores genéticos o adquiridos del hospedador y genotipo del microorganismo.
Actualmente, el “síndrome pertúsico” aparece mayoritariamente en lactantes no vacunados y, en menor proporción, en adolescentes-adultos quienes, en contra de la creencia popular, pueden presentar una clínica de tosferina clásica(4,7). Consta de 3 fases diferenciadas: a) catarral, b) paroxística y c) convalecencia que se desarrollan a lo largo de 6-12 semanas. En la fase catarral, hay rinorrea acuosa, lagrimeo y tos, siendo indistinguible de un resfriado común. Prácticamente nunca hay fiebre (a no ser que exista coinfección con otros patógenos) y la tos suele hacerse progresivamente más intensa. La rinorrea no cambia a purulenta con el paso de los días, a diferencia del catarro de vías altas. Tras la primera fase (1-2 semanas), la tos se torna paroxística, con episodios repetidos de accesos en los que se contabilizan más de 10 golpes de tos en cada espiración, a lo cual le sucede una inspiración forzada con la glotis parcialmente cerrada, en forma de estridor agudo o “gallo” que, cuando aparece, es característico. Durante los paroxismos es común la rubefacción facial, la cianosis, la protrusión lingual, la sialorrea espumosa y filante, la sudoración (adolescentes y adultos), la ingurgitación yugular por aumento de la presión intratorácica y la emesis posterior. Tras cada acceso de tos, el lactante suele quedar exhausto, apático y, ocasionalmente, puede aparecer la apnea (especialmente en neonatos/lactantes prematuros). Es común la pérdida de peso como consecuencia de los vómitos y la dificultad para alimentarse e hidratarse. Entre los paroxismos el paciente puede aparentar normalidad, sin la existencia de distrés respiratorio.
Algunas complicaciones frecuentes de la tosferina son: la neumonía, la atelectasia, el enfisema intersticial o subcutáneo, la hiperlinfocitosis o la otitis media aguda (generalmente producida por S. pneumoniae). Más raramente pueden observarse: prolapso rectal, rotura diafragmática, neumotórax, hematoma subdural, hernia inguinal, fractura costal, convulsiones, hipertensión pulmonar refractaria, tetania, encefalopatía secundaria a hipoxia cerebral, síndrome de secreción inadecuada de hormona antidiurética y muerte. Sin tratamiento, esta fase paroxística puede prolongarse 2-3 meses. En neonatos, una forma de presentación relativamente frecuente es la apnea sin paroxismos de tos evidentes ni “gallo” inspiratorio. El cuadro clínico del paciente mayor de 10 años y del adulto puede ser indistinguible de un catarro común, lo cual condiciona un bajo índice de notificación en este grupo de edad.
La fase de convalecencia dura entre 1 y 2 semanas, y en ella los paroxismos van disminuyendo en frecuencia e intensidad hasta finalmente desaparecer.
Diagnóstico
El clásico diagnóstico de tosferina ha sido y es, fundamentalmente, clínico(6,7), ya que la comprobación microbiológica de todos los casos es actualmente inviable.
Aunque mayoritariamente se usan los criterios diagnósticos de caso propuestos por la OMS o por los Centers for Disease Control and Prevention (CDC) de Atlanta (Tabla I), estos no resultan muy útiles a la hora de tomar decisiones clínicas en los pacientes que presentan mayor riesgo de presentar complicaciones de esta infección.
La razón es que dichos criterios se confeccionaron en un tiempo en el que la tosferina era considerada una enfermedad casi exclusivamente infantil, por lo que no hacen una diferenciación en las formas clínicas propias de cada grupo de edad. Se comenzaron a utilizar con la idea de evaluar la efectividad de las vacunas y primaban criterios de especificidad diagnóstica sobre otros más relacionados con la sensibilidad en la definición de caso. Parece obvio que, el diagnóstico de tosferina en un lactante menor de 6 meses debe ser sospechado mucho antes de los 14 días que se requerirían para cumplir criterios de caso probable según los CDC/OMS. En la actualidad, al menos, en los pacientes de mayor riesgo (< 6 meses), debe procurarse la confirmación microbiológica de la infección y la pronta instauración de tratamiento empírico con un macrólido hasta obtener el resultado microbiológico. Por otra parte, como ya hemos comentado, ya que la disponibilidad de pruebas microbiológicas confirmatorias de tosferina es escasa desde Atención Primaria, resulta primordial contar con una clasificación clínica lo suficientemente sensible, como para que no deje escapar a ningún caso que pueda ser potencialmente grave. Los pacientes con sospecha de sufrir tosferina y que por edad u otros factores presenten mayor riesgo, deberán ser derivados a medio hospitalario para procurar confirmación microbiológica y plantear ingreso si procede.
Si hemos comentado que la presentación clínica de la tosferina es variable según la edad y el estado de vacunación, es fácil entender que debería haber diferentes criterios clínicos de caso según se trate de un paciente lactante, un niño o un adolescente/adulto. La Global Pertussis Initiative (GPI), el mayor foro de expertos de tosferina del mundo, publicó en 2012 un trabajo en el que proponen unos nuevos criterios diagnósticos de tosferina, adaptados a la edad del paciente, en aras de incrementar la sensibilidad y detectar a todos los enfermos con riesgo de fallecer por tosferina (a expensas de una menor especificidad)(8). Los nuevos criterios diagnósticos se definen para tres grupos de edad: los menores de 3 meses, los de 4 meses a 9 años y los mayores de esta edad (Fig. 1).
Figura 1. Adaptación de nuevas definiciones clínicas de caso de tosferina propuestas por la Global Pertussis Initiative, 2012(8).
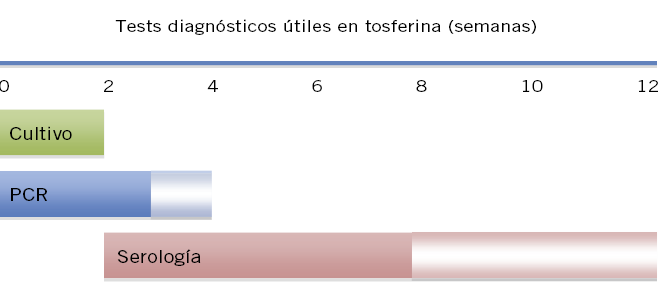
Una de las diferencias principales que existe con los criterios clásicos es que en el grupo de edad de 0 a 9 años, la duración de la tos de más de 2 semanas no es criterio indispensable para efectuar un diagnóstico de tosferina. Para la confirmación microbiológica son útiles: por un lado, el cada vez menos usado cultivo en medio de Bordet-Gengou enriquecido (gold standard), las pruebas de reacción en cadena de la polimerasa (PCR) en muestras de secreción respiratoria obtenidas idealmente mediante aspirado de la nasofaringe y, en menor medida, la serología (ELISA), que implica un diagnóstico confirmatorio casi siempre a posteriori, en fase paroxística tardía o de convalecencia (difícil de interpretar en vacunados). Cada una de las pruebas diagnósticas tiene su momento idóneo de realización para obtener mejores niveles de sensibilidad y especificidad (Fig. 2).
Figura 2. Momento óptimo de realización de los test de diagnóstico microbiológico de tosferina. Nota: El cambio de color refleja una disminución de la sensibilidad y/o especificidad de la prueba.
También se elegirá un método u otro según la edad del paciente. El interés de mantener el cultivo tradicional es, además de servir de estándar, el poder recuperar cepas para un ulterior análisis genético buscando mutaciones que, por ejemplo, confieran cierta resistencia a la acción de los anticuerpos generados por las vacunas acelulares en uso.
En lactantes no inmunizados afectos de tosferina, es característica la aparición en el hemograma de leucocitosis con concentraciones de linfocitos totales que superan las 10.000 células por microlitro. Existen trabajos que relacionan de forma directa la concentración de linfocitos en sangre periférica con las posibilidades de fallecer como consecuencia de la infección por B. pertussis. La radiología no suele servir de ayuda en el diagnóstico de tosferina, su utilidad se centra en la búsqueda de algunas de sus complicaciones (neumonía, atelectasia, neumotórax).
Tratamiento y quimioprofilaxis
Los macrólidos representan el tratamiento de elección, especialmente la azitromicina, siendo alternativas: la claritromicina, la eritromicina y el cotrimoxazol.
Durante las primeras fases de la enfermedad (menos de 2 semanas de síntomas), el tratamiento antibiótico puede influir en la sintomatología y disminuir la intensidad o frecuencia de los paroxismos. En fases posteriores, el tratamiento no varía el curso de la enfermedad, pero puede disminuir la contagiosidad del sujeto. El tratamiento antibiótico se debe iniciar de forma precoz en los casos sospechosos, aún sin confirmación microbiológica, especialmente en aquellos pacientes de mayor riesgo (menores de 6 meses). No estaría indicado en pacientes sin factores de riesgo con más de 21 días de síntomas. La dosis y duración del antimicrobiano es igual tanto para el tratamiento como para la profilaxis postexposición, pero la pauta varía según la edad del paciente (Tabla II). En pacientes con QT prolongado o riesgo de arritmias, así como en los que se sospeche la infrecuente resistencia a macrólidos de B. pertussis, el cotrimoxazol, en mayores de 6 semanas de vida, es la alternativa de elección. Muchos individuos, especialmente adolescentes y adultos, aclaran la infección en 3-4 semanas sin necesidad de usar antimicrobianos. Los antitusígenos no están indicados en ningún grupo de edad, tampoco los corticoides, el montelukast o los broncodilatadores(10).
La prevención preexposición se realiza con vacunas, tal y como desarrollaremos más adelante. En la profilaxis postexposición, se recomiendan los antimicrobianos en pauta idéntica a la del tratamiento (Tabla II).
Dado el escaso impacto de la quimioprofilaxis en la diseminación de la enfermedad(11), siguiendo indicaciones de la Dirección General de Salud Pública, esta solo se indicará a los contactos estrechos de un caso que cumplan con las premisas que se enumeran en la tabla III.
Los individuos diagnosticados de tosferina, correctamente tratados, deberán mantenerse aislados durante, al menos, 5 días, evitando el contacto, especialmente, con: niños pequeños, embarazadas, inmunodeprimidos e individuos que puedan servir de transmisores a los anteriores. Los individuos no tratados con antimicrobianos deberán mantenerse aislados 21 días. Se usarán las medidas de prevención de enfermedades transmisibles por gotas, tanto en el hogar como en el hospital. En los contactos estrechos del caso índice, además de indicarse si procede la quimioprofilaxis postexposición, se actualizará el estado vacunal. Además, teniendo en cuenta la escasa perdurabilidad de los anticuerpos contra TP con el uso de preparados acelulares, puede ser aconsejable la administración de una dosis de vacuna en aquellos contactos en los que hayan transcurrido más de 3-5 años de la última inmunización con preparados que incluyan componente pertúsico.
Vacunas contra tosferina
Las vacunas contra tosferina forman parte de las inmunizaciones básicas de todos los lactantes del mundo y han disminuido drásticamente la mortalidad generada por esta enfermedad.
La prevención preexposición se basa en la inmunización sistemática a partir de las 6 semanas de vida, usando preparados combinados, en nuestro medio, acelulares (DTPa, Tdpa), por ser menos reactógenos. La “P” mayúscula implica que presenta una mayor carga antigénica (ideal para la primovacunación de lactantes y niños de hasta 7 años). La mejor forma de proteger indirectamente a los recién nacidos y lactantes menores de 6 semanas es vacunar a sus madres durante el embarazo(9), idealmente entre las semanas 28 y 36. Esta estrategia, implantada en España de forma generalizada desde 2016(13), se ha demostrado efectiva en la prevención de ingresos y muertes por tosferina en lactantes, tanto en nuestro entorno, como en otros países como Reino Unido.
No se conoce con exactitud ni el tipo, ni el nivel de anticuerpos específicos necesario para conferir protección contra la tosferina. La eficacia de las vacunas acelulares con ≥3 componentes se estima en un 84-85% para prevenir la tosferina típica y en un 71-78% para la tosferina leve. Las nueve vacunas contra tosferina comercializadas en España en la actualidad (Tabla IV), contienen componentes purificados de B. pertussis combinados con los toxoides tetánico y diftérico (DTPa, Tdpa), en ocasiones, incluidos en preparados penta o hexavalentes.
Desde 2017, la variabilidad de los calendarios autonómicos españoles disminuyó como nunca lo había hecho, pero restándose una dosis de vacuna pertúsica con respecto a las pautas usadas hasta ese año en nuestro país. Una de las razones que empujaron a la búsqueda de esta congruencia de calendarios fue el desabastecimiento mundial de vacunas que incluían antígenos pertúsicos (pentavalentes, hexavalentes y Tdpa) por razones no muy bien explicadas, pero derivando en una incapacidad por parte de las industrias farmacéuticas encargadas de su producción y distribución para hacer frente a la ingente demanda mundial de vacunas combinadas contra tosferina(12). En Europa, este contratiempo se vivió de forma desigual entre los distintos países, siendo España, junto a Rumanía y Bulgaria, una de las más afectadas por el desabastecimiento “global”. Como consecuencia, estos países se vieron obligados a realizar cambios en sus esquemas de vacunación, administrando menos dosis de vacunas con componente pertúsico a su población infantil(12).
La serie de vacunaciones sistemáticas que se administraba en España antes de 2017 incluía 3 dosis de vacuna DTPa-VPI-Hib-VHB, a los 2, 4 y 6 meses de vida. En el nuevo calendario asumido por todas las comunidades y ciudades autónomas españolas desde 2017, los lactantes reciben 3 dosis de vacuna contra tosferina en el primer año de vida, pero a los 2, 4 y 11 meses de vida. Antes de 2017, a los 15-18 meses de edad, se administraba la cuarta dosis en forma de vacuna pentavalente. Como consecuencia del desabastecimiento mundial de vacunas, el esquema se reestructuró y esta dosis se eliminó tras retrasarse la administración de la tercera dosis a los 11 meses. Este cambio obliga a administrar la cuarta y última dosis de DTPa (mejor que Tdpa) a los 6 años de edad, junto a una de poliomielitis inactivada(14).
El nuevo escenario epidémico de tosferina que sufrimos países como España, ha obligado a plantear nuevas estrategias vacunales ya instauradas en otros países con resultados prometedores. Aunque las vacunas acelulares comercializadas en la actualidad son posiblemente mejorables, mientras no dispongamos de preparados más inmunógenos, cabría pensar en optimizar su uso extendiendo más su rango poblacional de aplicación(9). En concordancia con esta idea, diversos países como: Estados Unidos, Bélgica, Nueva Zelanda o Reino Unido iniciaron en 2012-2013 la estrategia de vacunar a las embarazadas durante el tercer trimestre de embarazo (y en cada gestación) con Tdpa, observándose excelentes resultados en cuanto a la prevención de muertes por tosferina en lactantes menores de 3 meses(15). En España en el año 2015, a la vista de las experiencias observadas en Reino Unido, el Grupo de Trabajo de tosferina de la Ponencia de Programa y Registro de Vacunaciones (Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud), redactó una adenda al programa de vacunación frente a tosferina en España en referencia a la vacunación en el embarazo(13). Así, en enero de 2016, todas las comunidades y ciudades autónomas ya vacunaban contra tosferina (Tdpa) a la embarazada entre las semanas 28 y 36 de gestación.
Aunque no es una estrategia universalmente aceptada, algunos países, tal y como propugna el Comité Asesor de Vacunas de la AEP, administran una quinta dosis de refuerzo con Tdpa entre los 12 y 14 años para prolongar la eficacia preventiva de la inmunización hasta edades adultas(16). Esta dosis parece especialmente indicada en los que recibieron Tdpa a los 6 años. Este refuerzo, sin embargo, no está contemplado en los nuevos calendarios oficiales españoles (con la única excepción de Asturias), reafirmándose en el uso de Td a los 14 años. Los jóvenes y adultos no vacunados previamente de la tosferina, deben recibir una dosis de Tdpa, que sustituirá a una de la serie de Td. Las personas que hayan padecido la tosferina deben, asimismo, vacunarse, puesto que la enfermedad no confiere inmunidad permanente. Finalmente, la vacunación del personal sanitario ha demostrado ser una estrategia eficiente en la lucha contra la tosferina y la OMS la propugna desde 2010, especialmente en servicios de Pediatría y en épocas de alta incidencia(6).
Función del pediatra de Atención Primaria
La situación de epidemia mantenida de tosferina que vivimos desde el año 2011 en nuestro país, hace que esta enfermedad se incluya en el diagnóstico diferencial de los cuadros de tos prolongada que veamos en nuestra consulta, sea cual sea la edad del paciente y su estatus vacunal. El pediatra de Atención Primaria es el que hará el diagnóstico con mayor frecuencia, incluso de los adultos sintomáticos convivientes del niño. Su papel es, pues, fundamental: sospechando el cuadro, iniciando tratamiento precoz, derivando a los pacientes de riesgo al hospital, buscando confirmación microbiológica cuando sea posible, comunicando el caso a las autoridades de Salud Pública, detectando otros casos en el entorno del enfermo, instaurando la profilaxis posexposición con antibióticos y/o vacunas a convivientes cuando esté indicado, adaptando el calendario vacunal a la situación cuando sea preciso, e incluso, instruyendo a los compañeros médicos de familia en la detección del “síndrome pertúsico” en adolescentes y adultos.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Montesdeoca Melián A. Tos ferina. En: Hidalgo Vicario MI, Montón Álvarez JL, ed. Vacunas. Algo más que el calendario vacunal. Preguntas y respuestas. Madrid: Undergraf S.L.; 2017. p 375-94.
2.*** Cherry JD, Heininger U. Pertussis and other Bordetella infections. In: Cherry JD, Harrison GJ, Kaplan SJ, et al. editors. Feigin and Cherry’s textbook of pediatric infectious diseases. 7th edition. Elsevier/Saunders; Philadelphia, PA: 2014. p. 1616-39.
3. Cherry JD, Paddock CD. Pathogenesis and histopathology of pertussis: implications for immunization. Expert Rev Vaccines. 2014; 13: 1115-23.
4. Mattoo S, Cherry JD. Molecular pathogenesis, epidemiology, and clinical manifestations of respiratory infections due to Bordetella pertussis and other Bordetella subspecies. Clin Microbiol Rev. 2005; 18: 326-82.
5. Boletín Epidemiológico Semanal. Volumen anual 2015. Centro Nacional de Epidemiología. Instituto Carlos III. Ministerio de Economía y Competitividad (consultado el 20 de junio de 2018). Disponible en: http://revista.isciii.es/index.php/bes/article/view/982/1202.
6.** World Health Organization (WHO). Pertussis vaccines: WHO Position Paper 2015. Disponible en: http://www.who.int/wer. Weekly Epidemiological. 2015, 90: 433-60.
7. Ebell MH, Marchello C, Callahan M. Clinical Diagnosis of Bordetella Pertussis Infection: A Systematic Review. J Am Board Fam Med. 2017; 30: 308-19.
8.*** Cherry JD, Tan T, Wirsing von König CH, Forsyth KD, Thisyakorn U, Greenberg D, et al. Clinical definitions of pertussis: summary of a global pertussis initiative roundtable meeting, February 2011. Clin Infect Dis. 2012; 54: 1756-64.
9.** Montesdeoca Melián A. El papel de los pediatras en la lucha contra la tos ferina. ¿Podemos tomar una actitud más activa? Pediatr Integral. 2013; XVII(8): 586-96.
10. Wang K, Bettiol S, Thompson MJ, Roberts NW, Perera R, Heneghan CJ, et al. Symptomatic treatment of the cough in whooping cough. Cochrane Database Syst Rev. 2014; 22: CD003257.
11.** Van Esso Arbolave DL. Actualización en tos ferina. Pediatr Integral. 2014; XVIII(2): 101-7.
12. European Centre for Disease Prevention and Control. Shortage of acellular pertussis-containing vaccines and impact on immunisation programmes in the EU/EEA –2 February 2016. Stockholm: ECDC; 2016.
13.** Grupo de Trabajo tos ferina 2015 de la Ponencia de Programa y Registro de Vacunaciones. Adenda al programa de vacunación frente a tos ferina en España: vacunación en el embarazo. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad, 2015.
14. Ponencia de Programa y Registro de Vacunaciones. Revisión del Calendario de Vacunación. Comisión de Salud Pública del Consejo Interterritorial del Sistema Nacional de Salud. Ministerio de Sanidad, Servicios Sociales e Igualdad, 2016.
15.*** Amirthalingam G, Letley L, Campbell H, Green D, Yarwood J, Ramsay M. Lessons learnt from the implementation of maternal immunization programs in England. Hum Vaccin Immunother. 2016; 12: 2934-9. Epub 2016 Jul 25.
16. Comité Asesor de Vacunas (CAV-AEP). Tosferina. Manual de vacunas en línea de la AEP (Internet). Madrid: AEP; abr/2016 (consultado por última vez el 16 de junio de 2018). Disponible en: http://vacunasaep.org/documentos/manual/cap-39.
Bibliografía recomendada
– Feigin and Cherry’s textbook of pediatric infectious diseases. 7th edition. Elsevier/Saunders; Philadelphia, PA: 2014.
Libro de referencia en Infectología Pediátrica, donde se encuentra un excelente capítulo escrito por uno de los mayores expertos en tosferina del mundo, el Dr. Cherry.
– World Health Organization (WHO). Immunization, vaccines and biologicals. Vaccines and diseases. Pertussis. Update 2018 (en línea). Disponible en: http://www.who.int/immunization/diseases/pertussis/en/.
Enlace web de la OMS con toda la información relativa a la enfermedad.
– Cherry JD, Tan T, Wirsing von König CH, Forsyth KD, Thisyakorn U, Greenberg D, et al. Clinical definitions of pertussis: summary of a global pertussis initiative roundtable meeting, February 2011. Clin Infect Dis. 2012; 54: 1756-64.
Este es el trabajo que sienta las bases de unos nuevos criterios para el diagnóstico clínico de tosferina. Dichos criterios resultan mucho más útiles desde la Atención Primaria para evitar la pérdida de pacientes con mayor riesgo de sufrir complicaciones.
– Yeh S, Mink CM, Edwards M, Torchia MM. Pertussis infection in infants and children: clinical features and diagnosis. Post TW, ed. UpToDate. Waltham, MA: UpToDate Inc. http://www.uptodate.com (consultado el 28 de junio de 2018).
Magnífica revisión de las características clínicas de los lactantes y niños afectos de tosferina. Resumen de los métodos diagnósticos en uso en la actualidad.
– Amirthalingam G, Letley L, Campbell H, Green D, Yarwood J, Ramsay M. Lessons learnt from the implementation of maternal immunization programs in England. Hum Vaccin Immunother. 2016; 12: 2934-9. Epub 2016 Jul 25.
Excelente trabajo de acceso gratuito en el que se analiza el impacto de la vacunación de la embarazada en las hospitalizaciones y muertes por gripe y tosferina en neonatos y lactantes en Inglaterra. Amplia y selecta bibliografía.
| Caso clínico |
|
Neonato de 8 días que acude a consulta sin cita previa porque hace aproximadamente una hora, la madre lo encuentra en su cuna inmóvil, con pérdida de conciencia, coloración violácea y ausencia de respiración espontánea. Tras estimularlo e iniciar respiración boca a boca, ha reaccionado, recobrando la conciencia y la respiración espontánea, acudiendo rápidamente al centro de salud más cercano. Niega antecedentes gestacionales o perinatales de interés, fue un recién nacido a término, con buen peso para su edad gestacional, segundo hijo de madre no portadora de estreptococo de grupo B, toma leche materna a demanda y ha ganado peso de forma adecuada desde el nacimiento. La madre niega la presencia de otros síntomas en el recién nacido, salvo algo de rinorrea y estornudos, pero ella tramita un cuadro de tos de seis semanas de duración, con emesis ocasional tras los accesos de tos, los cuales son prolongados, acabando ocasionalmente con un estridor inspiratorio final, pero sin fiebre. El examen físico del neonato es absolutamente normal, tanto en nivel de conciencia y aspecto general, como en el tono muscular y coloración de piel y mucosas. Se encuentra alerta, sin presencia de trabajo respiratorio y la auscultación cardiopulmonar y exploración neurológica es normal. Pese a encontrarse asintomático, este paciente es derivado al hospital de referencia, para observación y estudio del episodio aparentemente amenazador para la vida que ha sufrido.
|