|
| Regreso a las bases |
M. Ridao Redondo
Pediatra de Atención Primaria, a l’ABS St. Vicenç dels Horts (Barcelona)
Pediatr Integral 2018; XXII (2): 102.e1 – 102.e8
Metodología diagnóstica en Alergología Pediátrica
Introducción
En las últimas décadas existe un aumento de la prevalencia de la enfermedad alérgica. El asma, la rinitis, la dermatitis atópica y la alergia alimentaria son algunas de sus manifestaciones clínicas más frecuentes en la infancia afectando, según las áreas geográficas, a un 20-30% de la población pediátrica. La necesidad del Pediatra de Atención Primaria (PAP) de conocer, orientar correctamente y, por tanto, el número de estudios alergológicos a realizar, han tenido un incremento en paralelo(1,2).
Tanto la Sección de Alergia e Inmunología de la Academia Americana de Pediatría como la de la Academia Europea de Alergia e Inmunología Clínica han elaborado documentos para la realización de las pruebas de alergia en el paciente pediátrico, sea cual sea su edad, si existe sospecha de enfermedad alérgica(3,4). El estudio alergológico forma parte además del proceso diagnóstico de todas las Guías de referencia(5-7). Para el diagnóstico en alergia pediátrica, nos basamos en la historia clínica, estudios funcionales y pruebas complementarias “in vivo” e “in vitro”, buscando el alérgeno responsable y, sobre todo en pacientes respiratorios, el grado de afectación y la respuesta al tratamiento, para así poder ofrecer un diagnóstico y un manejo adecuado para cada paciente.
Historia clínica
Es la herramienta más importante para el diagnóstico de la enfermedad alérgica. Se debe realizar de forma detallada y orientada. En caso de tratarse de una alergia alimentaria, debe constar: vía de entrada del alérgeno (ingesta, contacto o inhalación), si era crudo, cocido, con o sin piel, tiempo entre el contacto e inicio de síntomas y detallar si hubo o no síntomas con compromiso de vía aérea. Es importante también, saber cómo se resolvió la clínica, si de forma espontánea o con medicación (oral o intramuscular), si acudieron a urgencias o no y la duración de la misma. En el caso de una alergia respiratoria, si alguna vez ha tenido: sibilantes, tos nocturna, dificultad respiratoria, asociación a la exposición de animales, humo de tabaco, predominio estacional y frecuencia de las crisis. Si ha utilizado alguna vez medicación inhalada, como suelen iniciarse los broncoespasmos, con o sin cuadro catarral previo, presencia o no de fiebre, rinorrea, picor, estornudos en salvas. Si se trata de una dermatitis atópica: frecuencia de brotes, desencadenantes que los favorezcan, tipo de tratamiento utilizado en ellos, extensión de la afectación, descanso nocturno.
Se deben recoger antecedentes personales, familiares y ambientales(8).
Estudio alergológico
Cuando hablamos de “pruebas de alergia”, estamos diciendo: “pruebas que demuestran sensibilización IgE específica a un alérgeno”, no confirmamos la etiología de la enfermedad, ni podemos predecir la gravedad de la misma.
En los últimos años, las técnicas diagnósticas han presentado importantes avances, los alérgenos, son cada día mejor conocidos. Hasta ahora se trabajaba con extractos que son mezclas mal definidas de alérgenos principales completos, alérgenos de reactividad cruzada y material no alergénico. Los avances en biología molecular y técnicas de ADN recombinante permiten disponer de nuevas herramientas diagnósticas, como los alérgenos recombinantes y los alérgenos purificados, que dan lugar a un nuevo concepto, el denominado “diagnóstico por componentes”, y permiten conocer, de una forma precisa, cuáles son las moléculas del alérgeno responsables de desencadenar la reacción alérgica(9) (Fig. 1).
Figura 1.
Componentes alergénicos:
- Fuente alergénica. Tejido, partícula, alimento u organismo capaz de inducir alergia (p. ej.: caspa de gato, D. pteronyssinus, leche, Aspergillus fumigatus, polen de Phleum pratense, etc.).
- Extracto alergénico. Mezcla cruda no fraccionada de proteínas, polisacáridos y lípidos, obtenida a partir de la extracción de una fuente alergénica (p. ej., granos de polen).
- Molécula alergénica (alérgeno). Molécula (proteína o glucoproteína) derivada de una fuente alergénica determinada que es identificada por anticuerpos específicos de clase IgE. Los alérgenos pueden ser obtenidos a partir de fuentes naturales (alérgenos nativos purificados) o producidos utilizando tecnología ADN-recombinante (alérgenos recombinantes).
El subcomité de nomenclatura de los alérgenos de la Organización Mundial de la Salud y la Unión Internacional de Sociedades Inmunológicas introdujeron unas guías para facilitar la nomenclatura coherente de los componentes de las fuentes alergénicas (http://www.allergen.org/index.php). Para nombrarlos, se utilizan las 3 primeras letras del género al que pertenecen, seguidas por una letra (dos, en ocasiones), que indican el nombre de la especie, y finalmente un número que muestra el orden de identificación del alérgeno; p. ej.: Der p 1; Der (género: Dermatophagoides), p (especie: pteronyssinus), 1 (primero identificado en el grupo) (Fig. 2).
Figura 2. Alérgenos clínicamente relevantes del ácaro del polvo doméstico. Aquellos con reactividad cruzada detectada experimentalmente, se muestran en naranja. http://www.eaaci.org/documents/Molecular_Allergology-web.pdf.
Pruebas “in vivo”
Son aquellas que realizamos en el propio paciente(5).
Pruebas cutáneas
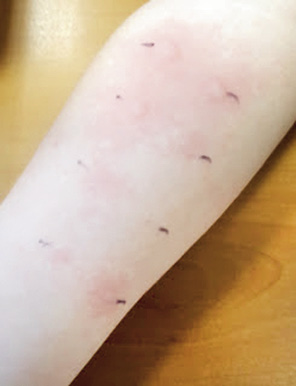
• Prick test: corresponde a la detección de la IgE específica que está unida al mastocito y que se degranula al contacto con el alérgeno al que el paciente está sensibilizado. Reproduce reacciones de hipersensibilidad de tipo I (inmediata, mediada por IgE) y son de lectura inmediata. Es el método de elección para el estudio de enfermedades alérgicas por su sencillez, rapidez y sensibilidad. Para su realización, requieren de personal entrenado y extractos de calidad.
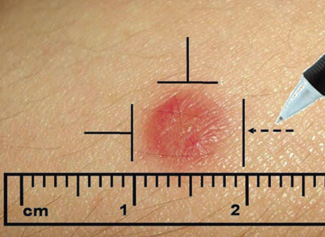
- Material y técnica: se coloca 1 gota de cada extracto alergénico, separadas unos 3 cm, de forma ordenada, en el antebrazo del paciente y se punciona con una lanceta estandarizada de forma perpendicular al plano, 1 mm hacia adentro. Se debe de utilizar 1 lanceta por alérgeno. Se utiliza control positivo con histamina y control negativo con suero salino. A los 15 minutos, se procede a la lectura de la pápula midiendo el diámetro mayor. Consideramos que un prick es positivo cuando es mayor a 3 mm de diámetro mayor.
En algunos casos, por ejemplo en alergia alimentaria, se realizan Prick by prick. La técnica consiste en una puntura sobre el alimento fresco o cocido y luego punzar en la piel del paciente. Se utiliza, sobre todo en vegetales, dado que los extractos disponibles promueven la inactivación de proteínas potencialmente alergénicas, lo que produce falsos negativos de las pruebas convencionales.
La batería de alérgenos debe adecuarse a la zona geográfica en la que estemos trabajando. Para detectar posibles reacciones cruzadas, en la batería mínima de estudio de asma/rinitis, deben incluirse tropomiosina y profilina.
Diversos factores pueden alterar el resultado de un prick test como: dermografismo, dermatitis atópica, calidad del extracto, errores en la técnica o fármacos (antihistamínicos). Pueden existir contraindicaciones para la realización de un prick, como el antecedente de haber hecho una reacción previa grave con un prick, pero no son frecuentes. Las reacciones alérgicas sistémicas tras la prueba son raras, se describe una frecuencia del 0,02-0,03%. Siempre se debe obtener previamente el consentimiento informado y realizarlas en un lugar que disponga de un equipo de reanimación (Fig. 3).
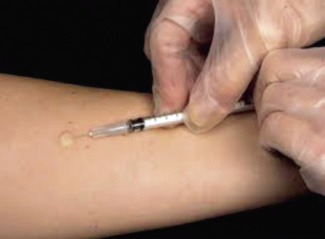
• Intradermorreacción (IDR): pueden reproducir reacciones de hipersensibilidad de tipo I y III en lectura rápida y, en la retardada, reacciones de hipersensibilidad de tipo IV o respuesta celular. Consiste en la inyección de 0,05-0,1 ml del extracto específico para IDR (solución salina en una concentración de 1.000 a 10.000 veces menor que para Prick), con aguja hipodérmica fina y con la jeringa paralela al brazo. Se introduce el volumen en un ángulo de 30º. Se utiliza también control negativo y positivo en diluciones de histamina para IDR. Se considera positiva una pápula de, al menos, 5 mm de diámetro mayor. Se utiliza en lectura inmediata y tardía, sobre todo, en el diagnóstico de alergia a fármacos (Fig. 4).
Figura 4. A. Técnica Intradermoreacción. B. Técnica de Sókal para delimitar los bordes de una induración positiva.
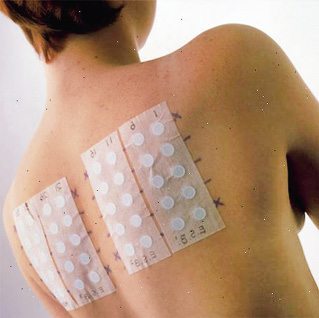
• Test de parches o pruebas epicutáneas: se utilizan, sobre todo, para diagnóstico de eccemas de contacto, poco en Pediatría. Son de lectura tardía a las 48-72 h de la aplicación. Reproducen reacciones de hipersensibilidad de tipo IV. Se aplican en zonas de piel sana, sin limpiar previamente, sobre todo en la espalda, y se utilizan sustancias recomendadas con apósitos ideados para la prueba (Fig. 5).
Pruebas “in vitro”
Estas pruebas nos permiten detectar la IgE específica circulante del paciente. Son un complemento diagnóstico de la historia clínica y de los test cutáneos(10).
• Determinación de IgE total: la IgE tiene una alta especificidad para unirse a los alérgenos. Su vida media es muy corta, y su valor tiene escasa correlación con la presencia de enfermedad alérgica, por tanto, no se recomienda como cribaje.
• Anticuerpos IgE específicos: proporcionan resultados cuantitativos y no se afectan por la toma de fármacos. Los métodos utilizados son RAST (radioallergo absorbent test) o CAP (inmunoenzimático). El rango oscila entre 0,1 y 100 kU/L, pudiéndose detectar valores superiores por técnicas de dilución. Tiene una buena especificidad y menor sensibilidad. Su positividad no siempre se relaciona con enfermedad alérgica, debe tenerse en cuenta la clínica y el resto de pruebas para valorar esta positividad. Su determinación resulta útil, sobre todo, para el diagnóstico de alergias IgE mediadas como: asma, rinitis y alergia alimentaria, siendo menos eficaz para el diagnóstico de urticaria o alergia a fármacos.
• Phadiatop®: es una herramienta diagnóstica útil para el cribaje en Atención Primaria. Su positividad obliga a seguir el estudio alergológico. Ofrece resultados cualitativos, positivos o negativos. Diagnostica correctamente 9 de 10 pacientes alérgicos con una eficacia de más del 90% cuando hay una historia clínica sugestiva, siendo más sensible y específica que la IgE total más la historia clínica (eficacia del 65%). El Phadiatop infant, uno de los más comercializados para Pediatría, está compuesto por una mezcla de alérgenos respiratorios y alimentarios: ácaros, gato, perro, caballo, alternaría, parietaria, phleum, abedul, platanero, olivo, leche, huevo, cacahuete, soja y gamba.
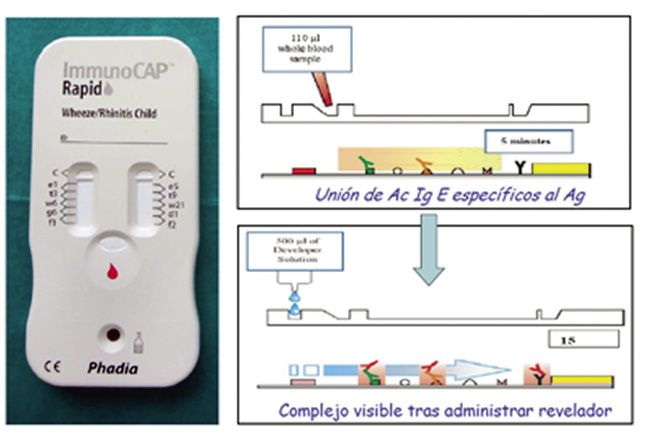
• InmunoCAP rapid®: disponible en España desde 2005, es uno de los test de diagnóstico rápido que puede disponer el PAP en la consulta. Detecta IgE específica frente a un panel de diez alérgenos inhalados y alimentarios a partir de una muestra de sangre capilar obtenida por punción del pulpejo del dedo. Disponemos de dos paneles de alérgenos que utilizaremos en función de la edad del niño, según sea mayor o menor de 5 años. El de los preescolares, InmunoCAP® Rapid Wheeze/Rhinitis Child, incluye huevo y leche, además de 8 aeroalergenos (gato, perro, abedul, olivo, artemisia, parietaria, hierba timotea y ácaros), y el que utilizamos en niños y adolescentes, InmunoCAP® Rapid Asthma/Rhinitis Adult, cambia estos dos antígenos alimentarios por alternaria y cucaracha. La principal ventaja es la sencillez de realización y la obtención de resultados en 20 minutos, en la misma consulta. Su positividad, nos da un valor semicuantitativo, cuando existe correlación con la clínica, permite iniciar medidas de evitación de alérgenos y valorar la necesidad de seguir el estudio(11,12)(Fig. 6).
• InmunoCAP ISAC®: es una técnica que permite determinar IgE frente a varios componentes alergénicos, utiliza técnicas de biochip (estudio molecular). Con la misma muestra y con mínima cantidad de suero (microlitros) proporciona resultados para un centenar de componentes de más de 50 fuentes alergénicas. Permite diagnosticar el perfil de sensibilización individual de cada paciente. Se trata de un estudio cualitativo que nos informa acerca de resultados positivos de IgE específica por grupos de proteínas, por fuente de alérgenos y según componentes de reactividad cruzada. Al cuantificar los niveles de anticuerpos IgE específicos para un determinado componente y no para el extracto completo, lograremos no solo un diagnóstico mucho más preciso del paciente alérgico, sino también la posibilidad de identificar los mejores candidatos para terapéuticas específicas (diseño de inmunoterapia alérgeno específica). Desde un punto de vista práctico, el diagnóstico molecular desempeña un importante papel en tres aspectos básicos del manejo alergológico: en pacientes aparentemente polisensibilizados, ayuda a distinguir entre la sensibilización genuina y la debida a fenómenos de sensibilidad cruzada; cuando la historia clínica y las pruebas diagnósticas tradicionales no son capaces de identificar el/los alérgenos relevantes, identifica moléculas asociadas a gravedad y permite establecer posibles riesgos; y ayuda a mejorar la intervención terapéutica para cada paciente.
• Test de activación de basófilos: es una línea nueva de investigación, la prueba mide la proteína CD63 que se expresa en la superficie de los basófilos activados. El estudio se realiza mediante citometría de flujo, se precisa sangre fresca, pudiéndose solo almacenar a 4°C hasta 24 horas. Aún falta experiencia para determinar un uso concreto en alergia.
Una vez detectada la presencia de IgE específica, debemos de saber diferenciar unos conceptos fundamentales en alergia:
• Sensibilización. Es la demostración de la existencia de niveles elevados de IgE especifica frente a uno o varios alérgenos “in vitro” o “in vivo”; es decir, detectada por métodos de laboratorio (RAST, CAP, Phadiatop, InmunoCap) o pruebas cutáneas (prick test). Esta sensibilización debe ser siempre valorada según la clínica del paciente y de esa forma determinar si su positividad tiene relación con su sintomatología alérgica. Si no fuera así, hablaremos de sensibilizaciones subclínicas o asintomáticas.
• Alergia. Existe una reacción adversa de salud en la que se demuestra un mecanismo inmunológico con una relación causa efecto evidente, producida por la ingesta, contacto o inhalación de un alérgeno.
• Tolerancia. La exposición al alérgeno no provoca síntomas de alergia. Puede ser espontánea y permanente, como por ejemplo, en el caso de la alergia alimentaria. A menudo, existe una historia natural de la enfermedad que puede conducir a dicha tolerancia a pesar de un largo periodo de evitación del alérgeno. Esta adquisición de tolerancia refleja un mecanismo de regulación a través de células T y, en ocasiones, la tolerancia adquirida puede ser solo parcial, lo que implica que podemos tener síntomas frente a una exposición masiva al alérgeno. La protección frente al alérgeno se puede también lograr a través de una exposición regular y continua, que conlleva a lo que denominamos desensibilización. Esto implica un descenso en la actividad de mastocitos y basófilos, con un aumento IgG4 específica al alérgeno que actúa como protectora. Este mecanismo está demostrado, tanto en la alergia respiratoria como alimentaria, siendo la base de la eficacia de la inmunoterapia específica en el asma y/o rinitis, como en la alergia alimentaria.
• Reactividad cruzada. Fenómeno que ocurre cuando un anticuerpo reacciona no solo con el alérgeno principal sino con otros similares. Es común entre alérgenos de una misma familia, por ejemplo: entre distintos frutos secos o distintos mariscos.
• Panalérgeno. Alérgeno presente en diversas especies con elevada conservación estructural, siendo difícil saber la especie sensibilizante original. Esto puede dar lugar a errores diagnósticos y de tratamiento, que obligan a utilizar el diagnóstico molecular o por componentes.
Los panalérgenos más estudiados son:
• Profilinas: proteínas sensibles al calor y a la digestión, responsables de reacciones cruzadas entre pólenes y frutas de diferentes especies. Los pacientes sensibilizados a profilina pueden tener clínica compleja, que obliga a efectuar un diagnóstico molecular.
• Proteina lipid transfer protein (LTP): proteína resistente al calor y a la digestión, que se concentra en la piel y superficie externa de vegetales. La clínica puede ser progresiva, presentándose con alimentos que se habían tolerado hasta ese momento y de forma cruzada entre pólenes y alimentos vegetales, dando lugar al Síndrome LTP. Puede causar reacciones alérgicas graves, ocasionalmente precipitadas por cofactores como el ejercicio físico. El alimento que más frecuentemente actúa como sensibilizador primario es el melocotón.
• Tropomiosina: proteína animal que origina reactividad cruzada entre crustáceos, moluscos, cucarachas y otros artrópodos como los ácaros.
Estudio de la función pulmonar
El estudio de la función pulmonar en niños colaboradores es uno de los pilares del diagnóstico de la patología respiratoria. Aunque el diagnóstico de asma es fundamentalmente clínico, siempre que la edad del niño lo permita, se deben efectuar pruebas objetivas que midan la función pulmonar(13).
Espirometría
La espirometría será para el PAP la prueba de primera elección, tanto para el diagnóstico como para el seguimiento de estos pacientes. En la actualidad, debido a la disponibilidad de mejores equipos, es posible llevar a cabo espirometrías fiables incluso en niños en edad preescolar, siempre y cuando estas sean realizadas por personal bien entrenado (Tablas I y II).
Es una técnica que evalúa volúmenes y flujos pulmonares, poniéndolos en relación entre sí y/o con el tiempo necesario para la realización de la prueba.
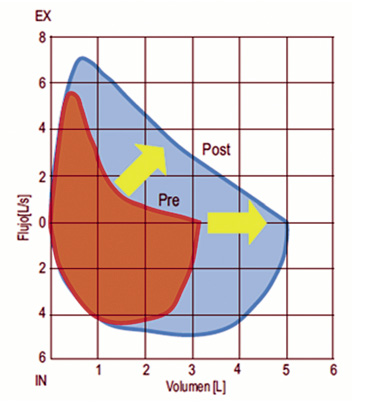
En el asma tiene interés la fase espiratoria; si bien, la fase inspiratoria puede ayudar en el diagnóstico diferencial de cuadros obstructivos intra y extrapulmonares. En Pediatría, fuera de los periodos de crisis, los niños pueden tener una función pulmonar normal, pero también, en ocasiones, niños aparentemente asintomáticos tienen una función pulmonar alterada (Fig. 7).
Los principales parámetros a determinar son:
• Capacidad vital forzada (FVC): volumen máximo espirado con el máximo esfuerzo y rapidez, partiendo desde la capacidad pulmonar total. Se considera que es un indicador de la capacidad pulmonar. Generalmente, un valor disminuido define las patologías restrictivas, aunque también puede estar limitada en las patologías obstructivas más graves.
• Volumen espiratorio forzado en el primer segundo (FEV1): volumen máximo espirado durante el primer segundo, contado desde el inicio, en el curso de una espiración forzada iniciada a capacidad pulmonar total. Refleja el tamaño de las vías respiratorias de calibre grueso e intermedio y guarda una correlación lineal e inversa con el grado de obstrucción de la vía aérea. Su mayor utilidad es la valoración de las respuestas broncodilatadora y broncoconstrictora de las vías respiratorias.
• Relación entre FEV1/FVC: La relación FEV1/FVC es el indicador más sensible y específico para la identificación de la obstrucción de las vías respiratorias.
• FEF25-75: Flujo espiratorio forzado entre el 25 y el 75% de la capacidad vital forzada o mesoflujos. Miden el flujo medio alcanzado en el tramo medio de la curva, comprendido entre el 25-75% de la FVC, y es específico de la obstrucción de las vías aéreas de pequeño tamaño, algunos trabajos le dan valor específicamente en la población pediátrica.
A partir de la relación entre estos parámetros, podremos evaluar si existe algún tipo de alteración respiratoria, así como el tipo de patrón espirométrico. Los valores de referencia en el espirómetro deben adecuarse a la edad y raza o etnia del paciente, así como otros factores ambientales del momento exacto de la prueba (temperatura, presión atmosférica y humedad relativa).
Una vez realizada la espirometría y valorada como correcta (Tablas III y IV), se deben identificar los patrones espirométricos como: normal, obstructivo, restrictivo o mixto, y clasificar la gravedad del patrón diagnosticando de acuerdo con los hallazgos y la clínica el proceso y valorando la necesidad de otras pruebas:
• Alteraciones ventilatorias de tipo obstructivo: limitan el flujo durante la espiración y cursan con incremento del volumen residual. Se caracterizan por la disminución marcada del FEV1 y de la relación FEV1/FVC, aunque en las formas graves se produce un descenso de la FVC y el cociente FEV1/FVC puede hacerse normal.
• Alteraciones ventilatorias de tipo no obstructivo (restrictivas): cursan con disminución de la capacidad pulmonar total. Se caracterizan por disminución de la FVC, permaneciendo normal o aumentada la relación FEV1/FVC.
• Alteraciones ventilatorias mixtas: coexisten ambos tipos de alteraciones ventilatorias y precisan de técnicas sofisticadas para completar su evaluación.
En Pediatría, se consideran valores espirométricos normales:
• FEV1/FVC mayor del 80% (la última revisión de la GINA establece el 90% en niños).
• FEV1 y FVC iguales o superiores al 80% de sus valores teóricos estandarizados.
• Flujo espiratorio forzado (FEF25-75) igual o superior al 65% de su valor teórico estandarizado.
Si en el estudio de la función pulmonar con la espirometría, buscamos la obstrucción al flujo aéreo, se debe completar el estudio con una prueba de broncodilatación, buscando la reversibilidad, la variabilidad con la medición seriada del pico de flujo y la hiperreactividad bronquial con test inespecíficos, como el ejercicio con carrera libre, la prueba de metacolina o manitol, o específicos, como provocaciones con alérgenos ambientales. En Atención Primaria debemos conocer bien y realizar la prueba de broncodilatación y el test de ejercicio con carrera libre.
Prueba de broncodilatación
La respuesta broncodilatadora se utiliza para evaluar la reversibilidad del patrón obstructivo en la espirometría. Para la realización de esta prueba, se debe realizar una espirometría para determinar el FEV1 basal y, posteriormente, se administran 4 inhalaciones sucesivas de 100 μg de salbutamol, o su equivalente de terbutalina, mediante un inhalador presurizado con cámara espaciadora. Se repite la espirometría a los 15 minutos (Fig. 8).
Se considera una prueba broncodilatadora positiva, cuando el incremento del FEV1 sobre el valor basal es mayor o igual al 12% y 200 ml, aunque es posible que un incremento del 8% sobre el valor basal o del 9% en relación al valor teórico, pueda definir mejor la respuesta broncodilatadora en niños. En los pacientes pediátricos, cuando hay dudas diagnósticas, son de especial interés las pruebas de provocación con ejercicio físico.
Medidor de pico de flujo
El medidor de pico de flujo o flujo espiratorio máximo (PEF) es un dispositivo sencillo, de pequeño tamaño, de bajo coste, portátil, fácilmente disponible para el uso domiciliario. El medidor es un tubo cerrado en un extremo, con una boquilla en el otro. La presión que genera el flujo de aire espirado mueve un diafragma por un carril hasta el punto máximo de flujo espiratorio, con rango de 0 a 400 L/min en monitores de PEF pediátricos. El PEF proporciona información sobre la variabilidad, o fluctuación excesiva de la función pulmonar a lo largo del tiempo. El índice de variabilidad diaria más recomendable es la amplitud del PEF con respecto a la media promediada durante un mínimo de 1-2 semanas y registrado antes de la medicación. Una variabilidad del PEF mayor del 20% orienta al diagnóstico de asma (Tabla V).
Las diferencias de exactitud y reproducibilidad entre los diversos modelos son significativas; en los homologados, se acepta un máximo del 10% intra aparato y del 5% entre aparatos del mismo modelo. Los medidores van perdiendo su exactitud y, al cabo de 12 meses, solo el 63% de las medidas permanecen en los límites de confianza del 95%. Por todo ello, no se deben utilizar para el diagnóstico de asma, pero pueden ser útiles para valorar la variabilidad en pacientes con mala percepción de los síntomas o con abuso de medicación de rescate acompañando a un plan de acción, para identificación de factores desencadenantes de crisis, y como medida de seguridad antes de la administración de la inmunoterapia subcutánea en Atención Primaria.
Pruebas de provocación
Ponen de manifiesto la sintomatología clínica referida por el paciente tras la exposición controlada al alérgeno sospechoso. Se utiliza cuando hay dudas diagnósticas o discordancias entre la historia clínica y los resultados obtenidos por la pruebas in vivo e in vitro. Son pruebas que comportan riesgo y deben realizarse en el ámbito hospitalario.
• Prueba de exposición controlada oral (PEC): consiste en la administración gradual y progresiva del alérgeno por vía oral para confirmar el diagnóstico o valorar tolerancia. Se utilizan en alergia alimentaria y medicamentosa. Es el patrón oro o “gold standard” en la alergia alimentaria. Confirman un diagnóstico de certeza o la adquisición de tolerancia. La PEC puede ser abierta, simple ciego o doble ciego. Se debe de realizar, preferentemente, en medio hospitalario, dónde se puedan asumir posibles reacciones adversas graves, siempre con consentimiento informado. Puede tener contraindicaciones relativas o absolutas (paciente en el que este contraindicado el uso de adrenalina, que tome betabloqueantes o una anafilaxia previa).
• Prueba de provocación nasal, conjuntival o bronquial específicas: administración del neumoalérgeno por estas vías, cuando hay dudas diagnósticas. Se realiza en niños colaboradores, generalmente mayores de 6 años, para que la respuesta además pueda ser objetivada de forma adecuada según tablas de referencia.
Material y técnica
• Provocación nasal y conjuntival: se aplica una gota del diluyente con el alérgeno en el saco conjuntival o través de las fosas nasales en concentraciones crecientes y se espera hasta la aparición de síntomas. Se valoran estos a través de tablas de referencia.
• Provocación bronquial: se realiza una espirometría basal y otra tras ser expuesto a una nebulización con el alérgeno en cuestión. Se considera la prueba positiva, cuando se objetiva una caída del 15% del FEV1. Existe, además, la posibilidad de respuesta tardía, por lo que esta prueba se puede realizar con el paciente ingresado o se debe advertir la posibilidad de aparición de síntomas en domicilio.
• Pruebas de provocación bronquial inespecífica, metacolina o ejercicio: son pruebas de especial interés en el niño, dado que son fáciles de realizar y, sobre todo, el test de esfuerzo tiene una alta especificidad para el diagnóstico de asma.
- Metacolina: partimos de una espirometría basal y se van administrando dosis crecientes de metacolina nebulizada. Se realizan espirometrías seriadas hasta valorar una caída mayor 20% del FEV1 inicial, que es cuando la prueba se considera positiva (PC20).
- Test de esfuerzo: partimos también de una espirometría basal, hacemos correr al niño en un tapiz rodante, realizamos espirometrías seriadas tras el esfuerzo, a los 5, 10 y 15 minutos, y consideramos positivo si se evidencia una caída del 15% del FEV1.
El diagnóstico de la enfermedad alérgica se basa fundamentalmente en: demostrar una asociación causal con el alérgeno, demostrar el mecanismo inmunológico implicado y descartar diagnósticos diferenciales. Las herramientas que utilizamos para ello son:
• Una historia clínica detallada que evidencie una relación causa-efecto con determinado alérgeno y manifestaciones clínicas producidas por una repuesta inmune.
• Pruebas cutáneas y/o IgE específicas que, siendo positivas, son compatibles con un mecanismo IgE mediado.
• Prueba de exposición controlada, que permite obtener un diagnóstico de certeza de la enfermedad alérgica que estamos sospechando.
Bibliografía
1. Fernández Benítez M. Metodología diagnóstica en alergia infantil. Pediatr Integral. 2013; 8: 581-5.
2. Machinena A. Métodos diagnósticos en alergia. Conceptos: Alergia, Sensibilización y Tolerancia. Allergologia et immunopathologia Proceedings. 2016; 185-9.
3. Sicherer SH, Wood RA. American Academy of Pediatrics Section on Allergy and Immunology. Allergy testing in childhood: using allergen-specific IgE tests. Pediatrics. 2012; 129: 193-7.
4. Eigenmann PA, Atanaskovic-Markovic M, O’B Hourihane J, Lack G, Lau S, Matricardi PM, et al. Testing children for allergies: why, how, who and when. Pediatr Allergy Immunol. 2013: 24: 195-209.
5. Guía española para el manejo del asma. GEMA 4.2 En: Gemasma (en línea) (consultado el 01/10/2017). Disponible en www.gemasma.com.
6. Estrategia global para el manejo y prevención del asma. Informe GINA Global Initiative for Asthma. Global Strategy for Asthma Managenement and Prevention 2016. Revisión 2016. Disponible en http://ginasthma.org/wp-content/uploads/2016/04/GINA-2016-main-report_tracked.pdf.
7. Papadopoulos NG, Arakawa H, Carlsen K-H, Custovic A, Gern J, Lemanske R, et al. International consensus on (icon) pediatric asthma. Allergy. 2012; 67: 976-97.
8. Torres Borrego J, Fontán Domínguez M. Pruebas diagnósticas en Alergología Pediátrica. Protoc diagn ter pediatr. 2013; 1: 185-205.
9. Matricardi P, Kleine-Tebbe J, Hoffman HJ, Valenta R, Ollert M. Alergology from extracts to molecules: Integrating Tradition with innovation. En: Molecular Allergology user’s guide. Pediatr Allergy Immunol. 2016; 27: 3-9.
10. Roberts G, Ollert M, Aalberse R, Austin M, Custovic A, DunnGalvin A, et al. A new framework for the interpretation of IgE sensitization tests. Allergy. 2016; 71: 1540-51.
11. Díaz-Vázquez C, Torregrosa-Bertet MJ, Carvajal I, et al. Accuracy of ImmunoCAP Rapid in the diagnosis of allergic sensitization in children between 1 and 14 years with recurrent wheezing: The IReNE study. Pediatr Allergy Immunol. 2009.
12. Ridao Redondo M. Test de diagnóstico rápido para patología alérgica (ImmunoCAP Rapid). En: De la Flor J, Mares J. ed. Test de diagnóstico rápido en la consulta de Pediatra de Atención Primaria. Madrid. Ergón S.A. 2015. p 83-7.
13. Ridao Redondo M. Espirometría. En: De la Flor J, Mares J. ed. Utillaje diagnóstico en la consulta de Pediatría de Atención Primaria. Madrid. Ergón S.A. 2017. p. 33-48.