|
| Temas de FC |
L. Soriano Guillén
Servicio de Pediatría. Instituto de Investigación Sanitaria Fundación Jiménez Díaz.
Universidad Autónoma de Madrid.
Laboratorio de Lípidos. Instituto de Investigación Sanitaria Fundación Jiménez Díaz. Madrid
| Resumen
La pubertad es un periodo de transición entre la infancia y la vida adulta, regulada por complejos mecanismos biológicos que, a su vez, están controlados por la interacción entre redes nodales de genes y el ambiente. Aunque ha existido una notable tendencia secular en el inicio de la pubertad, desde el siglo XIX hasta mediados del siglo XX, esta se ha estabilizado en las últimas décadas. De esta forma, se define como pubertad normal aquella que acontece entre los ocho y los trece años en las niñas y entre los nueve y catorce en los niños. El principal signo físico a tener en cuenta para la valoración del desarrollo puberal, es la aparición de telarquia progresiva en las niñas y el incremento del tamaño testicular en los niños. Seguidamente, se desarrollarán otros caracteres sexuales secundarios y se objetivará un incremento de la velocidad del crecimiento. En el diagnóstico diferencial de trastornos de la pubertad, aparte de conocer los límites normales de la pubertad, deberemos tener en cuenta una serie de variantes de la normalidad, como son: la adrenarquia prematura idiopática, la telarquia prematura aislada, la pubertad adelantada y el retraso constitucional del crecimiento y pubertad. |
| Abstract
Puberty is a transition period between childhood and adulthood regulated by complex biological mechanisms, which in turn are controlled by the interaction between gene networks and environment. Although there has been a significant secular trend in onset of puberty from the XIX century to the mid XX century, it has been stabilized in recent decades. Thus, it is defined normal puberty as that occurs between eight and thirteen years old in girls and between nine and fourteen years old in boys. The main physical sign to be considered for assessment of pubertal development is the emergence of progressive thelarche in girls and increased testicular size in boys. Then, other secondary sexual characteristics will develop and increased growth velocity will be observed. In the differential diagnosis of puberty disorders, apart from knowing the normal limits of puberty, we must consider a number of variants of normality such as idiopathic premature adrenarche, premature thelarche, early puberty and constitutional delay of growth and puberty. |
Palabras clave: Pubertad normal; Pubertad adelantada; Telarquia prematura; Adrenarquia prematura idiopática; Retraso constitucional del crecimiento y desarrollo
Key words: Normal and early puberty; Idiopathic premature adrenarche; Premature thelarche; Constitutional delay of growth and puberty
Pediatr Integral 2015; XIX (6): 380-388
Pubertad normal y variantes de la normalidad
Pubertad normal y tendencia secular
La pubertad normal corresponde a un criterio estadístico, en la que como signo principal se tiene en cuenta la aparición de telarquia entre los 8 y 13 años en las niñas y el aumento de tamaño testicular entre los 9 y 14 años en los niños.
La pubertad es un fenómeno biológico complejo a través del cual se desarrollan los caracteres sexuales secundarios, se obtiene la maduración sexual completa y se alcanza la talla adulta. En los seres humanos, la pubertad se manifiesta no solamente en forma de cambios hormonales y físicos, sino también con cambios conductuales y psicológicos(1,2).
La definición de pubertad normal obedece a criterios puramente estadísticos; es decir, si la aparición de los caracteres sexuales secundarios se encuentran dentro del intervalo de +/–2,5 SDS (Z-score) para sexo y población de referencia. Así, se considera una pubertad normal la que acontece entre los 8 y 13 años en niñas y entre 9 y 14 años en niños(3,4).
El inicio de la pubertad en las niñas, lo marca la aparición de telarquia (aproximadamente entre los 10,5 y 11 años de media), frente al incremento del tamaño testicular (≥4 ml) observado en los niños (entre los 11,5 y 12 años de media). Seguidamente, de forma progresiva, se desarrollan el resto de caracteres sexuales secundarios en paralelo al incremento del ritmo de crecimiento (Tabla I).
A continuación, de forma resumida, se describen algunos hitos del periodo puberal(5,6):
• Duración global: el tiempo transcurrido entre el inicio del estadio puberal Tanner II hasta alcanzar el estadio puberal Tanner V es variable, pudiendo oscilar en la mayoría de ocasiones entre tres y cuatro años. Generalmente, este intervalo es menor en las niñas.
• Adrenarquia: la aparición de vello púbico y/o axilar es un fenómeno dependiente de la glándula suprarrenal y es independiente del eje hipotálamo-hipófisis-gónadas. En la mayoría de ocasiones, suele aparecer en los seis meses siguientes al inicio de la telarquia. No obstante, entre un 10-15% de las ocasiones, puede preceder a la telarquia.
• Menarquia: la primera menstruación suele presentarse unos dos años después de la aparición de la telarquia. Esta suele aparecer en el estadio puberal Tanner IV.
• El cambio de voz en el niño aparece en el estadio puberal Tanner IV. Con posterioridad, los niños se afeitan. Generalmente, el afeitado completo suele observarse en el estadio puberal Tanner V.
• Crecimiento: el pico máximo de crecimiento observado durante la pubertad es algo más temprano en las niñas, entre el estadio puberal Tanner II y III, precediendo a la menarquia. En los niños, esta aceleración de crecimiento se objetiva en el estadio puberal Tanner IV. Desde el comienzo de Tanner II hasta alcanzar la talla adulta, las niñas crecen entre unos 20 y 25 cm de media y los niños, aproximadamente, entre 28 y 30 cm. El remanente medio de crecimiento después de tener la menarquia oscila entre 6 y 8 cm, pudiéndose incrementar si la aparición de la primera menstruación ha sido más temprana.
Es preciso indicar, que ha existido una tendencia secular de disminución de la edad de inicio de la pubertad en niñas. Esta tendencia ha sido documentada a través de la recogida de información sobre la edad de la menarquia en el último siglo y medio. De esta forma, sabemos que la edad de la menarquia a mediados del siglo XIX se situaba entre los 16 y 17,5 años, para un siglo después, colocarse entre los 12,5 y 13,5 años. Este hallazgo ha sido relacionado con la mejoría en las condiciones de vida de niños y adolescentes, fundamentalmente en lo referente a aspectos nutricionales. No obstante, este adelanto de la edad de aparición de la pubertad parece haberse atenuado en las dos últimas décadas del siglo XX(2,7). Aun así, los límites de edad para definir los criterios de pubertad normal fueron cuestionados en la última década del siglo XX(8), tras la aparición de un estudio transversal americano que alarmó a la comunidad científica internacional(9), ya que consideraba como límite inferior del comienzo de la pubertad los 7 años. Es necesario reseñar, sin embargo, que este estudio presentaba importantes errores metodológicos. El principal de ellos fue que la estimación del estadio puberal a través de la evaluación del grado de telarquia se realizó por inspección y no por palpación. En consecuencia, los límites anteriormente citados para la definición de pubertad normal siguen vigentes para la comunidad científica internacional desde la primera década del siglo XXI.
Más recientemente, estudios epidemiológicos daneses han mostrado cierto adelanto en la aparición de telarquia que no se acompaña de incrementos de los niveles de estradiol ni de gonadotropinas ni de un anticipo en la edad de la menarquia, sugiriendo un mecanismo gonadotropín-independiente relacionado con el ambiente, la nutrición y con mayor biodisponibilidad y/o sensibilidad a los estrógenos circulantes(7). Aunque este hallazgo debe corroborarse con estudios multicéntricos, en el que participen distintos países, parece que el intervalo entre telarquia y menarquia se prolonga, y deberemos tenerlo presente a la hora de emitir predicciones sobre la evolución de la pubertad.
Fisiología de la pubertad
Neurorregulación de la pubertad
La pubertad es un fenómeno biológico muy complejo, controlado por redes nodales de genes, que comienza tras el incremento de la secreción de hormona liberadora de gonadotropinas (GnRH). En este incremento de secreción, están implicados cambios transinápticos y gliales.
El inicio de la pubertad es el resultado final de la interacción entre importantes determinantes genéticos y un gran número de factores reguladores que incluyen diferentes elementos endógenos y señales ambientales, como: la disponibilidad de nutrientes, disruptores endocrinos ambientales y los ciclos de luz/oscuridad. Estas interacciones se inician en etapas tempranas del desarrollo, por lo que la pubertad puede considerarse el punto final de un proceso madurativo constituido por las interacciones dinámicas de genes y ambiente. Así, se estima que entre el 70-80% de la variabilidad en la edad de la menarquia, elemento clave del desarrollo puberal de las niñas, dependería de factores genéticos, frente a un 20-30% de factores ambientales(1,2,10).
Desde una perspectiva neurobiológica, ya desde hace dos décadas, se ha propuesto que el fenómeno final que pone en marcha la pubertad es el aumento en el número y en la amplitud de los picos de secreción de hormona liberadora de gonadotropinas (GnRH), por parte de las neuronas hipotalámicas productoras de GnRH, que conlleva un aumento en la secreción de gonadotropinas y, consecuentemente, de esteroides sexuales, favoreciendo, entre otros cambios, el desarrollo de los caracteres sexuales secundarios. Ahora bien, ¿qué regula este aumento de la secreción y pulsatilidad de GnRH?(10).
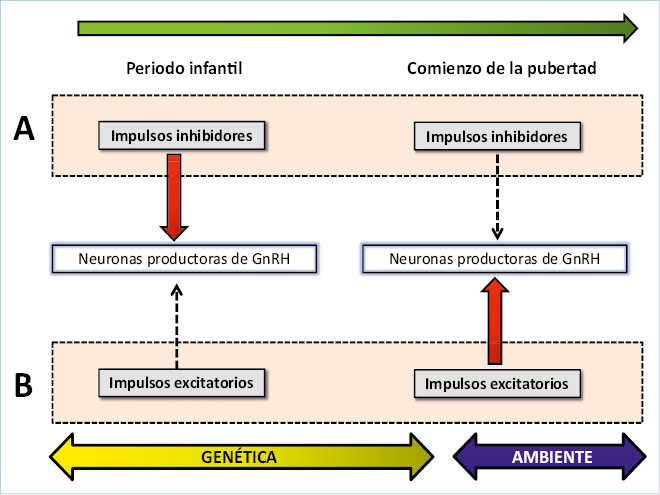
Tradicionalmente, se hablaba de dos teorías sobre el inicio y mantenimiento de la pubertad, merced a un predominio de estímulos inhibitorios o excitatorios, que a su vez, estarían regulados por factores genéticos y ambientales (Fig. 1).
Figura. 1. A. La secreción de GnRH estaría tónicamente reprimida durante la niñez por estímulos trans-sinápticos inhibitorios. De acuerdo a esta hipótesis, la pubertad se iniciaría en paralelo a la pérdida del estímulo inhibitorio. B. La secreción de GnRH durante la niñez estaría disminuida, debido a la falta de impulsos excitatorios sobre las neuronas secretoras de GnRH y la pubertad se iniciaría por un incremento de estos pulsos excitatorios.
En los últimos años, Ojeda y colaboradores(10) postulan que la neurorregulación de la pubertad depende de redes nodales de genes que codifican proteínas cuyas acciones se solapan e interaccionan, tanto de una forma jerárquica como independiente. De esta manera, se piensa que hay unos centros de actividad (hubs), compuestos por varios genes que previamente se habían relacionado con formación/represión de tumores (red central TGR: CDP/CULT1/CUX1, MAF, p53, YY1, USF2). Estos genes del centro de la red interactuarían entre ellos y, a su vez, regularían la transcripción de genes subordinados localizados en la periferia: regularían una primera red periférica de genes, que a su vez, interaccionaría con una segunda y tercera red nodal de genes. Lógicamente, la interrelación entre el eje central y la primera red de genes vecinos es superior al resto de redes. En esta periferia de redes nodales de genes, por ejemplo, se encuentran más de 20 genes relacionados con la edad de la menarquia, descubiertos mediante la realización de estudios de asociación de genoma completo (GWAS).
Por otra parte, junto al sistema de regulación transcripcional antes descrito, recientemente se ha descubierto un sistema de control postranscripcional que contribuye a la regulación del inicio de la pubertad, merced a un efecto inhibitorio. La red central de este sistema la constituye el gen LIN28b, que previamente, en estudios GWAS, había sido relacionado con la edad de la menarquia. En definitiva, la pubertad no es un evento desencadenado por la acción de un único gen.
La puesta en marcha de la pubertad, regulada por la red nodal de genes antes descrita, conlleva cambios en circuitos neuronales del núcleo arcuato del hipotálamo(10):
• Cambios transinápticos:
– Incremento de estímulos excitatorios de las neuronas secretoras de GnRH: vía glutamato y, fundamentalmente, vía kisspeptina.
– Disminución de los estímulos inhibitorios: neuronas gabaérgicas, neuronas productoras de sustancias opioides y neuronas productoras de péptido relacionado con RFamide [ortólogo mamífero del péptido inhibidor de gonadotropinas (GnIH)].
• Cambios en células gliales: las células gliales contribuyen a la activación de la secreción de GnRH por dos mecanismos relacionados. Uno es a través de la liberación de factores de crecimiento que actúan sobre receptores de las neuronas GnRH [factor de crecimiento transformador tipo b (TGFb), factor de crecimiento epidérmico (EGF) y factor de crecimiento similar a la insulina tipo 1 (IGF-1)]. El segundo mecanismo implica cambios en la adhesividad de las células gliales sobre las neuronas GnRH, a través de la molécula de adhesión celular tipo 1 (SynCAM1) y del receptor tipo de la proteína tirosinfosfatasa b (RPTPb).
El descubrimiento del sistema kisspeptina/receptor de kisspeptina ha permitido un avance espectacular en el conocimiento de la regulación de la secreción de GnRH. Estudios recientes han mostrado que las kisspeptinas, familia de neuropéptidos secretados por neuronas hipotalámicas, son factores esenciales en la regulación de las neuronas productoras de GnRH, ya que estas últimas neuronas expresan receptores para kisspeptina. Además, las neuronas productoras de kisspeptinas presentan un mecanismo de retroalimentación negativo por parte de los estrógenos. Por todo ello, esta familia de péptidos ha emergido como un factor primordial en la regulación de la pubertad(11).
Finalmente, en el conocimiento más profundo de la neurorregulación de la pubertad, resulta de sumo interés el estudio de la interacción entre genes y ambiente(10). Así, en los próximos años, se avanzará notablemente en la comprensión de la influencia de mecanismos epigenéticos (cambios en la expresión de distintos genes, no debidos a cambios de la secuencia de nucleótidos de un gen) sobre el normal desarrollo puberal. De esta forma, a día de hoy, existen varias líneas de investigación, de las que cabría destacar:
• Cambios epigenéticos relacionados con alteración del estado nutricional desde etapas tempranas de la vida.
• Influencia del ritmo circadiano y horas de luz sobre mecanismos epigenéticos.
• Disruptores endocrinos ambientales, fundamentalmente pesticidas, que pudieran influir sobre distintas alteraciones epigenéticas.
Estado nutricional y pubertad
Existe una vinculación muy estrecha entre metabolismo y reproducción, merced a señales periféricas que informan del estado nutricional al cerebro. Así, la obesidad se relaciona con adelanto puberal y la desnutrición se vincula con retraso puberal.
Desde hace tiempo, se apunta al tejido adiposo y al estado nutricional como factores determinantes del inicio y mantenimiento de la pubertad, siendo más evidente en niñas que en niños(12,13). Entre otros factores, se conoció, en primer lugar, la necesidad de alcanzar un peso crítico para la aparición de la edad de la menarquia y, con posterioridad, se demostró la relevancia de un mínimo de masa grasa corporal. A continuación, paralelamente a la constatación de la existencia de un incremento del grado de adiposidad a lo largo de la infancia, se mostró una relación inversa entre el estado nutricional y el tiempo de desarrollo puberal. Más recientemente, se ha sugerido que péptidos sintetizados en el tejido adiposo pudieran desempeñar un importante papel como enlaces entre el estado nutricional y la reproducción. Así, es indiscutible el papel desempeñado por la leptina, a la que se ha señalado con un factor favorecedor del desarrollo puberal. Menos clara es la implicación atribuible a adiponectina en el desarrollo puberal, aunque se especula que su papel en la regulación de la sensibilidad a la insulina pudiera ser importante en la maduración del eje reproductor.
Por otra parte, el péptido ghrelina, sintetizado principalmente en las células oxínticas del estómago, factor orexígeno y relacionado con el estado metabólico, ha sido también, relacionado con la reproducción, ya que parece desempeñar un papel inhibitorio sobre la secreción de hormona liberadora de gonadotropinas, merced al estímulo que ejerce sobre neuronas hipotalámicas productoras de neuropéptido Y. Además, contrariamente a lo que ocurre con leptina, se ha observado una reducción progresiva de los niveles de ghrelina a lo largo de la pubertad, lo que sugiere un papel permisivo sobre el inicio de la pubertad.
Ahora bien, ¿cómo es posible explicar que sustancias sintetizadas en tejidos periféricos como el tejido adiposo o en el intestino puedan influir en la neurorregulación de la pubertad, máxime, si tenemos en cuenta que las neuronas productoras de GnRH no expresan receptores para leptina ni adiponectina ni ghrelina? Pues bien, es ahí donde surge el papel de kisspeptina, ya que el sistema kisspeptina-receptor de kisspeptina es el mayor estimulador del sistema GnRH/gonadotropinas conocido hasta el momento. Los descubrimientos relacionados con este sistema nos han mostrado que las neuronas productoras de kisspeptina se encuentran en el núcleo arcuato y anteroventral periventricular hipotalámicos y presentan receptores de leptina, sugiriendo un nexo entre metabolismo y reproducción. En esta línea, también se ha demostrado una disminución de la expresión hipotalámica de kisspeptina en modelos animales de desnutrición por insuficiente aporte calórico.
Desde el punto de vista clínico, en el ámbito de la Pediatría, hay dos entidades de elevada prevalencia, obesidad y anorexia nerviosa, que afectan al metabolismo y que tienen consecuencias sobre la pubertad. El exceso de peso tiene una elevada prevalencia en la población infanto-juvenil y entre los riesgos que conlleva en la infancia destaca el adelanto puberal entre las niñas obesas(12). Por otra parte, la anorexia nerviosa es una patología psiquiátrica crónica en la que existe una distorsión de la imagen corporal, que provoca una pauta alimentaria restrictiva/purgativa, disminuyendo notablemente la ingesta calórica, produciendo disminución del IMC y de la masa grasa corporal. Esta situación de malnutrición crónica favorece la aparición de hipogonadismo hipogonadotropo. Este hecho condiciona, en función de la edad de inicio del trastorno, las siguientes consecuencias: retraso puberal, pubertad enlentecida y amenorrea primara o secundaria(14).
Desde hace años, se ha investigado la influencia de la etapa fetal en la vida adulta, sobre todo, en lo referente al recién nacido pequeño para la edad gestacional (PEG), definido como: recién nacido cuyo peso y/o longitud se sitúa por debajo de 2 SDS (Z-score) para la edad gestacional y sexo, según tablas de referencia poblacionales. Una de las líneas surgida de la investigación sobre la repercusión en la vida adulta de los recién nacidos PEG, ha sido la relativa a la influencia sobre la pubertad. Así, parece ser que niñas con el antecedente de PEG y, especialmente aquellas que han experimentado un rápido crecimiento recuperador y ganancia ponderal, parecen más expuestas a presentar adrenarquia prematura, adelanto puberal y síndrome de ovario poliquístico. No obstante, no todos los estudios han demostrado la evolución anteriormente descrita, por lo que se antoja necesario plantear el diseño de estudios prospectivos que evalúen la evolución de los recién nacidos PEG hasta el final de la adolescencia(15).
Historia clínica de utilidad en la valoración del desarrollo puberal
Anamnesis
Historia reciente: describir detalladamente la secuencia de aparición de posibles caracteres sexuales secundarios.
• Niña: aparición de telarquia, si esta es fluctuante o progresiva, unilateral o bilateral. Si ha notado incremento de la sensibilidad en el área de la areola. ¿Ha aparecido pubarquia y/o axilarquia? ¿Ha precedido o ha sido posterior a la telarquia? Valorar la curva de crecimiento, ¿ha existido aceleración del mismo?
• Niño: precisar si han notado aumento del tamaño testicular (valorando incremento de la bolsa escrotal) y desde cuando. ¿Son los testículos simétricos? ¿Han notado incremento del tamaño del pene? ¿Ha aparecido pubarquia y/o axilarquia? Evaluar la curva de crecimiento.
Antecedentes familiares: en primer lugar, descartar consanguinidad. Seguidamente, solicitar datos sobre raza y país de origen de los padres. A continuación, demandar información sobre talla de los progenitores y cálculo de talla genética, para comparar con los percentiles de talla de su hijo. Recoger datos sobre el desarrollo puberal de los padres (menarquia de la madre, edad de afeitado del padre, entre otros). Asimismo, resulta de interés conocer antecedentes entre las mujeres de síndrome de ovario poliquístico (SOP) e hirsutismo.
Antecedentes personales: embarazo, parto y datos antropométricos perinatales. En el supuesto de antecedente de bajo peso para edad gestacional, es necesario conocer si ha tenido un adecuado crecimiento recuperador o, si por el contrario, no lo ha realizado y ha precisado tratamiento con hormona de crecimiento. También es importante conocer si es adoptado y el tiempo que lleva en España. Interrogar por la presencia de patología crónica. Recoger datos sobre estado nutricional y grado de actividad física, así como de distorsión de imagen corporal. Otro dato que resulta de interés para la valoración de la patología puberal por retraso, es la existencia de alteración del sentido del olfato.
Examen físico
Inspección: fenotipo, bocio, lesiones cutáneas (manchas café con leche, acné, estrías), incremento del vello corporal, telarquia/adipomastia, aumento del tamaño de la bolsa escrotal, aumento del tamaño del pene, presencia de pubarquia/axilarquia.
Palpación: distinguir entre posible telarquia versus adipomastia, tamaño y simetría testicular, posibilidad de bocio, visceromegalias.
Recogida de datos: peso (kg, percentil, SDS), talla (cm, percentil, SDS), índice de masa corporal (valor absoluto, percentil, SDS), velocidad de crecimiento (cm/año, percentil, SDS) y tensión arterial. Si es preciso, calcular otros índices nutricionales.
Describir estadio puberal de Tanner (Tabla I): de I a V con subapartados:
a. Niñas:
• S (seno) o T (telarquia) de 1 a 5. Su puntuación es la que va a indicar el estadio Tanner.
• P (pubarquia) de 1 a 5.
• A (axilarquia): a (sin vello), b, c.
b. Niños:
• P (pubarquia) de 1 a 5. Junto con la evolución del tamaño del pene, marcará el estadio puberal de Tanner.
• A (axilarquia): a, b, c.
• Tamaño testicular mediante orquidómetro de Prader:
– <4 ml: prepuberal (Tanner I).
– ≥4 ml: inicio de la pubertad (Tanner II).
– ≥8 ml: generalmente coincide con Tanner III, aunque lo marca el crecimiento del pene y la pubarquia.
– ≥12 ml: generalmente coincide con Tanner IV.
– ≥18-20 ml: la mayoría de ocasiones coincide con Tanner V.
Variantes de la normalidad (ver algoritmo al final del artículo)
En el diagnóstico diferencial de la patología puberal, deberemos tener en cuenta unas entidades que se consideran variantes del desarrollo puberal normal: adrenarquia prematura idiopática, telarquia prematura aislada, pubertad adelantada y retraso constitucional del crecimiento y desarrollo.
Adrenarquia prematura idiopática
Se define como la aparición de vello púbico y/o axilar y/o aumento del olor corporal (olor apocrino) antes de los 8 años en niñas y de los 9 años en niños, una vez excluidas otras patologías de semiología similar(15).
Presenta un claro predominio femenino (relación 9:1) y se caracteriza por ser un fenómeno independiente de la pubertad. Por tanto, no se acompaña de desarrollo mamario en las niñas, ni de aumento del volumen testicular o del pene en los niños. Asimismo, no suele observarse una aceleración brusca del crecimiento, aunque la talla suele estar por encima de la talla diana. Por otra parte, es frecuente que la edad ósea se encuentre ligeramente adelantada con respecto a la edad cronológica.
Aún se desconoce la causa exacta de esta activación temprana de la funcionalidad de la glándula suprarrenal, que conlleva un aumento de la síntesis de dehidroepiandrostendiona sulfato en la zona reticularis. Algunos estudios poblacionales han mostrado mayor prevalencia de adrenarquia prematura en niñas con antecedentes de bajo peso para la edad gestacional.
La adrenarquia prematura idiopática es un diagnóstico de exclusión, existiendo dos entidades con semiología clínica parecida que debemos descartar:
• Hiperplasia suprarrenal congénita (HSR) de presentación tardía.
• Patología tumoral productora de andrógenos (origen ovárico o suprarrenal).
Por tanto, siempre deben derivarse a estos niños/as de Atención Primaria a Especializada. Para facilitar la orientación diagnóstica, es de suma utilidad aportar gráficas de crecimiento, así como la realización de una edad ósea.
Estas niñas, no requieren tratamiento, aunque es recomendable realizar seguimientos periódicos hasta el final de la pubertad; ya que, los datos disponibles de distintas investigaciones sobre las consecuencias a largo plazo de la adrenarquia prematura idiopática no son unánimes. Por ello, se necesitan más estudios longitudinales multicéntricos (englobando distintas áreas geográficas) para evaluar la talla final de estas pacientes, así como el porcentaje de niñas que desarrolla síndrome de ovario poliquístico, obesidad y alteraciones metabólicas.
Telarquia prematura aislada
Se define como el desarrollo mamario uni o bilateral antes de los 8 años, sin evidencia de otros signos de pubertad precoz como aceleración del crecimiento, edad ósea incrementada y aparición de vello púbico y/o axilar(16,17).
Es una entidad relativamente frecuente, con una incidencia aproximada de hasta 21,2 casos por 100.000/año. En la mayoría de ocasiones, aparece antes de los 2 años y tiende a la regresión espontánea. El otro pico de presentación se sitúa entre los 5 y 7 años, y es en estas situaciones, donde se han descrito mayor probabilidad de evolucionar a un cuadro de pubertad precoz central. Algunas series cifran esta probabilidad hasta en un 14%.
La etiología es desconocida, considerándose diferentes teorías:
• Activación transitoria parcial del eje hipotálamo-hipofisario-gonadal con aumento de FSH.
• Fallo de la involución folicular con o sin formación ovárica quística.
• Sensibilidad excesiva del tejido mamario a la misma cantidad de estrógenos.
• Contaminantes ambientales (disruptores endocrinos) con actividad estrogénica.
• Formas incompletas de síndrome de McCune-Albright en telarquias prematuras exageradas.
La telarquia prematura aislada suele ser un proceso autolimitado que tiende a la regresión espontánea. Por tanto, en la mayoría de ocasiones, no precisa de estudios complementarios y puede controlarse en Atención Primaria, vigilando estrechamente si la telarquia es progresiva, si existe aceleración del crecimiento y si aparece pubarquia/axilarquia. Tendremos especial precaución en el seguimiento de niñas en las que aparece telarquia por encima de los 2 años, ya que es en este grupo donde se ha documentado mayor probabilidad de evolución hacia una activación central de la pubertad.
No es preciso tratar a estas pacientes, aunque es recomendable realizar seguimientos periódicos hasta la desaparición de la telarquia. En el caso de no regresar, se recomienda seguimiento hasta los 8-9 años, momento en el que el inicio de la pubertad es normal.
Pubertad adelantada
Variante de la normalidad, en la que el desarrollo puberal se inicia entre los ocho y los nueve años en las niñas y entre los nueve y diez años en los niños(17). La etiología puede ser muy diversa. En esta revisión, presentamos algunos de los ejemplos más representativos:
1. Aceleración constitucional del crecimiento y desarrollo: son niños/as con antecedentes familiares de pubertad temprana y que ya, desde la etapa preescolar, se sitúan en percentiles elevados de talla (>percentil 90-97), generalmente, por encima de la talla diana. Asimismo, hasta la aparición temprana de la pubertad, presentan adelanto de la maduración ósea, con una velocidad de crecimiento en percentiles elevados para edad y sexo de las tablas de referencia. Con el inicio de la pubertad, se objetiva un incremento de la velocidad de crecimiento, situándose muy por encima del percentil 97, puesto que el pico de velocidad de crecimiento se adelanta al compararlo con niños/as de la misma edad. Estos niños/as terminan su crecimiento antes que el resto y suelen alcanzar una talla acorde con la talla genética.
2. Obesidad: entre las niñas hay mayor riesgo de adelanto puberal, particularmente en aquellas niñas que incrementan notablemente su índice de masa corporal a partir de los seis años. Por tanto, en el seguimiento de las niñas obesas, deberemos vigilar la posibilidad de adelanto puberal teniendo en consideración que, en ocasiones, es muy difícil el diagnóstico diferencial entre verdadera telarquia y adipomastia.
3. Adopción: las niñas adoptadas presentan mayor riesgo de pubertad precoz y pubertad adelantada que las niñas autóctonas del país. Deberemos fijarnos con detalle en el desarrollo temprano de los caracteres sexuales secundarios, en las valoraciones periódicas de estas niñas.
4. Antecedente de PEG: en fase de investigación. No obstante, conviene revisar periódicamente en estos pacientes, la posible relación con adelanto puberal, tanto en los que tuvieron un rápido crecimiento recuperador, como aquellos que no lo realizaron y reciben terapia con hormona de crecimiento.
Debe plantearse el diagnóstico diferencial con una pubertad precoz. Aunque como hemos comentado anteriormente, existe un criterio estadístico claro que define pubertad precoz y pubertad adelantada.
Estos niños y niñas pueden manejarse en Atención Primaria, puesto que no es necesaria la realización de pruebas complementarias específicas, ni la instauración de un tratamiento frenador de la pubertad, debido a que no existe evidencia científica suficiente que avale su utilidad para mejorar el pronóstico de talla final. No obstante, valoraremos derivaciones a Atención Especializada ante:
• Importante ansiedad familiar.
• Situaciones de pubertad adelantada rápidamente progresiva, en el que pudiera verse afectada el pronóstico de talla final.
Retraso constitucional del crecimiento y pubertad (RCCP)
Variante de la normalidad que se manifiesta en las niñas por ausencia de telarquia, a partir de los 13 años y, en los niños, por no objetivarse incremento del tamaño testicular (≥4 ml), a partir de los 14 años. Constituye la causa más frecuente de retraso puberal, aproximadamente un 65% de los casos en niños y un 35% de las niñas(18-20).
Aunque se desconoce la etiología del RCCP, se concede un papel primordial al componente genético, puesto que hasta, en un 75% de las ocasiones, existen antecedentes familiares. El patrón de herencia suele ser dominante con un grado penetrancia variable. Pese a ello, hasta la fecha, no se ha documentado ninguna alteración genética causante de RCCP.
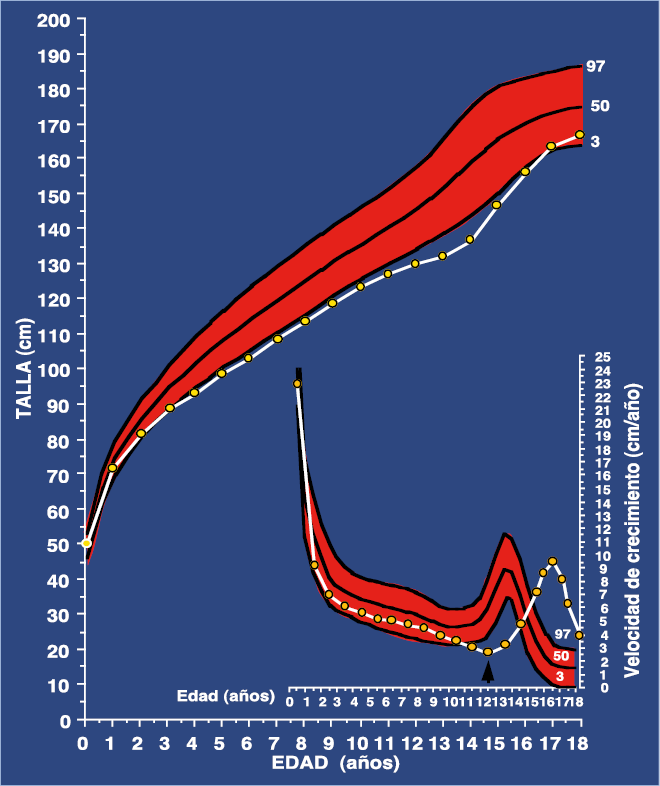
Estos niños/as se caracterizan por presentar unos datos antropométricos perinatales normales, con posterior desaceleración de la velocidad de crecimiento, generalmente, a partir de los 18 meses de vida, que les hace situar su talla por debajo del percentil tres, entre los dos y tres años de edad. A veces, la talla se encuentra entre percentil tres y diez o entre diez y veinticinco, pero marcadamente por debajo de su talla genética. A partir de ese momento, su velocidad de crecimiento adquiere un ritmo adecuado y la talla progresa paralelamente al percentil tres (Fig. 2).
Figura. 2. Curva de crecimiento de un niño con Retraso Constitucional del Crecimiento y Pubertad.
La realización de una edad ósea muestra un retardo de la misma con respecto a la edad cronológica, que con frecuencia es superior a dos años. A la edad correspondiente a un inicio normal de la pubertad, sufren una desaceleración del crecimiento, puesto que su ritmo de crecimiento es prepuberal; es decir, presentan mayor depresión prepuberal que los niños/as con un inicio normal de la pubertad. En ocasiones, este ritmo de crecimiento puede ser incluso inferior a 3 cm/año. Así pues, su curva de talla se aleja del percentil tres. Seguidamente, comienzan tardíamente la pubertad. Llegados a este punto, es preciso destacar que el pico de velocidad de crecimiento observado en estos niños/as, no es tan acentuado como en sujetos con pubertad normal. Finalmente, en la mayoría de casos, suelen alcanzar una talla normal acorde con su talla genética.
El RCCP entra en el diagnóstico diferencial con otras etiologías causantes de retraso puberal (ver capítulo correspondiente) y constituye un diagnóstico de exclusión. Por tanto, la anamnesis y el examen físico deben ser minuciosos y, en no pocas ocasiones, puede ser necesaria la realización de pruebas complementarias. Por ello, es aconsejable su derivación a Atención Especializada. A pesar de ello, con cierta frecuencia, solo el tiempo nos permitirá comprobar si se trata de un verdadero RCCD. Como datos sugestivos de esta variante de la normalidad, tomaremos en consideración:
• Existencia de antecedentes familiares.
• Ser niño.
• Curva de crecimiento antes descrita (Fig. 2).
• Retraso de edad ósea.
• Ausencia de adrenarquia.
• Sin antecedentes de criptorquidia ni micropene ni anosmia.
Normalmente, no requieren tratamiento médico, sin embargo, en aquellas situaciones en las que exista repercusión psicológica, puede ser aconsejable la administración de esteroides sexuales, ya sea testosterona, ya sea 17-β-estradiol, en ciclos de tres a seis meses con el propósito de favorecer el desarrollo de los caracteres sexuales secundarios y, de esta forma, mitigar, al menos en parte, las alteraciones psicológicas derivadas del retraso puberal.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Cartault A, Edouard T, Pienkowski C, Tauber M. Normal puberty. Rev Prat. 2008; 58: 1311-6.
2.*** Parent AS, Teilmann G, Juul A, Skakkebaek NE, Toppari J, Bourguignon JP. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev. 2003; 668-93.
3.** Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in girls. Arch Dis Child. 1969; 44: 291-303.
4.** Marshall WA, Tanner JM. Variations in the pattern of pubertal changes in boys. Arch Dis Child. 1970; 45: 13-24.
5.*** Rodríguez Hierro F. Pubertad normal. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (1ª edición). Madrid: Edimsa; 1995. p. 679-88.
6.** Basdemir D, Rogol AD. Maduración puberal. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (2ª edición). Madrid: Doyma; 2000. p. 843-66.
7.*** Sørensen K, Mouritsen A, Aksglaede L, Hagen CP, Mogensen SS, Juul A. Recent secular trends in pubertal timing: implications for evaluation and diagnosis of precocious puberty. Horm Res Paediatr. 2012; 77: 137-45.
8. Kaplowitz PB, Oberfield SE. Reexamination of the age limit for defining when puberty is precocious in girls in the United States: implications for evaluation and treatment. Pediatrics. 1999; 104: 936-41.
9. Herman-Giddens ME, Slora EJ, Wasserman RC, et al. Secondary sexual characteristics and menses in young girls seen in office practice: a study from the Pediatric Research in Office Settings Network. Pediatrics. 1997; 99: 505-12.
10.*** Lomniczi A, Wright H, Ojeda SR. Epigenetic regulation of female puberty. Front Neuroendocrinol. 2015; 36C: 90-107.
11.** Castellano JM, Tena-Sempere M. Metabolic regulation of Kisspeptin. Adv Exp Med Biol. 2013; 784: 363-83.
12.*** Kaplowitz PB. Link between body fat and the timing of puberty. Pediatrics. 2008; 121: S208-17.
13.** Sánchez-Garrido MA, Tena-Sempere M. Metabolic control of puberty: roles of leptin and kisspeptins. Horm Behav. 2013; 64: 187-94.
14.** Muñoz MT, Argente J. Anorexia nervosa in female adolescents: endocrine and bone mineral density disturbances. Eur J Endocrinol. 2002; 147: 275-86.
15.*** Williams RM, Ward CE, Hughes IA. Premature adrenarche. Arch Dis Child. 2012; 97: 250-4.
16.*** Codner E, Román R. Premature thelarche from phenotype to genotype. Pediatr Endocrinol Rev. 2008; 5: 760-5.
17. Cassorla F, Codner E. Pubertad precoz y adelantada. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (2ª edición). Madrid: Doyma; 2000. p. 867-81.
18. Rodríguez Hierro F. Pubertad retrasada e hipogonadismos. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (2ª edición). Madrid: Doyma; 2000. p. 883-911.
19.** Harrington J, Palmert MR. Distinguishing constitutional delay of growth and puberty from isolated hypogonadotropic hypogonadism: critical appraisal of available diagnostic tests. J Clin Endocrinol Metab. 2012; 97: 3056-67.
20.*** Palmert MR, Dunkel L. Delayed puberty. N Engl J Med. 2012; 366: 443-53.
Bibliografía recomendada
– Parent AS, Teilmann G, Juul A, Skakkebaek NE, Toppari J, Bourguignon JP. The timing of normal puberty and the age limits of sexual precocity: variations around the world, secular trends, and changes after migration. Endocr Rev. 2003; 668-93.
Excelente revisión sobre los límites normales de la pubertad, la evolución de la tendencia secular en distintos países del mundo y la influencia de factores ambientales sobre el normal desarrollo puberal.
– Rodríguez Hierro F. Pubertad normal. En: Argente Oliver J, Carrascosa Lezcano A, Gracia Bouthelier R, Rodríguez Hierro F, ed. Tratado de Endocrinología Pediátrica y de la Adolescencia (1ª edición). Madrid: Edimsa; 1995. p. 679-88.
Capítulo de la primera edición de un Tratado de Endocrinología Infantil de enorme prestigio y difusión, en el que se describe de forma muy minuciosa y didáctica todos los cambios físicos que acontecen a lo largo del desarrollo puberal.
– Lomniczi A, Wright H, Ojeda SR. Epigenetic regulation of female puberty. Front Neuroendocrinol. 2015; 36C: 90-107.
Puesta al día de los conocimientos adquiridos sobre el complejo mecanismo de regulación del inicio y mantenimiento de la pubertad. Este grupo de autores es pionero en la investigación de la neurorregulación de la pubertad, destacando sus aportaciones sobre los mecanismos genéticos y epigenéticos implicados en el inicio y mantenimiento de la pubertad.
– Williams RM, Ward CE, Hughes IA. Premature adrenarche. Arch Dis Child. 2012; 97: 250-4.
Magnífica revisión sobre la etiopatogenia, abordaje diagnóstico, evolución y seguimiento de la adrenarquia prematura idiopática. Analiza de forma concienzuda, estudios procedentes de distintos países sobre la etiología y evolución a largo plaza de niños/as con adrenarquia prematura.
– Palmert MR, Dunkel L. Delayed puberty. N Engl J Med. 2012; 366: 443-53.
Actualización muy didáctica sobre el retraso puberal, con un apartado especial dedicado al retraso constitucional del crecimiento y pubertad: epidemiología, carga familiar, diagnóstico diferencial y orientación terapéutica.
| Caso clínico |
|
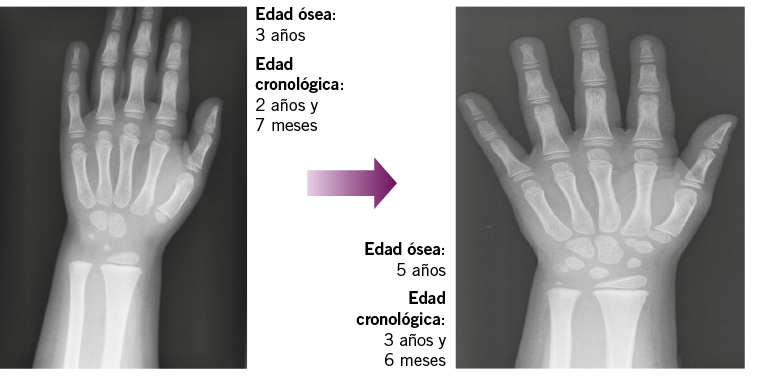
Historia reciente: niña que, desde aproximadamente los dos años y cuatro meses, presentaba telarquia izquierda, sin molestias locales ni cambios de pigmentación de areola. Dicha telarquia era fluctuante, no progresiva. A los dos años y nueve meses aparece telarquia derecha. Por otra parte, no presentaba ni pubarquia ni axilarquia ni aceleración del crecimiento, así como tampoco ningún episodio de sangrado vaginal. Antecedentes: como antecedentes familiares, destaca que la madre tuvo la menarquia a la edad de 9 años y el desarrollo puberal del padre fue normal. La talla diana es de 168 cm (p90). Sobre los antecedentes personales, hay que indicar que el embarazo fue de curso normal y el parto ocurrió a las 39 semanas de edad gestacional, con un peso y longitud de recién nacido dentro de percentiles normales (PRN 3.200 gramos; LRN 50 cm). No presentó telarquia en el periodo neonatal. Examen físico A los dos años y diez meses, mostraba un peso de 15,2 kg (percentil 75-90) y una talla de 98 cm (percentil 90-97). No presentaba lesiones cutáneas reseñables y la exploración abdominal fue normal. Presentaba genitales externos femeninos normales y era reseñable la presencia de telarquia izquierda de 1 x 1 cm y derecha de 1,5 x 2 cm. Por otra parte, no se objetiva pubarquia ni axilarquia. Pruebas complementarias iniciales A los dos años y sietes meses, se solicitó una edad ósea que correspondía a tres años (Fig. 3). A los dos años y diez meses, se realizó una ecografía pélvica que mostraba los siguientes datos: a) tamaño uterino de 20 mm (rango prepuberal); b) relación cuello fundus de 1/1 (rango prepuberal); c) sin línea endometrial (hallazgo prepuberal); d) volumen de ovario izquierdo de 1,7 cc y derecho de 1,8 cc (rangos prepuberales). Evolución A los tres años y seis meses, mostraba una talla de 106,2 cm (percentil >97/ + 2,36 SDS), es decir, se había objetivado una aceleración franca de la velocidad de crecimiento (ocho centímetros en ocho meses) y, paralelamente, la telarquia había progresado notablemente (telarquia izquierda de unos 3 x 2 cm, telarquia derecha de unos 3 x 3 cm). En ese momento, la edad ósea era de 5 años, objetivando un avance notable respecto a la previa (Fig. 3). Figura. 3. Evolución de las edades óseas realizadas a la paciente y descrita en el caso clínico. |