|
| Temas de FC |
J. Pericas Bosch
Pediatra. CAP La Mina. Sant Adrià de Besòs. Barcelona
| Resumen
Se define la neumonía como la presencia de fiebre y/o síntomas respiratorios de presentación aguda junto a la evidencia de infiltrado parenquimatoso en la radiografía torácica. La mayor parte se adquieren en la comunidad y en su mayoría podrán ser diagnosticadas, tratadas y controladas en el ámbito de la Atención Primaria. El diagnóstico, esencialmente clínico, suele confirmarse mediante la radiología de tórax. Habitualmente, no dispondremos de diagnóstico etiológico cierto sin medios diagnósticos complejos de los que no suele disponerse en Atención Primaria. Pese a ello, normalmente podrá tratarse ambulatoriamente con un antibiótico oral elegido empíricamente según la etiología más probable en cada caso, que depende, sobre todo, de la edad del paciente. Este antibiótico oral será casi siempre un betalactámico, principalmente amoxicilina, o un macrólido. |
| Abstract
Pneumonia is defined as the presence of fever and/or respiratory symptoms of acute presentation next to the evidence of parenchymal infiltration evidence on the chest radiography. Most of them are community acquired and can be diagnosed, treated and followed in primary care settings. The diagnosis, essentially clinical, is usually confirmed by chest radiology. Habitually we will not have a true etiological diagnosis without complex diagnostic means, usually not available in primary care. Nevertheless, it can normally be treated as outpatients with an empirically chosen oral antibiotic according to the most likely etiology in each case, which mostly depends on the age of the patient. This oral antibiotic is usually a beta-lactam, mainly amoxicillin, or a macrolide. |
Palabras clave: Neumonía; Neumonía adquirida en la comunidad; Derrame pleural; Empiema; Neumonía recurrente; Neumonía persistente.
Key words: Pneumonia; Community-acquired pneumonia; Pleural effusion; Empyema; Recurrent pneumonia; Persistent pneumonia.
Neumonía y neumonía recurrente
Neumonía
La neumonía es un proceso relativamente frecuente en la infancia, consistente en inflamación del parénquima pulmonar. La infección es, con mucho, la causa más frecuente. Definimos la neumonía como: la presencia de fiebre y/o síntomas respiratorios de presentación aguda junto con la evidencia de infiltrado parenquimatoso pulmonar en la radiografía de tórax. La mayoría se adquieren en la comunidad, fuera del hospital, y habitualmente podrán ser también diagnosticadas, tratadas y controladas en el ámbito de la Atención Primaria. La neumonía adquirida en la comunidad (NAC) es la que se descubre en un paciente que no ha estado hospitalizado en los últimos 7 días o que se presenta en las primeras 48 horas tras su hospitalización.
Entendemos por bronconeumonía, la infección en la que participan varios focos diseminados en uno o ambos pulmones. La bronconeumonía es más frecuente en lactantes, por su inmadurez inmunológica; mientras que, en niños mayores suele presentarse tras enfermedades víricas que afectan a los mecanismos inmunológicos específicos e inespecíficos o en el curso de enfermedades crónicas o debilitantes que comportan similares alteraciones.
Incidencia
La neumonía causa la muerte de 4 millones de niños al año, globalmente en todo el mundo, la gran mayoría en países en desarrollo(1). Incluso en países desarrollados es causa importante de morbilidad y hospitalización. En Europa, se dan 2-3 millones de casos de neumonía anualmente, con una incidencia de 10-40 casos/1.000 niños/año. En el primer año de vida, la incidencia es de 15-20 casos/1.000 niños/año. De 1 a 5 años sube a 30-40 casos y, de nuevo, desciende en los mayores de 5 años a 10-20 casos.
La prematuridad, la malnutrición, el bajo nivel socioeconómico, la exposición al humo del tabaco, la asistencia a guardería y la presencia de patología cardiorrespiratoria, neurológica o del sistema inmunitario, son factores que aumentan la incidencia y gravedad de la neumonía en niños.

Etiología
La mayoría de neumonías en niños y adolescentes son causadas por virus. Los más frecuentes son: VRS, parainfluenza, influenza, adenovirus y enterovirus. También, es una posible complicación de: sarampión, varicela, mononucleosis infecciosa o gripe.
Las bacterias(2-3) originan el 14-53% de neumonías: Streptococcus pneumoniae, Mycoplasma pneumoniae, Chlamidophila pneumoniae, Haemophilus influenzae, Streptococcus pyogenes, Moraxella catharralis, Staphylococcus aureus, Chlamydia trachomatis, Coxsiella burnetii, Legionella pneumophila y Chlamydophila psittaci. Los bacilos gramnegativos causan neumonía en lactantes y, sobre todo, en neonatos, en quienes es importante el estreptococo B. La neumonía por anaerobios es propia de inmunodeficientes, pacientes con patología de base o neumonía por aspiración. En el diagnóstico diferencial, debe considerarse la tuberculosis, especialmente en determinadas situaciones clínicas o epidemiológicas. Hongos y parásitos originan neumonía en inmunodeficientes y en individuos que residen o viajan a zonas endémicas para algún agente etiológico concreto.
El mejor predictor de la causa de la neumonía en la infancia(2) es la edad (Tabla I); por lo que, ésta va a condicionar la elección del tratamiento empírico. En los menores de 3 meses, la mayoría de neumonías son bacterianas y, salvo en neonatos, el neumococo es la causa más común. También, es el agente más frecuente en neumonías bacterianas en niños de más de 3 meses, al menos hasta los 5 años, y el responsable de la mayoría de neumonías graves a cualquier edad. Mycoplasma pneumoniae y Chlamydophila pneumoniae son más frecuentes en niños mayores, con una máxima incidencia alrededor de los 8-10 años, edad a partir de la cual se hacen tan frecuentes, conjuntamente, como el neumococo. Los virus son más habituales en niños pequeños. Existe infección mixta en un número significativo de casos, siendo frecuente la asociación VRS y neumococo.
Clínica
Las manifestaciones clínicas pueden variar en función de la edad, germen implicado y la presencia o no de patología de base previa. En los lactantes, aparecen primero síntomas generales, fiebre y, posteriormente, los síntomas respiratorios. En niños de más edad, suelen existir signos respiratorios ya al inicio del cuadro clínico, que permiten orientar el problema hacia un origen respiratorio.
Los signos respiratorios incluyen: aleteo nasal, retracciones, taquipnea o quejido. En la auscultación, pueden hallarse: estertores crepitantes, sobre todo al final de la inspiración, hipoventilación más o menos localizada y disminución del murmullo vesicular. A veces, soplo tubárico o roce pleural. Los roncus y sibilantes son más habituales en neumonías víricas, por VRS especialmente, pero pueden existir en las debidas a micoplasma. La percusión es poco sensible pero, si se detecta una franca matidez, puede resultar sugestiva. La cianosis o la hipoxemia, aun sin cianosis franca, serían criterios de gravedad.
En los pacientes afectos de neumonía suele existir afectación del estado general, mayor en las bacterianas que en las víricas y micoplásmicas. Son habituales síntomas como: cefalea, dolor torácico o abdominal, vómitos, diarrea, meningismo y mayor o menor postración. La presencia de síntomas no respiratorios obliga al diagnóstico diferencial con cuadros distintos de la neumonía, como la meningitis o el abdomen agudo (apendicitis o adenitis mesentérica), hasta el punto de que, en la valoración del abdomen agudo, se recomienda incluir una radiografía de tórax para descartar una neumonía basal.
Se distinguen dos patrones de neumonía (“típica” y “atípica”), que pueden resultar útiles para orientar el diagnóstico y el tratamiento empírico, al menos en adolescentes y niños mayores. En lactantes y niños pequeños no suelen estar tan bien definidos.
Neumonía típica. Debida generalmente a neumococo u otras bacterias (Haemophilus influenzae, Estreptococo pyogenes, estafilococo), suele presentarse con: fiebre alta, en pico, a menudo escalofríos, afectación del estado general, aspecto tóxico, tos variable, primero seca y, después, productiva, y síntomas respiratorios (taquipnea, disnea y cianosis). Son frecuentes el dolor torácico o abdominal, los vómitos y, en niños pequeños, diarrea. No es raro encontrar algún grado de meningismo, al menos parcial.
En niños mayores, la auscultación puede sugerir consolidación (estertores crepitantes localizados, pectoriloquia, soplo tubárico). En niños pequeños puede ser normal, casi normal o muy inespecífica. La tríada, constituida por: fiebre alta, tos y dolor en punta de costado, típica del adulto, puede encontrarse a veces en niños mayores, pero suele faltar o ser indemostrable en niños de menor edad.
Son complicaciones de la neumonía neumocócica: otitis, meningitis, artritis, osteomielitis, pericarditis, peritonitis y bacteriemia o sepsis. El empiema, el absceso pulmonar y los neumatoceles son poco frecuentes en la neumonía neumocócica, algo más en la estreptocócica, y aún más en la estafilocócica, actualmente rara salvo en lactantes con enfermedad de base (fibrosis quística o inmunodeficiencia), grave, rápidamente progresiva, que cursa con derrame pleural, neumotórax, neumatoceles, abscesificación y secuelas quísticas permanentes.
El estreptococo suele producir infecciones de vías altas, desde donde puede ser aspirado o diseminarse a vías bajas y parénquima pulmonar. Algunas enfermedades exantemáticas (varicela) y la gripe son factores predisponentes.
Haemophilus influenzae era frecuente en menores de 5 años hasta generalizarse la vacunación contra ese germen. Puede causar bronconeumonía, infiltración y destrucción importante de las pequeñas vías, derrame pleural y empiema. Las complicaciones extrapulmonares (sepsis, meningitis, artritis, celulitis) eran también relativamente frecuentes.
La neumonía por Klebsiella suele aparecer en el contexto de bronquiectasias crónicas, tuberculosis, fibrosis quística o inmunodeficiencia y puede parecerse a la estafilocócica.
Neumonía atípica. Debida principalmente a Mycoplasma pneumoniae o Chlamydophila pneumoniae, es frecuente a partir de la edad escolar. El proceso suele ser de inicio gradual y evolucionar como un cuadro gripal con tos seca, pertinaz, cefalea, mialgias, odinofagia y fiebre moderada. Pueden aparecer exantemas eritematosos (ocasionalmente, eritema multiforme o Stevens-Johnson) y manifestaciones extrapulmonares: otitis, anemia hemolítica autoinmune, trombocitopenia, meningoencefalitis, ataxia cerebelosa, Guillain-Barré, mielitis transversa, miocarditis, pericarditis, poliartritis y hepatitis. A menudo, hay antecedentes similares recientes entre los contactos.
Legionella pneumophila, rara en niños, puede originar neumonía típica o atípica y suele cursar con afectación multisistémica (hepática, renal, neurológica y cardiaca).
La neumonía por Chlamydia trachomatis suele presentarse en menores de 3 meses, de forma afebril, con tos seca, pertusoide a veces, taquipnea y estertores o sibilantes. Origina dificultad respiratoria creciente que, junto a infiltrados bilaterales difusos en la radiología de tórax constituye el “síndrome de neumonitis”. A menudo, se acompaña o va precedida de conjuntivitis. La evolución puede ser prolongada (4-8 semanas). Los pacientes con patologías crónicas, neoplasias malignas o SIDA padecen cuadros similares originados por: Ureaplasma urealyticum, Citomegalovirus y Pneumocystis carinii.
Las neumonías víricas suelen ir precedidas de catarro de vías altas, con rinitis y tos, y cursan con taquipnea, disnea, estertores bilaterales y/o sibilancias (VRS) y fiebre variable, a menudo escasa. Se presentan con máxima frecuencia alrededor de los 2-3 años de edad y predominan en la estación fría. La evolución suele ser buena, pero puede prolongarse más que en las bacterianas.
Radiología
La aparición de las imágenes radiológicas suele retrasarse respecto al inicio de la clínica, al menos en niños mayores, en quienes hay datos clínicos sugestivos, si se exploran adecuadamente, antes de evidenciarse la condensación radiológica. Por el contrario, en lactantes y niños pequeños, a menudo, los signos clínicos de afectación pulmonar son, al principio, escasos e inespecíficos y muchas veces será la radiología la que permitirá el diagnóstico.
Se distinguen clásicamente dos patrones radiológicos, habitualmente superponibles a los dos patrones clínicos descritos. Pueden orientar sobre la etiología probable del proceso:
• Alveolar, habitual en neumonías bacterianas. La condensación se denomina lobar o segmentaria si se limita a un lóbulo o a un segmento pulmonar, respectivamente.
• Intersticial, usual en neumonías por Mycoplasma, Legionella, Chlamydia y virus.
Existe gran variabilidad(4-6) en la interpretación de las radiografías de tórax para el diagnóstico de la neumonía y, en el mejor de los casos, resulta difícil distinguir entre una neumonía vírica y una bacteriana basándose sólo en la radiología(7). En las bacterianas, habrá más a menudo condensación; mientras que, en las víricas son más frecuentes la hiperinsuflación y las atelectasias. La mitad de los pacientes con neumonía bacteriana se presentarán con una condensación lobar o segmentaria, a menudo con broncogramas aéreos en su interior.
La neumonía neumocócica suele afectar a uno o más lóbulos o segmentos (patrón lobar o segmentario), aunque en lactantes la afección puede ser más difusa. La imagen de “neumonía redonda” sugiere infección neumocócica, pues es el aspecto que a menudo adquiere la neumonía por ese germen inicialmente. Las condensaciones lobares no excluyen un origen vírico, aunque en las neumonías víricas los infiltrados suelen ser difusos, a menudo bilaterales, con predominio perihiliar.
En la neumonía por micoplasma, suelen existir infiltrados intersticiales, aunque también condensaciones lobares o segmentarias (patrón mixto) y, a menudo, adenopatías hiliares. La afectación suele ser bilateral y predominar en lóbulos inferiores. Puede haber derrame pleural, sobre todo en adolescentes. Es frecuente la disociación clínico-radiológica (radiología más llamativa que la clínica).
Laboratorio
Ninguna suele ser necesaria en Atención Primaria(8,9) y, si se dispone de ellas, la tardanza en disponer de sus resultados reduce aún más su utilidad.
• Hemograma. La leucocitosis y la desviación a la izquierda sugieren etiología bacteriana (neumococo). La leucopenia, virus o micoplasma. Tiene insuficiente especificidad para diferenciar una neumonía bacteriana de una vírica. Una gran leucocitosis casi permite excluir micoplasma y clamidia.
• VSG. Mal marcador, por su ascenso y normalización lentos y su escasa especificidad para diferenciar infecciones bacterianas y víricas. Grandes incrementos (>100) sí tienen utilidad como marcador de infección bacteriana.
• PCR (proteína C reactiva). Su elevación (>80 mg/L) sugiere origen bacteriano. La PCR baja (<20 mg/L) orienta a un origen vírico o micoplásmico. Cifras intermedias tienen insuficiente (VPP (valor predictivo positivo) y VPN (valor predicitivo negativo).
• PCT (procalcitonina). Se eleva antes que la PCR y es más específica de infección y, concretamente, de infección bacteriana. La PCT >2 sugiere origen bacteriano (VPP 86%), una PCT <0,5 sugiere origen viral. Útil para tomar decisiones en Urgencias(10).
• Hemocultivo. Positivo sólo en un 10% de casos. Tiene especificidad muy alta pero escasa sensibilidad. Puede resultar útil en medio hospitalario.
• Cultivo de esputo. Sólo útil en los pocos casos con expectoración fácil. Puede proporcionar información importante en alguna patología, como la fibrosis quística.
• Cultivo faríngeo. No permite el diagnóstico etiológico, ya que los gérmenes que causan neumonía son habituales en las secreciones faríngeas.
• Antígenos bacterianos en orina. Tienen valor sobre todo si son negativos, pero no tanto si resultan positivos, pues pueden deberse a la presencia del germen en otros focos de infección o a colonización. Son muy sensibles pero poco específicos.
• PPD. Solo indicado si hay historia o sospecha de exposición o de viaje a zonas de alta prevalencia de infección tuberculosa.
• Cultivo nasofaríngeo. Salvo para B. pertussis, la presencia de bacterias en el cultivo nasofaríngeo carece de valor diagnóstico, pues los gérmenes que ocasionan neumonía son colonizadores habituales de la nasofaringe.
• Antígenos virales en el aspirado nasofaríngeo: VRS, influenza, parainfluenza, adenovirus. No permiten afirmar que ese virus concreto sea el causante de la neumonía.
• Serología. No se recomienda de rutina. La detección de anticuerpos específicos IgM o la elevación de los IgG en la convalecencia tienen valor en infecciones por Mycoplasma, Coxiella, Chlamydia o Legionella. La elevación de las crioaglutininas a partir de la 2ª semana es útil en infecciones por Mycoplasma pneumoniae, aunque no es exclusiva de ellas. Puede confirmarse la infección por serología (neutralización, fijación de complemento, ELISA). La seroconversión en dos muestras separadas 2-3 semanas, la primera obtenida al principio del cuadro y guardada congelada para cotejarla con una extraída más tarde si se considera necesario, permite demostrar la infección por VRS, CMV, influenza, parainfluenza y adenovirus.
En pacientes hospitalizados, se recomiendan la radiología de tórax, hemograma, PCR o PCT y hemocultivo, éste al menos en pacientes críticos, en inmunodeprimidos o si existen síntomas persistentes, fiebre alta o grandes consolidaciones. La indicación de otras pruebas deben individualizarse: virus respiratorios (VRS y gripe), PPD, serología a micoplasma y clamidia. La obtención de secreciones traqueobronquiales por lavado broncoalveolar o la toracocentesis en el derrame pleural permiten el estudio citobioquímico, cultivo y reacción en cadena de la polimerasa. Sus indicaciones se limitan, por supuesto, a casos concretos.
Proceso diagnóstico
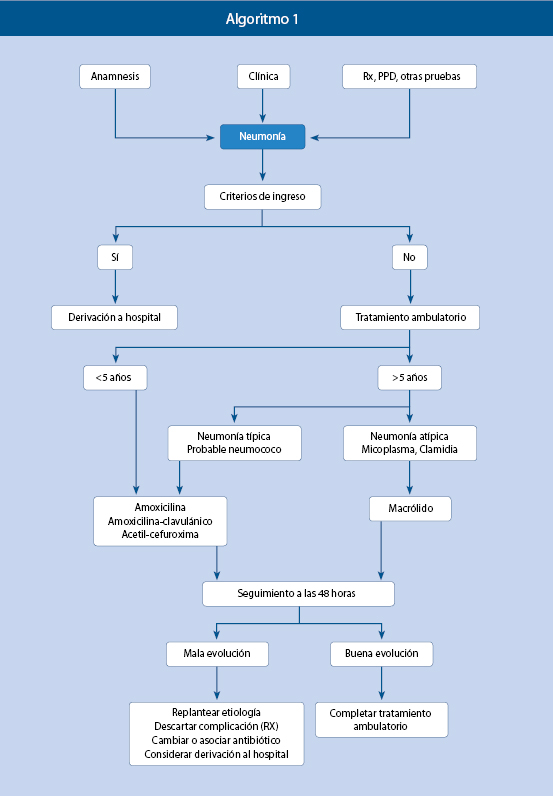
El proceso(11) que suele seguirse ante una posible neumonía se esquematiza en la tabla II.
1. ¿Puede este paciente tener una neumonía?
La ausencia de fiebre tiene un VPN de hasta un 97% si la temperatura no se ha modificado con antipiréticos. Basándose sólo en la clínica y la exploración, no siempre es fácil establecer o descartar con seguridad el diagnóstico de neumonía(12-13) y sentar o no la indicación de una radiografía de tórax. La auscultación es poco precisa para detectar la neumonía, pero si existen hallazgos resulta de ayuda. La percusión torácica sólo a veces proporciona información, aunque puede ser también muy sugestiva si la matidez es franca y la asimetría, evidente. De los signos físicos, la taquipnea(14) (Tabla III) y el distrés respiratorio son los mejores indicadores de la posibilidad de que exista una neumonía. La severidad de la taquipnea está, además, relacionada con la gravedad del proceso. La ausencia de taquipnea hace improbable la existencia de neumonía, aunque no la descarta. La presencia de distrés respiratorio (aleteo, quejido o tiraje) la hace más probable.
– Debe sospecharse una neumonía bacteriana en niños menores de 3 años con fiebre de más de 38,5°C junto a retracciones costales y/o taquipnea mayor de 50/min.
– En niños de más edad, el distrés respiratorio tiene mayor valor que otros signos clínicos. La asociación de fiebre, tos y estertores crepitantes es la que posee un mayor valor predictivo positivo. La ausencia de todos los signos físicos apuntados (auscultación anormal, taquipnea y distrés) hace improbable la neumonía.
La posibilidad de encontrar un infiltrado (neumonía oculta) es del 3% y la mayoría serán, además, víricas que, muy probablemente, se resolverían por sí solas. Por el contrario, con o sin signos respiratorios, en el contexto de una fiebre prolongada no explicada por otra causa, especialmente si existe leucocitosis >20.000 o PCR/PCT aumentadas, la posibilidad de encontrar una neumonía asciende al 20-25%.


Debiera incluirse la pulsioximetría(15) entre las determinaciones iniciales, sobre todo en niños con estado general afectado o dificultad respiratoria; ya que, aumenta la sensibilidad para detectar la presencia de neumonía y ayuda a valorar su gravedad(16).
2. ¿Debe solicitarse una radiografía?
El uso de la radiografía de tórax(17) en la evaluación del niño con posible neumonía varía ampliamente, en relación con muchos factores, como la falta de unos criterios clínicos claros para el diagnóstico de neumonía, las dificultades para apreciar signos sutiles de neumonía, especialmente al principio del cuadro y en niños pequeños o lactantes, y la accesibilidad a la radiología en diferentes escenarios de práctica clínica.
La radiografía de tórax se considera el gold standard en el diagnóstico de neumonía. Se recomienda, sobre todo, en presencia de clínica ambigua, sospecha de complicación, evolución prolongada o episodios previos de neumonía. La radiografía de tórax en niños con fiebre sin foco es, habitualmente, normal si no hay clínica respiratoria. Estaría, en principio, indicada:
– En niños pequeños, para descartar o confirmar la sospecha clínica de neumonía, aun en ausencia de signos respiratorios.
– En niños mayores, sólo si existe clínica compatible (fiebre y signos respiratorios).
– En ambos casos, aun en ausencia de signos respiratorios, en el contexto de una fiebre prolongada e inexplicada por otra causa.
Existe consenso, entre las guías de práctica clínica, en que no es imprescindible una radiografía de tórax para tomar una decisión terapéutica adecuada en el contexto de una infección leve de vías respiratorias bajas (primer episodio, sin criterios de gravedad, en niños previamente sanos, con signos claramente sugestivos de este diagnóstico), ya que no permite distinguir de forma fiable una neumonía bacteriana de una viral.
3. ¿Qué germen es más probable?
Según la complejidad de los medios de laboratorio empleados, puede llegarse a identificar la causa de la neumonía en un 20-60% de casos. La edad, los signos clínicos o radiológicos y la analítica general por separado no tienen suficiente especificidad para el diagnóstico etiológico. Su valoración conjunta, sin embargo, permite un diagnóstico de probabilidad (Tabla IV).
4. ¿Es necesaria alguna otra prueba complementaria?
En la tabla V, se muestran los exámenes complementarios recomendados por la Sociedad Española de Neumología Pediátrica para la orientación etiológica de la neumonía en cada nivel de asistencia.
5. ¿Existen factores de riesgo adicionales?
Debe considerarse la neumonía grave o probablemente grave si existe alguno de los criterios mostrados en la tabla VI.


6. ¿Debe ingresar este paciente?
La neumonía adquirida en el ámbito extrahospitalario puede generalmente controlarse en este medio. Sin embargo, será aconsejable el ingreso hospitalario si hay criterios clínicos de gravedad u otros que dependen de la edad del paciente, existencia de patología de base o dificultades para su tratamiento y control (Tabla VII).
Tratamiento
Muchas guías de práctica clínica(18-21) recomiendan no administrar antibióticos cuando se sospecha o se constata una neumonía en niños pequeños con sintomatología respiratoria leve, basándose en que la gran mayoría de estas neumonías son causadas por virus. Sin embargo, sobre todo el neumococo, pero también micoplasma y clamidia, son agentes frecuentes de neumonía incluso en edades en que mayoritariamente son originadas por virus. Son frecuentes las infecciones mixtas y, aunque cuanto más pequeño el niño más probable es que la neumonía sea vírica, también es mayor el riesgo de no tratar con antibióticos una neumonía bacteriana.
Al decidir si la neumonía se tratará en el ámbito de la Atención Primaria o en el hospital, deben tenerse en cuenta:
• Edad del paciente.
• Gravedad del cuadro clínico o radiológico.
• Presencia de complicaciones o patología de base.
• Fiabilidad de la familia.
• Posibilidades de seguimiento.
Los antibióticos orales se han demostrado eficaces y seguros(22) en el tratamiento de la NAC en niños; por lo que, en general, el tratamiento podrá efectuarse ambulatoriamente y por vía oral si: el estado general es aceptable, la aceptación y tolerancia son buenas, no hay factores de riesgo que aconsejen tratamiento hospitalario, está asegurado el seguimiento y la familia es fiable en cuanto al cumplimiento y la valoración de la evolución.
En la mayoría de casos, el tratamiento se iniciará de forma empírica con un antibiótico eficaz contra los gérmenes más frecuentes, teniendo en cuenta las probables sensibilidades y resistencias locales, salvo cuando, por pertenecer a determinado grupo de riesgo, se deban considerar otros patógenos o cuando se disponga de resultados bacteriológicos. Los más empleados son los betalactámicos y los macrólidos, entre los que la claritromicina reúne la mejor eficacia, tolerancia digestiva y comodidad posológica. Para decidir el tratamiento empírico disponemos de dos criterios generales: la edad del niño y el germen más probable, que depende también de la edad del paciente. La dosificación de los antibióticos más utilizados en Atención Primaria se muestra en la tabla VIII.
Tratamiento empírico en función del germen más probable
• Streptococcus pneumoniae (neumococo). Cada vez más cepas son parcial (hasta 40%) o totalmente (menos veces) resistentes a las penicilinas, por mecanismo cromosómico en relación con las PBP (proteínas de unión a la penicilina). Muchas lo son a eritromicina (hasta 50% en nuestro medio), cotrimoxazol o multirresistentes. Las resistentes a penicilina a menudo también lo son a los macrólidos. La posibilidad de que se trate de una cepa resistente aumenta en niños que asisten a guardería y han recibido antibióticos en los últimos 2-3 meses.
En la mayoría de casos, la penicilina, ampicilina y amoxicilina, son eficaces, aunque pueden necesitarse dosis mayores de las clásicas para cubrir los neumococos parcialmente resistentes, que pueden serlo también (en menos ocasiones) a las cefalosporinas de amplio espectro. Las más activas son: cefuroxima, cefotaxima, ceftriaxona, cefonicid y cefamandol. La cefixima es menos eficaz. La adición de ácido clavulánico no mejora la eficacia de la amoxicilina, pues las resistencias no se deben a betalactamasas. En el caso de los macrólidos, aumentar las dosis no resuelve el problema de las resistencias.



La mayoría de guías recomiendan amoxicilina como antibiótico oral de elección ante una probable etiología neumocócica. Los expertos sobre neumococo de los CDC (Centros para el Control y Prevención de Enfermedades) consideran la amoxicilina, amoxicilina-clavulánico y acetil-cefuroxima, antibióticos adecuados para la terapéutica empírica de las NAC, tanto en adultos como en niños. Asimismo, consideran los macrólidos adecuados para tratamiento de adultos, pero no para menores de 5 años.

• Haemophilus influenzae. Resistente a ampicilina en el 30-40% de casos, por betalactamasas o, en menos ocasiones, cromosómica. También, hay resistencias a eritromicina y cotrimoxazol (hasta 50%). El ácido clavulánico devuelve la sensibilidad a amoxicilina a las cepas productoras de betalactamasas pero no a las resistentes por mecanismo cromosómico. No hay, en nuestro medio, resistencias a amoxicilina-clavulánico o cefotaxima, aunque sí a cefaclor. Cefixima y ceftibuteno son útiles en infecciones no invasivas por Haemophilus pero no para el tratamiento empírico de las neumonías. Los macrólidos tienen escaso papel en infecciones por este germen. Claritromicina y azitromicina serían de elección en alérgicos a betalactámicos.
• Staphylococcus. En principio, resistente a penicilina, ampicilina y amoxicilina, y sensible a cloxacilina y cefalosporinas. El ácido clavulánico permite soslayar también la acción de sus betalactamasas. La sensibilidad a macrólidos es variable.
• Streptococcus (estreptococo ß-hemolítico del grupo A). Es sensible a: penicilina, ampicilina, amoxicilina, cefalosporinas de 1ª generación y macrólidos.
• Mycoplasma, Legionella, Chlamydia, Coxiella. El fármaco de elección es un macrólido.
El neumococo es responsable de la tercera parte de neumonías en todos los grupos de edad y de la mayoría de sus complicaciones graves y es difícil descartarlo como agente causal en una neumonía concreta. El antibiótico oral con mayor actividad, tanto frente a cepas sensibles como resistentes a penicilina, es la amoxicilina a dosis altas (80-100 mg/kg/día). Aunque existen pocos casos de fallos terapéuticos documentados en el tratamiento con betalactámicos de la neumonía causada por neumococos parcialmente resistentes, aun usando dosis “clásicas” de estos antibióticos, parece prudente emplear las dosis altas recomendadas recientemente.
Las neumonías atípicas evolucionan favorablemente en la mayoría de casos, incluso con betalactámicos o antibióticos no activos frente a los gérmenes causales. En conclusión, la amoxicilina es el tratamiento de primera línea para las NAC en Pediatría, reservando los macrólidos para cuando el cuadro clínico sea claramente de neumonía atípica: niños mayores con cuadro prolongado, tos pertinaz, síntomas extrapulmonares (cefalea, odinofagia) y antecedentes en sus contactos.
Tratamiento empírico en función de la edad del niño
Menores de 6 meses
Deben tratarse en el medio hospitalario, habitualmente con un betalactámico intravenoso: amoxicilina-clavulánico (100 mg/kg/día), cefotaxima (100 mg/kg/día), ceftriaxona (50 mg/kg/día) o cefuroxima (150 mg/kg/día).
El resto de niños pueden ser tratados (Tabla IX) ambulatoriamente si no existe ni aparece durante el curso clínico alguno de los criterios de ingreso ya mencionados.
Menores de 5 años
En niños pequeños, el tratamiento debe orientarse a la etiología neumocócica y por un neumococo con sensibilidad reducida a la penicilina.
• El antibiótico oral de elección sería amoxicilina a dosis altas (80-100 mg/kg/día). Alternativas serían: amoxicilina-clavulánico (misma dosis alta de amoxicilina) o una cefalosporina de 2ª-3ª generación, en este último caso parenteral. Serían también de elección en el niño pequeño hospitalizado con una neumonía moderada o grave.
• En niños mayores de 3 años, si se sospecha firmemente una neumonía “atípica”, el cuadro es leve y el seguimiento está asegurado, podría utilizarse un macrólido. La claritromicina es más efectiva, más fácil de administrar y mejor tolerada que la eritromicina. Si se opta por esta pauta y la evolución no es favorable a las 48-72 horas, deberá asociarse o cambiarse a un betalactámico.
En niños de este grupo etario, si la clínica es muy sugestiva de etiología vírica y el seguimiento está garantizado, sería correcto aplazar la decisión de administrar antibióticos. Si la evolución no es favorable, dadas la frecuente coinfección bacteriana en las neumonías inicialmente víricas y la dificultad para diferenciar ambas etiologías, deberá indicarse antibioterapia.
Antes de generalizarse la vacunación contra Haemophilus influenzae, el antibiótico de elección para el tratamiento ambulatorio empírico en menores de 5 años era:
• Amoxicilina a dosis altas (cubriría el neumococo parcialmente resistente) asociada al ácido clavulánico (cubriría el Haemophilus productor de betalactamasas).
• Una cefalosporina de segunda generación, como acetil-cefuroxima.
En niños no o mal vacunados contra Haemophilus, sigue siendo una pauta adecuada, indicada en nuestro entorno en los menores de 5 años procedentes de países donde no se vacuna contra ese germen. Cefonicid, cefotaxima o ceftriaxona serían una alternativa intramuscular. Tras la mejoría clínica, se completaría el tratamiento por vía oral con amoxicilina-clavulánico o acetil-cefuroxima.
Mayores de 5 años
La mayoría de guías clínicas, en niños mayores de 5 años cuyo estado general permite tratarlos fuera del hospital, recomiendan:
• Un macrólido, por la frecuencia con que a estas edades la neumonía está originada por micoplasma o clamidia, y porque en los países donde se elaboran la mayoría de guías clínicas solventes los macrólidos suelen ser eficaces también contra neumococo, el otro germen frecuente a estas edades.
• A los pocos días, si la evolución no es buena, cambiar a un antibiótico eficaz frente al neumococo: amoxicilina a dosis altas, amoxicilina-clavulánico (dosis de amoxicilina igualmente altas pues el clavulánico no la hace más eficaz contra el neumococo) o una cefalosporina de 2ª-3ª generación.
• Utilizar directamente un betalactámico si el niño tiene aspecto séptico o existe una clara consolidación lobar, con o sin derrame, en la radiografía de tórax. Amoxicilina, amoxicilina-clavulánico o acetil-cefuroxima si se opta por la vía oral o una cefalosporina de 3ª generación, si es por vía parenteral.
La prevalencia en nuestro país de cepas de neumococos resistentes, parcialmente al menos, a las penicilinas, pero a menudo también a los macrólidos, aconseja modificar aquí estos criterios. Ya no parece prudente tratar con macrólidos, empíricamente, una infección que quizá sea neumocócica. Por tanto:
• Si la clínica es compatible con una neumonía “típica”, quizá neumocócica, estaría indicado el tratamiento con amoxicilina a dosis altas (80-100 mg/kg/día). La amoxicilina-clavulánico o una cefalosporina de segunda o tercera generación, en el último caso parenteral, serían alternativas.
• Si la clínica sugiere firmemente una neumonía “atípica”, probablemente por Mycoplasma o Chlamydophila pneumoniae, mantendríamos la recomendación de empezar con un macrólido oral (eritromicina, claritromicina o azitromicina).
• Si la clínica no permite orientar la etiología en uno u otro sentido o si la evolución con cualquiera de las dos no es favorable tras 48-72 horas de tratamiento, podría asociarse un antibiótico de cada grupo, amoxicilina y claritromicina, por ejemplo, aunque es preferible la monoterapia mientras se espera la respuesta al primer fármaco indicado. De todas formas, ante el fracaso terapéutico a las 48-72 horas de iniciado cualquier tratamiento con uno, otro o ambos fármacos, probablemente sea prudente el ingreso para su manejo hospitalario.
En alérgicos a los betalactámicos podría utilizarse un macrólido (claritromicina, por ejemplo). Si la evolución no es rápidamente favorable, estaría indicado el ingreso para tratamiento parenteral con otro antibiótico (vancomicina, por ejemplo) o un betalactámico distinto al que se sabe alérgico, en este caso bajo vigilancia estrecha.
La duración del tratamiento será, habitualmente, de 7-10 días. En la neumonía por clamidia, se recomiendan 15 días y en la micoplásmica 10-14, en ambos casos con eritromicina o claritromicina. En el estafilococo, al menos 3 semanas.
Tratamiento general y sintomático
Las medidas generales incluyen reposo relativo, dieta blanda e hidratación suficiente. Deberá administrarse oxígeno si la saturación es =92% o existe dificultad respiratoria severa o cianosis. El ingreso es, en este caso, obligado.
Los antitusígenos pueden ser útiles en la tos no productiva, aunque su eficacia es escasa y existen limitaciones en las edades en que se permite su empleo, por sus posibles efectos secundarios. Los antitérmicos pueden mejorar el confort del paciente y reducir las pérdidas hídricas. No existen pruebas de beneficios de la humidificación o fisioterapia, salvo si existen bronquiectasias.
Seguimiento
Si la evolución clínica es favorable, no precisan más controles clínicos o radiológicos hasta resolverse totalmente el proceso. Si persiste la fiebre o aumenta la sintomatología respiratoria o general, debe reevaluarse el paciente mediante un control clínico, radiológico y quizá de laboratorio. Tras descartar una complicación clínica (sepsis, deshidratación) o radiológica (derrame, absceso, empiema), debe replantearse el diagnóstico de neumonía, revisar la elección del tratamiento empleado y considerar una etiología distinta de la supuesta inicialmente. Todo ello obligará, probablemente, a modificar el tratamiento y cambiar o añadir otro fármaco.
No es necesaria la radiografía de control(23) en el niño diagnosticado y tratado por una neumonía no complicada, con respuesta clínica favorable al tratamiento antibiótico, si se encuentra asintomático y con exploración física normal al finalizarlo. Sí se recomienda si existía derrame o atelectasia en la primera radiografía, cuando se hizo el diagnóstico, o en alguna efectuada después porque la evolución no fue la esperada. La resolución de las imágenes radiológicas puede retrasarse respecto a la curación clínica, como su aparición lo hace en relación a los signos clínicos; por lo que, si se efectúa una radiografía de control, será a las 3-4 semanas, para comprobar la resolución completa.
La neumonía redonda es frecuente en niños. Ya que puede similar una masa pulmonar, algunos autores recomiendan también una radiografía tras resolverse el proceso agudo para descartar la existencia de una masa subyacente (ganglioneuroma o neuroblastoma).
La persistencia de imágenes patológicas obliga a plantearse un seguimiento a más largo plazo, la necesidad de exploraciones adicionales o la derivación a neumología. En la última parte de este texto, se tratará de la neumonía recurrente o persistente.
Complicaciones
El neumococo es el principal responsable de este incremento de la gravedad de las neumonías(24-27). Al mismo tiempo, se ha observado un aumento de las resistencias del neumococo a los betalactámicos y otros antibióticos. No se ha podido demostrar una relación de causalidad entre el incremento de las resistencias y el de la morbilidad, y las neumonías con complicaciones no se deben en más ocasiones a cepas resistentes que las que cursan sin ellas. Sí parece establecida su relación con el incremento de la frecuencia de ciertos serotipos (1, 3 y 14). Tampoco parece poderse atribuir el aumento de estos serotipos neumocócicos no incluidos en la primera vacuna conjugada 7-valente al desplazamiento de serotipos originado por su uso más o menos generalizado; ya que, se ha observado desde antes de comercializarse esta vacuna y en escenarios con muy distintas coberturas vacunales. Las vacunas antineumocócicas 10 y 13-valentes suponen un avance en relación al aumento de la agresividad de las neumonías neumocócicas y el problema de las resistencias.
Las complicaciones(28,29) principales de la neumonía son:
• Atelectasias.
• Derrame pleural/empiema.
• Neumonía necrotizante.
• Absceso pulmonar.
• Neumatocele.
• Bronquiectasias.
Derrame pleural paraneumónico
Entendemos por derrame pleural la existencia de líquido en el espacio pleural. En niños y adolescentes, la causa más frecuente es la infección pulmonar, en cuyo caso se denomina derrame pleural metaneumónico o paraneumónico(30), empiema si es purulento. Un 0,6-2% de neumonías originan empiema y en un 40% de las que requieren hospitalización en niños existe algún grado de derrame pleural. Debe sospecharse su existencia si:
• Una neumonía no evoluciona favorablemente con un tratamiento en principio adecuado.
• Aparecen matidez e hipoventilación en el lado afecto (requieren un derrame considerable para ser detectables).
• Aparece dolor.
Neumococo y micoplasma son los agentes más frecuentes en niños mayores y adolescentes. En estos últimos, se encuentra hasta en el 25% de neumonías por micoplasma, en las que suele ser de tamaño limitado y no requerir tratamiento, y hasta en el 50% de las neumocócicas, donde puede ser mucho mayor y precisar drenaje. En las estafilocócicas aparece derrame o empiema hasta en el 75% de los casos. Pueden originarlo también el estreptococo, la Klebsiella y los anaerobios. En neumonías víricas es poco frecuente.
La ocupación del ángulo costofrénico suele ser el primer signo radiológico. Es preciso un derrame importante para que se detecte así, aunque la radiografía en decúbito lateral sobre el lado afecto permite descubrir derrames pequeños (5-10 ml).
Son más útiles otras técnicas de diagnóstico por la imagen (ecografía torácica o TAC). La ecografía, técnica de elección, detecta derrames a partir de 10 ml. Permite diferenciar derrames y engrosamientos pleurales, delimitar el tamaño y la localización, identificar la presencia de tabicaciones y guiar la técnica de punción o drenaje. El aspecto ecogénico de los derrames es uno de los criterios para decidir la pauta terapéutica a seguir. La TAC no está indicada de forma sistemática en los pacientes con sospecha de derrame pleural. Es más útil que la ecografía, sin embargo, para detectar la afectación del parénquima pulmonar.
Las opciones terapéuticas(31) incluyen, además del tratamiento médico, la toracocentesis (punción-aspiración), el drenaje con tubo torácico, la videotoracoscopia, la instilación intrapleural de fibrinolíticos (discutida) y la toracotomía (excepcional).
Los derrames pequeños y asintomáticos sólo precisan el tratamiento de la neumonía que los originó. En cualquier otro caso, deberá indicarse el ingreso hospitalario para valoración ecográfica y tratamiento antibiótico intravenoso. Deberán puncionarse, aun sin requerir drenaje, siempre que la evolución clínica no sea buena, pues la punción permitirá el diagnóstico preciso (citoquímica y cultivo). El empiema siempre deberá drenarse.
Deberá drenarse también mediante aspiración si el tamaño es significativo (se aprecia claramente en la radiografía AP) o rápidamente creciente, provoca dificultad respiratoria o no hay una respuesta adecuada al tratamiento antibiótico. Es preferible efectuar el drenaje precozmente, antes de que el derrame se organice y haga más difícil su eliminación. El empiema deberá evacuarse con tubo torácico y puede precisar cirugía. La videotoracoscopia permite visualizar y eliminar los derrames organizados (tabicados). Los pacientes sometidos a videotoracoscopia tienen menor mortalidad y menor duración de su hospitalización y tratamiento médico que los tratados sólo con antibióticos y drenaje mediante tubo torácico(32). En derrames complicados, pueden utilizarse fibrinolíticos (uroquinasa, estreptoquinasa…).
Para el tratamiento antibiótico, siempre intravenoso, de los empiemas o derrames complicados, suele recomendarse cefotaxima: 200 mg/kg/día o ceftriaxona: 50 mg/kg/día, y cloxacilina: 150 mg/kg o clindamicina: 40 mg/kg/día. Una alternativa sería amoxicilina-clavulánico a dosis de 100 mg/kg/día del componente amoxicilina.
Debiera mantenerse la vía IV 7-10 días tras ceder la fiebre y el drenaje de líquido y, posteriormente, puede completarse el tratamiento por vía oral una o dos semanas más.
Neumonía necrotizante
La neumonía necrotizante o abscesificada es una complicación infrecuente de la neumonía adquirida en la comunidad. El patógeno principal en niños es actualmente el neumococo, aunque pueden originarla: estafilococo, estreptococo, anaerobios, Legionella, Klebsiella, Aspergillus y otros gérmenes. Se relaciona con la agresividad del patógeno, la neumonía por aspiración y la existencia de patología de base en el paciente: inmunodepresión, cardiopatía, fibrosis quística… Clínicamente, cursa como una neumonía grave con fiebre persistente o recurrente.
Suele coexistir con derrame pleural complicado o empiema, por lo que puede retrasarse su diagnóstico al atribuirse al empiema la gravedad del paciente y la persistencia de la fiebre. Existe abscesificación, comprobable por TAC, hasta en el 50% de los empiemas. Puede evolucionar a absceso pulmonar y neumatoceles y complicarse con el desarrollo de fístula broncopleural y neumotórax localizados.
La TAC de tórax con contraste es la herramienta más útil para el diagnóstico de la abscesificación. No suele solicitarse al ingreso del paciente sino cuando la evolución es desfavorable. La neumonía necrotizante se caracteriza por imágenes radiológicas translúcidas o por cavidades con niveles hidroaéreos en su interior y pérdida de tejido pulmonar. La disminución de la impregnación del contraste en el parénquima pulmonar se debe a zonas de hipoperfusión, que pueden evolucionar a necrosis.
La indicación más útil de la TAC es su práctica antes de la videotoracoscopia, por la información que ofrece sobre la extensión y localización del derrame pleural y las condensaciones, y la existencia de zonas de necrosis o abscesos, que procurarán evitarse durante la videotoracoscopia. Dada la necesidad de sedación en pacientes de corta edad y la radiación que supone, nulas ambas en la ecografía torácica, debe individualizarse la indicación de cada una de estas técnicas.
La evolución con el drenaje del empiema asociado y antibioterapia (por ejemplo, una cefalosporina de 3ªG y clindamicina) suele ser buena, y las secuelas, infrecuentes.
Neumatoceles
Son cavidades únicas o múltiples de pared delgada, que aparecen sobre todo en niños con empiema. La mayoría son asintomáticos y no se hacen evidentes hasta que el empiema empieza a resolverse. Ocasionalmente, se rompen y originan neumotórax. La causa más frecuente es el Staphylococcus aureus. La evolución con tratamiento adecuado suele ser buena y se resuelven en 2-3 meses.
Neumonía recurrente
Si no existe esta resolución radiológica, se considera una neumonía persistente. Esta última también se ha definido como: aquella en la que existe evidencia clínica y radiológica de neumonía que no se resuelve a pesar de un tratamiento adecuado de más de un mes.
La recurrencia se produce en alrededor del 8% de neumonías(33). En consultas de neumología, son recurrentes el 25-30% de las neumonías y suponen alrededor del 3% de los pacientes atendidos. Es frecuente encontrar a pacientes con falso diagnóstico de neumonía recurrente en los que, al revisar su historia clínica y radiografías, queda claro que se trata de infecciones respiratorias virales recurrentes que en algún momento fueron mal catalogadas y/o tratadas como neumonías, llevando a los padres a transmitir una información errónea.
El asma es una patolo gía para la que los niños reciben a veces múltiples tandas de tratamiento antibiótico y acaban etiquetados de neumonía recurrente, cuando los cambios radiológicos son realmente atelectasias malinterpretadas como neumonías.
También, existen niños en los que la recurrencia de la neumonía es casual, sin ninguna causa concreta para ello. Son niños “normales, con mala suerte”(34), con crecimiento y desarrollo adecuados, radiología normal entre episodios y sin antecedentes personales o familiares de infecciones extrapulmonares importantes.
No es habitual que se controle radiológicamente una neumonía después del proceso agudo y a veces es difícil diferenciar entre neumonía recurrente y persistente. No existe indicación para la práctica rutinaria de una radiografía de tórax en el seguimiento de niños, por lo demás, sanos que padecen una neumonía adquirida en la comunidad, si esta cursa sin complicaciones. En aquellos con evidencia o sospecha de neumonía recurrente o persistente y en los que padecen inmunosupresión, sí debe efectuarse una radiografía de control al menos 2-3 semanas tras iniciarse el tratamiento.
Constituyen factores de riesgo(35): las malformaciones anatómicas, asma o aspiración a la vía aérea, enfermedad neuromuscular (neumonías repetidas por aspiración), fibrosis quística, disquinesia ciliar, bronquiectasias, inmunodeficiencias congénitas o adquiridas, cardiopatías congénitas y desnutrición severa.
La gran mayoría (81-89%) tienen una causa identificable, muchas veces conocida (asma, cardiopatía congénita, reflujo gastroesofágico, enfermedad neuromuscular…) ya antes de repetirse sus episodios neumónicos. La más frecuente es el asma, seguida de la aspiración, a menudo en el contexto de enfermedades neuromusculares. La frecuencia relativa de las etiologías encontradas en distintos estudios puede depender de muchos factores: algunos estudios son efectuados sólo en pacientes hospitalizados (encuentran menos asmáticos y/o más cardiopatías congénitas), otros en países donde la inmunodeficiencia ligada a la infección VIH es frecuente, etc. Su orientación diagnóstica debe iniciarse en el ámbito de la Atención Primaria, aunque muchas veces requerirá, para su diagnóstico etiológico definitivo y su seguimiento, la derivación a atención especializada (neumología, alergia o infectología, según el contexto clínico) u hospitalaria.
Historia clínica y exploración física
Es importante una historia clínica detallada, ya desde la primera valoración, procurando obtener la máxima información posible de los anteriores episodios, además del más reciente. La exploración clínica debe realizarse de forma completa, no sólo en relación al aparato respiratorio.
La anamnesis puede orientar ya hacia alguna patología o grupo de ellas:
• Signos de infección persistente durante y entre los episodios de neumonía.
• Asociación con otras infecciones(36) digestivas, cutáneas, neurológicas y ORL (sugieren inmunodeficiencia), o diarrea crónica con o sin desnutrición (fibrosis quística).
• Antecedentes familiares de inmunodeficiencia, déficit de a-1-antitripsina, fibrosis quística, discinesia ciliar primaria u otras patologías que cursen con infecciones de repetición, en especial respiratorias.
• Historia de atragantamiento, sospecha de aspiración alimentaria (frutos secos, por ejemplo) o de cuerpo extraño.
Debe comprobarse la práctica del cribado neonatal de fibrosis quística, allí donde se practica. Uno de los argumentos para la práctica de dicho cribado es precisamente evitar demoras en el tratamiento e investigaciones innecesarias en pacientes que se sabe van a estar afectos de fibrosis quística, cuando empiecen a presentar patología respiratoria.
Debe interrogarse acerca de la presencia de:
• Fiebre: grado, duración y patrón.
• Síntomas respiratorios: tos y sus características, predominio horario o estacional y aparición con el ejercicio, expectoración, especialmente amarilla o verdosa, estridor, sibilancias y dificultad respiratoria.
• Tos durante las tomas.
• Síntomas digestivos: vómitos y diarrea.
• Síntomas generales: fiebre, astenia y anorexia.
• Progresión de la curva ponderal.
Es necesario revisar todas las imágenes radiológicas disponibles de los sucesivos episodios de neumonía y, si existen, desde antes de ocurrir el primero de ellos. Deben aclararse, en lo posible, los tratamientos recibidos con anterioridad, en especial antibióticos, y las indicaciones para las que al menos supuestamente fueron indicados.
Orientación diagnóstica
La edad es un factor a tener en cuenta. Las neumonías recurrentes en los primeros meses de vida suelen deberse a anomalías estructurales pulmonares o cardiopatías congénitas. En preescolares, predomina el reflujo gastroesofágico y ya empiezan a detectarse los primeros casos relacionados con asma bronquial, que se hacen mayoritarios en niños de más edad. Los niños afectos de alteraciones neuromusculares pueden presentar neumonía aspirativa a cualquier edad.
Para una primera orientación(37-40), lo más útil es clasificarlos de entrada en 2 grandes grupos: neumonía localizada en el mismo lugar anatómico (Tabla X) o en distintos lugares (Tabla XI).
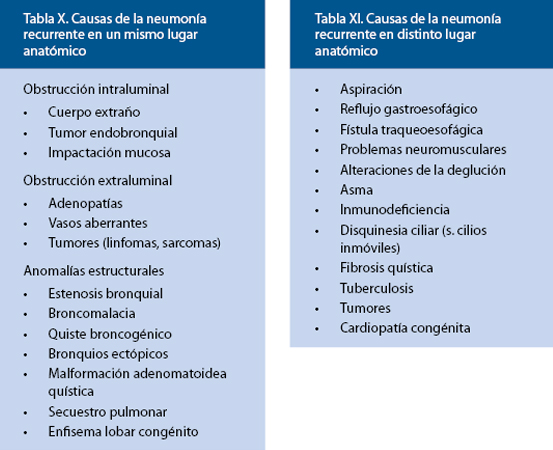
La neumonía recurrente en la misma localización sugiere la existencia de obstrucción o compresión bronquial, anomalías estructurales (secuestros, malformación adenomatoidea quística, anomalías bronquiales, fístula traqueoesofágica) o aspiración, por lo que las exploraciones principales son la fibroendoscopia y la TAC, con contraste o de alta resolución, y la RMN. Si se encuentran adenopatías, deberá practicarse un PPD y, eventualmente, serología para histoplasmosis, blastomicosis y coccidiomicosis, si la historia es sugestiva.
La broncoscopia flexible permite constatar la obstrucción intra o extraluminal y, si existe atelectasia, puede ser terapéutica. La broncoscopia rígida se utiliza si se sospecha la presencia de un cuerpo extraño, pues permitirá su extracción.
• Obstrucción intraluminal: aspiración de cuerpo extraño, tumor intrabronquial o impactación mucosa.
• Compresión extraluminal: linfadenopatías (tuberculosis), tumores (linfomas o sarcomas) o vasos aberrantes.
• Anomalías estructurales: broncomalacia, estenosis bronquial, quiste broncogénico, secuestro pulmonar, malformación adenomatoidea quística, enfisema lobar congénito o bronquios ectópicos o supernumerarios.
Merece consideración especial el síndrome del lóbulo medio, neumonía o atelectasia persistente o recurrente de ese lóbulo del pulmón derecho (o de la língula), relacionada con sus características anatómicas, que le hacen más vulnerable a la obstrucción y más propenso a colapsarse y a infectarse. Las causas más frecuentes son las infecciones, sobre todo por neumococo y Haemophilus, aunque debe considerarse también la tuberculosis (adenopatías), el asma y la aspiración alimentaria o de cuerpo extraño. La sintomatología predominante puede ser tos persistente. Lo inespecífico de los síntomas a menudo retrasa el diagnóstico, aumentando el riesgo de desarrollar bronquiectasias. Estaría indicada la broncoscopia, diagnóstica y muchas veces terapéutica, al poderse aspirar las secreciones acumuladas en el bronquio, cuando no se resuelve el problema en un espacio de tiempo prudente (2 meses) con tratamiento médico intensivo. La evolución suele ser buena, pero pueden quedar bronquiectasias residuales.
La neumonía recurrente en distintas localizaciones debe hacer pensar inicialmente en aspiraciones repetidas por incoordinación deglutoria o reflujo gastroesofágico, inmunodeficiencia y, sobre todo, considerar el asma bronquial, su causa más frecuente. Debe descartarse la fibrosis quística y pensar en la discinesia ciliar primaria si coexiste rinitis purulenta, otitis de repetición o sinusitis crónica. En el síndrome de Kartagener, existen sinusitis, situs inverso y bronquiectasias. La tos crónica o recurrente, productiva, con expectoración purulenta, sugiere la existencia de bronquiectasias (primarias o secundarias a discinesia ciliar, fibrosis quística o inmunodeficiencia).
• Aspiración repetida: alteraciones de la deglución, fístula traqueoesofágica o reflujo gastroesofágico.
• Alteraciones del aclaramiento mucociliar de las vías respiratorias: asma bronquial, discinesia ciliar, fibrosis quística o bronquiectasias.
• Inmunodeficiencias.
• Cardiopatías congénitas, especialmente con shunt izquierda-derecha.
Aquí, el diagnóstico suele precisar otras exploraciones complementarias, el orden y la complejidad de las cuales deberá ser orientado por la historia clínica:
• Test del sudor para descartar la fibrosis quística (diagnóstico en el 98% de casos).
• Hemograma completo (neutropenia, linfopenia…).
• Estudio inmunológico para descartar inmunodeficiencia, sobre todo humoral (déficit IgA, hipogammaglobulinemia). Ocasionalmente, estudio de subpoblaciones linfocitarias (B y T).
• Tránsito esofagogástrico o pH-metría si se sospecha reflujo.
• Estudio de deglución, videofluoroscopia o endoscopia, si la historia sugiere aspiración repetida.
• Estudio alergológico y funcional respiratorio, si la edad del niño lo permite, con pruebas de provocación y broncodilatación con beta-2, para el diagnóstico de asma bronquial o de hiperreactividad inespecífica.
• Estudios de imagen (TAC de alta resolución o RMN).
La TAC estaría indicada principalmente cuando se sospecha complicación de una neumonía previa (neumonía necrotizante y absceso pulmonar), en la exclusión de una anomalía anatómica o estructural subyacente, la detección de masas perilaríngeas o mediastínicas (tumores, adenopatías) y anillos vasculares.
La TAC de alta resolución resulta especialmente útil para la detección de bronquiectasias (incluyendo las presentes en la fibrosis quística) y el estudio de la patología intersticial pulmonar.
El estudio inmunológico puede demostrar una ausencia de IgG (agammaglobulinemia de Bruton), déficit de IgG con o sin alteraciones de la función de las células B y T (inmunodeficiencia común variable) o de alguna de sus subclases (IgG2). El déficit de IgA no suele causar problemas importantes en ausencia de un déficit asociado de alguna subclase de IgG. Entre las alteraciones de la fagocitosis, la más común es la enfermedad granulomatosa crónica. Las poblaciones de linfocitos T se encuentran alteradas en la infección por VIH, pero aquí suele haber otros datos que orientan en este sentido.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. UNICEF/WHO. Pneumonia: The forgotten killer of children; 2006.
2.*** Irastorza I, Landa J, González E. Neumonías. Etiología y diagnóstico. An Pediatr Contin. 2003; 1 (1): 1-8.
3. García-Rodríguez JA, Fresnadillo MJ. Microbiología de la infección respiratoria pediátrica. An Esp Pediatr. 2002; 56 (supl 1): 2-8.
4. Alario AJ, McCarthy PL, Markowitz R, et al. Usefulness of chest radiography in children with acute lower respiratory tract infection. J Pediatr. 1987; 111: 187-93.
5. Davies HD, Wang EE, Manson D, et al. Reliability of the chest radiograph in the diagnosis of lower respiratory infections in young children. Pediatr Infect Dis J. 1996; 15: 600-4.
6. Hall CB, Disney FA. Chest roentgenograms in children with clinically diagnosed pneumonia. Pediatr Infect Dis J. 1989; 8: 8954-6.
7. Courtoy I, Lande AE, Turner RB. Accuracy of radiographic differentiation of bacterial from nonbacterial pneumonia. Clin Pediatr (Phila). 1989; 28 (6): 261-4.
8. Liñán S. Pruebas diagnósticas en patología infecciosa respiratoria. An Esp Pediatr. 2001; 54 (Supl 2): 1-5.
9. Pueyo Val J, et al. Utilidad de las pruebas de diagnóstico rápido en las enfermedades infecciosas. FMC. 2009; 16 (2): 58-67.
10. Esparza MJ. Valor diagnóstico de la proteína C reactiva en las infecciones del tracto respiratorio inferior: revisión sistemática. Evid Pediatr. 2007; 3: 27.
11. Clark JE, Hammal D, Spencer D, Hampton F. Children with pneumonia: how do they present and how are they managed? Arch Dis Child. 2007; 92: 394-8.
12. Neuman MI, Monuteaux MC, Scully KJ, Bachur RG. Prediction of pneumonia in a pediatric emergency department. Pediatrics. 2011; 128: 246-53.
13. Margolis P, Gadomski A. Does this infant have pneumonia? JAMA. 1998; 279: 308-13.
14. Palafox M, Guiscafré H, Reyes H, Muñoz O, Martínez H. Diagnostic value of tachypnoea in pneumonia defined radiologically. Arch Dis Child. 2000; 82: 41-5.
15. Mower, WR, Sachs C, Nicklin E, Emily L, Baraff LJ. Pulse oximetry as a fifth pediatric vital sign. Pediatrics. 1997; 99 (5): 681-6.
16. Mahabee-Gittens E, Grupp-Phelan J, Brody A, et al. Identifying children with pneumonia in the emergency department. Clin Pediatr (Phila). 2005; 44 (5): 427-35.
17.* Lynch T, Platt R, Gouin S, Larson C, Patenaude Y. Can we predict which children with clinically suspected pneumonia will have the presence of focal infiltrates on chest radiographs? Pediatrics. 2004; 113 (3 Pt 1): e186-9.
18.*** Úbeda MI, Murcia J, Grupo de Vías Respiratorias. Protocolo de neumonía adquirida en la comunidad. El pediatra de atención primaria y la neumonía. Protocolo del GVR [consultado 01/11/2011]. Disponible en: www.aepap.org/gvr/protocolos.htm.
19.*** Moreno A, Liñán S. Neumonías. Orientación terapéutica. An Pediatr Contin. 2003; 1 (1): 9-14.
20.*** Liñán S, Cobos N, Escribano A, et al. Sociedad Española de Neumología Pediátrica. Protocolo de tratamiento de las neumonías en la infancia. An Esp Pediatr. 1999; 50: 189-95.
21.*** Hernández A, Guerra F. Neumonía (v.2/2008). Guía_ABE. Infecciones en pediatría. Guía rápida para la selección del tratamiento antimicrobiano empírico [consultado 01/11/2011]. Disponible en: http://infodoctor.org/gipi/guia_abe/.
22. Rojas MX, Granados C. Antibióticos orales versus parenterales para la neumonía grave en niños. Biblioteca Cochrane Plus, número 3, 2007. Oxford, Update Software Ltd.
23.** Fernández M, Martín P, Perdiki L. Neumonía adquirida en la comunidad y control radiológico. Rev Pediatr Aten Primaria. 2005; 7: 107-14.
24. Tan TQ, Mason EO, Wald ER, et al. Clinical characteristics of children with complicated pneumonia caused by streptococcus pneumoniae. Pediatrics. 2002; 110: 1-8.
25. Li ST, Tancredi DJ. Empyema hospitalizations increased in US children despite pneumococcal conjugate vaccine. Pediatrics. 2010; 125 (1): 26-33.
26. Hendrickson DJ, Blumberg DA, Joad JP, Jhawar S, McDonald RJ. Five-fold increase in pediatric parapneumonic empyema since introduction of pneumococcal conjugate vaccine. Pediatr Infect Dis J. 2008; 27 (11): 1030-2.
27. Mera R, Miller LA, Fritsche TR, Jones RN. Serotype replacement and multiple resistance in Streptococcus pneumoniae after the introduction of the conjugate pneumococcal vaccine. Microb Drug Resist. 2008; 14 (2): 101-7.
28.** Aracil FJ. Neumonía complicada. Bol Pediatr. 2008; 48: 183-8.
29.** Lozano J. Complicaciones respiratorias asociadas a neumonía bacteriana. Neumología Pediátrica. 2007; 2: 70-5.
30.* Asensio O, Moreno A, Bosque M. Derrame pleural paraneumónico. Guía diagnóstico-terapéutica. Protocolos de la AEP: Neumología (2); 2008.
31. Balfour-Lynn IM, Abrahamson E, Cohen G et al. BTS guidelines for the management of pleural infection in children. Thorax. 2005; 60: 1-21.
32. Avansino B, Goldman B, Sawin R, et al. Primary operative versus non-operative therapy for pediatric empyema: a metaanalysis. Pediatrics. 2005; 115: 1652-9.
33.* Navarro M, Andrés A, Pérez G. Neumonía recurrente y persistente. Protocolos AEP. Neumología (6); 2009.
34. Rubin BK. Evaluation of the child with recurrent chest infections. Pediatr Infect Dis J. 1985; 4: 88-98.
35.* Cabezuelo G, Vidal S, Abeledo A, Frontera P. Causas subyacentes de neumonía recurrente. An Pediatr (Barc). 2005; 63 (5): 409-12.
36. Liñán S. Patología pulmonar recurrente de origen infeccioso. An Esp Pediatr. 2000; 52 (Supl 5): 61-7.
37.*** Couriel J. Assesment of the child with recurrent chest infections. Br Med Bull. 2002; 61: 115-32.
38. Caussade MS. Neumonía recurrente. Neumología Pediátrica. 2007; 2: 76-9.
39. Panitch HB. Evaluation of recurrent pneumonia. Pediatr Infect Dis J. 2005; 24: 265-6.
40. Kaplan K, Beierle E, Faro A, et al. Recurrent pneumonia in children: a case report and approach to diagnosis. Clin Pediatr. 2006; 45: 15-22.
Bibliografía recomendada
– BTS guidelines for the management of community acquired pneumonia in children: Thorax. 2002; 57 (Suppl 1): 1-24.
– BTS guidelines for the management of community-acquired pneumonia in children: summary of key points for primary care. British Thoracic Society. 2002. Disponible on-line [consultado el 04-02-2012] http://thorax.bmj.com/content/suppl/2002/05/28/57.suppl_1.i1.DC1/1.pdf
Guía de práctica clínica de la British Thoracic Society sobre el manejo de la neumonía adquirida en la comunidad en el niño. Absolutamente recomendable su lectura detenida, y casi obligada al menos la de su excelente y completa sinopsis de recomendaciones principales, en la que incluye el grado de evidencia existente y fuerza de la de recomendación para cada una de ellas.
– Méndez A, García MJ, Baquero F, Del Castillo F. Neumonía adquirida en la comunidad. Protocolos AEP. Infectología (7); 2009.
Artículo de revisión, aunque sin características de Guía de Práctica Clínica, publicado en la serie de Protocolos de la AEP (Infectología).
– Moreno A, Liñán S. Neumonía adquirida en la comunidad. Rev Esp Pediatr. 2002; 58 (S1): 21-6.
– Ostapchuk M, Roberts DM, Haddy R. Community-acquired pneumonia in infants and children. Am Fam Physician. 2004; 70: 899-908.
– Durbin W, Stille C. Pneumonia. Pediatrics in Review. 2008; 29: 147-60.
Los tres artículos constituyen revisiones de la neumonía infantil adquirida en la comunidad.
– Bush A. Infecciones respiratorias recurrentes. En: Chang A (ed). Clínicas Pediátricas de Norteamérica. Trastornos e infecciones comunes: un enfoque basado en la evidencia. 2009. 56(1). p. 67-100.
Revisión del manejo de las infecciones respiratorias recurrentes en la infancia, incluyendo la neumonía.
– Navarro M, Andrés A, Pérez G. Neumonía recurrente y persistente. Protocolos AEP. Neumología (6); 2009.
Artículo de revisión, aunque sin características de Guía de Práctica Clínica, publicado en la serie de Protocolos de la AEP (Neumología).
| Caso clínico |
|
Acude a la consulta una niña de 6 años de edad, por fiebre de 36 horas de evolución y tos desde hace varios días. Ha presentado dos vómitos alimentarios y se queja de dolor abdominal pero no ha tenido diarrea. La exploración muestra afectación del estado general. Saturación O2: 94%, Tª axilar: 39,7°C, FR: 52 x min, FC: 106 x min, retracciones intercostales discretas, sin otros signos de distrés respiratorio, auscultación de sibilantes espiratorios diseminados y crepitantes inspiratorios localizados en base pulmonar en plano posterior. El resto de la exploración es irrelevante. Se administran 3 dosis de salbutamol inhalado, mejorando el cuadro clínico, ya que desaparecen los sibilantes y el mínimo distrés que la paciente presentaba. Al persistir la taquipnea y la auscultación de crepitantes localizados tras desaparecer totalmente los sibilantes, se solicita una radiografía de tórax con proyecciones de frente y perfil. La radiografía demuestra la presencia de una condensación a nivel del lóbulo inferior izquierdo, con algún broncograma en su interior, que coexiste con atelectasias laminares dispersas y aplanamiento diafragmático bilateral que se atribuye al atrapamiento aéreo. |