 |
| Regreso a las bases |
M.A. Zafra Anta
Médico Adjunto del Servicio de Pediatría, Área de Neumopediatría.
Hospital Universitario Fuenlabrada. Madrid
Metodologías diagnósticas en neumología pediátrica. Función pulmonar
Introducción
La ventilación se realiza según la mecánica de la respiración: acción de fuerzas generadas por los músculos respiratorios sobre el conjunto de la caja torácica y los pulmones y sus volúmenes(1,2).
El pulmón está constituido por unos 250.000 bronquiolos y 300 millones de alveolos que, desplegados, ocuparían una superficie de 70 metros cuadrados(2). La ramificación bronquial y la superficie alveolar ha sido descrita como un fractal(3); esto es, un tipo de estructura semi-geométrica que se ramifica y pliega sobre sí misma y se repite a diferentes escalas con autosimilitud. La forma fractal de los bronquios, alveolos y la barrera alveolocapilar pulmonar permite una optimización del aprovechamiento del espacio en la barrera alveolocapilar, y con ello se hace máximo el intercambio de CO2 y O2 en cada inspiración.
El estudio de la función pulmonar permite medir las capacidades ventilatorias, realizar una valoración diagnóstica objetiva de las enfermedades respiratorias e identificar la presencia de trastornos fisiopatológicos obstructivos y restrictivos. La utilización de las técnicas de exploración funcional respiratoria en Pediatría está cada vez más extendida, tanto en atención especializada hospitalaria como en Atención Primaria. Esta revisión se hace con la intención de contribuir a conocerlas en su importante valor actual. Entre las pruebas funcionales respiratorias de uso más frecuente para evaluar al niño y al adolescente con enfermedad respiratoria, destacan: espirometría, prueba de broncodilatación, pruebas de provocación bronquial con ejercicio y metacolina y flujometría(2,4,5). En niños no colaboradores, se utilizan otras pruebas, como: la pletismografía corporal, la oscilometría por impulsos, las resistencias por oclusión o la compresión toracoabdominal(2,6).
A lo largo de este texto, donde se dice niños y adolescentes se refiere a los dos géneros, salvo que se especifique lo contrario.
Breve reseña histórica
El término espirometría –spirare (latín: respiración y, a su vez, del griego spiro) metría (griego: metron medir)– se atribuye a Antoine L. Lavoisier. Se puede decir que la primera exploración funcional respiratoria moderna, así como el primer intento de medida del consumo de oxígeno por el hombre fue comunicada por los químicos Lavoisier y A. Seguin en 1789. El concepto spiro no sólo tiene el significado de respiración, sino que en la Antigua Grecia su raíz indicaba “fuego”, por cuanto los griegos creían que la respiración servía para mantener el fuego interior del organismo que sustentaba la vida y su vigor. Quizá no andaban muy desencaminados, por cuanto la respiración mantiene el metabolismo aerobio.
El invento del espirómetro moderno se ha atribuido al cirujano británico John Hutchinson; aunque, otros autores (p. ej.: Bourgery, en París, 1843) antes y después que él contribuyeron a su desarrollo. Entre 1846 y 1854, Hutchinson acuñó el término de capacidad vital, diseñó espirómetros, publicó medidas espirométricas y propuso que la espirometría podía tener valor para estudiar la función pulmonar en pacientes con enfermedad respiratoria. Otro autor que hay que destacar, cien años después, es el francés Robert Tiffeneau, que inició el desarrollo de la espirometría dinámica hacia 1945-49, y propuso que los cambios en los flujos espiratorios tras broncodilatador y broncoconstrictor podían servir para valorar a los pacientes con enfermedad de la vía aérea. En esa década de los 1950, se reconocieron útiles para medir la función pulmonar, primero, el volumen espiratorio forzado en 1 segundo y, posteriormente, el valor de la curva flujo-volumen en la espirometría forzada (véase Gaensler, Fry, Hyatt y otros)(1).

La estandarización de los equipos y de la realización de la prueba de espirometría forzada se publicó por primera vez en 1979 por la American Thoracic Society (ATS) y, para niños, en 1980 por Taussig y cols. En España, la SEPAR (Sociedad Española de Neumología y Cirugía Torácica) editó una primera normativa en 1985(2).
Espirometría
Concepto
La espirometría es una herramienta fundamental en el estudio de procesos que afectan a la fisiología respiratoria, mide de forma controlada la magnitud absoluta de las capacidades y volúmenes pulmonares y la velocidad con que pueden ser inhalados o exhalados (flujos ventilatorios), con lo que permite reconocer si hay las limitaciones obstructivas y restrictivas. Es el método inicial más práctico para la valoración de las enfermedades obstructivas pulmonares, como: asma, fibrosis quística o las secuelas de la displasia broncopulmonar-enfermedad crónica pulmonar del prematuro.
La espirometría puede ser simple o forzada. La simple mide volumen corriente o volumen tidal, es decir, el aire utilizado durante un ciclo respiratorio normal, y mide también el volumen máximo que se puede inspirar o espirar, esto es, la capacidad vital. La espirometría forzada, que mide los volúmenes durante maniobras realizadas con la mayor rapidez que el paciente pueda ejecutar, tiene mayor relevancia clínica(1,4) (véase la tabla I).
La representación gráfica puede ser entre estas variables (volumen/tiempo) o entre sus derivadas (flujo/volumen). Inicialmente, los viejos espirómetros eran de campana, con quimógrafo y ofrecían la curva volumen/tiempo. Desde hace décadas, en la práctica clínica, han sido sustituidos por los neumotacómetros, que permiten relacionar la lectura instantánea de flujo con el cálculo diferencial del volumen, obteniendo parámetros y una representación gráfica del trazado de flujo/volumen. El neumotacógrafo consiste en un tubo con una resistencia fija, provisto de unos detectores de presión a la entrada y salida del tubo. La diferencia de presión es enviada a un amplificador y luego procesada. La tecnología biomédica ha desarrollado la posibilidad de acoplar espirómetros no electrónicos a accesorios electrónicos, y también espirómetros electrónicos, que utilizan un transductor neumotacómetro (tipo Fleish), tipo turbina o bien desechable (tipo Lilly), que ofrecen una mayor rapidez de lectura, memoria y lecturas ayudadas por ordenador. Permiten además envío por Internet de pruebas de pacientes (telemedicina), datos de chequeo del equipo y actualización de software (véase fig. 1).
Realización
La metodología de la espirometría debe ser seguida de forma estricta, según los estándares, para obtener resultados adecuados. Las especificaciones sobre los espirómetros y requisitos que deben cumplir, así como las recomendaciones sobre la instrucción, ejecución e interpretación de los resultados de la prueba son publicadas y actualizadas periódicamente por la ATS, la European Respiratory Society(7), así como por el Grupo de Técnicas de la Soci edad de Neumología Pediátrica de la AEP(6). Hay que realizar la prueba en un espacio físico adecuado. El personal debe ser cualificado (diplomado-grado de enfermería o similar) y estar preparado, con entrenamiento en un centro adecuado, conocer la técnica y sus fines, mostrar habilidad en el trato con enfermos y con niños y adolescentes, así como tener buena capacidad de toma de decisiones. Se debe explicar el procedimiento, hacer una demostración o incluso dejar que los “novatos” vean cómo hacen la maniobra los “veteranos”. La secuencia de la maniobra tendrá lenguaje claro y enérgico, verbal y gesticular (algunas enfermeras dicen, con lenguaje de cercanía, por ejemplo: “parecerá que te grito, pero no estoy enfadada”). Para los niños más pequeños, es recomendable disponer de sistemas de imágenes de incentivación en la pantalla del ordenador.

Figura 1. Sala-laboratorio de función pulmonar ambulatoria (en la foto, el espirómetro está al lado del medidor portátil de óxido nítrico exhalado).
El resumen de la técnica de la espirometría forzada es como sigue(2,4,5,8): se realiza inspiración rápida y completa, se debe mantener el aire 1-2 segundos e iniciar espiración forzada enérgica que se continúa hasta volumen residual. Se realizan un mínimo de 3 maniobras aceptables y un máximo de 8 intentos. Se eligen los mejores valores de FVC (capacidad vital forzada) y FEV1 (volumen espiratorio forzado en el primer segundo) obtenidos de cualquier maniobra y los mesoflujos de la mejor de las pruebas (las de mayores FEV y FVC). El tiempo espiratorio forzado debe ser mayor de 1 segundo en niños menores de 8 años y más de 2 segundos en los mayores de 8 años, y la diferencia entre los dos mejores FEV1 y FVC debe ser menor del 5% (o <200 ml). En adultos, el tiempo recomendado para completar la espiración forzada es de 6 segundos (véase la tabla II).

Recomendaciones para antes de la prueba(4,8):
• Ayunas de más de 2 h, evitar comidas previas abundantes y bebidas estimulantes. No llevar ropa ajustada.
• No realizar ejercicio vigoroso al menos 30-60 min. Abstenerse de fumar al menos 4 h.
• Controlar medicación que pueda interferir con los resultados: suspender ß-adrenérgicos de corta acción inhalados 6-8 h y, de larga, 24-48 h; los antihistamínicos 48 h, hasta 3 a 7 días, antileucotrienos 24 horas, teofilinas 12-48 horas). No hace falta retirar ni los corticoides inhalados ni los sistémicos (salvo a efectos de estudio).
Indicaciones y contraindicaciones
Las indicaciones son muy amplias por su gran rentabilidad diagnóstica funcional, por su bajo coste, por requerir poco tiempo para su realización (suele ser menos de 15 minutos) y por la ausencia de riesgos significativos si se realiza siguiendo las normas estandarizadas. La indicación puede ser con fines diagnósticos o de monitorización, en el ámbito de atención especializada hospitalaria, seguimiento ambulatorio, Atención Primaria, salud pública, investigación, medicina del deporte, medicina legal o evaluación de discapacidades(4,6,8) (véase la tabla III).

La mayoría de las contraindicaciones son relativas, deben valorarse individualmente (véase la tabla III). En la fase aguda de muchos de estos procesos, simplemente se pospondrá la realización de la espirometría para evitar molestias, complicaciones o resultados alterados.
Parámetros y curvas de la espirometría
• Curva volumen/tiempo. El registro de la curva muestra el tiempo en abscisas y el volumen en ordenadas (véase fig. 1). Permite estudiar la FVC, el FEV1, la relación FEV1/FVC y el FEF25-75%(2,4,6,8). Sólo el primer tramo de la curva es dependiente del esfuerzo del niño (véanse tabla I y fig. 2).
• FVC. Es un indicador de capacidad pulmonar y, en los individuos normales, sus valores son similares a los de la capacidad vital; pero, en ciertas circunstancias, es menor, por el colapso dinámico de la vía aérea. Está disminuida especialmente en enfermedades restrictivas y en los casos moderados o graves de enfermedad obstructiva (sobre todo por atrapamiento aéreo-hiperinsuflación).
• FEV1 (o VEMS). Mide el flujo de la vía aérea central, y su disminución tiene relación directa con la gravedad de la obstrucción bronquial. Es dependiente del esfuerzo. Está disminuido en las enfermedades obstructivas y, en menor cuantía, en las restrictivas.
En adultos con enfermedad pulmonar crónica, algunos autores plantean el uso futuro del FEV6 como alternativa a la FVC(9).
• Cociente FEV1/FVC. Su valor normal es del 80-85% y es el indicador espirométrico más sensible de obstrucción bronquial al flujo aéreo(2,4,8); aunque, en los casos graves, la disminución de ambos parámetros es similar y el cociente puede ser normal.
• Curva flujo/volumen. Se ha popularizado la curva flujo/volumen (espiratoria-inspiratoria), que representa la imagen habitual de la espirometría convencional en todo el mundo(2,4,6,8). La morfología de la curva nos da información de si hay patrón obstructivo o restrictivo, errores en la ejecución (tos, esfuerzo variable). Se registra el flujo en las ordenadas y los volúmenes dinámicos en la horizontal. Tiene un punto máximo al iniciar la espiración –pico espiratorio de flujo (peak expiratory flow PEF)– y disminuye hasta llegar al volumen residual. La curva suele ser convexa, mientras que tiende a la concavidad en las enfermedades obstructivas. La porción inspiratoria y el 25% inicial de la rama espiratoria son dependientes del esfuerzo, y no el resto espiratorio, hasta el plateau, porque es dependiente de la compresión dinámica de las vías aéreas.
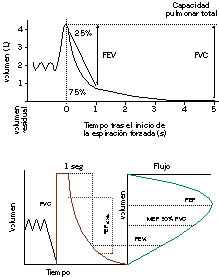
Figura 2. Espirometría, curva volumen/tiempo. Esquema de la relación curva volumen/tiempo y flujo/volumen.
La curva flujo-volumen nos da los parámetros antes mencionados, también el PEF y los “mesoflujos”.
• PEF o pico-flujo o flujo espiratorio máximo (FEM). Máximo flujo que el sujeto puede espirar en el curso de una espiración forzada. Está muy influido por el esfuerzo muscular y se considera, por tanto, dependiente de la colaboración. Puede estar disminuido en enfermedades obstructivas.
• FEF25-75. FEF50. En la parte central de la curva, no es dependiente del esfuerzo. Es un parámetro muy sensible de obstrucción bronquial inicial, pero no tiene tan buena especificidad como el FEV1.
Los espirómetros actuales incorporan también un “inspirómetro”, que representa una curva, no sólo del aire espirado, sino también del aire inspirado forzado desde el volumen residual hasta la TLC (capacidad pulmonar total). La curva de flujo/volumen inspiratorio forzado puede ser útil para diagnosticar una obstrucción al flujo extratorácico (como, por ejemplo, en disfunción de cuerdas vocales).
Interpretación
Los resultados de los parámetros se deben referir a los valores teóricos de la población de referencia y se expresan en porcentaje respecto de ellos. Hay valores publicados y estandarizados, siendo lo decisivo la talla y el sexo, así como la raza y, en menor medida, el peso(4,6,8). Se debe considerar para cada paciente el cambio de sus propios valores a lo largo del tiempo, además de la relación con los valores teóricos. Los resultados deben ser interpretados siempre en función de la historia clínica.
La utilidad de las pruebas de función respiratoria en el niño para clasificar la gravedad del asma es menor que en el adulto(10): la mayoría de los niños con asma, incluso moderado-grave, pueden tener resultados de FEV1 dentro de los valores de referencia (grado de evidencia C). La relación FEV1/FVC se correlaciona mejor con la gravedad del asma que el FEV1 en el niño (evidencia C).
La Guía GEMA 2009(10) especifica los niveles de evidencia de la eficacia de medidas terapéuticas y de estudios diagnósticos con la clasificación alfabética con gradiente de confianza (categoría A corresponde a alta calidad, D calidad muy baja). Esta clasificación es más útil en eficacia terapéutica, sobre todo de fármacos, que en estudios diagnósticos, donde muchas son clasificadas con una C (la evidencia proviene de estudios no aleatorizados, observacionales o no controlados).
Los valores espirométricos se consideran normales cuando son iguales o superiores al 80% del valor teórico en: FVC, FEV1 y FEM. Igual o superior al 75% del valor teórico en FEV1/FVC, e igual o superior al 65% del valor teórico en el flujo espiratorio forzado entre el 25-75% de la FVC.
Según los diversos valores obtenidos de la espirometría, podremos clasificar el tipo de alteración ventilatoria en obstructiva, restrictiva o mixta(4-6,8) (véanse tabla IV y fig. 3).


Figura 3. Patrones básicos de las alteraciones ventilatorias en la curva flujo/volumen.
En general, los trastornos obstructivos afectan a los índices de flujo y los restrictivos a los de volúmenes. La clasificación de la alteración funcional depende de la capacidad total pulmonar (TLC) y de la relación entre sus componentes. Como se menciona a continuación, la relación FEV1/FVC habitualmente nos permite establecer la clasificación de una enfermedad pulmonar sin necesidad de medir los volúmenes.
• Alteraciones ventilatorias de tipo obstructivo. La obstrucción de las vías aéreas desde la tráquea a los bronquiolos es limitante del flujo durante la espiración. La FVC se mantiene normal o ligeramente disminuida. Hay disminución marcada del FEV1 (y del FEF y de los flujos mesoespiratorios) y de la relación FEV1/FVC menor del 75 al 80%.
En una fase muy inicial de obstrucción de la vía aérea fina, como sucede en niños con asma leve, el FEV1 puede ser normal, y estar sólo afectados el FEF25-75. FEF50 (8).
Según el valor del FEV1, podemos cuantificar el grado de afectación funcional en leve (65-80%), moderada (50-64%) o grave (menor de 50).
• Alteraciones ventilatorias de tipo no obstructivo (restrictivas), por una reducción del tamaño del pulmón, por alteraciones en la caja torácica o por alteraciones neuromusculares. Hay disminución marcada del FVC, mientras que permanece normal o está aumentada la relación FEV1/FVC.
• Alteraciones ventilatorias de tipo mixto. Algunos procesos pueden cursar con ambos tipos de alteraciones ventilatorias, y se precisan técnicas más sofisticadas para completar el estudio funcional (medida de los volúmenes pulmonares estáticos para delimitar cada componente).
Limpieza del espirómetro y accesorios
El equipo de espirometría puede tener riesgo de transmisión de infecciones si no se toman las recomendaciones adecuadas. Deben leerse las especificaciones técnicas de cada aparato respecto a su limpieza y mantenimiento.
Durante la exploración funcional, especialmente en el contexto de tuberculosis, hemoptisis y lesiones orales, deben tomarse las precauciones adecuadas para evitar el riesgo de transmisión a personal sanitario o a pacientes por la exposición a otros: lavado de manos, dispositivos barrera (guantes), e incluso otros métodos de aislamiento respiratorio-gotas, si fuera preciso.
Realidad del uso de la espirometría. Necesidad de potenciarla
En nuestro medio, el uso de la espirometría en Atención Primaria no está tan generalizado como recomiendan las guías actuales, especialmente de asma. Es una técnica idónea para realizar en Atención Primaria: no es invasiva, es relativamente simple y requiere poco tiempo. Además, está el bajo coste de la prueba: el de los espirómetros oscila en 1.000-2.500 euros, y el coste de la espirometría es poco más de unos 30-40. Sin embargo, de la herramienta espirometría se sirven no mucho los médicos de familia, y aún menos los pediatras(9). Hace unos pocos años, Lora Espinosa, en 2003, revisó la atención por pediatras de Atención Primaria a los niños con asma y comprobó que sólo el 48,6% tenía disponibilidad de espirómetros, y únicamente un 17,3% realizaba espirometrías. Estos resultados contrastaban con la medición de PEF, que entonces era incluso más utilizado que la espirometría (en hasta el 33,2% de los niños con asma)(9). Aunque ha mejorado, parece que queda mucho por hacer respecto a la disponibilidad y el empleo de esta herramienta fundamental, al menos hasta estos momentos. Esto ocurre en nuestro país y en otros. En una encuesta nacional en Estados Unidos realizada en los años 2007-2008 a 360 médicos que veían a pacientes con asma, se notificó un mayor uso de la espirometría por los médicos de familia que por los pediatras (75% frente a 35%). Sólo la mitad de los respondedores conocían la interpretación correcta de los resultados de la espirometría(11). Afortunadamente, dos tercios de los respondedores estaban conformes con realizar entrenamiento o formación continuada para implementar la espirometría en su práctica clínica.
Las barreras percibidas más referidas para la infrautilización del espirómetro son(9,11): no disponer de espirómetro, la falta de tiempo y la inexperiencia, la falta de entrenamiento para la realización e interpretación de la espirometría, de formación continuada y no tener familiaridad con los aparatos y con los patrones de normalidad (y en EE.UU. también la dificultad en el reembolso del coste de la exploración). Probablemente, también, sea una razón la falta de motivación y el considerar que los datos obtenidos no son necesarios para el diagnóstico o el seguimiento terapéutico.
La calidad de las exploraciones todavía genera importantes controversias. Coincidimos con otros autores en que la mala calidad de algunas espirometrías realizadas en atención primaria no debe ser un argumento para no utilizarlas, antes al contrario, es un acicate para hacerlo mejor: revisar espirómetros utilizados y la técnica empleada. Hay maneras de lograr la formación continuada, con programas en presencia o basados en programas de ordenador y también en técnicas de aprendizaje por Internet.
La realización de talleres para conocer las bases del funcionamiento de la espirometría podría redundar en una práctica clínica más ajustada a las guías clínicas. Esto ya se tiene en cuenta en reuniones y congresos de las asociaciones de pediatría con implicación en Atención Primaria.
La formación en espirometría de los profesionales de Atención Primaria es una tarea que corresponde a las administraciones sanitarias, a las sociedades médicas, a los grupos de trabajo, e incluso a los propios médicos de familia, pediatras y neumólogos.
Flujometría. Pico-flujo o FEM
El flujo espiratorio máximo (FEM) o pico espiratorio de flujo o ápice de flujo espiratorio (peak expiratory flow PEF), representa un índice de obstrucción de las vías aéreas de gran calibre, depende de forma fundamental del esfuerzo coordinado voluntario. El FEM mantiene un ritmo circadiano: los valores son menores por la noche y al levantarse, y mayores por la tarde.
El medidor de FEM es un dispositivo sencillo, de pequeño tamaño, de bajo coste, portátil, fácilmente disponible para el uso domiciliario. Dicho así suena como un dispositivo ideal para el diagnóstico y el automanejo del paciente; pero las cuestiones son la validación de su uso y si éste realmente mejora el control del asma, como veremos más adelante. El medidor es un tubo cerrado en un extremo, con una boquilla en el otro. La presión que genera el flujo de aire espirado mueve un diafragma por un carril hasta el punto máximo de flujo espiratorio, con rango de 0 a 400 L/min en monitores FEM pediátricos, y de 0 a 900 en los de adultos.
Hace ya unas décadas, la monitorización del FEM se propuso como método para el control evolutivo y seguimiento del asma por su aparente buena correlación con el FEV1 obtenido por espirometría forzada, si bien con sensibilidad diagnóstica inferior(2,4-6,8). Incluso se propuso como método de diagnóstico alternativo, tras la espirometría, tanto por la medida del valor, como por la reversibilidad o prueba de broncodilatación, y también por la medida de la variabilidad. A los 15-50 min de salbutamol (o tras una tanda de tratamiento con glucocorticoides) un aumento del 15% sobre el valor previo se considera positiva y favorece el diagnóstico de asma. También, se propuso la monitorización ambulatoria del pico-flujo o FEV1 durante dos semanas y sin medicación de control, como una posible alternativa a una prueba de broncoprovocación. En niños, una variabilidad superior al 30% se considera característica de asma, en adultos es sobre el 20%.
Quizá todavía se puede decir que hay cierta controversia en el uso del FEM y su monitorización.
Controversia. Algunos documentos donde se menciona la utilidad del uso de FEM
En muchas guías y consensos actuales todavía se considera que el FEM o pico-flujo puede ser útil para el diagnóstico de asma, para su manejo y control y para la anticipación de las crisis agudas (especialmente en los consensos para la edad adulta)(8,10).
La guía GEMA 2009(10) da valor al FEM o PEF, alternativo a la espirometría con prueba broncodilatadora negativa en diagnóstico de asma si hay una variabilidad del 20% o superior en el FEM (grado de evidencia C). La Guía GEMA también menciona la utilidad del “PEF o FEV1” para clasificar el control del asma en adultos, la variabilidad del PEF para clasificar la gravedad del asma en niños (persistente moderada una variabilidad del 20-30%, y grave >30%). Por último, según GEMA, también puede tener un papel el PEF en el manejo de la exacerbación (pero sólo en adultos).
El consenso PRACTALL (European Pediatric Asthma Group) de 2008 menciona escuetas líneas sobre el estudio de la función pulmonar en niños, y habla del PEF y el asa de flujo-volumen como las mediciones más utilizadas y accesibles.
La British Guideline on the Management of Asthma de 2008, actualizada en mayo de 2011, afirma sobre la espirometría que ésta es el método preferido para demostrar la obstrucción de la vía aérea porque:
• Identifica con mayor claridad la obstrucción de la vía aérea que el pico-flujo espiratorio, y sus resultados dependen menos del esfuerzo realizado.
• La variabilidad del PEF puede aumentar en enfermedades que se confunden con frecuencia con asma.
• El PEF debe utilizarse sólo si no se dispone de espirometría. Es decir, no se excluye de forma definitiva el uso del PEF.
Controversia. Datos en contra del uso de FEM
El FEM proporciona una información con mucha variabilidad. Las diferencias de exactitud y reproducibilidad entre los diversos modelos son significativas, en los homologados se acepta un máximo del 10% intraaparato y del 5% entre aparatos del mismo modelo. Los medidores van perdiendo su exactitud y, al cabo de 12 meses, sólo el 63% de las medidas permanecen en los límites de confianza del 95%.
Además, la información es incompleta: no hay correlación entre el PEF y FEF50, que está descendido hasta en el 30-50% de los niños con asma asintomáticos. Es posible que el asma se manifieste más como una mezcla de obstrucción de las vías de grande y pequeño calibre que, a su vez, da lugar a una distribución desigual a lo largo de la vía aérea(1,2).
Muchos autores y Grupos de Trabajo opinan que la alta variabilidad intra e interindividual del FEM, la necesidad de estandarización de valores de referencia y la dudosa concordancia de sus variaciones con los cambios en la función pulmonar han invalidado su aplicación. Otros, ni la mencionan(4-6).
Los planes de actuación por escrito son una parte muy importante dentro del automanejo de la enfermedad, en estos planes los valores del PEF se han utilizado para modificar el tratamiento en función del porcentaje del mejor valor personal o del predicho. Gibson y cols., en un estudio, encontraron que usar el mejor valor personal condujo a reducción de ingresos y del número de visitas a Urgencias(12), y la revisión Cochrane de 2003, sobre educación para el automanejo del asma en niños, aporta la mejoría de la educación en las mediciones de los flujos(13). Por el contrario, en un ensayo aleatorizado, controlado, con grupos paralelos, Wensley y cols. no encuentran este beneficio(14). No encontraron diferencias significativas entre los pacientes con un plan de automanejo basado en síntomas y registro del PEF, frente a síntomas y registro no visualizado del PEF: en registros, en diferencias en escores de calidad de vida, ni en uso de urgencias durante 12 semanas de seguimiento. Los síntomas fueron más sensibles que el PEF para efectuar los cambios de tratamiento.
Perez-Yarza y cols. comunicaron que la medida de la variabilidad del FEM no era válida para clasificar el asma en niños por niveles de gravedad(15). El FEM no sustituye a la espirometría en la prueba de broncodilatación para el diagnóstico del asma. En niños con síntomas de asma y una espirometría normal, medir la variabilidad del FEM durante un periodo de dos semanas es de poca utilidad en el diagnóstico de asma.
Nuevos dispositivos. Futuro inmediato
A esta controversia se une el importante desarrollo que está teniendo lugar en biotecnología, con aparatos electrónicos que miden PEF de forma más aproximada al FEV1 medido con neumotacografía y que podrían aportar datos más objetivos y validados en situaciones de monitorización domiciliaria o en urgencias hospitalarias como, por ej.: el Piko-1(16). También, hay un desarrollo importante en espirometrías portátiles (Spirobank, Spirotube, Datospir Micro, Spirothor), con posibilidad de descargar los datos por USB, bluetooth, etc. Esto quizá permitirá una pequeña revolución en el futuro en el manejo del asma grave y otras patologías pulmonares con implicación del paciente en el automanejo, uso de telemedicina y coordinación entre niveles asistenciales.
Posibles indicaciones del FEM en la actualidad
Las posibles indicaciones del FEM se exponen a continuación, sabiendo que la realización de espirometrías y consultas médicas, con la frecuencia de visitas que se precise, así como la potenciación de la relación atención primaria-especializada, está más validada y debe ser lo prioritario. La utilidad del pico-flujo sigue siendo controvertida en el autocontrol del paciente(2,8,15). En el caso de indicar la monitorización del FEM, se incluirán siempre los síntomas en los planes de actuación, y se vigilará estrechamente si el FEM beneficia en el control del paciente. Y, ante una crisis aguda, para interpretar la gravedad de la crisis, el FEM se evaluará conjuntamente con parámetros clínicos y pulsioximétricos. Las indicaciones actuales quedan restringidas a ciertos casos de:
• Pacientes con asma persistente moderada y grave.
• Pacientes con mala percepción de síntomas, o con abuso de medicación de rescate.
• Tras exacerbaciones recientes y graves.
• Identificación de factores desencadenantes de crisis.
Evaluación de la función pulmonar en preescolares. Espirometría en el niño entre 3 y 6 años
Se ha comprobado que los niños preescolares pueden alcanzar la limitación al flujo durante la espiración forzada. Los criterios de validez de una espirometría deben ser diferentes respecto de otras edades. Hay estudios donde se consiguen hasta un 80% de espirometrías técnicamente aceptables y reproducibles en niños y niñas de 3 a 6 años de edad entrenados adecuadamente(17).
Los preescolares tienen volúmenes pulmonares menores y proporcionalmente vías aéreas más grandes que los niños mayores y adultos. Por ello, la espiración forzada se completa en menos tiempo que en el adulto, a veces incluso en menos de 1 segundo. La morfología del asa espiratoria es diferente, la fase de descenso es con mucha frecuencia convexa, lo que indica cese rápido del flujo al final de la maniobra espiratoria. Esto podría depender de diferencias fisiológicas; pero también quizá tenga relación con el esfuerzo(2,10,17).
Los parámetros más utilizados son el FVC para el volumen pulmonar y el FEV1 para determinar la obstrucción. Se han propuesto parámetros como el FEV0,75 y el FEV0,5 (evidencia C).
Función pulmonar en preescolares no colaboradores
En los lactantes y niños menores no colaboradores pueden utilizarse otro tipo de pruebas, más complejas, en el ámbito de Atención Especializada, y muchas ocasiones de no fácil disponibilidad. Entre las distintas pruebas, destacan la dilución de gases y la técnica de la compresión torácica externa a través de chaquetilla inflable (RTC, tidal rapid thoraco-abdominal compression), que puede realizarse, además, con insuflación rápida previa (raised volume rapid thoraco-abdominal compression technique, RVRTC). De esta forma, pueden evaluarse variables similares obtenidas con la espirometría forzada en niños mayores, como la capacidad vital forzada (FVC) y los volúmenes espiratorios forzados (FEV0,4, FEV0,5, FEV0,75, FEV1) además de la morfología e índices de la curva flujo-volumen obtenida. Recientemente, se han publicado las recomendaciones para realizar pletismografía corporal en lactantes, que permiten la determinación de la FRC, sRaw y sGaw(18). En lactantes pequeños no colaboradores, continúa siendo necesaria la sedación; sin embargo, se ha descrito la posibilidad de la determinación de la sRaw, incluso en niños a partir de los 2 años, mediante fórmulas matemáticas obtenidas a través de la relación entre los cambios de presión en la cabina pletismográfica y el flujo respiratorio, sin interrupción del flujo(1,2,4,18). Las pruebas basales de función pulmonar son poco útiles para el diagnóstico de asma en preescolares, siendo más útil demostrar una respuesta broncodilatadora o una prueba de provocación bronquial (evidencia D).

Figura 4. Espirometría basal normal. Curva flujo-volumen y parámetros corregidos respecto a valores de referencia para peso-talla. Prueba de broncodilatación normal.

Figura 5. Espirometría basal con FEF 50 bajo (<65%). Curva flujo-volumen y parámetros corregidos respecto a valores de referencia para peso-talla. Prueba de broncodilatación alterada.
Prueba de broncodilatación
La prueba de broncodilatación objetiva la reversibilidad de la obstrucción del flujo de la vía aérea. Consiste en repetir una prueba de función pulmonar (llamada entonces basal) tras la administración de un fármaco broncodilatador. Debe constituir una exploración habitual en el estudio de la función pulmonar en el niño y adolescente ante la sospecha o evidencia de la existencia de un patrón obstructivo, cualquiera que sea el ámbito asistencial en el que se realice. Debe realizarse en la primera visita, aunque los valores basales de función pulmonar sean normales; también sirve para estudiar los cambios evolutivos(4-6,8,10) (véanse figs. 4 y 5). La realización de estudios epidemiológicos y de ensayos clínicos es también una indicación de la prueba con broncodilatación.
• Técnica: espirometría basal, y repetir prueba tras 15-20 minutos de medicación broncodilatadora (agonistas ß-2-adrenérgicos): salbutamol o terbutalina. Dosis de salbutamol: 200-400 µg mediante MDI (inhaladores de dosis medida) y cámara. Dosis de terbutalina: 500 µg en dispositivo de polvo seco. Sólo en la enfermedad pulmonar crónica (fibrosis quística) se emplean anticolinérgicos, por su eficacia, y se valorará la prueba broncodilatadora a los 30 min de la inhalación.
• Se expresa el aumento en porcentaje según las fórmulas:
Cambio FEV1 porcentual respecto al teórico:
[FEV1 post – FEV1 pre]/FEV1 teórico x 100 = ?%
Cambio FEV1 porcentual respecto al previo:
[FEV1 post – FEV1 pre]/FEV1 previo x 100 = ?%
Si el FEV1 aumentó el 9% o más sobre el valor teórico o un 12% sobre el previo basal o de 200 ml en valores absolutos (aunque, por su menor volumen pulmonar en niños, no es necesariamente exigible superar esos 200 ml), la prueba de broncodilatación se considera positiva y muy sugestiva de asma (evidencia C)(4,6,10).
Antes de realizar la prueba deben suprimirse los medicamentos que puedan interferir con la respuesta bronquial.
Los riesgos relativos son por el uso de ß-2: tirotoxicosis, insuficiencia cardiaca, hipertensión arterial, diabetes mellitus o bajo tratamiento con aminas simpaticomiméticas.
Para determinar la reversibilidad de la obstrucción de la vía aérea, se pueden utilizar otras pruebas de función pulmonar distintas de la espirometría forzada. La interpretación en estos casos es más compleja en general, la variabilidad es mayor y más difíciles de establecer los puntos de corte. En pletismografía corporal: aumentos superiores de la conductancia (sGaw) del 55% o bien caída de la resistencia (sRaw) del 25%. En oscilometría de impulsos: si la resistencia a 5 Hz cae un 25-30%. En resistencia por interrupción (Rint): caída de la resistencia más del 35%(4,6,8).
Medida de la hiperrespuesta bronquial
La hiperrespuesta bronquial se mide mediante pruebas de broncoprovocación; para lo cual, se emplean estímulos bronconstrictores(1,4,6,8), que se clasifican en:
• Estímulos directos: actúan sobre los receptores del músculo liso bronquial (metacolina, histamina, fundamentalmente).
• Estímulos indirectos: actúan en células distintas a la musculatura lisa (células inflamatorias, células epiteliales y neuronas), estimulando la liberación de mediadores celulares o neurotransmisores que provocan la contracción del músculo liso. Puede tratarse de estímulos físicos (ejercicio, soluciones hipoosmolares o hiperosmolares, hiperventilación con aire frío, manitol) o farmacológicos (adenosina).
Para las indicaciones y contraindicaciones, véase la tabla V.

Prueba de esfuerzo
El ejercicio actúa como uno de los principales desencadenantes de hiperreactividad bronquial, por el enfriamiento y la pérdida de humedad de las vías aéreas intratorácicas. La prueba de esfuerzo es sencilla, segura, muy específica para el asma y es la que mejor reproduce la vida real del niño, por lo que es empleada con frecuencia en los laboratorios de estudio de la función pulmonar(1,2,4,6,8).
Material necesario y condiciones previas
El ejercicio debe ser supervisado y las condiciones previas deben contemplar: ausencia de síntomas clínicos de asma en el momento de la prueba, exploración cardiorrespiratoria basal dentro de la normalidad, cifras basales de capacidad vital forzada (FVC) y FEV1 sobre el 80% del valor teórico. Se debe ir adecuadamente preparado para realizar el ejercicio, y no haber realizado ningún otro ese mismo día.
Diferentes fármacos pueden interferir con los resultados (veáse arriba, en apartado de realización de espirometría).
Falsos negativos: esfuerzos subóptimos durante tiempo prolongado, ejercicio físico previo a la prueba, periodo refractario. Falso positivo: FEV1 disminuidos por inspiraciones poco completas durante la espirometría.
Métodos: carrera libre, tapiz rodante, bicicleta ergométrica.
• Carrera libre: se trata del método más sencillo, y sería el más fisiológico, pero no se pueden controlar factores como humedad o los aeroalérgenos. El sujeto efectúa una carrera libre durante 6 minutos, con la intensidad suficiente para alcanzar una frecuencia cardíaca de 175 lpm o del 80% del máximo para su edad (210-edad en años).
Se realizan espirometrías a los 0, 5, 10, 15 minutos y, opcionalmente, a los 20 y 30.
Si presentara disnea o no recupera el FEV1 basal, se administraría un broncodilatador, controlando la respuesta clínica y la espirométrica.
En el laboratorio de función pulmonar, la prueba de esfuerzo se puede hacer más controlada, incluidas la temperatura (20-25°C) y la humedad relativa. Es mejor realizar la prueba con pinzas nasales, obligando al paciente a respirar por la boca.
• Tapiz rodante: se usa más en niños porque pueden mantener el esfuerzo deseado constante con más facilidad que en la bicicleta. La duración total del ejercicio será de 6-8 minutos. Durante los 2 primeros, se incrementa paulatinamente la velocidad (de 0 a 5-6 km/hora) e inclinación del tapiz, hasta conseguir una frecuencia cardiaca igual al 80% de la máxima para la edad del paciente. De forma opcional, se puede monitorizar durante la prueba la pulsioximetría, el electrocardiograma y la presión arterial.
Se realizan, igualmente, espirometrías a los 0, 5, 10, 15 y, opcionalmente, 20 y 30 minutos.
Se considera la prueba positiva cuando se produce un descenso de FEV1 del 15% respecto al basal, según la fórmula: FEV1 basal – FEV1 postejercicio/FEV1 basal x 100. Aunque un descenso del 10% del FEV1 basal tras el ejercicio ya se considera anormal. Generalmente, el valle se alcanza en los primeros 10 minutos del cese del ejercicio. Además de esta caída del FEV1, el paciente puede presentar tos, sibilancias y opresión torácica, siendo todo ello reversible tras la administración de un broncodilatador de acción rápida.
En circunstancias especiales, también se valora el descenso del 25% del flujo espiratorio forzado en el 25-75% de la capacidad forzada (FEF25-75) y el del 30% del pico de flujo espiratorio (PEF).
• Bicicleta ergométrica: la metódica de la prueba con la bicicleta ergométrica es similar a la referida con el tapiz rodante. Es necesario obtener el esfuerzo máximo en los primeros 4 min y su mantenimiento total durante 6 min.
Preferiblemente, tres determinaciones válidas (variación entre FEV1 mayor y siguiente <0,2 L).
Otras pruebas de medida de hiperrespuesta bronquial
Provocación bronquial con metacolina y adenosina
Indicaciones: diagnóstico de asma (historia sugestiva de asma en fase asintomática que no se ha podido constatar obstrucción reversible al flujo aéreo o variabilidad; clínica atípica o monosintomáticos)(1,2,4,8).
La prueba con metacolina tiene alto valor predictivo negativo: una provocación negativa excluye el diagnóstico. La respuesta a adenosina es un marcador más sensible y específico del asma bronquial que la metacolina (sensibilidad y especificidad del 98% para distinguir asma de sano y del 90% de otras enfermedades obstructivas pediátricas).
Métodos: dos protocolos equivalentes, uno de respiración a volumen corriente durante 2 minutos con un nebulizador de flujo continuo o bien un protocolo de 5 inhalaciones con dosímetro. Se analiza FEV1 mediante espirometría a los 30 y 90 segundos de cada nebulización en caso de metacolina o a los 60 y 180 segundos en caso de adenosina.
Normal: PC 20 >8 mg/ml o PD 20 > 7,8 µmol. PC 20 < 1 mg/ml más síntomas de asma es diagnóstica de asma.
Conclusiones
La espirometría basal y una prueba broncodilatadora son el pilar básico en el diagnóstico del asma y las enfermedades con repercusión respiratoria. Estas técnicas deben siempre estar dirigidas y ser interpretadas en función de una correcta historia, exploración y seguimiento clínicos. Resulta fundamental la comunicación cercana con el paciente. La educación del paciente y su familia, el favorecer el automanejo de su enfermedad y la progresiva toma de responsabilidades, así como la coordinación entre niveles asistenciales y el uso de la telemedicina, deben ir paralelas al desarrollo de las tecnologías y su adecuada validación.
Conflicto de intereses
El autor declara no tener ningún conflicto de intereses.
Bibliografía
1. Chernick V, Boat TF, Wilmott RW, Bush A. Kendig’s Disorders of the respiratory tract in children. Seventh Ed. Philadelphia: Saunders Elsevier; 2006.
2. Cobos N, Pérez-Yarza EG, eds. Tratado de neumología infantil. 2ª edición. Madrid: Ergon; 2009.
3. Mauricio Canals L, Rigoberto Solís. Geometría de los sistemas vivos y su importancia en Medicina. Rev Med Chile. 2005; 133: 1097-107.
4. González Pérez-Yarza E, Aldasoro Ruiz A, Mintegui Aranburu J, Korta Murua J, Sardón Prado O. La función pulmonar en el niño. Principios y aplicaciones. Madrid: Ergon; 2007.
5. Jiménez Montero B, Zafra Anta MA, Barrio Gómez de Agüero MI. Anamnensis, exploración física y exploraciones complementarias en Neumología. En: Guerrero Fernández J, Ruiz Domínguez JA, Menéndez Suso JJ, Barrios Tascón A, eds. Manual de diagnóstico y terapéutica en Pediatría. Libro Verde. Hospital Infantil La Paz. 5ª ed. Madrid: PUBLIMED; 2009. p. 1191-8.
6. Oliva C, Gómez Pastrana D, Sirvent J, Asensio O y Grupo de Técnicas de la Sociedad Española de Neumología Pediátrica. Estudio de la función pulmonar en el paciente colaborador. Parte I y II. An Pediatr (Barc). 2007; 66(4): 393-406.
7. Miller MR Hankinson J, Brurasco V, Burgos F, Casaburi R, Coates A, et al. Standarisation of spirometry. ATS/ERS Task force: standarisation of lung function testing. Eur Respir J. 2005; 26: 319-38.
8. Liñán Cortés S, Cobos Barroso N, Reverté Bover C. Exploración funcional respiratoria. Protocolos Diagnóstico Terapéuticos de la AEP: Neumología, actualizados al año 2008. Cap 3. p. 41-70. Disponible en www.aeped.es/protocolos/ Último acceso: 5 de diciembre 2011.
9. García Benito C, García Río F. ¿Qué podemos hacer ante la escasa implantación de la espirometría en atención primaria? Aten Primaria. 2004; 33: 261-6.
10. GEMA (Guía Española para el manejo del Asma) 2009. Arch Bronconeumol. 2009; 45(Supl 7): 2-35.
11. Dombkowski KJ, Hassan F, Wasilevich EA. Clark SJ. Spirometry use among pediatric primary care physicians. Pediatrics. 2010; 126: 682-7.
12. Gibson PG, Powell H. Written action plans for asthma: an evidence-based review of the key componentes. Thorax. 2004; 59: 94-9.
13. Wolf FM, Guevara JP, Grum CM, Clark NM, Cates CJ. Educational interventions for asthma in children (Cochrane Review). En: The Cochrane Library, Issue 4, Chichester: John Wiley & Sons; 2003.
14. Wensley DC, Silverman M. Peak Flow monitoring for guided self-management in Childhood asthma. Am J Respir Crit Care Med. 2004; 170: 606-12.
15. Pérez-Yarza EG, Cobos N, de la Cruz JJ. Grupo de Trabajo de Asma de la Sociedad Española de Neumología Pediátrica. La variabilidad del flujo espiratorio máximo no clasifica el asma por niveles de gravedad. Arch Bronconeumol. 2007; 43: 535-41.
16. Aguilar Fernández AJ, Villa Asensi JR, Castro Codesal M, Almería Gil E, González Álvarez MI, Romero Andújar F. Concordance between the Piko-1 portable device and pneumotachography in measuring PEF and FEV1 in asthmatic children. Allergol Immunopathol (Madr). 2009; 37(5): 244-8.
17. Pérez-Yarza EG, Villa JR, Cobos N, Navarro M, Salcedo A, Martín C, Escribano A, Arranz L, Rueda S, Martínez A. Espirometría forzada en preescolares sanos bajo las recomendaciones de la ATS/ERS: estudio CANDELA. An Pediatr (Barc). 2009; 70: 3-11.
18. Koopman M, Zanen P, Kruitwagen CLJJ, van der Ent CK, Arets HGM. Reference values for pediatric pulmonary function testing: The Utrecht dataset. Respiratory Medicine. 2011; 105: 15-23.
