 |
| Temas de FC |
A. Méndez Echevarría, F. Baquero-Artigao*
Servicio de Pediatría General. *Unidad de Enfermedades Infecciosas Pediátricas. Hospital Universitario La Paz. Madrid
| Resumen La tuberculosis representa actualmente un importante problema de salud pública, con alta mortalidad en niños en países en vías en desarrollo, fundamentalmente en infectados por el VIH. El aumento de viajes internacionales y la inmigración han dado lugar a un aumento de casos en países desarrollados, facilitando también la aparición de cepas multirresistentes. Los niños son una población especialmente susceptible, ya que tienen mayor riesgo de desarrollar la enfermedad tras la primoinfección y de presentar formas graves. Además, aquellos niños con infección latente serán los adultos que presentarán enfermedad en el futuro, manteniendo así la epidemia. El diagnóstico de tuberculosis en la edad pediátrica es difícil, porque el aislamiento de M. tuberculosisen cultivos es menor en niños que en adultos y, en ocasiones, debemos realizar un diagnóstico de sospecha sin conseguir confirmación microbiológica. Por todo ello, los pediatras debemos realizar un esfuerzo para comprender y conocer esta enfermedad, ya que el control de la tuberculosis en niños ayuda y facilita el control epidemiológico de la enfermedad. |
| Abstract
Globally tuberculosis continues to exact an unacceptably high toll of disease and death among children proceeded from developed countries, especially HIV infected cases. Increased international travel and immigration have seen childhood tuberculosis rates increase even in industrialised countries like ours and threaten to facilitate the emergence of multi-drug resistant cases. Children are particularly vulnerable to severe disease following infection, and those with latent infection become the reservoir of disease reactivation in adulthood, fueling the future epidemic. The diagnosis of tuberculosis in children is a challenge, because rates of M.tubeculosis isolation in children are lower than in adults, so in many cases we will establish the diagnosis without microbiological confirmation. For all these reasons, advances in our understanding of tuberculosis in children would provide wider insights and opportunities to facilitate efforts to control this disease. |
Palabras clave: Mycobacterium tuberculosis; Mantoux; IGRAS; Quimioprofilaxis; Resistencia.
Key words: Mycobacterium tuberculosis; Mantoux; IGRAs; Chemoprophylaxis; Resistance.
Pediatr Integral 2012; XVI(2): 149-155
Tuberculosis pulmonar
Introducción
El estudio de la tuberculosis (TB) infantil es de gran valor epidemiológico, debido a que un niño infectado representa un evento centinela de una transmisión reciente de Mycobacterium tuberculosis (MTB) en la comunidad, siendo la fuente de contagio generalmente un familiar bacilífero próximo(1). Realizar un diagnóstico precoz de la primoinfección tuberculosa en población pediátrica es muy importante, ya que permite instaurar una quimioprofilaxis secundaria que evite la progresión a enfermedad y la aparición de formas graves diseminadas, así como detectar focos cercanos de contagio en el entorno familiar próximo. La actuación de pediatras expertos es, por tanto, clave en el control de la tuberculosis.
Por otro lado, el diagnóstico de la enfermedad tuberculosa (ETB) en niños es una tarea compleja ya que, hasta en un 70% de casos según diversas series, no se consigue confirmación microbiológica(2), debiendo establecerse un diagnóstico basado en criterios clínicos y epidemiológicos. La presentación clínica de la ETB en pediatría muestra una gran variabilidad, con formas en ocasiones oligosintomáticas que debutan de manera larvada. Además, algunos lactantes con enfermedad pulmonar pueden no mostrar inicialmente alteraciones en la radiografía de tórax, dado que las adenopatías mediastínicas pequeñas próximas al hilio y al timo pueden pasar desapercibidas.
Con todo ello concluimos que, a pesar de la importancia de establecer un diagnóstico precoz, los pediatras nos seguimos encontrando actualmente con innumerables dificultades a la hora de realizar esta importante tarea.
Epidemiología
La TB se transmite al niño por contacto con un adulto enfermo, siendo un centinela de transmisión reciente en la comunidad. La incidencia de VIH, de inmigrantes y las actuaciones sanitarias, determinan la endemia.
La OMS declaró la TB como “emergencia de salud global” en 2003, con 1,6 millones de fallecimientos anuales, fundamentalmente en países en vías de desarrollo. En el año 2009, se diagnosticaron 9,4 millones de casos nuevos de tuberculosis y la prevalencia fue de 14 millones de casos(3). Desde el año 2004, la tasa mundial de incidencia está disminuyendo y, en 2009, la estimación fue de 132 casos/100.000 habitantes. La mayor parte de nuevos casos se diagnosticaron en el Sudeste asiático (35%) y en África (30%), siendo un 11-13% de los mismos pacientes VIH positivos y aproximadamente un 12% tuberculosis multirresistentes (TB-MR)(3).
En España, la incidencia global estimada en 2008 fue de 18 casos/100.000 habitantes, diagnosticándose el 8,1% de estos nuevos casos en menores de 14 años(4). Los principales factores que determinan la endemia en países como el nuestro son: la situación de la infección VIH, el porcentaje de inmigrantes procedentes de países con alta prevalencia de TB y la actuación de las autoridades sanitarias. En la última década, se ha producido en nuestro país un aumento del fenómeno de la inmigración procedente de áreas con mayores tasas de resistencia a isoniacida (H)(5). En España, el porcentaje de resistencia a H en casos nuevos de TB es superior al 6%, siendo este porcentaje aun superior en población inmigrante(6). Por ello, los niños de mayor riesgo son aquellos que provienen de zonas endémicas, los que están infectados por el VIH y los que conviven en condiciones precarias socio-sanitarias con poblaciones de riesgo, como: adultos socialmente desfavorecidos, inmigrantes o infectados por el VIH. En ellos debe realizarse periódicamente una prueba de tuberculina (PT), permitiéndonos detectar precozmente la infección y buscar posibles fuentes de contagio(7).
Además, los lactantes y niños representan una población especialmente susceptible por presentar un riesgo muy superior al de los adultos de evolucionar de infectado a enfermo, sobre todo si se asocian malnutrición, inmunodepresión, primoinfección reciente o es un niño de corta edad, estimándose que hasta el 50% de los menores de un año desarrollarán enfermedad activa tras la primoinfección(8). Debemos considerar también que el riesgo de padecer formas graves es mucho mayor en niños pequeños que en escolares o adolescentes.
Fisiopatología
La TB se transmite por inhalación respiratoria de secreciones contaminadas y tras una convivencia estrecha y mantenida con un enfermo. En la mayor parte de los casos, la infección se controla. En otros, especialmente en lactantes e inmunodeprimidos, la infección progresa, dando lugar a la enfermedad pulmonar o extrapulmonar.
La TB es una enfermedad que precisa una convivencia estrecha y mantenida para su transmisión, habitualmente más de 4 horas diarias en el mismo habitáculo con un enfermo “bacilífero” o infectante, por inhalación respiratoria de secreciones contaminadas. Los enfermos bacilíferos son aquellos que eliminan la micobacteria a través de la tos, los estornudos y las secreciones respiratorias, y esto se evidencia por presentar una baciloscopia de esputo positiva.
MTB es un patógeno intracelular y, por tanto, la inmunidad celular tiene un papel fundamental. Por ello, los niños con defectos de inmunidad celular (VIH, inmunodeficiencias congénitas, tratamiento corticoideo o con terapias biológicas…) tienen un riesgo aumentado de desarrollar tuberculosis.
Tras la primoinfección, el MTB llega a los alvéolos pulmonares donde se produce la fagocitosis del mismo por los macrógafos. Los macrófagos infectados son transportados hasta los ganglios linfáticos regionales, hiliares y mediastínicos habitualmente. En la mayor parte de los casos, la infección se controla por el sistema inmune del huésped. Sin embargo, en algunos casos, especialmente en lactantes e inmunodeprimidos, la infección progresa, dando lugar a la enfermedad pulmonar o diseminándose produciendo enfermedad extrapulmonar(9). Tras la primoinfección inicial, los niños eliminan escasos bacilos a través de secreciones respiratorias, siendo estos pacientes excepcionalmente bacilíferos y, por tanto, no contagiosos. Sin embargo, las reactivaciones tuberculosas en adolescentes y adultos jóvenes que se infectaron en la primera infancia, especialmente si presentan formas pulmonares cavitadas, suelen ser formas bacilíferas y altamente contagiosas.
Clínica
Es obligado incluir al niño en uno de los estadios de la enfermedad, exposición, infección latente o enfermedad, ya que comporta un manejo diferente. La TB pulmonar es la forma mas frecuente de enfermedad.
Todos los niños en contacto con el bacilo tuberculoso deberán ser estudiados y clasificados en: expuestos, infectados o enfermos (véase tabla I).
Cada estadio comporta una actitud terapéutica diferente. En los casos de exposición debemos suspender contacto con el adulto enfermo e instaurar profilaxis primaria para evitar el contagio del niño que todavía no se ha infectado. En caso de infección latente (PT positiva), debemos descartar la TB activa e instaurar profilaxis secundaria para evitar que desarrolle enfermedad. Diagnosticaremos ETB cuando aparezca clínica compatible y hallazgos radiológicos, analíticos, anatomopatológicos y/o microbiológicos sugestivos(10). El diagnóstico de certeza lo proporciona un cultivo o una PCR positiva para MTB, aunque con frecuencia en niños no obtenemos confirmación microbiológica (formas paucibacilares), realizando habitualmente un diagnóstico de sospecha(10).
La presentación clínica de la ETB es muy variable, desde formas oligosintomáticas (presencia de síntomas constitucionales inespecíficos, síntomas respiratorios) hasta síntomas de afectación grave(1,11). La localización más frecuente es la pulmonar, con mayor predominio de formas ganglionares, siendo los síntomas respiratorios (tos crónica, dificultad respiratoria, dolor torácico) y constitucionales (fiebre, sudoración, perdida de peso), los que observamos con mayor frecuencia. En ocasiones, puede debutar de manera similar a una neumonía bacteriana, presentando consolidación lobar y/o derrame pleural. Las adenopatías de gran tamaño pueden producir una obstrucción bronquial, con atelectasias o enfisema, o erosionar hacia el interior, produciéndose una TB endobronquial, presentándose dificultad respiratoria con estridor o sibilancias. En las formas miliares aparece hipoxemia(1,11).
Sin embargo, la enfermedad puede afectar a cualquier órgano o sistema y presentarse con síntomas neurológicos, digestivos u osteoarticulares. En algunos casos, durante la infección primaria se produce una diseminación miliar del bacilo, ocurriendo esta diseminación con mayor frecuencia en lactantes e inmunodeprimidos. El cuadro clínico se manifiesta con un comienzo insidioso con febrícula, malestar, anorexia y pérdida de peso, adenopatías generalizadas, hepatoesplenomegalia y sintomatología respiratoria. En la radiografía de tórax, se evidencian infiltrados diseminados como en “granos de mijo”. Más de la mitad de los casos pueden presentar PT negativa(1,11). Otra forma grave es la meningitis, que tiene la máxima frecuencia entre los 6 m y los 4 años. El debut es subagudo, con: cefalea, irritabilidad, vómitos y, más tarde, afectación de pares craneales, alteración de conciencia, signos meníngeos y convulsiones. La hidrocefalia es la complicación más frecuente. El LCR presenta pleocitosis con linfocitosis, hipoglucorraquia e hiperproteinorraquia(1,11).
La tuberculosis ganglionar es la forma más frecuente de enfermedad extrapulmonar en niños mayores. Lo más habitual es que se produzca linfadenitis cervical posterior, supraclavicular y submandibular secundarias a extensión de la forma pulmonar(1,11).
Diagnóstico
El diagnóstico definitivo se realiza mediante el cultivo o la PCR. El diagnóstico de certeza es difícil en niños y con frecuencia es de sospecha: PT positiva, radiología, epidemiología y/o clínica positivas.
Historia clínica(10,12)
Se debe buscar el caso índice en el entorno habitual del niño. Documentar contacto con inmigrantes, viaje a áreas endémicas y convivencia en situaciones o poblaciones de riesgo. Si existe, detallar el tiempo de exposición y asegurar un contacto estrecho con el médico que controla el caso índice, averiguando la situación del paciente bacilífero, el tratamiento que recibe, el cumplimiento y, sobre todo, conocer la sensibilidad de la cepa. Es importante documentar la vacunación BCG (fecha, número de dosis, cicatriz postvacunal) y PT previa (fecha de realización y resultado). Debemos preguntar por la existencia previa de cuadros febriles, adenopatías, síntomas constitucionales o respiratorios.
PT e interpretación del Mantoux(12,13)
Los objetivos al realizar la PT en niños son: apoyar el diagnóstico de ETB, detectar precozmente la infección TB latente (ITBL) y controlar a los niños expuestos(12,13). Se necesita un periodo de tiempo, entre 8-12 semanas después de la infección, para que el Mantoux se haga positivo. Consiste en administrar intradérmicamente componentes antigénicos del bacilo (PPD o derivado proteico purificado). Si el niño ha tenido contacto previamente con el bacilo, se producirá una reacción de induración (intradermorreacción de Mantoux). Su positividad solo indica infección, siendo necesaria la realización de pruebas complementarias para descartar enfermedad activa(12,13). Se realiza mediante la inyección intradérmica de 0,1 ml del PPD, que contiene 2U de PPD-RT23 (5UI de PPD-S), utilizando una aguja de calibre 26, con bisel corto girado hacia arriba. La inyección se debe realizar en la cara anterior del antebrazo, produciéndose una pápula detectable. Debe leerse a las 72 h, cuando se consigue la máxima induración, midiendo solo la induración del diámetro máximo transversal al eje mayor del brazo, anotándola en milímetros con la fecha de lectura(12,13). La interpretación de la PT se describe en la tabla II.
Analítica general(10,11)
Es inespecífica. Puede presentar anemia, leucocitosis y VSG elevada. Es recomendable realizar estudio de función hepática previo a iniciar tratamiento.
Estudios radiológico(10,12)
No existe un patrón característico. Lo más frecuente es el engrosamiento mediastínico por adenopatías, aislado o asociado a lesión parenquimatosa y/o atelectasia. Las lesiones cavitadas son formas post-primarias o del adulto, infrecuentes en la infancia. La evolución radiológica es mucho más lenta que la clínica, observándose, en ocasiones, empeoramiento radiológico al iniciar el tratamiento y pudiendo quedar lesiones residuales después de completarlo correctamente. La TC torácica es más sensible que la radiografía para detectar adenopatías, principalmente subcarinales. Sin embargo, estudios que realizan TC sistemática a niños asintomáticos con contacto bacilífero, PT positiva y radiografía normal, evidencian adenopatías hiliares o mediastínicas en >50% de los casos, por lo que el aumento leve-moderado de ganglios torácicos puede formar parte natural de la primoinfección y no implica, necesariamente, enfermedad activa(12). Por ello, no está indicada la realización sistemática de TC. Sin embargo, en niños menores de 2 años con síntomas inespecíficos, con contacto bacilífero y PT positiva con radiografía normal, podría considerarse la realización de una TC torácica, para conocer si estos síntomas están en relación con la TB(12).
Estudios microbiológicos(10,12)
Muestras
En el niño, dada la dificultad para expectorar, se realiza el estudio en el jugo gástrico, recogiendo 3 muestras en ayunas mediante sonda nasogástrica en días consecutivos. Una nueva técnica es la obtención de esputo inducido, tras administrar salbutamol inhalado y, posteriormente, ClNa hipertónico nebulizado. De esta manera, se facilita la expectoración o la obtención de material mediante aspirado nasofaríngeo. Otras muestras: esputo (adolescentes), LCR, líquido sinovial y biopsia.
Tinciones y cultivo
Baciloscopia o visión directa de bacilos ácido-alcohol resistentes (BAAR) mediante fluorescencia con auramina o tinción de Ziehl-Neelsen. Los cultivos se realizan en medios sólidos (tipo Lowenstein, 4-6 semanas) o líquidos (tipo Middlebrook, 15 días-1 mes).
Reacción en cadena de la polimerasa (PCR)
Amplificación de material genético específico de MTB. Alta especificidad y sensibilidad algo mayor que los cultivos. Permite resultados en poco tiempo. Se puede realizar en líquidos orgánicos y muestras de tejidos.
Anatomía patológica(10,11)
Granulomas caseificantes y necrotizantes con células gigantes. Se puede realizar en biopsias de ganglios, sinovial, pleural, pericárdica, etc.
Determinación de adenosindeaminasa (ADA)(10,11)
Enzima cuya principal actividad se detecta en los linfocitos T. Su elevación es orientativa de TB, aunque no específica. Su estudio se realiza en LCR (normal: 1-4 U/L) y líquido pleural (normal: <40 U/L).
Nuevos métodos de inmunodiagnóstico (QuantiFERON®, T-SPOT®)(12,14)
La técnica consiste en realizar una extracción de sangre y estimular los linfocitos T con antígenos específicos de MTB. Si el paciente está infectado, sus linfocitos reconocen los antígenos y se activan produciendo inferterón-γ. Son más específicos que la PT, no presentando falsos positivos por BCG o por infección por la mayor parte de micobacterias ambientales, pero no sustituyen a la PT en la práctica diaria, utilizándose, sobre todo, en casos de interferencia con BCG y problemas diagnósticos (casos de PT positiva en niños bajo riesgo de TB, vacunados de BCG o sospecha de infección por micobacteria atípica y en casos de PT negativa pero sospecha de ETB y/o inmunodeprimidos)(12).
Diagnóstico diferencial
La ETB puede debutar con diversas presentaciones y afectar a prácticamente cualquier sistema, requiriendo establecer un diagnóstico diferencial amplio.
El diagnóstico diferencial en la ETB pulmonar lo realizaremos con procesos neumónicos (neumonía bacteriana típica, atípica o viral). En casos de compresión bronquial por adenitis mediastínica y enfisema, debemos realizar diagnóstico diferencial con cuerpo extraño en la vía aérea(13). En inmunodeprimidos e infectados por el VIH, debemos descartar una infección pulmonar por micobacterias no tuberculosas, fundamentalmente por MAC (Mycobacterium Avium Complex)(15). Otras entidades que pueden simular una ETB pulmonar son: linfomas, procesos tumorales intratorácicos, sarcoidosis o fiebre Q.
La ETB diseminada puede afectar a multitud de órganos y presentarse con síntomas inespecíficos lo cual obliga a establecer un diagnóstico diferencial con procesos infecciosos, inflamatorios o tumorales. Es fundamental mantener la sospecha ante determinados antecedentes epidemiológicos (contacto con enfermo TB, procedencia o viaje a zona endémica o infección VIH). En sospecha de meningitis TB, el diagnóstico diferencial lo realizaremos con otras causas de meningoencefalitis (bacterianas, virales u oportunistas en inmunodeprimidos), siendo igualmente necesario mantener la sospecha diagnóstica en determinados contextos epidemiológicos.
Los casos de adenitis subagudas con granulomas caseificantes suponen un reto diagnóstico, dado que también pueden deberse a infección por otras micobacterias, siendo el enfoque terapéutico radicalmente distinto(13). Las adenitis tuberculosas se diferencian de estas otras adenitis por micobacterias atípicas en que se observan en niños mayores y adolescentes, suelen ser bilaterales, de localización axilar, supraclavicular o cervical posterior y se acompañan de síntomas constitucionales. Las adenitis por otras micobacterias se presentan en menores de 5 años, sin clínica, constitucionales, y suelen ser submaxilares, preauriculares o cervicales anteriores. En estas formas, la radiografía de tórax nunca debe presentar alteraciones. La presencia de adenitis por micobacterias atípicas en niños mayores de 6 años es excepcional, debiendo por tanto sospecharse siempre una enfermedad tuberculosa, sobre todo ante determinados antecedentes epidemiológicos(13).
Tratamiento
Todos los niños deben recibir profilaxis post exposición. En ITBL debe descartarse ETB antes de iniciar monoterapia. El tratamiento de ETB no complicada en niños es 2HRZE+4HR.
Pauta de profilaxis primaria o post-exposición(10,11)
En todos los niños expuestos a enfermo tuberculoso, se instaurará una profilaxis primaria para evitar que se infecten (Tabla III).
Pautas recomendadas para el tratamiento (profilaxis secundaria) de la ITBL(10,11)
En todos los niños con ITBL se instaurará una profilaxis secundaria o tratamiento de ITBL para evitar que desarrollen enfermedad (Tabla IV).
Tratamiento de la enfermedad tuberculosa(11,16,17)
El tratamiento de la ETB consta de 2 fases(16). En la primera, de inducción o bactericida, se produce una rápida disminución del número de bacilos, con mejoría clínica y disminución de la capacidad de contagio (duración, dos meses). En la segunda fase, de mantenimiento, tiene lugar la eliminación de bacilos quiescentes (duración mínima, 4 meses).
Actualmente, en España, asistimos a un aumento de población inmigrante procedente de países con mayor tasa de resistencia a H. Ello ha conducido a que las tasas de resistencia globales en la población sean superiores al 4%. Por ello, en casos en los cuales no conozcamos la sensibilidad de la cepa del caso índice, el tratamiento debe iniciarse empíricamente con 4 fármacos (HRZE: isoniacida, rifampicina, pirazinamida y etambutol) hasta conocer la sensibilidad de la cepa, suspendiéndose el etambutol si la cepa es sensible a H y R, o a los 2 meses, tras finalizar el periodo de inducción. Si la cepa del caso índice es sensible, se recomienda iniciar la pauta clásica con 3 fármacos (HRZ). El mantenimiento se realiza con la asociación HR hasta completar un periodo mínimo de 6 meses.
En casos de multirresistencia comprobada (al menos a H y R), se tratará durante el periodo de inducción con 4-6 fármacos de sensibilidad conocida, siendo obligado utilizar todos los fármacos sensibles de primera línea, y cuando sea posible, por lo menos dos de ellos, bactericidas(11). Durante el periodo de mantenimiento, se recomiendan 3-5 fármacos y la duración del tratamiento debe ser más prolongada, aunque no ha sido establecida (18-24 meses)(11). El tratamiento de la TB-MR es complejo, debiendo remitirse los casos a una unidad especializada.
En niños, la toxicidad de los fármacos usados habitualmente es escasa y puede solventarse con modificaciones del régimen terapéutico(16). El efecto adverso más importante es la toxicidad hepática, principalmente por H. Si hay hepatotoxicidad leve, ajustar la dosis de H a 5 mg/kg/día o instaurar pauta intermitente. Si el paciente presenta sintomatología con cifras de transaminasas superiores a 3 veces el límite de la normalidad o 5 veces el límite, aunque no tenga síntomas, debemos suspender el fármaco temporalmente y valorar cambio a otro fármaco no hepatotóxico, principalmente etambutol (E) o estreptomicina (S), realizando controles clínicos más frecuentes y alargando el tiempo de tratamiento.
Tratamiento de TB extrapulmonar(17)
Son escasos los ensayos clínicos que evalúen el tratamiento de otras formas extrapulmonares(17). Esta ausencia es aún más patente en la edad pediátrica. En la tabla V, se recogen las principales recomendaciones para el tratamiento farmacológico y quirúrgico de las diversas formas de enfermedad tuberculosa(11).
Los corticoides están indicados en algunas formas de TB(11,17), generalmente durante las fases iniciales (prednisona, 1-2 mg/kg/día, o dexametasona, 0,3-0,5 mg/kg/día, cada 8-12 horas, 4-6 semanas) (véase tabla V).
En niños infectados por el VIH, el tratamiento debe realizarse durante al menos 9 meses. Debemos recordar que la R interacciona con algunos fármacos, como los inhibidores de proteasas, disminuyendo sus niveles y aumentando la toxicidad de la R(11,17).
Prevención
Los niños de mayor riesgo son los que viven con adultos infectados por el VIH, inmigrantes procedentes de zonas de alta endemia de TB o socialmente desfavorecidos. Los niños inmigrantes con TB con frecuencia han viajado con un núcleo familiar de alto riesgo y conviven en condiciones precarias socio-sanitarias. El niño adoptado del Tercer Mundo es también de alto riesgo para desarrollar la enfermedad, pues ha vivido en orfanatos de países de alta endemia de TB(1). En todos estos niños, debe realizarse periódicamente una prueba de tuberculina (PT), permitiéndonos detectar precozmente la infección y buscar posibles fuentes de contagio(7,12).
Función del pediatra de Atención Primaria
La responsabilidad del diagnóstico, del estudio de contactos y del cumplimiento terapéutico recae directamente en el sistema sanitario. El pediatra de Atención Primaria tiene, por tanto, un papel fundamental, especialmente en el control de la población inmigrante, que es una población de riesgo por no acudir, en ocasiones, a revisiones de salud o consultar con poca frecuencia. El pediatra debe actuar a tres niveles:
1. Detección de casos(1): es importante mantener la sospecha en niños con: astenia, decaimiento, disminución del apetito, palidez, artralgias, febrícula, tos, etc., siendo necesario realizar precozmente PT, si procede Rx tórax y búsqueda exhaustiva de contactos en la familia y en el entorno (cuidadores, abuelos, familiares en prisión…). El pediatra de Atención Primaria debe derivar con carácter urgente al hospital cada caso de sospecha de enfermedad.
2. Profilaxis de contactos(1): el pediatra debe implicarse activamente en la búsqueda de contactos en cada caso de TB detectado en una familia, realizar la PT a todos los individuos expuestos, y profilaxis y seguimiento cuidadoso tanto de los contactos expuestos como de las ITBL, siempre que se sospeche una cepa sensible a H. En niños inmigrantes o de adopción internacional, debe realizarse una PT, deseablemente en la primera visita al pediatra de Atención Primaria.
3. Ayuda en el seguimiento del paciente en tratamiento(1): el tratamiento de la ITBL y la enfermedad es largo y exige un estricto cumplimiento. En ocasiones, son necesarios medios sofisticados para llegar al diagnóstico y la aparición de resistencias dificulta encontrar regímenes terapéuticos eficaces. Por tanto, esta enfermedad, tanto en sus formas extrapulmonares más graves, como en sus formas pulmonares, es conveniente que se trate en el ámbito hospitalario, pero el seguimiento de expuestos, así como el diagnóstico y seguimiento de niños con infección latente, puede realizarse de manera extrahospitalaria. Además, el pediatra de Atención Primaria debe apoyar cada uno de los pasos del diagnóstico y del tratamiento, insistiendo en su cumplimiento y en el valor real de medidas coadyuvantes, como: reposo, correcta alimentación, medidas higiénicas, etc. La comunicación entre el pediatra de Atención Primaria y el especialista hospitalario es, en este caso, de especial relevancia para lograr un óptimo control y la curación de la enfermedad.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Mellado Peña MJ, Méndez Echevarría A, Martínez Fernández MR. Tuberculosis. En: Muñoz Calvo MT, Hidalgo Vicario MI, Clemente Pollán J (eds.). Pediatría extrahospitalaria: Fundamentos clínicos para atención primaria. 4ª edición. Majadahonda (Madrid): Ergon; 2008. p. 443-9.
2. Zar HJ, Hanslo D, Apolles P, Swingler G, Hussey G. Induced sputum versus gastric lavage for microbiological confirmation of pulmonary tuberculosis in infants and young children: a prospective study. Lancet. 2005; 365: 130-4.
3. Global tuberculosis control: WHO report 2010 Organización Mundial de la Salud (OMS). Disponible en:
http://www.who.int/tb/publications/global_report/2010/gtbr10_main.pdf
4. Tuberculosis surveillance in Europe 2008: surveillance report Organización Mundial de la Salud (OMS). Disponible en:
http://www.euro.who.int/__data/assets/pdf_file/0007/78856/E93600.pdf
5. Del Rosal T, Baquero-Artigao F, García-Miguel MJ, Méndez-Echevarría A, López G, Aracil FJ, de José MI, del Castillo F. Impact of immigration on pulmonary tuberculosis in Spanish children: a three-decade review. Pediatr Infect Dis J. 2010; 29: 648-51.
6. Jiménez MS, Casal M; Grupo Español de Micobacteriología (GEM). Situación de las resistencias a fármacos de Mycobacterium tuberculosis en España. Rev Esp Quimioter. 2008; 21: 22-5.
7. Grupo de Tuberculosis de la Sociedad de Infectología Pediátrica/SEIP. Documento de consenso sobre el tratamiento de la exposición a tuberculosis y de la infección tuberculosa latente en niños. An Esp Pediatr (Barc). 2006; 64: 59-65.
8. Marais BJ, Gie RP, Schaaf HS, Beyers N, Donald PR, Starke JR. Childhood pulmonary tuberculosis: old wisdom and new challenges. Am J Respir Crit Care Med. 2006; 173: 1078-90.
9. Lewinsohn DA, Gennaro ML, Scholvinck L, Lewinsohn DM. Tuberculosis immunology in children: diagnostic and therapeutic challenges and opportunities. Int J Tuberc Lung Dis. 2004; 8: 658-74.
10. Méndez Echevarría A, Baquero Artigao F, García Miguel MJ. Tuberculosis. Micobacterias atípicas. En: Guerrero Fernández J, Ruiz Domínguez JA, Menéndez Suso JJ, Barrios Tascón A (eds.). Manual de diagnóstico y terapéutica en pediatría. 5ª edición. Editorial Publimed. p. 784-91.
11.* Méndez Echevarría A, Mellado Peña MJ, Baquero Artigao F, García Miguel MJ. Tuberculosis. En: Protocolos diagnóstico-terapéuticos de Infectología Pediátrica SEIP-AEP. Madrid: Ergon; 2011.
12.* Moreno-Pérez D, Andrés-Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Durán D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010; 72: 283.e1-283.e14.
13. Interpretación de la prueba de tuberculina en niños. Grupo de trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica. An Pediatr (Barc). 2003; 59: 582-5.
14. Mazurek M, Jereb J, Vernon A, LoBue P, Goldberg S, Castro K; IGRA Expert Committee; Centers for Disease Control and Prevention (CDC). Updated guidelines for using Interferon Gamma Release Assays to detect Mycobacterium tuberculosis infection-United States, 2010. MMWR Recomm Rep. 2010; 59(RR-5): 1-25.
15. Walters E, Cotton MF, Rabie H, Schaaf HS, Walters LO, Marais BJ. Clinical presentation and outcome of tuberculosis in human immunodeficiency virus infected children on anti-retroviral therapy. BMC Pediatr. 2008; 8: 1.
16.* Grupo de Trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica (SEIP). Documento de consenso sobre el tratamiento de la tuberculosis pulmonar en niños. An Pediatr (Barc). 2007; 66: 597-602.
17.* Grupo de Trabajo de Tuberculosis de la Sociedad Española de Infectología Pediátrica (SEIP). Documento de consenso sobre el tratamiento de la tuberculosis extrapulmonar y formas complicadas de tuberculosis pulmonar. An Pediatr (Barc). 2008; 69: 271-78.
Bibliografía recomendada
– Del Rosal T, Baquero-Artigao F, García-Miguel MJ, Méndez-Echevarría A, López G, Aracil FJ, de José MI, del Castillo F. Impact of immigration on pulmonary tuberculosis in Spanish children: a three-decade review. Pediatr Infect Dis J. 2010; 29: 648-51.
Este estudio muestra cómo en nuestro país existe un aumento progresivo de tuberculosis pulmonar en niños inmigrantes procedentes de zonas endémicas. Analiza las características de los casos índice, observando un aumento de contactos extrafamiliares.
– Jones C, Whittaker E, Bamford A, Kampmann B. Immunology and pathogenesis of childhood TB. Paediatr Respir Rev. 2011; 12: 3-8.
Interesante artículo de revisión que permite una actualización en la patogénesis de la enfermedad en niños, facilitando al pediatra una mejor compresión y conocimiento de la tuberculosis.
– Marais BJ, Gie RP, Hesseling AC, Schaaf HS, Lombard C, Enarson DA, Beyers N. A refined symptom-based approach to diagnose pulmonary tuberculosis in children. Pediatrics. 2006; 118: e1350-9.
Estudio prospectivo que analiza los síntomas y signos más frecuentes presentados en niños con enfermedad TB pulmonar. Los autores concluyen cómo la presencia de determinados síntomas en niños inmunocompetentes con ciertos factores de riesgo nos debe hacer sospechar siempre una enfermedad TB pulmonar activa.
– Moreno-Pérez D, Andrés-Martín A, Altet Gómez N, Baquero-Artigao F, Escribano Montaner A, Gómez-Pastrana Durán D, et al. Diagnóstico de la tuberculosis en la edad pediátrica. An Pediatr (Barc). 2010; 72: 283.e1-283.e14.
Documento de consenso de la Sociedad Española de Infectología Pediátrica (SEIP) y la Sociedad Española de Neumología Pediátrica (SENP) donde se encuentra toda la documentación necesaria sobre diagnóstico de infección y enfermedad tuberculosa.
– Newton SM, Brent AJ, Anderson S, Whittaker E, Kampmann B. Paediatric tuberculosis. Lancet Infect Dis. 2008; 8: 498-510.
Interesante artículo de revisión realizado por reconocidos expertos en tuberculosis con actualización completa de todos los aspectos de la enfermedad en niños (epidemiología, patogénesis, clínica, diagnóstico y tratamiento).
| Caso clínico |
|
Paciente de 2 años que acude al Centro de Salud para consultar porque refiere que su padre está ingresado en la actualidad por tuberculosis pulmonar. El niño y su familia proceden de Ecuador y lleva viviendo en España 1 año. Está vacunado con una dosis de BCG al nacimiento en su país de origen. Es el segundo de 3 hijos, ya que tiene una hermana de 8 años y un hermano de 4 meses. El paciente está asintomático. El pediatra del Centro de Salud decide realizar una radiografía de tórax que no presenta alteraciones y una prueba de tuberculina que presenta 8 mm de induración.
|




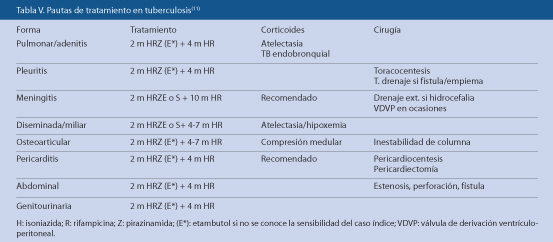










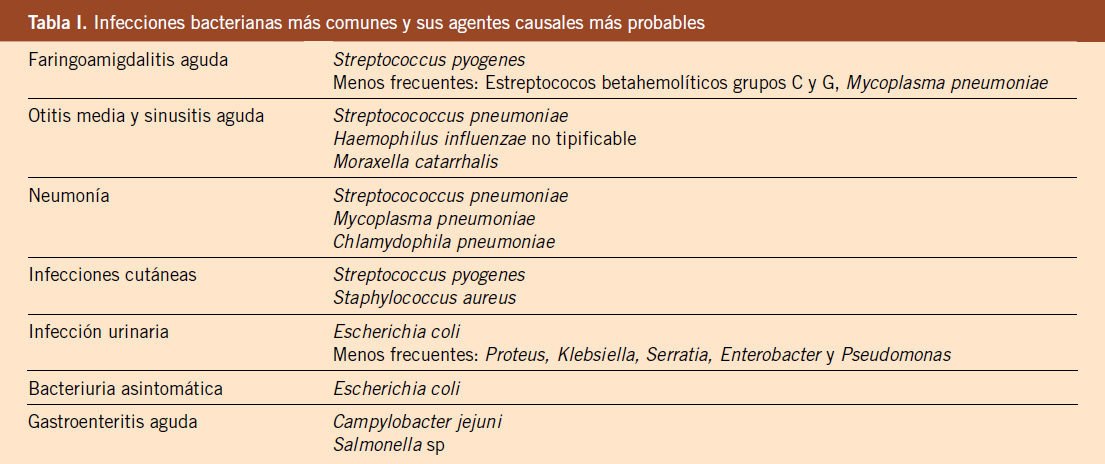














































 Figura 1. Incidencia de tos ferina en España (número de casos declarados cada año). Fuente: Organización Mundial de la Salud.
Figura 1. Incidencia de tos ferina en España (número de casos declarados cada año). Fuente: Organización Mundial de la Salud. Figura 2. Mortalidad anual por tos ferina en España (número total). Fuente: Instituto Nacional de Estadística.
Figura 2. Mortalidad anual por tos ferina en España (número total). Fuente: Instituto Nacional de Estadística. Figura 3.
Figura 3. 



