 |
| Temas de FC |
J. de la Flor i Brú
Centro de Salud “Vila Vella”. ABS Sant Vicenç dels Horts-1. SAP Baix Llobregat-Centre. ICS. Barcelona
| Resumen
Se describen las características generales de los test de diagnóstico microbiológico rápido y las utilidades potenciales y posible impacto asistencial de la utilización en Atención Primaria pediátrica de 15 test: estreptococo betahemolítico del grupo A, virus respiratorio sincitial, gripe, neumococo, rotavirus/adenovirus/astrovirus, norovirus, Campylobacter jejuni, Salmonella, Giardia/Criptosporidium, mononucleosis infecciosa y Helicobacter pylori. |
| Abstract
General features of rapid microbiologic diagnostic test are presented. We describe also potential utilities on primary pediatric health care in 15 specific test: streptococcus pyogenes, syncitial respiratory virus, influenza virus, pneumococcus, rotavirus/adenovirus/ astrovirus, norovirus, Campylobacter jjeuni, Salmonella, Giardia/Criptosporidium, infectious mononucleosis and Helicobacter pylori. In spite that it is not a microbiologic test, rapid test of C reactive protein are presented, cause it is potentially useful in assesment of fever without aparent source in infants and etiologic diagnosis of community pneumonia. |
Palabras clave: Test de diagnóstico microbiológico rápido; Proteína C reactiva; Atención Primaria pediátrica.
Key words: Quick diagnostic microbiologic test; C reactive protein; Primary pediatric health care.
Pediatr Integral 2014; XVIII(1): 37-43
Test de diagnóstico microbiológico rápido en la consulta de Pediatría de Atención Primaria
Introducción
En la clínica diaria, hay muchas ocasiones en las que desearíamos disponer de métodos sencillos de diagnóstico etiológico rápido, que pudiesen modificar en el mismo acto médico conductas tanto desde el punto de vista epidemiológico, como fundamentalmente diagnóstico y/o terapéutico. Es en este espacio en el que tendrían un posible rol determinados test de diagnóstico rápido (TDR), que en los últimos años han ido adquiriendo mayor presencia en los servicios de urgencia(1), pero cuya utilización en las consultas de Pediatría de Atención Primaria (AP), tanto en el sector público como en el privado, sigue siendo muy marginal o prácticamente nula y que son el objeto de este capítulo.
Fundamentos teóricos para la utilización de test de diagnóstico rápido
Características de los test de diagnóstico rápido
¿Cómo funcionan?
Básicamente, podríamos explicar el funcionamiento de los TDR microbiológicos de la siguiente forma(2): si en una muestra clínica, en nuestro caso secreción respiratoria, sangre, orina o heces, está presente el antígeno (Ag) del germen que queremos detectar, al añadir anticuerpos (Ac) específicos marcados contra este microorganismo, se producirá una reacción de fijación Ag-Ac y aparecerá un efecto o señal objetiva y claramente detectable por el clínico, señal que puede ser una aglutinación, un cambio de color de un sustrato positivando una tira reactiva o una placa/cassette de inmunodifusión, o la aparición de fluorescencia o luz, dependiendo del marcador. En la actualidad, disponemos de distintos métodos:
•Pruebas de aglutinación indirecta o pasiva.
•Inmunofluorescencia.
•Enzimoinmunoanálisis o enzimoinmunoensayo: ELISA (enzime linked immunosorbent assay); EIA (enzime immunoassay).
•Sondas quimioluminiscentes de ADN.
•Inmunocromatografía: todas las pruebas que vamos a presentar en este artículo son pruebas inmunocromatográficas, las más utilizadas en la actualidad por su comodidad y sencillez, cuyo funcionamiento es el siguiente: se realizan en una pequeña tira de nitrocelulosa estratificada o en una placa (cassette) horizontal de inmunodifusión óptica o de inmunoflujo lateral. En la parte inferior de la tira o en la base de la placa, hay Ac específicos de conejo marcados con oro coloidal. En la parte media, Ac no marcados. En la parte superior de la tira o extremo de la placa, Ac de otro animal, generalmente cabra, dirigidos contra los Ac de conejo. Si añadimos una muestra biológica líquida en la parte inferior o basal, por capilaridad el líquido migra hacia arriba de la tira o se difunde en la placa. Si la muestra es positiva, los complejos Ag-Ac son captados por la segunda zona, en donde observamos la banda de color de los Ac marcados. Los Ac sobrantes (solos o en complejo con Ag) siguen migrando hacia arriba o el extremo, positivando una segunda línea de color, independientemente del resultado de la prueba. Esta segunda línea será un control de que el test ha sido realizado con la técnica correcta (Fig. 1).
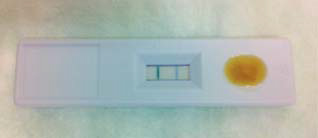
Figura 1. Placa/cassette de inmunoflujo lateral con línea de test positivo y línea de control.
¿De que nos informan?
En general, los TDR son pruebas cualitativas, que dan un resultado positivo o negativo, pero que no permiten cuantificar la intensidad del inóculo bacteriano o de la carga viral, ni diferenciar un estado de portador de una infección activa. Sólo en algunos casos de detección de antígenos virales en heces, las pruebas pueden ser catalogadas como semicuantitativas, al estar la intensidad del color en relación con la carga viral. Por lo tanto, son pruebas complementarias a la clínica, subsidiarias de la clínica e interpretables únicamente en el contexto de la clínica a la que en ningún modo pueden sustituir. No nos dan un diagnóstico, sino que nos informan de la presencia o ausencia de un determinado germen en una muestra biológica. Es el profesional quien tiene que interpretar esta información y situarla en su contexto clínico y epidemiológico para utilizarla adecuadamente.
¿Cuándo utilizarlos?
Los TDR deben usarse únicamente en aquellos casos en los que, de la información resultante, puedan derivarse potenciales cambios de conducta práctica, no únicamente en relación al tratamiento, sino también en cuanto a la epidemiología, el diagnóstico y la educación sanitaria (tanto de los pacientes como del propio profesional).
Utilidad potencial de la utilización sistemática del test de diagnóstico microbiológico rápido en Pediatría de AP
Estreptococo betahemolítico del
grupo A
Cuando evaluamos a un niño con faringitis aguda, debemos valorar cuidadosamente los aspectos clínicos y epidemiológicos antes de practicar un TDR. Si van en contra de la etiología estreptocócica, la baja probabilidad de un resultado positivo que, además, posiblemente reflejaría un estado de portador (15% de niños en edad escolar), y la escasa incidencia actual (aunque no nula) de fiebre reumàtica (FR) y otras complicaciones graves secundarias a la infección por Estreptococo pyogenes en nuestro medio, no justificaría el coste de la utilización indiscriminada del test ante cualquier proceso de faringodinia/hiperemia faríngea, mayoritariamente de causa viral. En cambio, la valoración pre-test de una supuesta alta probabilidad clínica y/o epidemiológica de faringitis estreptocócica, tiene muchos falsos positivos, incluso hecha por pediatras muy experimentados; por lo que, el test estaría indicado fundamentalmente en estos casos, con el objetivo de utilizar adecuadamente los antibióticos (ATB), reduciendo sensiblemente su uso. No debe olvidarse que la faringitis aguda es la primera causa de utilización de ATB en todas las edades y en todo el mundo.
Los TDR ofrecen una rapidez que permite reducir la diseminación del EBHGA y favorecer la incorporación rápida del niño a su actividad normal, factores ambos que, aunque más difíciles de cuantificar que el coste del test, tienen un impacto económico indudable.
A finales de los años 70, aparecieron los primeros test, basados en técnicas de aglutinación, pero sus sensibilidades eran inaceptablemente bajas; por lo que, los casos negativos debían ser igualmente cultivados, con lo que se perdía gran parte del interés que puede tener su utilización en pediatría de AP, muy especialmente en nuestra cultura asistencial, que no se basa generalmente en conductas expectantes y de seguimiento y además, aumentaba el coste total de la asistencia. En cambio, los test se mostraron, ya desde el principio, muy específicos y los más recientes, llamados de segunda generación, basados en enzimoinmunoensayo, inmunoensayo óptico y, más recientemente, en sondas quimioluminiscentes de ADN, presentan sensibilidades más elevadas, superiores al 90%, parecidas a las obtenidas por cultivo, que teóricamente permitirían obviar la práctica concomitante del mismo en los casos negativos(3). Sin embargo, debe señalarse que hay muchas discrepancias entre distintos estudios, hechos incluso con el mismo test, discrepancias que dependen probablemente de la metodología y de la habilidad en la recogida de la muestra: el manejo de un escobillón, con el que hay que frotar enérgicamente las dos superficies amigdalares, la faringe posterior, la úvula, retirarlo sin contactar con la mucosa bucal, ni con la lengua ni con los dientes, y hacerlo lo más rápidamente posible para disminuir las inevitables molestias al niño, es algo relativamente sencillo, pero que requiere de una cierta práctica y habilidad(4).
Algunos estudios de coste beneficio con test rápido sugieren una disminución de costes derivada de su uso sistemático.
En un único estudio de estas características disponible en nuestro medio, Contessotto y cols.(5) recogen 460 muestras de exudado faringoamigdalar de niños entre 6 meses y 14 años con faringitis sugestivas de etiología bacteriana, que se estudian con test rápido y cultivo simultáneo, e informan de que, pese a que la utilización del test reduce en un 50% la utilización de ATB, el coste asistencial es algo superior al que se deriva de la práctica habitual sin test, debido al coste del mismo. Sin embargo, este estudio se hizo con un test de coste sensiblemente superior (más de 5 euros) a los más actuales (menos de 3) y se incluyeron niños muy pequeños, con muy baja probabilidad de obtener un resultado positivo, lo que aumenta el coste global de la asistencia al obtenerse un exceso de test negativos.
Ehrlich y cols.(6) realizan un estudio de coste beneficio: el tratamiento basado sólo en el test rápido fue la mejor opción si se analizaba el coste económico. En cambio, si se pretendía minimizar el número de pacientes con FR, la mejor opción era tratar a los pacientes en base al cultivo. La tendencia actual es a considerar los modernos test como suficientes, sin necesidad de confirmar con cultivo los resultados negativos, en áreas de baja prevalencia de FR, como en nuestro medio. Sin embargo, el tema sigue siendo controvertido y hay guías de práctica clínica en las que se sigue recomendando el cultivo en casos negativos con fuerte sospecha clínica.
La Academia Americana de Pediatría concluye que con la utilización de los modernos test inmunocromatográficos se puede obviar el cultivo en casos negativos. Esta práctica no ha demostrado un aumento en las complicaciones supurativas y no supurativas de la infección estreptocócica.
El test es capaz de detectar antígenos hasta 48 h después de iniciado el tratamiento antibiótico, lo que lo hace especialmente útil para suspender en ese plazo tratamientos ATB incorrectamente instaurados en faringitis presuntamente virales, a partir de diagnósticos empíricos sin confirmación etiológica.
Los test también se han utilizado con buenos resultados en el diagnóstico rápido de patología cutánea potencialmente estreptocócica, fundamentalmente celulitis perianal y, obviamente, en el de escarlatina. No se ha documentado su utilización en el diagnóstico de balanopostitis supurativas y vulvovaginitis exudativas.
Virus respiratorio sincitial
El virus respiratorio sincitial (VRS) provoca epidemias anuales de bronquiolitis y neumonía en otoño-invierno, y es el origen de gran cantidad de visitas ambulatorias y controles pautados o espontáneos, de visitas espontáneas a urgencias, de un enorme gasto farmacéutico en medicaciones de dudoso valor e intermitente prestigio bibliográfico (broncodilatadores y corticoides), pero que la mayor parte de pediatras sigue utilizando con mayor o menor convencimiento, y de muchos ingresos hospitalarios, con una mortalidad baja pero no despreciable, generalmente confinada a lactantes de alto riesgo. Por su alta transmisibilidad (de 5 a 12 días, en ocasiones hasta 3 semanas), es causa también de brotes escolares y de infecciones nosocomiales; por lo que, el niño infectado requiere un manejo en condiciones de aislamiento adecuadas.
A nivel práctico, parece que esta necesidad de aislamiento sería la indicación fundamental de poder disponer del test, obviamente en un niño que tiene que ingresar por bronquiolitis, pero especialmente en el más frecuente caso de bronquiolitis leve con seguimiento domiciliario, en el que el paciente debe aislarse de la guardería, recomendación que suele olvidarse si el niño está afebril y tiene buen estado general. La documentación de la negatividad de un test previamente positivo podría ser un criterio de reentrada a guardería, hasta ahora no estudiado. Algunos estudios han sugerido que la bronquiolitis por VSR tiene un curso independiente de la utilización de fármacos broncodilatadores, lo que constituiría un factor diferencial con bronquiolitis producidas por otros virus respiratorios, y el disponer de una prueba rápida positiva sería un elemento definitivo para decidir la abstención terapéutica. Otros autores no han corroborado esta observación, con lo que la prueba terapéutica con broncodilatadores sigue siendo práctica habitual, independientemente de la etiología.
Desde la AP parece que el test de detección rápida podría tener interés en el manejo no agresivo del lactante febril con bronquiolitis. Diversos estudios(7-9) han coincidido en señalar que la incidencia de enfermedad bacteriana grave en el niño con VRS positivo es muy baja, y que su documentación aconseja obviar en el niño febril mayor de 1 mes cualquier otra exploración complementaria, con la posible excepción de descartar la infección urinaria que, por motivos desconocidos, es frecuente en niños con infección VRS.
Disponer de esta prueba en AP podría reducir el uso de ATB en neumonía ambulatoria. Ante una sospecha clínica de neumonía adquirida en la comunidad (NAC) en un niño de menos de 2 años, una prueba rápida positiva para VRS debería ser un factor decisivo en la abstención, al menos inicial, en la utilización de ATB, especialmente si valoramos la escasa incidencia de sobreinfección bacteriana en vías bajas que experimenta la infección por VRS. Las modernas pruebas inmunocromatográficas presentan sensibilidad y especificidad elevadas (89-94%), mayores que el cultivo de VRS, y ofrecen resultados en 15 minutos. Las muestras pueden obtenerse por lavado-aspirado nasal, o por frotis nasofaríngeo.
Gripe
Por fin, parece que la gripe pediátrica está recibiendo la atención que merece. Está claro que no es tan benigna como siempre se creyó, especialmente en niños pequeños, cuya tasa de hospitalización por neumonía es tan elevada como en el grupo de riesgo clásico de mayores de 65 años, y sobre todo actúa como factor fundamental en la diseminación de la enfermedad a colectivos de alto riesgo, al ser los niños transmisores más prolongados y eficaces del virus de la gripe, y tener una tasa de ataque de hasta el 45% en una epidemia estacional normal. El camino hacia la inmunización anual pediátrica parece claramente definido, al menos en los niños más pequeños, como ya recogen en sus recomendaciones los comités de vacunas de muchas sociedades científicas.
La fase inicial de la gripe, antes de la aparición de la sintomatología respiratoria, se presenta como un síndrome febril sin focalidad aparente (SFSF), y nos planteará en el lactante y niño pequeño el diagnóstico diferencial con el riesgo clínico de bacteriemia oculta (BO). Parece muy atractiva la posibilidad de disponer de un test rápido que permita evitarle al niño con SFSF las molestias derivadas de la aplicación estricta del protocolo de BO.
La incidencia de enfermedad bacteriana grave en un niño con gripe documentada es muy baja, y la presencia de un resultado positivo en un test de gripe permite evitar otras exploraciones complementarias y reducir el uso de ATB(10-13).
Los test inmunocromatográficos de gripe tienen sensibilidades menores que otras pruebas descritas en este capítulo, entre el 45,5 y el 71% según las series, mayores para el virus A, algo inferiores para el B, pero siempre inferiores al cultivo viral, y una elevada especificidad, del 95%. Hay grandes variaciones entre distintos test, aunque la sensibilidad depende fundamentalmente de una técnica correcta de recogida de la muestra con frotis nasofaríngeo (Fig. 2). La neumonía es frecuente en niños con gripe y, dada la difícil diferenciación clínica entre neumonía viral por el mismo virus de la influenza o la mucho más frecuente sobreinfección neumocócica, el niño con gripe que presente sintomatología sugestiva de neumonía debe someterse a la misma conducta diagnóstica independientemente del resultado del test.
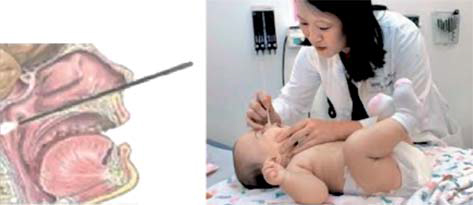
Figura 2. Técnica de recogida de muestra respiratoria por frotis nasofaríngeo.
El mejor periodo para practicar el test rápido está entre las 12 y las 48 horas del inicio de la sintomatología, y siempre en los 4 primeros días. Antes de las 12 horas puede haber falsos negativos.
Neumococo
El neumococo es el germen más prevalente en la neumonía adquirida en la comunidad. La infección sistémica por neumococo es una causa importante de morbilidad y mortalidad, especialmente en niños pequeños, ancianos y personas con enfermedad de base. La vacuna 13-valente está modificando sustancialmente la epidemiología de la enfermedad.
En los últimos años, se ha desarrollado experiencia en una nueva técnica inmunocromatográfica de detección de antígeno neumocócico PnC en muestras urinarias, que se ha mostrado útil en adultos y niños para el diagnóstico de neumonía neumocócica bacteriémica o no, ofreciendo comodidad en la recogida y procesamiento de la muestra, resultados en menos de 15 minutos y escasa interferencia con otros estreptococos presentes en la cavidad oral (mutis, oralis) que comparten con neumococo el citado PnC. Si bien el neumococo coloniza frecuentemente la orofaringe de niños normales (hasta un 25 % de niños menores de 7 años), la concentración de germen en estos casos suele estar por debajo del nivel de detección antigénica requerido por la prueba. No obstante, la prueba no ofrece dudas en cuanto a su sensibilidad, pero sí se ha cuestionado su especificidad (85%) en zonas de alta prevalencia de colonización nasofaríngea por neumococo. Se especula que el antígeno PnC puede alcanzar el tracto urinario, especialmente en caso de infección respiratoria concomitante que lesiona la barrera mucosa nasofaríngea. En cualquier caso, parece una prueba con un perfil de sensibilidad-especificidad superior al recuento leucocitario como predictor de neumonía o bacteriemia por neumococo, lo que le confiere potencial interés para su uso en una consulta de AP.
Rotavirus
La gastroenteritis aguda (GEA) por rotavirus (RV) es la más frecuente en niños pequeños; de forma que, la práctica totalidad han tenido contacto con el virus a los 5 años, experimentando además diversas reinfecciones de gravedad decreciente. En nuestro medio no provoca mortalidad o es muy escasa, pero la enfermedad tiene un gran impacto socioeconómico, que oscila entre los 160 euros de coste sanitario de un episodio atendido en primaria y los 1.500 del ingresado en hospital (1/50), además de unos 200 euros por episodio en costes indirectos. Los niños con GEA por RV presentan fiebre más elevada y de mayor duración, más vómitos, más deposiciones y más líquidas, y peor estado general y más incidencia de deshidratación que en otras GEA virales.
La importancia práctica que puede tener el diagnóstico rápido en el manejo del niño puede parecer a priori escasa, ya que el tratamiento basado en la prevención y tratamiento de la deshidratación con soluciones de rehidratación oral es común a todas las GEA e independiente de la etiología. No obstante, el test puede permitir una información correcta a los padres en el sentido de una previsión de cuadro más prolongado y potencialmente grave que probablemente requiere de controles clínicos programados para revalorar el estado de hidratación del niño.
El test también tiene interés para una indicación más estricta de aislamiento. El RV se elimina por heces en cantidad muy abundante (entre 10.000 millones y un billón de partículas virales por ml de heces, cuando 10 partículas son suficientes para producir infección) y sobrevive durante varias horas en las manos de los cuidadores del niño, y de días a semanas en superficies inanimadas (teléfonos, útiles de escuela, cuadernos…); por lo que, la transmisión viral es muy efectiva y la enfermedad, muy contagiosa, provocando brotes escolares y nosocomiales. Las medidas higiénico sanitarias no son útiles en el control de esta enfermedad, que se transmite fundamentalmente por vía fecal-oral y por aerosoles de partículas respiratorias. El rotavirus no es sólo una enfermedad digestiva de lactantes, sino una enfermedad que afecta a todas las edades (especialmente grave en las edades extremas) con posible afectación respiratoria y viremia. El lavado de manos meticuloso del personal que atiende al niño reduce la transmisión sólo si se hace con antisépticos potentes y no con agua y jabón, pero no la evita, aunque es el único método parcialmente efectivo para controlar la diseminación de la enfermedad. Por tanto, y mientras las vacunas no sean sistemáticas, el conocimiento de la etiología es importante para extremar las medidas de aislamiento. Teniendo en cuenta que el virus puede excretarse durante periodos prolongados, de varias semanas, aún sin diarrea, la documentación de la negatividad de un test previamente positivo podría ser un criterio de reentrada en guardería, aún no estudiado.
Finalmente, el diagnóstico etiológico permite valorar objetivamente el impacto de la enfermedad y la necesidad de recomendar su prevención con vacunas. En nuestro medio, la cobertura de vacunación antirotavirus está por debajo de otras vacunas no financiadas por el Sistema Nacional de Salud (neumococo y varicela), lo que se debe fundamentalmente a una baja percepción de la importancia de la enfermedad por parte del profesional sanitario que debe recomendar la vacuna. Como el rotavirus no se ve, ni se diagnostica, dado que se hace un diagnóstico genérico de GEA, el profesional tiene la falsa sensación de que la enfermedad no es importante y, por lo tanto, de que no es necesario esforzarse mucho en su prevención con vacunas.
El TDR para rotavirus es un test inmunocromatográfico con sensibilidad y especificidad del 99%(14).
Adenovirus
La gastroenteritis aguda por adenovirus es la más frecuente después de la causada por rotavirus (5-9% de casos de diarrea); si bien, parece estar siendo desplazada en nuestro medio por norovirus y astrovirus. Afecta fundamentalmente a niños de menos de 2 años y se presenta durante todo el año. Puede causar brotes nosocomiales, aunque son menos frecuentes que los causados por rotavirus. La duración de la diarrea es mayor (de 10 a 14 días) pero el cuadro es mucho más leve y tiene mucha menor tendencia a la deshidratación. Se ha relacionado ocasionalmente con invaginación intestinal. Un test rápido positivo para adenovirus permite una previsión de cuadro prolongado pero benigno y, probablemente, reduzca sucesivas visitas no pautadas.
El test rápido para adenovirus en heces es un test de inmunocromatografía que puede ir asociado en el mismo kit de diagnóstico para rotavirus e, incluso, astrovirus. La técnica es muy cómoda, requiere de poca cantidad de heces y ofrece resultados en un máximo de 15 minutos. No hay experiencia previa en su utilización en AP. En estudios hospitalarios, el test ha mostrado sensibilidad del 90% y especificidad del 99% en relación con el cultivo viral.
Astrovirus
La GEA por astrovirus tiene una duración de 5-6 días y generalmente tiene una evolución favorable y raramente evoluciona hacia la deshidratación. El test inmunocromatográfico puede ir asociado en el mismo kit con rotavirus y adenovirus. En estudios hospitalarios ha mostrado sensibilidad del 94% y especificidad del 99%.
Norovirus
La GEA por calicivirus (norovirus y sapovirus) se caracteriza por el predominio de los vómitos, náuseas y dolor abdominal sobre la diarrea. Es frecuente la sintomatología sistémica acompañante. Los norovirus son la causa más frecuente de GEA viral en adolescentes y adultos, aunque puede afectar a cualquier edad, y son frecuentes los brotes escolares y nosocomiales. Aunque es más frecuente en invierno, puede presentarse durante todo el año, y en EE.UU., donde hay altas tasas de vacunación contra rotavirus, ya es la primera causa de GEA viral. Existe un test inmunocromatográfico de procedimiento algo más engorroso que los descritos anteriormente, con diversos pasos intermedios, y la sensibilidad es también inferior (84%), con una especificidad del 95%.
Campylobacter
Es la GEA bacteriana más frecuente en niños, y segunda causa de diarrea del viajero, por detrás únicamente de la Escherichia coli enterotoxigénica. El cuadro tipico de GEA se acompaña frecuentemente de sangre en las heces. En lactantes, la diarrea con sangre y sin fiebre es una presentación común que permite orientar la sospecha diagnóstica. Se ha relacionado con la aparición de síndrome de Guillain-Barré, probablemente de causa autoinmunitaria. La infección suele ser benigna (más grave en países pobres) y autolimitada (raramente con bacteriemia), aunque el tratamiento con macrólidos reduce el periodo sintomático y previene las infecciones crónicas y las recaídas, por lo que el interés del TDR está en que, si se hace un diagnóstico precoz, puede instaurarse un tratamiento útil. El test inmunocromatográfico cualitativo tiene una sensibilidad y especificidad del 99%.
Salmonella
La GEA por Salmonella produce un cuadro típico de GEA, pero en un 10% se producen infecciones focales y, en menores de 6 meses, hay riesgo de bacteriemia. En cuadros de GEA no complicada no está indicado el tratamiento antibiótico. El test inmunocromatográfico cualitativo tiene una sensibilidad del 99 y una especificidad del 97%.
Helicobacter pylori
La infección per Helicobacter pylori (HP) es muy frecuente en la especie humana, especialmente en ámbitos socioeconómicos bajos, y se han comunicado prevalencias de hasta el 50% en edad pediátrica; si bien, muchas de estas infecciones son transitorias y asintomáticas. Todos los niños infectados persistentemente por este germen desarrollan cambios histológicos sugestivos de gastritis crónica. La infección por HP en Pediatría puede ser asintomática o manifestarse por dolor abdominal, vómitos y, menos frecuentemente, por anemia ferropénica refractaria al tratamiento por pérdidas ocultas de sangre en heces y retraso del crecimiento. La colonización crónica por HP aumenta el riesgo de desarrollar ulcus péptico y cáncer de estómago. Clásicamente, el diagnóstico se hizo con la detección de anticuerpos Ig G, y se confirmaban los cambios histológicos con endoscopia y biopsia. Actualmente, no se recomiendan los test serológicos en niños. Se considera el patrón de oro diagnóstico, los test de urea en aire espirado. En la actualidad, hay métodos de detección antigénica de HP en heces por técnicas de inmunocromatografía(15,16), que ofrecen gran comodidad y sensibilidad (94%)-especificidad (99%) parecidas a los test de urea en aire espirado.
Giardia
La infección por Giardia lamblia tiene un amplio espectro de presentación que oscila desde la colonización asintomática hasta la diarrea aguda, la diarrea crónica, el síndrome de malabsorción con retraso de crecimiento y el dolor abdominal recurrente.
El test rápido para Giardia en heces(17) es un test de inmunocromatografía que ofrece resultados en 10 minutos. No hay experiencia previa publicada en AP. Estudios hospitalarios muestran concordancia excelente con examen microscópico de heces, con sensibilidad, especificidad y valores predictivos positivo y negativo superiores al 99%.
Criptosporidium
Inicialmente, la infección por el protozoo Cryptosporidium parvum fue considerada patógena sólo en inmunodeprimidos. En la actualidad, se reconoce como una causa frecuente de diarrea aguda en niños sanos de todo el mundo y de brotes en guarderías. Produce diarrea acuosa abundante, sin sangre, acompañada de dolor abdominal intermitente, náuseas, vómitos y anorexia. El 80 % de casos cursan con vómitos y puede acompañarse también de cefalea, mialgias y debilidad. Clínicamente, es indistinguible de otras causas de GEA. Un 30-50% cursan con fiebre. La diarrea puede prolongarse durante semanas, y la infección es autolimitada en inmunocompetentes, debiendo tratarse solo en inmunodeprimidos.
El test rápido para Criptosporidium en heces, que puede formar parte del mismo kit para el diagnóstico rápido de Giardia(17), es un test inmunocromatográfico que utiliza anticuerpos monoclonales específicos para Criptosporidium que detectan todas las formas del ciclo vital del parásito. No hay experiencia previa publicada en AP. Estudios hospitalarios muestran concordancia excelente con examen microscópico de heces, con sensibilidad, especificidad y valores predictivos positivo y negativo superiores al 99%.
Mononucleosis infecciosa
La mononucleosis infecciosa (MI) es una enfermedad autolimitada causada por el herpesvirus Epstein-Barr (EB). Los síntomas más comunes son: fatiga, faringitis, fiebre, linfadenopatía, esplenomegalia y hepatopatía. En casos raros, pueden aparecer complicaciones, como: síndrome linfoproliferativo, trombocitopenia grave, anemia hemolítica, pericarditis, miocarditis, neumonía, pancreatitis, síndrome de Reye, encefalitis y otros síndromes neurológicos. En los países industrializados, la incidencia máxima de MI se produce entre los 14 y 18 años. En países en vías de desarrollo o en zonas con alta densidad de población, la mayoría de los niños se infectan antes de los 3 años, y los síntomas pueden ser leves o clínicamente inaparentes. La faringitis por EB (exudativa y a veces con petequias) puede plantear problemas diagnósticos en AP y se confunde fácilmente con la producida por EBHGA, no siendo raro que coexistan ambas. Su aspecto también puede confundirse con la causada por adenovirus. Debe sospecharse siempre que una faringitis supuesta o confirmadamente estreptocócica no mejore en 3 días de un tratamiento correcto con ATB.
Durante la fase aguda de la enfermedad, aparecen anticuerpos heterófilos en el 90% de MI, cuya presencia se puede demostrar a partir de la semana de enfermedad, alcanzando su concentración máxima a las 2-4 semanas y disminuyendo a las 12 semanas, siendo detectables incluso hasta un año después. Los Ac heterófilos son, a menudo, indetectables en niños menores de 5 años con MI.
El test rápido para Epstein-Barr se basa en la detección por inmunocromatografía de anticuerpos heterófilos IgM en plasma, suero o sangre completa. La muestra puede obtenerse cómodamente por punción capilar. No hay experiencia previa de su utilización en AP. En estudios hospitalarios comparativos con técnicas de EIA y de hemaglutinación, la sensibilidad y especificidad han sido superiores al 99%.
Proteína C reactiva
Aunque no es un test de diagnóstico microbiológico, lo incluimos aquí por su potencial utilidad en la valoración del niño febril o con neumonía.
La fiebre es uno de los motivos de consulta más frecuentes en AP. El manejo del SFSF sigue siendo muy controvertido, pese a la frecuente publicación de guías de práctica clínica que han tenido un seguimiento irregular.
La PCR se sintetiza en el hígado en respuesta a niveles altos de citocinas, a partir de las 4-6 horas del inicio de la inflamación o agresión tisular y va doblando sus valores cada 8 horas hasta llegar a un pico a las 36 horas. Actúa como modulador inmunitario, promoviendo la síntesis de complemento por la vía clásica y favoreciendo la fagocitosis. En recientes estudios(18), la PCR vuelve a ser reivindicada como un instrumento útil en la valoración del niño febril. En un metaanálisis de referencia, y con un nivel de corte propuesto de 32 mg/L, se ha mostrado con similar precisión diagnóstica que la procalcitonina (PCT), considerada generalmente como más sensible y específica, concepto no obstante proveniente de estudios en los que hay un sesgo de gravedad, con una alta tasa de enfermedad bacteriana grave más grave, como sepsis o meningitis. Se considera a partir de estos datos que la PCT sería más un marcador de la severidad de la infección bacteriana que un diferenciador básico de enfermedad viral o bacteriana. La PCT tiene la ventaja de que se eleva más precozmente que la PCR, que puede presentar una ventana silente de unas 8 horas. Sin embargo, el coste de determinación de la PCR es sensiblemente inferior. Recientemente, incluso se vuelve a proponer la PCR como un instrumento complementario útil en la valoración etiológica de la neumonía adquirida en la comunidad(19).
La posibilidad de practicar PCR en la consulta de AP parece de gran utilidad para una valoración más precisa del SFSF en el grupo etario de riesgo de bacteriemia oculta, con la disminución consiguiente de la derivación hospitalaria innecesaria. Las nuevas técnicas de determinación rápida de la PCR en sangre capilar son muy cómodas para el niño, tienen un bajo coste y permiten disponer del resultado en pocos minutos, por lo que se pueden tomar decisiones prácticas en el mismo acto médico.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.***Decker JP. Infectious disease testing at the point-of-care. Point of care. 2012; 11: 85-89.
2.*Prats G. Pruebas inmunológicas. En Microbiología clínica. Madrid: Panamericana; 2006. p. 157-85.
3.***Pichichero ME. Are follow up throat cultures necessary when rapid antigen detection test is negative for Group A streptococcus? Clin Pediatr. 2001; 40: 191-5.
4.**Kurtz B, Kurtz M, Roe M, Todd J. Importance of inoculum size and sampling effect in rapid antigen detection for diagnosis of streptococcus pyogenes. J Clin Microbiol. 2000; 38(1): 279-81.
5.*Contessotto C, Cámara M, Avilés MJ, Ojeda JM, Cascales I, Rodríguez F. Empleo racional de los antibióticos en pediatría: impacto de la aplicación de un test rápido de detección de estreptococo beta-hemolítico del grupo A en la faringoamigdalitis aguda. An Esp Pediatr. 2000; 52: 212-9.
6.**Ehrlich JE, Demopoulos BP, Daniel JR. Cost-effectiveness of treatment options for prevention of rheumatic heart disease from group A streptococcal pharyngitis in a pediatric population. Prev Med. 2002; 35: 250-7.
7.**Vega R. Rapid viral testing in the evaluation of the febrile infant and child. Curr Opin Pediatr. 2005; 17: 363-7.
8.**Titus MO, Wright SW. Prevalence of serious bacterial infections in febrile infants with respiratory syncitial virus infections. Pediatrics. 2003; 112: 282-4.
9.**Meléndez E, Harper MB. Utility of sepsis evaluation in infants 90 days of age or younger with fever and clinical bronchiolitis. Pediatr Infect Dis J. 2003; 22(12): 1053-6.
10.**Sharma V, Dowd, MD, Slaughter AJ, Simon SD. Effect of rapid diagnosis of influenza virus type A on the emergency department management of febrile infants and toddlers. Arch Pediatr Adolesc Med. 2002; 156: 41-3.
11.**Bonner AB, Monroe KW, Talley LI. Impact of the rapid diagnosis of influenza on physician decision-making and patient management in the pediatric emergency department: results of a randomized, prospective, controlled trial. Pediatrics. 2003; 112: 363-7.
12.**Smitherman HF, Caviness AC, Macias CG. Retrospective review of serious bacterial infections in infants who are 0 to 36 months and have influenza A infection. Pediatrics. 2005; 115: 710-8.
13.***Mintegui S, García JJ, Benito J, Carrasco J, Gómez B, Hernández S, Astobiza A, Luaces C. Rapid influenza test in young febrile infants for the identification of low-risk patients. Pediatr Infect Dis J. 2009; 28: 1026-7.
14.**Wilhelmi I, Colomina J, Martín-Rodrigo D, Román E, Sánchez-Fauquier A. New immunochromatographic method for rapid detection of rotaviruses in stool samples compared with standard enzyme immunoassay and latex agglutination techniques. European J Clin Microbiol Infect Dis. 2001; 20: 741-3.
15.**Czinn SJ. Helicobacter pylori infection: detection, investigation and management. J Pediatr. 2005; 146: S21-6.
16.*Elitsur Y. Helicobacter pylori diagnostic tools: is it in the stool? J Pediatr. 2005; 146: 164-7.
17.*Katanik MT. Evaluation of Color Pac Giardia/cryptospooridium rapid assay and Prospect Giardia/cryptosporidium microplate assay for detection of Giardia and Cryptosporidium in fecal specimens. J Clin Microbiol. 2001; 39: 4523-5.
18.***Andreola B, Bressan S, Callegaro S, Liverani A, Plebani M, Da Dalt L. Procalcitonin and C-reactive protein as diagnostic markers of severe bacterial infections in febrile infants and children in the emergency department. Pediatr Infect Dis J. 2007; 26: 672-7.
19.**Flood RG, Badik J, Aronoff SC. The utility of serum C-reactive-protein in differentiating bacterial from non bacterial pneumonia in children. Pediatr Infect Dis J. 2008; 27: 95-9.
Bibliografía recomendada
–Decker JP. Infectious disease testing at the point-of-care. Point of care. 2012; 11: 85-89.
Excelente revisión que valora el decisivo impacto de la introducción de éstas técnicas en la práctica clínica.
–Pichichero ME. Are follow up throat cultures necessary when rapid antigen detection test is negative for Group A streptococcus? Clin Pediatr. 2001; 40: 191-5.
El mayor investigador mundial en faringitis pediátrica nos ilustra sobre el uso correcto y valoración adecuada de los modernos test inmunocromatográficos.
–Mintegui S, García JJ, Benito J, Carrasco J, Gómez B, Hernández S, Astobiza A, Luaces C. Rapid influenza test in young febrile infants for the identification of low-risk patients. Pediatr Infect Dis J. 2009; 28: 1026-7.
Extraordinario trabajo nacional en el que se demuestra también en nuestro medio la baja incidencia de enfermedad bacteriana grave en el niño con test rápido de gripe positivo.
–Andreola B, Bressan S, Callegaro S, Liverani A, Plebani M, Da Dalt L. Procalcitonin and C-reactive protein as diagnostic markers of severe bacterial infections in febrile infants and children in the emergency department. Pediatr Infect Dis J. 2007; 26: 672-7.
Metaanálisis de referencia que devuelve a la PCR parte del prestigio perdido como marcador de enfermedad bacteriana.

