|
| Temas de FC |
A. de la Vega Bueno, M.D. Lledín Barbancho
Hospital Infantil La Paz. Servicio de Hepatología y Trasplante Hepático Infantil
| Resumen
Las hepatitis virales en Pediatría son una patología muy frecuente. Generalmente, son cuadros agudos, autolimitados y benignos. Los más frecuentes son los virus que producen un cuadro sistémico con afectación hepática, como el virus de Epstein Barr (VEB) y el citomegalovirus (CMV), entre otros. Otro grupo son los virus hepatotrópos (VHA, VHB, VHC, VHE), que constituyen un problema de salud pública y riesgo de complicaciones a largo plazo, como desarrollo de cirrosis y hepatocarcinoma (HCC). En los últimos años, se han producido importantes avances en el desarrollo e implantación de vacunas (VHA y VHB) y en el uso de nuevos fármacos para el tratamiento de las formas crónicas de hepatitis B y C. |
| Abstract
Viral hepatitis constitutes a common disease in childhood. They usually follow an acute, self- limited and benign course. Those viral infections leading to a systemic picture with hepatic involvement, such as EBV and CMV are the most common ones. The so-called hepatotropic viruses (HAV, HBV, HCV, HEV) constitute a public health concern and a long-term risk for cirrhosis and hepatocellular carcinoma. In the last few years, important advances in the development and implementation of vaccines for HAV and HBV have been attained. Further, new antiviral drugs for the treatment of chronic HBV and HCV infections have been recently developed. |
Palabras clave: Hepatitis B; Hepatitis C; Hepatitis viral; Hepatitis A; Hepatitis E; Niños.
Key words: Hepatitis B; Hepatitis C; Viral hepatitis; Hepatitis A; Hepatitis E; Children.
Pediatr Integral 2020; XXIV(1): 15 – 27
Hepatitis víricas
Hepatitis A
El virus de la hepatitis A es una de las causas más frecuentes de hepatitis aguda en la infancia, con un pronóstico favorable en la mayoría de los casos.
Patogenia
El virus de la hepatitis A es un virus pequeño sin cubierta, formado por una única cadena de ARN, pertenece a la familia de los Picornaviridae. Están descritos seis genotipos y un solo serotipo, lo que ha hecho posible la elaboración de una vacuna efectiva.
El hígado es el sitio primario de replicación. El daño hepático no se produce por efecto citopático directo del virus, sino por la reacción inmune que genera el huésped a través de las células T CD8+, CD4+ y las natural killer. En un pequeño porcentaje de individuos se genera una respuesta inmune exagerada, produciendo un fallo hepático fulminante. No existe infección crónica asociada a este virus. La infección confiere inmunidad permanente(1).
Epidemiología
La población susceptible en nuestro medio, son: los niños no vacunados que viajan a países endémicos, inmigrantes y sus hijos que van de vacaciones al país de origen, y los brotes en guarderías.
La transmisión es fecal-oral. El contagio se produce por el contacto directo con personas que excretan el virus o a través del consumo de alimentos y/o agua contaminada en zonas con deficientes condiciones higiénico-sanitarias. El período de incubación es de 2-6 semanas y se puede detectar el virus en las heces durante más de un mes.
En países en vías de desarrollo, la mayoría de los niños contraen la enfermedad antes de los 10 años de edad, mientras que en los países desarrollados, la incidencia cae significativamente, afectando a individuos de edades más avanzadas, lo que implica mayor gravedad de los casos. España pertenece a un área de baja seroprevalencia (<50% de la población está inmune a los 30 años)(2).
Clínica e historia natural
La sintomatología varía en función de la edad. En niños pequeños, generalmente es asintomática, mientras que en los adultos, más de un 70% pueden presentar ictericia e hipertransaminasemia.
El comienzo se caracteriza por un cuadro de: anorexia, náuseas, vómitos, diarrea y fiebre, seguido de coluria, hipocolia e ictericia, dolor en hipocondrio derecho con hepatomegalia y, en ocasiones, esplenomegalia y adenopatías asociadas. A veces, pueden presentarse manifestaciones extrahepáticas, como artritis y vasculitis. En la analítica, se aprecia en las fases iniciales, un aumento rápido de las transaminasas (>1.000 UI/ml) y, posteriormente, un pico de bilirrubina. No suele asociar coagulopatía importante, siendo este un dato importante que puede indicar la evolución hacia una hepatitis fulminante. La ictericia persiste generalmente alrededor de dos semanas y la normalización de los parámetros analíticos puede necesitar hasta varios meses(1).
Entre las manifestaciones atípicas se encuentran:
• Colestasis prolongada.
• Hepatitis fulminante: es una complicación rara, con una incidencia alrededor de 0,015-0,5%. Se asocia con viremia baja y altos niveles de bilirrubina lo que sugiere una respuesta inmune del paciente más que un efecto directo del virus.
• Recaída: se caracteriza por un patrón bifásico, con repunte de la cifra de transaminasas. Se produce hasta en un 25% de los casos sintomáticos, teniendo una evolución favorable.
• Otras: anemia hemolítica autoinmune, anemia aplásica, artritis reactiva, pancreatitis aguda, colecistitis acalculosa, síndrome de Guillain-Barré, glomerulonefritis mesangioproliferativa y fallo renal agudo, derrame pleural y ascitis.
Diagnóstico
El diagnóstico de la infección aguda se realiza mediante la detección de IgM anti-VAH específicos, que pueden persistir hasta 4-6 meses.
Los anticuerpos IgG anti-VAH aparecen en la fase de convalencencia y pueden permanecer positivos durante décadas(3). Aunque no se encuentra disponible en la mayoría de los laboratorios, también se puede estudiar el RNA del virus. Es una enfermedad de declaración obligatoria a las autoridades sanitarias.
Tratamiento
Se debe realizar un tratamiento de soporte, manteniendo una adecuada hidratación, reposo y antitérmicos.
En los casos de colestasis prolongada, puede ser necesario administrar vitaminas liposolubles. Si la presentación o evolución es hacia un fallo hepático fulminante [INR (Relación Normalizada Internacional) >1,5 con encefalopatía o INR 2 sin encefalopatía, que no responde a la administración de vitamina K], debe ser transferido con prontitud a un centro de referencia de trasplante hepático infantil.
Prevención
La vacuna se debe administrar en los primeros 14 días tras la exposición. En los pacientes inmunodeprimidos o con hepatopatía crónica, debe incluirse en el calendario vacunal, debido a la mayor gravedad del cuadro clínico en estos pacientes.
Las medidas generales incluyen mejoras en las condiciones socio-sanitarias de la población (potabilización del agua y saneamiento). El virus se inactiva con cloro, con formol y a altas temperaturas.
Existen medidas de inmunización pasiva y activa(4):
• Inmunización pasiva: mediante la administración de gammaglobulina polivalente en los primeros 14 días post-exposición. Ofrece protección durante 3-6 meses. Cada vez menos utilizada, debido a la eficacia que ofrece la vacuna posexposición.
• Inmunización activa: las vacunas actualmente autorizadas son preparados de VHA inactivados. Se puede combinar con otras vacunas: VAH+VHB.
La pauta de administración es una dosis y un recuerdo 6 meses después (0 y 6 o 12 meses) intramuscular en niños mayores de 12 meses. En el caso de la vacuna combinada A+B, se administran 3 dosis (0, 1 y 6 meses) (Tabla I).
Estudios demuestran que aparecen anticuerpos protectores 14 días después de la administración de la vacuna. Se recomiendan dos dosis para alcanzar anticuerpos protectores a largo plazo (>10 años). No es necesario realizar serologías posvacunación.
En el caso de profilaxis pre-exposición, numerosos países la incluyen en su calendario vacunal (Argentina, Estados Unidos, Grecia, Turquía…). En España, está incluida en algunas zonas: Cataluña, Ceuta y Melilla.
La vacunación está indicada en: pacientes con enfermedades hepáticas o en tratamiento con: fármacos hepatotóxicos, inmunodeprimidos, personal con riesgo ocupacional, viajeros a áreas endémicas (al menos, 1 mes antes) y familiares de familia originaria de zonas de alta endemia.
La profilaxis posexposición se debe realizar en los primeros 14 días tras la exposición, con la administración de las 2 dosis de la vacuna. En pacientes inmunodeprimidos o con hepatopatía crónica, debe administrarse conjuntamente con inmunoglobulina polivalente.
Hepatitis E
Introducción y epidemiología
El virus de hepatitis E es un virus RNA con 4 genotipos (según las áreas geográficas) y con diferente epidemiología (transmisión fundamentalmente oro-fecal).
El virus de hepatitis E es un pequeño virus RNA monocatenario y sin cápsula de envoltura. Pertenece a la familia de los ¨hepavirus¨. Cuatro genotipos diferentes se han aislado según las áreas geográficas. Los genotipos 1 y 2 se relacionan con casos endémicos en zonas en desarrollo (Asia, África y América Central) y, ocasionalmente, se producen brotes por agua contaminada, ambos afectan a seres humanos, siendo el más frecuente el genotipo 1. Los genotipos 3 y 4 infectan a animales (cerdo, jabalí, carne de caza…) y se relaciona con casos por consumo de carnes o alimentos contaminados (zoonosis). Para evitarlo, debe ser cocinada a más de 70ºC y no menos de 20 minutos(5). El genotipo 4 es similar y predomina en India y zonas de China. En estos dos últimos genotipos la infección, generalmente, se relaciona con consumo de carne contaminada(5). Es difícil estimar su frecuencia, pero la OMS calcula que cada año se producen unos 20 millones de casos de infección por el VHE, de los cuales 3,3 millones presentan los síntomas de la enfermedad. Igualmente, estima que en 2015, la hepatitis E provocó aproximadamente 44.000 defunciones, una cifra que representa el 3,3% de la mortalidad debida a las hepatitis víricas.
La mayoría de publicaciones sobre hepatitis E están realizados por grupos de adultos y hay escasos en población infantil. En 2018, se publica una revisión de hepatitis E en niños por el Comité de Hepatología de la ESPGHAN, que muestra sus conclusiones y recomendaciones en niños(6).
La prevalencia de anticuerpos se incrementa con la edad y es muy variable en los distintos países, y en algunos de Asia esta tasa llega hasta el 80% en adultos.
En nuestro país, se ha realizado una publicación en 2008 sobre 1.249 niños sanos, entre 6 y 15 años, y mediante determinación de IgG se obtiene una prevalencia de 4,6% (57 pacientes) y de ellos solo 4 casos presentaron clínica de la hepatitis aguda(7).
La vía de transmisión fundamental es oro-fecal y también hay casos de transmisión vertical (sobre todo, en países endémicos) o incluso por transfusiones de pacientes infectados en fase presintomática o asintomática.
Clínica
Generalmente aguda y autolimitada, puede haber formas graves y crónicas en pacientes inmunocomprometidos.
El período de incubación varía entre 15 y 60 días con una media de 40. La presentación clínica aguda es similar a la hepatitis A (febrícula, vómitos, anorexia, dolor abdominal, ictericia…), aunque en muchos casos es asintomática.
En la mayoría de pacientes, la evolución es autolimitada, pero también hay formas graves con fallo hepático agudo, más frecuente en embarazadas, fundamentalmente en el último trimestre, en las que la tasa de mortalidad es alta (en países de alta incidencia, como la India, y genotipo en 1 y 2). Siendo muy poco frecuente en nuestro medio, que cause un fallo hepático agudo.
En pacientes inmunocomprometidos (trasplantados de órgano sólido [TOS] y progenitores hematopoyéticos), se ha comprobado la existencia de casos con evolución crónica y, en los que, además de elevación de transaminasas, pueden presentar afectación extrahepática: trombocitopenia, pancreatitis, alteración neurológica y renal, y otras. Estas manifestaciones pueden darse de forma menos frecuentes en la presentación aguda.
En estos pacientes hay viremia prolongada y disfunción hepática durante más de 6 meses. En nuestro medio se relacionan, fundamentalmente, con el genotipo 3 (zoonosis) y pueden llegar a producir daño hepático severo. Debe sospecharse en alteraciones crónicas de la función hepática en niños trasplantados (frente al diagnóstico de rechazo, trastornos autoinmunes u otros). Casos de reactivación de virus E post-trasplante con títulos bajos de IgG son poco probables, pero sí se ha comprobado ocasionalmente reinfección post-trasplante con inmunosupresión alta.
Diagnóstico
Detección de anticuerpos (IgG e IgM). Si existe una sospecha elevada o en pacientes inmunocomprometidos, se recomienda la realización de PCR-VHE.
La detección puede realizarse mediante anticuerpos (IgG y IgM), cuya sensibilidad es variable. La IgM presenta un pico de elevación a las 4 semanas y permanece positiva durante varios meses. En casos de alta sospecha diagnóstica y en pacientes inmunosuprimidos, aunque los anticuerpos sean negativos, se debe realizar PCR en sangre, que muestra mayor sensibilidad. En la presentación aguda, es posible detectar PCR en heces desde unos días antes de los síntomas hasta casi 2 meses después. Esta eliminación es aún más prolongada en pacientes inmunocomprometidos y facilita la detección de portadores crónicos.
Tratamiento y recomendaciones (ESPGHAN)
No está indicado en formas agudas no complicadas, pero sí en formas graves, crónicas o en pacientes inmunosuprimidos: ribavirina.
En las formas agudas y sin factores de riesgo, no está indicado tratamiento antiviral. En formas crónicas, graves, con manifestaciones extrahepáticas o pacientes con hepatopatía de base, se recomienda tratamiento con un ciclo de ribavirina durante, al menos, 3 meses a 15 mg/kg/d. Se debe vigilar función renal y la posible aparición de anemia, y realizar control mensual de PCR y 3-6 meses tras acabar la terapia para comprobar respuesta viral sostenida. Estas recomendaciones se basan en datos obtenidos de grupos de adultos que demuestran una elevada eficacia de este antiviral en la eliminación del virus E(8). En pacientes trasplantados, es necesario disminuir el tratamiento inmunosupresor y, si con ello no es suficiente, o esta disminución no es posible, se debe indicar el tratamiento antiviral. En algunas publicaciones, se señala la eficacia del tratamiento con ribavirina en fallo hepático agudo, evitando la necesidad de trasplante hepático(9).
Prevención
Medidas higiénico-sanitarias. Detección universal en hemoderivados y desarrollo e implementación de vacuna (en fase avanzada).
Medidas higiénico-sanitarias en países endémicos, evitar el consumo de alimentos que pueden estar contaminados por la población de riesgo (inmunosuprimidos). Detección universal del virus en plasma y derivados. Desarrollo e implementación de vacuna pangenómica para proteger a la población de riesgo. En desarrollo en China(10).
Hepatitis B
En la actualidad, en nuestro medio, los principales grupos de riesgo son los hijos de emigrantes y las adopciones de países con alta endemia.
Patogenia
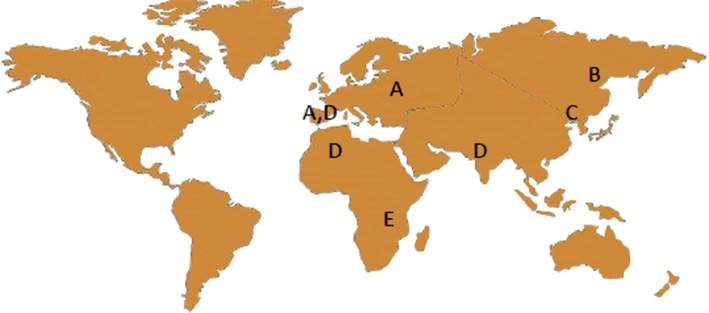
El virus de la hepatitis B (VHB) pertenece a la familia de los Hepadnaviridae. En humanos, se conocen hasta 10 serotipos distintos (A-J), con distinta distribución geográfica (Fig. 1). En los países mediterráneos predomina el A y el D(1,11). Cada serotipo tiene distinto comportamiento, evolución a la cronicidad y respuesta al tratamiento.
Figura 1. Distribución geográfica de los genotipos más importantes del VHB.
El virus de la VHB es una estructura esférica, con una envoltura lipoproteica externa que contiene el antígeno de superficie (HBsAg) y una interna que forma la nucleocápside o núcleo (core), donde se localiza el antígeno core (HBcAg). En el interior de la nucleocápside se localiza el genoma del virus, que consiste en una doble cadena de ADN y una enzima ADN polimerasa inversa, responsable de la síntesis del ADN viral(12) (Fig. 2).
Figura 2. Esquema del ciclo de replicación del VHB(12). El VHB se internaliza en el hepatocito por la unión de las proteínas de la superficie a receptores de la célula y la cápside (partícula core) se libera en el citoplasma y migra hacia el núcleo; allí, su genoma se recompone en una forma circular cerrada de enlaces covalentes de DNA (ccc DNA) que se transcribe a un RNA. Sale al citoplasma y comienza la síntesis de las proteínas virales: de superficie, core, polimerasa y proteína X que se acabarán ensamblando formando las cápsides y en el interior se incluirá una cadena de ARN, que mediante la transcriptasa inversa, sintetizará el ADN viral. Algunas de estas partículas se exportarán al exterior y otras volverán al núcleo del hepatocito para dar lugar de nuevo a cccDNA, constituyendo un reservorio del virus. En ocasiones, se produce la integración del genoma del virus en el cromosoma del hepatocito, lo que puede favorecer el desarrollo de hepatocarcinoma (HCC). Modificado de Ganem. D and Prince AM. Hepatitis B virus infection-Natural history and clinical consequences. N Eng J Med. 2004; 350; 1118-29.
El genoma del virus codifica varias proteínas: HBsAg (región preS-S), HBcAg y HBeAg (región preC-C) y la polimerasa viral (región P) y proteína X. Pueden aparecer distintas mutaciones que cambian la evolución de la enfermedad y la respuesta al tratamiento. Las mutaciones en la región precore impiden la secreción del HBeAg, estas variantes coexisten con las cepas que expresan HBeAg. En el proceso de seroconversión, las cepas mutantes escapan del control inmunológico, haciendo progresar el daño hepático y dando lugar a las hepatitis crónicas HBeAg negativas. También existen mutaciones en el gen S, que producen una alteración en el HBsAg, produciendo una respuesta inmune deficiente, y mutaciones en el gen de la polimerasa, que produce alteración en la respuesta a los fármacos(13).
El VHB no es directamente citopático, la necroinflamación se produce secundaria a la respuesta inmune que genera el huésped.
Epidemiología
La infección por el VHB tiene una distribución universal. Según datos de la Organización Mundial de la Salud (OMS), se estima que alrededor de 257 millones de personas en todo el mundo son portadores. Son zonas de alta prevalencia (5-10%): China, el Sureste asiático, África y algunos países del Este de Europa. España se encuentra entre los países de baja prevalencia (1-2%).
En las zonas endémicas, la principal vía de transmisión es vertical, durante el periodo perinatal (intraútero, canal del parto o tras el nacimiento), y en la primera infancia. Las madres HBeAg+ tienen una alta capacidad contagiosa y en ausencia de medidas profilácticas, hasta un 70-90% de los hijos de madres HBeAg+ se infectarán y un 10-40% de los hijos de madres HBeAg-(14). El riesgo de cronificación es de un 95% en el período neonatal, pero suele cursar de forma asintomática, debido a una situación de inmunotolerancia: el paso transplancentario del HBeAg materno induce una ausencia de respuesta específica de los linfocitos T a los antígenos HBeAg y HBcAg del virus, esto condiciona una falta de reconocimiento del HBcAg expresado en los hepatocitos infectados en el periodo postnatal. Si la madre es HBeAg-, el riesgo de contagio es menor, pero si se produce, tienen mayor riesgo de desarrollar una hepatitis fulminante, debido a la mayor probabilidad de virus mutados(1).
También se puede producir la transmisión horizontal por contacto con otra persona infectada a través de pequeños cortes y erosiones en la piel (compartir utensilios familiares como peines y cepillos de dientes) y por exposición parenteral y sexual (pinchazos, tatuajes, piercing, exposición a sangre y líquidos corporales como: saliva, semen y flujo vaginal)(11).
Presentación clínica
Hepatitis aguda
Su periodo de incubación oscila de 1-6 meses. La mayoría de los niños con hepatitis aguda van a tener síntomas leves: cansancio, ictericia, náuseas y vómitos. Los niveles de ALT se elevan y se detecta HBsAg y ADN-VHB. En la fase de convalecencia y resolución de la enfermedad, se aclara el HBsAg y el HBV DNA desaparece. En los casos que el paciente presenta escasa sintomatología, tiene más probabilidad de progresión hacia la cronicidad. Existe riesgo de fallo hepático agudo (1%) debido a una repuesta inmune exagerada por el huésped.
Hepatitis crónica
Se define por la persistencia del HBsAg durante más de 6 meses. Hasta el 95% de los neonatos infectados siguen esta evolución. A mayor edad del individuo, el porcentaje disminuye; en niños, un 35% y, menos del 5%, en adolescentes y adultos(15).
Generalmente, los pacientes en esta fase suelen estar asintomáticos, en pocos casos se asocia fatiga y anorexia. Alrededor del 1-10% pueden presentar manifestaciones extrahepáticas(1): enfermedad del suero, artritis, vasculitis (principalmente, la panarteritis nodosa), afectación renal (glomerulonefritis membranosa) y acrodermatitis papular de la infancia (síndrome de Gianotti-Crosti), que consiste en un exantema maculo-papular eritematoso no pruriginosas que afecta cara y extremidades, desaparece en 15 días. Las complicaciones a largo plazo más temidas son: el desarrollo de cirrosis (1-5% de los niños HBeAg+) y hepatocarcinoma (<1%). Se consideran factores de riesgo para el desarrollo de cirrosis: seroconversión antiHBe antes de los 3 años de edad con importante actividad necroinflamatoria y una fase de inmunoeliminación prolongada(14).
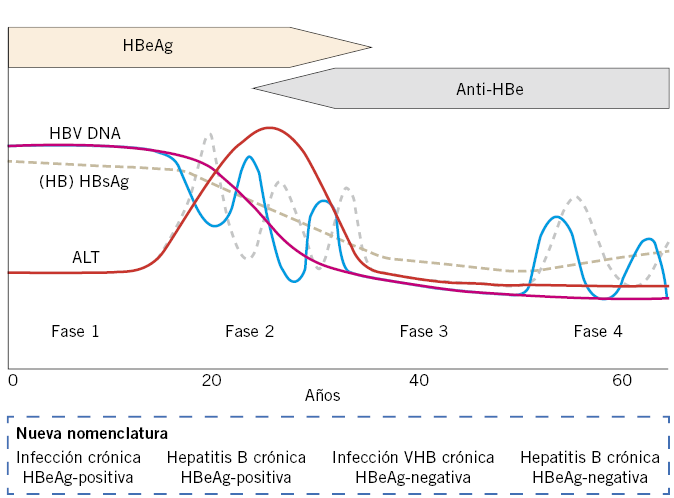
Historia natural de la enfermedad: la hepatitis B crónica es un proceso dinámico que se caracteriza por varias fases de distinta duración. La progresión de la enfermedad depende de la interacción entre el virus y el sistema inmune del huésped. En cursiva, aparece la nueva nomenclatura propuesta en las guías EASL (European Association for Study of the Liver) del 2017, basada en la cifra de ALT (infección o hepatitis) y en el estado HBeAg (positivo o negativo)(16) (Fig. 3):
Figura 3. Fases de la infección crónica VHB. Tomado de: EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection.
1. Fase de inmunotolerancia, fase de alta replicación (Infección crónica por VHB HBeAg positivo): puede durar décadas en los casos de transmisión perinatal, debido a que el paso transplacentario del HBeAg induce una tolerancia inmunológica en el RN. Se caracteriza por la presencia de HBeAg, HBsAg y carga viral elevada (DNA-VHB>10e5 cop/ml, equivale aproximadamente a > 20.000 UI/ml), con ALT normal o ligeramente elevada. Son altamente contagiosos.
2. Fase de inmunoeliminación o inmunoactividad (hepatitis crónica B HBeAg positivo): se caracteriza por el aclaramiento de HBeAg y seroconversión a anti-HBe. La media en Pediatría es aproximadamente de 2-5%/año(17), menor que en adultos (5-16%). Las cifras de ALT pueden elevarse previamente a la aparición de anti-HBe, reflejando la necroinflamación del parénquima hepático por la actividad inmunológica del huésped. Al final de esta fase, se produce un descenso de la carga viral con valores inferiores a 2.000 UI/ml, normalización de ALT y aparición de anti-HBe. Si esta fase se prolonga en el tiempo, se asocia con más riesgo de cirrosis y hepatocarcinoma (HCC). Algunos pacientes no consiguen controlar el virus en esta fase y progresan hacia una hepatitis B crónica HBeAg negativa. En otras ocasiones, se puede producir una resolución espontánea con aclaramiento del HBsAg.
3. Fase de baja replicación o portador inactivo (infección crónica por VHB HBeAg negativo): tiene HBeAg negativo con presencia de anti-HBe y baja o indetectable carga viral (< 2.000 UI/ml) de forma mantenida. La función hepática es normal o con mínimas alteraciones. Un pequeño porcentaje (1-3% anual) puede eliminar el HBsAg en esta fase.
4. Reactivación: algunos pacientes pueden progresar a una fase de actividad inmune con HBeAg- (hepatitis crónica B HBeAg negativo) (5%), debido al desarrollo de mutaciones en el virus (raro en niños) o volver al estado HBeAg+(17). Presentan elevación del DNA-VHB (DNA-VHB>10e5 cop/ml) y niveles altos de ALT. La reactivación puede ocurrir en cualquier momento, de forma espontánea o en situaciones de inmunosupresión.
5. Fase HBsAg-negativa o hepatitis B resuelta o hepatitis en remisión: se caracteriza por la pérdida del HBsAg+/- antiHBs+ y anti-HBc positivos, niveles de ALT normales y DNA VHB indetectable en suero, aunque se puede detectar el ccc-DNA (ADN circular cerrado covalentemente) en los hepatocitos (infección oculta) y, en situaciones de inmunosupresión, se puede activar la replicación.
Si el genoma viral se integra en el hepatocito, aumenta el riesgo de HCC, aunque el paciente haya aclarado el HBsAg.
Diagnóstico
Los primeros marcadores que se detectan en la fase aguda son HBsAg y HBeAg en suero, incluso antes del inicio de la sintomatología. Posteriormente, aparece los anticuerpos anti-HBc IgM. Si la infección se resuelve, el HBsAg desaparece y se detectan anticuerpos anti-HBs. Los Acs anti-HBc nunca aparecen como respuesta a la vacunación, indican siempre una infección natural (Tabla II).
Si evoluciona hacia la cronicidad, el HBsAg se mantiene positivo durante más de 6 meses y la carga viral es positiva. La determinación y cuantificación del DNA-VHB se realiza mediante técnicas de PCR. Se considera una replicación muy elevada cifras mayores de 10e5 copias/ml o 20.000 UI/ml. En los niños expuestos al virus, se debe realizar la determinación de HBsAg a la edad de 6-12 meses, para disminuir el riesgo de falsos positivos(14).
En la edad pediátrica, se aconseja la realización de biopsia hepática en la mayoría de los casos, antes de indicar el tratamiento, para evaluar el grado de inflamación o fibrosis. Las pruebas no invasivas, como la elastografía de transición, no están todavía validadas en niños y adolescentes con hepatitis B crónica.
Se deben realizar revisiones periódicas en todos los niños con hepatitis crónica. En los casos HBeAg+/HBeAg- con elevación de ALT, se debe realizar seguimiento cada 3 meses, monitorizando la cifra de ALT, serología y carga viral, para valorar evolutivamente la necesidad de tratamiento. Los niños HBeAg+ y ALT normal se pueden revisar cada 6 meses(18).
Tratamiento
Los nuevos análogos de nucleótidos con alta potencia antiviral y alta barrera genética (tenofovir/entecavir) son los fármacos de elección para los casos seleccionados que precisen tratamiento en la infancia.
Con el tratamiento, se intenta reducir el riesgo de fibrosis, cirrosis y HCC. El objetivo es alcanzar la seroconversión anti-HBe mantenida, con supresión de la carga viral y disminución de la inflamación hepática. En ocasiones, se consigue seroconversión antiHBs (<1% en adultos y 1-6% en niños); pero por desgracia, con los fármacos disponibles en la actualidad, la infección por el VHB no llega a ser erradicada, al no poder eliminar el cccDNA del núcleo de los hepatocitos.
Se deben estudiar varios factores antes de iniciar tratamiento en un niño: edad, cifra ALT, carga viral, lesión histológica, otras enfermedades asociadas y la historia familiar de hepatocarcinoma (HCC)(18).
Los pacientes candidatos a recibir tratamiento son los pacientes con hepatitis crónica HBsAg+ con elevación de la cifra de transaminasas (ALT>60 UI/L) y alta carga viral (DNA-VHB>10e5 cop/ml), mantenida durante varios meses (6-12 meses)(17).
Se aconseja realización de biopsia hepática previa al inicio del tratamiento(18). Una mayor inflamación periportal y portal se correlacionan con mayor probabilidad de seroconversión.
Indicaciones de tratamiento(14)
• Pacientes que muestren un proceso de inmunoeliminación prolongado con datos de inflamación, ya que tienen mayor riesgo de evolución a cirrosis.
• Pacientes por infección perinatal que presentan una seroconversión rápida, antes de los 5 años de edad, debido a que se asocia a un mayor riesgo de cirrosis.
• Pacientes con coinfección con VHD, VHC y HIV, por el riesgo elevado de una rápida progresión.
• Hepatitis fulminante o aguda grave con insuficiencia hepática.
• Todos los niños con antecedentes familiares de HCC deben ser tratados de forma indefinida.
• En casos de cirrosis descompensada o cirrosis compensada, si presenta alteración de la cifra de ALT y/o DNA-VHB>2.000 UI/ml.
• En el caso de hepatitis crónica HBeAg negativa que presenten disfunción hepática y elevada carga viral.
• Todos los niños que reciben inmunosupresores (corticoides, rituximab, anticuerpos monoclonales…) o quimioterapia: si tienen hepatitis B crónica (HBsAg+) deben recibir entecavir o tenofovir. En el caso de individuos HBsA- y antiHBc+, que pueden sufrir una reactivación por la persistencia de pequeñas cantidades de DNA viral en el hepatocito, se puede administrar tratamiento antiviral o seguimiento estrecho e iniciar tratamiento si se detecta DNA-VHB.
• Receptores de trasplante hepático por hepatitis B, precisan administración de gammaglobulina específica anti-HBs y antiviral (tenofovir-entecavir) para prevenir la reinfección del injerto y también deben recibir tratamiento los pacientes que reciben injertos de donantes anti-HBc positivos.
• En los niños en fase de inmunotolerancia (HBeAg+ y ALT normal) sin otra patología añadida, no se recomienda tratar, porque la probabilidad de respuesta es muy baja y requerirían muchos años de tratamiento (décadas)(14).
• Los fármacos disponibles en la actualidad son el interferón α y los análogos de los nucleótidos (Tabla III). La respuesta al tratamiento se define por niveles de DNA indetectables y pérdida del HBeAg o normalización de ALT o ambos. Los factores que favorecen una buena respuesta son: actividad inflamatoria alta en la biopsia, concentraciones elevadas de ALT y niveles bajos de DNA-VHB(14,17).
• El interferón α y su fórmula pegilada: tiene un efecto inmunomodulador. El tratamiento tiene una duración finita (24-48 semanas), pero asocia numerosos efectos adversos: fiebre, fatiga, neutropenia, pérdida de peso, retraso de crecimiento, tiroiditis autoinmune y depresión. Está contraindicado en caso de enfermedad hepática descompensada y en menores de 1-2 años de edad. No genera resistencias. Su eficacia (seroconversión antiHBe) es de un 30% en los 12 meses siguientes y consigue un aclaramiento de HBsAg en un 3-10%, mayor que con los análogos(15).
• Análogos de nucleótidos orales: actúan inhibiendo la síntesis del ADN-VHB, pero no actúan a nivel del DNAccc, con lo cual no logran eliminar el virus de los hepatocitos infectados. Tienen la ventaja de la administración oral con menos efectos adversos. El tratamiento no tiene una duración definida, se recomienda continuarlo un mínimo de 12 meses después de conseguir la seroconversión (HBAge – y antiHBe +) y carga viral indetectable.
Los nuevos análogos (tenofovir/entecavir) tienen una alta potencia antiviral y una alta barrera genética (número de mutaciones necesarias para el desarrollo de resistencias farmacológicas), con un riesgo de desarrollo de resistencias mínimo; por lo que son los fármacos indicados en la mayoría de los casos(17).
Entre los inconvenientes están: tiempos prolongados de tratamiento, la posible aparición de resistencias, un necesario buen cumplimiento y la posibilidad de reactivación de la enfermedad al interrumpir el tratamiento con posibilidad de una hepatitis grave(15).
• Se están investigando nuevos tratamientos combinados con fármacos que actúen en distintas fases del ciclo del VHB (inhibiendo la entrada del virus, destruyendo el cccDNA, impidiendo el ensamblaje de la cápside…), junto con fármacos que modulen la respuesta inmune del huésped(14).
Prevención
La vacuna de la hepatitis B ha demostrado una gran eficacia al disminuir la prevalencia de la infección y la incidencia de hepatocarcioma en adolescentes y adultos.
La vacuna actual es una vacuna inactivada, desarrollada por ingeniería genética. Induce una respuesta seroprotectora (antiHBs>10 mIU/ml) en el 95% de los vacunados con 3 dosis. Los pacientes hemodializados y otros inmunodeprimidos pueden presentar menores tasas de seroconversión, por lo que, a veces, es necesario aumentar la dosis de antígeno o aplicar mayor número de dosis.
Las formas comercializadas en España son monocomponentes y combinadas(19)(DTPa+Hib+VPI+HB y HA+HB) (Tabla I).
La vacunación de los lactantes requiere de, al menos, 3 dosis. El intervalo mínimo recomendado entre la 1ª y la 2ª dosis es de 4 semanas, y entre la 3ª de 8 semanas y no antes de la semana 24 de edad. Estudios demuestran que retrasar la administración de la dosis final a los 11-12 meses, se asocia con mayor inmunogenicidad.
El comité Asesor de vacunación de la AEP recomienda respecto a la vacuna antihepatitis B en el calendario de vacunaciones del 2019:
“Tres dosis, en forma de vacuna hexavalente, a los 2, 4 y 11 meses de edad. Los hijos de madres HBsAg positivas recibirán, además, al nacimiento, una dosis de vacuna HB monocomponente, junto con 0,5 ml de inmunoglobulina antihepatitis B (IGHB), todo dentro de las primeras 12 horas de vida. Los hijos de madres con serología desconocida deben recibir la dosis neonatal y se determinará inmediatamente la serología materna; si esta fuera positiva, deberán recibir IGHB cuanto antes, dentro de la primera semana de vida. La administración de 4 dosis de vacuna HB es aceptable en general y preceptiva en hijos de madres HBsAg positivas con peso al nacer menor de 2000 g vacunados de recién nacidos, pues la dosis neonatal en estos casos no se ha de contabilizar. A los niños y adolescentes no vacunados se les administrarán, a cualquier edad, 3 dosis de vacuna monocomponente o combinada con hepatitis A, según la pauta 0, 1 y 6 meses.”
Los niveles de anti-HBs disminuyen con el tiempo, pero persiste la memoria inmunológica y no está clara la indicación de una dosis de recuerdo en individuos inmunocompetentes. Solo se recomienda control serológico posvacunal en grupos de riesgo: hijos de madre HBsAg+ a los 1-2 meses después de administrar la dosis final de la vacuna, infección por HIV y otros inmunocomprometidos, hemodializados y en pacientes celiacos.
A pesar del empleo de la vacuna y IGHB se puede producir una transmisión vertical en el 2-10% si la madre es HBeAg+. Este fallo de la profilaxis se ha relacionado con: alta carga viral materna, genotipo C (puede transmitirse intraútero), hiporrespuesta inmune y fallo en las pautas de vacunación(14). En la actualidad, se recomienda administrar tratamiento con análogos de nucleótidos (tenofovir) en el último trimestre de embarazo a las madres con alta carga viral (>10e8 copias/ml). No se contraindica la lactancia materna, si se ha realizado una adecuada profilaxis (vacuna + IGHB), aun cuando la madre reciba tratamiento antiviral(20).
En el caso de una exposición accidental (sexual, pinchazo accidental, salpicadura cutaneomucosa) en personas no vacunadas, con vacunación incompleta o con niveles de anti-HBs< 10 mU/ml, se debe administrar IGHB (obtenida de suero de individuos sanos con altos títulos de anti-HBs) junto con una dosis de vacuna; posteriormente, debe recibir una segunda dosis de vacuna al mes.
Hepatitis D
El virus de la hepatitis D o virus delta es un virus defectuoso que precisa del VHB para la producción de las proteínas de su envoltura. Es un virus con una única cadena circular de RNA y con una envoltura constituida por la proteína HBsAg.
Epidemiología
La vía de transmisión es parenteral, puede ocurrir conjuntamente con la hepatitis B (coinfección) o después (sobreinfección). La transmisión perinatal es rara y se puede prevenir con la vacuna del VHB.
Clínica
En el caso de la coinfección, el VHD tiende a empeorar el curso agudo de la hepatitis B. El riesgo de cronicidad es similar al de la hepatitis B. En la sobreinfección se caracteriza por una forma más grave de hepatitis B crónica, con rápida evolución a cirrosis en pocos años y un riesgo incrementado de HCC.
Diagnóstico
Se diagnostica por la determinación de anti-VHD IgG. La cuantificación de RNA viral es la mejor determinación para conocer la actividad del virus.
Tratamiento
Los tratamientos de la hepatitis B que eliminen el HBsAg conducirían a la resolución de la hepatitis D asociada. En el caso de la hepatitis D crónica, el único tratamiento aprobado es el INF-α o el
PEG-INF-α.
Prevención
Consiste en la prevención de la hepatitis B.
Hepatitis C
Introducción y epidemiología
El virus C es un pequeño virus RNA monocatenario de la familia flaviviridae. Su estructura la forman proteínas estructurales (nucleocápside y proteínas de envoltura) y otras 7 proteínas no estructurales (NS1, NS2, NS3, NS4A, NS4B, NS5A y NS5B); todas ellas participan en el proceso de replicación y le confieren una gran variabilidad y potencial capacidad de mutación.
Existen 6 genotipos y varios subtipos con diferentes localizaciones geográficas y respuesta al tratamiento. El más común es el genotipo 1 y también es el más frecuente en España.
No existen datos exactos de la población infectada por el virus C en todo el mundo y menos si nos referimos a población infantil, pero la OMS estima en el año 2019, que hay 71 millones de personas con infección crónica por el virus C; de ellas, cada año mueren 399.000 por cirrosis y HCC. A pesar de que desde 2011 se dispone de antivirales muy eficaces en su curación >95%, no todos los pacientes pueden acceder al diagnóstico y tratamiento.
En adultos, la vía fundamental de transmisión es parenteral: sangre y hemoderivados, drogadictos por vía intravenosa, tatuajes y menos frecuente por vía sexual. En niños, la vía fundamental de trasmisión es vertical (madre-hijo). Existen revisiones recientes de la tasa de transmisión por esta vía.
En 2018, en niños checos de 244 madres con infección VHC, hubo 11 niños con transmisión (4,6%) y, de estos, 2 eliminaban el virus. De los niños, que adquieren la infección por vía vertical, aproximadamente el 20% la curan de forma espontánea en los primeros 3-4 años de vida y persisten los anticuerpos durante toda la vida. Excepcionalmente, la curación puede ser más tardía hasta los 6-7 años(21).
Cuando no se produce infección en el niño, solo se detectan anticuerpos IgG (anti-VHC) que se transmiten de la madre y son eliminados hasta desaparecer, generalmente antes de los 2 años(15) (Algoritmo 2).
En los niños cuya madre tiene hepatitis C, se recomendaba realizar un control al 3º y 18º mes para comprobar si existe infección o solo transmisión de anticuerpos que van a ser eliminados. Actualmente, se recomienda esperar a los 18 meses para excluir la posible transmisión de anticuerpos maternos que a esa edad ya estarán eliminados(27).
La mayor tasa de transmisión se relaciona con la coexistencia en la madre de infección por HIV(22), en estos casos puede llegar al 25%. No está autorizado el tratamiento con antivirales de acción directa en el embarazo, para intentar disminuir la viremia. No existe diferencia en la transmisión según el tipo de parto (no está indicada la cesárea programada) ni la prohibición de lactancia materna, salvo grietas importantes en la madre(23). La presencia de un hijo infectado no indica que en los siguientes ocurra también. En algunas publicaciones, se relaciona la tasa de transmisión con la viremia materna elevada y también con maniobras instrumentales durante el parto (rotura bolsa> de 6 horas y monitorización fetal invasiva)(23).
Clínica
La hepatitis C generalmente es asintomática y no presenta manifestaciones extrahepáticas. Elevación de transaminasas es el hallazgo más frecuente. La mayoría se cronifican (70-80%).
La hepatitis por VHC en niños, generalmente, es asintomática y solo presenta elevación de transaminasas en una analítica rutinaria o realizada por factores de riesgo. Puede presentar hepatomegalia leve. Las manifestaciones extrahepáticas más frecuentes en adultos, son raras en pacientes pediátricos. Entre el 5-10% pueden presentar alteraciones tiroideas, autoinmunidad positiva, crioglobulinemia… La hepatitis por virus C se cronifica en casi el 80% de los casos y esto significa, en adultos, persistencia de RNA-VHC en sangre más de 6 meses. En niños con VHC vertical, es necesario esperar más tiempo (al menos, 3-4 años) para hablar de cronicidad. Puede haber eliminación espontánea hasta esa edad e incluso, excepcionalmente, más tardía.
El VHC no es citopático directo y la inflamación en el hígado es debida a la respuesta inmunológica frente al virus y, generalmente, las lesiones severas tardan años en desarrollarse.
Diagnóstico
El diagnóstico se hará por detección de anticuerpos anti-VHC y con PCR-VHC positiva.
Para comprobar el grado de fibrosis del hígado se dispone de técnicas no invasivas, como la elastografía de transición (ET) o Fibroscan. La velocidad de propagación de la onda elástica es proporcional a la rigidez. Se mide en Kilopascal (kPa) y se describen cuatro grados: F0-F1, no fibrosis (menos de 7kPa); F2, fibrosis leve (kPa entre 7-9,4); F3, fibrosis moderada (9,4-12 kPa); y F4, que indica fibrosis severa/cirrosis (más de 12 kPa). Aunque la experiencia en niños es aún limitada, parece existir (al igual que en adultos) una buena correspondencia con los resultados obtenidos por biopsia hepática (escala METAVIR), evitando las posibles complicaciones de esta. Solamente en algunos casos de esteatosis importante o ascitis puede ser menos fiable(25).
La detección de anticuerpos (anti-VHC) nos indica que ha habido contacto con el virus, pero para demostrar infección actual es necesario detectar PCR-VHC en sangre. Los anticuerpos pueden ser negativos, aunque haya infección activa, en pacientes inmunocomprometidos y, por ello, en estos pacientes es imprescindible la determinación de PCR del virus.
Es posible estudiar el genotipo y cuantificar la viremia (importante para diseñar la pauta de tratamiento y pronóstico de respuesta).
Tratamiento
La aparición de los antivirales de acción directa (AAD) en 2011, ha cambiado de forma significativa el pronóstico de la hepatitis crónica VHC en adultos y niños mayores de 12 años, con tasas de curación muy altas.
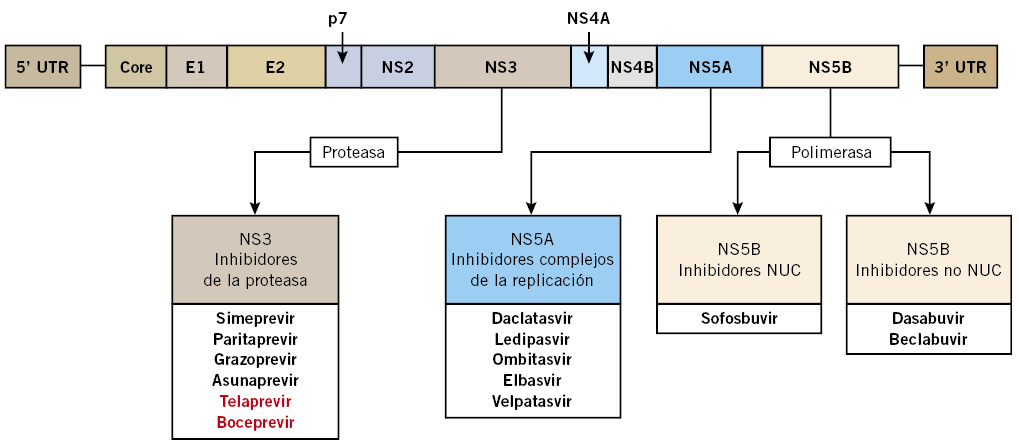
La respuesta al tratamiento de la hepatitis crónica por VHC en adultos, ha sufrido una mejoría muy significativa desde el año 2011, en que se aprueba el tratamiento con los antivirales de acción directa (AAD). Estos fármacos se dirigen frente a diferentes partes del virus C, impidiendo su replicación. Los primeros son inhibidores de las proteasas NS3/NS4A (Boceprevir, Telaprevir…). En 2014 y 2015, se incluyen inhibidores de la polimerasa NS5B (Sofosvubir, Dasabuvir) y, posteriormente, frente a proteínas del core y polimerasa NS5A (Ledipasvir, Daclatasvir…). En los últimos años, en que se dispone de estos nuevos antivirales, ha disminuido el uso de los primeros por su menor eficacia terapéutica y más efectos adversos, sobre todo, en pacientes cirróticos. Los esquemas de tratamiento varían en función del genotipo viral y la presencia o ausencia de cirrosis, asociando 2 o 3 AAD, con o sin ribavirina (RBV) y/o PegIFN. También puede variar la duración de 8, 12, 16 o 24 semanas. Algunos AAD son pangenómicos y se pueden utilizar en cualquier genotipo (Fig. 4).
Figura 4. Esquema VHC y acción de los antivirales de acción directa (AAD).
Globalmente, la proporción de pacientes que alcanza Respuesta Viral Sostenida (RVS) se encuentra en torno al 80-95%. Se considera RVS la desaparición de viremia tras finalizar el tratamiento: 12 semanas después (RVS12). Esta respuesta puede estar influenciada por distintos factores, como: genotipo viral, presencia de cirrosis, co-infección por otros virus, como el de la inmunodeficiencia humana (VIH) o el virus de hepatitis B, y factores tóxicos (alcohol) y esteatosis (obesidad)(26) (Tabla IV).
El gen IL28B está implicado en la respuesta a tratamiento frente a determinados virus y, entre ellos, al VHC. Un único polimorfismo de un nucleótido en el gen de la IL-28B puede influir, tanto en la eliminación espontánea del virus como en su respuesta al tratamiento. Existen tres subtipos del IL28B: CC, CT y TT. Las personas con el genotipo CC presentan una respuesta inmunitaria más potente frente a la infección por VHC que las que tienen los genotipos CT o TT.
Desde 2017, los tratamientos con AAD están autorizados en niños mayores de 12 años y peso mayor de 35 kg.
La terapia AAD se recomienda para todos los adolescentes de 12 a 17 años con infección crónica por el virus de la hepatitis C, independientemente del historial de tratamiento y la gravedad de la enfermedad. Tanto la EMA (Agencia Europea del Medicamento) como la FDA Americana, autorizan el uso de Sofosbuvir-Ledispavir o Sofosbuvir-Rivabirina en este grupo y, desde abril de 2019, la asociación de Glecaprevir y Pibrentasvir (última). No está autorizado el uso de AAD pangenómicos.
Controles durante el tratamiento:
• Basal: exploración, analítica hepática y renal, hemograma y serología VHB, RNA-VHC cuantitativo y genotipo.
• Semana 2-4: cuantitativo viremia (VHC-RNA), para comprobar adherencia.
• Cada 4 semanas: repetir exploración y análisis (para ver efectos adversos).
• Fin de tratamiento y 12 semanas post-tratamiento: RNA-VHC (eficacia).
En niños menores, solo está autorizado el tratamiento que incluya Interferón pegilado, con o sin Ribavirina, y esto supone más efectos adversos y menor eficacia terapéutica.
Se espera que en un futuro próximo se autorice el tratamiento con AAD en niños mayores de 3 años, con pautas más cortas. En este sentido, se ha realizado un estudio multicéntrico (Australia, Nueva Zelanda, UK y EE.UU.), entre agosto de 2015 y febrero de 2018, en 92 pacientes de entre 6 y 12 años (rango 6-11). Los pacientes presentan, mayoritariamente, genotipo 1 (87 niños). Se incluyen pacientes que han sido tratados previamente con interferón y pacientes sin tratamiento previo. La pauta asocia Sofosbuvir-Ledipasvir a dosis fija (200/45 mg) con o sin rivabirina (15 mg/d) (solo se asocia en 2 pacientes con genotipo 3). La duración oscila entre 12 y 24 semanas.
Se obtiene respuesta viral sostenida RVS 12 (negatividad de viremia a las 12 semanas de finalizar el tratamiento) del 99%. Estos resultados son similares a los obtenidos en adultos y adolescentes.
En cuanto a efectos secundarios, se observa buena tolerancia (18% cefalea, 17% fiebre y 15% con fatiga, dolor abdominal de intensidad leve-moderada). Ningún enfermo suspendió tratamiento por estos efectos(26).
Dados estos resultados tan favorables, la mayoría de Sociedades Científicas recomiendan esperar esta aprobación o que el paciente llegue a la edad en que esté autorizado su uso y evitar el tratamiento con interferón(27,28).
Si los AAD se aprueban para cohortes de edades más jóvenes, todos los niños mayores de 3 años infectados con hepatitis C se beneficiarán de la terapia antiviral(27)sea cual sea su afectación o velocidad de progresión.
Los pacientes diagnosticados de hepatitis VHC deben ser estudiados para otros virus, como VHA y VHB, recibiendo vacunación frente a ellos si su serología es negativa. También deben ser asesorados para minimizar riesgos potenciales (alcohol, sobrepeso…).
Otros virus
Muchos de los virus que causan infecciones frecuentemente en Pediatría pueden producir alteraciones hepáticas; la mayoría son cuadros leves de hepatitis, pero en ocasiones, pueden derivar en un fallo hepático agudo. Entre los virus más importantes se encuentran:
1. Familia de los herpesvirus:
- Virus herpes simplex (VHS) tipo I y II, que pueden producir una infección diseminada asociada a fallo hepático en el periodo neonatal y en inmunodeprimidos.
- Virus varicela-zóster.
- Citomegalovirus: durante la primoinfección (cuadro de mononucleosis), en el periodo neonatal, asociando un cuadro de colestasis severa con acolia (CMV congénito), y en pacientes inmunodeprimidos (receptores de trasplantes).
- Herpes virus humano tipo 6, 7 y 8.
- Virus Epstein-Barr (VEB): durante la primoinfección produce un cuadro de mononucleosis, y en los pacientes inmunodeprimidos se asocia a un síndrome linfoproliferativo.
2. Otros virus: parvovirus B19, adenovirus, enterovirus (polio, coxsackie A y B…), parechovirus, rubeola, sarampión, etc.
En casos de infecciones graves o en pacientes inmunodeprimidos, está indicado el tratamiento antiviral con: aciclovir (VHS 1 y 2; en el caso del VEB, actúa a nivel de la replicación del virus, pero no en su forma latente), ganciclovir (100 veces más activo que el aciclovir frente a la replicación del CMV) y valganciclovir (presentación oral del ganciclovir), foscarnet (en caso de infecciones por CMV resistentes al ganciclovir) o cidofovir (infecciones resistentes a ganciclovir o foscarnet e infecciones invasivas por adenovirus)(1).
En el diagnóstico diferencial, deben tenerse en cuenta otros cuadros clínicos, sobre todo, cuando los estudios microbiológicos son negativos. Así, hay que descartar los siguientes procesos según la edad y la historia clínica del paciente: hepatitis tóxicas, hepatitis autoinmune y enfermedad de Wilson, entre otros(11).
Recomendaciones para pediatras
1. Aunque la hepatitis A no evoluciona a la cronicidad, debe ser estrechamente vigilada durante la fase inicial por la posibilidad de complicarse, excepcional en nuestro medio, con un fallo hepático agudo. Debe recomendarse vacunación a contactos familiares y escolares expuestos.
2. La hepatitis B ha disminuido mucho su incidencia en nuestro país, por la implantación de vacunación generalizada. Debe investigarse en niños adoptados de países con altas tasas (China, Rusia…).
3. La hepatitis E en nuestro medio es infrecuente y se contrae por consumo de carne contaminada (cerdo, caza…). En fase aguda, los síntomas son similares a la hepatitis A.
4. En hijos de madre con hepatitis C, debe pedirse un control de Anti-C a los 18 meses. Si es positivo, debe remitirse para realización de viremia. En la hepatitis crónica por VHC, está autorizado el tratamiento (altamente eficaz) con AAD en niños mayores de 12 años (o 35 kg). Se están desarrollando estudios para su autorización en niños menores de esta edad (6-11 años). No deben utilizarse en los primeros 4 años de vida, por la posibilidad de curación espontanea.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio del autor.
1.*** Abdel-Hady M, Tong W. Viral hepatitis. En: Deirdre A. Kelly ed. Diseases of the liver and biliary system in children. Ed Deirdre A. Kelly John Wiley& sons Ltd; 2017. p. 191-210.
2. Codoñer Franch P, Simó Jorda R. Hepatitis virales agudas. En: Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica. 4ª ed. Ergon; 2016. p. 401-14.
3. Quirós-Tejeira R. Overview of hepatitis A virus infection in children. www.uptodate.com. Literature review current through 2019.
4.*** Comité Asesor de Vacunas (CAV-AEP). Hepatitis A. Manual de vacunas en línea de la AEP [Internet]. Madrid: AEP 2019. [consultado el 1 de octubre de 2019]. Disponible en: http://vacunasaep.org/documentos/manual/cap-28.
5. Barnaud E, Rogee S, Garry P. Termal inactivaction of infectious hepatitis E virus in experimentally contaminated food. Appl Environ Microbiol. 2012; 78: 5153-9.
6.** Fischler B, Baumann U, Dezsofi A, Hadzic N, Hierro L, Jahnel J, et al. Hepatitis E in children: A position Paper by the ESPGHAN Hepatology Committee. JPGN. 2016; 63: 288-94.
7. Buti M, Plans P, Domínguez A, Jardi R, Rodríguez F, Esteban R, et al: Prevalence of hepatitis E Virus Infection in children in the northeast of Spain. Clin Vaccine Immunol. 2008; 16: 732-4.
8. Kamar N, Izopet J, Tripon S. Ribavirin for chronic hepatitis E virus infection in transplant recipients. N Eng J Med. 2014; 370: 1111-20.
9. Gerolami R, Boretain P, Raissouni F. Treatment of severe acute hepatitis E by ribavirin. J Clin Virol. 2011; 52, 60-2.
10. Zhang J, Zhang XF, Huang SJ. Long -term efficacy and safety of a hepatitis E vaccine. N Engl J Med. 2015; 372: 914-22.
11. Marugán de Miguelsanz JM, Torres Hinojal MC. Hepatitis agudas. Pediatr Integral. 2015; XIX: 198-204.
12.** Ganem. D and Prince AM. Hepatitis B virus infection-Natural history and clinical consequences. N Eng J Med. 2004; 350; 1118-29.
13. Cortés L, Domínguez M, Simón MA. En: Problemas Comunes en la Práctica Clínica – Gastroenterología y Hepatología, 2ª ed. Jarpyo. 2012; 53: 769-86.
14.** Indolfi G, Easterbrook P, Dusheiko G, Siberry G, Chang M, Thorme C, et al. Hepatitis B virus in children and adolescents. Lancet Gastroenterol Hepatol. 2019; 4: 466-764.
15.*** Camarena C. Hepatitis crónicas. Pediatr Integral. 2015; XIX(3): 205-13.
16. European Association for Study of the Liver. EASL 2017 Clinical Practice guidelines on the management of hepatitis B virus infection. J Hepatol. 2017; 67: 370-98.
17.** Hierro Lanillo L, Lledín Barbancho MD. Hepatitis crónica por el virus de la hepatitis B. En: Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica. 4ª ed. Ergon; 2016. p. 415-26.
18.*** Sokal EM, Paganelli M, Wirth S, Socha P, Vajro P, Lacaille F, et al. Management of chronic hepatitis B in childhood: ESPGHAN clinical practice guidelines. Consensus of an expert panel on behalf of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J Hepatol. 2013; 59: 814-29.
19.*** Comité Asesor de Vacunas (CAV-AEP). Hepatitis B. Manual de vacunas en línea de la AEP [Internet]. Madrid: AEP 2019. [consultado el 1 de octubre de 2019]. Disponible en: http://vacunasaep.org/documentos/manual/cap-29.
20. Cryer AM, Imperial JC. Hepatitis B in pregnant women and their infants. Clin Liver Dis. 2019; 23: 451-62.
21. Rožnovsk L, Kabieszová L, Mrázek J, Kloudová A, Petroušová L, Orságová I, et al. Vertical hepatitis C transmission. Klin Mikrobiol Infekc Lek. 2018; 24: 105-10.
22. Fauteux-Daniel S, Larouche A, Calderon V, Boulais J, Béland C, Ransy DG, et al. Vertical Transmission of Hepatitis C Virus: Variable Transmission Bottleneck and Evidence of Midgestation In Utero. J Virol. 2017; 91: 1372-17.
23. Indolfi G, Resti M. Perinatal transmission of hepatitis C virus infection. J Med Virol. 2009; 81: 836-43.
24. European Paediatric Hepatitis C Virus Network. A significant sex-but not elective cesarean section-effect on mother-to-child transmission of hepatitis C virus infection. J Infect Dis. 2005; 192: 1872-9.
25. De Lédinghen V, Le Bail B, Rebouissoux L, Fournier C, Foucher J, Miette V, et al. Liver stifness measurement in children using fibroscan: Feasibility study and comparison with fibrotest, aspartate transaminase to platelets ratio index, and liver biopsy. J Pediatr Gastroenterol Nutr. 2007; 45: 443-50.
26. Murray K, Balistreri WF, Banjal S, Whitworth S, Evans H, González-Peralta RP, et al. Safety and Efficacy of Ledipasvir-Sofosbuvir with or without Ribavirin for Chronic Hepatitis C in Children Ages 6-11. Hepatol. 2018. 68: 2158-66.
27. Indolfi G, Hierro L, Dezsofi A, Jhhnel J, Debray D, Hadzic N, et al. Treatment of Chonic Hepatitis C virus infection in children: A position Paper by the Hepatology Committee of European Society of Pediatric Gastroenterology, Hepatology and Nutricion. JPGN. 2018; 66: 505-15.
28. Indolfi G, Serranti D, Resti M. Direct-acting antivirals for children and adolescents with chronic hepatitis C. 2018. Lancet Child Adolesc Health. 2018. Publicado online el 23 de febrero de 2018. http://dx.doi.org/10.1016/S2352-4642(18)30037-3.
29. Indolfi G, Easterbrook P, Duseiko G, El-Sayed MH, Jonas MM, Thorne C, et al. Viral hepatitis in children and adolescents. Hepatitis C virus infection in children and adolescents. Lancet. 2019; 4: 477-87.
Bibliografía recomendada
- Comité Asesor de Vacunas (CAV-AEP). Hepatitis A. Manual de vacunas en línea de la AEP [Internet]. Madrid: AEP 2019. [consultado el 1 de octubre de 2019]. Disponible en: http://vacunasaep.org/documentos/manual/cap-28.
Comité asesor de vacunas (CAV-AEP). Publicación online, con actualizaciones continuas de las vacunas frente al VHB y VHC. Recoge situaciones habituales en la práctica clínica diaria.
- Fischler B, Baumann U, Dezsofi A, Hadzic N, Hierro L, Jahnel J, et al. Hepatitis E in children: A position Paper by the ESPGHAN Hepatology Committee. JPGN. 2016; 63: 288-94.
Revisión actualizada por el Comité de Expertos de la ESPGHAN de la hepatitis E en niños. Publicaciones en niños y adultos, y recomendaciones que de ahí se derivan en cuanto a diagnóstico, tratamiento y medidas de prevención de la hepatitis por VHE en población pediátrica.
- Indolfi G, Easterbrook P, Dusheiko G, Siberry G, Chang M, Thorme C, et al. Hepatitis B virus in children and adolescents. Lancet Gastroenterol Hepatol. 2019; 4: 466-764.
Revisión y puesta al día de la infección por el virus B, comparando la evolución y el tratamiento entre los adultos y niños.
- Hierro Lanillo L, Lledín Barbancho MD. Hepatitis crónica por el virus de la hepatitis B. En: Tratamiento en Gastroenterología, Hepatología y Nutrición Pediátrica. 4ª ed. Ergon; 2016. p. 415-26.
Guía práctica de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica para el seguimiento y tratamiento de los pacientes con hepatitis B crónica.
- Sokal EM, Paganelli M, Wirth S, Socha P, Vajro P, Lacaille F, et al. Management of chronic hepatitis B in childhood: ESPGHAN clinical practice guidelines. Consensus of an expert panel on behalf of the European Society of Pediatric Gastroenterology, Hepatology and Nutrition. J Hepatol. 2013; 59: 814-29.
Guías europeas de ESPGHAN, elaboradas por expertos que recogen toda la información detallada de la epidemiología, evolución y tratamiento en la infancia de la hepatitis B.
- Indolfi G, Easterbrook P, Duseiko G, El-Sayed MH, Jonas MM, Thorne C, et al. Viral hepatitis in children and adolescents. Hepatitis C virus infection in children and adolescents. Lancet. 2019; 4: 477-87.
Revisión actual del tratamiento de la hepatitis crónica por VHC con antivirales de acción directa (AAD) en niños desde los 3 años. Opinión de las Sociedades Científicas de mayor prestigio (Europeas y Americanas) sobre indicaciones, pautas, seguridad y efectividad.
| Caso clínico |
|
Acude a Urgencias de un Hospital de Badajoz, una niña de 10 años de padres de origen magrebí, nacida en España, que nunca ha viajado al extranjero. Sin antecedentes de interés, calendario vacunal correcto. No conviven con animales. No ingesta de tóxicos ni productos de herbolario. Presenta cuadro de náuseas y vómitos desde hace 5 días con dolor abdominal y fiebre máxima de 38ºC. Los padres han notado que desde hace unos 2 días está más cansada y que la orina es más oscura. Ha recibido paracetamol 300 mg una o dos veces al día. Refiere que su madre ha vuelto de viaje de Marruecos hace 2 semanas y allí tuvo un cuadro de gastroenteritis, pero que en la actualidad se encuentra bien. Exploración: peso: 30 kg. Buen estado general, aunque un poco decaída, mucosas pastosas, leve ictericia conjuntival, no datos de hepatopatía crónica. ACP: normal. Abdomen: hepatomegalia a 2 traveses ligeramente dolorosa, sin esplenomegalia. Sin ascitis, ni circulación colateral. Neurológico: normal. Se realiza analítica y ecografía abdominal con estos resultados: Analítica: hemograma: Hb 11,1 g/dl; Hto: 34,3%; leucos: 4.750 (N: 12,7%, L: 69,5%, M: 5,4%, Eo: 0,7%, baso: 0,9%). Plaquetas: 223 x 10e3/µL. Coagulación: tiempo de protrombina: 12,7 s. Actividad de protrombina: 67%; INR: 1,2; fibrinógeno: 193 mg/dL. Tiempo de cefalina: 21,6 s; ratio de cefalina: 0,82. Bioquímica: glucosa: 70 mg/dL; creatinina: 0,26 mg/dL; sodio: 145 mmol/L; potasio: 3,9 mmol/L; cloro: 103 mmol/L; calcio total: 9,1 mg/dL; fosfato: 3,9 mg/dL; ASAT/GOT: 3.189 UI/L (<95) ALAT/GPT 3384 UI/L (<35); GGT: 292 UI/L (<38); bilirrubina total: 6,13 mg/dL; bilirrubina directa: 4,52 mg/dL. Proteínas totales: 6,0 g/dL; albúmina: 3,4 g/dL; proteína C reactiva: 5,0 mg/L (0,0-5,0). Informe de la ecografía: ligera hepatomegalia con edema de pared vesicular y adenopatías en hilio hepático. Ante estos hallazgos se amplía el estudio y se decide su ingreso por la afectación del estado general, con deshidratación y decaimiento. Se pauta fluidoterapia y vitamina K iv.
|