|
| Temas de FC |
A. Barrio Merino, G. Botija Arcos, A. Recio Linares, C. García Rodríguez
Gastroenterología Pediátrica. Servicio de Pediatría. Hospital Universitario Fundación Alcorcón
| Resumen
La patología inflamatoria esófago-gástrica del niño es objeto de interés creciente dada su elevada incidencia y prevalencia, debido a la identificación relativamente reciente de nuevas etiologías como la esofagitis eosinofílica. Tanto para la gastritis como para la esofagitis, el diagnóstico es endoscópico y requiere la toma de biopsias, y el tratamiento se basa en la identificación del factor etiológico y en la curación mucosa, siendo los fármacos más empleados, los supresores del ácido. |
| Abstract
Interest in gatroesophageal inflammatory disease in infants and children is increasing |
Palabras clave: Gastritis; Esofagitis; Reflujo gastroesofágico; Esofagitis eosinofílica; Helicobacter pylori.
Key words: Gastritis; Esophagitis; Gastroesophageal reflux; Eosinophilic esophagitis; Helicobacter pylori.
Pediatr Integral 2019; XXIII (8): 377 – 385
Esofagitis y gastritis
Esofagitis
Esofagitis es sinónimo de disrupción de la mucosa esofágica sana. Las causas son múltiples. La gastroscopia es la prueba esencial para su diagnóstico.
Se define la esofagitis como la disrupción de la mucosa esofágica. Las causas de esta lesión son múltiples, pudiendo ser agrupadas en(1):
1. Químicas:
• Refluido desde el estómago y duodeno: pepsina, tripsina, ácido y bilis.
• Ingesta de fármacos, cuando existe un contacto prolongado con la mucosa esofágica: tetraciclinas, doxiciclina, clindamicina (responsables de más de la mitad de los casos), AINEs, cloruro potásico, sulfato ferroso, alprenolol, esteroides…).
• Ingesta, accidental o intencionada, de cáusticos, lavavajillas, etc.
2. Inmunológicas: alergia a proteínas de leche de vaca (APLV) u otras proteínas alimentarias, esofagitis eosinofílica (EEo).
3. Infecciosas: cándida, virus herpes simplex (VHS), citomegalovirus (CMV), etc.
4. Traumáticas: irradiación torácica y sondas nasogástricas prolongadas.
5. Enfermedades sistémicas: enfermedad de Crohn, enfermedad granulomatosa crónica, otras.
6. Miscelánea: Munchausen por poderes, tabaquismo pasivo…
Síntomas y signos: los síntomas y signos son comunes a las diversas etiologías(1) y se resumen en la tabla I.
Síntomas de alarma: vómitos biliosos, vómitos con gran esfuerzo, fallo de medro, hemorragia digestiva, fiebre, letargia, hepatoesplenomegalia, fontanela prominente, macro/microcefalia, hipo/hipertonía, convulsiones, sospecha de enfermedades metabólicas y comienzo de los vómitos después de los 6 meses de edad(2).
Su presencia obliga a realizar los estudios necesarios para descartar etiologías graves e, incluso, potencialmente mortales.
Esofagitis infecciosas
Aun siendo más frecuentes en el paciente inmunodeprimido, las esofagitis infecciosas afectan también a niños sanos.
• Virus herpes simplex: produce esofagitis erosiva, tanto en el niño inmunodeprimido como en el inmunocompetente. Los síntomas se caracterizan por: una intensa odinofagia y disfagia, salivación, con o sin fiebre, y con o sin la presencia de herpes labial u orofaríngeo concomitante. El diagnóstico es endoscópico, objetivándose múltiples erosiones redondeadas diseminadas con base de fibrina y bordes elevados, conocidas como úlceras en volcán. Excepcionalmente, se observan lesiones vesiculosas características de los virus herpes, ya que cuando se realiza la exploración, las lesiones suelen estar más avanzadas. La histología muestra un intenso infiltrado mononuclear, y son características las células gigantes multinucleadas y las inclusiones eosinófilas intranucleares. La inmunohistoquímica, la PCR o el cultivo viral confirman la etiología por VHS. El tratamiento fundamental es de soporte: mantener la hidratación y la nutrición, y la analgesia adecuada. Puede ser útil el empleo de omeprazol o un protector de barrera, como el sucralfato. El tratamiento antiviral con aciclovir o valaciclovir es debatido pues, aunque acorta la duración de la enfermedad, no mejora la tasa de complicaciones y generalmente su instauración es tardía.
Dado el carácter oportunista del VHS, con afinidad por infectar epitelios previamente dañados, se han descrito esofagitis herpéticas en pacientes previamente diagnosticados de EEo o reflujo gastroesofágico (RGE) y, viceversa, precediendo a su diagnóstico(3).
• Candida spp: es la causa más frecuente de esofagitis infecciosa. Los síntomas de disfunción esofágica son inespecíficos. La candidiasis oral no predice la lesión esofágica, excepto en el niño inmunocomprometido. Son factores de riesgo: los tratamientos con esteroides, orales o inhalados, y los supresores del ácido. El diagnóstico se realiza mediante gastroscopia, caracterizándose por placas blancas que no desaparecen con el lavado ni con el cepillado, a diferencia de los residuos de leche u otros alimentos, y se confirma con la demostración de hifas en las biopsias. Se trata con nistatina oral durante 2-6 semanas o fluconazol oral durante 10 días (en este caso se debe suspender, si existiera, el tratamiento antiácido, pues el pH ácido del estómago facilita la absorción del fluconazol).
Esofagitis por reflujo
La actitud frente al reflujo gastroesofágico es muy diferente, según se trate de un reflujo simple o de una enfermedad por reflujo. También es distinto el manejo en función de la edad. Los inhibidores de la bomba de protones son los fármacos más importantes para su tratamiento.
El reflujo gastroesofágico (RGE) es el paso pasivo del contenido gástrico al esófago, con o sin regurgitación o vómito. Es un proceso fisiológico que muestra un pico máximo sobre el 4º mes de vida. La enfermedad por reflujo gastroesofágico (ERGE) es aquella que se presenta con complicaciones, como la esofagitis y la estenosis, o con síntomas que afectan a la calidad de vida del paciente. Es más frecuente en el contexto de otras enfermedades de base. En niños mayores y adolescentes, cursa con los síntomas típicos de: pirosis, epigastralgia y dolor torácico retroesternal, mientras que en lactantes, los síntomas son muy inespecíficos (Tabla I).
Diagnóstico
Las pruebas de imagen (ecografía abdominal en lactantes y tránsito baritado esófago-gastro-duodenal en niños mayores) son útiles para diagnosticar malformaciones anatómicas causantes de esofagitis en la ERGE.
La pHmetría y la impedanciometría con pHmetría están indicadas para: correlacionar síntomas persistentes con eventos de RGE, aclarar el rol del reflujo ácido en la etiología de la esofagitis y determinar la eficacia de la terapia de supresión ácida.
La endoscopia digestiva con toma de biopsias permite el diagnóstico definitivo de esofagitis, filiar su causa, así como evaluar posibles complicaciones.
Tratamientos no farmacológicos
En lactantes, se recomienda disminuir el volumen y aumentar la frecuencia de las tomas. El uso de espesantes o fórmulas anti-reflujo (AR) no están exentas de efectos secundarios y no han demostrado eficacia clara en la esofagitis. No se recomienda el tratamiento postural, en decúbito prono, por aumentar el riesgo de muerte súbita del lactante.
La alergia a proteína de leche de vaca (APLV) no mediada por IgE es indistinguible clínicamente del RGE/ERGE, por lo que está indicado realizar una prueba terapéutica de 2 a 4 semanas, con fórmula extensamente hidrolizada o bien retirar los lácteos de la dieta materna en caso de lactancia materna. La mejoría en 2 semanas y la reaparición de los síntomas al reintroducirlas, confirma el diagnóstico de APLV.
En niños mayores y adolescentes, se recomienda elevar el cabecero de la cama, el decúbito lateral izquierdo, reducir el sobrepeso/obesidad, así como retirar el tabaco y alcohol. Además, es crucial una correcta educación del paciente y el apoyo de los padres.
Tratamiento farmacológico
Los fármacos destinados a suprimir el contenido ácido son los inhibidores de la bomba de protones (IBPs) y los antagonistas del receptor de histamina(4) (H2AR).
Los IBPs aprobados para mayores de 1 año son: omeprazol: 1-4 mg/kg/día cada 12-24 horas, máximo 40 mg/dosis; esomeprazol: 10 mg/día en menores de 20 kg y 20 mg/día en aquellos que sobrepasan los 20 kg, máximo 40 mg/día; y lansoprazol: 2 mg/kg/día, máximo 30 mg/día. Son la primera línea de tratamiento farmacológico y deben administrarse 30 minutos antes de la ingesta.
El uso de H2AR, ranitidina 5-10 mg/kg/día cada 8-12 horas, máximo 300 mg/día, está relegado a los menores de 1 año o si los IBPs no están disponibles o están contraindicados. Pueden producir taquifilaxia y tolerancia.
En niños mayores y adolescentes con síntomas típicos, se recomienda realizar una prueba diagnóstico-terapéutica de 4 a 8 semanas de H2RA o IBPs. Es preciso evaluar periódicamente la dosis mínima necesaria, disminuyéndola progresivamente para evitar efecto rebote.
No se recomienda usar antiácidos para el tratamiento crónico (pueden ser útiles, de manera puntual, en adolescentes en fase aguda) ni procinéticos (eficacia no demostrada y alto riesgo de efectos secundarios cardiacos y neurológicos).
La funduplicatura de Nissen está indicada en pacientes con: complicaciones graves (apneas o episodios amenazantes para la vida), fracaso del tratamiento médico, síntomas refractarios tras excluir otras enfermedades subyacentes y patologías crónicas con alto riesgo de ERGE (parálisis cerebral infantil, fibrosis quística…).
Criterios de derivación a Gastroenterología Pediátrica
Existencia de signos/síntomas de alarma que sugieran enfermedad gastrointestinal subyacente, refractariedad al tratamiento óptimo tras 8 semanas e imposibilidad de retirar de forma permanentemente los tratamientos farmacológicos (6 a 12 meses)(4).
Esofagitis eosinofílica (EEo)
Es una inflamación esofágica crónica inmunomediada, caracterizada clínicamente por síntomas de disfunción esofágica e histológicamente por inflamación predominantemente por eosinófilos(5).
Epidemiología y evolución natural
Desde su descripción original en adultos en 1978 y en niños en 1983, se observa un espectacular aumento de incidencia, 1-20 casos por cada 100.000 habitantes/año y una prevalencia de entre 13 y 49 casos por 100.000 habitantes/año en Europa. Predomina en varones, proporción 3:1, con un pico máximo a los 10 años. La atopia es el factor de riesgo más importante (45-90%), seguido de la alergia alimentaria mediada por IgE.
La posible evolución de la enfermedad a remodelación fibrosa esofágica y formación de estenosis, indican la necesidad de tratamiento. No evoluciona a malignidad(6).
Clínica
• Lactantes y niños pequeños: dificultades de alimentación (vómitos, regurgitaciones, rumiaciones) y fallo de medro.
• Niños mayores: vómitos, dolor retroesternal, epigastralgia y tos nocturna.
• Adolescentes y adultos: disfagia, ERGE que no responde a IBPs, impactación y dolor torácico no asociado con la deglución.
Diagnóstico
La EEo es un diagnóstico endoscópico. Se recomienda la toma de, al menos, 6 biopsias (esófago distal y proximal). Además, en la primera exploración, se deben tomar biopsias gástricas y duodenales para descartar otros trastornos eosinofílicos gastro-intestinales. A nivel macroscópico, son característicos: anillos (traquealización), mucosa engrosada y pálida, exudados blanquecinos, fisuras longitudinales y estenosis, aunque el 10-30% de las gastroscopias no muestran alteraciones. A nivel microscópico, se define por la presencia de >= 15 eosinófilos por campo de gran aumento, presentando una altísima sensibilidad y especificidad, cercanas al 100%. Otros hallazgos histológicos adicionales, incluyen: microabscesos eosinófilos, hiperplasia de la zona basal, dilatación de los espacios intercelulares, estratificación de eosinófilos en la superficie de la mucosa, elongación papilar y fibrosis de la lámina propia.
El diagnóstico diferencial es principalmente con la ERGE, no siendo excluyentes. Otros diagnósticos posibles son: gastroenteritis eosinofílica, enfermedad de Crohn, infestación parasitaria, acalasia, síndrome hipereosinofílico, hipersensibilidad a fármacos, enfermedades reumatológicas, etc.
Tratamiento
El tratamiento se basa en el uso de IBPs, corticoides orales deglutidos y/o cambios dietéticos, pudiendo comenzar con cualquiera de ellos(5). En caso de remisión clínica e histológica, objetivada mediante endoscopia, se debe continuar con esa línea de tratamiento a la menor dosis posible y, en caso contrario, cambiar a otra línea terapéutica.
IBPs
Inducen remisión histológica (RH) en el 50,5% de los pacientes(5). Se realiza un ciclo inicial de 8-12 semanas con dos dosis al día. Si se objetiva RH y clínica, se disminuye a mitad de dosis y se mantienen durante 6 meses.
Dieta de exclusión
Presentan alta eficacia potencial sin efectos secundarios(2). Existen tres tipos de dieta:
1. Nutrición enteral exclusiva basada en fórmula elemental. Eficacia del 95%, con rápida mejoría, pero no es bien tolerada, salvo en lactantes y pacientes graves tratados con sonda nasogástrica.
2. Dieta de eliminación empírica de 6, 4 o 2 alimentos. Eficacia moderada (75% RH). Se basa en que el 90% de los pacientes tienen 1-2 alimentos causantes de su esofagitis.
3. Dieta de eliminación dirigida, seleccionando los alimentos según prick test. Muy poco eficaz, 57-77% RH, pero bien tolerada.
Corticoides tópicos deglutidos
Su eficacia se basa en el sistema de liberación del fármaco a lo largo del esófago. Se dispone de budesónida oral viscosa y fluticasona propionato. Ambos tienen que ser administrados en ayunas y mantener la misma durante 1 hora. La duración del tratamiento y el control de eficacia son iguales al de los IBP.
Corticoides sistémicos
Solo en pacientes con síntomas graves (disfagia, estenosis esofágica).
Dilatación endoscópica
En caso de anomalías fibroestenóticas que condicionen disfagia o impactaciones alimentarias pese a los tratamientos previamente descritos(6).
Gastritis
Gastritis: presencia de infiltrado inflamatorio en la mucosa gástrica. Gastropatia: trastorno gástrico que cursa sin infiltrado inflamatorio. Erosión: lesión que no afecta a la muscularis mucosae. Úlcera: lesión que afecta a la muscularis mucosae.
La gastritis es un término histológico y se refiere a la presencia de un infiltrado inflamatorio en la mucosa gástrica. Es un hallazgo muy frecuente en los pacientes pediátricos que se someten a endoscopia digestiva superior y se utiliza de forma indebida para hablar de dolor abdominal epigástrico, dispepsia o cambios radiológicos inespecíficos. Otros términos, en relación con la patología gástrica son: la gastropatía que se refiere al trastorno gástrico que cursa sin infiltrado inflamatorio y la enfermedad ulcerosa péptica (EUP) que engloba, tanto a las erosiones (lesión que no alcanza la muscularis mucosae) como a las úlceras gástricas y duodenales(7) (lesión que la sobrepasa).
Clasificación de la gastritis
La clasificación de Sydney 1996 es de uso limitado en Pediatría. La clasificación de Dohil et al, es específica de la edad pediátrica.
La gastritis, en función del tiempo de evolución puede ser aguda, forma en la que predomina un infiltrado de neutrófilos; y crónica, con células mononucleares, células plasmáticas, macrófagos y linfocitos(8). Existen dos clasificaciones ampliamente usadas para la gastritis. La más conocida es la de Sydney(9), pero tiene una utilidad limitada en la edad pediátrica La otra clasificación que sí es específica de la edad pediátrica es la de Dohil et al(10) del año 1999 (Tabla II).
Enfermedad ulcerosa péptica
Clasificación
Lesiones primarias: crónicas y duodenales. Lesiones secundarias: agudas y gástricas.
La causa más frecuente de erosión/úlcera primaria en niños es la infección por H. pylori [la lesión suele ser crónica y se localiza en el bulbo duodenal (85%)], seguido de la ingesta de AINEs, aunque hasta en el 20% se desconoce la causa. Por su parte, la erosión/úlcera secundaria es de inicio agudo, de localización gástrica con mayor frecuencia, y se asocia a situaciones de estrés como: sepsis, shock, lesiones intracraneales (úlcera de Cushing) o grandes quemaduras (úlcera de Curling)(8) (Tabla III).
Epidemiología
La prevalencia de enfermedad ulcerosa péptica en Pediatría, aumenta con la edad y se ha descrito hasta en un 12,3% de niños con síntomas digestivos sometidos a endoscopia digestiva superior.
La prevalencia de enfermedad péptica en Pediatría oscila, según diferentes estudios, entre el 2 y el 12,3%, y es más elevada cuanto mayor es la edad del niño(11). La presencia de síntomas como: epigastralgia, sangrado digestivo, estancamiento ponderal o bien presencia de enfermedades crónicas, como la enfermedad inflamatoria intestinal, elevan la probabilidad de existencia de una erosión o úlcera de manera significativa(12). Los factores de riesgo asociados a erosión/úlcera gastroduodenal son: la infección por H. pylori, segunda década de la vida, sexo masculino, ingesta de AINEs o aspirina, tabaquismo, enfermedad renal crónica, enfermedades neurológicas y artritis idiopática juvenil(11).
Fisiopatología
La enfermedad ulcerosa péptica es el resultado final del disbalance entre los mecanismos protectores y agresores de la mucosa.
Existen varios factores implicados en el binomio daño-protección de la mucosa:
1. Secreción ácida: es alta en lesiones duodenales y baja en lesiones gástricas, y está desencadenada por distintos estímulos, como son: acetilcolina (nervio vago), gastrina y pepsina o histamina.
2. Barrera mucosa y secreción de bicarbonato: estimulada por las prostaglandinas, impidiendo el contacto del ácido con la propia mucosa.
3. Factores genéticos: la secreción de gastrina y pepsina podrían seguir ciertos patrones hereditarios(13).
Manifestaciones clínicas
Lesiones gástricas: dolor abdominal durante la ingesta con saciedad precoz y vómitos. Lesiones duodenales: dolor abdominal postprandial y nocturno.
El síntoma más frecuente es el dolor abdominal localizado en el hemiabdomen superior. En el caso de las lesiones gástricas, el dolor se exacerba durante las comidas, con sensación de saciedad precoz y náuseas o vómitos. En el caso de las lesiones duodenales, el dolor aparece de forma característica unas horas tras la ingesta o durante la noche, por aumento de la secreción ácida. En ocasiones, los niños permanecen asintomáticos, lo que conlleva a una mayor tasa de complicaciones, tales como: sangrado, obstrucción o perforación(14).
Diagnóstico
El diagnóstico se basa en la realización de una endoscopia digestiva alta y en la toma de biopsias.
Hasta finales de los 90, se empleaban técnicas radiológicas, como el tránsito digestivo superior, prueba poco sensible y con importante radiación, que ha sido desplazada por la endoscopia digestiva alta que aporta información, tanto macroscópica como histológica. Se deben tomar biopsias a nivel gástrico, de cuerpo, antro e incisura angularis; y de duodeno, sobre todo de bulbo. Ante la sospecha de complicaciones, la tomografía puede ser una prueba adecuada(14).
Tratamiento
El tratamiento se basa en la combinación de esfuerzos dirigidos a tratar la causa y a la curación mucosa.
El manejo de la enfermedad ulcerosa péptica consiste en: interrumpir el agente agresor, tratar la causa específica, mejorar los síntomas y curar las lesiones mucosas. Los fármacos utilizados con este fin son los supresores del ácido, H2RA e IBP. Los primeros inhiben de forma reversible y competitiva los receptores H2 de las células parietales y presentan taquifilaxia, es decir, pierden efecto a largo plazo. El más empleado de este grupo es la ranitidina. Por su parte, los IBPs se unen de manera irreversible a la bomba ATPasa H/K. Los más conocidos son: omeprazol, lansoprazol, esomeprazol y pantoprazol(15).
Gastritis por Helicobacter pylori
La infección por H. Pylori desempeña un papel fundamental en el desarrollo de diversas enfermedades digestivas como: gastritis crónica, úlcera péptica y cáncer gástrico.
Se estima que la infección afecta a aproximadamente el 50% de la población mundial(16). Es adquirida normalmente durante la infancia, sin embargo, en comparación con los adultos, los niños desarrollan con poca frecuencia complicaciones. En regiones de alta prevalencia, la tasa de reinfección, tras la erradicación, puede ser significativa (hasta un 20% de reinfección al año en menores de 10 años)(17).
Las recomendaciones para el diagnóstico y tratamiento de la infección por H. Pylori difieren en niños y adolescentes respecto a los adultos, por la diferente ratio riesgo-beneficio. En niños, en ausencia de enfermedad ulcerosa péptica, definida como úlceras o erosiones gástricas o duodenales, la erradicación de la infección por H. Pylori no se asocia con una mejoría en los síntomas. El objetivo principal en los niños con síntomas gastrointestinales debe ser estudiar las posibles causas subyacentes y no solo la presencia de infección por H. Pylori. Por tanto, no está indicado realizar estudio de enfermedad por H. Pylori en pacientes con síntomas gastrointestinales inespecíficos o dolor abdominal funcional. Del mismo modo, que no debe realizarse dentro del estudio de talla baja, en pacientes con halitosis o como cribado inicial de la anemia ferropénica(18).
A diferencia de los adultos, las estrategias “test and treat” (diagnóstico no invasivo y tratamiento) no están indicadas. Se realizará diagnóstico invasivo mediante endoscopia solo a aquellos pacientes con sospecha clínica de enfermedad péptica ulcerosa. En aquellos en los que se confirme la enfermedad ulcerosa, estará indicado el tratamiento. En los pacientes con gastritis asociada a H. Pylori, en ausencia de enfermedad ulcerosa, se valorará de forma individual realizar tratamiento erradicador.
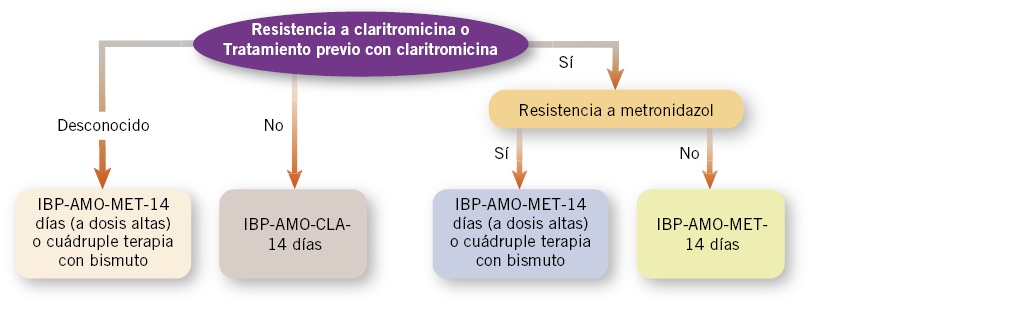
Las resistencias antibióticas son el principal factor que afecta a la eficacia de los regímenes terapéuticos actuales. La prevalencia de resistencias varía en función del área geográfica, la edad y la administración de terapias erradicadoras previas sin éxito(19). En nuestro medio, las resistencias a claritromicina se acercan en muchos casos al 50%, con resistencias a metronidazol entre el 25-30% y cepas con dobles resistencias (claritromicina y metronidazol) en torno al 14%.
Es, por tanto, fundamental obtener muestras para cultivo durante la endoscopia con el objetivo de obtener el patrón de sensibilidad antimicrobiana y realizar una terapia erradicadora adaptada (Fig. 1).
Figura 1. Algoritmo para seleccionar terapia erradicadora en función de la susceptibilidad antibiótica. IBP: inhibidor de la bomba de protones; AMO: amoxicilina; CLA: claritromicina; MET: metronidazol; Cuádruple terapia (< 8 años:
Bismuto-IBP-AMO-MET; >8 años: Bismuto-IBP-MET-Tetraciclina).
Una vez instaurado el tratamiento, es necesario que el médico explique al paciente y a su familia la importancia de la adherencia terapéutica para mejorar las tasas de erradicación. El resultado del tratamiento se debe evaluar, al menos, 4 semanas después de completar la terapia, utilizando una de las siguientes pruebas: test de aliento con UreaC13 (TAU-C13) o una prueba de antígeno monoclonal en heces. Cuando el tratamiento fracase, la terapia de rescate debe individualizarse, teniendo en cuenta: la susceptibilidad a los antibióticos, la edad del niño y las opciones antimicrobianas disponibles.
Otras gastritis infecciosas (Tabla IV)
Gastritis por citomegalovirus (CMV)
El citomegalovirus (CMV) es un virus omnipresente que tiende a infectar el estómago y el colon, sobre todo, en pacientes inmunosuprimidos.
Los huéspedes inmunocompetentes pueden estar infectados, y particularmente en los niños, pueden presentarse como enfermedad de Ménétrier. Si hay gastritis presente, los síntomas son inespecíficos e incluyen: dolor epigástrico, fiebre, náuseas y sangrado en presencia de enfermedad ulcerosa. La apariencia endoscópica puede variar, desde una mucosa de apariencia normal hasta: engrosamiento de la mucosa, eritema difuso, nódulos, pseudotumores, erosiones y úlceras, que pueden sangrar y perforarse. Aunque puede afectar cualquier parte del estómago, generalmente se localiza en el cuerpo y fundus gástrico. Histológicamente, puede haber evidencia de inflamación aguda y crónica, con edema y necrosis. El sello distintivo de la infección son los cuerpos de inclusión intranucleares de CMV, que se encuentran en las células epiteliales y endoteliales en las bases de la úlcera y la mucosa adyacente. El rendimiento diagnóstico aumenta por el cultivo viral y la inmunohistoquímica de las biopsias de la mucosa. Aunque la recuperación espontánea ocurre en 1-2 meses, en pacientes inmunodeprimidos, graves, o con evolución tórpida, puede usarse ganciclovir.
Enfermedad de Ménétrier
La enfermedad de Ménétrier infantil se caracteriza por una hipertrofia de la mucosa gástrica asociada a hipoalbuminemia secundaria a una gastroenteropatía pierde-proteínas.
Afecta, generalmente, a niños menores de 6 años. Clínicamente, presentan: náuseas, vómitos y dolor abdominal, así como signos y síntomas secundarios a la pérdida de proteínas como: edemas periféricos, ascitis y derrame pleural. En Pediatría, la enfermedad es un proceso agudo y benigno, que generalmente se resuelve espontáneamente en 2-10 semanas. En la mayoría de los casos, la enfermedad de Ménétrier se asocia con la infección por CMV, pero también se ha asociado con otros patógenos como: H. pylori, Mycoplasma pneumoniae, Giardia y herpes simple.
Gastritis medicamentosa (Tabla V)
Gastritis por AINEs (antiinflamatorios no esteroideos)
Las complicaciones gástricas causadas por los AINEs se producen debido a su efecto directo sobre la mucosa y al mecanismo de acción farmacológico.
La inhibición de la conversión del ácido araquidónico en prostaglandinas catalizada por la ciclooxigenasa (COX), reduce la síntesis de prostaglandinas. Las prostaglandinas producidas por la vía COX-1 son, en gran parte, responsables de la integridad de la mucosa y la hemostasia. La inhibición de la COX-1 compromete los mecanismos de protección de la mucosa, como: la producción de moco y bicarbonato, la integridad epitelial, la capacidad regenerativa y el suministro microvascular. En contraste, las prostaglandinas producidas por la vía COX-2 median el dolor, la inflamación y la fiebre.
El uso de los AINEs está limitado por sus efectos adversos en el tracto gastrointestinal, que van desde el daño superficial de la mucosa hasta las ulceraciones francas, que pueden dar lugar a una hemorragia gastrointestinal potencialmente mortal. En los niños, es típica la presencia de pliegues gástricos engrosados y la ulceración de la incisura angular con sangrado gastrointestinal. Esto puede ocurrir con el uso a corto y largo plazo. Aunque los efectos adversos de los AINEs se reconocen con mayor frecuencia en el estómago, puede haber cambios en todo el tracto gastrointestinal, incluidos: esófago, intestino delgado y colon. Se ha demostrado que los niños con uso prolongado de AINEs, durante más de 2 meses, desarrollan: gastropatía, erosiones antrales o úlceras. Otros factores que aumentan el riesgo de úlceras gastrointestinales relacionadas con AINEs son: uso concomitante de otro AINE o corticoides, dosis más altas de AINEs, antecedentes de enfermedad ulcerosa, uso de anticoagulantes e infección por H. Pylori. Para reducir los efectos adversos de los AINEs en el tracto gastrointestinal, el uso concomitante de IBPs o misoprostol (un análogo de prostaglandina) puede ser beneficioso. Los antagonistas de los receptores H2 no previenen eficazmente las úlceras gástricas inducidas por AINEs; por lo tanto, los IBPs son de elección en estos casos(8).
Gastritis y gastropatía neonatal
La gastritis o gastropatía en el recién nacido, generalmente, es una gastropatía por estrés, debido a diferentes factores de riesgo.
El neonato enfermo, a menudo, tiene múltiples factores de riesgo, como: prematuridad, hipoxia, asistencia respiratoria prolongada, desequilibrio ácido-base y sepsis. Los factores de exacerbación en estos neonatos críticos, incluyen: succión traumática, sufrimiento fetal, hipergastrinemia e hiperpepsinogenemia. Aunque los neonatos pueden estar asintomáticos, también pueden presentar síntomas como: dificultad para la alimentación, vómitos, escasa ganancia ponderal, hemorragia digestiva alta e incluso perforación gástrica. Por lo general, no se requiere una evaluación endoscópica, ya que esta gastropatía responde rápidamente al tratamiento supresor de ácido. Las cardiopatías congénitas (principalmente ductus dependientes, que reciben prostaglandina E1) y los medicamentos, también pueden contribuir al desarrollo de la patología gástrica.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio del autor.
1.*** Thomson M. Esophagitis. En: Kleiman R, Goulet O, Mieli-Vergani G, Sanderson I, Sherman P, Shneider B, ed. Walker´s Pediatric Gastrointestinal Disease. Physiology. Diagnosis. Management. 6th ed. North Carolina: People´s Medical Publishing House-USA; 2018. p. 125-49.
2.** Adamiak T, Plati KF. Pediatric Esophageal disorders: Diagnosis and Tretment of Reflux and Eosinophilic Esophagitis. Pediatrics in Review. 2018; 39: 392-403.
3.** Fritz J, Lerner D, Suchi M. Virus herpes simplex Virus Esophagitis in Immunocompetent Children: A Harbinger of Eosinophilic Esophagitis? J Pediatr Gastroenterol Nutr. 2018; 66: 609-13.
4.*** Rosen R, Vandenplas Y, Singendonk M, Cabana M, DiLorenzo C, Gottrand F, et al. Pediatric gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr. 2018; 66: 516-54.
5.*** Lucendo AJ, Molina-Infante J, Arias A, von Arnim U, Bredenoord AJ, Bussmann C, et al. Guidelines on eosinophilic esophagitis: evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterology Journal. 2017; 5: 335-58.
6.*** Lucendo AJ, Molina-Infante J. Eosinophilic oesophagitis: Current evidence-based diagnosis and treatment. Gastroenterol Hepatol. 2018; 41: 281-91.
7.** Ramos E. Gastritis, úlcera y hemorragia digestiva. Pediatr Integral. 2015; XIX(2): 3-91.
8.** Martínez MJ, Viada JF. Gastritis, infección por Helicobacter pylori y enfermedad ulcerosa péptica. En: Tratamiento en Gastroenterología, Hepatología y Nutrición pediátrica. Madrid: Ergon S.A.; 2016. p. 99-113.
9.** Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis. Houston 1994. Am J Surg Pathol. 1996; 20: 1161-81.
10.*** Dohil R, Hassal E, Jevon G, Dimmick J. Gastritis and gastropathy of childhood. J Pediatr Gastroenterol Nutr. 1999; 29: 378-94.
11.*** Bontems P, Kalach N, Vanderpas J, Iwanczak B, Casswall T, Koletzko S, et al. Helicobacter pylori infection in European Children with Gastro-duodenal Ulcers and Erosions. Pediatr Infect Dis J. 2013; 32: 1324-9.
12.** Kalach N, Bontems P, Koletzko S, Mourad-Baars P, Shchervakov P, Celinska-Cedro D, et al. Frequency and risk factors of gastric and duodenal ulcers or erosions in children: a prospective 1-month European Multicenter Study. European Journal of Gastroenterology and Hepatology. 2010; 22: 1174-81.
13.** Blecker U, Gold BD. Gastritis and peptic ulcer disease in childhood. Eur J Pediatr. 1999; 158: 541-6.
14.*** Vakil NB et al. Peptic ulcer disease: Clinical manifestations and diagnosis. Uptodate. Revisado en Noviembre 2019.
15.*** Sierra D, Wood M, Kolli S, Felipez LM. Pediatric Gastritis, Gastropathy, and Peptic Ulcer Disease. Pediatrics in review. 2018; 39: 542-9.
16.** Hooi JKY, Lai WJ, Ng WK, Suen MMY, Underwood FE, Tanyingoh D, et al. Global prevalence of Helicobacter pylori infection: systematic review and meta-analysis. Gastroenterology. 2017; 153: 420-9.
17.** Sivapalasingam S, Rajasingham A, Macy JT, Friedman CR, Hoekstra RM, Ayers T, et al. Recurrence of Helicobacter pylori infection in Bolivian children and adults after a population-based ‘‘screen and treat’’ strategy. Helicobacter. 2014; 19: 343-8.
18.*** Jones NL, Koletzko S, Goodman K, Bontems P, Cadranel S, Casswall T, et al. Joint ESPGHAN/ NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017; 64: 991-1003.
19.** Savoldi A, Carrara E, Graham DY, Conti M, Tacconelli E. Prevalence of antibiotic resistance in Helicobacter pylori: a systematic review and meta-analysis in world health organization regions. Gastroenterology. 2018; 155: 1372-382.
20.** Fernández Caamaño B, Ramos Boluda E, Martínez-Ojinaga Nodal E, Molina Arias M, Sarría Osés J, Prieto Bozano G. Enfermedad de Ménétrier asociada a infección por citomegalovirus. An Pediatr. 2015; 82: 113-6.
Bibliografía recomendada
- Thomson M. Esophagitis. En: Kleiman R, Goulet O, Mieli-Vergani G, Sanderson I, Sherman P, Shneider B, ed. Walker´s Pediatric Gastrointestinal Disease. Physiology. Diagnosis. Management. 6th ed. North Carolina: People´s Medical Publishing House-USA; 2018. p. 125-49.
Capítulo del libro considerado la “Biblia” de la Gastroenterología Pediátrica. Presenta una descripción extensa sobre las principales causas de esofagitis en el niño, dedicando una gran parte del capítulo al análisis y descripción de los mecanismos íntimos, celulares y citoquímicos, responsables de las distintas formas de esofagitis.
- Rosen R, Vandenplas Y, Singendonk M, Cabana M, DiLorenzo C, Gottrand F, et al. Pediatric gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr. 2018; 66: 516-54.
Guía indispensable para el tratamiento de ERGE y RGE en Pediatría.
- Lucendo AJ, Molina-Infante J. Eosinophilic oesophagitis: Current evidence-based diagnosis and treatment. Gastroenterol Hepatol. 2018; 41: 281-91.
Resumen actualizado del manejo de la esofagitis eosinofílica en Europa.
- Kalach N, Bontems P, Koletzko S, Mourad-Baars P, Shchervakov P, Celinska-Cedro D, et al. Frequency and risk factors of gastric and duodenal ulcers or erosions in children: a prospective 1-month European Multicenter Study. European Journal of Gastroenterology and Hepatology. 2010; 22: 1174-181.
Estupendo estudio prospectivo de un mes de duración en 19 centros de 13 países europeos, en el que se identifican factores de riesgo de la enfermedad ulcerosa péptica y se obtienen datos sobre la prevalencia de esta enfermedad en niños sometidos a endoscopia digestiva.
- Jones NL, Koletzko S, Goodman K, Bontems P, Cadranel S, Casswall T, et al. Joint ESPGHAN/ NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J Pediatr Gastroenterol Nutr. 2017; 64: 991-1003.
Actualización de la guía clínica conjunta de la sociedad europea y norteamericana de gastroenterología pediátrica, sobre el manejo de la infección por Helicobacter pylori.
| Caso clínico |
|
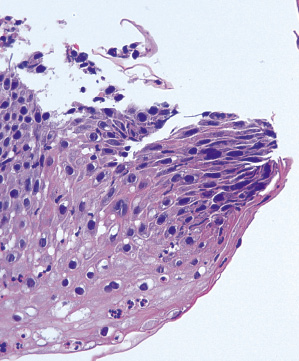
Niña de 9 años ingresada por dolor abdominal, malestar y cefalea de 5 días de evolución, con fiebre de hasta 40ºC durante los 3 primeros días. El dolor es epigástrico y retroesternal, urente e intenso, con empeoramiento durante las comidas e interrupción del sueño; no mejora con analgesia habitual (paracetamol y metamizol orales). Asoció, además, 3 vómitos no hemáticos y pérdida ponderal de 2 kg. Sin antecedentes de interés. Exploración: peso: 25,2 kg (p 10-25); talla: 133 cm (p 25-50); Tº axilar: 36,8ºC. BEG. AC: rítmica, no soplos; AP: normal. Abdomen: dolor intenso a la palpación en epigastrio, sin masas ni megalias. No lesiones en cavidad oral ni faringe. Exploración neurológica normal. Resto sin alteraciones. Pruebas complementarias: hemograma y bioquímica básica con amilasa y transaminasas sin alteraciones. Discreta acidosis metabólica parcialmente compensada. Ecografía abdominal normal. Evolución: ingresa para rehidratación, analgesia y omeprazol intravenosos. A las 48 horas de ingreso, persiste dolor intenso con sialorrea e incapacidad para deglutir alimentos sólidos ni líquidos. Se realizó una gastroscopia, objetivándose: patrón nodular a nivel gástrico, cardias incompetente y múltiples úlceras en el tercio esofágico distal con fondo fibrinoso y bordes elevados confluentes hasta abarcar la totalidad de la circunferencia esofágica. Histológicamente, el diagnóstico fue de gastritis superficial activa antral, sin identificar bacilos tipo Helicobacter pylori; intensa inflamación aguda a nivel esofágico, con erosiones y presencia de inclusiones virales compatibles con herpes (Fig. 2), etiología que se confirma mediante inmunohistoquímica (anticuerpo policlonal, Rabbit de Agilent-Dako) (Fig. 3). Figura 2. Biopsia de esófago mostrando infiltrado inflamatorio, núcleos hipercromáticos e inclusiones virales. Figura 3. Biopsia de esófago mostrando la positividad para la tinción inmunohistoquímica para el virus herpes simples tipo 1 (anticuerpo policlonal, Rabbit de Agilent-Dako). Ante los hallazgos descritos, se optimizó el tratamiento con omeprazol y se añadió aciclovir intravenoso, sustituido posteriormente por valaciclovir oral, con mejoría progresiva hasta el momento del alta. Se mantuvo en seguimiento en la consulta, persistiendo los síntomas (dolor y pirosis), al año se repitió la gastroscopia, en la que se objetivó pangastritis nodular con cultivo positivo para Helicobacter pylori resistente a claritromicina, y estrías eritematosas en esófago distal, no confluentes, sin úlceras. No se apreciaron inclusiones virales en las biopsias. Se pautó tratamiento erradicador guiado por antibiograma, con test de aliento de control negativo y tratamiento prolongado con lansoprazol. De nuevo, durante el seguimiento, presentó reaparición de la clínica tras cada intento de retirada de los IBP, motivando el ingreso y una tercera gastroscopia, persistiendo en la misma, esofagitis erosiva distal y gastritis nodular antral. Se realiza pHmetría-impedanciometría, mostrando reflujo moderado-severo de carácter ácido y predominio diurno, con extensión proximal del 70%, con aclaramiento esofágico normal. Ante la evolución tórpida y la falta de control de la enfermedad con los tratamientos médicos, se remitió a un servicio de cirugía pediátrica, que llevó a cabo una funduplicatura de Nissen, con evolución favorable tras la misma, pudiendo suspender IBP sin reaparación de los síntomas.
|