|
| Temas de FC |
M. Tolín Hernani*, C. Sánchez Sánchez*, C. Miranda Cid*, G. Álvarez Calatayud*, C. Rodríguez Jiménez**
*Médico Adjunto Sección de Gastroenterología y Nutrición Infantil. Hospital General Universitario Gregorio Marañón, Madrid. **Médico residente de Pediatría Hospital General Universitario Gregorio Marañón, Madrid
| Resumen
La enfermedad inflamatoria intestinal (EII) en la infancia es una patología de incidencia creciente en los últimos años, que produce una inflamación crónica del tracto digestivo y cuya evolución alterna periodos de actividad con otros de remisión. En este grupo de pacientes, la enfermedad tiene una forma de presentación y manifestaciones clínicas particulares que la hacen diferente a la del adulto y, en ocasiones, genera un retraso en el diagnóstico con consecuencias en la evolución a largo plazo. Existe un amplio espectro de presentación de la EII que puede clasificarse en cinco categorías: colitis ulcerosa típica, colitis ulcerosa atípica, EII no clasificada, Crohn cólico y enfermedad de Crohn con manifestaciones clínicas, evolución y tratamiento específicos. Es importante reconocer los signos y síntomas de alarma para realizar un diagnóstico temprano de estos pacientes. En cuanto al tratamiento, existen distintos escalones terapéuticos cuyo objetivo no es únicamente la remisión clínica, sino la curación de la mucosa. Es importante el seguimiento y monitorización de estos pacientes para detectar precozmente los brotes, posibles efectos del tratamiento, así como asegurar un adecuado desarrollo madurativo de los mismos hasta la edad adulta, siendo fundamental el papel de la transición a cuidados del adulto de estos pacientes, para disminuir las complicaciones y asegurar su bienestar a largo plazo, siendo el manejo multidisciplinar fundamental para garantizarlo. |
| Abstract
Inflammatory bowel disease (IBD) in children is a disease of increasing incidence in recent years producing chronic inflammation of the digestive tract. The natural course of IBD alternates periods of activity with others of remission. The disease has a particular form of presentation and clinical manifestations that makes it different from adult IBD, which sometimes leads to diagnosis delay with long-term consequences. There is a broad spectrum of presentation of IBD with five specific entities, typical ulcerative colitis, atypical ulcerative colitis, IBD- unclassified, Crohn ́s colitis and Crohn ́s disease with specific clinical manifestations, progression and treatment. It is important to recognize the “red flags”, signs and symptoms, in order to make an early diagnosis in these patients. There are different therapeutic steps in which the objective is not only clinical remission but also mucosal healing. Follow-up and monitoring of these patients is paramount to detect periods of activity, possible treatment adverse effects as well as to ensure an adequate development until adulthood. The role of transition to adult care services is essential to reduce complications and to ensure long-term appropriate outcome. Additionally, multidisciplinary management of these patients is key. |
Palabras clave: Enfermedad inflamatoria intestinal; Pediatría; Enfermedad de Crohn; Colitis ulcerosa.
Key words: Inflammatory bowel disease; Pediatrics; Crohn´s disease; Ulcerative Colitis.
Pediatr Integral 2019; XXIII (8): 406 – 416
Enfermedad inflamatoria intestinal pediátrica
Introducción
La enfermedad inflamatoria intestinal es una inflamación crónica de distintos tramos del tubo digestivo que alterna periodos de remisión clínica con otros de actividad.
La enfermedad inflamatoria intestinal (EII) se define como una entidad cuya característica principal es la inflamación crónica en diferentes localizaciones del tubo digestivo. El mecanismo fisiopatológico de la misma es de naturaleza inmunitaria y su etiología multifactorial, habiendo sido descritos múltiples factores, tanto genéticos como ambientales. Esto produce, tanto manifestaciones intestinales como extraintestinales.
La EII es una enfermedad que se caracteriza por presentar en su curso clínico periodos de inactividad o remisión, inducido en la mayoría de ocasiones por el tratamiento médico establecido, alternando con otros de actividad, que se conocen como brotes y que pueden tener distintos grados de severidad.
La EII se divide en cinco entidades, según las últimas guías(1), en función de sus características clínicas, analíticas, radiológicas, endoscópicas y anatomopatológicas, que son: colitis ulcerosa típica, colitis ulcerosa atípica, EII no clasificada (EIInc), Crohn cólico y enfermedad de Crohn (EC); esta última puede afectar de forma transmural y segmentaria a cualquier tramo del tracto digestivo, aunque suele afectar preferentemente a íleon y colon. En cambio, la colitis ulcerosa (CU) se localiza exclusivamente en colon, comenzando la afectación en recto y con extensión hacia ciego de forma continua, con afectación exclusiva de la mucosa.
Los síntomas y la gravedad de cada una de estas entidades dependerán de: la extensión, la localización, el grado de actividad inflamatoria y las manifestaciones extraintestinales asociadas a la enfermedad.
Epidemiología
La incidencia de EII en la edad pediátrica se encuentra en ascenso progresivo en los últimos años (7-5 pac/100.000 h). El 30% de EII se diagnostican en la edad pediátrica.
La incidencia de la EII en la edad pediátrica (EIIp) varía según las distintas zonas geográficas, siendo más frecuente en los países nórdicos e industrializados (7-5 pacientes/100.000). En estudios recientes, se describe un aumento de la tasa de incidencia, sobre todo de la EC, aunque globalmente es más prevalente la CU a nivel mundial.
La EII se presenta más frecuentemente entre la segunda y la cuarta décadas de la vida. El 30% de los casos se diagnostican en la edad pediátrica, por debajo de los 18 años, siendo la edad media al diagnóstico los 12 años. Un 20% de los pacientes pediátricos con EII debutan antes de los 10 años y el 5% antes de los 5 años, siendo el factor genético la principal causa en estos pacientes de inicio temprano, habiéndose asociado con mutaciones en el gen del transportador NOD2/CARD15, presentando estos pacientes de debut temprano, una mayor afectación intestinal y una progresión más rápida de la misma. La EIIp es más frecuente en varones, siendo la incidencia en adultos similar en ambos sexos.
El espectro de la EII incluye varios tipos definidos por la edad de debut de la misma, así la EIIp se divide en: infantil (very early onset), cuando el debut es por debajo de los 24 meses; muy precoz, por debajo de 5-10 años; y precoz, cuando debuta antes de los 17 años(2).
En los últimos años, se ha observado un aumento a nivel mundial, de la incidencia de casos de debut en etapas más precoces de la vida.
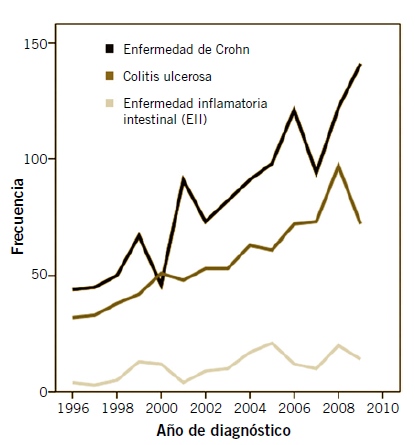
En nuestro país, el estudio SPIRIT(3) describe que la incidencia global de EIIp se ha triplicado los últimos 14 años, con un aumento mayor en EC (triple) que en CU (doble), estableciendo la incidencia real de EII en 2,8 nuevos casos por cada 100.000 habitantes menores de 18 años, existiendo un gradiente de incidencia norte-sur (3,5 vs 2,0 casos/100.000 habitantes) (Fig. 1).
Figura 1. Aumento de incidencia de EII en la edad pediátrica en los últimos años.
Etiología y fisiopatología
La fisiopatología de la EII consiste en una respuesta inflamatoria aumentada frente a la propia microbiota intestinal de aquellos pacientes que presentan predisposición genética. En la actualidad, la etiología de la EII se considera multifactorial.
En la fisiopatología de la EII, existe una respuesta inflamatoria aumentada frente a los propios gérmenes de la microbiota intestinal de aquellos pacientes que presentan predisposición genética.
La etiología de la EII es multifactorial, describiéndose tanto factores genéticos como ambientales, la participación de estos últimos explicaría el aumento progresivo de la incidencia de la misma. Se han estudiado diversos factores ambientales como la apendicectomía realizada antes de los 20 años, que resulta protectora frente a la CU, no así frente a la EC. Otro de estos factores sería el tabaco, que actuaría como desencadenante de la EC. También se ha postulado la teoría de la higiene, como base del aumento de la incidencia de la EII, así como de otras enfermedades de base inmunitaria. Otros factores que causan modificación de la microbiota como: consumo precoz de antibióticos, dietas ricas en azúcares simples y grasas, y la disminución de lactancia materna podrían estar implicados también en la patogenia de la enfermedad.
Clínica
Los síntomas más frecuentes de EII son: dolor abdominal, rectorragia, diarrea (diurna y nocturna), tenesmo y urgencia defecatoria.
Los signos y síntomas de la EIIp van a depender de la localización y extensión del tramo intestinal afecto. El espectro de la EIIp es muy variable, con distintos tipos de afectación intestinal; así, la EC y la CU tienen manifestaciones comunes, aunque de frecuencia variable, y algunas de ellas que serán exclusivas de la EC (Fig. 2).
Figura 2. Espectro de presentación de la enfermedad inflamatoria intestinal (EII) en la edad pediátrica. CU: colitis ulcerosa. EC: enfermedad de Crohn. Cortesía del Dr. Dan Tuner. Pediatric Gastroenterology Unit Shaare Zedek Medical Center. Jerusalem, Israel. Modificada.
Los pacientes pediátricos presentan con mayor frecuencia síntomas extraintestinales que, en ocasiones, producen un retraso en el diagnóstico.
Como se describe en el estudio SPIDER(4), existe un tiempo medio de diagnóstico de la EC de 27,5 semanas, desde el inicio de los síntomas hasta el diagnóstico definitivo de EII, siendo este tiempo de 13,7 semanas en la CU, debido a la mayor facilidad para identificar los síntomas de la misma. En este estudio, también se describe que el 71% de los pacientes acudieron a más de un médico antes del diagnóstico y que el 20% acudieron a tres o más médicos hasta que se realizó el diagnóstico definitivo. El 75% acudieron de inicio a su pediatra de Atención Primaria. El retraso en el diagnóstico de EII, se asocia a: riesgo aumentado de complicaciones, retraso del crecimiento y pubertad retrasada, mayor extensión de la enfermedad, peor respuesta al tratamiento, mayor necesidad de cirugía y peor calidad de vida de los pacientes.
Los síntomas que nos deben hacer pensar que estamos ante un paciente con una posible EII son: dolor abdominal, rectorragia, moco en la deposición, diarrea (diurna y nocturna), tenesmo y urgencia defecatoria, anemia, fisuras anales o fístulas digestivas, estancamiento ponderal o retraso en la talla y manifestaciones extradigestivas (fiebre, artritis, lesiones cutáneas, dolor articular, osteoporosis, etc.).
En la exploración física, hay que valorar: estado nutricional del paciente, color de piel (ictericia, palidez…) y presencia de lesiones cutáneas (hemangiomas, púrpura, zonas de hiperpigmentación…). En la exploración abdominal, hay que valorar si existe: distensión abdominal, dolor a la palpación y la localización del mismo, signos de irritación peritoneal o zonas de empastamiento. Es imprescindible realizar una exploración anal y perianal, buscando: fisuras, fístulas anales o repliegues cutáneos. Una exploración anodina no descarta que un paciente pueda ser diagnosticado de EII, si la afectación es leve o muy delimitada.
El retraso del crecimiento y del desarrollo puberal es frecuente en los niños con EII, y puede ocurrir entre el 15 y el 40% de los pacientes a lo largo de la evolución de la enfermedad. Se presenta con un enlentecimiento de la velocidad de crecimiento, con caída en los percentiles de talla de una o más DE respecto a la evolución previa, o con nulo crecimiento en un periodo de 6 o más meses. Por lo tanto, la EII debe considerarse dentro del diagnóstico diferencial de talla baja una vez descartadas otras causas, incluso en pacientes asintomáticos desde el punto de vista digestivo.
Este retraso del crecimiento es más frecuente en la EC y puede preceder al inicio de los síntomas digestivos, viéndose incrementado si existe afectación yeyunal o un retraso en el diagnóstico, siendo provocado por diversas causas como: la malnutrición, la inflamación o como efecto secundario de la terapia corticoidea. Los varones se ven más afectados por este retraso, ya que presentan una etapa de mayor crecimiento más tardía y prolongada(5).
Existen signos y síntomas de alarma denominados “red flags”, que son útiles a la hora de detectar determinados pacientes que requieran ampliar el estudio, como son aquellos que presenten: diarrea de más de 14 días de evolución, diarrea con sangre o sangrado rectal, pérdida de peso y dolor abdominal que persiste más de dos semanas (Tabla I).
En cuanto a los signos presentes en la exploración física, serían: la enfermedad perianal (fisura, fístula, repliegues cutáneos [“skin tags”]), úlceras orales recurrentes o manifestaciones extraintestinales (Tabla II).
El diagnóstico diferencial hay que realizarlo con la diarrea infecciosa prolongada, realizando estudio microbiológico de las heces, un 10-20% de los pacientes de EII presentan aparentemente una diarrea transitoria y febrícula.
La alergia alimentaria a diferentes proteínas de la dieta, como leche o soja, así como determinados fármacos (antibióticos, AINEs) pueden producir colitis, ocasionando síntomas como diarrea prolongada de más de dos semanas de evolución, en ocasiones, sanguinolenta. El sobrecrecimiento bacteriano, la intolerancia a la lactosa, el síndrome de intestino irritable o la enfermedad celiaca pueden cursar con diarrea crónica o recidivante, dolor abdominal y anemia. Las poliposis intestinales, el divertículo de Meckel, las hemorroides o fisuras anales secundarias a estreñimiento pueden cursar con rectorragia mantenida en el tiempo, asociada o no a otros síntomas digestivos. Otras causas sistémicas que pueden cursar con diarrea prolongada, desnutrición y/o sangrado son: inmunodeficiencias, linfomas intestinales, hipertiroidismo, vasculitis o síndrome hemolítico urémico.
La EII presenta un curso clínico que alterna brotes con periodos de remisión, inducidos en la mayoría de los casos por el tratamiento pautado; existen índices adaptados a los pacientes pediátricos, tanto para EC como para CU, que nos ayudan a identificar los episodios de brote, así como su severidad, en los que se incluyen, datos de la historia clínica, de la exploración física y parámetros analíticos (Tabla III).
Diagnóstico
El diagnóstico se basa en la anamnesis, exploración física, parámetros analíticos en sangre y heces, y estudio confirmatorio mediante endoscopia e histología.
Cuando en Atención Primaria existe la sospecha diagnóstica de un paciente con EII, debe realizarse una anamnesis y exploración física detalladas y analítica de sangre con: hemograma, en el que se puede observar: anemia, leucocitosis o trombocitosis; bioquímica, con hipoalbuminemia o ferropenia; coagulación; y reactantes de fase aguda (VSG, PCR, ferritina…). Se debe realizar, también, estudio de las heces: coprocultivo, huevos, parásitos y clostridium, y sangre oculta. En función de los hallazgos en las exploraciones anteriores, deberá remitirse al paciente, si existe una alta sospecha de EII, de forma preferente, a consultas de Gastroenterología Infantil; si la sospecha es baja y el estado general del paciente es bueno, puede realizarse seguimiento en su centro de salud y valorar remitir en función de la evolución. La aplicación conjunta de criterios clínicos de alarma (red flags) junto con parámetros analíticos y marcadores fecales alterados (PCR, calprotectina fecal), aumentan la fiabilidad diagnóstica en pacientes con sospecha de EII(6).
Los criterios diagnósticos para la EII en edad pediátrica y adolescente, se recogen en los criterios de Oporto, revisados por la ESPGHAN, en el año 2014(7) (Algoritmo).
Como ya se ha comentado anteriormente, la historia clínica y la exploración física son pilares fundamentales para la sospecha inicial de EII, a partir de las cuales se realizarán las diferentes exploraciones complementarias.
1. Pruebas de laboratorio: la analítica sanguínea debe incluir: hemograma y bioquímica completas, así como reactantes de fase aguda (PCR y VSG); en determinados casos de diagnóstico dudoso, serán de utilidad los marcadores ASCA (anticuerpos anti-Saccharomyces cerevisiae) y pANCA (anticuerpos anticitoplasma del neutrófilo) para diferenciar la EC o CU de la EIInc. En las heces, se debe solicitar: coprocultivo, parásitos y toxina de Clostridium difficile, así como marcadores fecales, como calprotectina o lactoferrina, que son muy sensibles para detectar inflamación de mucosa intestinal, pero no específicos de EII.
2. Exploraciones endoscópicas e histología: tanto la endoscopia alta como la colonoscopia son las exploraciones fundamentales para el diagnóstico, tanto por la visualización macroscópica como por la posibilidad de toma de biopsias para estudio anatomopatológico. En cualquier paciente con sospecha de EII, debe realizarse colonoscopia con ileoscopia, excepto si existe megacolon tóxico o perforación intestinal, y gastroduodenoscopia, obteniéndose múltiples biopsias de todos los tramos explorados incluso aunque el aspecto macroscópico sea normal. La cápsula endoscópica y la enteroscopia permiten la valoración de intestino delgado, que también está recomendada en el diagnóstico de estos pacientes.
La lesión macroscópica característica de la CU, en la colonoscopia, será la inflamación mucosa continua con progresión de la afectación desde recto hasta ciego. La afectación en la EC será parcheada, con lesiones ulcerosas y aftosas entre mucosa sana, que pueden aparecer a lo largo de todo el tracto digestivo y afectar la totalidad de la pared intestinal. En cuanto a las lesiones en la endoscopia alta, pueden ser de utilidad para evaluar la EIInc, ya que el 35% de los pacientes con EC pueden tener lesiones a dicho nivel (Fig. 2).
La histología en Pediatría suele ser inespecífica, sobre todo, en las fases más iniciales de la enfermedad, dificultando el diagnóstico de estos pacientes, pero es de utilidad en la monitorización de la eficacia del tratamiento para valorar la curación de la mucosa (Tabla IV).
3. Radiología: es útil para valorar la localización, extensión y gravedad de la enfermedad. La resonancia magnética se considera la técnica de elección para valoración de intestino delgado en el paciente pediátrico, ya que permite valorar tanto la extensión y gravedad, como la presencia de complicaciones asociadas (estenosis, fístulas…). Otras técnicas de imagen que pueden ser útiles en estos pacientes, serían: la ecografía abdominal con o sin contraste, la gammagrafía con leucocitos marcados para establecer la localización de la inflamación, tomografía axial computarizada con contraste, el tránsito intestinal o la radiografía simple de abdomen, aunque su rentabilidad diagnóstica es variable en la edad pediátrica.
Según la localización y la afectación, la EIIp se clasifica siguiendo la clasificación de París del año 2011 (Tabla V).
Tratamiento
El objetivo del tratamiento de la EII es la remisión clínica y la curación mucosa; para ello, existen varios escalones terapéuticos en función de la enfermedad de cada paciente.
En la actualidad, la estrategia recomendada para la EII es el tratamiento por objetivos o “treat to target”, persiguiendo no solo el control de los síntomas y la remisión clínica, sino también el control de la inflamación, pretendiendo la curación mucosa y transmural, y mantener el control de la remisión.
La EIIp tiene objetivos de tratamiento específicos, debido a las características específicas de estos pacientes, como son: detener la progresión de la enfermedad, mantener un adecuado estado nutricional, favorecer el adecuado crecimiento y desarrollo sexual, reducir la tasa de cirugías, facilitar el soporte psicológico/educacional y mejorar la calidad de vida.
Para ello, existen distintos tratamientos, cuyo objetivo principal es actuar sobre la regulación del sistema inmunitario y la acción antiinflamatoria sistémica o local(8,9) (Tabla VI).
1. Fármacos antiinflamatorios:
• Aminosalicilatos (sulfasalazina, mesalazina): acción antiinflamatoria, principalmente tópica, mediante la inhibición de mediadores proinflamatorios (interleuquinas, prostaglandinas…). Su indicación es en la EII con afectación cólica en inducción y mantenimiento de remisión. Existen preparaciones orales o tópicas (supositorios, enemas, espumas) que resultan útiles en afectaciones distales de colon izquierdo.
• Corticoides (budesonida, beclometasona, corticoides clásicos): efecto antiinflamatorio sistémico. Indicados en inducción de remisión en brote moderado-severo. No están indicados como terapia de mantenimiento.
Los corticoides orales de acción local (budesonida, beclometasona) presentan menor biodisponibilidad, con menor efecto antiinflamatorio y efectos adversos. Existen tanto presentaciones orales como tópicas.
2. Inmunomoduladores:
• Tiopurinas (azatioprina, 6-mercaptopurina): inhiben la proliferación de linfocitos T y B. Indicados para el mantenimiento de remisión, no en inducción de la misma, ya que su efecto máximo puede requerir 8-12 semanas de tratamiento.
• Metotrexato: inmunomodulador con efecto antiproliferativo y citotóxico, a través de la inhibición de la síntesis de ADN y ARN. Indicado en el mantenimiento de remisión en EC en pacientes con riesgo de mal pronóstico o en fallo de tiopurinas.
• Ciclosporina y tacrolimus: indicados en CU grave refractaria a otros tratamientos, como medida temporal. Estos tratamientos tienen efectos adversos frecuentes y potencialmente graves, por lo que no son de uso como terapia inicial en estos pacientes.
3. Terapia biológica: fármacos derivados de fuentes biológicas que regulan el sistema inmune del individuo, ejerciendo efecto antiinflamatorio a través de la inhibición selectiva de distintos pasos de la cascada inflamatoria.
Existen, en la actualidad, dos fármacos biológicos, anti-TNFa (factor de necrosis tumoral a), aprobados para el uso en niños a partir de 6 años: Infliximab, que es de administración intravenosa y tiene indicación en EC y CU pediátricas en brotes graves que no responden a otros tratamientos; y el Adalimumab, de administración subcutánea, que tiene indicación en EC pediátrica en brote grave, que no ha respondido a otros tratamientos.
Recientemente, en enero de 2019, han sido publicadas por la EPGHAN las recomendaciones del uso de fármacos biosimilares en niños, que son medicamentos biológicos similares equivalentes en calidad, eficacia y seguridad a los fármacos biológicos originales, según los estudios de los últimos años(10).
Los principales efectos secundarios de estos fármacos son: las reacciones alérgicas en el momento de la infusión, el riesgo de linfoma (linfoma hepatoesplénico de células T) que podría estar aumentado en varones jóvenes con EC en tratamiento combinado con tiopurínicos, y el aumento del riesgo de infecciones.
4. Terapia nutricional en la EC: esta terapia se basa en una alimentación líquida con fórmula polimérica completa exclusiva, durante un periodo de tiempo entre 6-8 semanas. Este tratamiento tiene ventajas en cuanto a la mejoría del estado nutricional del paciente, la ausencia de efectos secundarios y la capacidad de curación mucosa en comparación con los corticosteroides. La indicación de esta terapia sería para brote leve-moderado de EC no fistulizante ni con afectación perianal.
5. Antibioterapia: recomendada como terapia coadyuvante en enfermedad perianal fistulizante en EC (durante periodos prolongados), así como en casos de pacientes con reservoritis en ciclos puntuales. Los antibióticos utilizados son metronidazol y ciprofloxaciono.
6. Aféresis: técnica que consiste en la extracción de leucocitos del torrente sanguíneo a través del paso por una membrana extracorpórea. Indicado en tratamiento de pacientes con CU con contraindicación para uso de corticoides o en brotes corticodependientes, cuando los tiopurínicos son ineficaces como alternativa a la cirugía.
7. Cirugía: en los casos de EIIp, se reserva este tratamiento para aquellos pacientes que no responden a los tratamientos anteriormente citados. La colectomía resulta curativa en los pacientes con CU refractaria a tratamiento y está indicada en la EC para el tratamiento de complicaciones como: fístulas, abscesos o cuadros de estenosis que produzcan cuadros obstructivos.
Transición a cuidados del adulto
El objetivo de la transición es asegurar la continuidad de cuidados, incluyendo aspectos médicos, del desarrollo social e independencia de cuidados.
La transición de cuidados médicos se define como: el movimiento intencional y planificado de los adolescentes con enfermedades crónicas, desde los cuidados infantiles al sistema adulto(11). El objetivo principal del programa de transición en estos pacientes, es asegurar de forma individualizada la continuidad de cuidados, incluyendo no solo aspectos médicos, sino también del desarrollo social y el fomento de habilidades para la independencia de cuidados. Dicho proceso debe ser: multidisciplinar, anticipativo y organizado.
Debido a que la EII supone una patología crónica con elevada morbilidad, en algún momento de su evolución, los pacientes pediátricos serán trasladados a la atención clínica por parte de gastroenterólogos de adultos. Como consecuencia de las características propias de la enfermedad en niños, los factores psicológicos y sociales propios de la adolescencia, la incertidumbre de la evolución en brotes y la importancia de la adhesión al tratamiento, se hace fundamental en esta transición, la participación de los gastroenterólogos de referencia, un pediatra y un especialista de adultos, así como la implicación familiar y del propio paciente.
Existe evidencia de que un programa de transición coordinado y ajustado a las características del paciente (edad, estado de la enfermedad etc.) mejora los resultados del curso de las enfermedades crónicas, por lo que es importante conocerlo y ponerlo en práctica para la mejora en la calidad asistencial de estos pacientes.
Función del pediatra de Atención Primaria
El papel del pediatra es importante en el seguimiento, detección de efectos secundarios de tratamiento y periodos de actividad de la enfermedad.
El papel del pediatra de Atención Primaria (AP) es fundamental, tanto en el diagnóstico como en el seguimiento de estos pacientes(12).
Como se ha explicado previamente, el retraso en el diagnóstico de la EII genera complicaciones y peor respuesta al tratamiento, por lo que es fundamental la alta sospecha de esta patología, así como la derivación de los pacientes a Digestivo infantil, si la sospecha es elevada.
Una vez confirmado el diagnóstico y pautado el tratamiento, el pediatra deberá conocer el mismo, así como identificar los posibles efectos adversos (cefaleas, náuseas o vómitos, hipertensión, reacciones alérgicas…) que pueden ocasionar los mismos, así como favorecer la autonomía del paciente y su autocuidado.
En cualquier paciente con EII, que acuda para valoración a AP con sintomatología aguda como: fiebre, dolor abdominal, rectorragia o diarrea, deberán descartarse, en primer lugar, los cuadros clínicos más frecuentes propios de la edad, como la patología infecciosa intercurrente y, en el caso de que se descartaran y persistiera la sospecha de brote agudo o efectos relacionados con la medicación de base, deberá ponerse en contacto al paciente con la Unidad de Gastroenterología infantil de referencia. Hay que tener en cuenta que el paciente puede estar en tratamiento con fármacos inmunosupresores e inmunomoduladores que pueden producir mayor riesgo de infecciones.
En cuanto a las vacunaciones, debe revisarse el calendario vacunal de todos los pacientes antes del inicio de cualquier fármaco inmunosupresor y completarse en el caso de que se encontrara incompleto. Las vacunas de virus vivos están contraindicadas en los pacientes con estos tratamientos.
Está recomendada la vacunación anual de gripe en todos los pacientes en tratamiento inmunosupresor.
En cuanto al hábito tabáquico es importante desaconsejar su inicio en los pacientes con EC, ya que aumenta el riesgo de cirugía, de uso de inmunosupresores y la aparición de recidivas de la enfermedad.
Debe controlarse en las visitas de seguimiento, que los pacientes tengan adecuada ingesta de calcio y vitamina D o una pauta correcta de suplementos, ya que en ellos se incrementa el riesgo de osteoporosis y con ello de fracturas, por lo que habrá que valorar la realización de densitometrías durante el seguimiento.
Recordar que existe un aumento no bien establecido del riesgo de linfoma en los pacientes con estos tratamientos y que debe recomendarse protección solar para evitar tumores cutáneos.
Se debe insistir, tanto por la evolución de la enfermedad como para asegurar un adecuado crecimiento de estos pacientes, en la necesidad de realizar una alimentación equilibrada, evitando productos manufacturados y realizando ejercicio de forma frecuente, así como favorecer hábitos de vida saludables.
Es fundamental el papel del pediatra de AP en la monitorización del cumplimiento del tratamiento pautado para su enfermedad, ya que la falta de adhesión es una de las principales causas de recaída en estos pacientes, especialmente en determinados momentos como es la adolescencia.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio del autor.
1.*** Turner D, Ruemmele FM, Orlanski-Meyer E, Griffiths AM, de Carpi JM, Bronsky J, et al. Management of Paediatric Ulcerative Colitis, Part 1: Ambulatory Care-An Evidence-based Guideline From European Crohn’s and Colitis Organization and European Society of Paediatric Gastroenterology, Hepatology and Nutrition. JPGN. 2018; 67: 257-91.
2. Levine A, et al. Inflamm Bowel Dis. 2011; 17: 1314-21. Proposed by Hyams J. PIBD; 2014. Rotterdam (Benchimol, et al; 2009. Gut. 48: 1490-97; Benchimol, et al; 2011. IBD; Heyman, et al; 2005. J Ped; Ruemmele, et al; 2006. JPGN; Kappelman, et al; 2008. IBD).
3. Martín-de-Carpi J, Rodríguez A, Ramos E, Jiménez S, Martínez-Gómez MJ, Medina E, et al. Increasing incidence of pediatric inflammatory bowel disease in Spain (1996-2009): the SPIRIT Registry. Inflamm Bowel Dis 2013; 19: 73-80.
4. Jiménez S, Navas VM, Martín de Carpi J, Rodríguez-Martínez A, Segarra O, Peña L, et al. Diagnostic Delay in Pediatric Inflammatory Bowel Disease in Spain: The SPIDER Registry. J Pediatr Gastroenterol Nutr. 2017; 65: S28-S29.
5.** Medina E. Enfermedad inflamatoria intestinal (I): clasificación, etiología y clínica. An Pediatr Contin. 2013; 11: 59-67.
6. Holtman GA, Lisman-van Leeuwen Y, Kollen BJ, Norbruis OF, Escher JC, Walhout LC, et al. Diagnostic test strategies in children at increased risk of inflammatory bowel disease in primary care. PLoS ONE. 2017; 12: e0189111. https://doi.org/10.1371/journal.pone.0189111.
7.*** Levine A, Koletzko S, Turner D, Escher J, Cucchiara S, Ridder L, et al. ESPGHAN Revised Porto Criteria for the Diagnosis of Inflammatory Bowel Disease in Children and Adolescents. J Pediatr Gastroenterol Nutr. 2014; 58: 795-806.
8.*** Sánchez Sánchez C, Marín Jiménez I, Tolín Hernani M, Morales Pérez JL. Enfermedad inflamatoria intestinal en Pediatría. Ergon. Madrid. 2013.
9.** Sánchez Sánchez C, Álvarez Calatayud G, Tolín Hernani M. Manual práctico de Enfermedad Inflamatoria Intestinal pediátrica. Ergon. Madrid. 2015.
10. Ridder L, Assa A, Bronsky J, Romano C, Russell R, Afzal N, et al. On behalf of the Paediatric IBD Porto group of ESPGHAN. Use of Biosimilars in Pediatric Inflammatory Bowel Disease: An Updated Position Statement of the Pediatric IBD Porto Group of ESPGHAN. JPGN. 2019; 68: 144-53.
11. Blum RW, Garell D, Hodgman CH, Jorissen TW, Okinow NA, Orr DP, et al. Transition from child-centered to adult health-care systems for adolescents with chronic conditions. A position paper of the Society for Adolescent Medicine. J Adolesc Health. 1993; 14: 570-76.
12.*** López M, Ros I, García R, Cenarro T. Enfermedad Inflamatoria Intestinal pediátrica en Atención Primaria. Recomendaciones de actuación. Hospital Universitario Miguel Servet.
13. Martínez Gómez MJ. Enfermedad inflamatoria intestinal pediátrica. Pediatr Integral. 2015; XIX(2): 119-26.
Bibliografía recomendada
– ESPGHAN Revised Porto Criteria for the Diagnosis of Inflammatory Bowel Disease in Children and Adolescents - J Pediatr Gastroenterol Nutr. 2014; 58: 795-806.
Artículo de revisión de la Sociedad Europea de Gastroenterología, Hepatología y Nutrición pediátrica sobre los criterios diagnósticos de la enfermedad inflamatoria intestinal en niños, tanto de EC como de CU, en el que se revisan tanto marcadores endoscópicos como analíticos. También, se resumen recomendaciones prácticas en cuanto a diagnóstico de pacientes con sospecha de EII, así como de posibles diagnósticos diferenciales.
– Sánchez Sánchez C, Álvarez Calatayud G, Tolín Hernani M. Manual práctico de Enfermedad Inflamatoria Intestinal pediátrica. Ergon. Madrid. 2015.
Manual de bolsillo muy interesante desde el punto de vista práctico, en el que se resumen los puntos más importantes para el manejo diario de los pacientes con EII, tanto en el diagnóstico como en el tratamiento y seguimiento de los mismos.
– Rosen J, Dhawan A, Saeed SA. Inflammatory Bowel Disease in Children and Adolescents. JAMA Pediatr. 2015; 169: 1053-60.
Artículo resumen de toda la EII en niños y adolescentes, desde el diagnóstico con las manifestaciones clínicas, exploraciones complementarias, los distintos tipos de tratamientos y el seguimiento de los pacientes.
– Página web: Educainflamatoria. Enfermedad inflamatoria intestinal Crohn y Colitis. https://www.educainflamatoria.com/dudas-frecuentes-en-padres-de-ninos-y-adolescentes.
Plataforma educativa on line dirigida especialmente a cualquier tipo de paciente diagnosticado de EII, en la que se puede obtener una información multidisciplinar de la patología, desde los diversos puntos de vista de la misma. Esta página también resulta de interés para el personal sanitario, dada la gran cantidad de información que contiene, siendo avalada por Geteccu.
| Caso clínico |
|
Motivo de consulta: niña de 14 años y medio que acude a la consulta de Digestivo Infantil remitida por su médico de Atención Primaria por cuadro de diarrea con deposiciones semilíquidas, 6-8 al día, de cuatro meses de evolución, asocia: deposición nocturna, urgencia y tenesmo defecatorio. No refieren sangre ni moco en la deposición. Asocia: dolor abdominal, anorexia y pérdida ponderal de 4 kilos desde el inicio del cuadro. Afebril desde el inicio. No refieren cuadros infecciosos ni tratamientos intercurrentes. Antecedentes personales: embarazo controlado, diabetes gestacional controlada con dieta. Parto eutócico a término. Peso de recién nacido: 3 kg. Periodo neonatal e infancia sin incidencias. No ingresos. No intervenciones quirúrgicas. No alergias conocidas. Calendario vacunal al día. Antecedentes familiares: sin antecedentes familiares de EII, ni de enfermedad celiaca, ni de enfermedades autoinmunes. Exploración física: peso: 55,6 kg (p65); talla: 158,7 cm, (p34); IMC: 22,08 kg/m2 (p 80). Normosómica, leve palidez de piel y mucosas, perfusión periférica normal. Auscultación cardiopulmonar: buena entrada de aire bilateral sin ruidos patológicos. Rítmica sin soplos. Abdomen: blando depresible, sin distensión, no doloroso, no visceromegalias. En la consulta, se realizan las siguientes exploraciones complementarias: • Analítica de sangre: - Hemograma: hematíes: 5,18 10E6/μL; hemoglobina: 11,9 g/dL 13,0-16,0 *Hematocrito: 38,2% 36,0-48,0; V.C.M.: 73,7 fL 78,0-102,0*; H.C,M.: 22,9 pg 26,0-32,0*;C.H.C.M.: 31,1 g/dL 29,0-36,0; A.D.E.: 14,3% 11,5-15,0; plaquetas: 496 10E3/μL 150 – 400*; leucocitos: 11,10 10 E3/μL 4,50-13,50; Neu: 7,9 10E3/μL 1,8-7,7*; Lin: 1,8 10E3/μL 1,2 5,2; Mon: 1,3 10E3/μL 0,2-1,0**; Eos: 0,1 10E3/μL 0,0-0,5. - Bioquímica: amilasa: 80 U/L 28-100; Lipasa: 30 U/L 5-160; Sodio: 141 mmol/L 135-145: potasio: 4,4 mmol/L 3,5-5,2; cloruro: 101 mmol/L 95-110; hierro: ** 14 μg/dL 37-145; orosomucoide (alfa-1-glicoproteína ácida) ** 273 mg/dL 30-135; proteína C reactiva: * 3,3 mg/dL 0,0-0,5; ferritina: 37 μg/L 12-200; transferrina: 213 mg/dL 200-360; índice de saturación de transferrina: * 5% 15-45. - Coagulación: tiempo de protrombina: 13,3 s. 10,5-13,5; I.N.R.: 1,2 0,8-1,2; A.P.T.T. 34,5 s. 27-38; control A.P.T.T.: 31 27-38; ratio A.P.T.T: 1,15 0,95-1,3; fibrinógeno: * 693 mg/dl 200-400. - Analítica de heces: sangre oculta en heces: positivo, calprotectina: ** >3.000 mg/kg. • Cultivos de heces: negativos. • Tras valorar resultados analíticos, se decide realización de ileocolonoscopia y endoscopia alta: en zona ileal, objetivan restos de fibrina y pequeñas erosiones cubiertas de fibrina en su entrada. En colon, mínimas erosiones hasta transverso, descendente con mucosa ulcerativa continuada, con numerosas úlceras profundas, recubiertas de fibrina de bordes irregulares, mucosa eritematosa petequial y friable al roce, que se hace más importante en sigma y recto, con sangrado activo con el roce del trayecto explorado. Inspección anal: eritema perianal. Esofagogastroduodenoscopia: mucosa y calibre esofágico normal. Cámara gástrica con mucosa levemente eritematosa y micronodular hasta antro pilórico. En bulbo duodenal, se objetivan lesiones erosivas superficiales en número de 3, recubiertas de fibrina de pequeño tamaño. • Anatomía patológica: íleon, ciego, colon ascendente, colon descendente, sigma y recto: Tomas de mucosa ileal y colorrectal, con cambios histológicos habitualmente observados en EII, compatibles con enfermedad de Crohn, con actividad moderada. Colon transverso: toma de mucosa colónica de morfología habitual. Bulbo duodenal y 3ª porción duodenal: tomas de mucosa duodenal de morfología habitual. Antro pilórico: gastritis crónica superficial leve. • EnteroRM: hallazgos compatibles con enfermedad de Crohn en fase inflamatoria activa, con estenosis luminal y sin enfermedad fistulosa evidente, con afectación íleocecal y colónica. Tratamiento y evolución: tras realización de endoscopia con sospecha de EII, se reevalúa a la paciente, clasificando su enfermedad, según Clasificación de París: A1B, L3, B1, G0; presentando una puntuación, según wPCDAI, de 75, considerándose brote grave, por lo que se inicia tratamiento corticoideo con prednisona 40 mg al día, además de mesalazina oral, presentando buena evolución con mejoría clínica. Previo al inicio de tratamiento, presenta aparición de lesiones nodulares eritematosas en cara anterior de ambas piernas, que presentaron mejoría con el tratamiento, con descenso de wPCDAI hasta 40. A los quince días del inicio del tratamiento, inicia cuadro de rectorragia, por lo que requiere ingreso hospitalario, pautándose corticoterapia intravenosa y tratamiento tópico con enemas de budesonida diarios, además se solicita estudio para screening de infecciones latentes por posible inicio de terapia biológica, si presenta mala evolución a pesar del tratamiento. Durante este cuadro se extraen cultivos de heces, siendo positivo para Clostridium difficile toxigénico, por lo que se inicia tratamiento con vancomicina oral con desaparición de rectorragia y mejoría clínica, por lo que es dada de alta con corticoterapia oral, mesalazina y tratamiento tópico con enemas, con buena evolución, por lo que se realiza descenso progresivo de los mismos hasta suspender, iniciándose azatioprina como tratamiento de mantenimiento, encontrándose en la actualidad clínicamente asintomática, con control analítico con reactantes y marcadores fecales negativos.
|