|
| Temas de FC |
G. Domínguez Ortega, S. Rodríguez Manchón
Hospital Infantil Universitario Niño Jesús. Madrid
| Resumen
Las alergias gastrointestinales no mediadas por IgE son reacciones adversas a alimentos desencadenadas por un mecanismo inmunológico no mediado por IgE, que cursan con clínica digestiva generalmente de aparición tardía. Es una patología en aumento, dentro de la cual se incluyen diversas entidades con características clínicas, gravedad y pronóstico variables. Ante la falta de biomarcadores para su diagnóstico, este se basará en la sospecha clínica seguida de una prueba de eliminación y, en el caso de mejoría, confirmado con una prueba de provocación. Será fundamental realizar un diagnóstico preciso, ya que la base del tratamiento es la evitación de los antígenos alimentarios causantes, siendo los alimentos más frecuentemente relacionados: leche de vaca, soja, huevo y trigo. Las dietas de exclusión en la infancia suponen un desafío para mantener una adecuada nutrición y tienen un impacto significativo en la calidad de vida de los niños y sus familias, con un coste financiero importante. Aunque el pronóstico general en la mayoría de los casos es bueno, la edad a la que se alcanza la tolerancia es variable en las distintas entidades y en cada paciente, por lo que regularmente habrá que comprobar la adquisición de tolerancia oral. |
| Abstract
Non-IgE-mediated gastrointestinal food allergies (GIFA) are adverse food reactions triggered by a non IgE mediated immune mechanism, mostly characterized by delayed onset gastrointestinal symptoms. Its prevalence seems to be increasing. Various entities with different clinical characteristics, severity and prognosis are included. Considering the lack of diagnostic biomarkers, the diagnosis is based on the clinical suspicion followed by a trial of food elimination and in case of improvement, confirmed by an oral food challenge. A precise diagnosis is of utmost importance since the mainstay of treatment is the elimination of the causal food antigens from the diet, being the foods most commonly excluded cow’s milk, soya, egg and wheat. Elimination diets in infancy not only pose a challenge to maintain an adequate nutritional status but also have a significant impact in quality of life of children and their families and an important financial cost. Even though prognosis is generally good, the age in which food tolerance is acquired is variable in each patient and entity, so tolerance should be periodically assessed. |
Palabras clave: Alergia gastrointestinal; Alergia alimentaria no IgE mediada; Dietas de eliminación.
Key words: Gastrointestinal allergy; Non IgE mediated food allergy; Elimination diets.
Pediatr Integral 2020; XXIV (3): 139 –150
Alergia gastrointestinal no mediada por IgE en Pediatría
Introducción
Las alergias alimentarias gastrointestinales incluyen un espectro de trastornos que resultan de las respuestas inmunológicas adversas a los antígenos de la dieta(1) y que son fundamentalmente no mediadas por IgE.
Las reacciones adversas a los alimentos son respuestas desfavorables del organismo producidas tras la ingestión de un alimento. Hablamos de intolerancias alimentarias, cuando la respuesta no es inmunomediada y, de alergias alimentarias, cuando existe un mecanismo inmunológico subyacente. Estas a su vez, se clasifican en: alergias mediadas por IgE, no mediadas por IgE o mixtas (Fig. 1).
Figura 1. Tipos de reacciones adversas a los alimentos, basado en las definiciones del Panel de Expertos de 2010 del National Institute of Allergy and Infectious Diseases (NIAID)(1) y adaptado de Connors, et al(8).
Las alergias alimentarias mediadas por IgE se producen por anticuerpos IgE específicos frente a un antígeno alimentario y cursan con sintomatología inmediata: cutánea, digestiva, respiratoria y/o cardiovascular. En cambio, las alergias no mediadas por IgE se caracterizan por síntomas predominantemente cutáneos y/o digestivos, de aparición generalmente tardía y en los cuales no suele ser posible confirmar la implicación de un mecanismo inmunológico mediante pruebas complementarias(2). En este artículo de revisión, nos centraremos en las alergias gastrointestinales no IgE mediadas (AGI). Las alergias alimentarias IgE mediadas y las intolerancias alimentarias han sido abordadas en otros números de esta revista: nº2 de 2018 y nº7 de 2019.
Epidemiología
Aunque se desconocen datos fiables sobre su prevalencia real, la AGI es una patología en aumento en los últimos años.
Al igual que otras enfermedades atópicas, la AGI es una patología en aumento en países con un estilo de vida occidental. La prevalencia estimada de alergia alimentaria en niños oscilan entre el 3-8%(3,4). Aunque la mayoría de los estudios reflejan prevalencias de alergia IgE mediada, existe un reconocimiento creciente de las no mediadas por IgE. Las cifras publicadas de la alergia a la proteína de leche de vaca (APLV) no IgE mediada, según un estudio europeo (0,13-0,72%)(4) parecen subestimar su incidencia real. En este estudio, solo se consideró el diagnóstico de alergia no IgE mediada en aquellos pacientes sin sensibilización IgE que manifestaron síntomas cutáneos, digestivos o respiratorios en las primeras 2 h o cuyo eccema empeoró en las primeras 48 h tras la provocación oral, obviando los que tuvieron otras manifestaciones más tardías.
Fisiopatología
El malfuncionamiento del sistema inmune de mucosas resulta en una pérdida de la tolerancia oral que puede traducirse en respuestas alérgicas indeseadas frente a los alimentos.
La mucosa intestinal es el mayor órgano inmune del cuerpo humano, constituido por la barrera epitelial, la lámina propia y el tejido linfoide asociado al tracto digestivo, y tiene el papel de distinguir entre componentes beneficiosos y perjudiciales a nivel intestinal(5). La tolerancia oral es el estado de inhibición activa de las respuestas inmunitarias a un antígeno (alimentario y de microorganismos comensales), mediante la exposición previa a través de la vía oral y constituye la respuesta fisiológica a la ingesta de alimentos. El malfuncionamiento del sistema inmune de la mucosa del tracto digestivo resulta en una pérdida de la tolerancia oral que se traduce en respuestas alérgicas indeseadas. La predisposición genética y el ambiente (tipo de parto, higiene, nutrición, exposición a antibióticos…) determinan su aparición. La microbiota participa en este sistema contribuyendo al mecanismo de barrera intestinal, interviniendo en la presentación de antígenos y modificando la respuesta inmune(2,5).
Alergia gastrointestinal no mediada por IgE (AGI)
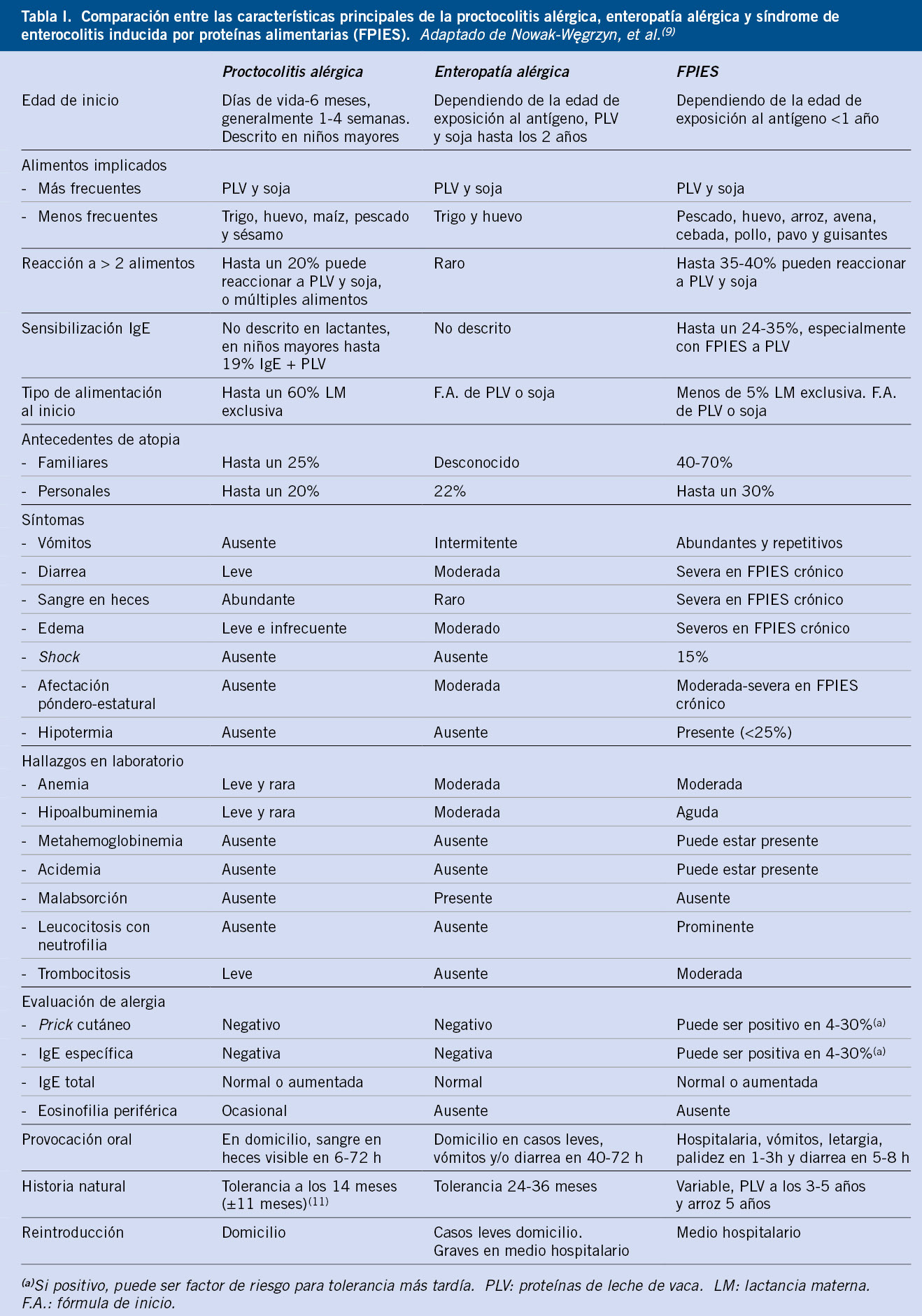
Las AGI engloban cuadros clínicos diferenciados, aunque con solapamiento en las manifestaciones clínicas (Tabla I).
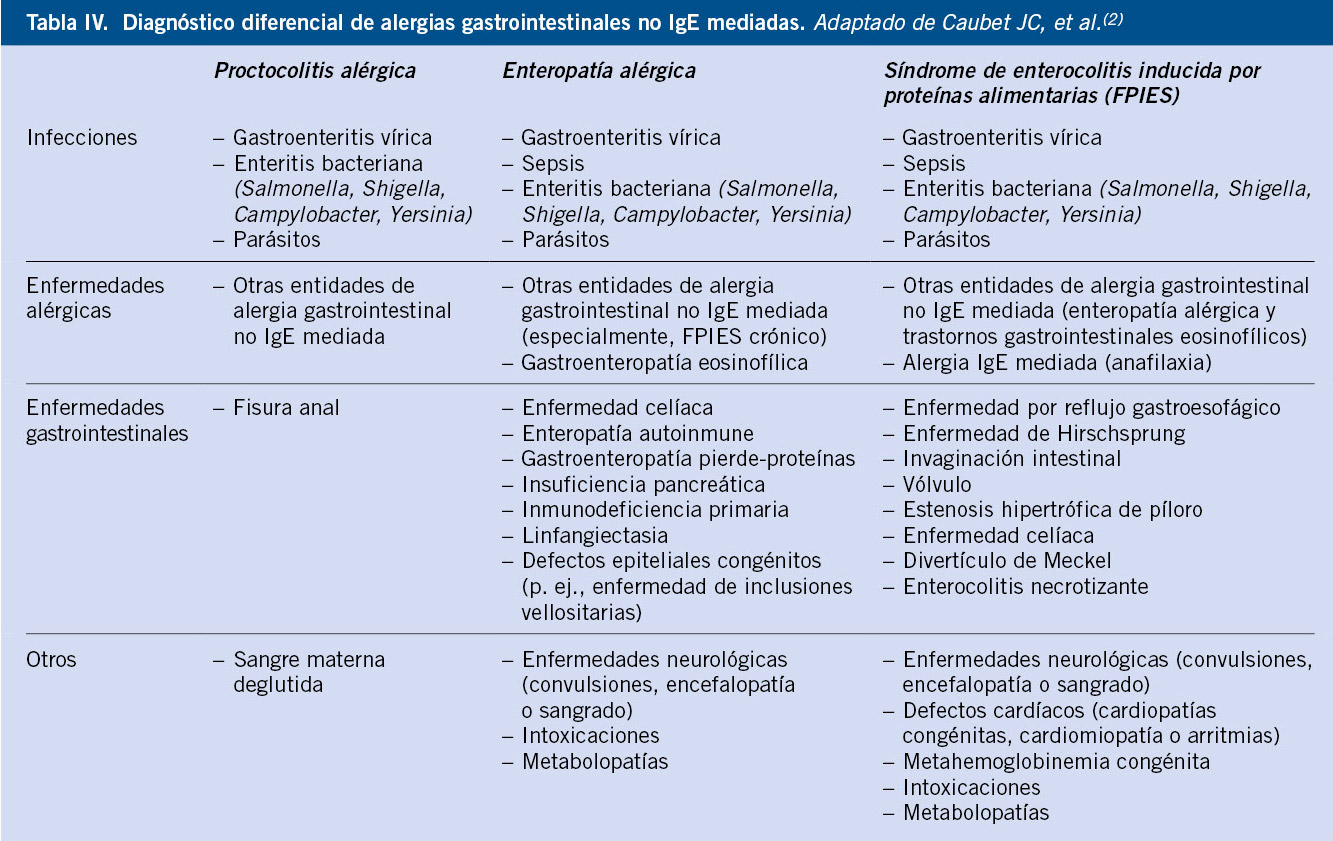
Dentro de las AGI, se incluyen: la proctocolitis alérgica, la enteropatía alérgica y el síndrome de Enterocolitis Inducida por Proteínas Alimentarias (FPIES por sus siglas en inglés)(2). Aunque existe controversia al respecto, se incluye también la dismotilidad alérgica (enfermedad por reflujo gastroesofágico [ERGE], estreñimiento, cólicos y síndrome de intestino irritable [SII]); ya que, aunque no se ha demostrado un mecanismo inmunológico subyacente, la mejoría sintomática tras la retirada del alimento causante y su recurrencia con su reintroducción, junto con la falta de respuesta a tratamientos médicos convencionales, apoya su inclusión dentro de este grupo de patologías(6). La esofagitis eosinofílica (EEo) y los trastornos gastrointestinales eosinofílicos primarios (TGIEP), la enfermedad celíaca y la anemia ferropénica inducida por APLV, se consideran también alergias no mediadas por IgE, pero no serán abordadas en este artículo.
Proctocolitis alérgica inducida por proteínas alimentarias
La proctocolitis alérgica (PA) se considera la AGI más frecuente. Se estima causante de entre el 18-64% de los casos de sangrado rectal aislado en lactantes, aunque son estudios de baja calidad metodológica(2,7). Es la entidad más benigna y se caracteriza por inflamación a nivel distal del tracto digestivo. El cuadro clínico típico es el de un lactante de aspecto sano que presenta, en los primeros meses de vida, hebras de sangre en las heces. Puede asociar: irritabilidad, diarrea, deposiciones con mucosidad, dolor con la defecación, vómitos intermitentes y, en casos graves, anemia y/o hipoalbuminemia, sin repercusión ponderoestatural. Infrecuentemente, se han descrito casos de comienzo entre los 2-18 años(8). Su inicio suele ser insidioso tras la introducción del alimento, con un periodo latente prolongado. Aproximadamente, un 60% de los casos, ocurrirán en lactantes con lactancia materna exclusiva (LME), en los cuales el alimento ingerido por la madre pasa a la leche materna en forma inmunológicamente reconocible, siendo los alimentos frecuentemente implicados: leche de vaca, soja y huevo. En niños alimentados con fórmula de inicio, se asocia a fórmula adaptada de proteínas vacunas y menos frecuentemente de soja(9). Aunque se desconoce su patogenia, se ha descrito inflamación de predominio eosinofílico en biopsias rectales(2). En lactantes con LME generalmente será suficiente con la eliminación en la dieta materna del alimento causante. En casos de escasa respuesta a la eliminación materna de PLV, será necesario descartar transgresiones inadvertidas o valorar excluir también soja y posteriormente huevo. Aun así, en una minoría puede ser necesario iniciar una fórmula hipoalergénica [fórmula extensamente hidrolizada (FEH), hidrolizado de arroz o elemental]. Hasta en un 4-10% puede persistir a pesar de alimentación con FEH. No obstante, en algunos de estos lactantes con LME puede resolverse espontáneamente sin cambios en la dieta materna(2). En la mayoría de los casos, el pronóstico es bueno con adquisición de tolerancia antes del año, pero puede tardar más en niños con alergias múltiples(2).
Enteropatía alérgica (EA) inducida por proteínas alimentarias
Aunque su prevalencia es desconocida, parece haber disminuido en las últimas décadas(2). Se caracteriza por afectación del intestino delgado y cursa con diarrea crónica que puede asociar estancamiento ponderal en más del 50% de los casos, y en menor frecuencia: distensión abdominal, saciedad precoz, vómitos intermitentes, anorexia y clínica malabsortiva. Se inicia de forma gradual entre los 2-9 meses de edad y los alimentos más frecuentemente implicados serán la leche de vaca, seguida de la soja, el huevo y el trigo(2,9,10). Puede manifestarse pocas horas tras la ingesta o, de forma más larvada, tras 3-4 semanas. En algunas ocasiones, puede desencadenarse tras una gastroenteritis infecciosa, lo que dificulta su diferenciación de un síndrome post-enteritis. En su patogenia, se ha involucrado la presencia en la mucosa intestinal de eosinófilos, linfocitos Th 2 y la producción local de IgE(2). En cuanto al pronóstico, la tolerancia se conseguirá entre los 24-36 meses de edad, aunque en algunos casos, puede persistir hasta edad escolar(10,11).
Síndrome de enterocolitis inducida por proteínas alimentarias (FPIES)
Aunque existen pocos datos sobre su incidencia real, es una de las patologías de AGI más estudiadas en los últimos años, con un aumento en el número de casos detectados. Se describen prevalencias acumuladas de FPIES por leche de vaca entre 0,34-0,36% e incidencias de hasta 15,4/100.000 en niños menores de 24 meses(11,12). En España, un estudio multicéntrico registró 120 nuevos diagnósticos de FPIES durante el año 2017(12). El FPIES es la entidad potencialmente más grave de AGI. En su forma aguda, se manifiesta como vómitos repetidos de inicio entre 1-4 horas tras la ingesta, a los cuales se asocia letargia y palidez. En las siguientes 24 horas, puede aparecer diarrea acuosa, ocasionalmente, con sangre y mucosidad. Los casos más graves pueden provocar: deshidratación, acidosis metabólica e hipotensión, y confundirse con un cuadro séptico. El fenotipo clínico y la severidad dependerán de la edad de inicio, la frecuencia y cantidad de la ingesta, y la presencia de sensibilizaciones alérgicas(11,12). El patrón agudo ocurrirá con ingestas intermitentes o tras un periodo de evitación del alimento, y los síntomas se resolverán tras 24 horas de la eliminación.
El FPIES crónico es una entidad más larvada y peor caracterizada. Las reacciones ocurren con la ingesta mantenida del alimento causante (generalmente, fórmula adaptada de leche de vaca o soja) e incluyen: vómitos intermitentes, diarrea crónica, retraso ponderal y/o estatural. Tras el inicio de una dieta de eliminación, suelen recuperar su estado previo en 3-10 días, aunque en casos graves, puede requerirse reposo intestinal y sueroterapia intravenosa. La clínica puede confundirse con una EA, pero tras la ingesta del alimento después de un periodo de evitación, se producirá una reacción tipo FPIES agudo que confirmará el diagnóstico(11).
La leche de vaca es el alimento causal más frecuentemente descrito (en España, el 40%) y, aunque existen casos en niños alimentados con LME, suponen menos de un 5%(12). En cuanto al resto de alimentos causantes, existen variaciones geográficas, siendo en España frecuentes desencadenantes: el pescado (32%), el huevo (11%) y el arroz (10%)(12). Otros alimentos involucrados son: soja, avena, pollo, frutas y verduras(11). Aunque la mayoría de pacientes presentará FPIES a un alimento (84%), hasta un tercio puede presentar reacciones a varios alimentos(11). La edad de inicio típica es entre los 2-7 meses, coincidiendo con la introducción, tanto de las fórmulas adaptadas como de los alimentos sólidos. Por ello, el debut de FPIES suele ser más precoz (antes de 6 meses) si el desencadenante es leche de vaca, con respecto a los alimentos sólidos (5-9 meses). Existen también casos en niños mayores y adultos relacionados con la ingesta de huevo, pescado y marisco(11). Aunque es una entidad distinta de las alergias IgE mediadas, existe una asociación entre FPIES y atopia, y entre el 4-30% de los niños pueden tener IgE positiva a alimentos, bien al inicio o durante el seguimiento, constituyendo el denominado FPIES atípico(11). Aunque la patogenia del FPIES es desconocida, se ha descrito activación del sistema inmune innato y una posible implicación de las vías neuroendocrinas(2,11). El momento de adquisición de tolerancia dependerá del alimento causante y de la presencia de sensibilización alimentaria. Se ha descrito tolerancia entre los 18-36 meses de edad en las reacciones a leche de vaca y cereales, y más tardía (en torno a los 5 años) con otros alimentos como el huevo o el pescado(11).
Dismotilidad alérgica (DA)
Enfermedad por reflujo gastroesofágico (ERGE)
Se ha descrito alergia alimentaria no IgE mediada confirmada con provocación en un 23-59% de los niños con ERGE(6,10) y las últimas guías ESPGHAN/NASPGHAN de 2018 recomiendan considerar prueba con dieta de eliminación en lactantes con ERGE persistente tras optimizar medidas no farmacológicas, especialmente en aquellos con comorbilidades atópicas(13) (Algoritmo 1). La DA ocasionaría un retraso en el vaciamiento gástrico y una distensión gástrica prolongada y con ello un aumento en los episodios de reflujo(10). Los síntomas suelen comenzar en los primeros 6 meses de vida, aunque pueden iniciarse más tarde, coincidiendo con la introducción de la leche de vaca y se caracterizarán por: regurgitaciones o vómitos dolorosos, irritabilidad, arqueamiento con las tomas, afectación ponderoestatural y/o dificultades de alimentación. La leche de vaca es el principal alimento involucrado, seguido de la soja, y la tolerancia se conseguirá a una edad similar al resto de AGI, tolerando la mayoría antes de los 4 años de edad(6).
Estreñimiento
Puede ser una forma de presentación de AGI, especialmente en niños con comorbilidades atópicas. Se describen en estudios prospectivos, tasas de respuesta variables a la dieta de eliminación (28-78%) y se postula que la infiltración de la mucosa rectal por eosinófilos y mastocitos podría condicionar un incremento en la presión en reposo del esfínter anal que justificaría la retención fecal(14). Los alimentos más involucrados serán: la leche de vaca, la soja y el trigo, y a diferencia del resto de entidades de AGI, la presentación será más tardía, en torno a 1-2 años de edad con el 80% de los pacientes alcanzando la tolerancia al año del diagnóstico(14).
Cólicos
El papel de la alergia en los cólicos del lactante es discutido, aunque diferentes revisiones sistemáticas sugieren el beneficio del uso de fórmulas extensamente hidrolizadas y del inicio, en LME, de dieta materna exenta de: leche de vaca, soja, huevo, trigo, pescado y frutos secos(6). Sin embargo, los estudios incluidos muestran limitaciones metodológicas, lo cual unido al carácter transitorio del cólico dificulta su interpretación. No obstante, aunque no hay evidencia suficiente para recomendar de forma rutinaria dietas de eliminación en las madres de todos los lactantes con cólicos, se podría considerar en aquellos con síntomas importantes, con comorbilidades atópicas y que asocien otros síntomas gastrointestinales(6).
Síndrome de intestino irritable (SII)
En los últimos años, se ha descrito el papel de las AGI en el SII(15). Hasta un 71% refieren mejoría en los síntomas con dietas de eliminación y exacerbaciones tras ingesta de determinados alimentos, y recientemente se ha evidenciado en pacientes adultos con SII y respuesta clínica a determinados alimentos, especialmente al trigo, aumento de la permeabilidad intestinal, incremento de los linfocitos intraepiteliales e infiltración eosinofílica duodenal tras contacto con los alimentos sospechosos(15). También se ha descrito mayor frecuencia de trastornos gastrointestinales funcionales en niños con antecedentes de APLV en los primeros años de vida, aunque son necesarios más estudios para confirmar esta asociación(10).
Diagnóstico
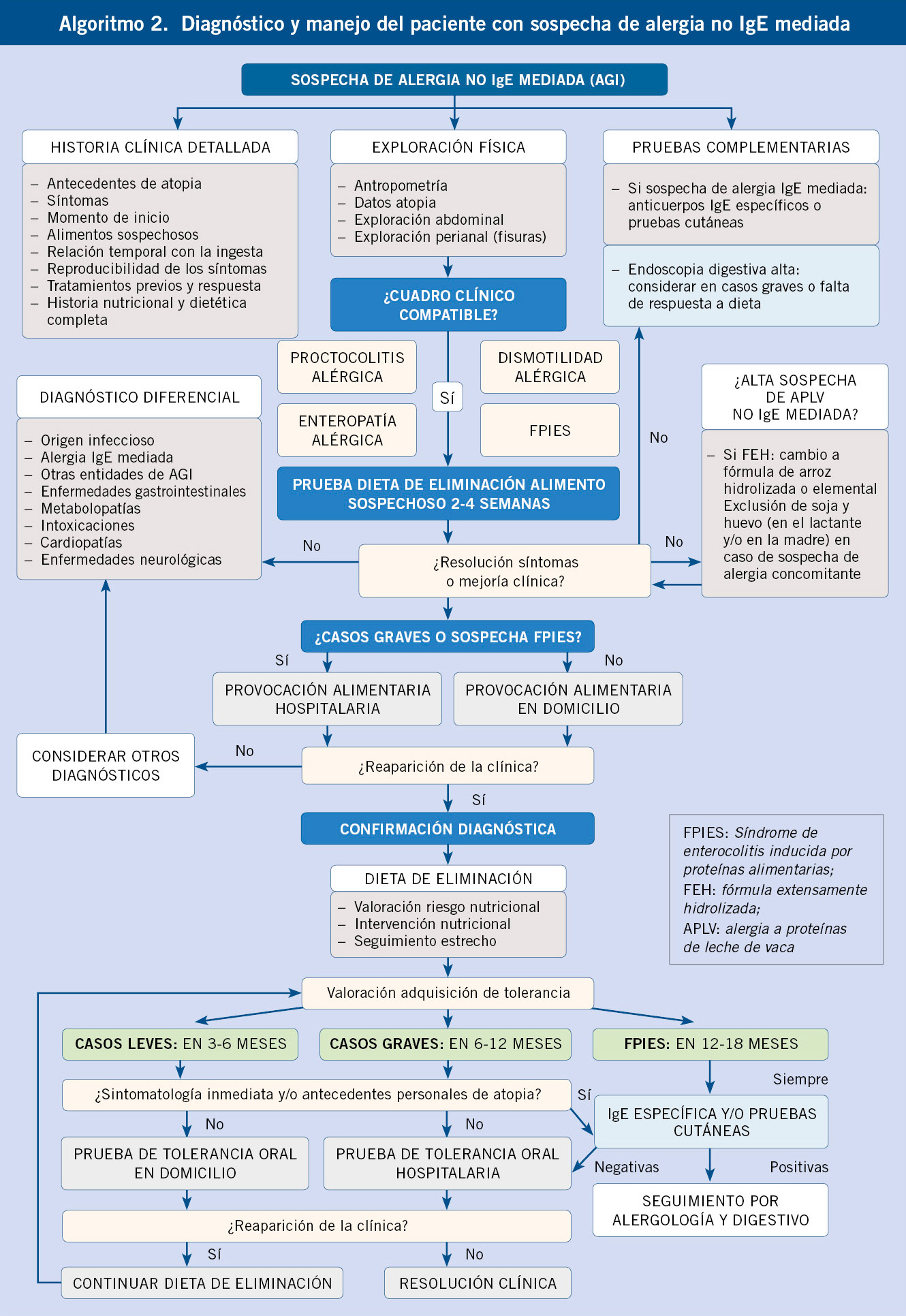
El diagnóstico se basará en la sospecha clínica de AGI, seguido de una prueba de eliminación y, en el caso de mejoría, confirmación con una prueba de provocación.
Será fundamental una historia clínica exhaustiva registrando: los síntomas, su momento de inicio, los alimentos sospechosos, la relación temporal con la ingesta y la reproducibilidad con ingestas repetidas del mismo alimento. Se preguntará por los antecedentes familiares y personales de atopia y si ha recibido tratamientos farmacológicos previos, y la respuesta a ellos. Además, habrá que realizar una historia nutricional y dietética completa, indicando: la cronología de la introducción alimentaria, los síntomas asociados a cada alimento y la actitud frente a la alimentación del niño y los familiares(2). Se preguntará también por la presencia de manifestaciones extraintestinales como: fatiga, ojeras, aftas orales, artralgias, hiperlaxitud articular, mala calidad del sueño, sudoración nocturna profusa, cefalea y enuresis nocturna, que se han descrito asociadas a AGI(16). En el FPIES, las últimas recomendaciones internacionales recogen los criterios diagnósticos (Tabla II)(11) y en la PA y la EA se han propuesto criterios diagnósticos basados en la práctica clínica (Tabla III)(2). Será fundamental además realizar un adecuado diagnóstico diferencial (Tabla IV)(2).
La exploración física debe incluir: una valoración antropométrica y una exploración cutánea, respiratoria y digestiva detallada, en busca de datos de atopia, alergia o sugerentes de otros diagnósticos. En la PA, será fundamental buscar signos de otras causas de sangrado rectal (infecciones, enterocolitis necrotizante, invaginación intestinal o fisuras anales). En el FPIES agudo, deberá prestarse atención a los signos de: deshidratación, coloración de piel y estado neurológico. En la EA, puede haber signos de: desnutrición, deshidratación, distensión abdominal y/o edemas(8).
Prueba de eliminación-provocación
Siempre que se sospeche AGI, será necesario realizar una prueba de eliminación del alimento sospechoso de la dieta durante 2-4 semanas(2). Esta retirada producirá la mejoría y resolución de los síntomas en un periodo variable: entre horas-días en el FPIES agudo, en 1-2 semanas en la PA, y en 2-4 semanas en la DA y en la EA, aunque en este último caso, la reparación mucosa puede tardar varios meses(6,8,9). En casos de LME, tras el inicio de la dieta de exclusión en la madre, los alérgenos alimentarios pueden continuar eliminándose en la leche hasta 7-10 días, por lo que la respuesta puede ser más tardía(17). Si no se evidenciara una mejoría clínica, deberían considerarse diagnósticos alternativos (Tabla IV) o valorar la existencia de alergia a otro alimento. Además, en el caso de la APLV, algunos niños pueden precisar fórmula elemental por persistencia de los síntomas a pesar de FEH, por lo que en ellos la prueba de eliminación se prolongará hasta 4-6 semanas.
En cualquier caso, siempre que exista respuesta clínica a la dieta de eliminación, será necesario confirmar el diagnóstico con una prueba de provocación, siendo el patrón de referencia la prueba de provocación doble ciego, aunque por su difícil aplicación se suele hacer abierta.
Solo se podrá eludir esta, en casos en los que por la severidad de la reacción inicial el riesgo de reproducirla sea elevado, como en el FPIES con criterios diagnósticos claros o en casos graves de otras formas de AGI(8,9,11). No obstante, con la excepción de las últimas recomendaciones españolas para el manejo de la APLV en menores de 2 años(17), no existen guías unificadas sobre cómo ni dónde realizarla (qué cantidades emplear, tipo de procesamiento alimentario, intervalos, incrementos, tiempos de respuesta ni duración de la misma). En los casos de PA, EA leve y DA, la sintomatología que puede aparecer suele ser leve y de fácil manejo ambulatorio, por lo que la reintroducción podrá realizarse en el domicilio por indicación del pediatra y con un registro parental completo de los síntomas(2,17). En el caso del FPIES y la EA grave, la provocación puede desencadenar reacciones importantes que requieran atención urgente, por lo que la reintroducción debe efectuarse en medio hospitalario(8,9,17). También se realizará en medio hospitalario, cuando existan dudas sobre un posible mecanismo inmunológico IgE mediado(8). La reaparición de la clínica puede ser tardía y requerir dosis crecientes del alimento desencadenante, por lo que se considerará una respuesta positiva a la provocación si reaparecen los síntomas en las 4 semanas tras la reintroducción(2,17).
Pruebas complementarias
No existen biomarcadores diagnósticos específicos, por lo que solo serán necesarias cuando existan dudas en el diagnóstico y para excluir otros alternativos o concomitantes. Debe descartarse enfermedad celíaca en todos los pacientes con AGI que consumen gluten, especialmente si se sospecha una enteropatía. En FPIES agudo puede existir: leucocitosis con neutrofilia y eosinofilia, trombocitosis, acidosis metabólica, elevación de la PCR y/o metahemoglobinemia; en PA anemia e hipoalbuminemia leve; y en EA: malabsorción, anemia e hipoproteinemia(8-10). La determinación de anticuerpos IgE específicos y las pruebas cutáneas serán negativas en la mayoría y solo estarán indicadas cuando existan comorbilidades atópicas, como dermatitis atópica severa o existan dudas sobre un posible mecanismo IgE mediado, así como en FPIES antes de la provocación alimentaria(11,17). No se recomienda la realización de pruebas epicutáneas con alimentos, la determinación de IgG ni IgG4 específicas a alimentos, ni la realización de calprotectina fecal, salvo ante la sospecha de Enfermedad Inflamatoria Intestinal (EII)(6,8). La presencia de sangre oculta en heces positiva es un marcador inespecífico y poco fiable en el diagnóstico y seguimiento(8).
La endoscopia digestiva alta con biopsias se requería clásicamente para el diagnóstico de EA en ausencia de enfermedad celíaca(2,9). En el resto de entidades se han descrito diversos hallazgos endoscópicos(2). En la actualidad, considerando la inespecifidad de estos hallazgos y que generalmente no modificarán el manejo, la decisión de realizar endoscopia quedará a criterio del gastroenterólogo pediátrico y habitualmente se realizará en casos graves sin respuesta a la dieta de exclusión, para descartar otra patología (EII, enteropatía autoinmune, enteropatía en penacho, enfermedad de inclusiones vellositarias) y cuando se sospeche una EEo o TGIEP(2,6-10).
Tratamiento
La base del tratamiento consiste en la eliminación en la dieta de los alimentos causantes, asegurando un adecuado aporte nutricional y minimizando su repercusión en la conducta alimentaria y en la calidad de vida del niño y sus cuidadores.
Al igual que en las alergias IgE mediadas, la piedra angular del tratamiento será evitar los antígenos alimentarios causantes, siendo los más frecuentemente implicados: la leche de vaca, el trigo, el huevo, las legumbres, incluida la soja, el pescado, el marisco y los frutos secos. Sin embargo, la eliminación de estos alimentos puede contribuir significativamente al estado nutricional del niño (Tabla V), afectar a su calidad de vida y a la de sus familias y conllevar un coste financiero y emocional significativo(18,19).
Las dietas de eliminación pueden acarrear déficits de micronutrientes (especialmente calcio, vitamina D, zinc, hierro, vitaminas del grupo B y ácidos grasos) y favorecer o desencadenar dificultades en la alimentación(18). Será necesario hacer una adecuada valoración nutricional al diagnóstico, una correcta intervención nutricional (Tabla VI) y un seguimiento estrecho, comprobando periódicamente la adquisición de la tolerancia oral a fin de evitar dietas prolongadas innecesarias.
La intervención nutricional debe individualizarse, proporcionando una correcta educación y asesoramiento a los pacientes y sus cuidadores en la identificación de alérgenos, lectura de etiquetados y sustitución de los mismos(19). No se recomienda retrasar la introducción de la alimentación complementaria y será necesario expandir el número de alimentos introducidos para asegurar un adecuado aporte nutricional y permitir la adquisición progresiva de habilidades en la alimentación y la exposición a diversas texturas y sabores(18). En pacientes con FPIES, se recomienda comenzar con un solo alimento (generalmente vegetales y frutas) y esperar, al menos, 4 días antes de continuar con otro alimento para evidenciar posibles reacciones(11).
Alergia a proteína de leche de vaca no IgE mediada(17)
El manejo de la APLV merece mención especial por ser la más frecuente en los lactantes. En niños con LME, esta debe mantenerse indicando la retirada de las PLV de la dieta materna y asegurando una suplementación de las madres con 1 g de calcio y 600 UI vitamina D al día. Cuando exista alta sospecha de AGI y persistan los síntomas a pesar de una dieta materna adecuada, se podría valorar la exclusión de otros alimentos (especialmente soja y/o huevo) y si persistieran, podría ser necesario iniciar una FEH o FE. En niños con lactancia mixta, si los síntomas coinciden con la introducción de la fórmula, se mantendrá la lactancia materna sin ser necesaria la dieta de exclusión materna, pero sustituyendo los suplementos por FEH. En niños alimentados con fórmula para lactantes, serán de elección las FEH de caseína y/o seroproteínas. Las fórmulas de arroz hidrolizado pueden ser una alternativa a cualquier edad en algunos casos que rechacen o no respondan al tratamiento con FEH de caseína y/o seroproteínas. Dado el riesgo de correacción a soja en lactantes con APLV no Ig E mediada, no se recomienda el uso de fórmulas a base de soja, especialmente en menores de 6 meses. Las fórmulas elementales serán de elección cuando fracase la FEH, en la enteropatía que curse con fallo de medro, hipoproteinemia y anemia graves, FPIES graves, en alergias alimentarias múltiples, en clínica refractaria con lactancia materna exclusiva a pesar de dieta de exclusión en la madre y eccema grave o sangrado rectal importante que condicione inestabilidad hemodinámica(17). No deben emplearse las fórmulas parcialmente hidrolizadas por mantener en su composición péptidos potencialmente antigénicos, ni leches ni fórmulas procedentes de otros mamíferos (cabra, oveja, yegua, camella, burra…) por el riesgo de reacciones cruzadas. En niños mayores de 2 años que mantengan la exclusión de PLV, deberán asegurarse unos aportes adecuados de calcio y vitamina D, suplementado acorde a sus ingestas dietéticas de referencia (RDI).
Prueba de adquisición de tolerancia
Periódicamente, deberá realizarse de forma controlada la reintroducción progresiva del alimento en la dieta para comprobar la adquisición de tolerancia oral al mismo.
La reintroducción del alimento causante se realizará bajo supervisión médica y se registrará la reaparición de los síntomas. El momento en el que realizarla dependerá de: la edad al diagnóstico, la entidad clínica y la gravedad de los síntomas iniciales(2). En los FPIES, la edad de tolerancia será distinta dependiendo del alimento desencadenante y del país de origen, pero de forma general, se recomienda esperar entre 12-18 meses desde la última reacción(11,17). En el resto de entidades podrá valorarse realizar prueba de adquisición de tolerancia tras 3-6 meses de dieta en casos leves y tras 6-12 meses en los más graves(3,17). Tras un periodo de exclusión prolongado, los niños con: sintomatología inmediata, antecedentes personales de atopia (dermatitis atópica, broncoespasmo de repetición, rinitis alérgica y/o sensibilización IgE mediada a otros alimentos) y/o FPIES, pueden desarrollar un mecanismo mediado por IgE frente al alimento excluido, por lo que será recomendable la valoración conjunta por el alergólogo y realizar prick test o determinación de IgE específica al alimento excluido antes de efectuar la prueba de adquisición de tolerancia(17). En las PA, EA y formas leves de DA, si no existe sensibilización al alimento ni antecedente de reacción grave previa, la reintroducción podrá hacerse de forma gradual en domicilio bajo supervisión médica. En los casos graves, en los FPIES o cuando exista sensibilización IgE mediada, la prueba de adquisición de tolerancia se hará en medio hospitalario(2,17). Si reaparecen los síntomas tras la prueba de tolerancia, habrá que reevaluarla de forma periódica cada 6-12 meses. Si tras 4-8 semanas de su reintroducción no reaparecen los síntomas, se mantendrá el alimento en la dieta.
Prevención
No hay suficiente evidencia para recomendar ninguna medida de prevención eficaz de la alergia alimentaria(20-22). Ni las intervenciones dietéticas en la madre durante la gestación o la lactancia, ni el uso de FEH, probióticos ni prebióticos en lactantes de riesgo, ni el retraso en la introducción de la alimentación complementaria han demostrado que puedan prevenir el desarrollo de AGI(17-19,23). Las recomendaciones actuales se dirigen al mantenimiento de una alimentación equilibrada en la madre y en el lactante, rica en alimentos naturales no procesados y con aportes de todos los nutrientes necesarios.
Papel del pediatra de atención primaria
El papel del pediatra de Atención Primaria es fundamental en el reconocimiento de los síntomas de AGI, sospechando la relación causal entre cada una de las entidades y la introducción de los diversos alimentos. Es frecuente un retraso diagnóstico en estas patologías, por lo que es importante el conocimiento de las mismas por todos los pediatras para poder realizar un diagnóstico precoz y evitar así la repercusión nutricional y el desarrollo de trastornos de conducta alimentaria secundarios. En casos dudosos, con riesgo nutricional elevado o cuando sea necesario valorar la realización de pruebas complementarias, la derivación al gastroenterólogo pediátrico puede agilizar el proceso diagnóstico y terapéutico.
Bibliografía
Los asteriscos muestran el interés del artículo a juicio del autor.
1. Boyce JA, Assa’ad A, Burks AW, Jones SM, Sampson HA, Wood RA, et al. Guidelines for the diagnosis and management of food allergy in the United States: summary of the NIAID-sponsored expert panel report. J Allergy Clin Immunol. 2010; 126: S1-58.
2.** Caubet JC, Szajewska H, Shamir R, Nowak- W?grzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol. 2017; 28: 6-17.
3. Nwaru BI, Hickstein L, Panesar SS, Roberts G, Muraro A, Sheikh A. On behalf of the EAACI Food Allergy and Anaphylaxis Guidelines Group. Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy. 2014; 69: 992-1007.
4. Schoemaker AA, Sprikkelman AB, Grimshaw KE, Roberts G, Grabenhenrich L, Rosenfeld L, et al. Incidence and natural history of challenge-proven cow’s milk allergy in European children–EuroPrevall birth cohort. Allergy. 2015; 70: 963-72.
5.** Berin MC, Shreffler WG. Mechanisms underlying induction of tolerance to foods. Immunol Allergy Clin North Am. 2016; 36: 87-102.
6.*** Meyer R, Chebar Lozinsky A, Fleischer DM, Vieira MC, Du Toit G, Vandenplas Y, et al. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants – An EAACI Position Paper. Allergy. 2020; 75: 14-32.
7. Xanthakos S, Schwimmer JB, Melin-Aldana H, Rothenberg M, Witte DP, Cohen MB. Prevalence and Outcome of Allergic Colitis in Healthy Infants with Rectal Bleeding: A Prospective Cohort Study. J Pediatr Gastroenterol Nutr. 2005; 41: 16-22.
8. Connors L, O’Keefe A, Rosenfield L. Non-IgE-mediated food hypersensitivity. Allergy Asthma Clin Immunol. 2018; 14: 56.
9. Nowak-W?grzyn A. Non-IgE-mediated gastrointestinal food allergy. J Allergy Clin Immunol.2015; 135: 1114-24. J Allergy Clin Immunol..
10. Meyer R, Fox AT, Chebar Lozinsky A, Michaelis LJ, Shah N. Non-IgE-mediated gastrointestinal allergies -Do they have a place in a new model of the Allergic March. Pediatr Allergy Immunol. 2019; 30: 149-58.
11.*** Nowak-W?grzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017; 139: 1111-26.e4.
12.** Díaz JJ; Espín B; Segarra O; Domínguez-Ortega G; Blasco-Alonso J; Cano B. on behalf of the Gastrointestinal Allergy Working Group of the Spanish Society of Pediatric Gastroenterology, Hepatology and Nutrition (SEGHNP) Food Protein-Induced Enterocolitis Syndrome: Data from a Multicenter Retrospective Study in Spain. J Pediatr Gastroenterol Nutr. 2019; 68: 232-6.
13.* Rosen RB, Vandenplas Y, Singendonk MM, Cabana MD, Lorenzo CD, Gottrand F, et al. Pediatric Gastroesophageal Reflux Clinical Practice Guidelines: Joint Recommendations of the North American Society for Pediatric Gastroenterology, Hepatology, and Nutrition and the European Society for Pediatric Gastroenterology, Hepatology, and Nutrition. J Pediatr Gastroenterol Nutr. 2018; 66: 516-54.
14. Miceli Sopo S, Arena R, Greco M, Bergamini M, Monaco S. Constipation and cow’s milk allergy: a review of the literature. Int Arch Allergy Immunol. 2014; 164: 40-5.
15. Fritscher-Ravens A, Pflaum T, Mösinger M, Ruchay Z, Röcken C, Milla PJ, et al. Many Patients With Irritable Bowel Syndrome Have Atypical Food Allergies Not Associated With Immunoglobulin E. Gastroenterology. 2019; 157: 109-18.
16. Domínguez Ortega G, Borrelli O, Meyer R, Dziubak R, De Koker C, Godwin H, et al. Extraintestinal manifestations in children with gastrointestinal food allergy. J Pediatr Gastroenterol Nutr. 2014; 59: 210-4.
17.*** Espín Jaime B, Díaz Martín JJ, Blesa Baviera LC, Claver Monzón A, Hernández Hernández A, García Burriel JI, et al. Alergia a las proteínas de leche de vaca no mediada por IgE: documento de consenso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), la Asociación Española de Pediatría de Atención Primaria (AEPAP), la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y la Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP). An Pediatr (Barc) 2019; 90: 193.e1-e11.
18.** Groetch MS, Henry M, Feuling MS, Kim J. Guidance for the Nutrition Management of Gastrointestinal Allergy in Pediatrics. J Allergy Clin Immunol Pract. 2013; 1: 323-31.
19. Meyer R, Godwin H, Dziubak R, Panepinto JA, Foong RX, Bryon M, et al. The impact on quality of life on families of children on an elimination diet for Non-immunoglobulin E mediated gastrointestinal food allergies. World Allergy Organ J. 2017; 10: 8.
20. Nevot Falcó S, Gómez Galán C. Prevención de las enfermedades alérgicas. Pediatr Integral. 2018; XXII(2): 68-75.
21. Macías Iglesias EM. Alergia a los alimentos. Pediatr Integral. 2018; XXII(2): 87-93.
22. Cañedo Villarroya E. Nuevos trastornos digestivos y su relación con intolerancias alimentarias y dietas de restricción en Pediatría. Pediatr Integral 2019; XXIII(7): 356-65.
23. Wang HT, Anvari S, Anagnostou K. The Role of Probiotics in Preventing Allergic Disease Children (Basel). 2019; 6(2):24.
Bibliografía recomendada
– Caubet JC, Szajewska H, Shamir R, Nowak- W?grzyn A. Non-IgE-mediated gastrointestinal food allergies in children. Pediatr Allergy Immunol. 2017; 28: 6-17.
Artículo de revisión sobre las alergias gastrointestinales no IgE mediadas, que aborda las principales entidades y la dismotilidad alérgica, desde sus características clínicas, a su diagnóstico, manejo y pronóstico.
– Berin MC, Shreffler WG. Mechanisms underlying induction of tolerance to foods. Immunol Allergy Clin North Am. 2016; 36: 87-102.
Interesante artículo de revisión sobre el mecanismo de tolerancia oral, el sistema inmune de mucosas y las posibles implicaciones de su disfunción en el mecanismo de las alergias alimentarias.
– Meyer R, Chebar Lozinsky A, Fleischer DM, et al. Diagnosis and management of Non-IgE gastrointestinal allergies in breastfed infants – An EAACI Position Paper. Allergy. 2020; 75: 14-32.
Muy reciente artículo de posicionamiento en cuanto al diagnóstico y manejo de las alergias gastrointestinales no IgE mediadas en niños con lactancia materna, elaborado con el fin de potenciar el mantenimiento de la misma en este subgrupo de pacientes.
– Nowak-W?grzyn A, Chehade M, Groetch ME, Spergel JM, Wood RA, Allen K, et al. International consensus guidelines for the diagnosis and management of food protein-induced enterocolitis syndrome: Executive summary-Workgroup Report of the Adverse Reactions to Foods Committee, American Academy of Allergy, Asthma & Immunology. J Allergy Clin Immunol. 2017; 139: 1111-26.e4.
Guía Internacional para el diagnóstico y manejo del síndrome de enterocolitis inducida por proteínas alimentarias, de obligada lectura para tener una visión global de todos los aspectos de esta entidad, con recomendaciones basadas en la evidencia actual.
– Espín Jaime B, Díaz Martín JJ, Blesa Baviera LC, Claver Monzón A, Hernández Hernández A, García Burriel JI, et al. Alergia a las proteínas de leche de vaca no mediada por IgE: documento de consenso de la Sociedad Española de Gastroenterología, Hepatología y Nutrición Pediátrica (SEGHNP), la Asociación Española de Pediatría de Atención Primaria (AEPAP), la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP) y la Sociedad Española de Inmunología Clínica, Alergología y Asma Pediátrica (SEICAP). An Pediatr (Barc) 2019; 90: 193.e1-e11.
Artículo de obligada lectura que resume las recomendaciones del documento de consenso elaborado por varias sociedades pediátricas españolas para el diagnóstico y manejo de la APLV en niños menores de 2 años, basado en la última evidencia disponible.
– Groetch MS, Henry M, Feuling MS, Kim J. Guidance for the Nutrition Management of Gastrointestinal Allergy in Pediatrics. J Allergy Clin Immunol Pract. 2013; 1: 323-31.
Artículo muy útil sobre el manejo nutricional y dietético en este tipo de pacientes, con recomendaciones sobre su valoración inicial, la intervención nutricional, con pautas y recomendaciones sugeridas, así como del seguimiento. Incluye, además, de forma muy didáctica, casos clínicos con sugerencias adaptadas a cada uno de los mismos.
| Caso clínico |
|
Anamnesis Historia actual: niña de 2 años y 3 meses que es derivada a consultas de Digestivo desde Atención Primaria por sospecha de reacción adversa a la leche de vaca. Refieren inicio del cuadro clínico 3 meses antes, coincidiendo con un síndrome gripal. Tras el mismo, presenta: deposiciones de consistencia líquida, malolientes, sin productos patológicos, en número de 2-3 al día, junto con vómitos alimentarios intermitentes, 1-2 h tras la toma del biberón de leche de vaca (5-6 vómitos a la semana). Tras valoración por su pediatra, se indicó retirada de proteína de leche de vaca (PLV) de la dieta e inicio de bebida de soja. Con ello, refieren desaparición de la sintomatología con normalización de las deposiciones, pero persistencia de escasa ganancia ponderal. En el momento de la consulta, se encuentra asintomática desde el punto de vista digestivo. Realiza una alimentación variada con ingesta regular del resto de grupos alimentarios. Antecedentes personales: antecedentes pre y perinatales sin incidencias. Desarrollo psicomotor normal, aunque póndero-estatural lento desde los primeros meses de vida. Lactancia artificial desde el nacimiento bien tolerada y diversificación reglada sin incidencias. Inmunizaciones según calendario. Dermatitis atópica, sin otras comorbilidades atópicas. Antecedentes familiares: madre sana sin comorbilidades atópicas. Padre con urticaria crónica, asma leve y psoriasis. Hermano con antecedente de alergia al huevo superada. Exploración física Antropometría: talla: -1.7 DE según OMS; peso: -2.2 DE según OMS; IMC: -2 DE según OMS; estado nutricional (OMS): desnutrición aguda moderada. Buen estado general. Masas musculares algo blandas, escaso panículo adiposo, sin pliegues de adelgazamiento. Bien hidratada y perfundida. Normocoloración cutáneo-mucosa. Piel seca. Exploración abdominal y perianal normal. Resto de exploración sin alteraciones. Pruebas complementarias Analítica sanguínea: leucocitos: 14.6 x 1.000/μL (5-15); Eosinófilos: 2,82 x 1.000/μL (0-0,5), resto de fórmula sin alteraciones. Hemoglobina, coagulación, plaquetas, perfil férrico, vitaminas A, D, E y bioquímica con perfil hepato-renal e iones normales. Inmunoglobulina E total 687 kU/l (0-45), con IgE específicas negativas a leche de vaca, soja, trigo y gluten. Anticuerpos de celiaquía negativos. Endoscopia digestiva alta: macroscópicamente normal. Histológicamente, a nivel de mucosa duodenal, hiperplasia de las criptas, atrofia parcial de las vellosidades y linfocitosis intraepitelial (40-44 linfocitos/100 enterocitos) encuadrable en grado 3a de la clasificación de Marsh-Oberhuber. Evolución En la valoración inicial, ante el estancamiento ponderal a pesar del inicio de la dieta de eliminación y con los datos antropométricos de desnutrición moderada, se decide realizar endoscopia digestiva alta, en la que se evidencian hallazgos compatibles con enteropatía. En la consulta de revisión, los padres refieren reaparición de la diarrea y de vómitos intermitentes, unos 2 meses tras el inicio de la bebida de soja. Por este motivo, en Urgencias se les indicó retirada de soja de la dieta tras lo que se resolvieron los síntomas. Refieren además en una ocasión aislada transgresión accidental con leche de vaca sin presentar síntomas inmediatos. En la consulta se le indica mantener dieta estricta exenta de PLV y soja, y se revisa a la paciente de forma seriada.
|