|
| Temas de FC |
A.J. Conejo-Fernández*, F.A. Moraga-Llop**
*Hospital Regional Universitario Materno-Infantil, Málaga; Hospital Vithas Xanit Internacional, Benalmádena, Málaga. **Pediatra, Societat Catalana de Pediatria, Barcelona
| Resumen
Las infecciones cutáneas bacterianas constituyen un motivo de consulta frecuente en dermatología pediátrica. La mayoría de las veces son procesos superficiales banales, aunque pueden darse casos de infección profunda con afectación sistémica y riesgo vital. Los microorganismos más frecuentes son: Staphylococcus aureus y Streptococcus pyogenes. Además del mecanismo de invasión directa, estas bacterias pueden producir síndromes sistémicos por producción de toxinas. S. aureus resistente a la meticilina adquirido en la comunidad, no representa actualmente en España un problema de salud pública en la población pediátrica. El diagnóstico de las infecciones cutáneas bacterianas es generalmente clínico y, solo en casos concretos, se recomienda la confirmación microbiológica. El tratamiento es casi siempre empírico. En las infecciones superficiales, suele bastar el tratamiento tópico. En las infecciones complicadas o con afectación del estado general, se recomienda tratamiento antibiótico sistémico. El drenaje quirúrgico puede ser necesario en los casos en que se objetive la formación de abscesos. |
| Abstract
Bacterial skin infections are a frequent presenting complaint in paediatric dermatology. Mostly they are mild superficial infections, although deep tissue involvement with systemic symptoms and life- threatening events may occur. The most common germs involved are Staphylococcus aureus and Streptococcus pyogenes. In their pathogenesis, they mainly produce local invasion, but can also cause systemic syndromes via the secretion of toxins into the blood. Community – acquired methicillin – resistant S. aureus is not currently a public health concern in the paediatric population in Spain. |
Palabras clave: Infección cutánea; Staphylococcus aureus; Streptococcus pyogenes; Antibióticos
Key words: Skin infection; Staphylococcus aureus; Streptococcus pyogenes; Antibiotics
Pediatr Integral 2016; XX (3): 179-188
Enfermedades bacterianas de la piel
Introducción
La mayoría de las infecciones cutáneas bacterianas son procesos leves, aunque pueden darse casos con afectación cutánea profunda y sistémica.
Las infecciones bacterianas cutáneas constituyen el motivo más frecuente de consulta en dermatología pediátrica. En la mayoría de casos, son infecciones leves, como el impétigo o la foliculitis. A veces, son infecciones con capacidad invasora local y repercusión sistémica, pudiendo poner en peligro la vida del paciente (fascitis necrotizante). Los principales factores de riesgo son: el deterioro de la integridad de la piel, la falta de higiene, el hacinamiento, la humedad y las inmunodeficiencias.
Se pueden clasificar en: primarias, cuando suceden sobre una piel previamente sana; secundarias o sobreinfecciones, cuando se producen sobre lesiones cutáneas preexistentes; y las infecciones mediadas por toxinas. También, se pueden dividir según la localización anatómica de las lesiones o de la estructura de la piel o los anejos afectados (Tabla I).
Figura 1. Adenoflemón.
Etiopatogenia
Los microorganismos más frecuentes son: Staphylococcus aureus y Streptococcus pyogenes, que pueden producir invasión local directa y síndromes sistémicos mediados por toxinas.
Las bacterias más frecuentes son: S. aureus y S. pyogenes. Pueden producir infecciones cutáneas por: inoculación directa, invadiendo territorios de piel sana; por diseminación hematógena; y mediante la producción de toxinas que se liberan al torrente sanguíneo desde el foco de infección(1), como en el síndrome estafilocócico de la piel escaldada por S. aureus y en el síndrome del shock tóxico estafilocócico o estreptocócico (Tabla II).
El S. aureus resistente a la meticilina adquirido en la comunidad (SAMR-AC), pese a ser un microorganismo emergente en los últimos años, es todavía infrecuente en España y no constituye, por el momento, un problema sanitario.
Principales infecciones cutáneas bacterianas
En general, el diagnóstico es fundamentalmente clínico. En los casos con afectación sistémica, factores de riesgo del huésped y en algunas infecciones concretas, sí se recomienda la realización de pruebas complementarias.
Impétigo
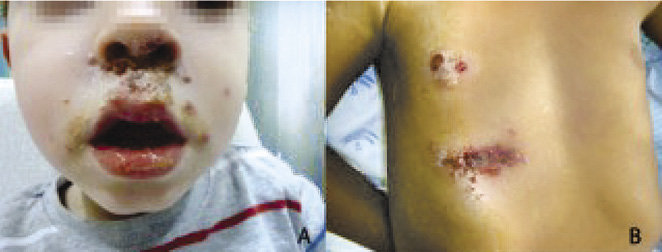
Puede aparecer a cualquier edad y se contagia por autoinoculación, contacto directo o a través de objetos contaminados. Se trata de lesiones epidérmicas no cicatriciales, bien delimitadas, generalmente en zonas expuestas. Puede ser bulloso o no bulloso. En la forma no bullosa, causada por S. pyogenes, S. aureus (solo o como coinfección) y, ocasionalmente, por estreptococos de los grupos C y G, las lesiones evolucionan de mácula a pápula, vesícula, pústula y terminan en costras melicéricas gruesas (Fig. 2).
Figura 2. Impétigo contagioso no bulloso: costras melicéricas (A y B).
En la forma bullosa, causada por S. aureus productor de toxina exfoliativa, las lesiones evolucionan a vesículas y estas, a bullas de contenido amarillento, más o menos turbio e incluso purulento, y con una costra fina (Fig. 3).
Figura 3. Impétigo bulloso estafilocócico (A y B).
La principal complicación es la propagación local (celulitis, linfadenitis) o, excepcionalmente, sistémica (neumonía, osteoartritis, sepsis)(1).
El diagnóstico es fundamentalmente clínico, aunque puede confirmarse con el cultivo del exudado de las lesiones en casos de afectación extensa o mala evolución clínica con los tratamientos habituales.
Dermatitis perianal bacteriana
Cursa con un eritema alrededor del ano y está causada por S. pyogenes o, con menos frecuencia, por S. aureus, solo o asociado al anterior(2). Presenta un pico de incidencia a los 3-5 años de edad y predomina en los varones (70%)(3).
Se manifiesta como un eritema perianal no elevado de unos 2-3 cm, de bordes bien delimitados, que puede asociar: prurito, defecación dolorosa, estreñimiento, incontinencia por rebosamiento, hematoquecia y fisuras(4). En los niños, puede asociarse a balanopostitis, y en las niñas, a vulvovaginitis (la llamada enfermedad perineal bacteriana). No suele producir síntomas generales. En la fase aguda (menos de 6 semanas de evolución), la lesión es roja, brillante, húmeda, dolorosa y puede presentar una pseudomembrana blanquecina. Sin tratamiento, las lesiones se cronifican, con fisuras dolorosas, secreción mucosa o placas psoriasiformes con costra periférica amarillenta.
El mecanismo de transmisión es por contacto, ya sea por autoinoculación (infección o portador asintomático faríngeo o cutáneo) o por contagio intrafamiliar, en especial, si se comparte el agua de la bañera o si algún familiar ha padecido faringoamigdalitis aguda o dermatitis perianal(3).
El diagnóstico se establece por la clínica y la confirmación es bacteriológica. Deben recogerse muestras de la zona perianal en todos los pacientes y muestras faríngeas para realizar un test de diagnóstico rápido (TDR) antigénico de S. pyogenes (valor predictivo positivo del 100%)(3) o un cultivo. Deben investigarse posibles casos en convivientes y realizar un TDR o un cultivo a los pacientes sintomáticos, ya que constituyen una causa frecuente de recurrencias dentro del núcleo familiar.
Se recomienda el uso de antibióticos sistémicos en todos los casos (Algoritmo 1). La duración del tratamiento debe ser de entre 14 y 21 días, siendo recomendable confirmar la erradicación de la infección tanto clínica como microbiológica, mediante el cultivo o el TDR. Las recurrencias tras el tratamiento con penicilina o amoxicilina son frecuentes (hasta el 37%)(5), sobre todo, si hay casos familiares no diagnosticados. En estas recurrencias se recomienda cefuroxima(5) durante 7-10 días. La asociación de tratamiento oral y tópico parece disminuir las recurrencias(2).
Infecciones de los folículos pilosos: foliculitis, forúnculo y ántrax
El principal agente causante de las infecciones de los folículos pilosos es S. aureus, seguido de los bacilos gramnegativos. Son factores predisponentes: la obesidad, la diabetes, la hiperhidrosis, la inmunosupresión y la dermatitis atópica.
Se trata de lesiones centradas por pelos en la cara, el cuello, las axilas o los glúteos, que evolucionan desde una pápula-vesícula con base eritematosa (foliculitis, que afecta al folículo piloso superficial), pasando por nódulos eritematosos pustulosos dolorosos (forúnculo, que se extiende a la dermis profunda), hasta placas eritematosas calientes y dolorosas (ántrax, que afecta al tejido celular subcutáneo circundante).
El diagnóstico es clínico y solo se recomienda el estudio microbiológico en lesiones de mala evolución o atípicas(6).
Además del tratamiento antibiótico tópico o sistémico, se recomienda aplicar calor local en los forúnculos y ántrax, y valorar la realización de drenaje quirúrgico.
Linfangitis aguda bacteriana
Se define como la inflamación de los vasos linfáticos del tejido celular subcutáneo. Los microorganismos más frecuentemente implicados son: S. pyogenes, S. aureus y Pasteurella multocida (esta última tras la mordedura animal). Suele haber afectación sistémica, incluso antes de que sean evidentes el característico cordón lineal inflamatorio, desde su origen hasta los linfáticos regionales, y el edema distal.
Erisipela
Es una infección superficial que afecta a la dermis superior, el tejido celular subcutáneo y, a veces, al sistema linfático, causada en la mayoría de los casos por S. pyogenes o, también, por estreptococos de los grupos B, C o G (1,7-11).
Son factores desencadenantes: las abrasiones, las úlceras, las infecciones fúngicas intertriginosas de los pies, la obstrucción venosa o linfática y el edema crónico. En el recién nacido, la infección puede originarse en el cordón umbilical y extenderse a la pared abdominal.
El comienzo es agudo, con una placa eritematosa de bordes bien definidos y ligeramente elevados. Ocurre con mayor frecuencia en los miembros inferiores y en la cara y puede asociarse con linfadenitis regional. Suele haber síntomas generales (fiebre, escalofríos, malestar), a veces, precediendo a los signos cutáneos. También, pueden ocurrir complicaciones sistémicas (sepsis, síndrome del shock tóxico estreptocócico, endocarditis, etc.), aunque son raras en los pacientes por lo demás sanos. Cuando la infección se resuelve, produce descamación e hiperpigmentación.
El diagnóstico es clínico. Los pacientes con lesiones mayores de 5 cm o con afectación del estado general, los lactantes y los inmunodeprimidos pueden requerir hospitalización y antibioticoterapia parenteral.
Celulitis
Se trata de una infección aguda que afecta a la dermis y al tejido celular subcutáneo. Son factores predisponentes: los traumatismos, las heridas y las infecciones preexistentes. Aparece como una placa eritematosa, caliente y dolorosa, con límites mal definidos; que, en ocasiones, presenta flictenas, petequias o necrosis local y puede acompañarse de linfadenitis y síntomas sistémicos(10).
Está causada principalmente por S. aureus y S. pyogenes. Otros microorganismos menos frecuentes que se observan en pacientes inmunodeprimidos son: Streptococcus agalactiae y bacilos gramnegativos en neonatos y enterobacterias en pacientes inmunodeprimidos.
La localización puede proporcionar una orientación etiológica: en la región periauricular y la planta del pie con heridas punzantes es más frecuente Pseudomonas aeruginosa y en mordeduras es habitual P. multocida. Las celulitis orbitaria o periorbitaria suelen ser secundarias a una puerta de entrada cutaneomucosa (herida, conjuntivitis) o a una sinusitis y suelen estar causadas por S. aureus, S. pyogenes, S. pneumoniae o H. influenzae.
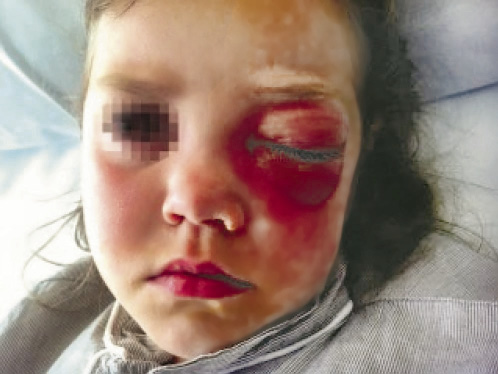
El diagnóstico es clínico, pero se recomienda estudio microbiológico en los casos de mala evolución clínica o que presenten factores de riesgo. La ecografía puede ser útil para diferenciar la celulitis de los abscesos aún no fluctuantes. En el caso de la celulitis orbitaria (Fig. 4), se recomienda confirmar el diagnóstico mediante una prueba de imagen (tomografía computarizada), en la cual se defina la profundidad de la afectación.
Figura 4. Celulitis orbitaria.
Debe recomendarse siempre el tratamiento antibiótico sistémico con cobertura frente a S. aureus y S. pyogenes. En casos leves y bajo estricta vigilancia, puede considerarse la vía oral con amoxicilina-ácido clavulánico, cloxacilina, cefadroxilo, cefalexina, cefuroxima o clindamicina.
Fascitis necrotizante
Se trata de una infección de las partes blandas rápidamente progresiva que afecta: la piel, el tejido celular subcutáneo, la fascia superficial y, en ocasiones, la profunda. Estas lesiones producen una importante necrosis hística, con grave toxicidad sistémica. La mortalidad es alta, y debe sospecharse y tratarse de forma precoz para mejorar el pronóstico.
La localización más frecuente es en los miembros, y su causa puede ser: polimicrobiana (70-80%), por microorganismos aerobios y anaerobios, o monomicrobiana (20-30%), con S. pyogenes como patógeno más frecuente. En el niño suele presentarse en el curso de la varicela o en pacientes que se han sometido a cirugía abdominal(1,8).
Se presenta con eritema, edema, calor, piel brillante e inflamación, con o sin bullas o ampollas, y márgenes mal definidos. En ocasiones, la piel adquiere el aspecto de “piel de naranja”. La presencia de fiebre, de un dolor intenso, desproporcionado a los signos clínicos, así como el aspecto tóxico del niño, debe hacer sospechar una fascitis necrotizante. Cursa con leucocitosis con desviación izquierda y aumento de los valores de los reactantes de fase aguda, con trombocitopenia, anemia y aumento de las enzimas musculares.
La gravedad de la fascitis necrotizante hace que se recomiende siempre la derivación al hospital de referencia para iniciar antibioticoterapia parenteral y valorar el desbridamiento quirúrgico de forma precoz.
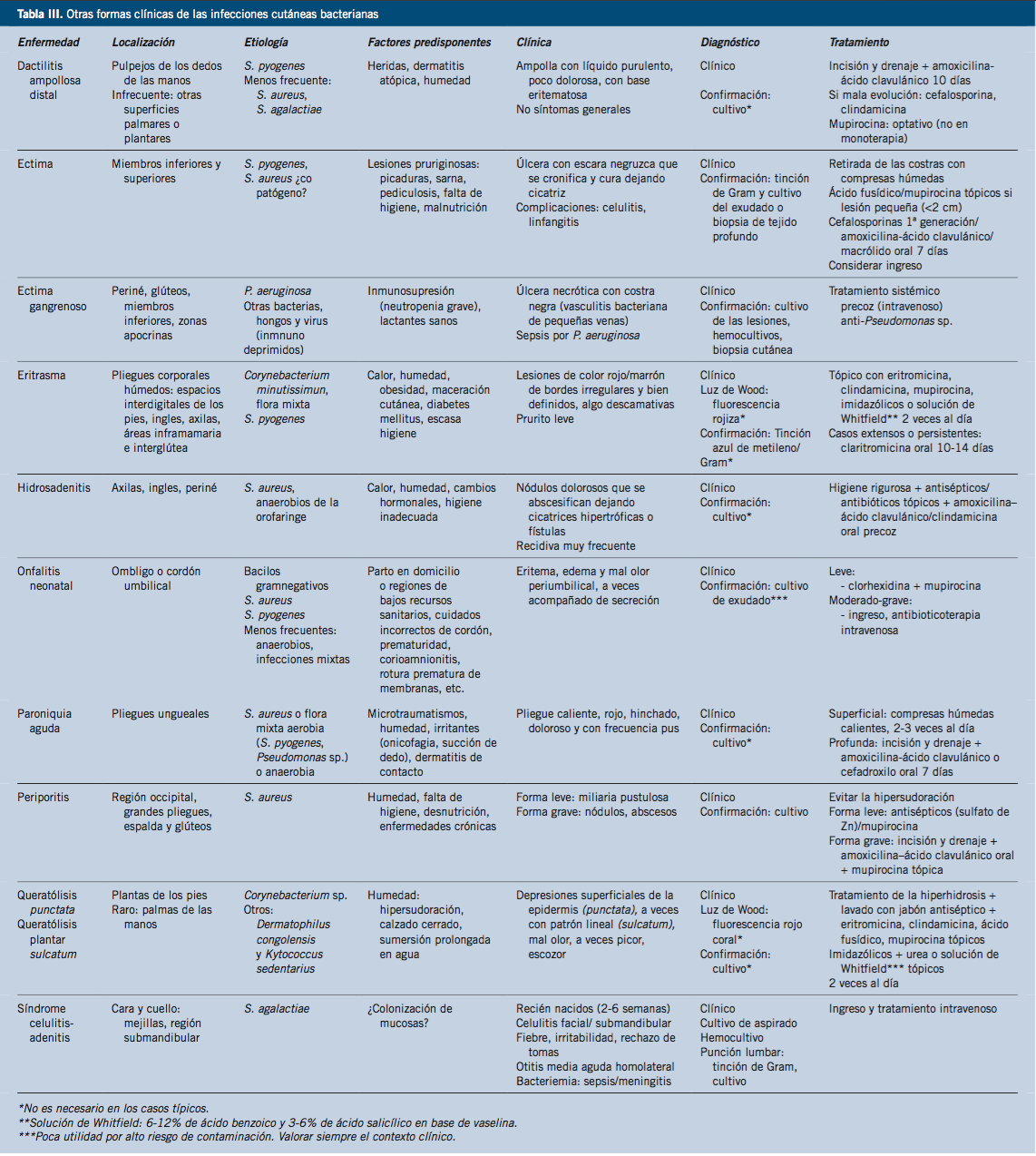
En la tabla III se resumen otros cuadros infecciosos con importancia clínica.
Staphylococcus aureus resistente a la meticilina adquirido en la comunidad (SAMR-AC)
El SAMR-AC es poco frecuente en España en la población pediátrica; por lo que, actualmente, no se recomienda modificar las pautas de antibioticoterapia empírica en las infecciones estafilocócicas.
Epidemiología
El porcentaje de SAMR-AC en la población pediátrica de España oscila entre el 9% y el 14,8%(12-14). Las principales diferencias entre los SARM de adquisición hospitalaria y los SARM-AC se recogen en la tabla IV(13,15,16).
La baja incidencia actual de SARM-AC en nuestro medio, no justifica el cambio de las pautas de antibioticoterapia empírica. Sin embargo, hay circunstancias en las que debe considerarse, como: una celulitis extensa, abscesificada o necrotizante, abscesos recurrentes en el niño o sus convivientes, mala respuesta al tratamiento convencional, procedencia de zonas de alta endemia (Asia, América o Europa del Este) o convivencia con portadores conocidos.
Clínica y diagnóstico
La mayoría de infecciones por SARM-AC se limitan a la piel y los tejidos blandos, aunque pueden causar neumonía, meningitis, sepsis y osteoartritis. No existen criterios clínicos que ayuden a diferenciar las infecciones cutáneas producidas por S. aureus meticilín-sensible de las causadas por SARM(17); si bien, en estas últimas son más frecuentes el fracaso terapéutico y la formación de abscesos y necrosis con costra superficial negruzca, similar a una picadura de araña(18). Si es posible, se recomienda tomar muestras para cultivo, determinación de la leucocidina de Panton-Valentine y caracterización genética de la cepa.
Estudio y tratamiento de los portadores
No se recomienda el estudio sistemático de convivientes, reservándose para brotes en comunidades definidas (familias, instituciones, etc.) y para infecciones recurrentes(18). El tratamiento para la descolonización del niño y sus convivientes portadores se realizará con mupirocina nasal cada 12 horas, y lavados corporales y del cuero cabelludo con jabón de clorhexidina al 4% durante 5-10 días. En caso de fracaso terapéutico con mupirocina, se empleará ácido fusídico tópico cada 12 horas, asociado a trimetoprima-sulfametoxazol oral durante 7 días(18,19).
Tratamiento antibiótico de las infecciones cutáneas
En general, el tratamiento antibiótico de las infecciones cutáneas es empírico. Solo en algunas circunstancias (quimioterapia, neutropenia, inmunodeficiencia grave, heridas por inmersión, mordeduras de animales, afectación del estado general, sospecha de complicaciones, afectación extensa, sospecha de ectima gangrenoso, fascitis necrotizante y pacientes ingresados) o ante una mala evolución, es recomendable realizar hemocultivos o cultivos de aspirados, biopsias o exudados. Para elegir el tratamiento deben considerarse: la clínica, los microorganismos posiblemente implicados, la localización, extensión y profundidad de la infección, y los antecedentes personales(1,19). En la tabla V, se detalla la posología de los antiinfecciosos más empleados.
Las infecciones cutáneas sin síntomas sistémicos que afectan las capas superficiales de la piel (impétigo, foliculitis, etc.) se tratan habitualmente con antisépticos o antibióticos tópicos. Los de mejor cobertura frente a los patógenos habituales son la pomada de mupirocina y la crema o pomada de ácido fusídico. El SARM-AC es generalmente sensible a estos antibióticos tópicos. En infecciones con mala respuesta clínica a la mupirocina, la pomada de retapamulina constituye una alternativa válida a partir de los 9 meses de edad(20).
La antibioticoterapia sistémica se reserva para determinadas formas clínicas (celulitis), formas extensas, de rápida progresión o diseminadas, casos graves o con afectación del estado general (fascitis necrotizante), en recién nacidos, celulitis-adenitis en lactantes menores de 3 meses e inmunodeprimidos. En algunas ocasiones, como en la infección por SAMR-AC, es fundamental el drenaje quirúrgico precoz. El desbridamiento precoz también es uno de los pilares del tratamiento de la fascitis necrotizante.
Si se sospecha S. aureus, el antibiótico de elección es la cloxacilina, si bien, sus características farmacológicas (administración cada 6 horas, baja biodisponibilidad y mal sabor) hacen que sean preferibles la amoxicilina-ácido clavulánico y las cefalosporinas de primera generación (cefadroxilo o cefalexina). En caso de contraindicación para los betalactámicos o infección por SAMR-AC, los fármacos de elección son la clindamicina (aunque en España solo se comercializa en cápsulas de 150 y 300 mg) y la trimetoprima-sulfametoxazol.
Ante la sospecha de infección por S. pyogenes, el antibiótico de elección es la penicilina o la amoxicilina. En los alérgicos a los betalactámicos, pueden usarse macrólidos de 16 átomos (josamicina o midecamicina), clindamicina o, en caso de reacción no anafiláctica, cefalosporinas de primera generación.
En las infecciones en que pueda existir coinfección por S. aureus sensible a la meticilina y S. pyogenes, está indicado el tratamiento con amoxicilina-ácido clavulánico o una cefalosporina de primera generación.
El tratamiento de la fascitis necrotizante debe incluir antibióticos frente a microorganismos aerobios y anaerobios. Una opción es la administración de una cefalosporina de tercera generación y metronidazol o clindamicina. Puede ser útil la administración de inmunoglobulina hiperinmune o el uso de la cámara hiperbárica.
En el momento de la redacción de este documento, ni el cefadroxilo ni la cefalexina, únicas cefalosporinas de primera generación con presentación oral, se comercializan en España en forma de suspensión y solo se dispone de cápsulas de 500 mg. Debido a esta circunstancia, las cefalosporinas de segunda generación (cefuroxima, cefaclor), pese a ser algo menos activas frente a los cocos Gram positivos que las de primera, pueden considerarse alternativas válidas.
Función del pediatra de Atención Primaria
El pediatra de Atención Primaria es el facultativo clave para el diagnóstico de las infecciones cutáneas. Tras considerar los posibles diagnósticos diferenciales, debe establecer una orientación diagnóstica. Probablemente, no siempre dispondrá de medios para estudiar la etiología, pero en las formas más superficiales esto no supone ningún problema para instaurar un tratamiento. En las formas profundas y en las que, por asociarse a alguna enfermedad de base, crea necesario realizar antibioticoterapia por vía intravenosa, deberá derivar el caso con celeridad al centro hospitalario de referencia, en especial si sospecha una fascitis necrotizante.
Agradecimientos
A los coautores del “Documento de consenso SEIP-AEPAP-SEPEAP sobre la etiología, el diagnóstico y el tratamiento de las infecciones cutáneas bacterianas de manejo ambulatorio” (último apartado de la Bibliografía recomendada), publicado en Anales de Pediatría, por su aportación en esta publicación de Pediatría Integral.
Bibliografía
1. Stevens DL, Bisno AL, Chambers HF, et al. Practice guidelines for the diagnosis and management of skin and soft tissue infections: 2014 update by the Infectious Diseases Society of America. Clin Infect Dis. 2014; 59: e10-52.
2. Heath C, Desai N, Silverberg NB. Recent microbiological shifts in perianal bacterial dermatitis: Staphylococcus aureus predominance. Pediatr Dermatol. 2009; 26: 696-700.
3. Echeverría Fernández M, López-Menchero Oliva JC, Marañón Pardillo R, Mínguez Navarro C, Sánchez Sánchez C, Vázquez López P. Aislamiento del estreptococo beta hemolítico del grupo A en niños con dermatitis perianal. An Pediatr (Barc). 2006; 64: 153-7.
4. Lehman R, Pinder S. Streptococcal perianal infection in children. BMJ. 2009; 338: b1517.
5. Meury SN, Erb T, Schaad UB, Heininger U. Randomized, comparative efficacy trial of oral penicillin versus cefuroxime for perianal streptococcal dermatitis in children. J Pediatr. 2008; 153: 799-802.
6. Ensinck GN, Casanueva E, Sguassero Y, Comité Nacional de Infectología de la SAP. Infecciones de la piel y partes blandas en pediatría: consenso sobre diagnóstico y tratamiento. Arch Argent Pediatr. 2014; 112: e96-102.
7. Lawrence HS, Nopper AJ. Superficial bacterial skin infections and cellulitis. En: Long S, Pickering LK, Prober CG, editores. Principles and practice of pediatric infectious diseases. 4th ed. Philadelphia: Churchill Livingstone; 2012. p. 427-35.
8. Jackson MA. Skin infections. Bacterial skin infections. En: Cherry JD, Harrison GJ, Kaplan SL, et al., editores. Feigin and Cherry’s textbook of pediatric infectious diseases. 7th ed. Philadelphia: Elsevier; 2014. p. 772-81.
9. Larru B, Gerber JS. Cutaneous bacterial infections caused by Staphylococcus aureus and Streptococcus pyogenes in infants and children. Pediatr Clin N Am. 2014; 61: 457-78.
10. Santos Sebastián M. Infecciones cutáneas y de partes blandas. En: Cruz Hernández M, director. Tratado de pediatría. 11ª ed. Madrid: Ergon; 2014. p. 761-7.
11. Moraga Llop FA, Tobeña Rue M. Infecciones bacterianas cutáneas y de partes blandas. En: Delgado Rubio A, editor. Enfermedades infecciosas en pediatría. Madrid: McGraw Hill; 2008. p. 651-62.
12. Broseta A, Chaves F, Rojo P, Otero JR. Emergencia de un clon de Staphylococcus aureus resistente a meticilina de origen comunitario en la población pediátrica del sur de Madrid. Enferm Infecc Microbiol Clin. 2006; 24: 31-5.
13. Daskalaki M, Rojo P, Marín-Ferrer M, Barrios M, Otero JR, Chaves F. Panton-Valentine leukocidin-positive Staphylococcus aureus skin and soft issue infections among children in an emergency department in Madrid, Spain. Clin Microbiol Infect. 2010; 16: 74-7.
14. Casado-Verrier B, Gómez-Fernández C, Paño-Pardo JR, et al. Prevalencia de infecciones de piel y tejidos blandos producidas por Staphylococcus aureus resistentes a meticilina comunitario en Madrid. Enferm Infecc Microbiol Clin. 2012; 30: 300-6.
15. Rojo P, Barrios M, Palacios A, Gómez C, Chaves F. Community-associated Staphylococcus aureus in children. Expert Rev Anti Infect Ther. 2010; 8: 541-54.
16. Odell CA. Community-associated methicillin-resistant Staphylococcus aureus (CA-MARSA) skin infections. Curr Opin Pediatr. 2010; 22: 273-7.
17. Jiménez JN, Ocampo AM, Vanegas JM, et al. A comparison of methicillin-resistant and methicillin-susceptible Staphylococcus aureus reveals no clinical and epidemiological but molecular differences. Int J Med Microbiol. 2013; 303: 76-83.
18. Frick MA, Moraga-Llop FA, Bartolomé R, et al. Infecciones por Staphylococcus aureus resistente a meticilina adquirido en la comunidad en niños. Enferm Infecc Microbiol Clin. 2010; 28: 675-9.
19. Liu C, Bayer A, Cosgrove SE, et al. Clinical practice guidelines for the treatment of methicillin-resistant Staphylococcus aureus infections in adults and children. Clin Infect Dis. 2011; 52: 285-92.
20. Rojo Conejo P. Infecciones por estafilococo. En: Cruz Hernández M, director. Tratado de pediatría. 11ª ed. Madrid: Ergon; 2014. p. 771-6.
Bibliografía recomendada
– Hurley HJ, Knepper BC, Price CS, Mehler PS, Burman WJ, Jenkins TC. Avoidable antibiotic exposure for uncomplicated skin and soft tissue infections in the ambulatory care setting. Am J Med. 2013; 126: 1099-106.
Estudio retrospectivo realizado en los EE.UU. sobre población adulta, en el que se objetiva la prescripción innecesaria de antibioticoterapia sistémica en casos de abscesos de bajo riesgo sometidos a drenaje quirúrgico o el uso innecesario de tratamiento antibiótico combinado.
– Clegg HW, Giftos PM, Anderson WE, Kaplan EL, Johnson DR. Clinical perineal streptococcal infection in children: epidemiological features, low symptomatic recurrence rate after treatment, and risk factors for recurrence. J Pediatr. 2015; 167: 687-93.
Revisión retrospectiva de pacientes pediátricos con dermatitis perianal estreptocócica, en la que se describe una tasa de recurrencias de tan solo el 12,4% tras el tratamiento con amoxicilina.
– Barrios-López M, Rojo-Conejo P, Gómez-González C, Cháves-Sánchez F. Infecciones neonatales por Staphylococcus aureus de inicio en la comunidad. Enferm Infecc Microbiol Clin. 2013; 31: 316-8.
Estudio prospectivo observacional español en el que se describen los casos de infección neonatal por Staphylococcus aureus en el servicio de urgencias pediátricas de un hospital terciario y se evidencia su todavía baja incidencia en este grupo de edad, con solo 30 casos registrados en 3 años. Únicamente uno de los aislamientos fue resistente a la meticilina.
– Miller LG, Daum RS, Creech CB, et al. Clindamycin versus trimethoprim-sulfamethoxazole for uncomplicated skin infections. N Engl J Med. 2015; 372: 1093-103.
Estudio multicéntrico prospectivo aleatorizado y doble ciego realizado en los EE.UU. en población adulta y pediátrica, en el que no se encuentran diferencias en la eficacia de ambos antibióticos en casos de celulitis o abscesos cutáneos.
– Conejo-Fernández AJ, Martínez-Chamorro MJ, Couceiro JA, et al. Documento de consenso SEIP-AEPAP-SEPEAP sobre la etiología, el diagnóstico y el tratamiento de las infecciones cutáneas bacterianas de manejo ambulatorio. An Pediatr (Barc). 2016; 84: 121.e1-121.e10.
Documento de consenso de tres sociedades científicas pediátricas (una de infectología y dos de Atención Primaria), sobre las infecciones cutáneas bacterianas desde la perspectiva de la Atención Primaria.
| Caso clínico |
|
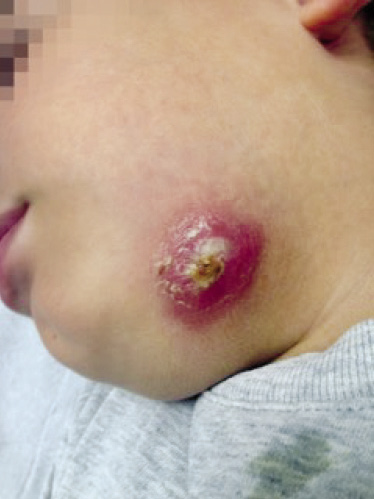
Paciente varón de 4 años de edad, previamente sano y sin antecedentes de interés, que acude a la consulta por presentar desde hace 48 horas una lesión, en el antebrazo derecho, eritematosa, dolorosa, caliente, de bordes discretamente difusos y con aparición de una flictena central durante las últimas 12 horas (Fig. 5). A la exploración, además de evidenciar los hallazgos referidos, se constata una zona de induración central. Se inicia tratamiento empírico con amoxicilina-clavulánico y se cita de nuevo al paciente en 48 horas para comprobar la evolución. En la segunda visita, se objetiva la no mejoría de los signos inflamatorios locales, con aumento de tamaño de la zona de induración central, en la que han aparecido signos de flogosis incipiente. Además, ha iniciado febrícula de hasta 37,5ºC axilar. El cumplimiento terapéutico y la tolerancia oral al antibiótico han sido correctos según nos refiere la familia. El paciente acude a Urgencias hospitalarias, donde se le realiza el drenaje del absceso y, al haber sido este incompleto, se le inicia tratamiento antibiótico con clindamicina. Dos días después de la realización del drenaje y el inicio del tratamiento antibiótico, acude nuevamente a su consulta para una revisión clínica. Los signos locales han mejorado sensiblemente y la febrícula ha desparecido. Algunos días después, usted recibe la confirmación microbiológica de que se trataba de un SAMR-AC. La evolución posterior del caso sigue siendo positiva hasta su resolución y no hay nuevas incidencias al respecto en las sucesivas visitas de control. Figura 5.
|