 |
| Regreso a las bases |
L.M. Rodríguez Fernández
Jefe de Sección. Unidad de Nefrología Pediátrica. Servicio de Pediatría. Complejo Asistencial Universitario de León (CAULE)
Pediatr Integral 2013; XVII(6): 433-440
Morfología y función renal
Introducción
El riñón es un órgano par situado en la parte alta de la región retroperitoneal, a ambos lados de los grandes vasos paravertebrales a los que se une por su pedículo vascular, y provisto de un conducto excretor, el uréter, que desemboca en la vejiga urinaria. Está formado por una serie de estructuras vasculares y epiteliales que funcionan en relación estrecha y que lo convierten en el órgano primordial del sistema urinario. Este sistema es el encargado de formar la orina y de eliminarla del cuerpo. La secreción de orina y su eliminación son cometidos vitales, pues constituyen en conjunto uno de los mecanismos básicos de la homeostasis del medio interno; hasta el punto de que, como se ha dicho, la composición de la sangre y del medio interno está regida, no por lo que se ingiere, sino por lo que los riñones conservan.
Además de desempeñar este papel esencial, el riñón tiene la capacidad de producir hormonas y autacoides (sustancias que actúan en el lugar en el que se producen), como la eritropoyetina, la renina o las prostaglandinas, que tienen gran influencia sobre el control de la tensión arterial, el metabolismo óseo o la formación de glóbulos rojos, y que lo convierten también en un órgano endocrino.
Las funciones que realiza el riñón son posibles gracias a su morfología. Para alcanzar una comprensión elemental de la fisiología renal, es indispensable disponer de un conocimiento suficiente de las estructuras en las que tienen lugar los distintos procesos en los que participa este órgano.
Morfología renal
Anatomía macroscópica(1)
Dimensiones, forma y localización
Los riñones tienen característicamente forma de habichuela y en la edad adulta llegan a pesar una media de 140 a 150 g y a medir longitudinalmente un promedio de 11,5 cm. En general, el riñón izquierdo es algo más voluminoso que el derecho. Durante la infancia van aumentando de tamaño; de forma que, en los niños, su longitud se correlaciona muy directamente con la talla. En las figuras 1 y 2, procedentes del estudio de Gavela y cols., se presentan los valores que va adquiriendo la longitud de cada uno de los riñones en relación con la talla de los niños(2).
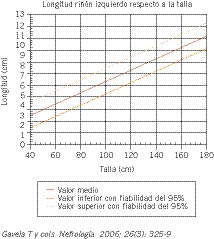
Figura 1. Valor normal del tamaño del riñón izquierdo según la talla.
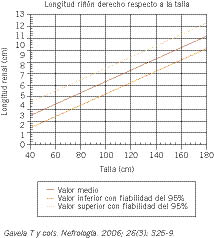
Figura 2. Valor normal del tamaño del riñón derecho según la talla.
Los riñones están situados detrás del peritoneo parietal contra la pared posterior del abdomen, un poco por fuera de las apófisis transversas de la 11ª y 12ª vértebras dorsales y las dos primeras vértebras lumbares, dentro de una celda celuloadiposa cerrada, limitada por una fascia perirrenal de tejido conectivo, que los fija a las estructuras adyacentes y ayuda a que conserven su situación normal, con el eje mayor algo inclinado hacia fuera. Por el lugar que ocupa el hígado, el riñón derecho se ve desplazado un poco más abajo que el izquierdo.
Estructura externa(1,3)
Cada riñón está rodeado por una cápsula resistente de tejido fibroso blanquecino que se interrumpe a nivel del hilio renal, una concavidad situada en su borde interno, por la que penetran en el riñón el uréter y los vasos sanguíneos.
Aunque hay un gran número de variaciones individuales en la vascularización renal, cada riñón está irrigado por una arteria renal que se origina de la aorta y que, poco antes de llegar al hilio, se bifurca en sus ramas anterior y posterior. Las venas renales se sitúan por delante de las arterias y desembocan en la vena cava inferior.
Estructura interna(1,3)
Al practicar la hemisección de los riñones a lo largo de su eje mayor, es posible observar que están formados por dos tipos de sustancia: la capa externa granulosa, corteza, y la porción interna o central de aspecto estriado, médula (Fig. 3). Esta última queda dividida en una docena o más de cuñas triangulares, las pirámides renales de Malpighi. La base de estas pirámides está orientada hacia la corteza y su vértice, orientado hacia el seno renal, forma unas eminencias redondeadas que protruyen en los cálices, denominadas papilas renales. La corteza se prolonga entre dos pirámides adyacentes, en formaciones que se llaman columnas renales de Bertin.
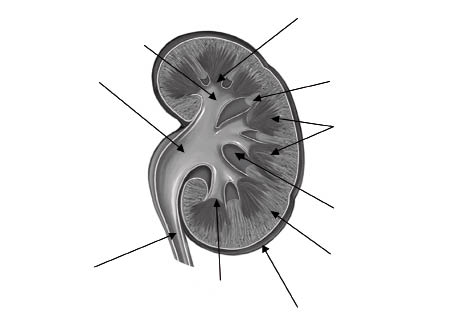
Figura 3. Aspecto macroscópico del corte frontal de un riñón.
El seno renal es una cavidad cuya abertura coincide con el hilio renal y cuyas paredes están constituidas por el parénquima renal. Contiene, en un tejido celuloadiposo, las ramificaciones de los vasos, los nervios y los primeros segmentos del aparato excretor urinario: los cálices y la pelvis renal.
Anatomía microscópica
La nefrona es la unidad estructural y funcional del riñón y comprende un elemento filtrante (corpúsculo renal de Malpighi) y un túbulo renal (Fig. 4). Se estima que cada riñón de un sujeto adulto sano contiene un millón de nefronas.
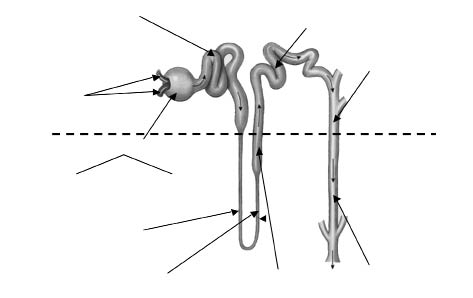
Figura 4. Descripción esquemática de la nefrona (las flechas en el interior de los túbulos indican la dirección del flujo).
Corpúsculo renal(1,3)
El corpúsculo renal de Malpighi está compuesto por el glomérulo capilar y la cápsula de Bowman que lo recubre (Fig. 5). Existe un espacio dentro de la cápsula, espacio de Bowman, hacia donde pasa el líquido filtrado procedente del glomérulo. La barrera de filtración del corpúsculo renal o membrana glomerular consta de tres capas: el endotelio de los capilares glomerulares, la membrana basal y una capa de células epiteliales especializadas con fenestraciones. Las células mesangiales se sitúan en la parte central del glomérulo entre las asas capilares, a veces penetrando en ellas de forma que conectan íntimamente con la célula endotelial. Estas células tienen función contráctil, gracias a los filamentos de actina y miosina, que les permiten regular el coeficiente de ultrafiltración en respuesta a distintos agonistas. Además, tienen capacidad fagocítica y pueden sintetizar y degradar la matriz extracelular. Intervienen también en la síntesis de determinados autacoides y factores de crecimiento que pueden actuar de forma autocrina y paracrina.
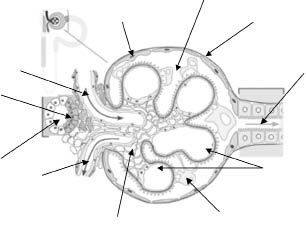
Figura 5. Esquema de un corpúsculo renal.
Túbulos renales(1,3)
El túbulo renal comienza con el túbulo próximal que inicialmente forma varias espiras (porción convoluta del túbulo proximal o túbulo contorneado proximal), seguida de una porción recta. El siguiente segmento es la rama delgada descendente del asa de Henle, que posee una morfología en horquilla, comenzando en su final con un ascenso paralelo a la rama descendente. En las asas largas, la primera porción de la zona ascendente permanece delgada, denominándose rama delgada ascendente del asa de Henle. Más allá de esta región, las asas largas se ensanchan en la rama ascendente gruesa del asa de Henle, en cuya parte final existe una zona engrosada denominada mácula densa, en la que el túbulo transcurre entre las arteriolas que irrigan su propio glomérulo. Tras ella comienza la parte convoluta del túbulo distal o túbulo contorneado distal que, a través de los conductos conectores, llega a los tubos colectores corticales que entran en la médula, convirtiéndose en tubos colectores medulares externos e internos. Estos últimos se unen a otros y todos los de una pirámide renal convergen para formar una estructura que desemboca en la papila renal en uno de los cálices menores.
Aparato yuxtaglomerular(1,3)
Está situado entre la primera porción del túbulo contorneado distal y las arteriolas aferente y eferente, pertenecientes al corpúsculo renal de su propia nefrona (Fig. 5). Lo componen tres tipos de células: las células yuxtaglomerulares, que son células mioepiteliales que rodean el final de la arteriola aferente, ricas en gránulos de secreción y que secretan el 90% de la renina; las células de la mácula densa, un tipo de células epiteliales diferenciadas de la pared del túbulo recto distal ascendente que en esta zona de contacto con el glomérulo, se vuelven más altas y estrechas, controlan la secreción de renina y la velocidad de filtración glomerular, y las células de Goormaghtigh o del lacis, que son células mesangiales extraglomerulares que responden a múltiples mediadores y controlan la superficie de filtrado.
El corpúsculo renal y los túbulos contorneados se encuentran en la corteza renal; en cambio, el asa de Henle y la mayor parte de los túbulos colectores se sitúan en la médula renal.
Ultraestructura de la barrera de filtración glomerular
La barrera de filtración glomerular es una barrera molecular situada entre la sangre y el espacio urinario capaz de evitar el paso, a su través, de la mayoría de las proteínas plasmáticas, pero que permite el paso del agua, de pequeñas moléculas de soluto y de iones. Está formada por tres capas: el endotelio vascular fenestrado, la membrana basal glomerular y la hendidura del poro y la zona que queda entre los pedicelos de los podocitos (Fig. 6).
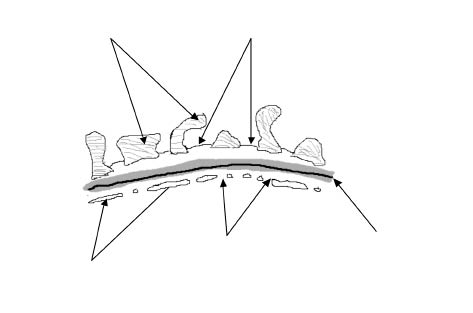
Figura 6. Esquema de la barrera de filtración glomerular.
Endotelio vascular(1,3,4)
Está constituido por células de citoplasma aplanado, perforadas por poros o fenestraciones de 70-100 nm de diámetro, cuya superficie está cargada negativamente por la presencia de una proteína polianiónica, la podocalixina. La aglomeración de moléculas superficiales aniónicas y fenestraciones hace que el endotelio glomerular se diferencie de otras membranas plasmáticas endoteliales y permita el paso de moléculas de bajo peso molecular; aunque, no es muy eficiente para impedir el paso de macromoléculas.
Membrana basal glomerular(1,3)
La membrana basal glomerular impide el paso de macromoléculas en forma mecánica y eléctrica. Su integridad estructural es clave para el mantenimiento de la función de permeabilidad de la barrera al agua, pequeños solutos, iones y proteínas menores de 70 KDa. Está compuesta por dos capas finas, la lámina rara interna y la lámina rara externa, y una capa central gruesa, la lámina densa. Las células endoteliales y epiteliales adyacentes secretan moléculas tales como colágeno tipo IV, laminina, fibronectina y proteoglicanos de heparán sulfato, dando lugar a una estructura semejante a un enrejado.
Podocito y poro de filtración glomerular(1,3)
El tercer elemento de la barrera de filtración glomerular lo constituyen las células epiteliales viscerales o podocitos, encargados de sintetizar la membrana basal glomerular y formar los poros de filtración. Los podocitos son células muy diferenciadas que expresan una serie de proteínas específicas, indispensables para el mantenimiento de la compleja estructura de la barrera de filtración con los procesos pedicelares interdigitados (pedicelos) y los diafragmas de hendidura, pequeñas hendiduras cubiertas por una película proteica.
La superficie del podocito podría ser dividida, sin entrar en demasiado detalle, en tres dominios con diferentes localizaciones, componentes proteicos y funciones. En cada dominio existen proteínas, que son fundamentales para el mantenimiento y estabilidad global de la arquitectura del podocito. En el dominio apical encontramos podocalixina, ezrina y el complejo NHERF-2, que cubren la superficie del podocito. En el dominio del diafragma de filtración se encuentra la principal responsable de la de selectividad del diafragma, la nefrina. A este nivel, también encontramos P-cadherina, neph-1, podocina, filtrina, etc. El dominio basal o de anclaje es el encargado de fijar al pedicelo a la membrana basal glomerular, y en él encontramos el complejo distroglicano, el complejo integrina a3 b1 y la megalina(4).
Función renal
La función básica del riñón es la formación de orina para su eliminación a través del sistema excretor urinario. Dos procesos distintos determinan esta formación: la filtración de líquido a través de los capilares glomerulares hacia el espacio de Bowman y la modificación del volumen y de la composición del filtrado glomerular en los túbulos renales.
Filtrado glomerular(5,6)
El líquido pasa de los capilares glomerulares a la cápsula de Bowman por la existencia de un gradiente de presión entre estas dos áreas. Este proceso está favorecido por dos características estructurales que convierten los corpúsculos renales en membranas de filtración especialmente eficaces: los capilares glomerulares tienen un número de poros mucho mayor que otros capilares y la arteriola eferente tiene un diámetro menor que la aferente, provocando una mayor resistencia a la salida del flujo sanguíneo del glomérulo y aumentando la presión hidrostática glomerular. En condiciones normales se producen 120 ml/minuto o 180 l/día de filtrado. La tasa de filtración glomerular está determinada, además de por la diferencia de presión en el capilar glomerular, por el flujo plasmático renal y por el coeficiente de ultrafiltración glomerular, dependiente del área de filtración y de la permeabilidad de la membrana a través de la que ésta se produce.
Presión efectiva de filtración
La presión efectiva de filtración (PEF) es el resultado de la interacción de presiones a través de la membrana capilar glomerular, de acuerdo con la siguiente ecuación: PEF = (Presión hidrostática glomerular + Presión osmótica capsular) – (Presión osmótica glomerular + Presión hidrostática capsular).
La presión hidrostática glomerular es la fuerza impulsora fundamental del filtrado y tiende a expulsar líquido de los glomérulos; mientras que, la presión hidrostática capsular y la presión coloidosmótica sanguínea actúan en dirección opuesta. En sujetos sanos, la presión oncótica en la cápsula de Bowman debe ser cero, porque el filtrado glomerular no contiene proteínas. La presión hidrostática glomerular guarda cierta relación con la tensión arterial sistémica. La pérdida urinaria de proteínas aumenta inicialmente la tasa de filtrado glomerular al descender la presión osmótica sanguínea y aumentar la presión osmótica capsular.
Flujo plasmático renal
El flujo a través de un órgano depende de la presión de perfusión y de la resistencia al paso del mismo. Así, cambios en la presión producirían cambios en el mismo sentido en el flujo sanguíneo renal. Sin embargo, esto está modulado por la existencia de un sistema de autorregulación intrínsecamente renal que se produce incluso en ausencia de estímulos nerviosos u hormonales y que mantiene constante el flujo plasmático renal dentro de un rango de tensión arterial mediante modificaciones en la resistencia al flujo. El lugar principal donde se ejerce esta autorregulación es la arteriola aferente a través de dos mecanismos:
• Mecanismo miogénico: el estiramiento de la pared vascular, causado por aumento de presión, provoca contracción de su músculo liso e incremento de la resistencia al flujo.
• Retroacción tubuloglomerular: mantiene constante el flujo plasmático renal mediante modificación primaria de la tasa de filtración glomerular; de forma que, cuando existe un aumento de la tensión arterial, se produce inicialmente un aumento del flujo plasmático renal y se elevan la tasa de filtración glomerular, la velocidad del flujo y la oferta de sodio a través del túbulo. La mácula densa detecta estos cambios, desencadenando la producción de sustancias vasoconstrictoras (adenosina, ATP…) que actúan sobre la arteriola aferente disminuyendo el flujo plasmático renal al nivel basal. Sucede lo contrario en las situaciones de hipotensión.
El objetivo básico de la autorregulación renal es mantener un adecuado balance de líquido y sodio en el organismo, así como la preservación de la estructura glomerular.
Coeficiente de ultrafiltración glomerular
Finalmente, la tasa de filtración glomerular depende del coeficiente de ultrafiltación glomerular, que se expresa como el producto de la constante de permeabilidad hidráulica de la pared glomerular por la superficie disponible para la filtración. La permeabilidad de la membrana puede verse afectada en diferentes patologías glomerulares y el área de filtración puede sufrir modificaciones por contracción mesangial o en respuesta a sustancias vasoactivas, cuyo efecto permite al glomérulo modificar la superficie de filtración, tanto en condiciones normales como patológicas.
La función renal en el feto se caracteriza por una baja tasa de filtración glomerular determinada por una tensión arterial y un flujo plasmático renal bajos, un área de filtración menor y unas elevadas resistencias vasculares renales. Sin embargo, tras el nacimiento la función renal aumenta debido al ascenso de la tensión arterial y al importante descenso de las resistencias vasculares renales (Tabla I)(7).
Función tubular renal(5,8)
El ultrafiltrado glomerular es modificado en los túbulos renales por dos procesos: la reabsorción y la secreción tubulares.
• Reabsorción tubular: recuperación de solutos y de la mayor parte del agua filtrada en los glomérulos desde el fluido tubular hacia la sangre de los capilares peritubulares.
• Secreción tubular: adición de solutos al fluido tubular desde la sangre de los capilares peritubulares o desde las células tubulares.
El complejo equilibrio entre estos dos procesos, en ocasiones regulado por influjo hormonal y que se revisará a continuación someramente, posibilita la formación de orina con unas características determinadas y mantiene estable la composición del medio interno. De esta forma, entre el 97 y el 99% del agua y una parte importante de los solutos filtrados en el glomérulo volverán a la sangre y no formarán parte de la orina.
Manejo renal de sodio, cloro y agua
• En el túbulo proximal se produce reabsorción del sodio (Na+) filtrado, acompañado de un anión para mantener la electroneutralidad (75% Cl- y 25% HCO3-); también, se reabsorbe buena parte del agua filtrada gracias a la fuerza osmótica generada por la absorción de Na+ (Fig. 7).
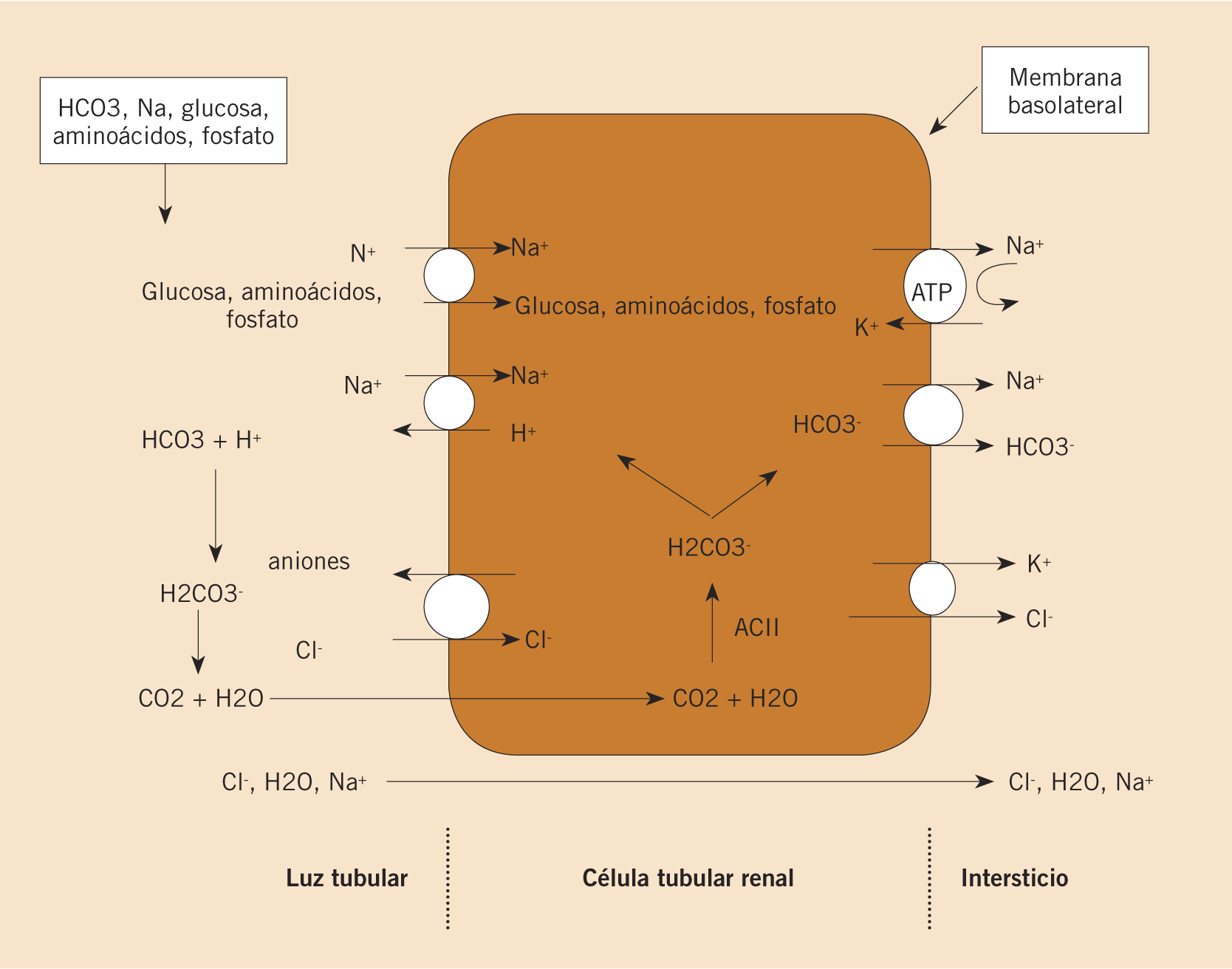
Figura 5. Esquema de un corpúsculo renal.
• En la rama ascendente gruesa del asa de Henle, el Na+ y el Cl- son trasportados activamente desde la luz tubular por el cotransportador Na+-K+-2Cl- (NKCC2) en la membrana apical. Esta reabsorción de Na+ y Cl- sin reabsorción de agua aumenta la osmolaridad del intersticio, promoviendo la salida de agua de las asas descendentes del asa de Henle. A medida que asciende, la luz tubular de la rama ascendente gruesa del Asa de Henle se va volviendo hipotónica y, a nivel de la corteza, está diluida con respecto al plasma. El intersticio medular alcanza su mayor osmolaridad en la zona más profunda.
• En la parte convoluta del túbulo distal y en los conductos conectores existe reabsorción activa de Na+ y Cl- a través de un cotransportador Na+/Cl- activado por la aldosterona y por el aumento en la ingesta de sal.
• En los tubos colectores corticales, la reabsorción de Na+ se produce por canales de Na+ (ENaC) en las células principales sensibles a la acción de la aldosterona.
• El transporte de agua en los segmentos distales de la nefrona está sujeto a un estricto control fisiológico. Así, cuando la osmolaridad del plasma aumenta, los receptores hipotalámicos responden liberando hormona antidiurética (ADH) que se une a los receptores V2 en la membrana basolateral de los tubos conectores y colectores e induce la inserción en la membrana apical de canales para el agua (acuaporina 2), causando reabsorción de agua desde la luz tubular a medida que los túbulos colectores se dirigen hacia la papila, descendiendo a través del intersticio hiperosmótico. En ausencia de ADH no se produce reabsorción de agua a este nivel, por lo que la orina es muy diluida.
En resumen, el 65% del Na+, Cl- y agua filtrados se reabsorben en el túbulo proximal, el 20%, en la rama ascendente gruesa del asa de Henle, el 10%, en la parte convoluta del tubo distal y un 3-5%, en los conductos colectores.
Manejo renal del potasio
El K+ se filtra libremente en el glomérulo.
• El 50-60% del K+ filtrado se reabsorbe en el túbulo proximal de forma pasiva vía paracelular siguiendo la reabsorción de agua y Na+.
• En la rama ascendente gruesa del asa de Henle, la reabsorción de K+ se lleva a cabo por el cotrasportador NKCC2 (25% del K+ filtrado). El Na+ que entra en la célula es enviado al intersticio por la Na+/K+ ATPasa; mientras que, parte del K+ reabsorbido es reciclado a la luz tubular mediante canales ROMK. Además, la secreción tubular de K+ crea un gradiente eléctrico que favorece su reabsorción paracelular.
• La nefrona distal es el lugar más importante de la regulación renal de K+. Aquí el Na+ difunde pasivamente al interior de la célula principal por los canales ENaC apicales, siendo trasportado posteriormente al intersticio por la Na+/K+ ATPasa, lo que aumenta la concentración intracelular de K+, creando un gradiente que favorece su difusión a la luz tubular a través de canales selectivos. Existen también canales basolaterales de K+ que lo reciclan al intersticio, manteniendo la eficiencia de la Na+/K+ ATPasa. Además de esta secreción de K+ por las células principales, la nefrona distal es capaz de reabsorber K+ en situaciones de depleción del mismo o de acidosis metabólica a través de la acción de la H+/K+ ATPasa de las células intercaladas.
En contraste con otros iones, los cambios en la excreción urinaria de K+ son determinados principalmente por cambios en su secreción tubular y no por cambios en la reabsorción y filtración. La excreción urinaria de K+ en la nefrona distal se eleva en respuesta a diferentes factores, como son la mayor oferta de Na+, la mayor velocidad de flujo en el tubo distal que ocurren, por ejemplo, durante la expansión del volumen extracelular, acidosis metabólica y, sobre todo, en presencia de aldosterona, su regulador hormonal más potente.
Control renal del equilibrio ácido-base
• En el túbulo proximal (donde se reabsorbe un 80% del HCO3- filtrado), la anhidrasa carbónica (AC) intracelular cataliza la formación de HCO3- y H+. Los H+ salen a la luz tubular mediante el transportador NHE3 intercambiándose por Na+ reaccionando con el HCO3- filtrado formando ácido carbónico (H2CO3-) que, por acción de la AC de la membrana apical, se escinde en agua y CO2. Mientras, el HCO3- pasa al intersticio por intercambio con Cl- o en simporte con Na+.
• El mecanismo de reabsorción de HCO3- en la rama ascendente gruesa del asa de Henle y en los túbulos distales es similar (aproximadamente un 15%).
• En los túbulos colectores corticales, las células intercaladas son las responsables de la secreción de H+ a la luz tubular gracias a la existencia de una H+-ATPasa y una H+/K+-ATPasa apicales. El HCO3- reabsorbido (4%) sale de la célula por intercambio con Cl-.
Además de este mecanismo conservador del HCO3- filtrado, el riñón es capaz de añadir HCO3- a la sangre por otros dos mecanismos: la excreción de acidez titulable (AT) y la excreción de amonio (NH4+).
Manejo renal de fósforo
Aproximadamente un 80% del fósforo (P) filtrado se reabsorbe en el túbulo proximal. El paso de P al interior de la célula tubular se lleva a cabo por cotransportadores de Na+y P que forman parte de la superfamilia de transportadores de solutos SLC34. Los subtipos NaPi-IIa y NaPi-IIc existen en la membrana apical de las células tubulares. Un transportador tipo III de la familia SLC20 participa también en la conservación renal de P con la isoforma PiT2.
La reabsorción renal de P disminuye en las situaciones de acidosis metabólica, dietas ricas en P, hiperpotasemia, en presencia de hormona paratiroidea que actúa modificando las proteínas encargadas del transporte de los NaPi-II hacia la membrana apical, y en presencia de las denominadas fosfatoninas, que son proteínas con efecto fosfatúrico. La más importante, desde el punto de vista renal es el factor de crecimiento fibroblástico 23 (FGF-23) producido en el hueso y que aumenta la eliminación de P e inhibe la síntesis de vitamina D. El FGF-23 precisa para unirse a sus receptores de la célula tubular un cofactor, la proteína Klotho(9).
Manejo renal del calcio
La porción libre de calcio (Ca+2) es filtrada libremente, mientras que el resto es retenido en el plasma unido a albúmina. Sólo un 1-2% del Ca+2 filtrado se excreta en orina.
• Un 70% se reabsorbe en el túbulo proximal y un 10-15% en la rama ascendente gruesa del asa de Henle de forma pasiva vía paracelular a través de canales iónicos (claudinas) gracias al gradiente electroquímico y de concentración generado por la reabsorción de Na+ y agua en estos segmentos.
• En los túbulos distales se reabsorbe una pequeña cantidad de Ca+2. Aquí la entrada apical de Ca+2 se produce pasivamente a través de canales iónicos TRPV5 regulados por la PTH de forma directa en relación al balance de Ca+2 del organismo, mientras el paso hacia el intersticio está mediado por un intercambiador con Na+ y por la Ca+2-ATPasa. La reabsorción de Ca+2 en los conductos colectores es mínima.
Un elemento importante en el transporte renal del Ca+2 es el receptor sensible al calcio (CaSR) que se expresa en diferentes lugares del túbulo renal. En la membrana apical del túbulo proximal su activación disminuye la respuesta fosfatúrica de la PTH. En la membrana basolateral de la rama ascendente gruesa del asa de Henle disminuye la actividad de los canales ROMK, disminuyendo la reabsorción de Na+ y de Ca+2. Además, inhibe la fosforilación de Claudina-16, disminuyendo su acción paracelular impidiendo la reabsorción de Ca+2. Se encuentra también en la membrana apical de los tubos colectores donde interfiere con el tráfico de acuaporina 2 hacia la membrana apical, provocando dilución de la orina a la vez que aumenta la secreción de H+ por las células intercaladas.
Regulación renal de la presión arterial(10)
El riñón participa de manera importante en la regulación de la presión arterial merced a su acción sobre el equilibrio del Na+, un determinante importante de la presión arterial. La concentración de Na+ en el líquido tubular proximal se percibe en la mácula densa, parte del aparato yuxtaglomerular. En este lugar se valora también la presión de perfusión de la sangre, un indicador importante del estado del volumen intravascular en circunstancias normales. La escasez del Na+ y la menor presión de perfusión actúan como un estímulo para la liberación de la renina. La renina, una proteasa elaborada en las células yuxtaglomerulares, escinde el angiotensinógeno sanguíneo para generar angiotensina I, transformada en angiotensina II por la enzima convertidora de angiotensina. La angiotensina II aumenta la presión arterial provocando vasoconstricción y estimulando la secreción de la aldosterona, que favorece la retención del Na+ y del agua en el túbulo colector.
La depleción del volumen intravascular también desencadena la liberación de vasopresina. Receptores en el cuerpo carotídeo y otros captan la disminución en la presión arterial y activan las vías neurales autónomas y la liberación de vasopresina en el hipotálamo. En la membrana plasmática apical del túbulo colector renal, la vasopresina facilita la inserción de canales para el agua, aumentando su cantidad y, por tanto, la reabsorción de agua libre y, secundariamente, la tensión arterial.
Los riñones también tienen la capacidad de producir mensajeros químicos, como las prostaglandinas, las quininas y el óxido nítrico que participan en mecanismos hipotensores.
Función endocrina
El riñón sintetiza dos hormonas: la eritropoyetina y el calcitriol o vitamina D activa.
La eritropoyetina es una glicoproteína, producida por un grupo especial de células del intersticio renal que se libera, principalmente, en respuesta a la hipoxia y estimula la eritropoyesis en la médula ósea. En algunas patologías renales, especialmente en la enfermedad renal crónica, se produce un déficit en la producción de esta hormona y consecuentemente se acompaña de anemia.
La vitamina D se forma a partir del 7-dehidrocolesterol que, por acción de la luz solar en la piel, se convierte en colecalciferol. Esta sustancia es hidroxilada en el hígado, convirtiéndose en 25-hidroxicolecalciferol, pero el metabolíto más activo, llamado 1,25 dihidroxicolecalciferol o calcitriol se forma tras sufrir una nueva hidroxilación en las células del túbulo renal. El calcitriol, que interviene de forma principal en el metabolismo óseo tiene, por tanto, origen renal. Su déficit explica, en parte, el hipocrecimiento y la osteodistrofia de la enfermedad renal crónica(9).
Glucogénesis
Finalmente, es preciso señalar que, en los periodos de ayuno prolongado, los riñones son capaces de sintetizar glucosa a partir de ciertos aminoácidos y otros precursores, liberándola la sangre en cantidades que representan el 80% de la glucosa producida por el hígado.
Bibliografía
1. Kriz W, Bankir L. A standard nomenclature for structures of the kidney. The Renal Commission of the International Union of Physiological Sciences (IUPS). Kidney Int. 1988; 33: 1-7.
2. Gavela T, Sánchez Bayle M, Gómez Mardones G, Gallego S, Martínez Pérez J, Moya MT. Estudio ecográfico del tamaño renal en niños. Nefrología. 2006; 26: 325-9.
3. Arévalo Gómez MA. El riñón normal. Anatomía e histología. En: Hernando Avendaño L, ed. Nefrología Clínica. 3ª edición. Editorial Médica Panamericana; 2008. p. 3-10.
4. Cherñavvsky DR, Gómez RA. Morfogénesis renal. En: Rudolph CD, Rudolph AM, Hostetter MK, Lister G, Siegel NJ, eds. Pediatría de Rudolph. 21ª edición. McGraw-Hill Interamericana; 2004. p. 1765-8.
5. Baum M. Desarrollo de la función renal. En: Rudolph CD, Rudolph AM, Hostetter MK, Lister G, Siegel NJ, eds. Pediatría de Rudolph. 21ª edición. McGraw-Hill Interamericana; 2004. p. 1768-74.
6. Franco M, Sánchez-Lozada LG, Herrera Acosta J. Fisiología glomerular. En: García Nieto V, Santos F, Rodríguez Iturbe B, eds. Nefrología Pediátrica. 2ª edición. Grupo Aula Médica; 2006. p. 3-8.
7. Santos F, García Nieto V. Función renal basal. En: García Nieto V, Santos F, Rodríguez Iturbe B, eds. Nefrología Pediátrica. 2ª edición. Madrid: Editorial Aula Médica Ediciones; 2006. p. 39-49.
8. Barac Nieto M. Funciones de los túbulos renales. En: García Nieto V, Santos F, Rodríguez Iturbe B, eds. Nefrología Pediátrica. 2ª edición. Grupo Aula Médica; 2006. p. 9-38.
9. Haussler MR, Whitfield GK, Kaneko I, Foster R, Saini R, Hsieh JC, et al. The role of vitamin D in the FGF 23, klotho, and phosphate bone-kidney endocrine axis. Rev Endocr Metab Disord. 2012; 13: 57-69.
10. Navar LG. The role of the kidneys in hypertension. J Clin Hypertens. 2005; 7: 542-9.


