 |
| Temas de FC |
L. Madero López*,**, L.M. Parra Ramírez**
*Hospital Infantil Universitario Infantil Niño Jesús. Madrid.
**Hospital Sanitas La Moraleja. Madrid
| Resumen
Los síndromes histiocíticos son enfermedades producidas por la acumulación anormal de las células del sistema mononuclear-fagocítico, bien sea células dendríticas o monocito-macrófagos. La presentación clínica de estos síndromes es variable y el diagnóstico se basa en criterios histológicos, dependiendo el tratamiento de la gravedad del caso clínico. La Histiocitosis de Células de Langerhans (HCL) es la forma más frecuente y se caracteriza por la proliferación clonal y acumulación progresiva en diversos tejidos de células de Langerhans patológicas (CLP). La linfohistiocitosis hemofagocítica es un síndrome clínico donde existe proliferación incontrolada de histiocitos (macrófagos), defectos en los mecanismos reguladores de la respuesta inmune y alteración en la función de las células natural killer (NK). Por tratarse de patologías relativamente infrecuentes en la población infantil, constituyen un reto diagnóstico y terapéutico para el pediatra. Así, el acercamiento y conocimiento de ellas permitirá tenerlas en cuenta en la práctica médica. |
| Abstract
The histiocytic syndromes are diseases caused |
Palabras clave: Histiocitosis de células de Langerhans; Linfohistiocitosis hemofagocítica; Sarcoma histiocítico.
Key words: Langerhans Cell Histiocytosis; Hemophagocytic lymphohistiocytosis; Histiocitic sarcoma.
Pediatr Integral 2012; XVI(6): 487-493
Síndromes de histiocitosis
Introducción
Los síndromes histiocíticos son desór-denes poco prevalentes en la población infantil que resultan de la proliferación e infiltración del sistema fagocítico-mononuclear en los diferentes órganos o sistemas.
El sistema mononuclear-fagocítico (células histiocitarias) tienen su origen en las células CD34+ de la médula ósea y desempeña un papel importante en la inmunidad innata, la fagocitosis y la presentación de antígenos así como en la activación del sistema inmune a través de citocinas o contacto directo.
Células dendríticas
Se categorizan según su papel en el sistema linfoide T o B. Las células dendríticas foliculares se encuentran en los folículos de los ganglios linfáticos y presentan antígenos a los linfocitos B. Las células dendríticas interdigitantes se encuentran en las áreas de linfocitos T del ganglio linfático y presentan antígenos a las células T.
Las células de Langerhans (CL) derivan de las células dendríticas de la médula ósea(1). Son las células presentadoras de antígenos más potentes del organismo. Se encuentran en la epidermis, ganglios linfáticos, epitelio del timo y mucosa bronquial.

Figura 1. Células histiocitarias.
A diferencia de otros histiocitos, las CL expresan el complejo CD1a y muestran en su interior los gránulos de Birbeck. Estas características son utilizadas para diferenciarlas en la piel, los ganglios linfáticos, médula ósea y pulmones.
Enfermedades originadas en las células dendríticas
Histiocitosis de células de Langerhans (HCL)
Es una entidad poco frecuente, de etiología aún no esclarecida, que se caracteriza por la proliferación y acumulación de células dendríticas de Langerhans en lesiones granulomatosas en diferentes órganos, sobre todo en piel y el hueso.
Cada vez se enfatiza más en que estas células de Langerhans patológicas tienen un origen clonal (Tabla II)(1).


Esta enfermedad puede presentarse a cualquier edad, con un pico entre 1 a 3 años. Tiene un espectro de presentación y evolución muy variable.
Según el compromiso de órganos o sistemas afectados puede ser:
1. Localizada: un solo órgano o sistema comprometido:
– Hueso: unifocal (1 hueso), multifocal (>1 hueso).
– Piel.
– Ganglios linfáticos: simple (1 grupo ganglionar), múltiple (>1 grupo ganglionar).
– Pulmón.
– Sistema nervioso central.
– Otros (tiroides/timo).
2. Multisistémica: 2 o más órganos/sistemas comprometidos, con o sin manifestaciones generales, como: fiebre, anorexia, pérdida peso o irritabilidad. Se consideran órganos de riesgo: hígado, bazo y sistema hematopoyético.
Manifestaciones clínicas
Piel y mucosa oral (30-60% de los casos)
Son muy frecuentes sobre todo en lactantes.
Se caracterizan por lesiones eritematosas, escamosas y descamativas, parecidas a la dermatitis seborreica.
Principalmente, se localizan en: cráneo, cuero cabelludo, pabellón auricular, region inguinal y perineal.
También, puede aparecer: hipertrofia gingival, úlceras en paladar, labios o lengua(2,5).
Hueso
La presentación de la HCL como lesión ósea única (monostótica) es más común que las lesiones múltiples (poliostótica). Compromete principalmente los huesos con actividad hematopoyética.
En los niños, el cráneo es el principal sitio comprometido, seguido de huesos lárgos, los planos y las vértebras (Tabla III).

Radiológicamente, son lesiones líticas, en “sacabocado”, bien delimitadas, con o sin márgenes escleróticos o reacción perióstica que pueden afectar los tejidos blandos contiguos. Aunque pueden ser asintomáticas, frecuentemente generan dolor e hipersensibilidad.
Dependiendo del hueso comprometido, se pueden asociar otros síntomas:
1. Proptosis si hay compromiso de los huesos de la órbita.
2. Otitis media refractaria o mastoiditis por compromiso del hueso temporal (mastoides).
3. Exfoliación prematura de los dientes y dolor (dientes flotantes) por compromiso maxilar y mandibular.
4. Diabetes insípida o neurodegeneración por afectación de los huesos de la base del cráneo.
5. Inestabilidad de la columna o aplastamiento por compromiso vertebral.
En la enfermedad monostótica, la lesión suele regresar espontáneamente entre 3 a 12 meses.
Pulmón
Es una manifestación poco frecuente (10%), de predominio en adultos. En niños, se asocia a enfermedad multisistémica. Se caracteriza por la afectación del intersticio pulmonar, principalmente en la región ápico-medial de éste. La tomografia axial computarizada de alta resolución es la prueba de imagen más sensible para valorarla, donde se puede identificar la fibrosis intersticial y la formación de quistes y nódulos en la enfermedad avanzada(5,8,9).
Las manifestaciones clínicas más frecuentes son: tos no productiva, disnea, dolor torácico o neumotórax espontáneo y recurrente.
El diagnóstico se confirma con biopsia pulmonar o lavado bronquioalveolar (BAL) con más de 5 células de Langerhans patológicas.
Actualmente, no se considera un órgano de riesgo que afecte el pronóstico de los pacientes con HCL(8).
Ganglios linfáticos y médula ósea
La linfadenopatía la presentan aproximadamente el 20% de los pacientes, siendo los ganglios cervicales los más comprometidos.
Son considerados órganos de riesgo y por tanto determinan peor pronóstico.
El crecimiento tímico y adenopatías mediastínicas también pueden estar presentes. La disfunción de la médula ósea se manifiesta principalmente por anemia (Hb <10 g/dl) y trombopenia (plaquetas <100.000); y menos frecuente neutropenia. La pancitopenia asociada a hepatoesplenomegalia determina mal pronóstico(9).
Hígado y bazo
El compromiso hepático se manifiesta por: elevación de las enzimas hepáticas, hipoalbuminemia, hiperbilirrubinemia y alteraciones de la coagulación, o se puede manifestar como una lesión quística o LOE (lesión ocupante de espacio). Estas manifestaciones suelen acompañar sólo a los pacientes con enfermedad diseminada.
La esplenomegalia masiva es característica de la enfermedad multisistémica del lactante. Es un factor adicional en las citopenias por hiperesplenismo.
Gastrointestinal
Sólo un 1-2% de los pacientes con HCL tienen compromiso digestivo y se asocia a enfermedad multisistémica. Las principales manifestaciones están relacionadas con malabsorción y diarrea mucosanguinolenta. El diagnóstico se hace a través de la biopsia gastrointestinal(6,7).
La diabetes insípida es la principal anormalidad endocrina en los pacientes con HCL.
Sistema endocrino
Puede presentarse antes (4%), concomitante (18%) o después del diagnóstico de HCL. Son factores de riesgo para desarrollar diabetes insípida, el compromiso óseo craneal y la enfermedad multisistémica.
Los pacientes con diabetes insípida frecuentemente presentan un engrosamiento del tallo hipotalamohipofisiario (63%) y/o pérdida de la señal brillante de la hipófisis posterior en la RM con gadolinio. El diagnóstico se confirma con el test de restricción hídrica, midiendo los niveles de vasopresina(4).
En el 50% de los casos, la hipófisis anterior también puede comprometerse, manifestándose como un hipopituitarismo. Esto puede dar origen en la RM al signo de “la silla turca vacía”, por disminución del tamaño de la hipófisis(8).
Cualquier zona del SNC puede estar comprometida, sin embargo la HCL tiene una clara predisposición por el eje hipotálamo-hipofisiario.
Rara vez hay compromiso tiroideo y paratiroideo.
Sistema nervioso central
Los signos y síntomas característicos son: alteración del apetito, patrón del sueño, regulación de la temperatura, polidipsia, poliuria, retraso del crecimiento, alteraciones puberales, amenorrea e hiposecreción de TSH y ACTH. La diabetes insípida es la manifestación más frecuente de la HCL en el SNC(4).
La evolución de las alteraciones radiológicas no se relaciona con el curso clínico de la enfermedad(9).
El síndrome de degeneración cerebelosa ocupa el segundo lugar en frecuencia. Se caracteriza por: alteración en los reflejos y la marcha, ataxia, disartria, disdiadococinesia. Se origina por lesiones en los ganglios basales y núcleo dentado del cerebelo. Este cuadro clínico es progresivo y no existe aún un tratamiento eficaz.
Las masas en el parenquima cerebral, menínges o plexos coroideos se pueden observar en el 1% de los pacientes.
Diagnóstico
La sospecha clínica es importante por la escasa frecuencia de la enfermedad. Siempre es necesario la confirmación histológica e inmunohistoquímica de la lesión. El principal hallazgo es la identificación morfológica de las células de Langerhans; siendo indispensable confirmar su positividad para CD1a y Langehina (CD207)(8).
Pronóstico
Se han identificado 2 factores de mal pronóstico:
1. Edad <2 años.
2. Presencia de disfunción órgánica (Tablas IV y V).


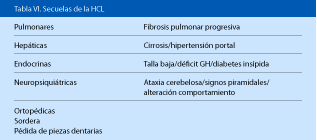
Además son factores de riesgo para desarrollar secuelas (Tabla VI):
1. Enfermedad multisistémica.
2. Enfermedad de más de 5 años de duración.
El tratamiento quimioterápico está indicado en pacientes con:
• Enfermedad multisistémica.
• Disfunción orgánica.
• Compromiso de sitios especiales (p. ej., SNC).
Tratamiento
El tratamiento está adaptado al riesgo, de acuerdo a la extensión y severidad de la enfermedad. En general, la enfermedad ósea localizada y cutánea tienen un curso benigno sin recurrencias. Sólo deben recibir tratamiento las lesiones óseas que produzcan incapacidad, dolor, deformidad o riesgo de fractura.
Se basa en la combinación de vinblastina, etopósido y prednisolona durante 6 semanas como tratamiento inicial, seguido de un tratamiento de mantenimiento adaptado a la respuesta inicial (12-24 meses)(8).
Para los pacientes no respondedores, en la semana 6ª la supervivencia es del 24%, y para los respondedores, del 89%.
Sarcoma histiocítico
Es una enfermedad extremadamente rara, más frecuente en adultos. No es un sarcoma como tal, ya que se relaciona con las células dendríticas interdigitantes o foliculares. Se ha encontrado asociación con otras neoplasias hematológicas, como: leucemia linfoblástica aguda, linfoma folicular o mielodisplasia.
Su manifestación clínica depende del órgano comprometido y los síntomas presentes se deben a afectación extranodal uni o multifocal. Principalmente, estas manifestaciones son a nivel gastrointestinal, cutáneo y de tejidos blandos.
El compromiso solitario de los ganglios linfáticos se ve en <20%. La mayoría de los pacientes presentan una masa palpable y síntomas sistémicos (pérdida de peso, fiebre) o por compresión.
El diagnóstico está basado en el estudio anatomopatológico e inmunohistoquímico. Estas lesiones no expresan CD1a ni CD207, ni marcadores de células T o B (p. ej., mieloperoxidasa, CD33).
Es un síndrome clínico asociado a condiciones genéticas o adquiridas que se caracteriza por una respuesta inflamatoria excesiva, con proliferación incontrolada de linfocitos activados y macrófagos, defectos en la apoptosis y alteraciones en la función de las células natural killer (NK)(2,3).
El tratamiento no está estandarizado. Las opciones terapéuticas actuales se basan en la cirugía, radiación o quimioterapia.
Enfermedades originadas en los macrófagos
Linfohistiocitosis hemofagocítica (LHH)
Afecta comunmente al sistema reticulo-endotelial, estando principalmente comprometidos: bazo, hígado, médula ósea, ganglios linfáticos y sistema nervioso central.
Los histiocitos tienen características morfológicas e inmunofenotípicas normales, aunque inmaduros y activados. Es común la hemofagocitosis (principalmente de eritrocitos). Se ha observado además fagocitosis de plaquetas y fibrina contribuyendo a la presencia de trombopenia e hipofibrinogenemia.
La LHH incluye una forma genética o familiar (autosómica recesiva) y formas secundarias asociadas a: infección, cáncer, enfermedades autoinmunes y reumáticas (conocido como síndrome de activación macrofágica –SAM).
La incidencia de la LHH primaria o familiar se ha estimado en 0,12/100.000 niños/año. En el 70% de la forma familiar, las manifestaciones clínicas aparecen antes del año y, generalmente, entre el primer y sexto mes de vida; sin embargo hay casos genéticos descritos en adolescentes y adultos jóvenes.
La LHH secundaria puede deberse a:
• Infecciones: entre las infecciones asociadas con LHH están: EVB, CMV, parvovirus, herpes simple, VZV, sarampión, herpes-8 y HIV. También, puede coincidir con infecciones bacterianas (Brucella, gramnegativos, tuberculosis), parásitos (Leishmania) o infecciones fúngicas.
• E. autoinmunes: dentro de las enfermedades autoinmunes relacionadas con LHH se incluyen: lupus eritematoso sistémico, artritis reumatoidea, poliarteritis nodosa, enfermedad mixta del tejido conectivo, sarcoidosis pulmonar, esclerosis sistémica y síndrome de Sjogren. Estos pacientes desarrollan la LHH seguido de una infección o por la misma enfermedad.
En la LHH familiar o primaria existe una alteración de la citotoxicidad y apoptosis, debido a la disminución severa o ausencia de la actividad asesina natural (NK).
• Otras patologías: se ha relacionado con inmunodeficiencias, como: inmunodeficiencia variable común, síndrome linfoproliferativo ligado a X, E. Chediak Higashi y síndrome linfoproliferativo postrasplante.
Etiología
En estos pacientes, una vez las NK se activan por un estímulo determinado, se libera una gran cantidad de citocinas (IFN ?, GM-CSF, TNFa) que, a la vez, promueven la respuesta inflamatoria, activando los macrófagos y modulando la respuesta de los linfocitos T.
La respuesta inmune, que en una persona sana finalizaría cuando desaparece el antígeno, es persistente y sostenida en estos pacientes al tener la actividad NK comprometida, generándo una hiperactivación de linfocitos T y macrófagos, e hiperproducción de citocinas que, en conjunto, generan el daño tisular, dando lugar a las manifestaciones clínicas de la enfermedad.
En general, parece que existe un factor desencadenante para que se manifieste la enfermedad, y en la mayoría de los casos suele ser una infección vírica banal.
En un 40-50% de los pacientes, se han hallado mutaciones en el gen de la perforina (PRF1) y en los genes MUNC 13-4 y sintaxin 11(3,5).
La perforina es una proteína expresada en linfocitos y macrófagos cuyo papel es formar poros en la membrana de la célula diana y favorecer la lisis osmótica. También, está implicada en la finalización de la función de la célula presentadora de antígenos. Si la perforina es defectuosa, la función presentadora de antígenos nunca termina, persistiendo la estimulación de los linfocitos T(9).
Manifestaciones clínicas
Generalmente, tiene un comienzo variable e inespecífico, como: pérdida de peso, anorexia, diarrea, fiebre alta, rash cutáneo y adenopatías.
Si la enfermedad no es identificada, tiene un curso rápido y progresivo con persistencia de la fiebre, hepatoesplenomegalia, diátesis hemorrágica, citopenias e ictericia.
Los síntomas neurológicos pueden aparecer en el curso clínico inicial con: convulsiones, irritabilidad, signos de meningismo o defectos neurológicos focales. Los hallazgos de laboratorio principales son: las citopenias en 2 ó 3 series, especialmente anemia y trombopenia, hipofibrinogenemia, hiperferritinemia e hipertrigliceridemia (Tabla VII).

El marcador con mayor sensibilidad es un valor de sCD25 por encima de 2.400 U/ml. Otro hallazgo fundamental es la marcada disminución de la actividad NK y de la actividad celular T.
Compromiso del sistema
retículo-endotelial
• Médula ósea: generalmente es hiperplásica en los estadios tempranos. La hemofagocitosis es un hallazgo poco sensible y específico, con presencia variable y heterogénea. En las etapas avanzadas, disminuye la celularidad y puede confundirse con una médula aplásica. La ausencia de hemofagocitosis no descarta la posibilidad de LHH.
• Bazo: existe expansión de la pulpa roja, infiltración mononuclear e histiocitos con hemofagocitosis.
• Hígado: el compromiso hepático se refleja por la infiltración linfocitaria en los espacios porta y lobulillos hepáticos. En fases avanzadas, puede haber hepatitis crónica persistente. Hay incremento de las transaminasas, hiperbilirrubinemia, elevación de la LDH (>1.000 U/L) y coagulopatía.
• Ganglios linfáticos: la linfadenopatía a cualquier nivel es caracterísitica de la LHH. Suelen ser múltiples. Se producen por la proliferación linfoide y acumulación histiocitaria. Generalmente, no son dolorosas ni se asocian a signos inflamatorios locales(9).
• Sistema nervioso central: en los estadios iniciales, hay afectación meníngea por infiltración de macrófagos; posteriormente, hay cambios perivasculares, afectación difusa tisular y necrosis multifocal. El estudio de LCR en los pacientes con LHH puede estar alterado, mostrando leucocitosis, hiperproteinorraquia e histiocitos espumosos.
Diagnóstico
La Sociedad Histiocitaria propuso una guía que resume los criterios para diagnosticar la enfermedad (Tabla VII).
La positividad de los resultados genéticos específicos es suficiente para el diagnóstico; por lo que, los estudios genéticos son claves en la LHH. La hiperferritinemia se ha introducido como un criterio de gran utilidad diagnóstica por su accesibilidad y sensibilidad.
El diagnóstico diferencial es difícil, porque el cuadro clínico inicial puede ser variable y la presencia de hemofagocitosis no siempre es evidente.
Lo más difícil es diferenciar la forma primaria de algunas secundarias, en especial cuando se manifiesta en niños pequeños, porque las formas primarias suelen tener un desencadenante (p. ej., EBV).
La principal diferencia entre ellas, es la ausencia mantenida de la actividad citotóxica tras la remisión clínica en las formas primarias(5).
La LHH debe diferenciarse de procesos infiltrativos como leucemia, linfoma, HCL o enfermedades autoinmunes (artritis reumatoidea juvenil).
Evolución
En la LHH primaria la evolución suele ser progresiva y rápida, con afectación muy grave y curso fatal en 6-8 semanas. En las formas secundarias, la supervivencia puede ser de un 40%. Algunos pacientes pueden mejorar espontáneamente o tener reactivaciones clínicas posteriores.
Debido a que el diagnóstico es difícil por los síntomas inespecíficos y porque en la primera fase de la enfermedad puede no demostrarse la hemofagocitosis, el tratamiento debe instaurarse ante cualquier sospecha severa de LHH.
Tratamiento
El objetivo del tratamiento está orientado a:
1. Suprimir la hiperinflamación responsable del fallo multiorgánico y de los síntomas que amenazan la vida del paciente.
2. Combatir el agente patógeno desencadenante (generalmente infeccioso).
Para ello, se utilizan medicamentos como: dexametasona, ciclosporina A, etopósido e inmunoglobulinas.
Los corticoides, la ciclosporina A y las inmunoglobulinas disminuyen la inflamación con efecto inmunosupresor. El etopósido tiene un efecto citotóxico sobre las células histiocitarias.
En las formas primarias, es necesario realizar TPH (trasplante de progenitores hematopoyéticos) para obtener la curación(3). En los casos de LHH secundaria, es preciso además tratar la causa desencadenante.
Función del pediatra de Atención Primaria
La función del pediatra en Atención Primaria en las patologías histiocitarias es fundamental. Aunque son patologías relativamente infrecuentes, el conocimiento de estas enfermedades permite la sospecha clínica en la consulta externa y la orientación adecuada y oportuna para el diagnóstico y tratamiento.
Son manifestaciones clínicas que un pediatra deben tener en cuenta para sospechar HCL:
• Dermatitis seborreica refractaria o dermatitis del pañal con ulceraciones y erosiones que no responde al tratamiento convencional.
• Otitis media refractaria o mastoiditis recurrentes.
• Dolor mandibular con pérdida temprana de los dientes.
• Diabetes insípida central.
• Lesiones óseas en sacabocado, especialmente craneales.
Además, el pediatra de Atención Primaria debe tener presente especialmente las infecciones como causa de LHH.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Badalian-Very G, Vergilio JA, Degar B, Rodríguez-Galindo C, Rollins BJ. Recent advances in the understanding of langerhans cell histiocytosis. British Journal of Haematology. 2011; 156: 163-72.
2.** Janka GE. Hemophagocytic síndromes. Blood Reviews. 2007; 21: 245-53.
3.* Astigarraga I. Linfohistiocitosis hemogagocítica. LI Reunión Nacional de la AEHH y XXV Congreso de las SETH. Haematologica. 2009; 94: 315-8.
4.* Grois N, Potschger U, Prosch H, et al. Risk factors for diabetes insipidus in langerhans cell histiocytosis. Pediatr Blood Cancer . 2006; 46: 228.
5.** Astigarraga I. Enfermedades del sistema mononuclear fagocítico (SMF). I. Síndromes histiocíticos: histiocitosis de células de Langerhans. Linfohistiocitosis hemofagocítica. En: Sánchez de Toledo Codina J, Ortega JJ, eds. Manual práctico de hematología y oncología pediátricas. Madrid: Ergon; 2010. p. 125-35.
6. Hait E, Liang M, Degar B, Glickman J, Fox V. Gastrointestinal tract involvement in Langerhans cell histiocytosis: case report and literature review. Pediatrics. 2006; 118(5): 1593-99.
7. Shima H, Takahashi T, Shimada H. Protein-losing enteropathy caused by gastrointestinal tract-involved Langerhans cell histiocytosis. Pediatrics. 2010; 125(2): 426-32.
8. LCH-IV International Collaborative treatment Protocol for children and adolescents with Langerhans cell histiocytosis. 2011.
9.*** Ladish S, Jaffe E. The histiocytosis. En: Pizzo PA, Poplack DG, eds. Principles and Practice of Pediatric Oncology. 5ª ed. Philadelphia: Lippincott; 2005. p. 768-95.
Bibliografía recomendada
– Astigarraga I. Enfermedades del sistema mononuclear fagocítico (SMF). I. Síndromes histiocíticos: histiocitosis de células de Langerhans. Linfohistiocitosis hemofagocítica. En: Sánchez de Toledo Codina J, Ortega JJ, eds. Manual práctico de hematología y oncología pediátricas. Madrid: Ergon; 2010. p. 125-35.
Capítulo que resume lo más importante de los síndromes histiocíticos. Muy útil para el pediatra de Atención Primaria.
– LCH-IV International Collaborative treatment Protocol for children and adolescents with Langerhans cell histiocytosis. 2011.
Protocolo actual de diagnóstico y tratamiento.
– Ladish S, Jaffe E. The histiocytosis. En: Pizzo PA, Poplack DG, eds. Principles and Practice of Pediatric Oncology. 5ª ed. Philadelphia: Lippincott; 2005. p. 768-95.
Libro básico y fundamental de la patología oncológica infantil.
– McClain K. Clinical manifestations, pathologic features and diagnosis of Langerhans cell histiocytosis. En: UpToDate.com 2012.
Excelente resumen y puesta al dia al respecto de la histiocitosis de células de Langerhans.
| Caso clínico |
|
Niña de 10 años que acude a Urgencias por 10 días de evolución de polidipsia, poliuria, nicturia y urgencia miccional. No ha presentado cambios en el comportamiento, pero la sintomatología le impide su actividad cotidiana y desempeño escolar. No presenta fiebre ni polifagia. No tiene antecedentes personales ni familiares relevantes para la enfermedad actual. Exploración física: buena situación clínica, sin signos de deshidratación. Peso: 41,2 kg (p51), talla: 150,3 cm (p80), IMC: 18,2 (p38), TA: 112/81, FC: 110/min, T: 36,7°C. Exploraciones complementarias: hemograma: leucocitos: 12.300 (N: 58%, L: 34%, M: 5,7%), plaquetas: 270.000, Hb: 12,9 g/dl. Bioquímica: glucosa: 86 mg/dl, creatinina: 0,87 mg/dl; urea: 19,1. Na: 139 mg/dl, K: 3,6 mg/dl. Gases venosos: pH: 7,35, pCo2: 55, HCO3: 30,4, BE: 4,8. Orina: pH: 5,0, densidad: 1.005. Sedimento normal. Electrolitos en orina: Na: 7 mEq/L, K: 5,4 mEq/L, cloro: 7 mEq/L. Osmolaridad sérica: 294 mOsm/kg (275-290). Osmolaridad urinaria: 70,94 mOsm/kg (300-1.000). Evolución Ante la sospecha de diabetes insípida, se realiza el test de restricción hídrica que confirma el diagnóstico y posteriormente el test de vasopresina siendo compatible con diabetes insípida central. La RM cerebral con gadolinio evidencia engrosamiento del tallo infundibular y ausencia de hiperintensidad de señal en la neurohipófisis. Ante la alta sospecha de HCL, se realiza estudio de extensión que descarta compromiso en otros sistema. Por la localización de la lesión central no es posible realizar estudio anatomopatológico inicial. A los 2 años del diagnóstico de diabetes insípida central, debuta con un síndrome febril prolongado (20 días) asociado a astenia y adinamia. La biopsia digestiva evidencia infiltración histioeosinófila duodenal y esofágica con positividad para CD1a, pS100 y langerina. Al confirmar el diagnóstico de HCL, inicia tratamiento con vinblastina y prednisona remitiendo inmediatamente la fiebre. Las lesiones en el SNC persisten a lo largo de la evolución, pero en menor proporción. |

