|
| Temas de FC |
J. Marès Bermúdez
Institut Pediàtric Marès-Riera. Blanes (Girona)
| Resumen
Está completamente establecida la relación causal entre la infección por determinados genotipos del virus del papiloma humano (VPH) y el desarrollo de determinados tipos de cáncer. Las vacunas disponibles frente a VPH han demostrado ampliamente su eficacia protectora para las lesiones preneoplásicas producidas por los genotipos que contienen y, tras su utilización extensa en la población, se ha corroborado su adecuado perfil de seguridad. Los adolescentes excepcionalmente presentan manifestaciones clínicas de la infección por VPH, pero son el grupo etario con mayor riesgo de infección tras su debut sexual y, por tanto, la población diana para la vacunación preventiva. La vacunación frente a VPH ha estado dirigida de forma prioritaria a la mujer y enfocada básicamente para la prevención del cáncer de cérvix; pero la carga global de la enfermedad debida a VPH en ambos sexos, el papel trasmisor tanto del hombre como de la mujer y la inmunidad de grupo observada con la vacunación, justifican que deba considerarse la vacunación en ambos sexos en los programas de inmunización. |
| Abstract
The causal relationship between infection by certain genotypes of human papillomavirus (HPV) and the development of certain types of cancer has been completely established. |
Palabras clave: Vacunas frente al virus del papiloma humano; Vacunación en adolescentes; Vacunación en varones; Prevención del cáncer
Key words: Human papillomavirus vaccines; Vaccination in adolescents; Vaccination in males; Cancer prevention
Pediatr Integral 2015; XIX (10): 693.e1-693.e11
Vacunación frente al virus del papiloma humano y adolescencia
Introducción
Los adolescentes excepcionalmente presentan manifestaciones clínicas de infección por genotipos mucosales de VPH, pero son el grupo etario con mayor riesgo de infección tras su debut sexual y, por tanto, la población diana para la vacunación preventiva.
Está completamente establecida la relación causal entre la infección por determinados genotipos del virus del papiloma humano (VPH) y el desarrollo de determinados tipos de cáncer. Las evidencias epidemiológicas, microbiológicas, anatomopatológicas y estudios moleculares de alta sensibilidad han permitido confirmar esta relación. Todos los cánceres de cuello uterino en la mujer, la mayoría de los cánceres del área anogenital en el hombre y en la mujer, y un porcentaje significativo de los cánceres de cavidad oral y faringe en ambos sexos, son debidos a una infección persistente por genotipos mucosales oncogénicos de VPH. Otros genotipos mucosales no oncogénicos son responsables de las verrugas genitales (condilomas acuminados), que son lesiones de carácter benigno, de gran prevalencia, que afectan por igual a ambos sexos, son molestas, recurrentes y de tratamiento complejo(1).
Todos los genotipos mucosales de VPH, oncogénicos o no, se trasmiten por contacto persona-persona mediante las relaciones sexuales. Tanto el hombre como la mujer, pueden ser portadores asintomáticos y transmisores de la infección por VPH. Afortunadamente, la mayoría de personas que se infectan son capaces de eliminar el virus espontáneamente tras un periodo de varios meses a 1-2 años y, aunque generalmente no desarrollan enfermedad, pueden transmitir la infección durante este periodo(2).
En el sexo femenino está perfectamente documentado que el máximo riesgo de infección por VPH se produce muy precozmente tras el inicio de la actividad sexual, lo que condiciona que las mayores prevalencias de infección por VPH se observen en menores de 25 años. La precocidad sexual y el número de parejas sexuales son los dos factores asociados a mayor riesgo de infección. Estos datos tienen una gran implicación en la adolescencia, período de la vida en la que muchos chicos y chicas inician su actividad sexual, y en el que se observa un avance generacional en la edad de la primera relación sexual y un porcentaje de jóvenes con mayor número de parejas sexuales que antaño(1,2).
Las vacunas han demostrado también su eficacia en la prevención de otras lesiones preneoplásicas del tracto genital femenino, y la vacuna tetravalente de las verrugas genitales y del cáncer de ano en ambos sexos. Además, es muy probable que estas vacunas tengan un efecto protector frente al resto de lesiones neoplásicas asociadas a VPH(3).
Ante este abanico ampliado de carga de enfermedad por VPH en ambos sexos, el papel como transmisor de la infección, tanto del hombre como de la mujer, la eficacia de las vacunas, la inmunidad de grupo observada y el impacto demostrado en la reducción de la incidencia de infección reciente y persistente en personas vacunadas que disminuye su potencial de transmisión, es pertinente considerar también la vacunación frente a VPH del varón en los programas de inmunización.
Manifestaciones clínicas del VPH
El cáncer de cérvix por su mayor incidencia y su estrecha relación causal con el VPH es la expresión clínica más relevante de esta infección y condiciona que la carga de enfermedad sea mayor en la mujer que en el hombre.
Es importante conocer la carga global de la enfermedad neoplásica causada por la infección por VPH, ya que en ella se fundamentan todas las estrategias preventivas, incluida la vacunación. En la figura 1, se representan los cánceres relacionados causalmente con los VPH y la fracción que es atribuible a esta infección.
Figura 1. Carga global a nivel mundial de los cánceres relacionados causalmente con los VPH y estimación de la fracción atribuible a esta infección. Modificado de Schiller JT et al.(3). Fuente de datos: Schiller JT et al.(3 )y Marès J et al(1).
En la mayoría de los casos, las infecciones por los VPH son asintomáticas. Existen genotipos denominados cutáneos que son los causantes de las verrugas comunes, a nivel cutáneo y plantar, verrugas planas y, excepcionalmente, de la epidermodisplasia verruciforme. En cambio, los genotipos mucosales producen infecciones en el área anogenital y orofaríngea, existiendo tipos de alto riesgo (oncogénicos) y de bajo riesgo (no oncogénicos), que en función del genotipo, la localización y de la capacidad de la persona infectada de eliminar el virus, pueden producir las siguientes manifestaciones(1,2,4):
• Verrugas genitales o anales (condilomas acuminados): es la expresión clínica más frecuente de la infección por VPH. Son lesiones benignas que afectan a ambos sexos y que son causadas por genotipos de VPH no oncogénicos. En dos estudios retrospectivos transversales realizados en España, se ha constatado una prevalencia estimada de verrugas genitales en personas de ambos sexos de 14 a 64 años cercana al 0,2%. El 55% de los casos son varones y la tasa de incidencia estimada es de 118 casos/100.000 personas/año(5).
• Papilomatosis laríngea recurrente: forma clínica infrecuente (prevalencia de 4 x 100.000 niños), también producida por genotipos de VPH no oncogénicos. Existe la forma clínica juvenil de comienzo antes de los 18 años de edad, generalmente entre los 2-5 años, debida al contagio perinatal a través del canal del parto, especialmente si la madre presenta verrugas genitales. La forma clínica del adulto se transmite por contacto sexual.
• Lesiones neoplásicas de cérvix: en base a los cambios observados en los estudios citológicos del cérvix uterino, se clasifican en lesiones escamosas intraepiteliales de bajo grado (LSIL) producidas tanto por los genotipos de bajo riesgo (no oncogénicos), como por los de alto riesgo (oncogénicos), y las lesiones escamosas intraepiteliales de alto grado (HSIL) ocasionadas exclusivamente por los VPH oncogénicos. En algunos casos, no es posible tal diferenciación y se clasifican como atipias escamosas de naturaleza incierta (ASCUS). Cuando se realiza la biopsia dirigida, las lesiones se clasifican en: neoplasias cervicales intraepiteliales (CIN), correspondiendo las CIN de grado 1 (displasia leve) a las LSIL y las CIN 2 (displasia moderada) y CIN 3 (displasia grave, carcinoma in situ, adenocarcinoma in situ) a HSIL. Cuanto mayor es el grado de displasia, mayor es la detección de VPH de alto riesgo (oncogénicos). En España, se realizan anualmente en mujeres mayores de 20 años, cerca de 7.600.000 citologías, resultando patológicas un 3,5%, similar a lo descrito en otros países de nuestro entorno(1).
• Cáncer invasor de cérvix: es el resultado final de la progresión de las lesiones preneoplásicas causadas por los VPH oncogénicos. Todos los cánceres de cérvix (≈100%) son debidos a la infección por VPH. Es el segundo cáncer más frecuente en la mujer joven (menor de 45 años), después del cáncer de mama. Se estima que la incidencia de cáncer invasivo de cuello uterino en los países desarrollados de nuestro entorno oscila entre 10-15 casos por 100.000 mujeres/año (Tabla I). En España, la tasa de incidencia media es de 9 casos por 100.000 mujeres/año (oscila entre 4-12/100.000 mujeres/año según zona geográfica) lo que representa aproximadamente unos 2.000 casos por año y cerca de 700 fallecimientos. Estudios epidemiológicos realizados en Europa estiman un incremento anual de un 1% en la incidencia de cáncer de cérvix en España en los próximos años(1,6).
• Lesiones neoplásicas y cánceres ano-genitales: algunos genotipos de VPH oncogénicos son los agentes causales de neoplasias intraepiteliales de vagina (VaIN), y vulva (VIN) en la mujer, de pene (PIN) en el hombre y de ano en ambos sexos (AIN). Las incidencias de estos cánceres son mucho menores que el cáncer de cérvix, y se sitúan sobre el 0,5/100.000 personas/año para el cáncer de vagina y pene, 2/100.000 el de vulva y sobre el 1/100.000 para el de ano, más frecuente en varones que en mujeres, y mucho más frecuente en varones homosexuales (40 veces más que en la población general)(29). Se detectan VPH oncogénicos como causantes de estas lesiones en el 40% de los cánceres de vulva y pene, 65% en vagina y hasta el 85% en los de ano (Tabla I)(1,4).
• Cáncer orofaríngeo: los VPH oncogénicos son responsable de un 15-35% de los cánceres de cavidad oral y faringe (zona amígdalar, orofaringe y con menor frecuencia base de la lengua, y laringe), 4 veces más frecuentes en el hombre que en la mujer. Se ha constatado un incremento de este tipo de lesiones atribuibles a VPH en países desarrollados en los últimos años (4-5 veces más que en países en desarrollo). La incidencia en Europa de cánceres orofaríngeos atribuibles al VPH se estima en 1,2/100.000 personas/año (Tabla I)(2-4).
Virología y fisiopatología
La infección por VPH es la causa necesaria para el desarrollo del cáncer de cérvix y de un alto porcentaje de otras neoplasias ano-genitales y orofaríngeas en ambos sexos.
Los VPH son virus con ADN de doble cadena circular y envueltos por una cubierta proteica compuesta por dos moléculas, L1 y L2, que forman parte de la estructura del virus. La proteína L1 recombinante y especifica para cada genotipo es la utilizada como antígeno en las actuales vacunas.
Se han identificado cerca de 150 tipos diferentes de papilomavirus con un tropismo diferenciado: unos genotipos son cutaneotrópicos, causantes de lesiones cutáneas, y otros son mucosotrópicos o mucosales, con capacidad de infectar al tracto genital.
Entre los VPH mucosales (aproximadamente 40 genotipos) existen los de alto riego (oncogénicos) relacionados con las neoplasias ano-genitales y orofaríngeas, y los de bajo riesgo (no oncogénicos) responsables de las verrugas genitales (condilomas acuminados):
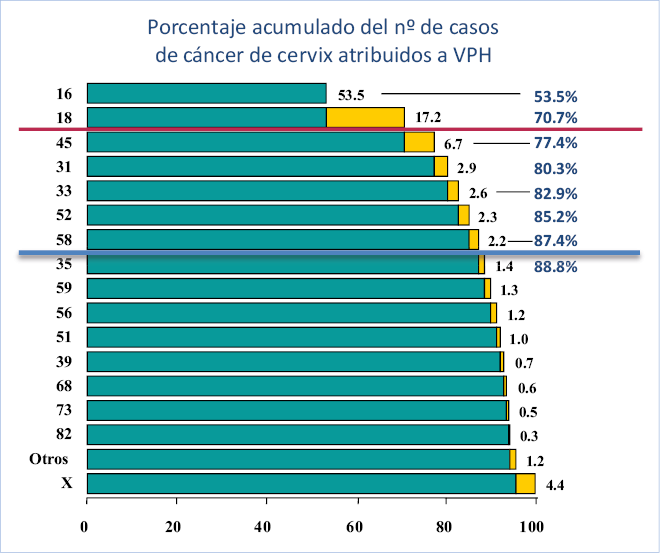
• Existen hasta 16 genotipos oncogénicos confirmados, de los que el VPH 16 y el VPH 18 están relacionados causalmente con la mayoría de los cánceres de cérvix a nivel mundial. En España, los VPH 16 y 18, son causantes del 72% de todos los cánceres de cuello uterino y, por orden de frecuencia, los genotipos 16, 18, 45, 31, 33, 52 y 58 son globalmente responsables de más del 85% de los casos (Fig. 2)(6,7).
Figura 2. Porcentaje acumulado de casos de cáncer de cérvix atribuidos a cada genotipo de VPH. Los VPH 16 y 18 representan en total más del 70% de la etiología del cáncer de cérvix en todas las regiones del mundo. X= VPH no genotipados. Fuente de datos: Muñoz N et al(7).
• Los VPH de alto riesgo (especialmente VPH 16 y 18) están implicados en el 40-85% de otros cánceres anogenitales (vagina, vulva, ano y pene) y en el 15-35% de los cánceres orofaríngeos, tanto en el hombre como en la mujer(4).
• Los genotipos VPH 6 y VPH 11 son mucosales de bajo riesgo y causantes de hasta el 90% de las verrugas genitales en el hombre y en la mujer, de la papilomatosis laríngea recurrente tanto juvenil como del adulto y de un alto porcentaje de las lesiones escamosas intraepiteliales de bajo grado (LSIL/CIN1) en la mujer(2).
La infección genital por VPH es transmitida por vía sexual, a través del contacto entre las superficies mucosas y cutáneas con personas previamente infectadas. Muy a menudo, la infección se adquiere precozmente tras el debut sexual, tanto en el hombre como en la mujer. Si la infección se produce por genotipos de bajo riesgo pueden desarrollarse, en ambos sexos, verrugas genitales sin potencial de malignización. Si se produce por VPH de alto riesgo, como el 16 o el 18, la infección aguda en la mujer puede acompañarse de un período de cambios citológicos de bajo grado en el cuello uterino. La mayoría de estas infecciones se resuelven espontáneamente, aunque en un porcentaje de mujeres, el VPH se mantiene persistente en la zona de transición del cuello uterino. Es, en estos casos, cuando existe el riesgo de progresión a lesiones epiteliales de alto grado (CIN 2 o CIN 3) y, en última instancia, a cáncer invasor(3).
El desarrollo de neoplasias debidas a la infección persistente por el VPH requiere la integración del ADN del virus en el genoma de la célula infectada, interfiriendo con la expresión de las proteínas reguladoras del crecimiento celular normal. La malignización se produce tras el desarrollo de múltiples mutaciones que condicionan la transformación celular y habitualmente requiere para el cáncer de cérvix un proceso lento de 10 a 30 años, aunque se han constatado evoluciones rápidas de tan solo 2 años desde la infección. El largo intervalo entre la infección y el desarrollo de cáncer sugiere que, aunque la infección por VPH es necesaria para su desarrollo, esta no es suficiente. Los determinantes genéticos y ambientales que facilitan la persistencia de la infección y colaboran con los oncogenes del virus para producir cáncer no son bien conocidos, con la excepción del estado de inmunocompetencia del huésped. El consumo de tabaco, el uso de anticonceptivos orales y la precocidad sexual en el inicio de las relaciones sexuales, son factores que incrementan el riesgo de infección persistente y el desarrollo de cáncer, y que deben tenerse muy en cuenta en las adolescentes y mujeres jóvenes (Tabla II)(1,3,8).
La historia natural de la infección por VPH de alto riesgo en el resto de zonas anogenitales y en orofaringe es menos conocida, aunque las lesiones preneoplásicas de alto grado de vulva y ano (VIN3 y AIN3) tienen un potencial de transformación maligna bien establecido(3).
Epidemiología
El inicio precoz de las relaciones sexuales en la adolescencia y el número de parejas sexuales son los factores de mayor riesgo para la adquisición de la infección por VPH.
Tanto la mujer como el hombre pueden ser portadores asintomáticos y vehículos de la infección por VPH. Aunque la prevalencia de infección varía en las distintas zonas geográficas del mundo, se considera que cerca del 80% de las mujeres se habrán infectado por, al menos, un tipo de VPH a lo largo de su vida. El riesgo estimado de contagio tras una relación sexual sin protección con una persona infectada es elevado y oscila entre el 40 y el 80%.
• En un gran estudio epidemiológico realizado en España, se detectó una prevalencia global de infección del 14% en mujeres de 18 a 65 años. En mujeres de 18 a 25 años, la tasa de infección resultó del 29% y a partir de los 30 años se reducía con la edad, hasta un 10% de media. En el 84% de las mujeres, la infección fue causada por un VPH oncogénico de alto riesgo, siendo el VPH 16 el más prevalente(1).
• En varones, la prevalencia de infección es menos conocida, ha sido evaluada en distintas regiones del mundo, oscila entre el 10 y el 40%, y se mantiene relativamente estable en las distintas edades de la vida. La menor tendencia a la infección persistente en el varón sugiere que esta prevalencia estable con la edad sea debida, más probablemente, a la adquisición de nuevas infecciones a lo largo de la vida(4).
La conducta sexual es un factor que determina el mayor o menor riesgo de infección a todas las edades, pero muy especialmente en adolescentes y jóvenes:
• La edad precoz en el inicio de las relaciones sexuales se asocia a mayor riesgo de prevalencia. Datos epidemiológicos en España sitúan la edad de la primera relación sexual entre los 17 y 21 años, aunque en más de un 7% de las mujeres se reduce a los 14-16 años. Además, confirma el avance en más de 5 años en la edad de la primera relación sexual entre las mujeres jóvenes (18-25 años) en comparación a las mujeres de mayor edad (56-70 años)(1).
• El número de compañeros sexuales a lo largo de toda la vida sexual es el factor correlacionado con un mayor riesgo de infección, estimándose un incremento de un 3-5% para la infección por VPH 16 y 18 por cada compañero sexual. Existen datos que indican que, aunque en España un 50% de las mujeres entre 18 y 25 años mantienen relaciones monógamas, en este rango de edad el porcentaje con 2-4 compañeros sexuales, o más de 5 compañeros sexuales, se incrementa respectivamente en 4 y 8 veces más en relación al que presentaron mujeres que actualmente tienen una edad superior(1).
• Un incremento del número de contactos sexuales de la pareja masculina de una mujer, aumenta el riesgo de infección de esta.
En la mayoría de los casos, la infección es transitoria y se resuelve espontáneamente, generalmente entre los 12 y 24 meses en mujeres y entre los 6 y 12 meses en los varones. En un 3-15% de las mujeres infectadas por los VPH de alto riesgo, la infección se vuelve persistente y constituyen el grupo de riesgo de desarrollo de neoplasias. La infección persistente en varones es menos frecuente que en las mujeres, estimándose tasas por debajo del 5%(1-4).
Estrategias preventivas frente a VPH
La vacunación frente a VPH es la estrategia preventiva prioritaria frente a las lesiones neoplásicas producidas por el papilomavirus.
La utilización del preservativo reduce el riesgo de contagio del VPH, aunque solo lo evita en un 60-70% de los casos, debido al contacto de zonas genitales no cubiertas por el mismo o a su uso inadecuado. La circuncisión reduce la prevalencia de infección en el varón, acorta el tiempo de aclaramiento viral y paralelamente puede disminuir el riesgo de contagio en la mujer.
El cribado citológico mediante la técnica de Papanicolau, ha sido y es la estrategia fundamental para la detección precoz de lesiones preneoplásicas de cuello uterino. Ha contribuido de forma determinante en la reducción, en más de un 75%, de la morbilidad y mortalidad por cáncer de cérvix en las poblaciones en las que se realiza de forma sistemática y continuada. En España, el cribado es oportunista, y aunque más de 80% de las mujeres entre los 18 y los 70 años se han realizado alguna vez una citología, a menos del 50%, se les ha practicado en el último año. Además, la cobertura es irregular e insuficiente en función de la edad (menor a mayor edad), situación socioeconómica (menor en niveles bajos) y región geográfica (inferior al 65% de cobertura en varias comunidades autónomas)(1). La incorporación reciente de técnicas de detección de ADN viral de VPH oncogénicos por PCR mediante frotis vaginal, permiten optimizar las estrategias de cribado y mejorar la eficiencia.
No existen técnicas de cribado para la detección precoz del resto de cánceres ano-genitales u orofaríngeos debidos a VPH(2).
Sin lugar a dudas, la vacunación profiláctica frente a la infección por papilomavirus, con eficacia y efectividad demostrada para evitar la infección persistente por determinados genotipos de VPH y el desarrollo de lesiones preneoplásicas debidas a estos, se convierte en la estrategia preventiva prioritaria frente a las distintas neoplasias relacionadas causalmente con la infección por este virus.
Vacunas frente al virus del papiloma humano
Las vacunas frente a VPH han demostrado ampliamente su eficacia en la prevención de determinadas neoplasias asociadas a esta infección, y los datos de farmacovigilancia mundial confirman su adecuado perfil de seguridad.
Todas las vacunas actualmente disponibles frente a VPH utilizan como antígeno la proteína estructural L1 de la cápside externa de los VPH obtenida por recombinación genética. Esta proteína se autoensambla cuando se expresa en cultivos de células eucariotas y forma partículas similares al virus (virus-like particles o VLPs) que son capaces de inducir una respuesta inmunitaria de anticuerpos neutralizantes que permite prevenir la infección por VPH. Son vacunas inactivadas y al no contener genoma viral, no pueden causar infección ni tienen potencialidad para causar lesiones neoplásicas.
Son vacunas profilácticas capaces de prevenir la infección inicial para determinados tipos de VPH, pero sin efecto terapéutico para los genotipos causantes de una infección ya establecida con anterioridad a la vacunación, ni sobre las lesiones producidas por esta infección previa(1,3,9).
Composición
Se trata de vacunas inactivadas: contienen proteínas estructurales L1 (VLPs) no infecciosas obtenidas por técnicas de recombinación genética. Existen dos vacunas comercializadas en España, la vacuna bivalente Cervarix® y la vacuna tetravalente Gardasil®. En julio de 2015, la Agencia Europea del Medicamento (EMA) ha autorizado una vacuna nonavalente denominada Gardasil 9®, y que tiene prevista la comercialización en España en 2016. En la tabla III, se detallan las diferencias en la composición de estas tres vacunas: los genotipos y dosis de proteína recombinante L1, su sistema de expresión para formar las VLPs y el tipo de adyuvante que contienen(10-12).
Inmunogenicidad
La vacuna bivalente presenta en mujeres de 15 a 25 años tasas de seroconversión del 100% tras la vacunación con tres dosis para los genotipos de VPH que contiene la vacuna, manteniendo a los 9,4 años las tasas de seropositividad con titulaciones, al menos, 10 veces superiores a las generadas por la infección natural. La vacuna tetravalente presenta en mujeres de 16 a 26 años tasas de seroconversión del 99-100% para los tipos incluidos tras la vacunación con tres dosis, manteniéndose a los 9 años tasas de seropositividad > 98% para el VPH16 y del 65% para el VPH18(1-3).
Tanto para la vacuna bivalente como tetravalente, se ha comprobado la adecuada inducción de memoria inmunológica con la administración de una dosis de refuerzo a los 6,5 y 5 años respectivamente.
Se han realizado estudios de inmunogenicidad en niñas y adolescentes de 9 a 14 años con la vacuna bivalente y en niñas, niños y adolescentes de ambos sexos de 9 a 15 años de edad con la tetravalente, con tasas de seroconversión del 100% para los genotipos incluidos en ambas vacunas y con titulaciones más de 2 veces superiores a las obtenidas en las mujeres de 15 a 25 años y de 16 a 26 años respectivamente, en las que se ha comprobado la eficacia clínica. Para ambas vacunas, se han realizado estudios de inmunogenicidad con dos dosis (pauta 0-6 meses) en niñas y adolescentes de 9 a 14 años (vacuna bivalente) y en niñas, niños y adolescentes de ambos sexos de 9 a 13 años (vacuna tetravalente), con respuesta no inferior a la obtenida en mujeres de 15 a 25 años y de 16 a 26 años respectivamente con pauta de 3 dosis, lo que ha permitido la indicación con dos dosis en dichos rangos de edad(1,3).
Con la vacuna nonavalente se han realizado estudios de inmunogenicidad en niñas, niños, adolescentes de ambos sexos, mujeres y hombres de 9 a 26 años. En todos los grupos de edad entre el 99 y el 100% de los vacunados presentaron tasas de seroconversión para los 9 genotipos contenidos en la vacuna al mes de la última dosis. Como ya ocurría con la vacuna tetravalente, los niños y niñas de 9 a 15 años presentaron titulaciones de anticuerpos superiores a las obtenidas en mujeres de 16 a 26 años, en las que se ha comprobado la eficacia clínica. En los estudios, se demuestra la no inferioridad inmunológica en relación a la vacuna tetravalente con pauta de 3 dosis en niñas, adolescentes y mujeres de 9 a 26 años de edad para los genotipos que comparten ambas vacunas (VPH 6, 11, 16 y 18). Estos datos permiten inferir la eficacia de la tetravalente a la nonavalente para estos genotipos. En varones entre 16 y 26 años, tanto las tasas de seroconversión como la titulación de anticuerpos fueron similares a las obtenidas para todos los genotipos en las mujeres del mismo rango de edad vacunadas con la nonavalente. Con esta vacuna, no se han realizado estudios en hombres o mujeres mayores de 26 años(2,3,13).
Eficacia
En los ensayos clínicos con un seguimiento de hasta 8 años, se corrobora para ambas vacunas, y a pesar de las diferencias en la inmunogenicidad, una eficacia superior al 95% para la prevención de las lesiones preneoplásicas de alto grado CIN2+, CIN3+, y adenocarcinoma in situ (AIS), y en la prevención de lesiones preneoplásicas vulvovaginales debidas a los VPH oncogénicos 16 y 18 en mujeres mayores de 15 a 25 años (vacuna bivalente) y de 16 a 26 (vacuna tetravalente)(3,9).
La vacuna tetravalente presenta en mujeres una eficacia del 99% para la prevención de verrugas genitales. En varones, esta vacuna ha demostrado globalmente una eficacia del 90% en la reducción de verrugas genitales y del 75% en la prevención de lesiones anales preneoplásicas de alto grado (AIN2+) debidas a los genotipos de VPH que contiene la vacuna(9,14). Estos datos han permitido extrapolar la eficacia para lesiones preneoplásicas y cáncer de ano en ambos sexos.
Se ha confirmado para las vacunas bivalente y tetravalente, la presencia de distintos grados de protección cruzada para otros tipos de VPH oncogénicos no incluidos en los preparados, que puede ampliar la efectividad global de la vacunación:
• Eficacia protectora frente a lesiones CIN2+ y AIS por genotipo VPH 31 del 56% con vacuna tetravalente y del 88% con vacuna bivalente(10,11).
• Eficacia protectora frente a lesiones CIN2+ y AIS por genotipos VPH 33, VPH 45, VPH 39, y VPH 51 del 68%, 82%, 75% y 55% respectivamente con la vacuna bivalente(11).
La eficacia clínica en niñas y adolescentes de 9 a 14 y 15 años se infiere para ambas vacunas en base a la no inferioridad inmunológica en relación a las cohortes de mujeres mayores de 15 y 16 años en las que se ha comprobado la eficacia protectora.
Para la vacuna nonavalente, la eficacia frente a los genotipos que comparte con la tetravalente se extrapola de la no inferioridad inmunológica entre la nueva vacuna y su predecesora, en la que se realizaron los estudios de eficacia. Para los 5 genotipos añadidos se realizó un estudio de eficacia que incluyó a 14.000 mujeres aleatorizadas para recibir la vacuna tetravalente o la nonavalente, seguidas durante una media de 40 meses. Las mujeres vacunadas con la nonavalente presentaron una eficacia > 97% en la reducción de CIN2+, CIN3+ o AIS causados por los VPH 31, 33, 45, 52 y 58(12,13).
Efectividad
Tras la introducción de la vacunación sistemática en preadolescentes, adolescentes y mujeres jóvenes, se han documentado ya los primeros datos de efectividad:
• En Australia, tras la introducción en 2007 de un programa de vacunación sistemática en chicas de 12-13 años de edad (con vacunación de rescate en adolescentes y mujeres jóvenes de hasta 26 años hasta el año 2009) se observó, ya desde 2011 (cobertura vacunal 70%), una reducción global del 85% en la prevalencia de verrugas genitales en poblaciones vacunadas con vacuna tetravalente (mujeres < 30 años), y una reducción muy significativa, debida a la inmunidad de grupo, de la tasa de verrugas genitales en varones no vacunados menores de 30 años(15). Resultados similares han sido registrados en otros países, como Nueva Zelanda, Estados Unidos, Dinamarca, Alemania y Suecia(9).
• Se ha documentado una reducción de la tasa de infección por VPH oncogénicos en mujeres vacunadas en países con coberturas vacunales de más del 50%, con una reducción de un 68% de la prevalencia de infección por VPH 16 y 18 en adolescentes y jóvenes de 13 a 19 años en el periodo posvacunal comparado con el periodo prevacunal. Adicionalmente, se han observado datos de protección cruzada frente a VPH 31, 33 y 45, y un efecto de protección indirecta en mujeres de 20 a 39 años y en hombres menores de 20 años, gracias a la inmunidad de grupo(9).
• Recientemente en Australia, se ha documentado el impacto del programa de inmunización iniciado en 2007 con la reducción global de lesiones preneoplásicas de alto grado (CIN2+, CIN3+) de hasta un 50% en la población que fue tributaria de vacunación, e incluso un discreto descenso también en cohortes de mujeres no vacunadas, probablemente por la inmunidad de grupo generada por la menor circulación de los genotipos vacunales(16). En EEUU, Canadá y otros países con programas de seguimiento bien estandarizados, se han comunicado también datos similares que corroboran la reducción de lesiones preneoplásicas de alto grado en sus cohortes objeto de vacunación, incluso con coberturas vacunales menores al 50%(9, 17).
Son necesarios más años de seguimiento para la constatación de la reducción esperada de lesiones preneoplásicas asociadas a VPH y, al menos, una o dos décadas más para poder valorar los primeros datos sobre el impacto en la reducción de la incidencia de cáncer invasor(9).
Seguridad y efectos adversos
Metanálisis de todos los ensayos clínicos de estas vacunas, con más de 30.000 mujeres con la vacuna bivalente, más de 29.000 personas (mujeres y hombres) con la tetravalente y cerca de 23.000 personas de ambos sexos con la nonavalente, muestran un excelente perfil de seguridad de estas vacunas(18).
Pero los datos más potentes para confirmar el adecuado perfil beneficio/riesgo de estas vacunas, nos los ofrece el seguimiento postcomercialización, con cerca de 100 millones de dosis administradas de las vacunas bivalente y tetravalente. En 2014, el Global Advisory Committee on Vaccine Safety de la Organización Mundial de la Salud revisó todos los datos existentes de los programas de farmacovigilancia a nivel mundial y ratificó sus conclusiones de 2009, confirmando el adecuado perfil de seguridad de estas vacunas y constatando que los efectos adversos más frecuentes de las mismas son la reactogenicidad local y el dolor muscular generalizado, generalmente leves y bien tolerados. No se ha constatado un incremento de enfermedades crónicas de nueva aparición, ni de enfermedades autoinmunes, ni de enfermedades neurológicas, ni de mortalidad asociados a la vacunación frente a VPH(18,19).
La farmacovigilancia continúa con el objetivo de garantizar la seguridad de las vacunas a la población, y prueba de ello es la comunicación en 2015, por parte de la EMA, de la resolución de su Comité de Evaluación de Riesgos en Farmacovigilancia (PRAC) sobre la seguridad de las vacunas frente a VPH. En dicho informe la EMA descarta la evidencia de una relación causal entre la vacunación y dos patologías extremadamente infrecuentes, como son el síndrome de dolor regional complejo y el síndrome de taquicardia postural ortostática, en las que se había observado una asociación temporal.
Además de la reactogenicidad local y el dolor muscular generalizado, otros efectos adversos que se presentan en algunos pacientes son: cefalea y, en ocasiones fiebre, habitualmente tolerables. Se han comunicado algunas reacciones alérgicas en pacientes sensibilizados a alguno de los componentes de las vacunas. Específicamente en adolescentes y jóvenes, se observa un incremento de síncopes tras la administración de estas vacunas y que se consideran debidos a reacciones vagales relacionadas con la inyección intramuscular, que son más frecuentes en este grupo de edad(1).
Para ambas vacunas, se han comunicado datos de seguridad en relación a la administración accidental de la vacuna en mujeres embarazadas, sin evidencia de incremento de efectos adversos en la mujer, abortos, partos prematuros ni efectos teratogénicos en el feto(18).
Indicaciones
En la tabla III, se detallan las indicaciones autorizadas por la EMA para toda Europa de cada una de las vacunas frente a VPH.
Pauta de administración
Vacuna bivalente(1,3,11)
• Niñas de 9 a 14 años de edad (ambos inclusive) deben recibir dos dosis de 0,5 ml por vía intramuscular a los 0 y 6 meses. El intervalo mínimo entre dosis es de 5 meses. Si se administrara la segunda dosis antes de este intervalo, deberá administrase necesariamente una tercera dosis, con un intervalo mínimo de 3 meses tras la segunda.
• A partir de los 15 años de edad, la pauta de vacunación consiste en 3 dosis de 0,5 ml administradas a los 0, 1 y 6 meses. El intervalo mínimo entre la primera y la tercera dosis debe ser de 5 meses y, al menos, 3 meses después de la segunda dosis. Es recomendable que las tres dosis se administren dentro del periodo de un año.
Vacuna tetravalente(1,3,10)
• Niñas y niños de 9 a 13 años de edad (ambos inclusive) deben recibir dos dosis de 0,5 ml por vía intramuscular a los 0 y 6 meses. El intervalo mínimo entre dosis es de 6 meses. Si se administrara la segunda dosis antes de este intervalo, deberá administrase necesariamente una tercera dosis, con un intervalo mínimo de 3 meses tras la segunda.
• A partir de los 14 años de edad, la pauta de vacunación consiste en 3 dosis de 0,5 ml administradas a los 0, 2 y 6 meses. El intervalo mínimo entre la primera y la segunda dosis es de 1 mes, y entre la primera y la tercera dosis debe ser de 5 meses, y, al menos, 3 meses después de la segunda dosis. Es recomendable que las tres dosis se administren dentro del periodo de un año.
Vacuna nonavalente(3,12)
• Niños, adolescentes y adultos de ambos sexos a partir de los 9 años de edad: deben recibir 3 dosis de 0,5 ml administradas a los 0, 2 y 6 meses. El intervalo mínimo entre la primera y la segunda dosis es de 1 mes, y entre la primera y la tercera dosis debe ser de 5 meses, y, al menos, 3 meses después de la segunda dosis. Es recomendable que las tres dosis se administren dentro del periodo de un año.
Las personas vacunadas con vacuna tetravalente pueden recibir una pauta de 3 dosis de vacuna nonavalente para ampliar la protección a los genotipos que esta incorpora(2,3).
Se debe completar la pauta de vacunación con el mismo preparado comercial. Sin embargo, si se desconoce o no está disponible el preparado comercial de la vacuna frente a VPH administrado con anterioridad, se puede utilizar para continuar o completar la serie cualquiera de las vacunas disponibles para asegurar, al menos, la protección frente a VPH16 y VPH18. No hay estudios que hayan evaluado la intercambiabilidad de las vacunas frente a VPH(3).
No se ha establecido hasta la actualidad, la necesidad de administrar dosis de refuerzo para ninguna de estas vacunas.
Precauciones y contraindicaciones
La vacuna está contraindicada en:
• Antecedentes de hipersensibilidad después de la administración de una dosis anterior.
• Antecedentes de alergia a cualquier componente de la vacuna.
• Embarazo.
Se recomienda posponer la administración de la vacuna hasta la recuperación clínica en caso de:
• Enfermedad aguda moderada o grave, con o sin fiebre.
• Fiebre alta (más de 38,5º axilar o 39º rectal).
Ya que no se dispone de datos de seguridad y eficacia en pacientes inmunodeprimidos ni mujeres en período de lactancia, la administración en estas situaciones debe considerarse con precaución y solo tras una valoración individualizada del beneficio/riesgo(1-3).
Coadministración con otras vacunas o medicamentos
Al tratarse de vacunas inactivadas, pueden coadministrarse en lugares anatómicos distintos con otras vacunas inactivadas o bien con vivas atenuadas, o administrarse con cualquier intervalo entre ellas, y también concomitantemente o con cualquier intervalo con inmunoglobulinas y hemoderivados(1-3).
Puede administrarse en mujeres que toman anticonceptivos hormonales.
Vacunación frente a VPH en la adolescencia
En la adolescencia y específicamente en las edades más tempranas de la misma, es cuando deben instaurarse las campañas de vacunación a nivel poblacional.
¿Contra qué nos protegen las vacunas?
Las tres vacunas, bivalente, tetravalente y nonavalente ofrecen protección frente al cáncer relacionado con los genotipos 16 y 18, causantes de la gran mayoría (≈ 65%) de los cánceres debidos a VPH en ambos sexos, y concretamente de ≈70% de los cánceres de cérvix en la mujer. La protección cruzada que ofrece la vacuna bivalente frente a genotipos no incluidos puede incrementar más esta protección, incluso hasta un 10-15% adicional para el cáncer de cérvix. Las vacunas tetravalente y nonavalente, al incluir protección para los tipos 6 y 11, previenen la mayoría (≈90%) de las verrugas genitales en ambos sexos. La vacuna nonavalente, con protección para 5 genotipos oncogénicos más, ofrece en relación a la tetravalente, un incremento de protección frente al cáncer relacionado con VPH mayor en las mujeres (de hasta un 15% adicional) que en los hombres (hasta un 4% adicional), dada la distinta implicación de estos genotipos como causales de las diferentes lesiones neoplásicas en cada sexo(20).
Recomendaciones de vacunación en la adolescencia
Dado que la alta eficacia protectora de las vacunas disponibles está vinculada a que la persona que se vacune no esté infectada por alguno de los genotipos de VPH que estas contienen, la mayor efectividad de cualquier estrategia vacunal se obtendrá cuando se vacune a la población antes de que se haya producido una infección por papilomavirus; ya que la infección por los VPH mucosales, oncogénicos o no, se produce precozmente con el inicio de la actividad sexual; es precisamente en la adolescencia y específicamente en las edades más tempranas de la misma, cuando deben instaurarse las campañas de vacunación a nivel poblacional. Además, en estas edades, en las que las niñas y adolescentes todavía están incluidas en programas de vacunación con otras vacunas y en las que socialmente hay mayor aceptación, se consiguen coberturas de vacunación más elevadas que en campañas dirigidas a adolescentes mayores o a adultos. Se ha comprobado que las campañas de vacunación a nivel escolar tienen una incidencia muy positiva en mejorar las coberturas en adolescentes. En España, la cobertura de vacunación a la edad de 14 años es subóptima, del 74,7% de media, y en algunas Comunidades Autónomas (CCAA) es inferior al 55%. Las mayores coberturas se observan precisamente en las CCAA que realizan vacunación escolar. La cobertura de la vacunación es esencial para obtener una efectividad elevada en la población, independientemente de la eficacia de la vacuna a nivel individual.
No obstante, si la persona ha iniciado ya relaciones sexuales, puede vacunarse sin necesidad de cribado previo. Estudios que han evaluado el riesgo de que una mujer menor de 25 años con actividad sexual esté infectada por uno de los genotipos 16 o 18 de VPH es menor del 10%, y simultáneamente por los dos menor al 1%. Aunque la mujer este infectada por uno de los de genotipos que contienen las vacunas, estas han demostrado eficacia protectora para el resto de genotipos y, por tanto, en la gran mayoría de casos, existirá beneficio para la mujer no siendo coste-efectico un cribado virológico previo a la vacunación(1).
La vacunación frente a VPH ha estado enfocada prioritariamente para la prevención del cáncer de cérvix por su elevada incidencia y su total asociación a la infección por VPH. La población diana han sido y siguen siendo las niñas preadolescentes y adolescentes entre los 11 y los 14 años de edad. No obstante, todas las mujeres de cualquier edad, y muy especialmente las mujeres jóvenes, al menos hasta los 26 años, deberían beneficiarse de esta vacunación(1). Prueba de ello, es el gran beneficio individual y poblacional que han representado los programas de rescate instaurados en algunos países, generando una reducción de la carga de la enfermedad en vacunadas e inmunidad de grupo para las cohortes no inmunizadas(15,16).
La protección frente a verrugas genitales y lesiones preneoplásicas y cáncer de ano que ofrecen la vacuna tetravalente y nonavalente, con indicación en ambos sexos, abre la posibilidad de plantear la vacunación sistemática también de los varones, además de la mujer. Es innegable que la carga global de la enfermedad atribuible a VPH, condicionada por la prevalencia del cáncer de cérvix, es mayor actualmente en la mujer que en el hombre (Fig. 1)(3), pero tampoco deja de ser cierto, que la carga de enfermedad neoplásica atribuible al VPH en el hombre no es despreciable, y se está incrementando(2,3). Específicamente, la vinculada al cáncer orofaríngeo atribuible a VPH, mucho más frecuente en el sexo masculino, va claramente en aumento en países desarrollados e independientemente de la orientación sexual(2). Otros cánceres como el de ano, también más frecuentes en el hombre que en la mujer, son claramente más frecuentes en varones homosexuales(3). Las verrugas genitales son lesiones benignas con una carga de enfermedad similar en hombres y mujeres. Y, finalmente, es indudable que el hombre juega un papel muy relevante en la transmisión de la infección, similar o probablemente superior al de la mujer(3).
Los datos ya disponibles de impacto de las campañas de vacunación en mujeres con altas coberturas, generando inmunidad de grupo al reducir la circulación de los VPH vacunales en la población, también son un elemento que plantea la necesidad de incrementar este beneficio poblacional con la vacunación de los varones. Finalmente, todo es un problema de coste-beneficio desde la vertiente de salud pública, cuando son las autoridades sanitarias quienes deben decidir la financiación de las campañas de vacunación. Existen estudios de coste-efectividad que consideran la estrategia de vacunar a los adolescentes de ambos sexos favorable desde la perspectiva de salud pública. La efectividad de ampliar la vacunación a varones está condicionada por la cobertura vacunal en mujeres, siendo mayor cuando menor es la cobertura en estas. Modelos matemáticos que evalúan este beneficio teórico para coberturas del 70% en ambos sexos, estiman un plus de reducción del 40% de la carga de enfermedad global en mujeres y un 60% en varones, en relación al beneficio de solo vacunar a mujeres(21). Algunos países como: EEUU, Canadá, Austria y Australia ya han incluido también la vacunación de varones en sus calendarios.
Con cualquier estrategia vacunal quien más se beneficia de la vacunación es la mujer, por su mayor carga de enfermedad, pero para hacer frente, con mayor efectividad, a la carga global de la enfermedad atribuible a VPH en la población, es necesario plantear la vacunación de los varones(22). Es razonable considerar que estas vacunas ofrecerán protección frente a las neoplasias atribuibles a VPH también en las regiones no anogenitales, como es la orofaríngea, y que son las que justifican la mayor carga observada en el sexo masculino. No obstante, no se han realizado estudios que demuestren la eficacia protectora en estas localizaciones y ninguna de las vacunas actuales tiene indicación para ellas. Igual que es deseable, obtener datos en este sentido, el futuro requiere vacunas con amplia cobertura para los VPH más prevalentes (de forma directa o con protección cruzada), pautas posológicas con el menor número de dosis posible (para mejorar coberturas y coste), y un menor precio que mejore el coste-efectividad de los programas y facilite su financiación pública.
Recomendaciones en España
El calendario común de vacunaciones para 2015 del Consejo Interterritorial del Sistema Nacional de Salud (CISNS) establece la vacunación sistemática en todas las Comunidades Autónomas de España, de todas las niñas a la edad de 12 años y da de plazo para su implantación hasta el mes de diciembre de 2016. El adelanto de la vacunación de los 14 a los 12 años permitirá mejorar la efectividad de la vacunación y es muy probable que favorezca el incremento de las coberturas vacunales de las adolescentes en nuestro país. Actualmente, el CISNS no establece ninguna recomendación de vacunación en varones(1).
El Comité Asesor de Vacunas de la Asociación Española de Pediatría establece en su calendario 2015, la recomendación de vacunación sistemática de todas las niñas entre los 11 y los 12 años de edad, y recomienda la vacunación de todas las adolescentes que no hubiesen recibido la vacuna por superar la edad fijada por cada CCAA para la vacunación sistemática. No establece, por el momento, una recomendación de vacunación sistemática en varones, aunque recomienda que se informe a los adolescentes y a sus familias sobre el beneficio de esta vacunación(23).
En un consenso de 2011, nueve sociedades científicas españolas establecían, tras una valoración individualizada, la recomendación de vacunar a varones con vacuna tetravalente(1).
Por tanto, la vacunación de los varones adolescentes en España queda a criterio de los pacientes y sus padres que por indicación de su pediatra o médico de familia, soliciten o acepten recibir esta vacunación. La vacunación individualizada no tiene un impacto comunitario significativo, y dada la mayor carga global de enfermedad en la mujer, la vacuna a nivel individual produce más beneficio en estas que en los varones. Dado el beneficio poblacional de la vacunación universal, y el incremento de efectividad que se podría conseguir con la vacunación de ambos sexos, debería considerarse la vacunación de los varones como una estrategia preventiva, desde la perspectiva de salud pública, en los programas de vacunación sistemática.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Marès J, Barrio F. Virus del papiloma humano. En: Álvarez F, Arístegui J, Moreno D, eds. Vacunas en Pediatría. Manual de la AEP 2012. Madrid: Exlibris Ediciones SL; 2012. págs. 524-43. Actualización julio 2015 disponible en: http://vacunasaep.org/documentos/manual/cap-42#1.
2.*** American Academy of Pediatrics. Human Papillomaviruses. En: Kimberlin DW, ed. Red Book: 2015 Report of the Committee on Infectious Diseases. 30th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2015. págs. 576-83.
3.*** Schiller JT, Lowy DR, Markowitz LE. Human Papillomavirus vaccines. En: Plotkin SA, Orenstein WA, Offit PA (ed). Vaccines. 6th ed. Philadelphia: Elsevier; 2013. Págs. 235-56.
4. Giuliano AR, Anic G, Nyitray AG. Epidemiology and pathology of HPV disease in males. Gynecol Oncol.2010; 117 (Suppl 2):S15-9.
5.* Castellsague X, San Martín M, González A, Casado MA. Epidemiología de las lesiones precancerosas y verrugas genitales asociadas a infección por virus del papiloma humano en España. Prog Obstet Ginecol. 2010 ; 53:81-7. doi:10.1016/j.pog.2009.07.001.
6.** Alemany L, Pérez C, Tous S, Llombart-Bosch A, Lloveras B, Lerma E et al. Human papillomavirus genotype distribution in cervical cancer cases in Spain. Implications for prevention. Gynecol Oncol. 2012; 124: 512-51.
7.* Muñoz N, Bosch FX, Sanjosé S, Herrero R, Castellsagué X, Shah KV et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med. 2003; 348: 518–27.
8.** Muñoz N, Castellsagué X, Berrington de Gonzalez, A, Gissmann L. El VPH en la etiología del cáncer humano. En: Bosch FX (editor). Vacunas VPH y cribado en la prevención del cáncer de cuello uterino. Vaccine (Ed Esp). 2006; 24(S:3): 1-10.
9.*** Bruni L, Serrano B, Bosch X y Castellsagué X. Vacuna frente al virus del papiloma humano. Eficacia y seguridad. Enferm Infecc Microbiol Clin. 2015; 33: 342-54. http://dx.doi.org/10.1016/j.eimc.2015.03.018.
10. Gardasil, Sanofi Pasteur MSD. Ficha técnica. Actualización marzo 2015. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000703/WC500021142.pdf. Último acceso el 15 de septiembre de 2015.
11. Cervarix, GlaxoSmithKline. Ficha técnica. Actualización abril 2015. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/000721/WC500024632.pdf. Último acceso el 115 de septiembre de 2015.
12. Gardasil 9, Sanofi Pasteur MSD. Ficha técnica. Primera publicación julio 2015. Disponible en: http://www.ema.europa.eu/docs/es_ES/document_library/EPAR_-_Product_Information/human/003852/WC500189111.pdf. Último acceso el 15 de septiembre de 2015.
13.** Joura EA, Giuliano AR, Iversen OE, Bouchard C, Mao C, Mehlsen J, et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women. N Engl J Med. 2015; 372: 711-23.
14.* Giuliano AR, Palefsky DJ, Goldstone S, Moreira ED, Penny EM, Aranda C, et al. Efficacy of quadrivalent HPV vaccine against HPV infection and disease in males. N Engl J Med. 2011; 364: 401-11.
15.** Ali H, Donovan B, Wand H, Read TR, Regan DG, Grulich AE, et al. Genital warts in Young Australians five years into national human papillomavirus vaccination programme: national surveillance data. BMJ. 2013; 346: f2032.
16.** Crowe E. Effectiveness of quadrivalent human papillomavirus vaccine for the prevention of cervical abnormalities: case-control study nested within a population based screening programme in Australia. BMJ. 2014; 348: g1458.
17.* Hariri S, Bennett NM, Niccolai LM, Schafer S, Park IU, Bloch KC, et al. Reduction in HPV 16/18-associated high grade cervical lesions following HPV vaccine introduction in the United States -2008-2012. Vaccine. 2015; 33: 1608-13.
18.*** Stillo M, Carrillo Santisteve P & Lopalco PL†. Safety of human papillomavirus vaccines: a review. Expert Opin. Drug Saf. 2015; 14: 697-712. doi: 10.1517/14740338.2015.1013532.
19.** World Health Organization. Human papillomavirus vaccines: WHO position paper, October 2014. Wkly Epidemiol Rec. 2014; 89: 465-91.
20.** Markowitz LE. 9-valent HPV vaccine background, transitional issues, and additional vaccination. Program and abstracts of the Advisory Committee on Immunization Practices Meeting; June 24-25, 2015; Atlanta, Georgia. Disponible en: http://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2015-06/hpv-02-markowitz.pdf. Último acceso 31 julio 2015.
21.** Marty R, Roze S, Bresse X, Largeron N, Smith-Palmer J. Estimating the clinical benefits of vaccinating boys and girls against HPV-related diseases in Europe. BMC Cancer. 2013; 13:10. http://www.biomedcentral.com/1471-2407/13/10.
22.** Newman P, Lacombe-Duncan A. Human papillomavirus vaccination for men: advancing policy and practice. Future Virol. 2014; 9: 1033-47.
23.* Moreno-Pérez D, Álvarez García FJ, Arístegui Fernández J, Cilleruelo MJ, CorretgerRauet JM, García Sánchez N, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2015. An Pediatr (Barc). 2015; 82: 44.e1-12.
Bibliografía recomendada:
– Schiller JT, Lowy DR, Markowitz LE. Human Papillomavirus vaccines. En: Plotkin SA, Orenstein WA, Offit PA (ed). Vaccines. 6th ed. Philadelphia: Elsevier; 2013. Págs. 235-56.
Capítulo excelente y actualizado sobre las vacunas frente a papilomavirus en el tratado de vacunología de mayor prestigio a nivel mundial. De lectura imprescindible.
– American Academy of Pediatrics. Human Papillomaviruses. En: Kimberlin DW, ed. Red Book: 2015 Report of the Committee on Infectious Diseases. 30th ed. Elk Grove Village, IL: American Academy of Pediatrics; 2015. p. 576-83.
Revisión sobre las infecciones producidas por el virus del papiloma humano, actualizada en 2015 por la Academia Americana de Pediatría. Información concisa, relevante, de gran utilidad práctica y de lectura imprescindible.
– Marès J, Barrio F. Virus del papiloma humano. En: Álvarez F, Arístegui J, Moreno D, eds. Vacunas en Pediatría. Manual de la AEP 2012. Madrid: Exlibris Ediciones SL; 2012. p. 524-43.
Capítulo sobre vacunación frente al papilomavirus en el Manual de la Asociación Española de Pediatría que incorpora, además de la visión general de la infección y su prevención, información relativa al impacto de la enfermedad en España. Actualizado en julio de 2015, en el manual disponible on-line en la web del Comité Asesor de Vacunas de la AEP en: http://vacunasaep.org/documentos/manual/cap-42#1.
– Bruni L, Serrano B, Bosch X y Castellsagué X. Vacuna frente al virus del papiloma humano. Eficacia y seguridad. Enferm Infecc Microbiol Clin. 2015; 33: 342-54. http://dx.doi.org/10.1016/j.eimc.2015.03.018.
Excelente revisión, muy actualizada, de todos los datos disponibles de eficacia, efectividad y seguridad de todas las vacunas comercializadas frente al virus del papiloma humano. Revisión muy recomendable.