 |
| Temas de FC |
O. Asensio de la Cruz, M. Bosque García, A. de los Ríos Pérez, C. Montón Soler, M. Espasa Soley
Unidad de Neumología, Alergia e Inmunología pediátricas. Unidad de Fibrosis Quística.
Laboratorio de Microbiología. Hospital de Sabadell. Corporació Sanitaria i Universitaria Parc Taulí
| Resumen La infección e inflamación crónica pulmonar y sus complicaciones asociadas son, con mucho, las principales causas de la morbilidad y mortalidad de la Fibrosis Quística (FQ). Desde que en los años 60 la introducción de los enzimas pancreáticos eliminaran la malnutrición como primera causa de muerte, hemos observado un avance considerable en el tratamiento de las manifestaciones respiratorias. En este artículo, revisamos el estado de la cuestión en relación con el manejo y seguimiento de las manifestaciones respiratorias de la FQ. Esta mejora ha condicionado un espectacular aumento de la esperanza de vida, en la actualidad superior a los 40 años. A pesar de ello, aún se precisan de nuevos avances para que la afectación pulmonar no sea un obstáculo para la salud y la vida de dichos pacientes. En ausencia de un tratamiento definitivo con terapia genética o de reparación proteica del defecto básico, el diagnóstico precoz, la aplicación de medidas preventivas y tratamientos combinados paliativos que actúen sobre la cascada etiopatogénica de la enfermedad, son básicos para modificar el curso natural de la misma. El conocimiento de las bases moleculares que condicionan la historia natural de la enfermedad debe permitir este avance. Los programas de cribaje neonatal son básicos para implementar estos objetivos. |
| Abstract
The chronic lung infection and inflammation and its associated complications are by far the leading causes of morbidity and mortality of cystic fibrosis (CF). Since the 60’s the introduction of pancreatic enzymes eliminate malnutrition as a cause of death we observed a significant advance in the treatment of respiratory manifestations. This article reviews the state of art off the management and follow up of CF respiratory manifestations. This improvement has conditioned a dramatic increase in life expectancy, today more than 40 years. Yet still require new developments to the pulmonary involvement is not an obstacle to health and life of these patients. In the absence of a definitive treatment by gene therapy or protein of the basic defect repair, early diagnosis, implementation of preventive and palliative combination therapies acting on the etiopathogenic cascade of the disease are essential to modify the natural course of the same . Knowledge of the molecular bases that determine the natural history of disease should allow this development. Neonatal screening programs are essential to implement these objectives. |
Palabras clave: Fibrosis quística; Enfermedad pulmonar; Epidemiología; Tratamiento y complicaciones.
Key words: Cystic fibrosis; Pulmonary disease; Epidemiology; Treatment and complications.
Pediatría Integral 2012; XVI(2): 156-169
Fibrosis quística y sus manifestaciones respiratorias
Introducción
Las manifestaciones respiratorias de la fibrosis quística, las infecciones respiratorias con sus reagudizaciones, así como las complicaciones pulmonares de las mismas, son la principal causa de la morbi-mortalidad en la FQ.
Desde la identificación del gen de la FQ en 1989, en la década de los 90 se ha conseguido un rápido conocimiento de la estructura y funcionamiento del producto del gen, la proteína CFTR (Cystic Fibrosis Transmembrane Conductance Regulator).
Esfuerzos multidisciplinarios se han dirigido a conocer las bases moleculares de la enfermedad y, al mismo tiempo, a la mejora del seguimiento y tratamiento de los pacientes afectos.
La relación entre la disfunción de la proteína reguladora transmembrana de la fibrosis quística (CFTR) y la fisiopatología de la enfermedad pulmonar en la FQ, cada vez está más clara. El transporte iónico anormal de cloro y sodio en las células epiteliales del aparato respiratorio condiciona una disminución del volumen de líquido de superficie de la vía aérea, lo que enlentece el transporte mucoso y dificulta la eliminación bacteriana. De este modo, se inicia una respuesta inflamatoria crónica que conduce, finalmente, a la lesión pulmonar en la FQ.
Investigadores clínicos y de laboratorio están aplicando estos conocimientos para investigar correctores del defecto genético y del proteico, así como los factores críticos que facilitan la infección crónica endobronquial, para aplicarlos en el desarrollo de posibles nuevos tratamientos más efectivos que en la actualidad ya no descartan, a corto/medio plazo, la posible curación de la enfermedad.
Epidemiología
Es la enfermedad hereditaria grave, más frecuente de la raza blanca, afectando a 1 de cada 3.000-5.000 recién nacidos, donde la morbilidad y mortalidad vienen condicionadas especialmente por la afectación pulmonar. Con los conocimientos actuales, se considera que un recién nacido en los 90 tiene una esperanza de vida de unos 40 años. Aun así, la FQ sigue siendo una enfermedad que puede acortar la vida de sus afectados, en función del genotipo, de factores ambientales y del tratamiento. La aplicación de programas de cribado en algunas comunidades españolas, nos ha permitido observar que la prevalencia puede variar ampliamente según la zona. Concretamente en Cataluña, la prevalencia se estima en alrededor de 1/6.000 recién nacidos(1). Técnicas combinadas de determinación de Tripsina Inmunoreactiva (TIR) con el estudio molecular de mutaciones muestran una excelente sensibilidad y especificidad para el diagnóstico de FQ, siendo la base del cribado neonatal. Gracias al diagnóstico precoz, se puede instaurar un seguimiento y un tratamiento precoz, mejorando el pronóstico nutricional y el desarrollo cognitivo y pulmonar de los pacientes. Ello nos debe permitir poder prevenir las complicaciones tempranas, retrasar la colonización crónica por gérmenes patógenos y la aplicación de nuevos tratamientos antes de que aparezcan las lesiones. El retraso en el diagnóstico clínico nos puede hacer llegar tarde a muchos de estos objetivos.
La importancia del cribado neonatal para la FQ, aunque no implantado de forma general, se ha hecho evidente. Diferentes estudios demostraron, ya hace unas décadas, la mejora del estado nutricional en los niños diagnosticados por el cribado neonatal, por tanto, con un diagnóstico precoz (DP), respecto a los de diagnóstico tardío (DT), por la clínica. Pero cada vez, hay más evidencias de que, a nivel pulmonar, también mejora la morbilidad.
En la Unidad de FQ del Hospital de Sabadell, evaluamos a 29 pacientes de la misma edad y características, 18 en el grupo de DP con diagnóstico por cribado y 11 en el grupo de DT (diagnóstico clínico tardío); de ellos, 65,5% niños, un 24,1% homocigotos para la mutación DeltaF508, un 48,3% heterocigotos y un 31%, combinaciones de otras 2 mutaciones. Se analizaron 602 cultivos de esputo: 357 en el DP y 245 en el DT, el 40,7% de ellos resultaron positivos, siendo menor el porcentaje en el grupo DP (31,9%) que en el grupo DT (53,7%). En ambos grupos, Staphylococcus aureus fue el germen más prevalente. Burkholderia cepacia complex y Pseudomonas aeruginosa morfotipo mucoso se aislaron solo en el grupo DT. Un 63,6% de los pacientes del grupo DT fueron portadores crónicos de Staphylococcus aureus, frente a un 38% de los del grupo DP, y un 9% portadores de Pseudomonas aeruginosa y Burkholderia cepacia complex en el grupo DT frente al 0% del grupo DP. La función pulmonar fue normal en un 93,3% del grupo DP frente al 75% del grupo DT. Así mismo, el grupo DT precisó más ingresos hospitalarios por reagudización pulmonar que el grupo DP. Estos resultados se hallan resumidos en la tabla I(3,24,25).

Debido al diagnóstico precoz, al mejor conocimiento de la fisiopatología de la enfermedad y a la aplicación de las nuevas estrategias de tratamiento, en los últimos 25 años se ha cuadriplicado la proporción de adultos, pasando del 8 al 33%. En una encuesta realizada a los afectados de la Asociación Catalana de Fibrosis Quística en 1995, se constataron similares cambios a los de registros de otros países, con modificaciones en las complicaciones, gérmenes detectados y necesidades de los pacientes en función con la edad(2).
En el transcurso de estos últimos años, se ha incrementado el conocimiento e interés por el control de la infección pulmonar en la FQ, pero también se han observado cambios epidemiológicos de los patógenos relacionados con dicha infección, siendo todo ello cada vez más complejo. Staphylococcus aureus, Haemophilus influenzae y Pseudomonas aeruginosa siguen siendo los patógenos más frecuentes, pero Burkholderia cepacia complex, Stenotrophomonas maltophilia, Achromobacter (Alcaligenes) xylosoxidans, Aspergillus sp, micobacterias no tuberculosas y virus se postulan como patógenos de importancia creciente en dichos pacientes con FQ. Existen diversos factores que han contribuido a estos cambios. El manejo clínico-terapéutico ha variado y de basarse en tratamientos a través de ingresos hospitalarios, ha pasado a ser, mayoritariamente, de forma ambulatoria o mediante tratamientos domiciliarios(9). Los pacientes reciben cursos repetidos de antibióticos orales, por vía inhalada o endovenosos, emergiendo resistencias antimicrobianas y apareciendo organismos multirresistentes.
Los registros nacionales de pacientes son herramientas importantes para poder adecuar los planes de salud a los cambios que se vayan produciendo y para monitorizar el progreso en la atención de esta patología, la FQ como una nueva enfermedad del adulto(4,5).
Con el avance del conocimiento, podemos ser optimistas en que el pronóstico pueda mejorar y que incluso podamos, en un futuro no muy lejano, hablar de curación de la enfermedad.
Genética
La FQ es una enfermedad autosómica recesiva, causada por mutaciones en un único gen del brazo largo del cromosoma 7 que codifica la proteína CFTR(15).
El descubrimiento del gen permitió comprobar que éste codificaba una proteína que se llamo Reguladora de conductancia Transmembrana para la Fibrosis Quística (CFTR) y que ésta correspondía a un canal del cloro que era regulado por el AMPc.
Desde entonces, más de 1.800 mutaciones han sido descritas, siendo la más frecuente la Delta F 508, pero variando mucho su frecuencia en función de la raza y región del mundo estudiada.
Estudios fisiológicos in vitro han demostrado que mutaciones en el gen de la FQ pueden alterar la función del CFTR en las células epiteliales de diferentes maneras, variando desde la pérdida completa hasta una expresión parcial de la misma con pobre conductancia de cloro.
Esta proteína CFTR inicia su síntesis a partir del núcleo, de donde pasa, por el sistema retículo-endotelial y aparato de Golgi, donde se irá glicosilando y transformando hasta llegar a su localización definitiva en la membrana celular (Fig. 1). Las diferentes mutaciones pueden alterar cualquiera de los pasos y, en función de ello, se han clasificado en: mutaciones de clase 1, donde no se sintetiza proteína (mutaciones Nonsense tipo: G542X…); de clase 2, donde hay un bloqueo en el procesamiento, con una degradación prematura y un fallo en alcanzar la membrana celular (Missense: Delta F 508…); clase 3, donde hay un bloqueo en la regulación con un descenso de la actividad (G551D…); clase 4, donde hay una alteración en la conductancia (R117H…); clase 5, donde se observa una reducción en la síntesis (A455E…); y clase 6, donde hay una aumento del turnover de la proteína a nivel epitelial.

Figura 1. Clases de mutaciones de la CFTR.
Estas consecuencias moleculares de las mutaciones de la CFTR pueden explicar la amplia variabilidad clínica de esta enfermedad que va, desde casos muy graves, que fallecerán los primeros años de su vida, a formas leves, que se pueden diagnosticar en la 6ª o 7ª década de la vida.
Algunos fenotipos, como el de la insuficiencia pancreática, están bien caracterizados (buena correlación entre genotipo y fenotipo), en este caso dependiendo de la correcta localización de la proteína en la membrana celular; mientras que, otros, como el de la afectación pulmonar grave, son menos conocidos o dependen más de factores ambientales o de genes modificadores que pueden estar en otros cromosomas. Así, podemos saber que la presencia del 20% de la CFTR en la membrana evitaría los síntomas respiratorios pero no la ausencia congénita de vasos deferentes.
Defecto básico proteico
La proteína CFTR está formada por 5 partes o dominios. Dos de ellos de membrana, que forman físicamente el poro del canal. Dos citoplasmáticos, que regulan la apertura y cierre, y uno regulador que, al ser fosforilado por la PKA en presencia de ATP, permite la apertura del canal.
El defecto básico que condiciona esta alteración en el canal del cloro es la disminución en la secreción de cloro del espacio intracelular a la luz bronquial y un aumento de la reabsorción de Na y como consecuencia, una disminución de agua a nivel de la luz bronquial, con la secundaria disminución del líquido periciliar, alteración de la movilidad ciliar, aumento de la viscosidad del moco y retención de secreciones(6).
Existirían también otros canales del cloro, unos regulados por la propia CFTR y otros alternativos dependientes del Ca.
La propia alteración de la proteína CFTR podría jugar un papel importante en la predisposición a infecciones, como la de la Pseudomonas aeruginosa (PA).
Patofisiología
El conocimiento molecular del defecto de la FQ nos ha permitido entender la patogenia de la enfermedad desde el defecto genético hasta la lesión pulmonar, así como desarrollar líneas de investigación para dar soluciones terapéuticas adecuadas a los problemas de la cascada patogénica de la FQ(7).
Aunque aún hay controversias sobre la exactitud del proceso, la cascada etiopatogénica propuesta es la que se esquematiza en el algoritmo, donde el trastorno iónico condicionaría los cambios visco-elásticos de las secreciones. Éstas más fácilmente obstruirían la luz bronquial, abonando un terreno ya de por sí predispuesto, por el defecto proteico, para las infecciones y su cronificación. En la actualidad, se cree que el defecto proteico estaría involucrado en defectos de inmunidad innata que podrían jugar un papel importante en la infección persitente por gérmenes específicos. La respuesta inflamatoria persistente (elastasas, proteasas, oxidación…) no adecuadamente contrarrestada al sobrepasar la propia capacidad de la vía aérea de defensa acabaría por dañar el propio parénquima en un intento frustrado de eliminar la infección.
Tratamiento
Del defecto genético
Terapia genética
Al ser la FQ una enfermedad hereditaria recesiva, es potencialmente susceptible de terapia genética. El DNA complementario para la CFTR ha sido satisfactoriamente clonado y su introducción in vitro en cultivos de células epiteliales respiratorias se ha comprobado que corrige el defecto del canal del cloro. Estudios en cultivo de tejido demuestran que la expresión del CFTR en el 6-10% de las células corrige la alteración del canal del cloro, pero no el aumento de la reabsorción de Na.
Diversos vectores conteniendo el DNAc de la CFTR han sido desarrollados para la liberación del DNAc CFTR en la vía aérea. Tres vectores son los más estudiados: adenovirus, virus adenoasociados y liposomas, demostrando su eficacia, aunque limitada, en el tiempo, probablemente por la reacción inmunitaria neutralizante que condicionan.
Estos estudios han demostrado que la CFTR puede transducirse a las células epiteliales de la vía aérea pero con baja eficacia, pudiendo transitoriamente corregir la expresión funcional de la enfermedad. Nuevos estudios están siendo aplicados para desarrollar el sistema óptimo de administración para que resulte en un prolongado efecto y no condicione una respuesta inflamatoria del organismo local e inmune que pueda lesionar más el parénquima o limitar su eficacia en el tiempo. Algunos estudios a largo plazo han obtenido resultados desalentadores, con alteración funcional respiratoria superior a la observada con el placebo. La búsqueda de vectores que permitan mantener los beneficios más tiempo sin efectos inflamatorios añadidos debe ser el futuro.
Del defecto proteico
Se están desarrollando nuevos tratamientos farmacológicos dirigidos hacia las alteraciones proteicas de las mutaciones más frecuentes. Algunos resultados parciales ya han visto la luz y estarán aplicables para la práctica clínica en un corto periodo de tiempo. Las mutaciones clase I no producen proteína CFTR debido a una señal de parada prematura en el CFTR DNA. Durante estos últimos años, se han intentado corregir, no con mucho éxito, con la administración inhalada de aminoglucósidos, que eliminarían la señal aberrante de parada, pero otros estudios con otras sustancias (PTC 124) parecen tener más éxito en su reparación. Las proteínas CFTR inestables de las mutaciones clase II pueden restituirse manipulando las interacciones de los chaperones con la CFTR con chaperones químicos o fármacos que afecten a la regulación del gen, tales como los butiratos. La base de la clase III es la producción de una CFTR que reduce el transporte de Cl por la regulación anómala del canal del cloro. La genisteína puede vencer este bloqueo. Recientemente, resultados muy esperanzadores se han observado con un potenciador del CFTR, el VX-770, observándose mejoras precoces y mantenidas de la función pulmonar, nº de exacerbaciones, incremento de peso e incluso, en la normalización del test del sudor en pacientes con mutaciones tipo G551D(32).Otras estrategias que combinan potenciadores y correctores se están ensayando en mutaciones del tipo II (Delta F508). Las mutaciones que reducen parcialmente la conductancia del cloro a traves del CFTR (clase IV) pueden estimularse con milrinona, que es un inhibidor de la fosfodiesterasa. Algunos trabajos parecen indicar que pueden producirse aumentos de la expresión con butiratos. Fármacos correctores y potenciadores de la expresión del CFTR o la combinación de ambos son, en este momento, las estrategias con un futuro más alentador(16-18).
Del trastorno iónico de las secreciones, aumento de viscosidad,obstrucción bronquial
Modificadores del transporte iónico
El defecto fisiológico asociado a la anormalidad del producto del gen de la CFTR es una combinación de la disminución de la secreción de cloro por los canales regulados por el CFTR y una excesiva reabsorción de Na, lo cual promueve la absorción pasiva de agua de la luz bronquial.
Dos aproximaciones terapéuticas se están estudiando para corregir este defecto de transporte.
Inhibición de la reabsorción de Na
El amiloride es un diurético que actúa como antagonista del canal del Na. Se administra en aerosol 4 veces al día inicialmente, habiendo demostrado una disminución en el declive de la función pulmonar de los pacientes. Posteriores estudios controlados no parecen confirmarlo.
Activación de canales alternativos del cloro
Los nucleótidos trifosfato, como el ATP y, especialmente, el UTP, parecen estimular la secreción de cloro, especialmente si se utilizan concomitantemente con la administración de amiloride.
Suero hipertónico al 7%
La inhalación de suero hipertónico 2 veces al día mejora la función pulmonar, disminuye la viscosidad del moco y el nº de exacerbaciones de los pacientes con FQ. El gusto salado y la tos son inconvenientes que pueden limitar su utilización, pero la hiperreactividad puede mejorarse con el tratamiento previo con beta-2-adrenérgicos. La idoneidad de iniciar el tratamiento en un momento evolutivo u otro aún está por definir(20).
Mucolíticos
La anormal viscosidad de las secreciones de las vías aéreas en los pacientes con FQ se debe primordialmente a la presencia de polimorfonucleares y de sus productos de degradación.
La agregación del DNA de los neutrófilos muertos en largos filamentos condiciona el aumento de la viscosidad.
En estudios in vitro se demostró que una desoxiribonucleasa recombinante humana puede digerir el DNA extracelular, reduciendo la viscosidad del esputo en pacientes con FQ. La eficacia y seguridad de la DNAsa rh ha sido estudiada en varios estudios. La administración de 2,5 mg inhalados 1 vez al día mejora la función pulmonar alrededor de un 6% y reduce el riesgo de exacerbaciones entre un 25-30%. Hay resultados controvertidos en su eficacia en el tratamiento de las exacerbaciones o a largo plazo. Se utiliza de forma mayoritaria en afectaciones moderadas con FVC >40% y con infección crónica endobronquial con cultivos de esputo positivos y patrón obstructivo en la espirometría.
Otro mucolítico como el Gelsolin, estudiado por Stossel T. P., podría actuar rompiendo los filamentos de actina y facilitando la acción de la DNAsa rh.
Eliminación de secreciones
Las anormales propiedades viscoelásticas del esputo purulento en pacientes con FQ condicionan la retención de secreciones y la obstrucción de la vía aérea.
La fisioterapia y el drenaje postural siguen siendo el pilar básico para evitar dicha retención. Aunque su aplicación mejora la función pulmonar y la evolución del paciente, es una técnica que consume tiempo y energía, que requiere colaboración y que debe ser realizada por personal entrenado. Por ello, últimamente se están utilizando nuevas técnicas que consuman menos tiempo y doten especialmente a adolescente y adultos de mayor independencia.
Técnicas como: drenaje autogénico, espiración forzada, peep mask, flúter, compresión torácica de alta frecuencia… se están mostrando útiles y facilitan el cumplimiento de la fisioterapia. Dichas técnicas se deben emplear de forma individualizada en función de la edad del paciente, estado clínico y efectividad individual. Y aunque algún metaanálisis falla en encontrar evidencia de eficacia de la fisioterapia en la FQ, en buenas manos y aplicándola de forma individualizada, sigue siendo un pilar básico en el tratamiento de dichos pacientes.
Broncodilatación
Los fármacos broncodilatadores se han mostrado eficaces como tratamiento complementario de la aerosolterapia y fisioterapia. La presencia de hiperreactividad bronquial en el FQ no es uniforme, pero es más frecuente que en la población general. Está presente entre el 40-75% de los pacientes. La utilización de broncodilatadores debería ser considerada en pacientes que mejoren > de un 10% su FEV1 tras la administración del mismo. Así mismo, pueden ser de utilidad en las exacerbaciones. Normalmente, se utilizan los beta-2-adrenérgicos a las mismas dosis que para el asma. Algunos tratamientos inhalados antibióticos lo recomiendan antes de su administración.
Infección
Trabajos recientes han confirmado el papel de la CFTR alterada en la mayor susceptibilidad de los pacientes con FQ para las infecciones pulmonares. Las células que expresan la proteína CFTR alterada tendrían un defecto en la internalización de la Pseudomonas aeruginosa por la célula, paso previo para su destrucción. Todo ello, junto con las alteraciones del líquido periciliar, condicionaría un fallo en la inmunidad innata del paciente.
Así mismo, en el epitelio respiratorio de los pacientes con FQ existiría un mayor número de receptores Asialo GM1 para la Pseudomonas aeruginosa, que explicaría la mayor adherencia de dichas bacterias a las células epiteliales. Aparte de la infección por Pseudomonas aeruginosa, por lo general hay una historia natural en la colonización bacteriana en los pacientes con FQ. De forma habitual, inicialmente se colonizan por Gram negativos, posteriormente y de forma temprana, como nos ha permitido observar la práctica de cribajes neonatales en nuestro colectivo de pacientes, Staphylococus aureus y Pseudomona aeruginosa. Actualmente, es controvertida la profilaxis antiestafilocócica, aunque de nuevo algunos autores insisten en su interés(21).
Mientras que los patógenos tradicionales, como: P. aeruginosa, Staphylococcus aureus meticilina-sensible (MSSA) y Haemophilus influenzae, siguen siendo los patógenos más frecuentes, estos se están viendo acompañados por un nuevo grupo de organismos que incluyen: Burkholderia cepacia complex, Stenotrophomonas maltophilia, Achromobacter xylosoxidans, S. aureus resistente a meticilina (MRSA), Pandorea spp, Ralstonia spp, así como otros microorganismos Gram negativos más raros. De entre estos nuevos patógenos pulmonares para la FQ que han aparecido, cabe destacar que, mientras ya se ha demostrado que la infección por Burkholderia cepacia complex (BCC) empeora la función pulmonar, la relación entre Stenotrophomonas maltophilia y Achromobacter xylosoxidans y la evolución clínica continúa en debate. De todos modos, debe tenerse en cuenta que el efecto de los patógenos puede variar en función del fenotipo de cada paciente y que no siempre está claro cuándo un germen está realmente emergiendo, o cuándo su aumento de prevalencia puede estar relacionada con la utilización de nuevas técnicas moleculares de los laboratorios.
En nuestro medio, en un estudio realizado en la Unidad de FQ del Hospital de Sabadell sobre 4.264 muestras de 15 años (1995-2009), los gérmenes más prevalentes fueron: Staphylococcus aureus (1078n, 40,8%), Pseudomonas aeruginosa (512n, 19,4%), Burkolderia cepacia complex (440n, 16,7%), Enterobacteriáceas (163n, 6,2%), E. coli (103n, 3,9%), Klebsiella spp (90n, 3,4%), Haemophilus influenzae (88n, 3,3%), Stenotrophomonas maltophilia (50n, 1,9%) y Achromobacter xylosidans (12, 0,5%). Observamos a lo largo del tiempo una disminución progresiva de Pseudomona aeruginosa y Burkolderia cepacia complex, y un aumento de la prevalencia de Staphylococcus aureus, con aparición de Achromobacter y Stenotrophomonas (Fig. 2). Burkolderia cepacia complex, Stenotrophomonas y Achromobacter se han mostrado panresistentes; mientras que, Pseudomona aeruginosa mantiene una resistencia inferior al 5-10% frente a colimicina y tobramicina (Tabla II). La resistencia del Staphylococcus aureus fue de un 8,5% frente a oxacilina de forma estable, sin embargo mantiene una sensibilidad del 100% frente a la vancomicina (Tabla III, Fig. 3)(28,30,31).


Figura 2. Prevalencia anual de microorganismos en pacientes con fibrosis quística de la Unidad de Fibrosis Quística del Hospital de Sabadell.

Figura 3. Evolución anual de las resistencias de Staphylococcus aureus.

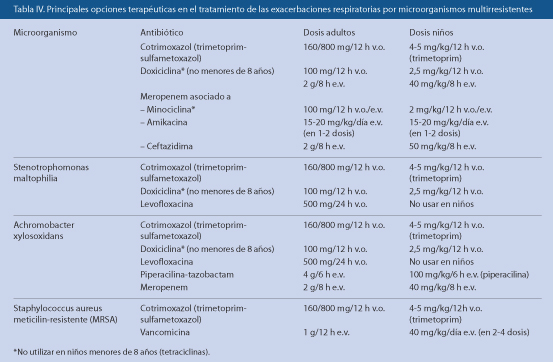
Las opciones terapéuticas para exacerbaciones por gérmenes panrresistentes se especifican en la tabla IV.
La presencia de una exacerbación pulmonar viene definida por los siguientes criterios:
• Aumento de la tos y/o dificultad respiratoria, menos tolerancia al ejercicio.
• Cambios en el aspecto o en el volumen de la expectoración.
• Nuevos signos a la auscultación.
• Nuevos hallazgos radiológicos.
• Pérdida del apetito.
• Fiebre y
• Disminución de la función pulmonar.
Indicaría la necesidad de iniciar un ciclo de tratamiento antibiótico (ATB)(22,29).
En general, se utilizan ATB por vía parenteral 14-21 días, siendo los regímenes más comunes los que asocian un aminoglucósido con un betalactámido activos frente a la Pseudomona.
Diferentes pautas y más controversia hay en el tratamiento preventivo o de mantenimiento en los portadores de infección crónica.
Estudios recientes ponen en duda la eficacia de tratamientos continuos antiestafilocócicos desde el diagnóstico en retrasar la afectación pulmonar y la colonización por Pseudomona aeruginosa. Aunque resultados controvertidos discuten su idoneidad aun en la actualidad.
Los centros daneses siguen recomendando la terapia discontinua cada 3-4 meses con ATB endovenosos para los portadores crónicos de infección, argumentando la mejor evolución y pronóstico de estos pacientes, aparentemente sin la selección de gérmenes resistentes que otros argumentaban. La utilización en su defecto de terapias continuas o discontinuas de tratamiento antibiótico nebulizado con compresor puede ser una alternativa(8).
La aparición de ATB antipseudomónicos por vía oral, como las quinolonas, facilitan el tratamiento de exacerbaciones leves-moderadas.
La presencia de Micobacterias atípicas entre el 12-28% de los adultos afectos de FQ y de hongos, como el Scedosporium apiospermum, y su papel patogénico en la evolución posterior de la enfermedad (colonización versus enfermedad) sigue siendo analizado.
Estrategias de tratamiento de las infecciones por Pseudomonas aeruginosa
Tratamiento de las primeras infecciones por Pseudomonas
Hay una evidencia creciente que la prevención de la infección crónica por Pseudomonas ofrece beneficios importantes en los pacientes afectos de FQ, teniendo menos síntomas y mejor estado general de salud, así como una disminución en el declive de la función pulmonar y una mejora en la supervivencia. La edad de inicio de la condición de portador crónico de infección por P. aeruginosa puede ser un predictor del pronóstico de la enfermedad. El éxito de la identificación y el tratamiento precoz en la prevención de la colonización crónica determinará la calidad de vida y la supervivencia del paciente. Estudios realizados en pacientes diagnosticados mediante cribaje han evidenciado las ventajas del mismo sobre el diagnóstico por clínica, en función de la mejor evolución nutricional, cognitiva y pulmonar.
Mayoritariamente, ante la primera presencia de Pseudomonas aeruginosa en el esputo, probablemente después de reconfirmar la presencia de Pseudomonas en el esputo y de descartar que el estado clínico del paciente no precise tratamiento endovenoso, se inicia un régimen combinado de 3 semanas de colistina nebulizada o tobramicina inhalada 28 días y ciprofloxacino oral durante 21 días. Si el cultivo se negativiza, se recomienda seguir tratamiento inhalado hasta 6-12 meses, cuando se considera erradicada la Pseudomonas. Si no desaparece la P. aeruginosa o aparecen nuevos síntomas después de las 3 semanas, se mantiene el tratamiento inhalado y se inicia un ciclo de 2 semanas de tratamiento endovenososo con ceftacidima y tobramicina. Están en marcha diversos estudios que valoran la posibilidad de tratamientos antibióticos inhalados para las primocolonizaciones. Nuevos cultivos de esputo positivos para Pseudomonas aeruginosa se tratarán de la misma forma. Diversos estudios están comparando diferentes pautas de tratamiento inhalado, solo o con ciprofloxacino oral, así como estudios comparativos entre diferentes antibióticos inhalados (colimicina, tobramicina, aztreonam).
Tratamiento de las exacerbaciones
Una exacerbación se define por la presencia de, al menos, cuatro de estos hechos: aumento de la tos y/o dificultad respiratoria, cambios en el aspecto o en el volumen de la expectoración, nuevos signos a la auscultación, nuevos hallazgos radiológicos, pérdida del apetito, fiebre y disminución de la función pulmonar. Pero, probablemente, el hecho más informativo es la caída de un 10% o más de la FEV1 o FVC basal, más dos o más signos de empeoramiento de los síntomas respiratorios de vías aéreas bajas.
Independientemente de los criterios usados, es aconsejable el inicio de tratamiento endovenoso, que debe ser continuado durante un mínimo de 10-14 días y un máximo de 21 días o hasta que no se observe mejoría. El tratamiento precoz puede prevenir la pérdida permanente de función pulmonar tanto a corto como a medio plazo.
En la elección del antibiótico, el principal objetivo es conseguir el tratamiento más efectivo y menos tóxico. Objetivos secundarios serán el reducir la posibilidad de resistencias bacterianas y el uso de regímenes con mejor relación coste-beneficio. Por lo general, se utilizará la combinación de 2 antibióticos con diferente mecanismo de acción. Por ejemplo, un beta-lactámido y un aminoglucósido. La elección se realizará en función de la sensibilidad del esputo actual o de su historial. La frecuencia óptima de la administración de los antibióticos está en la actualidad en discusión. Los beta-lactámidos se utilizan administrados 3-4 veces al día, ya que son más efectivos cuando los niveles de antibiótico se mantienen de forma prolongada por encima de la concentración mínima inhibitoria. Los aminoglucósidos se han administrado clásicamente 3 veces al día, pero cada vez hay más evidencias para utilizarlos incluso en la FQ 1 vez al día, ya que su máximo efecto se consigue al lograr altos niveles intermitentes y su toxicidad depende del fallo de eliminar adecuadamente el fármaco entre las dosis. El tratamiento se mantendrá a partir de las dos semanas si se observa aún una mejoría progresiva en espera de recuperar los parámetros de función pulmonar, saturación de O2, score clínico y ganancia de peso previos a la exacerbación o hasta llegar a una meseta de mejoría clínica-funcional(9,10).
Tratamiento de portadores crónicos
Delante de esta situación, dos aproximaciones son posibles, con resultados en ocasiones controvertidos. Los centros daneses, basándose en sus excelentes resultados de supervivencia y morbilidad, aplican el tratamiento electivo endovenoso cada 3-4 meses; mientras que, otros centros solo realizan tratamiento sintomático. La tendencia en conjunto es a tratar con tratamiento inhalado continuo o intermitente y realizar tratamiento sintomático de las exacerbaciones, siendo frecuente en los casos clínicos moderados-severos la realización de 3-4 ciclos de tratamiento endovenoso al año. Argumentos para la administración electiva de antibióticos endovenosos serían: la disminución del número de exacerbaciones, la reducción de la infección y de los posibles efectos inflamatorios de la misma, el mejorar la función pulmonar, el peso y la supervivencia. A favor de tratar solo las exacerbaciones, estaría: la falta de evidencia del beneficio de los antibióticos electivos, la presumible disminución de problemas médicos (alergia, resistencia, accesos venosos, toxicidad…), la menor disrupción personal y familiar, el menor coste y el desconocimiento de los efectos adversos de los antibióticos a largo plazo.
La progresión de la enfermedad en pacientes con infección crónica por P. aeruginosa es muy individual y abundantes factores, probablemente aún desconocidos, pueden jugar un papel notable. De manera que, es muy importante individualizar el manejo y éste puede incluir el tratamiento endovenoso electivo cada 3 meses en algunos pacientes.
Tratamientos para infecciones por otros gérmenes se basarán en la susceptibilidad microbiana, los patrones de resistencia local, experiencias previas y, en general, se aplicarán en función de la presencia de clínica(11,12).
Antiinflamatorios
Desde hace años, se conoce que la respuesta inflamatoria frente a una infección crónica, no adecuadamente compensada por los propios mecanismos pulmonares sobrepasados en su capacidad de neutralizar, es la causante de lesión pulmonar progresiva. Los pacientes con valores normales de IgG (indicador de poca actividad infecciosa) tienen mejores scores clínicos y una más lenta progresión de la enfermedad.
La presencia de neutrófilos perpetúa el ciclo de la inflamación al liberar estímulos quimiotácticos (leucotrienos, citoquinas) y enzimas proteolíticas que degradan la elastina y otras proteínas estructurales, así como al interferir con los mecanismos de defensa inmunitaria.
La utilización de corticoides a 1-2 mg/kg a días alternos ha mostrado su eficacia en enlentecer la progresión de la enfermedad. Pero sus importantes efectos secundarios limitan su utilización.
Otros antiinflamatorios no esteroideos, como el ibuprofeno a dosis altas, de 30-40 mg/kg/día, también enlentecen la progresión con menos efectos secundarios. Debido a su especial farmacocinética, habría que asegurar unos niveles séricos entre 50-100 mcg/ml.
Otros fármacos que se están estudiando son: los corticoides tópicos inhalados, la pentoxifilina (una xantina que suprime la activación de los neutrófilos, su quimiotaxis y degranulación) y otras sustancias que bloqueen las sustancias tóxicas liberadas, como los antioxidantes y la alfa-1 -antitripsina como antielastasa.
Diferentes estrategias y nuevos fármacos se están analizando para su posible aplicación en un futuro no muy lejano(13) (Fig. 4).

Figura 4. Nuevas estrategias de tratamiento y fase de estudio.
Comorbilidades y complicaciones
Broquiolitis
La bronquiolitis es una infección viral común durante los dos primeros años de la vida, siendo, en ocasiones, en los países donde no se realiza el cribaje neonatal de la FQ, el momento donde, por su evolución más tórpida de lo habitual, se hace el diagnóstico clínico de la enfermedad.
Por otra parte, el diagnóstico mediante el cribaje permite implementar medidas preventivas (palivizumab) que minimicen el impacto de una posible infección por VRS. Las sobreinfecciones, sobre todo por enterobacteriáceas o por Stafilococcus aureus, se observan a menudo en el curso de una bronquiolitis VRS positiva, siendo difícil de establecer si la sobreinfección bacteriana que padecen estos niños es primaria o secundaria. Además, las infecciones virales parecen tener un papel en la reactividad de gérmenes como la Pseudomonas aeruginosa, colonizadora habitual de las vías aéreas de estos pacientes.
Lactantes con bronquiolitis grave pueden beneficiarse del tratamiento con corticoides sistémicos, corticoides nebulizados y antibióticos. Este tratamiento debe ser guiado por cultivo, si es posible. Si el paciente tiene el cultivo negativo, tratamiento empírico con tobramicina y ceftacidima debe ser iniciado.
Atelectasias
Los infiltrados pulmonares, sobre todo en lóbulos superiores, son un hallazgo común en los niños con FQ, las atelectasias lobares son menos frecuentes, presentándose solo en el 5% de los niños pequeños afectos. El lóbulo medio es el lóbulo que más frecuentemente se afecta, la fisioterapia agresiva, los antibióticos apropiados y los broncodilatadores son el tratamiento de elección de esta complicación. En adolescentes, la aspergilosis puede ser causa de atelectasias. Cuando persisten a pesar del tratamiento médico, se puede practicar una fibrobroncoscopia, con un lavado broncoalveolar, para intentar remover la atelectasia; se puede realizar el lavado solo con suero fisiológico o con mucolíticos del tipo de la DNAsa o de N-acetil cisteína.
Reflujo gastroesofágico
El reflujo gastroesofágico se da con cierta frecuencia en los lactantes y niños afectos de FQ. La probable etiología es el aumento de la presión intra-abdominal junto a la presión intratorácica negativa debida a la tos crónica y a la obstrucción de la vía aérea.
La clínica que presentan estos lactantes afectos de reflujo es: vómitos frecuentes, estancamiento ponderal, intranquilidad, aumento en número de bronquitis y más hiperreactividad bronquial.
Neumotórax-neumomediastino
El neumotórax-neumomediastino ocurre en estos pacientes debido a la rotura de bullas subpleurales a través de la pleura visceral. En alguna ocasión, estos pacientes también pueden presentar un neumotórax traumático, como resultado de una complicación en el curso de la colocación de una vía central o con la ventilación mecánica.
Si el neumotórax es pequeño y asintomático, puede realizarse tratamiento conservador pero, si es un neumotórax grande y presenta una insuficiencia respiratoria con dolor que impide la respiración normal precisando suplementación de oxígeno, entonces se debe colocar un drenaje bajo agua. Si el neumotórax no se resuelve o recidiva, se debería valorar someter al paciente a una pleurodesis o pleurectomía; aunque, si el paciente va ser candidato a un trasplante pulmonar debería intentarse evitar.
Hemoptisis
La hemoptisis es muy frecuente en los pacientes con FQ, sobre todo las de pequeña cantidad de sangre, tanto en los adultos como en niños.
Las hemoptisis masivas de más de 250 ml de sangre en 24 horas, ocurren en el 7% de los pacientes adultos.
La causa de la hemoptisis en estos pacientes es la granulación tisular que crea la infección pulmonar crónica, junto con la rotura de los capilares y de los vasos sanguíneos que condiciona la tos continua que presentan la mayoría de los pacientes. Agravada por el déficit de vitamina K, por la malabsorción intestinal y enfermedad hepática, junto con la disfunción plaquetaria, debida a los múltiples tratamientos antibióticos y a la trombocitopenia por el hiperesplenismo.
Las hemoptisis moderadas se suelen controlar con: reposo y un apropiado tratamiento antibiótico, normalmente endovenoso, debiéndose valorar la fisioterapia, administrar un antitusígeno del tipo de la codeína, además de tratamiento postural. El paciente debe estar estirado en la cama sobre el lado que sangra y con suplementación de oxígeno. En hemoptisis severas o repetidas pueden ser necesarias transfusiones.
En las hemoptisis masivas (Tabla V), se requiere una embolización de la arteria pulmonar previa broncoscopia para localizar el sitio del sangrado; si falla la embolización, debe realizarse tratamiento quirúrgico, ligando la arteria bronquial correspondiente o practicando una resección quirúrgica, muchas veces muy mal tolerada si el enfermo presenta una enfermedad pulmonar avanzada.

Aspergilosis broncopulmonar alérgica
La relación entre el Aspergillus fumigatus y la fibrosis quística es extremadamente compleja. Se pueden encontrar colonias de Aspergillus fumigatus en el esputo en el 50% de los casos y precipitinas positivas en el 27%.
El diagnóstico de la aspergilosis broncopulmonar alérgica en un enfermo de FQ se debe sospechar cuando se constate un empeoramiento pulmonar brusco e inesperado. En general, se aprecian infiltrados pulmonares fugaces, eosinofilia y unas pruebas cutáneas positivas. El paciente puede presentar también: precipitinas positivas, IgE elevada (>5 veces del valor normal) y un Rast positivo a Aspergillus fumigatus.
Se puede utilizar con buenos resultados, el itraconazol, 200 mg, 2 veces al día, por un periodo prolongado (> cuatro meses). Los importantes efectos secundarios de los corticoides sistémicos en estos pacientes hacen que, en pacientes no respondedores o que inician diabetes relacionada con FQ coincidiendo con su administración, deba valorarse la utilización de otras estrategias. Recientemente, se han publicado series pequeñas de pacientes con buena respuesta al omalizumab, que permitiría evitar el tratamiento corticoideo(26,27).
Los micetomas son raros en los pacientes afectos de FQ. La enfermedad invasiva es más frecuente en los pacientes trasplantados.
Cor pulmonale
Los pacientes con enfermedad pulmonar avanzada e hipoxemia severa, sobre todo durante el sueño y el ejercicio, pueden desarrollar esta complicación.
El mecanismo potencial es la hipoventilación que, junto con los cambios de ventilación-perfusión-difusión, relacionados con la enfermedad pulmonar, condiciona una severa hipoxemia que desencadena una hipertensión pulmonar y ésta, a su vez, condiciona un fallo cardiaco derecho.
Insuficiencia respiratoria
Los pacientes afectos de FQ desarrollan un fallo respiratorio hipoxémico, lo que conduce a una hipertensión pulmonar y a un cor pulmonale.
Al mismo tiempo, la obstrucción de la vía aérea disminuye la capacidad vital, el volumen tidal y la ventilación alveolar, con un progresivo aumento del CO2 y un fallo respiratorio hipercápnico.
El tratamiento inmediato de la insuficiencia respiratoria consiste en fisioterapia respiratoria agresiva, incluyendo técnicas de presión positiva intermitente, antibióticos apropiados orales, endovenosos o inhalados, drogas antiinflamatorias, incluyendo los esteroides y broncodilatadores, suplementación con O2, diuréticos, suplementos de potasio y drogas cardiotónicas, si es necesario.
En los casos de hipercapnia severa, se puede administrar aminofilina o beta-2-adrenérgicos endovenosos, pudiéndose también instaurar ventilación mecánica por vía endotraqueal o nasal.
Las enfermedades neuromusculares, las alteraciones de la pared torácica, la enfermedad pulmonar intersticial difusa, la EPOC, las bronquiectasias y la FQ están caracterizadas por un déficit de ventilación-perfusión-difusión, produciéndose una enfermedad hipercápnica crónica, llegando así a un estado final de la enfermedad. Los factores predictivos de mortalidad son: FEV1 y la PaO2 pero, si los pacientes presentan, además, una PaCO2 alta, la mortalidad es del 50-60% a los dos años.
Hasta la actualidad, los textos clásicos de FQ recomendaban la ventilación mecánica solo cuando existía una insuficiencia respiratoria aguda, potencialmente reversible y como puente para el trasplante pulmonar, pero nunca se debía utilizar en pacientes con enfermedad pulmonar terminal. Ahora las indicaciones (Tabla VI) de la ventilación mecánica en los pacientes afectos de FQ han cambiado(14).

Los pacientes afectos de una insuficiencia respiratoria irreversible deben tener una oportunidad para el trasplante pulmonar. El primer trasplante pulmonar se efectuó en EE.UU. en el año 1963. En el año 1981 fue cuando el grupo de Stanford, en California, realizó el primer trasplante cardiopulmonar en pacientes afectos de FQ, que presentaban enfermedad pulmonar avanzada en la que se habían agotado las posibilidades de una terapéutica conservadora.
En España, los primeros trasplantes pulmonares datan del año 1990. Cuando un enfermo presenta los criterios clínicos (Tabla VII) que indican el beneficio de un trasplante, no se debe retrasar la revisión, para valorar (Tabla VIII) si es subsidiario o no al trasplante.

Las contraindicaciones (Tabla IX) cada vez son menos, debido a la progresiva experiencia que van adquiriendo los equipos de trasplante.

Es una alternativa última necesaria. Pero, aunque los resultados son esperanzadores (supervivencia del 60% en los 5 primeros años), aún existen problemas sin resolver, como: la elección del momento de la indicación por las largas listas de espera, las infecciones pulmonares multirresistentes, la inmunosupresión crónica, las infecciones oportunistas, el rechazo y enfermedades relacionadas, así como la escasez de donantes.
En este último punto, se han iniciado experiencias de trasplantes lobares de donantes vivos relacionados con escasas secuelas para los donantes y con resultados equiparables a los trasplantes pulmonares de órganos cadavéricos.
Plan de seguimiento
Aunque los tres pilares fundamentales del tratamiento de la FQ continúan siendo la fisioterapia, el control de la infección y el soporte nutricional, al ser una enfermedad crónica posiblemente fatal condiciona otros retos tanto para el paciente, como para la familia o el clínico. Esto implica el conocimiento específico del tratamiento de la enfermedad, así como el de problemas relacionados con la cronicidad y gravedad de la misma, como son: psicosociales, económicos, educacionales, etc.
Para atender adecuadamente estos problemas, son necesarias habilidades en diversas disciplinas, hecho que ha condicionado la composición multidisciplinaria de los equipos que atienden a estos pacientes en los países desarrollados (clínico especialista, enfermera, fisioterapeuta, dietista, trabajadores sociales, genetistas y psicólogos). Además, algún miembro de la familia debe ser considerado como un miembro más del equipo y educado para ello, siendo pieza fundamental para muchos objetivos. La presencia de un paciente adulto en los equipos se ha sugerido en los últimos años, siendo una idea que puede ser beneficiosa para el mejor acercamiento a la realidad de los pacientes. Igualmente, se han unido especialistas clínicos de adultos.
Las Unidades de Fibrosis Quística se localizan en hospitales grandes que proveen el lugar donde la aproximación multidisciplinaria puede operar más eficazmente. Donde se centralizan test diagnósticos y exploraciones complementarias complejas, se realizan actividades educativas de formación continuada, tanto para los pacientes y familia como para el equipo, así como al grupo de pediatras de Atención Primaria que pueden atender a dichos pacientes. La comunicación debe ser fluida y la colaboración, asegurada. Con el paso de los años, el tratamiento de los pacientes con FQ cada vez más se realiza ambulatoriamente o en su domicilio. Precisando de la colaboración de las familias, los equipos de Atención Primaria y atención continuada, así como también en función de su existencia de los equipos de atención domiciliaria. Pieza que pensamos básica para implementar un adecuado tratamiento domiciliario que se equipare en cuanto a seguridad y eficacia al hospitalario.
Por lo general, se recomiendan en función de las posibilidades, controles clínicos cada mes, donde se realizan controles clínicos, recogida de cultivo de esputo, práctica de función pulmonar y fisioterapia, y donde se repasan con el paciente el cumplimiento y los problemas que surgen en función de su patología crónica. De forma individualizada y según la evolución clínica de cada paciente, se realizan controles analíticos y de exploraciones de diagnóstico por la imagen (generalmente, de forma anual). Con el diagnóstico neonatal, posible con los programas de cribaje, y el conocimiento de la historia natural de las diferentes “fibrosis quísticas”, el seguimiento más adecuado para cada situación podrá ser definido en el futuro próximo.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.** Asensio O, Cobos N, Seculi JL, Casals T, Bosque M, et al. Programa de cribaje neonatal para la fibrosis quística en Catalunya. Investig Clín 2001;4 (supl 1): 82-83.
2.** Asensio O, Bosque M, Marco MT. Fibrosis quística, una nueva patología del adulto. An Esp Ped. 1997; 46: 24-8.
3.*** Bosque M, Asensio O. Severe infections caused by Pseudomonas aeruginosa. Hauser AR, Rello J (eds.). Perspectives on critical care infections diseases series. Kluwer Academic Publishers; 2003.
4.*** Döring G, et al. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus. Eur Respir J. 2000; 16: 749-67.
5.** FitzSimmons S. The changing epidemiology of cystic fibrosis. Curr Probl Pediatr. 1994; 24(5):171-9.
6.*** Gibson RL, Burns JL, Ramsey BW. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am J Respir Crit Care Med. 2003; 168: 918-51.
7.** Koch C, Hoiby N. Diagnóstico y tratamiento de la fibrosis quística. Respiration (edición española). 2001; 3(1): 1-9.
8.*** Landau LI. Cystic fibrosis: trasition from paediatric to adult physician’s care. Thorax. 1995; 50: 1031-2.
9.** Marco T, Asensio O, Bosque M, de Gracia J, Serra C. Home intravenous antibiotics for cystic fibrosis (Cochrane Review). The Cochrane Library, Issue3. Oxford: Update Software; 2002.
10.** Moss RB. Cystic fibrosis: pathogenesis, pulmonary infection, and treatment. Clin Infect Dis. 1995; 21: 839-51.
11. Orenstein DM, et al. Cystic Fibrosis. Philadelphia: Lippincott Williams & Wilkins; 2000.
12.*** Ramsey BW, et al. Inermittent administration of inhaled Tobramycin in patiens with cystic fibrosis. N Engl J Med. 1999; 340: 23-30.
13.** Ramsey BW. Management of Pulmonary disease in patiens with Cystic Fibrosis. N Engl J Med. 1996; 335: 179-88.
14.** Serra A, Polese G, Braggion C, Rossi A. Non-invasive proportional assist and presssure support ventilation in patiens with cystic fibrosis and chronic respiratory failure. Thorax. 2002; 57(1): 50-4.
15.** Tsui LC. The spectrum of cystic fibrosis mutations. TIG. 1992; 8: 392-8.
16.*** Weeb AK, Dodd M, Abbott J. Adult Cystic Fibrosis: Current issues in a regional Unit. Resp Med. 1993; 87(1): 9-15.
17.** Zeitlin PL. Tratamiento farmacológico futuro de la fibrosis quística. Respiration. 2001; 3(2): 109-15.
18.** Pamela B. Davis Cystic Fibrosis Since 1938. Am J Respir Crit Care Med. 2006; 173: 475-82.
19.** Rao S, Grigg J. New insights into pulmonary inflammation in cystic fibrosis. Arch Dis Child. 2006; 91: 786-8.
20.*** Elkins M, Robinson M, Rose BR, Harbour C, Moriarty CP, Marks GB, et al. for the National Hypertonic Saline in Cystic Fibrosis (NHSCF) Study Group. A Controlled Trial of Long-Term Inhaled Hypertonic Saline in Patients with Cystic Fibrosis Hypertonic saline preceded by a bronchodilator is an inexpensive, safe, and effective additional therapy for patients with cystic fibrosis. N Engl J Med. 2006; 354: 229-40.
21.* Smyth A. Prophylactic antibiotics in cystic fibrosis: a conviction without evidence? Pediatr Pulmonol. 2005; 40: 471-6.
22.** Hafen GM, Ranganathan SC, Robertson CF, Robinson PJ. Clinical Scoring Systems in Cystic Fibrosis. Pediatr Pulmonol. 2006; 41: 602-17.
23.*** Accurso FJ. Update in Cystic Fibrosis 2005. Am J Respir Crit Care Med. 2006; 173: 944-7.
24.** Dankert-Roelse JE, Merelle MK. Review of outcomes of neonatal screening for cystic fibrosis versus non-screening in Europe. J Pediatr. 2005; 147: s15-s20.
25.*** Hoffman G, Parad RB, Wilfond BS, Rosenfeld M, Comeau AM, Accurso FJ, et al. Guidelines for Implementation of Cystic Fibrosis Newborn Screening Programs: Cystic Fibrosis Foundation Workshop Report. Pediatrics. 2007; 119: e495-e518.
26.** Antunes J, Fernández A, Borrego M, Leiria-Pinto P, Cavaco J. Cystic fibrosis, atopy, asthma and ABPA. Allergol Immunopathol (Madr). 2010; 38(5): 278-84.
27.*** Pérez-de-Llano LA, Vennera MC, Parra A, Guallar J, Marin M, Asensio O, et al. Effects of omalizumab in Aspergillus-associated airway disease. Thorax. 2011; 66(6): 539-40.
28.*** Saiman L, Siegel J. Infection control in cystic fibrosis. Clin Microbiol Rev. 2004; 17: 57-71.
29.*** Parkins MD, Elborn JS. Newer antibacterial agents and their potencial role in cystic fibrosis pulmonary exacerbation management. J Antimicrob Chemother. 2010; 65: 1853-61.
30.** Vrankrijker AMM, Wolfs TFW, van der Ent CK. Challenging and emerging pathogens in cystic fibrosis. Paediatr Respir Rev. 2010; 11: 246-54.
31. Asensio de la Cruz O, de los Ríos Pérez AM, Espasa Soley M, Bosque García M, Montón Soler C, Fontanals Aymerich D. Patógenos respiratorios en pacientes con fibrosis quística. Revisión de los últimos 15 años. Anales de Pediatría. 2009; 71 (Espec Congr): 68.
32. Ramsey BW, Davies J, McElvaney NG, Tullis E, Bell SC, Devnek P, et al., for the VX08-770-102 Study Group. A CFTR Potentiator in Patients with Cystic Fibrosis and the G551D Mutation. N Engl J Med. 2011; 365: 1663-72.
Bibliografía recomendada
– Bosque M, Asensio O. Severe infections caused by Pseudomonas aeruginosa. Hauser AR, Rello J (eds.). Prespectives on critical care infections diseases series. Kluwer Academic Publishers; 2003.
Libro donde se revisan en general todas las infecciones severas por Pseudomonas aeruginosa. Concretamente, en el capítulo de los autores, se revisa la estrategia europea de tratamiento de la infección por Pseudomonas aeruginosa en el paciente con FQ, comparándose con la visión norteamericana.
– Döring G, et al. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus. Eur Respir J. 2000; 16: 749-67.
Un panel de expertos consensúan una pauta de actuación frente las infecciones por Pseudomonas aeruginosa basándose en la evidencia y la experiencia. Documento básico para clínicos que controlen a pacientes afectos de FQ.
– Gibson RL, Burns JL, Ramsey BW. Pathophysiology and management of pulmonary infections in cystic fibrosis. Am J Respir Crit Care Med. 2003; 168: 918-51.
Este comprensivo “estado de la cuestión” resume el conocimiento publicado sobre la patofisiología y microbiología de la enfermedad pulmonar en la FQ. Se describen las bases moleculares de la enfermedad pulmonar, desde el impacto del defecto proteico en la fisiología de la vía aérea, clearance mucociliar, hasta el establecimiento de la infección por Pseudomonas aeruginosa.
– Landau LI. Cystic fibrosis: transition from paediatric to adult physician’s care. Thorax. 1995; 50: 1031-2.
Modelos de transición de los pacientes de las Unidades Pediátricas a las de adultos.
– Ramsey BW, et al. Intermittent administration of inhaled Tobramycin in patiens with cystic fibrosis. N Engl J Med. 1999; 340: 23-30.
Primer estudio de 24 semanas de duración en pacientes con FQ en el que se demuestra que la administración de tobramicina inhalada es adecuadamente tolerada, mejorando la función pulmonar, disminuyendo la densidad de P. aeruginosa en esputo y disminuyendo el riesgo de hospitalización.
– Weeb AK, Dodd M, Abbott J. Adult Cystic Fibrosis: Current issues in a regional Unit. Resp Med. 1993; 87(1): 9-15.
Primeros resultados sobre la evolución de una de las primeras Unidades de Fibrosis Quística de adultos del Reino Unido.
– Elkins M, Robinson M, Rose BR, Harbour C, Moriarty CP, Marks GB, et al. for the National Hypertonic Saline in Cystic Fibrosis (NHSCF) Study Group. A Controlled Trial of Long-Term Inhaled Hypertonic Saline in Patients with Cystic Fibrosis Hypertonic saline preceded by a bronchodilator is an inexpensive, safe, and effective additional therapy for patients with cystic fibrosis. N Engl J Med. 2006; 354: 229-40.
Artículo básico en la evidencia de la mejora con el tratamiento con suero hipertónico inhalado.
– Accurso FJ. Update in Cystic Fibrosis 2005. Am J Respir Crit Care Med. 2006; 173: 944-7.
Excelente puesta al día de los avances en el conocimiento de la FQ y sus nuevos posibles tratamientos.
– Hoffman G, Parad RB, Wilfond BS, Rosenfeld M, Comeau AM, Accurso FJ, et al. Guidelines for Implementation of Cystic Fibrosis Newborn Screening Programs: Cystic Fibrosis Foundation Workshop Report. Pediatrics. 2007; 119: e495-e518.
Guía práctica para la puesta en marcha de programas de cribaje neonatal.
– Pérez-de-Llano LA, Vennera MC, Parra A, Guallar J, Marin M, Asensio O, et al. Effects of omalizumab in Aspergillus-associated airway disease. Thorax. 2011; 66(6): 539-40.
Publicación con la mayor serie de pacientes con ABPA tratada con omalizumab.
– Saiman L, Siegel J. Infection control in cystic fibrosis. Clin Microbiol Rev. 2004; 17: 57-71.
Excelente revisión sobre la microbiología en la FQ.
– Parkins MD, Elborn JS. Newer antibacterial agents and their potencial role in cystic fibrosis pulmonary exacerbation management. J Antimicrob Chemother. 2010; 65: 1853-61.
Cambios epidemiológicos de los gérmenes en la FQ.
| Caso clínico |
|
Se trata de un niño de 10 años de edad, afecto de FQ, diagnosticado a los 3 años de edad por infecciones respiratorias de repetición; el niño presenta un test de Shwachman de 45, bronquiectasias centrales difusas y generalizadas, exploración funcional respiratoria: FEV1: 50% del predictivo, mala tolerancia al ejercicio, tos diaria y muy persistente con expectoración mucopurulenta, buena calidad durante el sueño. Consulta por presentar, desde hace 3 días, febrícula, aumento de la disnea, de la tos y de la expectoración, siendo la expectoración muco sanguinolenta. A la exploración, presenta: regular estado general, tiraje supraesternal e intercostal, respiración abdominal, aleteo nasal, estertores crepitantes y subcrepitantes en ambos hemotórax. Saturación de O2 del 92%, exploración funcional: FEV1: 43% (anterior FEV1: 68%). Rx de tórax: presencia de nuevos infiltrados pulmonares, además de las condensaciones alveolares con atrapamiento aéreo en ambos hemitórax ya habituales. Cultivo de esputo positivo a Stafilococcus aureus y Pseudallescheria boydii. |


