|
| Temas de FC |
A. Ranera Málaga
Pediatra. Urgencias pediátricas, UCI pediátrica y neonatal. Hospital Universitari Parc Taulí. Sabadell. Barcelona
| Resumen
Las rickettsiosis son un grupo de zoonosis de distribución mundial causadas por bacterias intracelulares del grupo de las fiebres manchadas del género Rickettsia y transmitidas por un vector, generalmente, la garrapata. La lesión histopatológica característica es la vasculitis multisistémica de pequeños vasos. Su incidencia global es baja, pero en los últimos años están cobrando relevancia, considerándose algunas de ellas, como infecciones emergentes. La más frecuente en nuestro medio es la Fiebre Botonosa Mediterránea que se considera endémica en gran parte de la cuenca mediterránea y que se caracteriza por la “mancha negra”, aunque en los últimos años han tomado importancia otras formas clínicas, como el TIBOLA/DEBONEL. El diagnóstico suele realizarse por serología, ya que el microbiológico, en la mayoría de rickettsiosis, es complejo y lento. Por ello, es importante conocer las características clínico-epidemiológicas de cada una de ellas para orientar el diagnóstico desde el inicio y comenzar tratamiento antibiótico precoz, lo que puede evitar complicaciones, que son raras, pero potencialmente graves en algunos casos. |
| Abstract
Rickettsiosis is a globally distributed zoonosis caused by the intracellular bacteria Rickettsias. It is a tick-borne disease and its main histopathological feature is a multisystemic small vessel vasculitis. It has a low incidence, however, it has increased in recent years, some being considered as emerging infections. Mediterranean Spotted Fever is the most frequent form of rickettsiosis in our area. It is endemic in the Mediterranean region and produces a characteristic “black spot”, although other similar clinical forms, such as TIBOLA/ DEBONEL, have become important in recent years. The diagnosis is usually made by serology because the microbiological diagnosis, in most Rickettsiosis, is difficult and delayed. Therefore it is important to know the main features of each Rickettsia infection to get to an early diagnosis and early treatment, in order to avoid potentially serious complications. |
Palabras clave: Rickettsia; Garrapatas; Fiebre Botonosa Mediterránea; Rickettsiosis del grupo de las fiebres manchadas
Key words: Rickettsia; Ticks; Mediterranean Spotted Fever; Spotted Fever Group Rickettsiosis
Pediatr Integral 2018; XXII (7): 323 – 332
Rickettsiosis
Introducción y clasificación
Las rickettsiosis son un grupo de enfermedades infecciosas causadas por bacterias del género Rickettsias. Son zoonosis transmitidas por artrópodos vectores y su incidencia va ligada al ciclo de los mismos. Son conocidas desde la antigüedad, pero en los últimos años están cobrando mayor relevancia, considerándose algunas de ellas como infecciones emergentes.
Las rickettsiosis son un grupo de zoonosis de distribución mundial causadas por bacterias intracelulares obligadas, cuyo ciclo vital transcurre en un artrópodo vector, generalmente la garrapata. Microbiológicamente, son cocobacilos inmóviles, pleomorfos, de 1-2 micrómetros de longitud y 0,3-0,6 micrómetros de anchura, que se multiplican mediante replicación intracelular en huéspedes artrópodos. No pueden cultivarse en medios acelulares, poseen la pared celular y la membrana citoplasmática características de las bacterias y se dividen por fisión binaria.
El hombre es un huésped accidental en el ciclo biológico de las Rickettsias (excepto en el tifus exantemático epidémico) en el que intervienen mamíferos (reservorios) y artrópodos que actúan como reservorios o como vectores.
Pertenecen a la orden Rickettsiales: familia Rickecttsiaceae, tribu Rickettsieae y género Rickettsia, que está subdividido en dos grupos: el de las fiebres del tifus (Rickettsia typhi y Rickettsia prowazeki), y el de las fiebres manchadas, con más de 30 especies diferentes (Tabla I)(1,2).
Las principales rickettsiosis de interés humano son:
• Grupo fiebres manchadas: Fiebre Botonosa Mediterránea, Fiebre Manchada de las Montañas Rocosas y TIBOLA/DEBONEL, transmitidas por garrapatas; y la rickettsiosis vesiculosa, transmitida por ácaros.
• Grupo fiebres tíficas: tifus exantemático epidémico y tifus endémico o murino, transmitidos por piojos y pulgas respectivamente.
La ehrlichiosis, transmitida por garrapatas, actualmente está incluida en la familia Anaplasmataceae. Una característica que la diferencia de las rickettsias es que se replican en unas vacuolas derivadas de la membrana celular de las células que infectan, principalmente leucocitos y plaquetas.
La Fiebre Q, originariamente incluida en el grupo de las Rickettsias, hoy se considera una especie aparte, pero con similitudes a las rickettsiosis, por eso la trataremos en el presente capítulo.
Además de estas, se han descrito otras infecciones por Rickettsia epidemiológicamente distintas, pero clínicamente similares. Entre ellas destacan: R. sibirica, agente etiológico del tifus por garrapatas de Siberia, que es endémico en Asia central; R. australis, agente etiológico del tifus por garrapatas de North Queensland, endémico en el este de Australia; R. japonica, agente de la fiebre maculosa, endémica de Japón; y O. tsutsugamusi, agente de la fiebre de los matorrales transmitida por ácaros, endémica en Asia y Oceanía(3). Todas estas infecciones presentan características clínicas, anatomopatológicas y epidemiológicas similares, y se tratan de la misma forma, aunque suelen ser leves y se asocian a una pequeña lesión indurada que se desarrolla en el lugar de la picadura.
Epidemiología
Las Rickettsias se transmiten por artrópodos vectores (pulgas, piojos, ácaros y garrapatas). La distribución e incidencia de la enfermedad se encuentra relacionada con el área geográfica, ciclos de vidas y época de actividad del vector (Tabla II).
Aunque estas enfermedades son raras en nuestro medio, la proliferación de viajes internacionales a zonas endémicas supone un riesgo de aparición en nuestro país. En los últimos 25 años, la incidencia de las rickettsiosis ha aumentado dramáticamente, haciendo de ellas, un paradigma ideal para entender las infecciones emergentes(4).
Según la Orden SSI/445/2015, de 9 de marzo del BOE, existen 60 enfermedades de declaración obligatoria, entre las que se encuentran: la fiebre botonosa mediterránea (Fig. 1) y la fiebre Q, que requieren envío de datos epidemiológicos básicos de forma semanal. En todo caso, ante la sospecha o confirmación de cualquier rickettsiosis, debemos informar a las autoridades sanitarias de referencia.
Figura 1. De arriba a abajo, Rhipicephalus sanguineus, vector de R. conorii (agente de la fiebre botonosa mediterranea), D. marginatus, vector de R. slovaca y Amblyomma variegatum, vector de R. africae. Izquierda machos, derecha hembras.
Fisiopatología/Etiopatogenia
La lesión anatomopatológica característica de las rickettsiosis es la vasculitis multisistémica de pequeños vasos.
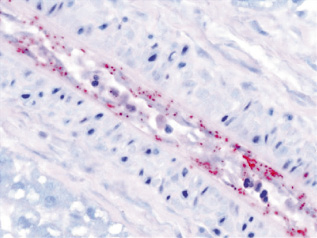
Después de ser introducidas en el organismo, las Rickettssias infectan el endotelio vascular al adherirse a los receptores celulares por diferentes proteínas, favoreciendo su entrada a las células y provocando su multiplicación dentro de estas. Se diseminan posteriormente por el sistema vascular produciendo vasculitis multisistémica de pequeños vasos (Fig. 2)(5).
Figura 2. Tinción de Giménez, donde se observan Rickettsias en el endotelio vascular.
Las lesiones más habitualmente encontradas en este grupo de enfermedades son las alteraciones de la capa media de los vasos, como en el grupo de las fiebres manchadas, y las alteraciones endoteliales, como en el grupo tífico. Las lesiones son generalizadas y aparecen en capilares y pequeños vasos arteriales y venosos, con posterior formación de trombos y necrosis hísticas, lo que produce una verdadera vasculitis, origen de las manifestaciones clínicas. No se conoce con exactitud si la lesión vascular se debe al efecto de la anidación de la Rickettsia, por sus toxinas o por la respuesta inmunitaria producida. Los signos y síntomas encontrados se derivan, por tanto, del aumento de la permeabilidad vascular, que puede producir edema, hipovolemia e hipotensión, y del foco infeccioso producido, como: fiebre, exantema (excepto en la fiebre Q y en la mayoría de casos, de ehrlichiosis), cefalea, mialgias y síntomas respiratorios. Las alteraciones hematológicas y bioquímicas en estos enfermos son poco significativas.
Grupo fiebres manchadas
Fiebre botonosa mediterránea (FBM)
La FBM es una enfermedad endémica en nuestro entorno, cuya lesión característica es la mancha negra producida por la picadura de la garrapata.
Epidemiología
Descrita por primera vez en 1910 en Túnez, los casos de FBM se han publicado de forma exponencial en los últimos años, en la mayoría de países de nuestro entorno. En el área mediterránea, la FBM (o fiebre exantemática mediterránea) es la rickettsiosis exantemática más frecuente, siendo considerada una enfermedad endémica en el norte de África y sur de Europa(6).
Está causada por R. conorii (existen cuatro subespecies similares que producen cuadros similares) y el principal vector de la enfermedad es la garrapata del perro (Riphicephalus sanguineus), aunque en otras zonas pueden transmitirla otras garrapatas ixódidas. Los huéspedes habituales son pequeños mamíferos roedores y perros, por lo que la mayoría de pacientes refieren haber tenido contacto con estos (a veces, la enfermedad se transmite a partir de garrapatas que se encuentran en el suelo o en las plantas). En todo caso, el ser humano se considera un huésped accidental.
La enfermedad es más frecuente en meses cálidos, con una incidencia máxima en agosto. Afecta a ambos sexos y a cualquier edad, siendo algo más frecuente en varones y en las dos primeras décadas de la vida.
El periodo de incubación es de 4 a 20 días, aunque muchas veces es difícil de determinar, ya que la picadura de la garrapata puede pasar desapercibida.
Manifestaciones clínicas (Tabla III)
La aparición de la clínica suele ser abrupta y casi todos los pacientes presentan síntomas inespecíficos, como: fiebre, dolor de cabeza, cefalea, mialgias y artralgias. El rash, es muy característico y está presente en el 97-99% de los pacientes. Sin embargo, puede estar ausente durante los primeros días de la enfermedad. Generalmente, es maculopapular, afectando a palmas y plantas, pero en el 10% de los casos puede ser petequial (Figs. 3a y 3b).
Figura 3. Exantema purpúrico y macular típico de la fiebre botonosa mediterránea. Fotografía extraída del CDC (Centers for Disease Control and Prevention).
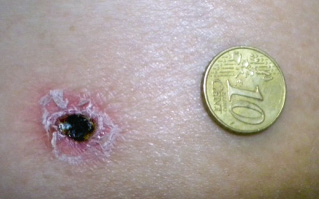
La lesión de inoculación, producida por la garrapata, es indolora y no pruriginosa. Está presente en el 73% de los casos y puede ser múltiple. En los niños, predomina en la cabeza. Consiste en una lesión ulcerosa, recubierta de una escara negra con un halo eritematoso. Recibe el nombre de “mancha negra” (Fig. 4).
Figura 4. Lesión de inoculación producida por la garrapata (mancha negra) en la fiebre botonosa mediterránea.
Diagnóstico
Raoult et col. publicaron un Score que puede ayudar a realizar un diagnóstico clínico (Tabla IV); en todo caso, ante la sospecha de FBM, la mejor técnica para establecer el diagnóstico en cuanto a disponibilidad, sensibilidad, especificidad y rapidez es la inmunofluorescencia indirecta (IFI).
Esta técnica permite, además, investigar de forma independiente la presencia de anticuerpos específicos IgM, a fin de distinguir entre infección actual y seropositividad residual. Son títulos significativos a partir de 1/80(7).
Como en todas las Rickettsiosis, lo ideal sería el cultivo del agente causal, pero para ello se requieren medios de cultivo celulares y se debe trabajar en laboratorios de seguridad que no siempre están disponibles; por ello, el método diagnóstico más utilizado es la serología mediante IFI.
Actualmente, la reacción en cadena de la polimerasa (PCR) en sangre y en la lesión de la mordedura de la garrapata, se está utilizando en algunos laboratorios de manera experimental. Se basa en la amplificación de diferentes genes específicos del género Rickettsia y abre un campo muy prometedor en lo que se refiere al diagnóstico microbiológico de esta enfermedad y del resto de Rickettsiosis.
Tratamiento
La doxiciclina vía oral o endovenosa continúa siendo el tratamiento de elección en estas infecciones. Aunque las tetraciclinas no están indicadas en niños menores de 8 años, con pautas cortas de doxiciclina, los efectos adversos son prácticamente nulos, ya que estos efectos se relacionan, sobre todo, con la dosis total administrada durante la infancia. La dosis es de 5 mg/kg/día cada 12 horas en niños y de 100 mg cada 12 horas en adultos. La duración habitual es de 5-7 días. El tratamiento durante un solo día (5 mg/kg/dosis cada 12 horas en niños y 200 mg cada 12 horas en adultos) ha mostrado igual efectividad que las pautas clásicas de 5-7 días(8), por lo que se puede recomendar en la actualidad. La josamicina (1 g/8 h en adultos y 50 mg/kg/día cada 12 h en niños, durante 5 días) y los nuevos macrólidos, como la claritromicina (500 mg/12 h en adultos y 15 mg/kg/día cada 12 h en niños, durante 5-7 días), pueden ser alternativas válidas para el tratamiento de la FBM, en gestantes o alérgicos a las tetraciclinas.
En cualquier caso, el tratamiento ha de ser instaurado de forma rápida y empírica, ante la sospecha de FBM, antes de la confirmación diagnóstica serológica.
Pronóstico
La FBM se trata habitualmente de una enfermedad benigna y no deja secuelas, pero en un pequeño porcentaje de casos (depende de las series, entre un 1 y un 10% aproximadamente) se pueden producir complicaciones en forma de vasculitis severa con fallo multiorgánico. Los factores que contribuyen a ello son: infección por la subespecie israelensis, retraso en el diagnóstico y tratamiento, uso de antibióticos no adecuados, edad avanzada, inmunodepresión o alcoholismo, déficit de glucosa-6-fosfato deshidrogenasa y diabetes(9).
Fiebre Manchada de las Montañas Rocosas (FMMR)
La FMMR debe sospecharse en pacientes que hayan viajado a zonas rurales del continente americano y presenten un cuadro clínico característico después de la picadura de una garrapata. Su tratamiento debe ser iniciado precozmente.
Epidemiología
Descrita en 1899 y prototipo de las rickettssiosis transmitidas por garrapatas, está causada por Rickettsia rickettsii. Se transmite al hombre por la picadura de la garrapata del género Dermacentor, que actúa como reservorio y vector a la vez. Esta enfermedad está ampliamente distribuida por el hemisferio occidental (América del Norte y Sur) y la morbilidad depende de la existencia de focos endémicos, como en las Montañas Rocosas de Estados Unidos. Por ello, debe sospecharse en pacientes que hayan estado en zonas rurales del continente americano. La incidencia es máxima entre los meses de abril y octubre y es típica de niños menores de 15 años y personas que frecuentan las áreas infestadas con fines laborales o recreativos.
Manifestaciones clínicas
El periodo de incubación es de entre 2 y 14 días (cuanto más corta más grave) y cursa como una enfermedad sistémica febril con exantema (90% de los casos) que, característicamente, aparece a los 6 días de la infección. Aparecen: cefalea, artromialgias, vómitos, diarreas y tos. El exantema es eritematoso y macular, que posteriormente se puede transformar en petequial, ulcerándose. Inicialmente, afecta a muñecas y tobillos y se generaliza a tronco. Es característica la afectación de palmas y plantas.
La enfermedad puede ser grave y durar 3 semanas, complicándose con: encefalitis/meningitis, miocarditis, afectación pulmonar y renal. Puede aparecer coagulación intravascular diseminada (CID) y signos de shock. Típicamente, es más letal en la raza negra y en pacientes con déficit de glucosa-6-fosfato-deshidrogenasa.
Diagnóstico
Aunque se ha utilizado la PCR para detectar ADN de R. rickettsii en muestras de sangre de pacientes con formas graves(10), para la confirmación diagnóstica, generalmente se utiliza la serología específica, como la IFI, cuyos títulos diagnósticos son de más de 1/64.
Tratamiento
El tratamiento debe iniciarse de forma empírica cuando hay sospecha, para obtener las máximas probabilidades de éxito, ya que la enfermedad puede evolucionar desfavorablemente. El fármaco de elección es la doxiciclina a dosis de 100 mg cada 12 horas en adultos y 5 mg/kg/día cada 12 horas en niños. En menores de 8 años, se debe usar con precaución, pero la necesidad de tratamiento contra la bacteria tiene más peso que el pequeño riesgo de tinción dental. El tratamiento debe continuarse hasta que el paciente haya permanecido afebril 2 o 3 días (habitualmente, entre 7 y 10 días de tratamiento).
Linfadenopatía transmitida por garrapatas (TIBOLA/DEBONEL)
Única rickettsiosis que predomina en meses fríos, cuya lesión característica es una escara melicérica en el punto de la picadura con linfadenopatía regional.
De reciente descubrimiento, es una rickettsiosis causada por R. slovaca (recientemente, se ha descrito también por R. rioja) cuyo vector es la garrapata Dermacentor marginatus que parasita animales como: cabras, ovejas y jabalíes, por lo que el contagio humano se produce en contacto con la naturaleza.
El mayor número de casos se han descrito en Hungría, pero también en Francia y otros países de Europa central. En La Rioja y Cataluña, ha habido un importante aumento de casos en los últimos años(11).
A diferencia de otras rickettsiosis, los casos de TIBOLA (tick-borne lymphadenopathy)/DEBONEL (dermacentor-borne, necrosis, eritema, lymphadenopathy) aparecen sobre todo en meses fríos. Es una enfermedad frecuente en niños y la clínica consiste fundamentalmente en la aparición de una escara melicérica (posteriormente, evoluciona a necrótica) en el punto de la picadura de la garrapata (habitualmente, en mitad superior de cuerpo/cuero cabelludo) rodeada de un halo eritematoso y linfadenopatía regional dolorosa (Fig. 5).
Figura 5. Escara producida por la mordedura del Dermacentor en el TIBOLA en fase no inicial y linfadenopatia regional secundaria.
Cuando la escara desaparece, puede persistir una alopecia residual. La fiebre aparece solo en uno de cada 3 pacientes, siendo generalmente de bajo grado. El diagnóstico es clínico, ya que la serología solo es positiva en un número pequeño de casos y el tratamiento de elección es la doxiciclina 2,2 mg/kg/dosis cada 12 horas en niños o 100 mg cada 12 horas en adultos durante 7-10 días o azitromicina durante 5 días.
Rickettsiosis vesiculosa
Única rickettsiosis causada por un ácaro del ratón, cuya lesión característica es una vesícula en la zona de la picadura.
También llamada rickettsiosis variceliforme, está causada por Rickettsia akari. La transmisión al humano es accidental y la produce la picadura de un ácaro del ratón, Allodermanyssus sanguineus. No se ha encontrado un patrón estacional. El cuadro clínico comienza con una lesión primaria en el lugar de la picadura del artrópodo y posterior aparición de una vesícula que se transforma en costra negra o escara, a la vez que aparece linfadenopatía regional. A los 2-6 días del inicio de la fiebre, aparecen erupciones papulovesiculares eritematosas generalizadas en tronco, cara y extremidades, incluidas palmas y plantas. El proceso habitualmente es autolimitado y no suele presentar complicaciones. El diagnóstico es mediante serología por inmunofluorescencia indirecta. El tratamiento indicado es la doxiciclina a las dosis habituales, que debe mantenerse durante 2-5 días.
Grupo tífico
Tifus exantemático epidémico
Transmitida por el piojo corporal común, es típica de zonas de hacinamiento y bajas condiciones de salubridad. Aparece en meses fríos.
Está causado por Rickettsia prowazekii y su único reservorio es el ser humano. Se transmite por el piojo corporal Pediculus humanus corporis, que se infecta al alimentarse de una persona portadora de esta rickettsia y lo transmite al defecar sobre la piel, material contaminado. Su transmisión requiere un contacto personal estrecho, por lo que es típico de situaciones de hacinamiento, falta de saneamiento, etc.
La enfermedad, suele aparecer en forma de brotes epidémicos en periodos fríos. Tiene una incubación de unos 7 días y cursa con síntomas inespecíficos como: fiebre elevada, cefaleas, artromialgias y malestar general. A los 4-7 días, aparece un exantema maculopapular confluente en tórax y extremidades, que respeta palmas y plantas. Inicialmente, es eritematoso y, posteriormente, se vuelve petequial o hemorrágico, evolucionando finalmente a áreas pigmentadas de color parduzco. Pueden aparecer complicaciones neurológicas o respiratorias. La enfermedad de Brill-Zinsser es la replicación de estas rickettsias en un paciente portador crónico en situaciones de inmunodepresión y el curso es mucho más benigno(3,12).
El diagnóstico se realiza mediante pruebas indirectas como la serología por inmunofluorescencia indirecta. Una variación de cuatro veces en los títulos de anticuerpos entre los sueros de la fase aguda y de convalecencia tiene valor diagnóstico, pero no permite distinguir la forma endémica de la epidémica.
El tratamiento de elección es la doxiciclina (2-4 mg/kg/día en dos dosis en menores de 45 kg o 100 mg/12 h en adultos) que debe mantenerse, al menos, hasta 3 días después de desaparecer los síntomas, siendo la duración habitual de 7-10 días. Para la desparasitación, deben utilizarse cremas o geles pediculicidas como piretrinas al 0,16-0,33% o lindano al 1%.
Tifus endémico o murino
Transmitida por la pulga de la rata o del gato y de distribución mundial y buen pronóstico en pediatría, se considera el paradigma de la enfermedad infecciosa emergente.
Está causado por Rickettsia typhi (antiguamente R. mooseri), microorganismo similar a la Rickettsia prowazekii. Su reservorio natural es la rata y el vector de transmisión entre ellas y entre ellas y el hombre es la pulga murina (Xenopsylla cheopis), que transmiten la Rickettsia a través de sus heces que contaminan las heridas cutáneas o, también, siendo inhaladas. Recientemente, se ha demostrado que la pulga del gato (Ctenocephalides felis) puede desempeñar un importante papel en el ciclo biológico y en la transmisión de R. typhi a seres humanos.
La enfermedad es de distribución mundial y tiene una máxima incidencia entre abril y octubre. Su importancia clínica y sanitaria se ha subestimado a pesar de constituir en la actualidad un paradigma de enfermedad infecciosa emergente.
El periodo de incubación es de 6 a 14 días y el cuadro clínico es similar al del tifus epidémico, pero menos grave. En niños pequeños, el cuadro suele ser benigno. La fiebre es el signo más habitual y pueden aparecer mialgias y cefalea. El exantema suele ser macular/maculopapular rosado, de predominio en tronco y raíces de miembros. Existen complicaciones graves, pero no son habituales.
El diagnóstico se realiza igual que en el resto de rickettsiosis, mediante pruebas serológicas (IFI).
El tratamiento de elección consiste en dos únicas dosis de doxiciclina (2 mg/kg/dosis en menores de 45 kg o 100 mg/dosis en adultos). Hay que eliminar las pulgas murinas mediante insecticidas, a ser posible antes de usar raticidas, ya que las pulgas buscan huéspedes alternativos cuando no existen ratas en el entorno.
Ehrlichiosis
Endémica de Estados Unidos, la ehrlichiosis produce típicamente citopenias por la afinidad de esta bacteria por las células sanguíneas.
Conjuntamente con el género Anaplasma, la Ehrlichia se clasifica actualmente en la familia Anaplasmataceae. Tienen similitudes microbiológicas y clínicas, por eso se comentará brevemente en el presente capítulo. Una característica diferencial, es que estas especies se aglomeran en el citoplasma celular y forman unas inclusiones visibles al microscopio llamadas mórulas. La afinidad de estas bacterias por las células sanguíneas es la responsable de las citopenias causadas, que pueden generar grados importantes de inmunodepresión e infecciones oportunistas.
La ehrlichiosis monicítica humana es endémica del sur y sureste de Estados Unidos. Ha habido algún caso aislado descrito en Europa y África. Está producida por Ehrlichia chaffeensis y su vector principal es la garrapata Amblyomma americanum. El ciervo de cola blanca es el huésped habitual. Hay pocos casos descritos en pediatría y la clínica reportada es de fiebre, cefaleas, mialgias y rash (66-69% de los pacientes), así como vómitos y linfadenopatías(13). Los hallazgos de laboratorio habituales son leucopenia, trombocitopenia y elevación de las aminotransferasas, LDH y fosfatasa alcalina. El diagnóstico microbiológico es extremadamente dificultoso y requiere serologías por IFI o PCR. El tratamiento de elección en todos los pacientes es la doxiciclina que se administra a 5 mg/kg/día en dos dosis en menores de 45 kg de peso (en mayores de 45 kg las dosis son de 100 mg cada 12 horas). La duración del tratamiento es de 7-10 días. En general, la evolución es favorable, pero pueden aparecer complicaciones como: convulsiones, coma y fallo renal o respiratorio.
Fiebre Q
Causada por Coxiella burnetti, actualmente no se considera una Rickettsiosis. No tiene vector, sino que la transmisión es por fómites, inhalación o ingesta de leche no pasteurizada.
Epidemiología
La fiebre Q es una zoonosis que inicialmente se clasificó dentro del grupo de la familia Rickettsiaceae, pero estudios posteriores demostraron que pertenece al grupo de las gamma-proteobacterias, familia Legionellaceae. C. burnetii es un bacilo gramnegativo de pequeño tamaño, que por su similitud con el resto de Rickettsias, trataremos en el presente capítulo. Esta zoonosis afecta a diversas especies de animales, sobre todo rumiantes, y de modo accidental al ser humano, por lo que no tiene vector. La enfermedad es endémica en todo el mundo. La inhalación de aerosoles generados por materiales infectados espontáneamente, como orina, heces y leche de animales de granja, y la manipulación de animales son los mecanismos de transmisión más frecuentes(14). También, se han descrito casos por consumo de leche no pasteurizada. El periodo de incubación suele variar entre 14 y 22 días.
Manifestaciones clínicas
La infección por Coxiella burnetti puede ser asintomática (55-60%), aguda (40%) o crónica (1-5%)(14). La infección aguda, caracterizada por su polimorfismo, presenta manifestaciones clínicas que dependen de la puerta de entrada del patógeno. Cursa con mayor frecuencia, como un cuadro de neumonía atípica con fiebre elevada y distrés respiratorio agudo. Otras veces, puede cursar con: afectación hepática, pericarditis y miocarditis, meningoencefalitis o granulomas. Otras manifestaciones menos frecuentes pueden ser: anemia hemolítica, pancreatitis, neuritis óptica y oligoartritis.
La infección crónica generalmente se presenta en pacientes trasplantados, inmunodeprimidos o cardiópatas, en forma de endocarditis.
Diagnóstico
El diagnóstico más utilizado es el indirecto, mediante inmunofluorescencia indirecta, ya que los cultivos son difíciles de realizar en todos los laboratorios y pueden dar falsos negativos. Son significativos los títulos de anticuerpos de clase IgG ≥ 1/128, la seroconversión y los títulos de anticuerpos de clase IgM ≥ 1/32.
Tratamiento
El tratamiento de la fiebre Q aguda consiste en doxiciclina a 5 mg/kg/día en dos dosis en niños o 100 mg cada 12 horas en adultos y se debe continuar hasta que el paciente haya permanecido afebril durante 2 o 3 días. En la meningoencefalitis y endocarditis, se considera eficaz un tratamiento con fluoroquinolonas, puesto que penetran la barrera hematoencefálica, pero estos antibióticos no están indicados en pacientes menores de 18 años y hay que valorar el riesgo/beneficio. En la hepatitis por fiebre Q, hay que asociar tratamiento con prednisona (2 mg/kg/día durante 7 días) por la producción de autoanticuerpos(15).
Prevención de las picaduras por garrapata
La prevención del acceso de las garrapatas a la piel incluye las siguientes medidas:
• En excursiones a la montaña, permanecer en caminos y vías.
• Colocar los pantalones dentro de las botas o calcetines.
• Vestir camisas de manga larga y de color claro.
• Aplicar repelentes con dietiltoluamida (DEET) en las superficies de la piel.
La DEET sebe usarse con precaución en niños pequeños por posibilidad de reacción tóxica. La aplicación de permetrina sobre la ropa mata las garrapatas de forma efectiva. En las áreas endémicas, resulta fundamental la búsqueda frecuente de garrapatas, en particular en zonas con pelo y en niños.
Las garrapatas de mayor tamaño deben extraerse con cuidado y no deben aplastarse entre los dedos porque así, se puede transmitir la enfermedad. La tracción gradual de la cabeza con una pequeña pinza desaloja la garrapata. El punto donde la garrapata estaba adherida debe limpiarse con alcohol. La aplicación de vaselina en gel, calor o irritantes no son formas eficaces de quitar las garrapatas. No está indicado el uso de antibioterapia empírica tras la picadura de una garrapata(16).
En la tabla V, se indican las características generales de algunas rickettsiosis de interés humano.
Función del pediatra de Atención Primaria
• Informar de forma clara y correcta sobre la prevención de las picaduras de garrapatas en pacientes que puedan tener contacto con animales o que viajen a zonas rurales/endémicas de enfermedades transmitidas por garrapatas.
• Tener presente las rickettsiosis en el diagnóstico diferencial de la fiebre y exantema en pacientes con riesgo de haberlas contraído.
• Tratar y derivar a un servicio de urgencias hospitalario, de forma precoz, ante la sospecha clínica de rickettsiosis.
• Retirar de forma correcta las garrapatas de la piel de los pacientes y dar normas de reconsulta claras tras la picadura de estas.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1. Fournier PE, Raoult D. Current Knowledge on Phylogeny and Taxonomy of Rickettsia spp. Ann N Y Acad Sc. 2009; 1166: 1-11.
2.** Walker DH. Rickettsiae and rickettsial infections: the current state of knowledge. Clin Infect Dis. 2007; 45 Suppl 1: S39-44.
3.** Fleta J. Rickettsiosis transmitidas por piojos, pulgas y ácaros. Med Integral. 2002; 39: 147-52.
4.*** Parola P, Paddock CD, Socolovschi C, Labruna MB, Mediannikov O, Kernif T, et al. Update on Tick-Borne Rickettsioses around the World: a Geographic Approach Clin. Microbiol. Rev. 2013; 26: 657.
5. Walker DH, Valbuena GA, Olano JP. Pathogenic mechanisms of diseases caused by Rickettsia. Ann N Y Acad Sci. 2003; 990: 1-11.
6.*** Sanfeliu I, Pons I, Segura F. Rickettsiosis en nuestro entorno. JANO 2008. Nº 1689.
7.** Cardeñosa N, Sanfeliu I, Segura F. Diagnóstico microbiológico de las rickettsiosis. Enferm Infecc Microbiol Clin. 1997; 15: 32-7.
8.** Bella F, Font B, Segura F, Espejo E, López P, Muñoz T. Comparative, randomized trial of one day doxycicline versus 10 day tetracycline therapy for Mediterranean spotted fever. J Infect Dis. 1987; 155: 1056-58.
9. de Sousa R, Franc A, Nóbrega SD, Belo A, Amaro M, Abreu T, et al. Host and microbial risk factors and pathophysiology of fatal Rickettsia conorii infection in Portuguese patients. J. Infect. Dis. 2008; 198: 576-85.
10.** Walker DH, Burday MS, Folds JD. Laboratory diagnosis of Rocky Mountain spotted fever. South Med J. 1980; 73: 1443-7.
11.** Antón E, Muñoz T, Travería FJ, Luelmo J, Sanfeliu I, Quesada I, et al. Epidemiological and clinical characteristics of 24 patients with Tick-borne lymphadenopathy (TIBOLA) in Catalonia. 44th ICAAC 2004 Washington.
12.*** Bernabeu-Wittel M, Segura-Porta F. Enfermedades producidas por Rickettsia. Enferm Infecc Microbiol Clin. 2005; 23: 163-72.
13.*** Chapman AS, Bakken JS, Folk SM, Paddock CD, et al. Diagnosis and management of tickborne rickettsial diseases: Rocky Mountain spotted fever, ehrlichioses, and anaplasmosis-United States: a practical guide for physicians and other health-care and public health professionals. MMWR Recomm Rep. 2006; 55(RR-4): 1-27.
14.** Raoult D, Marrie TH. Retrospective study of Q fever. Clin Infect Dis. 1995; 20: 496.
15.** Fraile Fariñas MT, Muñoz Collado C. Infección por Coxiella burnetii (fiebre Q). Enferm Infecc Microbiol Clin. 2010; 28(Supl 1): 29-32.
16.*** Rodríguez Arranz C. Enfermedades transmitidas por garrapatas en Pediatría. Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención primaria. Junio 2016. (Disponible en: http://www.aepap.org/grupos/grupo-de-patologiainfecciosa/contenido/documentos).
Bibliografía recomendada
– Raoult D, Parola P. Rickettsials diseases. New York, London. CRC Press, Taylor and Francis Group. 2007.
Libro de referencia para los interesados en rickettsiosis, que realiza una revisión completa sobre las características microbiológicas, epidemiológicas y clínicas de estas enfermedades. Editado por Raoult y Parola, grandes conocedores del tema.
– Bernabeu-Wittel M, Segura-Porta F. Enfermedades producidas por Rickettsia. Enferm Infecc Microbiol Clin. 2005; 23(3): 163-72.
Sencilla, pero interesante revisión de las rickettsiosis, sobre todo, aquellas de nuestro entorno y del grupo tífico. Disponible en castellano.
– Chapman AS, Bakken JS, Folk SM, Paddock CD, et al. Diagnosis and management of tickborne rickettsial diseases: Rocky Mountain spotted fever, ehrlichioses, and anaplasmosis-United States: a practical guide for physicians and other health-care and public health professionals. MMWR Recomm Rep. 2006; 55(RR-4): 1-27.
Guía práctica americana para el manejo y tratamiento de la fiebre manchada de las montañas rocosas, erhlichiosis y anaplasmosis. Realizada por el grupo de trabajo de rickettsiosis del CDC (centro control enfermedades americano). Disponible en: https://www.cdc.gov/ticks/.
– Rodríguez Arranz C. Enfermedades transmitidas por garrapatas en Pediatría. Grupo de Patología Infecciosa de la Asociación Española de Pediatría de Atención primaria. Junio 2016. (Disponible en: http://www.aepap.org/grupos/grupo-de-patologiainfecciosa/contenido/documentos).
Documento actualizado y elaborado por el grupo de enfermedades infecciosas de la Asociación Española de Pediatría de Atención Primaria, en el que se tratan todas aquellas enfermedades transmitidas por garrapatas. Aparecen diversas imágenes de utilidad.
– Parola P, Paddock CD, Raoult D. Tick-borne rickettsioses around the world: emerging diseases challenging old concepts. Clin. Microbiol. 2005; Rev. 18: 719-56.
Exhaustiva revisión de las enfermedades producidas por Rickettsia, aquellas que afectan a los humanos y aquellas potencialmente patógenas. Profundiza mucho en las técnicas diagnósticas y los tratamientos.
– Diagnosis and Management of Tickborne Rickettsial Diseases: Rocky Mountain Spotted Fever and Other Spotted Fever Group Rickettsioses, Ehrlichioses, and Anaplasmosis — United States. A Practical Guide for Health Care and Public Health Professionals. Centers for Disease Control and Prevention. MMWR. Recommendations and Reports / Vol. 65 / No. 2 May 13, 2016.
Disponible en: http://www.cdc.gov/mmwr/cme/conted.html una gran revisión actualizada de todas las enfermedades causadas por Rickettsia realizada por el CDC americano.
| Caso clínico |
|
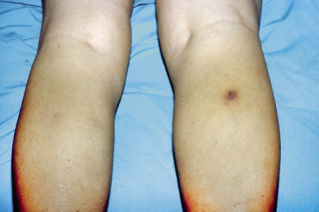
Niño de 7 años, de vacaciones estivales en una casa rural, que consulta al centro de Atención Primaria de zona por fiebre máxima de 38,3ºC de 2 días de evolución y malestar general con cefalea y dolores musculares. No presenta diarreas ni vómitos ni otra sintomatología. En la historia clínica informática consta una visita 14 días antes, por mordedura de garrapata. Antecedentes personales Alergia al epitelio de perro tratada con inmunoterapia hace 2 años con buena respuesta, sin nuevos brotes a pesar de convivir con animales. Antecedentes familiares Sin interés. No ambiente epidémico familiar. Exploración física “Triángulo de evaluación pedíatrica: Aspecto alterado, respiración estable, circulación estable”. Regular aspecto general, normohidratado y normocoloreado. No exantemas ni petequias. Auscultación cardiorrespiratoria normal. Abdomen sin masas ni megalias, no doloroso. Orofaringe normal sin exudados y otoscopia bilateral normal. Alguna adenopatía laterocervical pequeña rodadera no dolorosa. Aparato locomotor normal, con dolor a nivel de musculatura de extremidades inferiores, sin signos clínicos de artritis. Neurológicamente estable, sin meningismo ni focalidades. Evolución Dada la edad del paciente, el poco tiempo de evolución de la fiebre y la normalidad en la exploración física, se decide remitir al paciente a domicilio con tratamiento sintomático con ibuprofeno y paracetamol y control en 24 horas. A la mañana siguiente, el paciente persiste con fiebre que ha aumentado a 39,2ºC y en la exploración física, destaca un exantema maculopapular que afecta a palmas y plantas, pero no a boca. La madre ha observado una lesión en zona nucal con una costra negra (Fig. 6). Dada la evolución, se deriva al paciente a urgencias hospitalarias para realización de pruebas complementarias. Figura 6. Pruebas complementarias • Hemograma: leucocitos: 9.750/μl (60% neutrófilos, 22% linfocitos); hemoglobina: 9,7 g/dl; hematocrito: 31,7%; plaquetas: 118.000/μl. • Bioquímica: sodio: 132 mEq/L; potasio: 3,8 mEq/L; AST: 53 UI/L; ALT: 47 UI/L; proteínas totales: 7,8 g/dl; albúmina: 3,2 g/dl; VSG: 39 mm/h; PCR: 3,7 mg/dl; LDH: 92 UI/L (V.N 60 a 70 UI/L). Resto normal. • Radiografía de tórax: normal. Evolución posterior Se inicia tratamiento con doxiciclina a 5 mg/kg/día en dos dosis y, dada la estabilidad clínica y analítica, se da de alta a domicilio con control en infecciosas en 48 horas.
|