 |
| Temas de FC |
A. Sánchez Abuín*, A. del Cañizo López, R. Aguilar Cuesta, M.E. Molina Vázquez
Sección de Cirugía Pediátrica. Hospital Clínico Universitario de Valladolid
*Jefe de Sección de Cirugía Pediátrica
| Resumen
La Urología Pediátrica comprende una serie de patologías muy variadas que afectan al sistema urogenital, de complejidad variable y que suponen aproximadamente el 50% de las intervenciones quirúrgicas en cirugía pediátrica. El objetivo de este artículo es, por tanto, informar sobre cuándo es necesario un abordaje quirúrgico para resolver un problema urológico en el niño y cuándo es el mejor momento para llevarlo a cabo |
| Abstract
The Pediatric Urology comprises a series of varied pathologies of varying complexity which account for approximately 50% of surgical interventions in Pediatric Surgery. The aim of this article is indicate the appropiated timing to solve a urological problem in children |
Palabras clave: Urología pediátrica; Tratamiento; Cirugía.
Key words: Pediatric urology; Treatment; Surgery.
Pediatr Integral 2014; XVIII(10): 739-749
Indicaciones quirúrgicas en patología urológica pediátrica
Introducción
La Urología Pediátrica comprende una serie de patologías muy variadas que afectan al sistema urogenital, de complejidad variable y que suponen aproximadamente el 50% de las intervenciones quirúrgicas en cirugía pediátrica. Describir las indicaciones quirúrgicas de todas estas enfermedades sería harto extenso, por lo que nos centraremos en resumir aquellas que resultan más frecuentes en la Pediatría de Atención Primaria. El objetivo de este artículo es informar sobre cuándo es necesaria la cirugía, para resolver un problema urológico en el niño y cuándo es el mejor momento para resolverlo.
Patología peneana
Fimosis
Debe tratarse, siempre, a partir de los 3 años con corticoides tópicos. Si no hay respuesta o existen complicaciones asociadas, está indicada la realización de una plastia prepucial o una circuncisión.
La fimosis podría describirse como la incapacidad de retracción del prepucio sobre el glande, debido a una estenosis de la piel prepucial.
Existe una fimosis fisiológica que es propia de los niños pequeños, hasta la edad de 3 años, por lo que en la actualidad no se recomienda iniciar el descenso del prepucio hasta que el niño no haya alcanzado la continencia urinaria.
Como opción terapéutica conservadora para la fimosis, puede administrarse una pomada de corticoide (0,05%-0,1%), dos veces al día durante 20-30 días (grado de comprobación científica: 1, grado de recomendación: A).
El tratamiento quirúrgico se llevará a cabo a partir de los 3 años. Antes de esta edad, se intervendrán solo aquellos pacientes que sufran balanitis de repetición o infecciones de orina.
Las técnicas más utilizadas en el tratamiento de la fimosis son: la prepucioplastia de Duhamel y la circuncisión.
En ocasiones, sobre todo los niños mayores y adolescentes con fimosis cicatricial, pueden asociar balanitis xerótica o liquen escleroatrófico, que requieren tratamientos posteriores con corticoides.
La circuncisión neonatal sistemática no está indicada para prevenir el carcinoma de pene. La circuncisión infantil conlleva una morbilidad importante y no debe recomendarse sin un motivo médico.
Hipospadias
Es una malformación peneana que afecta: a la uretra, al glande, al prepucio y a la curvatura peneana (Fig. 1). El tratamiento es siempre quirúrgico y la edad óptima de corrección es: entre los 12-18 meses de edad. Son muy frecuentes las complicaciones tipo fístula uretrocutánea y estenosis meatal. Por ese motivo, casi todos los pacientes necesitan a lo largo de su vida más de dos intervenciones correctoras. La neouretra se reconstruye habitualmente con piel peneana, mucosa prepucial y en pacientes circuncidados o reintervenciones, con mucosa oral. La cirugía es técnicamente muy compleja(7).

Figura 1. Hipospadias proximal intervenido.
Es una malformación congénita en la que el meato uretral no se encuentra en la zona distal del glande. Su localización puede variar, desde la parte inferior del glande (hipospadias balánico), el surco balanoprepucial, el pene o incluso el escroto (hipospadias escrotal). Suele asociar una incurvación peneana, así como un defecto de piel prepucial ventral.
Un aumento significativo de la incidencia de hipospadias durante los últimos veinte años sugiere la participación de factores ambientales (alteradores hormonales y pesticidas)(6).
Su tratamiento quirúrgico es distinto dependiendo del tipo de hipospadias y puede requerir varias intervenciones. En general, la edad más adecuada para realizar la cirugía es a partir del año y lo ideal es que esté totalmente corregido cuando el niño inicie la escolarización (Algoritmo 1).
Dependiendo de la gravedad de la malformación, el número de complicaciones postoperatorias (estenosis, fístulas uretrocutáneas, divertículos) varía, siendo bastante frecuente en los hipospadias proximales.
Patología testicular
Hidrocele
Es la presencia de líquido alrededor del testículo. Puede tener varias causas.
El hidrocele no comunicante (del recién nacido), sin relación con un proceso vaginal permeable, es muy común en recién nacidos masculinos y es autolimitado. Por lo regular, se resuelve entre los 6 y los 12 meses de edad.
La persistencia de un hidrocele más allá de los 12 meses, suscita la sospecha de una comunicación con la cavidad abdominal a través de un proceso peritoneo-vaginal permeable y se debe considerar como una hernia inguinal.
El hidrocele de tipo comunicante, al igual que la hernia inguinal del niño, se debe a una persistencia de un conducto peritoneo-vaginal permeable, que permite el paso de líquido desde el abdomen al testículo. Clínicamente, se manifiesta por un aumento del tamaño del testículo, tumefacción que varía y fluctúa a lo largo del día. El tratamiento es quirúrgico y consiste en realizar una ligadura alta del conducto peritoneo-vaginal, a nivel del orificio inguinal interno.
En adolescentes y adultos, es más frecuente el hidrocele secretor (tipo adulto), que se produce por un aumento de la producción de líquido por la capa vaginal del testículo. Pueden ser muy voluminosos y con frecuencia bilaterales. Su tratamiento también es quirúrgico y consiste en la extirpación de las capas del hidrocele y en realizar una eversión de la capa vaginal del testículo.
Menos frecuentes son los hidroceles secundarios, que pueden aparecer ante procesos inflamatorios, infecciosos o tumorales.
Criptorquidia
Es la ausencia de testículo en la bolsa escrotal. Ocurre en el 3% de los niños a término y hasta en el 30% de los prematuros.
Existe una gran diversidad en la nomenclatura de la criptorquidia. Lo más útil para el clínico es dividirlas en testículos palpables y no palpables. Los testículos palpables incluyen la criptorquidia verdadera y los testes en ascensor. Los testículos no palpables incluyen el testículo intraabdominal y los testículos que se han torsionado intraútero o en etapa perinatal.
La realización de una ecografía, tomografía computarizada (TC), resonancia magnética (RM) o angiografía, carece de efectos beneficiosos adicionales.
Los testículos durante la etapa fetal, se forman a nivel retroperitoneal y descienden a la bolsa escrotal a través del canal inguinal. Si el descenso se interrumpe en algún momento, se produce la criptorquidia.
En ocasiones, el testículo que no está presente en el escroto al nacimiento, puede descender a él durante los primeros meses de vida. Si no lo ha hecho en los 3-8 primeros meses no lo hará más adelante. El diagnóstico diferencial debe hacerse con el teste “en ascensor”, que es debido a que el músculo cremáster está muy desarrollado en el niño y ante cualquier estímulo “tira” del teste hacia arriba llevándolo hasta la ingle. Este diagnóstico diferencial se realiza durante la exploración física; de tal manera que, un teste localizado a nivel inguinal que durante la exploración desciende sin tensión al escroto y permanece en él tras la misma, será un teste normal.
Si no desciende o desciende con mucha tensión y vuelve a ascender tras la exploración será un teste criptorquídico, asociado hasta en un 90% a una hernia inguinal (persistencia del proceso peritoneo-vaginal).
El tratamiento quirúrgico de la criptorquidia se realiza idealmente, a partir del 8º mes de vida. Consiste en una orquidopexia y ligadura del conducto peritoneo-vaginal permeable (herniotomía).
No existen pruebas fiables para confirmar o descartar un testículo intraabdominal, inguinal y ausente/evanescente (testículo impalpable), excepto la laparoscopia diagnóstica (grado de comprobación científica: 1b).
En los testículos no palpables, debe realizarse siempre una laparoscopia exploradora y en caso de confirmarse la presencia intraabdominal del testículo, una orquidopexia asistida por laparoscopia, en 1 o 2 tiempos, según la longitud de los vasos espermáticos. En caso de encontrar una atrofia testicular o restos testiculares atróficos, está indicado realizar una orquiectomía, para evitar una posible malignización y colocar una prótesis testicular.
Solo se intervienen antes de los 6 meses, las criptorquidias que asocian una hernia inguinal sintomática o en casos de torsión testicular.
Siempre se ha considerado que la orquidopexia debe hacerse antes de los 2 años, debido a que los cambios de temperatura del teste inducían una displasia de los mismos; sin embargo, en la actualidad se sospecha que los testes criptorquídicos son displásicos desde su origen y que es esta displasia la causa de la interrupción en su descenso y no la consecuencia de la misma. En cualquier caso, la cirugía no debería demorarse más allá de los 2 años, en la medida de lo posible.
El tratamiento médico con gonadotropina coriónica humana (hCG) o gonadoliberina (GnRH) se basa en la dependencia hormonal del descenso testicular, con unas tasas de éxito del 20% como máximo (grado de comprobación científica: 1; grado de recomendación: C). La hCG se utiliza en una dosis total de 6.000-9.000 UI, administrada en cuatro dosis durante 2 a 3 semanas en función del peso y la edad; y la GnRH, en una dosis de 1,2 mg/día, dividida en tres dosis al día durante 4 semanas por medio de pulverización nasal, respectivamente.
El tratamiento médico puede ser beneficioso antes (dosis según se ha descrito anteriormente) o después (dosis intermitentes bajas) de una orquidopexia(14), en lo que se refiere a aumentar el índice de fertilidad, que puede servir como factor predictivo de la fertilidad en fases más avanzadas de la vida (grado de comprobación científica: 1b; grado de recomendación: A). Sin embargo, todavía faltan datos de seguimiento a largo plazo de los efectos de la hormonoterapia sobre la posible fertilidad(4).
Varicocele
Se trata de la dilatación de las venas del cordón espermático (plexo pampiniforme) por reflujo venoso. Es más frecuente en el lado izquierdo 80% (ante un varicocele derecho hay que sospechar una masa retroperitoneal).
Se encuentra en el 15%-20% de los adolescentes. Clínicamente, puede ser asintomático o manifestarse con dolor o sensación de peso en el teste. En la exploración física, se manifiesta por el signo de “la bolsa de gusanos” en el escroto, que no es más que la palpación de las venas dilatadas en la bolsa escrotal y aumenta con las maniobras de Valsalva. En el 70% de los pacientes con varicocele de grado II y III, se observa una pérdida del volumen testicular izquierdo.
En el 20% de los adolescentes con varicocele surgen problemas de fertilidad. El espermiograma mejora tras una varicocelectomía (grado de comprobación científica: 1)(8).
El varicocele se clasifica en:
• Grado I, Valsalva positivo (palpable solo con la maniobra de Valsalva).
• Grado II, palpable (palpable sin la maniobra de Valsalva).
• Grado III, visible (visible a distancia).
Las indicaciones claras para decidirse por un tratamiento quirúrgico son: dolor testicular persistente, alteración del espermiograma, disminución progresiva del tamaño testicular o atrofia (demostrado en controles ecográficos) y varicosidades de gran tamaño.
Existen varias opciones terapéuticas, quizás las más extendidas en la actualidad son, la ligadura de las venas a nivel retroperitoneal mediante laparoscopia y el tratamiento por embolización venosa con espuma o coils (que tiene un mayor riesgo de recidiva).
Escroto agudo. Torsión de testículo
Ante un dolor testicular agudo en un paciente en edad pediátrica lo importante es identificar aquellos cuadros que pongan en peligro la viabilidad del testículo, sobre todo, la torsión testicular.
La torsión testicular en la infancia tiene dos picos de incidencia:
• Torsión testicular neonatal: es una torsión extravaginal, se suele producir antes del nacimiento y el teste se pierde en casi el 100% de los casos. Clínicamente, no suele dar sintomatología, pero en la exploración física se aprecia un teste tumefacto, de color oscuro con hidrocele reaccional. Requiere cirugía para orquiectomía de los restos testiculares y fijación contralateral (orquidopexia testículo contralateral).
• Torsión testicular del adolescente: es una torsión intravaginal. Se asocia a la malformación llamada testículos en badajo de campana, en la cual los testes se encuentran sin fijar, “flotando” en la vaginal testicular, hecho que facilita la torsión del cordón espermático, la isquemia testicular y el infarto consiguiente.
• Se trata de una EMERGENCIA QUIRÚRGICA. Si la detorsión del teste se realiza en las seis primeras horas, se recuperan más del 90% de los testículos afectados, pero si la cirugía se difiere más de 24 horas, el infarto testicular suele ser irreversible (Fig. 2).
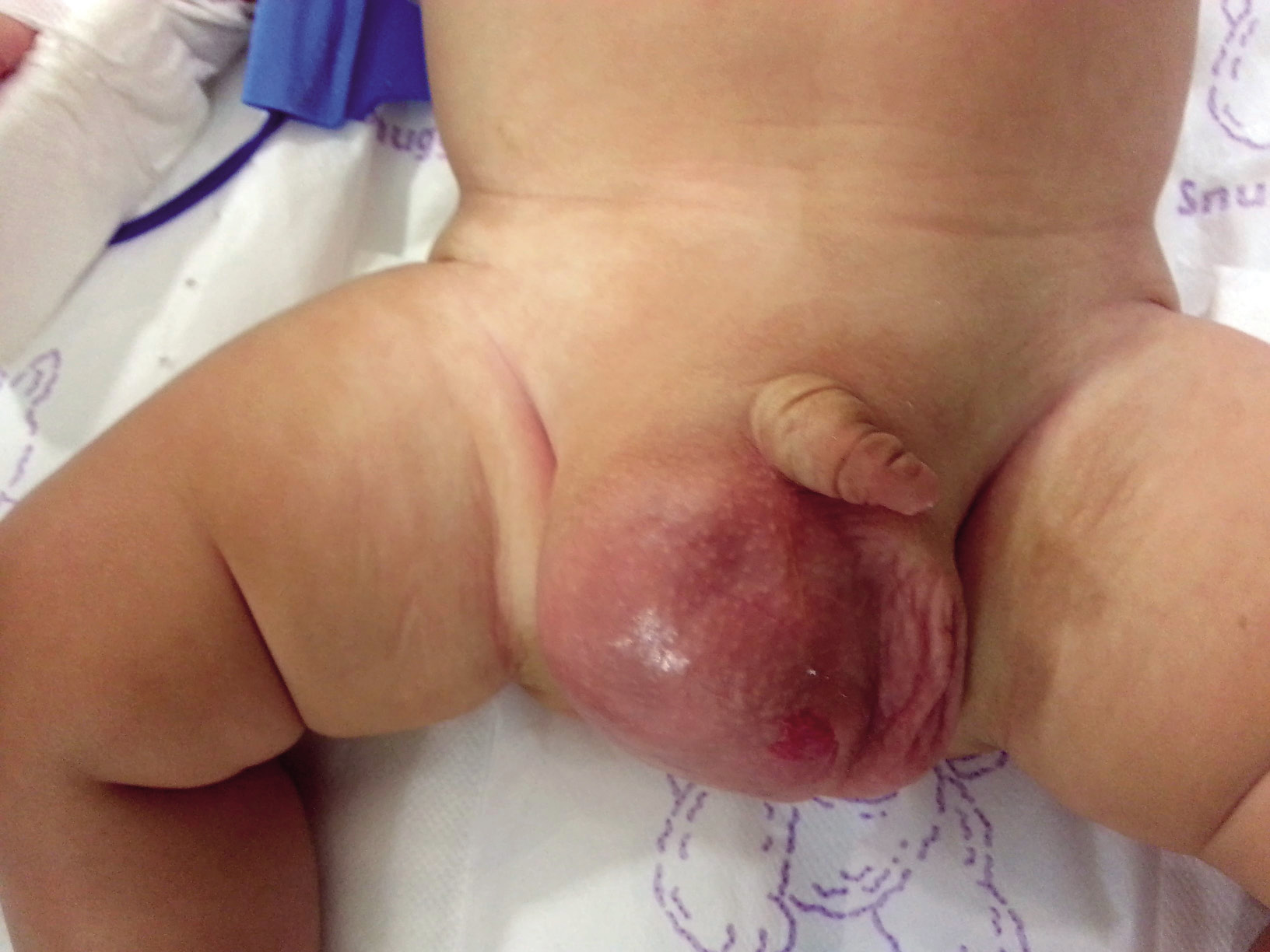
Figura 2. Escroto agudo. Torsión testicular.
Clínicamente se manifiesta por un dolor testicular intenso, en ocasiones acompañado de dolor abdominal, náuseas o vómitos.
La exploración en etapas iniciales muestra un teste fijo, ascendido y rotado y muy doloroso a la palpación. En etapas posteriores, aparece el hidrocele reaccional y el eritema y edema escrotal. Es característica la ausencia de reflejo cremastérico.
El eco-doppler testicular puede servir de ayuda si se realiza por un radiólogo con mucha experiencia, pero el diagnóstico es clínico. La exploración física realizada por un especialista basta para establecer la indicación quirúrgica.
El tratamiento consiste en realizar una detorsión del teste, asegurarse de su viabilidad y si es viable fijarlo en el escroto. Algunos autores recomiendan fijar también el testículo contralateral. Si el teste no es viable, se realiza una orquiectomía y fijación del testículo contralateral(5).
Otra posible causa de escroto agudo es la torsión de la hidátide de Morgagni, que es un apéndice testicular sin función que se torsiona y se necrosa, dando una clínica de dolor testicular que suele ser menos intenso. Durante la exploración física es posible apreciar la hidátide torsionada, que se observa en el polo superior del testículo como un pequeño bulto de color azulado. El tratamiento es conservador con reposo y antiinflamatorios, pero si existe gran componente inflamatorio, mucho dolor o hay dudas diagnósticas, puede extirparse quirúrgicamente.
La epididimitis es menos frecuente en niños que en adultos, pues está relacionada con la actividad sexual. Los niños prepuberales con epididimitis aguda tienen una incidencia de anomalías genitourinarias subyacentes del 25%. Si se confirma la infección urinaria, está indicado realizar el tratamiento antibiótico correspondiente.
Si aparecen epididimitis de repetición, está indicado realizar un estudio urológico completo, que incluya ecografía renal y vesical, cistouretrografía miccional (CUMS) y, en algunos casos, cistoscopia exploradora.Otras causas de dolor escrotal agudo son: edema escrotal idiopático, orquitis urliana, varicocele, hematoma escrotal, hernia incarcerada, apendicitis o enfermedad sistémica (púrpura de Henoch-Schonlein).
Patología renal
Agenesia renal
La incidencia fluctúa entre 1/500-1.000 recién nacidos vivos. Es más frecuente del lado izquierdo.
Clínicamente son asintomáticos. Hoy en día suele diagnosticarse en las ecografías prenatales.
Ante la sospecha ecográfica, al nacimiento debe repetirse una ecografía para confirmar el diagnóstico. El siguiente paso consiste en realizar una Gammagrafía renal con ácido dimercaptosuccínico (DMSA) marcado con Tc99, para tener la confirmación de ausencia de funcionalidad.
Habitualmente veremos también la compensación en tamaño y función del riñón sano.
Riñón en herradura
Es la anomalía de fusión más frecuente. Consiste en una fusión en la línea media de los polos inferiores de ambos riñones.
La incidencia es de 1/400. Es más frecuente en varones. Existe relación con agenesias de segmentos sacros y anomalías anorrectales (cloacas). También se relaciona con malformaciones uterinas y con el síndrome de Turner.
Un tercio de los pacientes son asintomáticos. El síntoma más frecuente es el dolor de espalda. Las anomalías del sistema colector suelen producir hidronefrosis, por obstrucción ureteral o reflujo, infecciones urinarias o cálculos.
Hasta el 50% tienen reflujo. Un 30% presentan un síndrome de la unión pielo-ureteral (SUPU).
La alteración más frecuente que requiere cirugía en estos pacientes, es la hidronefrosis por presentar un SUPU.
Presentan más riesgo de tumores renales, especialmente carcinoma de células renales y tumor de Wilms.
Displasia renal multiquística (DRM)
Es la forma más frecuente de enfermedad quística renal en el recién nacido. El parénquima renal es displásico y está ocupado por quistes múltiples de tamaño variable. El riñón no tiene sistema colector.
El lado izquierdo se afecta con más frecuencia. Habitualmente se diagnostica en etapa prenatal, gracias a la ecografía. En niños mayores, puede debutar con clínica de masa abdominal, dolor o hematuria. En la mayoría de los casos, es asintomático.
Es importante establecer el diagnóstico diferencial con la hidronefrosis, para ello se realizan ecografía renal y vesical. Posteriormente, se realiza gammagrafía renal DMSA, para ver la función renal diferencial. El riñón con DRM es un riñón que presenta una anulación funcional completa.
Los riñones con DRM sufren un proceso de involución progresiva. La principal preocupación con estos riñones es el riesgo de malignización, que no se ha establecido con claridad, aunque hay casos descritos en la literatura.
El protocolo de actuación en nuestro hospital es el seguimiento clínico y ecográfico hasta los 3 años. Se indica nefrectomía por vía retroperitoneoscopia en aquellos casos donde no se observa involución de los quistes renales o en pacientes que presenten complicaciones.
Quistes renales simples
No se conoce la etiología de los quistes simples, pero el hecho de que sean frecuentes en adultos (50%) y raros en los niños (0,2%) sugiere que sean adquiridos.
Son lesiones benignas localizadas en la corteza renal. Casi todos son asintomáticos y aparecen de forma incidental en estudios ecográficos abdominales por otras causas. La ecografía renal es la única prueba diagnóstica necesaria para realizar el diagnóstico diferencial con neoplasia maligna.
No está indicada la punción, ni el destechamiento. Solo está indicada la cirugía en quistes de gran tamaño o en caso de duda diagnóstica.
Hidronefrosis neonatal
Consiste en la dilatación del sistema pielocalicial del riñón, sin por ello tener una naturaleza patológica.
Aparece entre el 1 y el 5% de todos los embarazos y en un 20-40% es bilateral (Tabla I).
La hidronefrosis se clasifica de dos maneras, según las características prenatales, ambas con carácter pronóstico.
• Según el diámetro antero-posterior (Asociación Española de Pediatría) (Tabla II).
• Según su morfología (Sociedad Americana de Urología Fetal) (Tabla III).
En el 63% de los casos no tiene carácter patológico, siendo una dilatación transitoria o fisiológica, precisando únicamente controles seriados hasta su diagnóstico o resolución. Las causas más frecuentes de hidronefrosis patológica son: el reflujo vesicoureteral y el síndrome de la unión pielo-ureteral(Algoritmo 2).
Reflujo vesicoureteral (RVU)
Consiste en el paso retrógrado de orina desde la vejiga hacia el uréter y pelvis renal, ya sea durante la fase activa de la micción o durante la fase pasiva de llenado.
Es uno de los aspectos más controvertidos en Pediatría(10). Aparece en el 1-2% de los recién nacidos.
En 1985, el Comité Internacional para el Estudio del Reflujo introdujo un sistema uniforme para la clasificación del RVU. Este sistema de graduación combina dos clasificaciones precedentes y se basa en el grado de llenado retrogrado y dilatación del uréter, la pelvis renal y los cálices, en una CUMS (Fig. 3).

Figura 3. Sistema de graduación del reflujo vesicoureteral, según el Comité Internacional para el Estudio del Reflujo.
Puede tener una etiología anatómica, reflujo primario, debida a una implantación alta y anómala del uréter en la vejiga. Tiende a resolverse con el crecimiento de la vejiga, a partir del año de edad.
Puede tener un origen secundario, por alteraciones en el funcionamiento de la vejiga, entre las que se encuentran, presiones intravesicales elevadas o disfunción en la coordinación del vaciamiento vesical. También puede ser secundario a obstrucción uretral, como en las válvulas de uretra posterior. El tratamiento consiste en la corrección de la causa originaria.
Los riñones con reflujo presentan alteraciones de la función; además, las infecciones secundarias al RVU pueden provocar un daño renal añadido.
La técnica diagnóstica más utilizada para valorar el reflujo es la Cistouretrografía Miccional Seriada (CUMS). Hoy en día, también se utiliza en muchos centros la ecocistografía con ecopotenciador, para minimizar las radiaciones y, especialmente, en seguimiento evolutivo del reflujo.
Para el seguimiento se utiliza también la ecografía renal convencional, para valorar el grado de dilatación y el DMSA, para vigilar la evolución de la función renal.
La gammagrafía renal con DMSA y función renal diferencial, está desplazando a la CUMS como primera prueba a realizar ante la aparición de Infecciones del Tracto Urinario (ITUs) y, en caso de verificar la existencia de daño renal con pérdida de función y cicatrices, la segunda prueba a realizar es la CUMS.
Las opciones terapéuticas son múltiples y deben individualizarse en cada caso, pero de forma progresiva son: observación, profilaxis antibiótica, tratamiento endoscópico con implante submeatal o cirugía con reimplante vesical vía abierta o laparoscópica (Tabla IV).
La probabilidad de resolución mediante cistoscopia y punción es variable, según el grado de reflujo, aproximadamente 70-90% para grados I-III y disminuyendo hasta el 50-72% para grados IV-V. Este porcentaje de resolución se puede aumentar, repitiendo nuevas punciones, con lo que se acerca mucho al 100% con 3 punciones.
No hay un protocolo terapéutico establecido por consenso internacional y existen numerosas guías.
En términos generales y tras descartar una micción disfuncional, si se sospecha un paciente recién nacido o lactante con RVU mayor de grado III, se comenzaría con profilaxis antibiótica a la espera de su resolución espontánea, no siendo necesaria la profilaxis en RVU grado I-II.
Si el paciente presenta ITUs, aparecen cicatrices renales, pérdida de función en DMSA o efectos secundarios a la medicación, se pasa al siguiente nivel terapéutico, siempre explicando a los padres del paciente todas las opciones posibles y el porcentaje de resolución con cada una de ellas.
Muchos de ellos optan por un tratamiento endoscópico precoz en grados severos, en vez de mantener profilaxis durante varios años.
Síndrome de la unión pieloureteral (SUPU)
Consiste en la alteración del flujo urinario desde la pelvis hasta el uréter proximal, con dilatación consiguiente del sistema colector y posibilidad de lesión renal. Es la causa más frecuente de hidronefrosis neonatal.
Tiene una incidencia global de 1:1.500.
Mucho más difícil es la definición de obstrucción y diferenciar entre vías urinarias obstruidas y no obstruidas. En la actualidad, la definición más aceptada es que la obstrucción representa una restricción al flujo urinario que, si no se trata, provocará un deterioro renal progresivo.
Para ello, es necesario confirmar la hidronefrosis con una ecografía a la semana de vida y realizar al mes un renograma diurético 99mTc-MAG3 (mercaptoacetiltriglicina). Este trazador nos aportará una imagen de la función renal diferencial entre los dos riñones y nos permite valorar la eliminación del trazador por el sistema, una vez administrado un diurético. Una diferencia mayor del 20% entre ambos riñones indica sufrimiento renal y en la segunda fase, si el tiempo de eliminación de la mitad del trazador una vez administrado el diurético es mayor de 20 minutos, se consideraría un sistema “obstruido”.
Las indicaciones quirúrgicas del SUPU son:
• Síntomas (niños mayores, ITU, dolor, cálculos).
• Función renal alterada de base (< 40%).
• Empeoramiento de la función renal > 10%.
• Empeoramiento ecográfico con aumento del diámetro AP de la pelvis.
• Hidronefrosis masiva (> 50 mm).
El tratamiento quirúrgico consiste en una pieloplastia desmembrada, según la técnica abierta normalizada de Hynes y Anderson (Fig. 4). Recientemente, cada vez hay más datos que respaldan el uso de un abordaje laparoscópico.

Figura 4. Pieloplastia desmembrada (según la técnica de Anderson-Hynes).
Megaureter. Obstrucción de la unión ureterovesical
Consiste en la dilatación del uréter, considerándose un uréter dilatado si el diámetro de este es mayor de 7 mm.
Se clasifica según su etiología en:
• Refluyente (el más frecuente por RVU).
• Megauréter Obstructivo Primario.(obstrucción de la unión ureterovesical). Tasa de remisión espontánea de hasta el 85%.
• Refluyente y obstructivo.
• No refluyente ni obstructivo (funcional).
El protocolo diagnóstico terapéutico se basa en clasificarlo según su etiología para aplicar el tratamiento correspondiente. Un megauréter refluyente seguirá el protocolo terapéutico del RVU, el funcional precisará simple seguimiento y observación, y el obstructivo precisará un manejo conservador como mejor opción y, si existe empeoramiento, dilatación neumática con balón por cistoscopia o cirugía de reimplante ureteral.
Ureterocele
Es una malformación estructural que consiste en la dilatación terminal del uréter en su desembocadura. El tamaño y la localización del ureterocele determinará si es intravesical o extravesical.
En un 80% de los casos está asociado a duplicidad ureteral, perteneciendo el ureterocele al polo superior, que suele tener cierto grado de displasia. El diagnóstico puede ser un hallazgo casual o realizarse en el contexto de una ITU, en el estudio de una hidronefrosis o por provocar síntomas inespecíficos (falta de ganancia ponderal). La valoración inicial se realiza con ecografía, hemos de descartar reflujo asociado en dicho riñón o en el contralateral con una CUMS y valorar si el ureterocele tiene o no carácter obstructivo (MAG-3). Las posibilidades de tratamiento son: punción mediante cistoscopia, reimplante transvesical de dicho uréter o heminefrectomía si el polo renal asociado no es funcional.
Uréter ectópico
Consiste en la inserción de la desembocadura ureteral caudal a su inserción habitual, pudiendo llegar a desembocar desde la vejiga hasta la vagina en niñas o en la vesícula seminal en varones.
Suele asociarse a duplicidad y, en concreto, al uréter correspondiente al polo superior. Al desembocar, en muchos casos por debajo del esfínter (infraesfinteriano), puede provocar incontinencia de unas características muy concretas: manchado escaso, asintomático y continuo en todas las horas del día. El riñón asociado suele ser más displásico cuanto más distal es la ectopia. El diagnóstico incluye el estudio detallado de: malformaciones asociadas, obstrucción, función renal ipsilateral y de la anatomía, por lo que será necesario realizar una CUMS y un renograma diurético, siendo incluso necesaria, en ocasiones, la urorresonancia magnética o la realización de una cistoscopia diagnóstica.
Duplicidad pieloureteral
Es una alteración anatómica en la que uno o ambos riñones tienen 2 sistemas de drenaje hacia la vejiga (2 pelvis +2 uréteres) y, por lo tanto, con dos orificios de desembocadura vesical.
Puede ser asintomática o asociar cualquiera de las malformaciones urológicas descritas.
El polo superior se asocia, con más frecuencia, a: uréter ectópico, riñón displásico y ureterocele. El polo inferior asocia RVU, preferentemente.
Válvulas de uretra posterior (VUP)
Se trata de unas valvas o membranas congénitas y obstructivas a nivel de la uretra posterior de los recién nacidos varones, que impide el flujo anterógrado de la orina y, por tanto, el vaciado vesical.
Aparece en 1/5.000 recién nacidos y puede llevar a insuficiencia renal en un 20% de los casos. La morfología es variable, habiéndose descrito 3 tipos (Young):
• Tipo 1 (95%): hipertrofia de crestas uretrales.
• Tipo 2: no obstructivas. Pliegues mucosos.
• Tipo 3 (5-10%): anulares. Otro origen.
El bloqueo de la uretra por las válvulas provoca un aumento de presión intravesical, hipertrofia del detrusor y resultante de esto, un RVU.
Según la severidad y momento de aparición, el daño renal puede provocar insuficiencia renal con oliguria, oligohidramnios y la consecuente hipoplasia pulmonar.
La clínica y el momento de aparición es variable y depende de la severidad, de forma que pueden ser diagnosticadas en ecografía prenatal o postnatal, ante una ureterohidronefrosis o ante una ITU, o ante una masa vesical en el recién nacido.
El diagnóstico es ecográfico, tanto en la ecografía prenatal como postnatal.
Es importante conocer la función renal del recién nacido (RN). Una creatinina en el RN > 0,6 mg/dl es un dato de mal pronóstico.
CUMS a las 24-48 horas, que valorará la anatomía del defecto y la presencia de RVU.
Gammagrafía DMSA al mes de vida, para valorar la función renal relativa (algoritmo 3).
El manejo en el RN consiste en la realización de una resección transuretral (RTU) de las VUP por cistoscopia o realizar una derivación urinaria para prevenir el daño renal (vesicostomía o ureterostomías)
La intervención in-útero en las VUP y en hidronefrosis severa bilateral consiste en realizar antes de las 30 semanas de gestación un shunt vesicoamniótico fetal.
Bibliografía
1. American Academy of Pediatrics. Report of the Task Force on Circumcision. Pediatrics. 1989; 84: 388-91. Erratum in: Pediatrics. 1989; 84(2): 761.
2. Hutcheson JC. Male neonatal circumcision: indications, controversies and complications. Urol Clin North Am. 2004; 31(3): 461-7. http://www.ncbi.nlm.nih.gov/pubmed/15313055.
3. Elmore JM, Baker LA, Snodgrass WT. Topical steroid therapy as an alternative to circumcision for phimosis in boys younger than 3 years. J Urol. 2002; 168(4 Pt 2): 1746-7; discussion 1747.
4. Schwentner C, Oswald J, Kreczy A, Lunacek A, Bartsch G, Deibl M, Radmayr C. Neoadjuvant gonadotropin releasing hormone therapy before surgery may improve the fertility index in undescended testes –a prospective randomized trial. J Urol. 2005; 173(3): 974-7.
5. Varga J, Zivkovic D, Grebeldinger S, Somer D. Acute scrotal pain in children–ten years’ experience. Urol Int. 2007; 78(1): 73-7. http://www.ncbi.nlm.nih.gov/pubmed/17192737.
6. Wang Z, Liu BC, Lin GT, Lin CS, Lue TF, Willingham E, Baskin LS. Up-regulation of estrogen responsive genes in hypospadias: microarray analysis. J Urol. 2007; 177(5): 1939-46. http://www.ncbi.nlm.nih.gov/pubmed/17437852.
7. Snodgrass WT, Yucel S. Tubularized incised plate for mid shaft and proximal hypospadias repair. J Urol. 2007; 177(2): 698-702. http://www.ncbi.nlm.nih.gov/pubmed/17222659.
8. Kogan SJ. The pediatric varicocele. In: Gearhart JP, Rink RC, Mouriquand PDE, eds. Pediatric urology. Philadelphia: WB Saunders, 2001, pp. 763-773.
9. O`Reilly P, Aurell M, Britton K, Kletter K, Rosenthal L, Testa T. Consensus on diuresis renography for investigating the dilated upper urinary tract. Radionuclides in Nephrourology Group. Consensus Committee on Diuresis Renography. J Nucl Med. 1996; 37(11): 1872-6.
10. Fanos V, Cataldi L. Antibiotics or surgery for vesicoureteric reflux in children. Lancet 2004; 364(9446): 1720-2. http://www.ncbi.nlm.nih.gov/pubmed/15530633.
11. Di Benedetto V, Montfort G. How prenatal utrasound can change the treatment of ectopic ureterocele in neonates? Eur J Pediatr Surg. 1997; 7(6): 338-40.
Bibliografía recomendada
- Tekgül S, Riedmiller H, Gerharz E, Hoebeke P, Kocvara R, Nijman R, Radmayr Chr, Stein R. European Society for Paediatric Urology. © European Association of Urology 2010.
Guía clínica sobre urología pediátrica.
| Caso clínico |
|
Recién nacido varón a término, de adecuado peso para su edad gestacional. Durante el embarazo, se detectó una hidronefrosis derecha con pelvis renal de 15 mm de diámetro AP sin dilatación de uréter, con dilatación calicial y parénquima normal. Se realiza ecografía a las 24 horas del nacimiento, que muestra una ectasia piélica derecha de 7 mm de diámetro AP, sin visualizar uréter. |
Puede realizar el cuestionario de acreditación pinchando AQUÍ.
Le recordamos que debe ser socio y estar registrado.
El cuestionario debe realizarlo en el orden en que los temas aparecen en la revista (del primero al último).
Al finalizar las preguntas de cada tema, estas se guardan automáticamente.
