 |
| Temas de FC |
R.M. Perich Durán
Unidad de Cardiología Pediátrica. Hospital de Sabadell. Corporació Sanitària Parc Taulí. Sabadell. Institut Universitàri Parc Taulí. UAB. Universitat Autónoma de Barcelona, Campus d’Excelència Internacional 08193. Bellaterra, Spain
| Resumen
Se hace una revisión de las cardiopatías congénitas (CC) más frecuentes diagnosticadas en el niño. Según varios autores, la incidencia de las CC está entre el 5-12‰ RN vivos. Se han seleccionado 7 cardiopatías que según estos mismos estudios, son las más frecuentes en la infancia y adolescencia, y se describen las características clínicas y formas de presentación, los métodos diagnósticos de que disponemos en la actualidad, así como el tratamiento médico, cateterismo terapéutico o tratamiento quirúrgico. |
| Abstract
A review is made of the most frequent congenital heart diseases (CHD) diagnosed in the child. According to several authors, the incidence of CHD is 5-12% live newborns. A total of 7 heart diseases which, according to these studies are the most frequent in childhood and adolescence, have been chosen. Their clinical characteristics and presentation forms, the currently available diagnostic methods and the medical treatment, therapeutic catheterism or surgical treatment have been described. |
Palabras clave: Cardiopatías congénitas; Epidemiología; Diagnóstico.
Key words: Congenital heart diseases; Epidemiology; Diagnosis.
Pediatr Integral 2012; XVI: 622-635
Cardiopatías congénitas más frecuentes y seguimiento en Atención Primaria
Introducción
Se define como cardiopatía congénita (CC) a toda anomalía estructural del corazón o de los grandes vasos. Las cardiopatías congénitas son consecuencia de las alteraciones del desarrollo embrionario del corazón, aproximadamente entre la 3ª y 10ª semana de gestación.
Etiología
Las CC pueden tener una causa genética, ambiental o multifactorial.
La etiología todavía no es clara en muchas de las cardiopatías y se consideran tres principales causas: genética, factores ambientales y multifactorial, en la que se asociarían factores genéticos y ambientales. Dentro de los de etiología genética, a parte de las cromosomopatías conocidas, se han identificado defectos genéticos y moleculares específicos que contribuyen en las malformaciones cardiacas, gracias a los recientes avances sobre el genoma humano. De tal manera, se han identificado mutaciones de un solo gen en malformaciones cardiacas aisladas, como la estenosis aórtica supravalvular y la coartación aórtica, o asociadas a síndromes malformativos como: Alagille, Marfan, Noonan o Holt Oram. También síndromes de microdeleciones cromosómicas han sido implicadas en las malformaciones cardiacas, como en el síndrome de DiGeorge, o en el síndrome de Williams-Beuren. Es muy interesante en este aspecto el estudio publicado por Mary Ella Pierpont y cols.(1) que hace una revisión actualizada sobre las bases genéticas de las cardiopatías, donde se puede encontrar por un lado un algoritmo de las diferentes malformaciones cardiacas asociadas a las cromosomopatías (deleciones, trisomías, monosomías…) y, por otro lado, un algoritmo extenso de las causas genéticas, asociaciones y características clínicas de las principales cardiopatías.
El riesgo de recurrencia varía según si hay una herencia del tipo monogénico que será del 50% en casos de herencia autonómica dominante. Si la herencia es autonómica recesiva, cuando existe un hermano afecto el riesgo de recurrencia para el otro hermano es del 25%. En el estudio de Gill(2) detectó una recurrencia de CC en un 2,7% de 6.640 gestantes.
Dentro de las causas ambientales responsables de malformaciones cardiacas están: 1) las enfermedades maternas, como: la diabetes pregestacional, la fenilcetonuria, el lupus eritematoso y la infección por HIV; 2) exposición materna a drogas (alcohol, anfetaminas, hidantoínas, y otras); y 3) exposición a tóxicos como: disolventes orgánicos, lacas, pinturas, así como herbicidas, pesticidas y productos de cloración. El riesgo de padecer una cardiopatía en relación con estos factores no hereditarios está detallado en el estudio de Kathy J. Jenkins(3), en que se valora el riesgo relacionado con las diferentes drogas y agentes químicos y físicos.
Estaría indicado realizar un estudio citogenético en los siguientes casos:
1. Lactante o niño con fenotipo reconocible de un síndrome cromosómico.
2. Lactante o niño con CC asociada a rasgos dismórficos, retraso de peso/talla que no se explique por la cardiopatía, retraso mental o retraso del desarrollo o cuando presente varias malformaciones.
3. Lactante o niño con historia familiar de múltiples abortos.
4. Si se detecta una CC y/o otra malformación en otro órgano por ecografía prenatal o ecocardiografía fetal.
Incidencia
Se estima una incidencia de CC entre el 5-12 por 1.000 recién nacidos (RN) vivos.
La cardiopatía congénita es la malformación más frecuente, según el estudio de prevalencia de los 10 defectos más frecuentes, realizado en nuestro país en el año 2004(4). La incidencia es del 5-12 ‰ según los autores. Este intervalo es amplio y varía dependiendo de los criterios de inclusión, ya que hay cardiopatías, como la válvula aórtica bicúspide o el prolapso mitral, que no se incluyen en algunos estudios, bajando por tanto la incidencia; y también depende de los métodos diagnósticos, ya que actualmente con la ecocardiografía –Doppler– color se identifican muchas CC que antes podían pasar desapercibidas como: comunicación interventricular (CIV) muscular, comunicación interauricular (CIA), ductus y válvula bicúspide aórtica. Por otro lado, el hecho de que muchas CC se diagnostiquen actualmente por ecocardiografía fetal en el 2º trimestre, con posibilidad de interrupción del embarazo, hace que esta incidencia se pueda ver afectada en número de RN vivos con CC, sin embargo, la incidencia en el feto será la misma.
En nuestro país, hay un estudio sobre la incidencia de CC en Navarra en un periodo de 10 años, dando una incidencia de 8,96‰ RN vivos, de las cuales el 90% de las cardiopatías detectadas está constituido por las CC más frecuentes(5).
Las CC más frecuentes según los diferentes autores son por orden de frecuencia: la CIV, CIA, el ductus permeable, estenosis pulmonar (EP), coartación aórtica (CºAº), tetralogía de Fallot y estenosis aórtica (EAº). Y después: la transposición de grandes arterias, el canal atrioventricular y el síndrome del corazón izquierdo hipoplásico.
Detección de una CC en el recién nacido
Los signos sospechosos de CC en el RN son la cianosis, la taquipnea, la presencia de soplo y la alteración de los pulsos.
Actualmente, con la ecocardiografía fetal se pueden diagnosticar muchas cardiopatías antes del nacimiento, lo que ayuda para poder planificar el nacimiento en un hospital terciario, cuando se prevé que ésta pueda comportar un riesgo para el RN. Sin embargo, todavía hay cardiopatías que no se diagnostican prenatalmente, esto comporta que sea importante la valoración de varios signos y síntomas en el RN para detectar una cardiopatía en estos primeros meses de vida.
Anamnesis
En primer lugar, es importante la anamnesis de las enfermedades maternas (diabetes, drogas, tóxicos), antecedentes de CC o de otras anomalías cardiacas familiares, antecedentes obstétricos (si se ha efectuado ecocardiografía fetal, sufrimiento fetal, infecciones…).
También hay que valorar el momento de aparición de los síntomas o signos, así preguntaremos sobre la respiración, ya que la taquipnea suele ser frecuente en muchas cardiopatías, la forma de alimentarse, si rechaza el alimento, si suda con las tomas, si gana peso, o si es un lactante cianótico investigar si puede tener crisis hipóxicas.
El tiempo de aparición de los síntomas y signos nos puede orientar sobre el tipo de cardiopatía, así si aparecen en la primera semana de vida, seguramente se tratará de una cardiopatía compleja, como la transposición de grandes arterias, la EP o EAº severas o la hipoplasia de cavidades izquierdas.
Exploración
Habrá que investigar la cianosis, y diferenciarla de la cianosis periférica secundaria a un enlentecimiento del flujo sanguíneo por el frío, hipovolemia o shock. Se considera patológica una PO2 inferior a 60 mmHg o una saturación menor del 92% respirando aire ambiente.
La auscultación tiene un valor limitado en el RN pues puede haber CC sin soplos. Hay que prestar atención a la frecuencia cardiaca y el ritmo; así, en el RN, los límites normales están entre 80-170/m, y en los dos primeros años oscila de 80-130/m.
Es importante la palpación de los pulsos periféricos simultáneamente para descartar una Cº Aº. En el RN y lactante es más fácil palpar los axilares que los radiales, y en ocasiones se palpan mejor los pedios que los femorales. La palpación torácica de un frémito es indicativa de cardiopatía. Una hepatomegalia superior a 3 cm probablemente sea secundaria a insuficiencia cardiaca congestiva (ICC). Una frecuencia respiratoria por encima de 60/m debe ponernos en alerta para descartar CC.
El diagnóstico se basará principalmente en la ecocardiografía-Doppler, que se hará siempre que haya la sospecha. El ECG nos puede orientar en algunas cardiopatías y cuando se sospeche arritmia. La Rx de tórax será útil para valorar el tamaño cardiaco, el flujo pulmonar y el arco aórtico.
Cardiopatías congénitas más frecuentes
Vamos a estudiar las CC más frecuentes y las dividiremos en tres grupos:
1. Cardiopatías que cursan con cortocircuito izquierda-derecha (CIV, CIA, ductus).
2. Cardiopatías con obstrucción al flujo de sangre (EP, EAº, CºAº).
3. Cardiopatías con cianosis (tetralogía de Fallot).
Cardiopatías con cortocircuito izquierda-derecha
Es un grupo de CC en que los síntomas vienen condicionados por el hiperaflujo pulmonar.
Fisiopatología
Cuando hay una conexión anormal entre la circulación sistémica y pulmonar hay un aumento de volumen de sangre desde el lado izquierdo (sistémico) al derecho (pulmonar). Estas conexiones pueden ser por defectos intracardiacos como la CIV o la CIA o conexiones vasculares como el ductus o las fístulas arterio-venosas.
La cantidad de flujo que pasa a la circulación pulmonar se puede valorar midiendo el gasto sistémico (QS) y el gasto pulmonar (QP), de tal manera que una relación QP/QS 1:1 es normal, mientras que cuando hay un cortocircuito izqda.-dcha. la relación puede ser 2:1, lo que indicaría que el flujo pulmonar es el doble que el sistémico. Este aumento del flujo pulmonar es el causante de la mayoría de síntomas que presentan los lactantes.
Los cambios fisiopatológicos que se producen cuando hay un cortocircuito dependen del tamaño de la comunicación, la localización y también de la resistencia al flujo en el lugar de la comunicación. Como las resistencias vasculares pulmonares al nacer son elevadas, el cortocircuito izqda.-dcha. es mínimo y será cuando estas bajan en las primeras semanas de vida, cuando se ponga de manifiesto el cortocircuito y aparezcan los síntomas(6).
Manifestaciones clínicas
Los pacientes con un hiperaflujo pulmonar debido a un cortocircuito izqda.-dcha. pueden estar asintomáticos o presentar taquipnea y distrés respiratorio. Con un QP/QS >2:1 suele haber trastornos hemodinámicos por edema intersticial, lo que provoca disminución de la compliance pulmonar, enfisema y atelectasias, que se traducen clínicamente en taquipnea y el distrés respiratorio, así como más vulnerabilidad para presentar infecciones pulmonares, especialmente la del VRS, que condiciona un incremento de la estancia hospitalaria y mortalidad comparando con otros niños.
También presentan taquicardia y sudoración debido al aumento de catecolaminas circulantes, y poca ganancia ponderal debido a la dificultad respiratoria combinada con insuficiente ingesta, asociada al aumento del consumo calórico y demandas de oxígeno del miocardio. Los signos más específicos de IC son la taquipnea >50/m, el ritmo de galope, la hepatomegalia y las dificultades de alimentación.
Comunicación interventricular (CIV)
Las manifestaciones clínicas dependerán de la localización y el tamaño de la CIV.
Es un defecto a nivel del septo interventricular que comunica el ventrículo izquierdo (VI) con el ventrículo derecho (VD). La CIV aislada corresponde a un 25% de todas las CC. También, se puede dar asociada a otras CC como: tetralogía de Fallot, canal atrioventricular, transposición de grandes arterias, truncus…
Clasificación y clínica
Las clasificamos según su localización y su tamaño. Según estas características hay una gran variedad de manifestaciones.
Según su localización pueden ser: (Fig. 1.):

Figura 1. CIV. Tipos.
a. CIV membranosa (o perimembranosa o subaórtica). Es la más frecuente de las CIV (75%) y se localiza debajo de la válvula aórtica y detrás de la valva septal de la tricúspide, a menudo se extiende hacia el septo de entrada.
b. CIV supracristal (del septo de salida). Es una CIV superior y anterior, localizada inmediatamente debajo de las válvulas de ambos troncos arteriales. Corresponde a un 5-7% de las CIV y no suele cerrar espontáneamente.
c. CIV muscular (15% de las CIV), localizadas en la zona muscular del septo, en la zona central o en el apical. Pueden ser múltiples y es muy frecuente su cierre espontáneo.
d. CIV del septo de entrada (tipo canal AV) (5% de las CIV). Es un defecto posterior y superior, cerca del anillo tricuspídeo. Se asocia a CIA como parte del canal AV.
Según su tamaño, dividiremos las CIV en pequeñas, moderadas y grandes.
El tamaño del defecto se expresa habitualmente en relación con el anillo aórtico, así las CIV grandes equivalen al tamaño del anillo aórtico o mayores, medianas (entre 1/3 y 2/3 del anillo aórtico) y pequeñas (inferiores a 1/3 del anillo aórtico)(7).
• CIV pequeñas, o restrictivas: hay una resistencia al paso de sangre, dando solo un cortocircuito ligero. La presión del VD y arteria pulmonar es normal o ligeramente aumentada, las resistencias pulmonares son normales y solo hay una ligera sobrecarga ventricular. Se suelen diagnosticar por la presencia de un soplo sistólico en los primeros días de vida, generalmente de G 2-3/6 en el borde paraesternal izquierdo sin otros síntomas. En las CIV musculares pequeñas, el soplo se ausculta al inicio de la sístole, ya que con la contracción ventricular se cierra el defecto.
En estas CIV, el ECG y la Rx de tórax son normales y el ecocardiograma-Doppler confirma el diagnóstico, ya que localiza el defecto y puede valorar el tamaño y la repercusión hemodinámica. La historia natural de estas CIV es buena, ya que aproximadamente un 35% presentan un cierre espontáneo en los primeros dos años de vida. Las CIV musculares cierran por el crecimiento del septo muscular y las CIV membranosas por aposición de la válvula septal de la tricúspide. Gabriel HM publica los resultados del seguimiento de 229 casos de CIV aislada, no cerrada durante la infancia y seguidos a 30+/-10 años, y detecta un cierre espontáneo del 6%, y el 94,6% están asintomáticos con tamaño y función del VI normal(8).
Los factores que predicen un curso benigno son:
1. Que el cortocircuito QP/QS sea <1,5.
2. Que no haya sobrecarga de volumen del VI.
3. Que la presión pulmonar sea normal.
4. Que no haya insuficiencia aórtica relacionada con la CIV.
• CIV moderadas: ofrecen una ligera resistencia al flujo y la presión en el VD y arteria pulmonar pueden estar bajas o ligeramente elevadas. Hay una sobrecarga de volumen del VI y la aurícula izquierda y signos y síntomas de IC, como la taquipnea, taquicardia a partir de los 15 días de vida. Se auscultará un soplo holosistólico en el 3º-4º EII. En la Rx de tórax habrá cardiomegalia con hiperaflujo pulmonar. Con el ecocardiograma-Doppler (Fig. 2), aparte de informarnos sobre el tamaño y repercusión, podemos obtener información sobre la presión pulmonar y del VD mediante el cálculo del gradiente de presión entre los dos ventrículos. La evolución de estas CIV dependerá del tamaño del defecto y de la presión pulmonar. Puede presentarse IC en los primeros 6 meses de vida, y deberán tratarse en espera de la reducción del defecto. En muchos casos habrá un cierre espontáneo y no precisarán cirugía, o pueden evolucionar hacia una estenosis pulmonar en el tracto de salida del VD como protección al aumento del flujo pulmonar. En un estudio en que se valoró la evolución de 33 niños con CIV moderada no operados, con dilatación del VI, pero sin IC ni hipertensión pulmonar (HTP), presentaban en el seguimiento de 7,8 años una disminución del tamaño del VI por reducción del cortocircuito(9).

Figura 2. Eco-Doppler-color. Corte subcostal. CIV paramembranosa.
• CIV grandes: generalmente son de igual o mayor tamaño que la raíz aórtica, y prácticamente no ofrecen resistencia al flujo, la presión en ambos ventrículos es igual y el grado de cortocircuito dependerá de las resistencias sistémicas y pulmonares. Cuando bajan estas últimas hay un gran cortocircuito izqda.-dcha. que se traduce en un aumento del retorno venoso pulmonar y dilatación de cavidades izquierdas. Los efectos del hiperaflujo pulmonar son los que provocan la taquipnea y dificultad respiratoria, y el efecto sobre la circulación sistémica comporta una disminución del gasto sistémico, que se acompaña de una serie de mecanismos compensatorios que permiten al niño adaptarse a la sobrecarga de volumen, como son el efecto Frank-Starling, la hiperestimulación simpática y la hipertrofia miocárdica. El aumento de presión en el lecho capilar pulmonar provoca un aumento del líquido intersticial y edema pulmonar. El hiperaflujo pulmonar severo y mantenido puede dar lugar a una enfermedad vascular pulmonar irreversible. Clínicamente, puede aparecer ICC entre las 2 y 8 semanas de vida, con: ritmo de galope, taquicardia, taquipnea, tiraje, hepatomegalia y mala perfusión periférica. La auscultación de un soplo sistólico con un 2R único indicaría unas resistencias pulmonares elevadas. En el ECG suele haber una hipertrofia biventricular, aunque si la presión en el VD es alta puede haber una hipertrofia ventricular derecha (HVD). En la Rx de tórax, hay una cardiomegalia con hiperaflujo pulmonar y si hay ICC, signos de edema pulmonar. El ecocardiograma-Doppler nos podrá dar el diagnóstico, así como la valoración hemodinámica y el cálculo de la presión pulmonar.
Estas CIV no cierran espontáneamente y, si no se realiza cirugía, pueden evolucionar hacia una HTP por aumento de resistencias pulmonares.
Indicaciones de cateterismo cardiaco:
• Valoración preoperatoria de defectos amplios o múltiples con sospecha de patología asociada.
• Defectos medianos con indicación dudosa de cirugía.
• Pacientes con HTP y cortocircuito izqda.-dcha. pequeño o moderado para valorar resistencias pulmonares y posibilidad del tratamiento quirúrgico.
• Oclusión del defecto mediante implantación del dispositivo para el cierre por cateterismo de la CIV(10).
Tratamiento
1. El tratamiento médico estará indicado para los lactantes con clínica de IC y retraso pondoestatural. Los objetivos serán la mejora de los síntomas, la normalización del peso y la prevención de las infecciones respiratorias.
Estos niños precisan más calorías (más de 150 kcal/kg/día), debido al aumento de la demanda metabólica, esto se consigue añadiendo a su dieta preparaciones de carbohidratos y/o triglicéridos, no se aconseja restricción hídrica. Debido a la dificultad respiratoria, en ocasiones será necesaria la alimentación por sonda nasogástrica nocturna o continua.
Los fármacos utilizados son:
a. Diuréticos: actúan reduciendo la precarga. Furosemida oral (1-3 mg/kg/día) en 1-3 tomas, junto con espironolactona oral, que es útil para reducir la pérdida de potasio, a dosis 2-3 mg/kg/día.
b. Inhibidores de la enzima convertidora de angiotensina (IECA): (captopril o enalapril) que se usan para disminuir la poscarga, ya que al disminuir la resistencia vascular sistémica disminuye el cortocircuito izquierda-derecha. Cuando se usa la espironolactona junto con los IECA hay que controlar el potasio por el riesgo de hiperpotasemia. Enalapril a dosis inicial 0,1 mg/kg/24 h (en 2 dosis), aumentando progresivamente hasta 0,5 mg/24 h. Captopril a dosis 0,1 mg/kg/dosis (cada 8-12 h), hasta 0,5-1 mg/kg/dosis.
c. Digoxina: actúa aumentando la contractilidad cardiaca. Su uso es debatido cuando hay una contracción normal. Puede estar indicada cuando no hay mejoría de los síntomas con el tratamiento habitual y no se puede realizar cirugía.
Este tratamiento se realiza con ingreso hospitalario para control de los síntomas, tolerancia a la medicación, control de la digoxinemia, electrólitos y control de la ingesta y el peso.
Estos lactantes hacen infecciones respiratorias frecuentes, que empeoran los síntomas de IC y habrá que hacer una profilaxis adecuada.
2. Tratamiento quirúrgico: la reparación directa del defecto es la preferida en la mayoría de centros. El Banding de la arteria pulmonar se reserva para casos críticos con CIV múltiples o para lactantes muy pequeños para realizar la corrección completa.
Indicaciones para el tratamiento quirúrgico:
– Lactantes < de 6 m (< de 3 m si tienen trisomia 21), que presenten IC no controlada médicamente y que presenten HTP.
– Niños de <12 m con QP/QS >2/1 que no tengan resistencias pulmonares altas.
– Niños mayores, asintomáticos con presión pulmonar normal, si hay un QP/QS >2/1.
– CIV membranosas y subpulmonares, independientemente del tamaño, que presenten insuficiencia aórtica.
El procedimiento de elección será el cierre del defecto bajo circulación extracorpórea, que se hará con un parche de dacron o con sutura directa, entrando por la aurícula derecha y a través de la válvula tricúspide sin abrir la pared ventricular.
El cierre con dispositivo por cateterismo es controvertido, ya que la principal limitación es la posibilidad de lesión de las estructuras próximas, como: válvulas AV, sigmoideas o el nodo AV.
La evolución posquirúrgica de estos niños suele ser excelente (supervivencia 87% a 25 años). Suelen hacer vida normal. Puede haber casos de CIV residuales que generalmente no precisan un cierre posterior(11).
Es frecuente la presencia de bloqueo de rama derecha del haz de His debido a la ventriculotomía o a la lesión directa de la rama derecha al cerrar el defecto.
Revisiones pediátricas: tiene especial interés vigilar cualquier infección intercurrente en un lactante con CIV significativa, que podría descompensar su situación cardiológica. También, es importante valorar la aparición de nuevos signos (cianosis, arritmia).
La profilaxis de la endocarditis infecciosa se limitará a los procedimientos dentales y del tracto respiratorio en los pacientes con CIV: a) los 6 meses posteriores al cierre del defecto con material protésico o dispositivo; b) CIV reparadas y con defecto residual a nivel del material protésico o dispositivo; y c) endocarditis bacteriana previa.
Se recomienda vacuna del neumococo, varicela y gripe (>6 m), así como la profilaxis pasiva frente al VRS con anticuerpos monoclonales (palivizumab) que debería ser administrado a los niños menores de 2 años y cardiopatía hemodinámicamente significativa.
Post-cirugía, la aparición de fiebre entre la 2ª y 3ª semana de la intervención tiene que hacernos sospechar un síndrome postpericardiotomía.
Comunicación interauricular (CIA)
Se puede sospechar ante la presencia de un soplo sistólico en foco pulmonar y un desdoblamiento fijo del 2ºR.
Es una CC frecuente, aproximadamente un 7% de todas las CC. Es un defecto en el septo interauricular que permite el paso de sangre entre las dos aurículas. Las consecuencias hemodinámicas dependerán de la localización y tamaño del defecto y de la asociación con otros defectos.
Clasificación
• CIA ostium secundum: corresponde al 70% de todas las CIA, es más frecuente en mujeres y hay una recurrencia familiar del 7-10%. Se localiza en la región de la fosa oval en la parte central del septo. Se puede asociar a CIA seno venoso y también al prolapso de la válvula mitral.
• CIA seno venoso: 10% de las CIA. Puede ser tipo superior, que se localiza en el septo interauricular por debajo del orificio de la vena cava superior y que se asocia a drenaje venoso pulmonar anómalo parcial, o también puede ser inferior (cerca de la vena cava inferior).
• CIA ostium primum: localizada en la base del septo interauricular, por falta de unión del septum primum con los cojines endocárdicos. Casi siempre se asocia a anomalías en las válvulas AV.
Fisiopatología
El cortocircuito dependerá del tamaño del defecto, de las resistencias pulmonares y sistémicas y de la compliance (o capacidad de distensión) del VD. Si la CIA es pequeña, la presión en la aurícula izquierda (AI) es ligeramente superior a la de la derecha (AD) y hay un paso de sangre continuo de izqda.-dcha., mientras que si la CIA es grande las presiones en ambas aurículas son iguales y el grado de cortocircuito dependerá de la compliance del VD comparada con la del VI. De esta forma, se establece un flujo de sangre de AI-AD-VD-circulación pulmonar, y de nuevo AI, con el consiguiente aumento del flujo pulmonar.
Clínica
La CIA aislada no suele dar síntomas en la infancia y el diagnóstico suele hacerse por la presencia de un soplo o de un desdoblamiento fijo del 2R cardiaco.
Sin embargo, en los lactantes con una CIA grande, puede haber un retraso pondoestatural, bronquitis de repetición y síntomas de IC.
El soplo es eyectivo pulmonar debido al hiperaflujo pulmonar y no al paso a través de la CIA (dado que la velocidad a este nivel es baja), y se detectará en el 2º EII, sin frémito. Hay que diferenciarlo del soplo de la estenosis pulmonar válvular ligera-moderada, que suele ser más rudo y generalmente de mayor intensidad. Suele haber un desdoblamiento del 2R fijo, que no varia con la respiración. Si se ausculta un soplo sistólico apical, sospechar una insuficiencia mitral, que suele asociarse a la CIA ostium primum.
Diagnóstico
• ECG: puede ser normal en una CIA pequeña o presentar un retraso de la conducción del VD. Suele haber un patrón de rsR’ en V1 (bloqueo de rama derecha), típico de la sobrecarga de volumen del VD.
• Rx tórax: en la CIA grande se observa una cardiomegalia a expensas del borde derecho de la silueta cardiaca que corresponde a la aurícula derecha, también puede haber una prominencia del tronco de la arteria pulmonar y un aumento de la vascularización pulmonar (Fig. 3).

Figura 3. Niño de 10 años con CIA. Cardiomegalia con aumento del flujo pulmonar.
• Ecocardiograma-Doppler: es el método de elección para el diagnóstico. Nos da información anatómica (tamaño y localización) (Fig. 4), así como funcional (grado de dilatación del VD, movimiento septal y presión pulmonar). El plano subcostal es el más útil para el diagnóstico.

Figura 4. Eco-Doppler-color. CIA tipo ostium secundum.
Tratamiento
Puede haber un cierre espontáneo de la CIA si es inferior a 8 mm, con una tasa de cierre que puede llegar al 70-80% antes de los 18 meses. Si es más grande o persiste después de los 18 meses, difícilmente se cerrará.
Si se deja una CIA a su libre evolución podría dar lugar a HTP y taquiarritmias (fibrilación auricular) a partir de la 3ª década de la vida.
¿Cuándo estará indicado cerrar una CIA?
• Cuando hay un cortocircuito significativo con un QP/QS >1,5 entre los 3-5 años de edad.
• Niños con CIA y gran afectación hemodinámica se cerrarán antes de los 3 años.
Hay dos posibilidades de cierre: 1) quirúrgico, mediante una sutura del defecto o con un parche de pericardio, bajo circulación extracorpórea, o por cirugía mínimamente invasiva; y 2) mediante cateterismo cardiaco intervencionista colocando un dispositivo para su cierre.
Elección del método para cierre: la selección inicial será mediante el ecocardiograma, valorando si la CIA está centrada en el septo, el tamaño, y si tiene bordes adecuados para implantar el dispositivo, y en caso de dudas se realizará un eco transesofágico que dará información del tamaño de la aurícula izquierda, los bordes y localización exacta de la CIA.
El dispositivo más usado en la actualidad es el Amplatzer (Fig. 5), que consta de un doble disco de nitinol y dacrón unido por un disco central. Las ventajas de este método respecto a la cirugía son que: no precisa esternotomía, evita la circulación extracorpórea y reduce el tiempo de hospitalización y de interrupción de la actividad del niño.
En un estudio multicéntrico(12) de 29 centros de cardiología pediátrica, comparan a 442 pacientes con cierre percutáneo con dispositivo y 154 con cierre quirúrgico (con tamaño y características similares del defecto) y obtienen una tasa de cierre similar en ambos grupos, siendo la estancia hospitalaria, duración del procedimiento y las complicaciones (24% vs 7%), menores en el grupo del cierre percutáneo.

Figura 5. Amplatzer para el cierre de la CIA.
Revisión y control pediátrico
La prevención con palivizumab antes del cierre no estará indicada, excepto en los casos con gran afectación hemodinámica que precisan tratamiento médico antes de la corrección.
Posterior al cierre con dispositivo se precisa tratamiento antiagregante y profilaxis de endocarditis durante 6 meses.
Después de la cirugía hay que hacer un control pediátrico, aparte del cardiológico, para descartar complicaciones como una arritmia o el síndrome postpericardiectomía, que se caracteriza por dolor torácico con fiebre y puede acompañarse de derrame pericárdico y pleural.
Ductus (PDA)
Es patognomónico del PDA la auscultación de un soplo continuo en región infraclavicular izquierda y la palpación de unos pulsos saltones.
El ductus conecta el tronco de la arteria pulmonar con la aorta descendente por debajo de la arteria subclavia izquierda (Fig. 6). En vida fetal, es una conexión normal que lleva una gran parte de la sangre desde el VD a la aorta descendente, siendo solo un 10% del flujo que sale del VD el que se dirige al pulmón. En el período postnatal, ocurre el cierre del ductus, primero de forma funcional, con oclusión de la luz por protrusión de la íntima, y posteriormente el cierre definitivo, que suele ocurrir entre los 20-30 días de vida, que da lugar al ligamento arterioso. El término PDA se refiere a su persistencia más allá del periodo neonatal en RN a término. La incidencia es del 5-10% de todas la CC y es más frecuente en niñas.
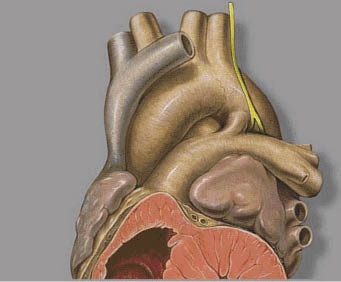
Figura 6. Anatomía del ductus.
Fisiopatología
Si el ductus es grande, cuando bajan las resistencias pulmonares, hay un cortocircuito de izquierda-derecha, en sístole y diástole, desde la aorta hacia la pulmonar, que provoca un hiperaflujo pulmonar con el consiguiente aumento de volumen y presión en aurícula izquierda y VI, que puede comportar una IC izquierda con edema pulmonar. En estos ductus grandes, puede ocurrir que el hiperaflujo pulmonar impida la regresión normal de la capa muscular de las arterias pulmonares y se desarrolle una HTP por enfermedad vascular pulmonar.
Clínica
Dependerá del tamaño del ductus y de la relación de resistencias pulmonares y sistémicas.
• Ductus pequeño (<3 mm): habrá un flujo restrictivo a través del ductus con un aumento del flujo pulmonar ligero. Se puede auscultar un soplo sistólico o continuo en el 2º EII, región infraclavicular izquierda, que suele aparecer cuando bajan las resistencias vasculares pulmonares. El niño suele estar asintomático y generalmente es derivado por soplo.
• Ductus moderado (entre 3-6 mm): debido a un cortocircuito izqda.-dcha. más importante, puede haber síntomas, como: taquipnea, dificultades de alimentación y retraso ponderal. Se ausculta un soplo sistólico o continuo sistólico-diastólico (soplo en maquinaria) en 2º EII y puede haber frémito. Los ruidos cardiacos están enmascarados por el soplo. Es importante la palpación de los pulsos, que son típicamente “saltones” debido a la presión arterial diferencial amplia, con diastólicas bajas debidas al robo hacia la arteria pulmonar.
• Ductus grande (>6 mm): los lactantes con gran cortocircuito presentan clínica de IC izquierda debida a la sobrecarga de cavidades izquierdas. El edema pulmonar condiciona: taquipnea, tiraje, dificultades de alimentación e infecciones respiratorias frecuentes. A la auscultación, no se detecta el soplo continuo, pero sí un soplo sistólico en foco pulmonar. Suele haber el precordio activo y los pulsos saltones con una TA diastólica baja.
Diagnóstico
• ECG: en el ductus grande hay un crecimiento del VI con ondas R prominentes, Q profundas y alteraciones de la repolarización. También, puede haber ondas P prominentes por dilatación de la aurícula izquierda.
• Rx tórax: se detecta una cardiomegalia a expensas del VI con hiperaflujo pulmonar y en los casos de ductus pequeño es normal.
• Ecocardiograma-Doppler: se puede detectar el flujo del ductus sistólico-diastólico desde la aorta a la arteria pulmonar (Fig. 7). También, se puede apreciar el tamaño y la repercusión sobre cavidades izquierdas (podemos medir la aurícula izquierda relacionada con la raíz Aº, siendo normal <1,3, y dilatación severa >2). Cuando el ductus es grande habrá un aumento del diámetro diastólico del VI y en la aorta se podrá ver una onda diastólica retrógrada (por robo diastólico). También, podremos valorar la presión en la arteria pulmonar midiendo el gradiente pico sistólico del flujo transductal.

Figura 7. Ecocardiograma-Doppler del ductus.
• El cateterismo se reserva para los casos en que se sospeche una HTP o previo al cateterismo intervencionista, para su cierre.
Tratamiento
El tratamiento del PDA sintomático será del cierre cuando se realice el diagnóstico. Si hay signos de IC, inicialmente se puede hacer tratamiento médico.
Se puede cerrar mediante cateterismo intervencionista con colocación de un dispositivo (coil o Amplatzer), que suele ser la técnica de elección en la mayor parte de los centros. En general, los coils se colocan en ductus pequeños (<4 mm) y los amplatzer en los de >4 mm. Las ventajas son: evitar la toracotomía y el tiempo de hospitalización. Las complicaciones son infrecuentes y pueden ser: la embolización del dispositivo, la hemólisis, la estenosis de la arteria pulmonar izquierda o la obstrucción aórtica por el amplatzer. El cierre quirúrgico se reserva para los pacientes por debajo de los 8 kg, con IC y ductus grandes.
En un trabajo del 2010 en Corea(13), valoran la clínica y evolución del cierre percutáneo del ductus en niños < de 10 kg. De un total de 115 casos con edad media de 8 m y peso medio de 7,8 kg, diámetro del ductus de 3 mm, consiguen una oclusión completa en el 98% de casos y solo 1 precisó cirugía. Concluyen que la técnica percutánea, realizada en centros con experiencia, es eficaz y segura en menores
de 10 kg.
Control por el pediatra
En el postoperatorio inmediato, hay que vigilar si aparece hematuria y en este caso descartar hemólisis. Habrá que hacer profilaxis de la endocarditis durante los 6 meses posteriores a su cierre. Se deben vigilar las zonas de la cicatriz quirúrgica, o de punción (como la pérdida de pulso o el hematoma).
Cardiopatías con obstrucción al flujo
Dentro de este grupo están las CC que cursan con obstrucción al flujo de salida ventricular, y de ellas las más frecuentes son: la EP, la Cº Aº y la EAº.
Clínicamente, se pueden presentar solo con la presencia de un soplo sistólico y sin síntomas, en los casos de estenosis ligeras. En los casos de obstrucción severa, pueden debutar en los primeros días de vida con ICC (EAº crítica) o con hipoxemia (EP crítica), que pueden precisar una actuación urgente para abrir la válvula.
Estenosis pulmonar (EP)
La valvuloplastia por catéter balón es la técnica de elección para el tratamiento de la EP.
Puede ser valvular en que hay una fusión de las comisuras de las valvas de la válvula pulmonar que provoca una obstrucción a la eyección del VD, en ocasiones hay una válvula displásica (frecuente en el síndrome de Noonan).
Supravalvular (ramas pulmonares) que se asocia al S. de Williams, Alagille, Noonan.
Subvalvular o infundibular que es la típica del Fallot o asociada a CIV grandes.
Vamos a estudiar la EP valvular, cuya prevalencia es del 8-12% de todas las CC y a veces se presenta de forma familiar.
Clínica
• EP ligera: cuando la obstrucción es leve, los niños están asintomáticos y se detecta por la aparición de un soplo sistólico de tono rudo en foco pulmonar, precedido de click. Suelen no progresar.
• EP moderada: pueden presentar síntomas como disnea o dolor torácico con esfuerzo. Suelen aumentar con la edad. También, se ausculta soplo sistólico de más intensidad y el 2P del 2ºR suele estar disminuido por la restricción de la movilidad valvular.
• EP severa: que cursa con síntomas y con HVD. La EP crítica del RN se presenta con cianosis, hipoxemia, acidosis y es una situación de emergencia, pues precisa de la administración de PGE1 para mantener el ductus abierto hasta la realización de una valvuloplastia.
Diagnóstico
• En el ECG puede haber una HVD.
• Rx tórax: prominencia del tronco de la arteria pulmonar por dilatación post-estenótica.
• Ecocardio-Doppler: sirve para valorar la válvula, el VD, la arteria pulmonar y los gradientes de presión a través de la válvula estenótica. Se clasifican las EP según los gradientes de Doppler, valorados según el gradiente pico o máximo: EP ligera: <40 mmHg; EP moderada: entre 40-60 mmHg; y EP severa: >60 mmHg (Fig. 8A).
• El cateterismo se reserva solo para los casos en que está indicada la dilatación (valvuloplastia).
Tratamiento
Se aconseja profilaxis de endocarditis infecciosa.
La indicación para la realización de una valvuloplastia con catéter balón (Fig. 8B) por cateterismo intervencionista será cuando el gradiente pico por Doppler sea superior a 60 mmHg.

Figura 8. AEP valvular. A) Ecocardiograma-Doppler (corte paraesternal transversal). B) Catéter de valvuloplastia.
Los resultados post-valvuloplastia son excelentes y la insuficiencia pulmonar secundaria suele ser leve y muy bien tolerada.
La valvulotomía quirúrgica estará indicada cuando hay una válvula pulmonar muy displásica (rígida y con irregularidades) o cuando hay hipoplasia del anillo.
Estenosis aórtica válvular (EAº)
Es importante la detección de una válvula bicúspide Aº, dado su carácter familiar y su evolución; ya que, en ocasiones, se acompaña de dilatación Aº y de insuficiencia Aº.
Es una malformación de la válvula aórtica que produce obstrucción a la salida del flujo del VI. Incidencia en la infancia del 3-6% de las CC. El riesgo de recurrencia es del 3% si el padre está afecto y si es la madre, del 15%. La causa más frecuente de EAº es la válvula bicúspide, que presenta unos velos aórticos desiguales provocados por la fusión o ausencia de una de las tres valvas y que a veces se presenta como una falsa comisura. Se estima que la bicúspide se podría presentar en un 1-2% de la población y que aproximadamente un 35% de ellos tienen algún miembro en la familia que la presenta, afectando más a los hombres (4:1). Se considera que la válvula aórtica bicúspide es una enfermedad de toda la aorta. La forma de presentación en los más jóvenes es la insuficiencia Aº. En estos casos, hay un riesgo especial de presentar endocarditis, por lo que se precisa de una adecuada profilaxis. También, se puede presentar con EAº y en adultos jóvenes con dilatación aórtica y riesgo de disección aórtica.
Es frecuente la asociación a más de un tipo de obstrucción izquierda, especialmente la CºAº, la E. subaórtica y las anomalías de la válvula mitral.
Fisiopatología
En la mayoría de casos de EA; el gasto cardiaco y la presión sistémica se mantienen por el aumento de presión sistólica del VI.
Puede haber una reducción relativa del flujo coronario debido a la hipertrofia del VI, hecho que puede ocasionar isquemia con el ejercicio.
Clínica
• EAº crítica del RN: puede ser severa y presentarse con ICC y shock cardiogénico en la 1ª semana de vida cuando se cierra el ductus, por la incapacidad del VI para mantener el gasto sistémico. Los pulsos son débiles en las cuatro extremidades.
• EAº del RN/lactante: se presenta con la aparición de un soplo sistólico rudo eyectivo en el borde paraesternal izquierdo y que irradia hacia el cuello, a veces se ausculta un click de apertura valvular. La función cardiaca está conservada y no tienen síntomas. Suele aumentar durante los primeros 6 meses, por lo que precisan controles muy periódicos.
• EAº del niño mayor: no suele presentar síntomas, aunque con gradientes importantes podrían presentar fatiga, dolor anginoso o síncope con el esfuerzo. La auscultación detecta el click y el soplo rudo, y en ocasiones se puede auscultar un soplo diastólico de insuficiencia Aº. Puede detectarse un frémito en región supraesternal. Es importante diagnosticar una bicúspide Aº, dado su carácter familiar y la tendencia a presentar insuficiencia Aº y dilatación de la raíz Aº.
Diagnóstico
• ECG: en los casos leves es normal. Cuando hay una obstrucción más severa, puede haber hipertrofia VI y trastornos de repolarización (con alteraciones de la onda T y ST).
• Ecocardiograma-Doppler: se puede valorar la morfología de la válvula, valorar el grado de severidad y la presencia de insuficiencia aórtica (Fig. 9).
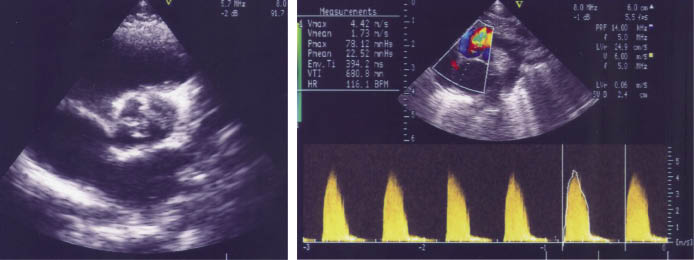
Figura 9. EAº severa. Eco-Doppler-color. A) Corte paraesternal transversal: válvula Aº engrosada. B) Corte supraesternal: aceleración del flujo Aº con gradiente máximo de 78 mmHg.
Con el Doppler se puede valorar el gradiente máximo y medio de presión transvalvular y con ello clasificar las estenosis:
– EAº ligera: gradiente máximo <40 mmHg y gradiente medio <20 mmHg.
– EAº moderada: gradiente máximo entre 40-60 mmHg y medio 25-40 mmHg.
– EAº severa: > a 60 mmHg medio >45 mmHg.
• Prueba de esfuerzo: puede estar indicada en la EAº de grado moderado, en jóvenes que quieren hacer ejercicio y están asintomáticos, para valorar si se presenta hipotensión o signos de isquemia durante el ejercicio.
• Cateterismo: se hace previamente a la valvuloplastia. Hay una buena correlación entre el gradiente por cateterismo y el gradiente medio estimado por Doppler.
Tratamiento
La profilaxis de la endocarditis es importante, aunque la EAº sea de grado ligero.
En las EAº leves a moderadas, se hace un tratamiento conservador con seguimiento ecocardiográfico.
En EAº de grado moderado, se hace un seguimiento para valorar la progresión de la EAº o la aparición de insuficiencia Aº o de una hipertrofia del VI. No se aconsejan deportes de competición, aunque pueden hacer actividades de carácter recreativo. Se podría hacer una prueba de esfuerzo para valorar el riesgo.
Indicaciones de la valvuloplastia percutánea
Es el procedimiento de elección en la mayoría de casos cuando hay una EAº severa (gradiente pico >60 mmHg), con resultados similares a la valvulotomía quirúrgica. Hay muchos estudios sobre la seguridad y efectividad de la valvuloplastia en los lactantes, lo importante es conseguir dilatar la válvula sin provocar una insuficiencia aórtica significativa.
En la EAº crítica del RN se debe iniciar tratamiento con PGE1 para mantener el ductus abierto, corrección de la acidosis metabólica y, si hay disfunción miocárdica, dar inotrópicos (dopamina, adrenalina); después, se procederá a la valvuloplastia aórtica.
Es interesante el trabajo de Reich y cols.(14) en el que hace un seguimiento (14,8 años) de 269 casos de EAº tratados con valvuloplastia, edad media 8 meses (30% < de 1 mes, 22% entre 1 mes y 1 año y 48% > 1 año) y detecta una IAº en el 22%, mortalidad 10,4%, reestenosis 16,7% y necesidad de cirugía en el 20,1%. En su experiencia, detecta unos predictores de riesgo independientes, que son el anillo aórtico pequeño, la válvula aórtica bicúspide y la disfunción del VI.
Valvulotomía quirúrgica
Estaría indicada en pacientes que precisan agrandamiento del anillo Aº, resección sub-Aº o supra-Aº, o que tienen un VI pequeño.
Recambio valvular
Se hace en los casos en que no ha tenido éxito la valvuloplastia o la valvulotomía, y tienen una EAº severa o hay una insuficiencia Aº significativa, asociadas a una dilatación del VI o deterioro de la función sistólica.
Evolución
En el trabajo de Eroglu y cols.(15), valoran la evolución de la EAº en 192 niños, de edades entre 3 días y 15 años (media 4,9 +/- 4,3), 48% de los cuales tenían bicúspide Aº, y detecta que en el seguimiento de 5 años, 70 casos con EAº ligera, el 28% evoluciona a moderada y el 9% a severa; en los 44 casos de EAº moderada seguidos 3,7 años, un 36% evoluciona a EAº severa, con lo cual recomienda una evaluación cada 6 m.
Control por el pediatra
Conjuntamente con el cardiólogo. Se derivará para valoración en el caso de síntomas de nueva aparición, como un síncope, una arritmia o un dolor torácico.
Coartación aórtica (CºAº)
Es importante la palpación del pulso femoral al mismo tiempo que el axilar, para poder detectar precozmente una CºAº neonatal y en las primeras semanas de vida.
La CºAº es una obstrucción de la Aº descendente en la confluencia del istmo aórtico y el ductus que causa una obstrucción al flujo aórtico. También, en ocasiones se acompaña de un segmento hipoplásico.
Suele estar provocada por una hipertrofia de la capa media en la zona posterior de la aorta, que protuye hacia la luz. Se denomina yuxtaductal por estar en la zona del cierre del ductus.
La incidencia es del 6-8% de todas las CC, y es 2 veces más frecuente en el sexo masculino que en el femenino. Es frecuente en el S. de Turner. Se asocia con la válvula aórtica bicúspide (30-40%), y con otras CC como la CIV, ductus, la E. subaórtica y la estenosis mitral.
Clínica y formas de presentación
En vida fetal la circulación a la Aº descendente se realiza desde el ductus y, por tanto, la CºAº no dará alteración hemodinámica hasta después del nacimiento, cuando se cierra el ductus. Hay tres formas de presentación:
a. CºAº neonatal: suele ser severa, puede asociarse a una hipoplasia del istmo Aº y un gran ductus con flujo de derecha a izquierda hacia la Aº descendente. Cuando el ductus se hace restrictivo, el RN puede presentar signos de shock, oliguria, acidosis y distrés respiratorio, pueden no palparse los pulsos o haber asimetría entre los axilares y femorales. Es importante palpar al mismo tiempo el pulso femoral y el axilar. Hay que tener en cuenta que en el RN si el ductus es permeable podría no existir una aceleración de flujo significativa y por tanto no haber diferencia de pulsos en las extremidades.
b. CºAº de presentación a partir de las 3 semanas de vida: suele deberse a la obstrucción aórtica que se genera después del cierre ductal, con crecimiento de tejido ductal hacia la luz Aº. Habrá una diferencia de pulsos y TA entre los miembros superior e inferior, signos de IC con: palidez, mala perfusión, ritmo galope y hepatomegalia. Habrá que hacer el diagnóstico diferencial con sepsis o bronquiolitis.
c. CºAº del niño mayor: suelen ser niños o adolescentes asintomáticos cuyo motivo de consulta ha sido un soplo sistólico o una HTA. A la exploración, hay una asimetría de pulsos y la HTA es en ambos brazos, aunque si la subclavia izquierda es distal a la CºAº, la HTA será solo en el brazo derecho. Una diferencia >20 mmHg es significativa. El soplo sistólico se ausculta en 2º-3º EII y en el área interescapular.
Diagnóstico
• ECG: en el RN y lactante con CºAº severa se aprecia una HVD, y en niños mayores puede ser N o HVI.
• Rx tórax: lactantes con CºAº severa y IC se aprecia una cardiomegalia con congestión venosa pulmonar.
• Ecocardio-Doppler: diagnostica la zona coartada y la severidad. Valora la hipoplasia del istmo y con el Doppler continuo se puede valorar la aceleración del flujo en la zona coartada y calcular el gradiente a través de la CºAº . Las obstrucciones severas muestran un patrón de flujo característico con prolongación diastólica.
• Angio RMN: es recomendable cuando la imagen ecocardiográfica no es concluyente para definir la aorta en todo su trayecto. Permite valorar la localización, la severidad y también permite hacer una reconstrucción tridimensional (Fig. 10).

Figura 10. Coartación aórtica. Angio-RMN.
• Angio-TAC: de alta calidad, puede obtener las imágenes con menos tiempo, pero con irradiación.
Tratamiento
• En los RN y lactantes <3 meses con CºAº severa, se hará tratamiento médico para estabilizar al paciente. En los RN, se administrará PGE1 para mantener el ductus abierto, agentes inotrópicos y corrección de la acidosis. Una vez estabilizado el niño, se recomienda la cirugía (coartectomía con resección del tejido ductal y anastomosis término-terminal). La angioplastia a través de cateterismo intervencionista (angioplastia con catéter-balón) debe considerarse en los casos de pacientes críticos con IC debida a disfunción ventricular severa como puente para el tratamiento quirúrgico(16).
En la angioplastia, se coloca el catéter balón en la zona coartada y se hincha, lo que provoca una ruptura de la capa íntima y media aórtica con posterior cicatrización.
Aunque hay controversia, la mayoría de autores recomiendan la cirugía en la CºAº nativa (ya que es más elevada la aparición de aneurismas y recoartaciones después de la dilatación por catéter, especialmente en lactantes menores de 3 meses)(17).
• En los lactantes y niños entre los 4 meses y 5 años, la reparación se hará con cirugía o angioplastia según la experiencia del centro, la morfología de la CºAº y la presencia de lesiones asociadas. La angioplastia podría ser adecuada si la lesión es discreta y no hay hipoplasia del arco aórtico.
• En niños mayores asintomáticos, la indicación para la reparación incluye: 1) HTA en reposo o inducida por el ejercicio; y 2) gradiente a través de la CºAº >20 mmHg.
La angioplastia primaria es un método útil y seguro para el tratamiento de la CºAº en niños mayores con lesiones circunscritas, así también en los casos de recoartación post-cirugía.
La colocación de un “stent” después de la angioplastia en la CºAº nativa o en la recoartación funciona como refuerzo endovascular para dar soporte al segmento Aº dilatado. El stent disminuye la estenosis y puede disminuir la incidencia de aneurisma. No se aconseja en niños de menos de 25 kg.
Control por el pediatra
Es importante el control periódico en el RN y lactante intervenido de CºAº, especialmente buscando la asimetría de los pulsos, así como el control de la TA, para poder detectar una posible recoartación. También, en RN y lactante que presente lesiones residuales o recoartación, conviene hacer un control pondoestatural exhaustivo, así como profilaxis de las infecciones respiratorias.
Cardiopatías con cianosis
Tetralogía de Fallot
La cirugía reparadora electiva en el lactante con Fallot se hace actualmente en los 6 primeros meses de vida.
La descripción anatómica de la tetralogía de Fallot incluye: 1) estenosis pulmonar; 2) CIV; 3) cabalgamiento aórtico; y 4) HVD (Fig. 11).

Figura 11. Esquema de tetralogía de Fallot.
La obstrucción del tracto de salida pulmonar puede ser a varios niveles, infundibular (50-75%), válvular (10%) y ramas pulmonares hipoplásicas (50%). La CIV suele ser grande y subaórtica, siendo la aorta la que cabalga sobre ella. Hay un 25% de casos que tienen arco Aº derecho. También son frecuentes las anomalías coronarias.
Se asocia al síndrome de DiGeorge y a la trisomía 21. Corresponde a un 10% de todas las CC.
Fisiopatología
Las consecuencias hemodinámicas dependen del grado de obstrucción pulmonar. Así, si hay una EP leve, el flujo de sangre irá de izquierda-derecha a través de la CIV; mientras que, si hay una obstrucción importante a la salida del flujo pulmonar, habrá un flujo predominante de dcha.-izqda. a través de la CIV, que dará lugar a cianosis.
Clínica
Si la obstrucción pulmonar es severa y el flujo pulmonar disminuido se presentará en el RN con cianosis severa.
Si la obstrucción es moderada y el flujo sistémico y pulmonar equilibrado, se presentará con un soplo sistólico de EP en el borde paraesternal alto y, si aumenta la obstrucción, el soplo llega a desaparecer. En ocasiones, hay un espasmo del infundíbulo pulmonar, que puede presentarse clínicamente en forma de crisis hipóxicas, que se caracterizan por episodios bruscos de cianosis intensa con hiperventilación y suelen acompañarse de irritabilidad y llanto que puede acabar en apnea o pérdida de conocimiento. Se suelen dar en el lactante cianótico y de los 2 a los 4 meses de vida. Son más frecuentes a primera hora de la mañana y se pueden desencadenar con el llanto, la defecación o durante las comidas.
Si hay una obstrucción mínima pulmonar, se puede presentar con cierto hiperaflujo pulmonar por flujo de izqda.-dcha (Fallot rosado).
Diagnóstico
• ECG: se detecta una HVD, con R prominentes y T+ en V1.
• Rx tórax: la forma clásica del corazón es la de forma de “zueco” por una zona cóncava a nivel del tronco de la arteria pulmonar. No hay cardiomegalia y el flujo pulmonar es normal o disminuido.
• Ecocardio-Doppler: localiza la CIV y el cabalgamiento aórtico, grado de severidad de la estenosis del tracto de salida del VD (del anillo y el tamaño de las ramas), el arco Aº y las anomalías asociadas (Fig. 12).
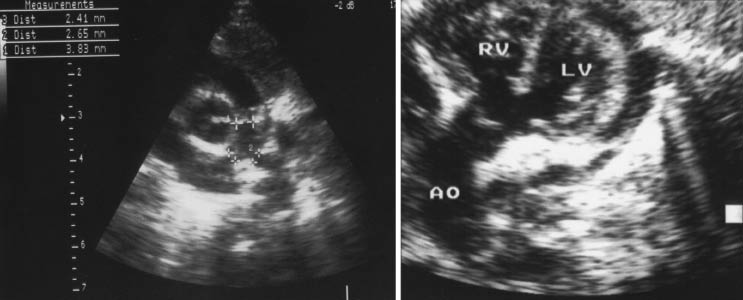
Figura 12. Ecocardiograma. A) Corte paraesternal transversal en que se aprecia el tronco de la arteria pulmonar y ramas hipoplásicas. B) Corte subcostal en que se aprecia el cabalgamiento Aº sobre la CIV.
• Cateterismo cardiaco: es útil para identificar la anatomía coronaria y las características periféricas del árbol pulmonar.
Tratamiento
En RN con cianosis severa, se requiere la administración de PGE1 para mantener el ductus abierto hasta realizar el tratamiento adecuado.
Las crisis hipóxicas se tratarán cogiendo al lactante en brazos y doblando las rodillas hacia el pecho para aumentar la resistencia vascular periférica, oxígeno nasal, sedación con morfina IV y bolus de líquidos para mejorar el llenado del VD y flujo pulmonar. Se pueden dar beta-bloqueantes (propranolol) que puede relajar el tracto de salida del VD que mejoraría el flujo pulmonar. Como tratamiento profiláctico, se recomienda propranolol oral a dosis de 1-3 mg/kg/día.
Ante la aparición de crisis hipóxicas, está indicada la cirugía paliativa (fístula sistémico pulmonar) o reparadora si tiene buena anatomía.
Cirugía: la elección del procedimiento quirúrgico se realizará según la presentación clínica del paciente:
a. Procedimiento paliativo: con una fístula sistémico pulmonar de “Blalock-Taussig” que consiste en una conexión entre la arteria subclavia y la arteria pulmonar mediante un conducto de goretex. Estaría indicada en los casos de RN con hipoplasia severa de la arteria pulmonar y ramas para favorecer el crecimiento de las ramas, en prematuros y también en algunos casos de coronaria anómala. Posteriormente, se realiza la reparación completa.
b. Cirugía correctora: actualmente la mayoría de grupos tienden a realizar la reparación completa a los 3-6 meses de edad. La corrección va dirigida a aliviar la obstrucción del tracto de salida del VD en todos sus niveles. Si la anatomía es posible, se intenta evitar el parche transanular para preservar la función de la válvula pulmonar. En el caso de que no se pueda, se hará la corrección mediante un parche transanular que amplía el tracto de salida del VD y libera la EP.
Reintervenciones tardías: algunos casos de Fallot deben ser intervenidos por lesiones residuales, la más frecuente es la insuficiencia pulmonar severa con disfunción del VD. Con el tiempo, estos pacientes van a precisar un recambio de la válvula pulmonar.
Control por el pediatra
• Si el lactante tiene una fístula sistémico pulmonar estará indicado el tratamiento antiagregante con ácido acetilsalicílico (7 mg/kg/día).
• Hacer un control estrecho de los lactantes con cianosis ante el riesgo de presentar una crisis hipóxica.
• Remitir al cardiólogo si un niño intervenido de Fallot presenta arritmia, o disnea o IC derecha de nueva aparición.
• Los casos de Fallot intervenidos pueden participar en todos los deportes, si no presentan “shunt” residual, no presentan taquiarritmia auricular o ventricular en una prueba de esfuerzo o holter y tengan la presión en corazón derecho normal. Cuando hay una sobrecarga de volumen del VD con insuficiencia pulmonar importante o hay una arritmia auricular o ventricular deberían hacer solo deporte recreativo.
Comentarios generales a pediatras
Los pediatras asumirán la responsabilidad junto a los cardiólogos pediátricos de dar a los pacientes con cardiopatía una atención global, teniendo en cuenta:
• La alimentación que sea flexible en el horario y las tomas, ya que a veces el lactante con IC ingiere poca cantidad y precisará fraccionar las tomas y darlas más frecuentemente, con aportaciones calóricas añadidas. También, se puede dar la alimentación con cuchara que tolerará mejor.
• Prestar especial atención a la inmunización (gripe, neumococo, varicela), así como frente al VRS con gammaglobulina (palivizumab), cuando esté indicado. Su uso es hospitalario y las recomendaciones para la prevención en pacientes con CC las encontramos en la web de la SECP(18).
• Control frecuente del desarrollo pondoestatural, dado que estos niños con IC y dificultades de alimentación presentan frecuentemente retraso de peso y talla.
• Prestar especial atención a las infecciones respiratorias, ya que pueden descompensar al niño con IC.
• Tener en cuenta que el lactante con anemia tolera peor su cardiopatía.
• Apoyo psicológico: cuando se diagnostica una cardiopatía, los padres suelen cambiar su trato hacia el niño y lactante generalmente dándoles sobreprotección. Es importante la ayuda del pediatra para aconsejarles.
• Cuidados postoperatorios respecto al cuidado de las cicatrices y también estar alerta por si aparecen fiebre, dolor torácico o arritmias(19).
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Pierpont ME, Basson CT, Benson DW, et al. Genetic Basis for congenital heart defects: current knowledge: A scientific statement from the American Heart Association Congenital cardiac Defects Committee, Council on Cardiovascular Disease in the young: endorsed by the American Academy of Pediatrics. Circulation. 2007; 115: 3015-38.
2.* Gill HK, Splitt M, Sharland GK, Simpson JM. Patterns of recurrence of congenital heart disease. an analysis of 6,640 consecutive pregnancies evaluated by detailed fetal echocardiography J Am Coll Cardiol. 2003; 42: 923-9.
3.** Jenkins KJ, Correa A, Feinstein JA, et al. Noninherited risk factors and congenital cardiovascular defects: current knowledge: a scientific statement from the American Heart Association Congenital Cardiac Defects Committee, Council on Cardiovascular Disease in the young: endorsed by the American Academy of Pediatrics. Circulation. 2007; 115: 2995-3014.
4.* Villanueva Orbáiz R, Arráez Aviar LA. Epidemiología de las malformaciones congénitas y de sus factores de riesgo. Pediátrica. 2006; 26(9): 308-15.
5.* Martínez Olorón P, Romero Ibarra C, Alzina de Aguilar V. Incidencia de las cardiopatías congénitas en Navarra (1989-1998). Rev Esp Cardiol. 2005; 58(12): 1428-34.
6.* Myung Park. Pediatric Cardiology for Practitioners. Capítulo 9: Fisiología de las lesiones con shunts izquierda-derecha. Capítulo 11: Defectos congénitos cianosantes. 5ª edición. 2008.
7.** McDaniel NL, Gutgesell HP. Ventricular septal defects. En: AllenHD, Driscol DJ, Shaddy RE, Feltes TF, eds. Moss and Adams Heart Disease in Infants, children, and Adolescents. 7 ed Philadelphia: Lippincott Williams & Wilkins; 2008. p. 669-83.
8.* Gabriel HM, Heger M, Innerhofer P, et al. Long-term outcome of patients with ventricular septal defect considered not to require surgical closure during childhood. J Am Coll Cardiol. 2002; 39(6): 1066-71.
9.* Kleinman CS, Tabibian M, Starc TJ, et al. Spontaneous regression of left ventricular dilation in children with restrictive ventricular septal defects. J Pediatr. 2007; 150: 583-6.
10.** Insa AB, Malo CP. Protocolos en Cardiología Pediátrica. Capítulo 18 (CIV). Sociedad Española de Cardiología Pediátrica y CC; 2010.
11.** Muñoz R, Da Cruz E, Palacio G, Maroto C. Cuidados Críticos en Cardiopatías congénitas o adquiridas. 2008.
12.** Du ZD, Hijazi ZM, Kleinman CS, et al. Comparison between transcatheter and surgical closure of secundum atrial septal defect in children and adults: results of a multicenter nonrandomized trial. J Am Coll Cardiol. 2002; 39(11): 1836-44.
13.** Park YA, Kim NK, Park SJ, Yun BS, Choi JY, Sul JH. Clinical outcome of transcatheter closure of patent ductus arteriosus in small children weighing 10 kg or less. Korean J Pediatr. 2010; 53(12): 1012-7.
14.** Reich O, Tax P, Marek J, et al. Long term results of percutaneous balloon valvoplasty of congenital aortic stenosis: independent predictors of outcome. Heart. 2004; 90(1): 5-6.
15.*** Eroglu AG, Babauglu K, Saltik L et al. Echocardiographic follow-up of congenital aortic valvular stenosis. Pediatr Cardiol. 2006; 27(6): 713-9.
16.*** Feltes T, Bacha E, Beekman III RH, et al. Indications for cardiac catheterization and intervention in pediatric cardiac disease. A scientific statement from the American Heart Association. Circulation. 2011; 123: 2607-52.
17.** Solana Gracia R, García Guereta L. Protocolos en Cardiología Pediátrica. Capítulo 22 (Coartación aórtica + IAAº). Sociedad Española de Cardiología Pediátrica y CC; 2010.
18.*** Web de la Sociedad Española de Cardiología Pediátrica (SECP): http://www.secardioped.org
19.*** Picazo Angelin B. Protocolos en Cardiología Pediátrica. Capítulo 10 (Inmunizaciones y seguimiento pediátrico del lactante con CC). Sociedad Española de Cardiología Pediátrica y CC; 2010.
Bibliografía recomendada
– Jenkins KJ, Correa A, Feinstein JA, et al. Noninherited risk factors and congenital cardiovascular defects: current knowledge: a scientific statement from the American Heart Association Congenital cardiac Defects Committee, Council on Cardiovascular Disease in the young: endorsed by the American Academy of Pediatrics. Circulation. 2007; 115: 2995-3014.
Es una puesta al día de los principales factores de riesgo no hereditarios, de padecer una cardiopatía congénita, como los agentes tóxicos, las drogas y las enfermedades maternas, como la diabetes, el sida, etc.
– Muñoz R, Da Cruz E, Palacio G, Maroto C. Cuidados Críticos en Cardiopatías congénitas o adquiridas. 2008.
Puesta al día del manejo de las principales cardiopatías valorando tanto los aspectos médicos más novedosos, como los quirúrgicos. También, es útil la revisión del ecocardiograma en la UCI pediátrica.
– Pierpont ME, Basson CT, Benson DW, et al. Genetic Basis for congenital heart defects: current knowledge: A scientific statement from the American Heart Association Congenital cardiac Defects Committee, Council on Cardiovascular Disease in the young: endorsed by the American Academy of Pediatrics. Circulation. 2007; 115: 3015-38.
Interesante estudio sobre las bases genéticas de las cardiopatías, donde se puede encontrar un algoritmo de su asociación a cromosomopatías y por otro lado un algoritmo extenso y práctico sobre las causas genéticas, asociaciones y características clínicas de las principales cardiopatías.
– Eroglu AG, Babauglu K, Saltik L, et al. Echocardiographic follow-up of congenital aortic valvular stenosis. Pediatr Cardiol. 2006; 27(6): 713-9.
Muy interesante este trabajo sobre la evolución de 278 casos con estenosis aórtica valvular en niños.
– Protocolos en Cardiología Pediátrica. Sociedad Española de Cardiología Pediátrica y CC; 2010.
En la web de la SECP (http://www.secardioped.org) se puede encontrar una actualización de las diversas cardiopatías y de los temas más frecuentes relacionados con la atención del niño con cardiopatía.
| Caso clínico |
|
Lactante de 3 meses que acude al pediatra por tos de 3 días de evolución y rechazo del alimento. No refiere fiebre. Antecedentes RN a término con peso adecuado para la edad gestacional (3.100 g). No antecedentes valorables durante el embarazo ni familiares de cardiopatía. Ha presentado 2 episodios de bronquiolitis tratados con broncodilatadores que no precisaron ingreso hospitalario. Anamnesis La madre refiere que desde que tenía 1 mes de vida le nota la respiración rápida, que suda y para de mamar varias veces durante la toma. Exploración Retraso ponderal (peso actual: 3.900 g). FR: 60/m, FC: 160/m, TA: 80/50 (brazo dcho.), TA: 75/ 40 (pierna dcha.), pulsos femorales saltones, hepatomegalia: 2 cm. AC: soplo sistólico-diastólico en 2º-3º EII. Auscultación pulmonar: sibilantes discretos en ambos campos pulmonares. Pruebas complementarias RX tórax (Fig. 13). ECG: ritmo sinusal a F 150/m sin arritmias. Ondas P prominentes en D2-D3-VF. Patrón de QRS con ondas RS amplios desde V3 a V6 y en derivaciones inferiores predominio de R amplias. |
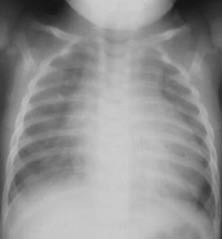
Figura 13.
|

