 |
| Temas de FC |
A.L. Luis Huertas*, R. Espinosa Góngora*, M.T. Muñoz Calvo**
*Servicio de Cirugía Pediátrica. Hospital Infantil Universitario Niño Jesús. Madrid
**Servicio de Endocrinología. Hospital Infantil Universitario Niño Jesús. Profesora Asociada de Pediatría. Universidad Autónoma. Madrid
| Resumen
Es la malformación congénita más frecuente que afecta a los genitales externos en el varón. El descenso testicular se puede completar durante los seis primeros meses en los nacidos a término y se puede retrasar hasta los 12 meses en los prematuros. El bajo peso al nacer, ser pequeño para la edad gestacional y la prematuridad influyen en el desarrollo de la criptorquidia no sindrómica. El objetivo del tratamiento de los testículos no descendidos es la colocación del testículo en su posición escrotal normal con el objetivo de disminuir el riesgo de secuelas y complicaciones futuras, como: infertilidad, torsión, traumatismos o cáncer testicular. Aunque no existe un consenso definitivo en cuanto a la edad exacta de tratamiento, siempre se recomienda antes de los 2 años de edad. La técnica estándar para el tratamiento del teste palpable es la funiculolisis y orquidopexia, por vía inguinal. Los pacientes con testículos retráctiles deben seguirse mediante exploración anual o bianual, hasta descartar de forma definitiva la situación de maldescenso testicular |
| Abstract
Cryptorchidism is the most common congenital malformation affecting the external genitalia in male infants. The testicular descent may occur after birth and should be completed by the age of six months in term neonates and up until twelve months in premature infants. Prematurity and low weight at birth, are two factors which affect the presence of non-syndromic cryptorchidism. |
Palabras clave: Testículo; Tratamiento, Fertilidad; Orquidopexia.
Key words: Testis; Treatment; Fertility; Orchidopexy.
Pediatr Integral 2014; XVIII(10): 718-728
Patología del descenso testicular
Concepto
Es la ausencia de al menos uno de los testículos en el escroto. Puede ser unilateral (85% de los casos, más frecuente el derecho, ya que es el último en descender) o bilateral.
Es la malformación congénita más frecuente que afecta a los genitales externos en el varón, observándose en un 3-9% de los varones nacidos a término y en más del 30% de los nacidos pretérmino.
El descenso testicular se puede completar durante los seis primeros meses en los nacidos a término y se puede retrasar hasta los 12 meses en los prematuros(1).
La criptorquidia puede aparecer aislada o asociada a otras anomalías congénitas, o ser, un signo de endocrinopatías, alteraciones cromosómicas o alteraciones del desarrollo sexual. Se incluye dentro del llamado síndrome de disgenesia testicular, que englobaría también a: hipospadias, infertilidad y cáncer testicular, asociados a una alteración del desarrollo embrionario de las células germinales, de Leydig y de Sertoli.
Clasificación
Se considera que hasta el 40% de los testículos criptorquídicos al nacimiento bajan espontáneamente, reascienden y pueden requerir tratamiento quirúrgico(2). Hay que realizar el seguimiento de estos pacientes hasta los 5-10 años.
• Testículos no descendidos congénitos: se encuentran fuera de la bolsa escrotal desde el nacimiento, y pueden ser palpables a lo largo del trayecto normal de descenso, pero no se pueden desplazar hacia el escroto o si podemos, vuelve a reascender de inmediato.
• Testículo ausente (anorquia): cuando no es posible encontrar la gónada tras las pruebas complementarias y la cirugía.
• Testículo ectópico: se encuentra fuera del trayecto normal del descenso.
• Testículos no descendidos adquiridos: han descendido en el primer año de vida y posteriormente reascienden. Se debe, en la mayoría de los casos, a la falta de crecimiento del cordón espermático, que permanece corto en relación con el crecimiento del niño y retrae el testículo.
• Testículo retráctil: permanece en el conducto inguinal y, de manera espontánea o con maniobras manuales, desciende con facilidad al escroto. En la mayoría de los casos, se debe a un reflejo cremastérico exagerado. Cuando llega la pubertad, el testículo permanece en su situación normal. No es subsidiario de tratamiento y solo requieren seguimiento por tener mayor riesgo de ascenso.
Etiopatogenia
Formación testicular en la vida fetal
La gónada indiferenciada comienza a desarrollarse durante la 7ª semana de edad gestacional. La diferenciación testicular precisa de la presencia del gen SRY (brazo corto del cromosoma Y) y de la activación del gen SOX9. La diferenciación de los genitales externos y del seno urogenital se produce por la acción de la dihidrotestosterona (DHT), resultante de la reducción intracelular de la testosterona por la 5-a reductasa tipo 2. DHT y testosterona actúan sobre el mismo receptor de andrógenos, pero la DHT posee una mayor potencia androgénica.
Descenso testicular
Fase transabdominal
Los testículos se deslizan por la cavidad abdominal hasta situarse junto al orificio inguinal interno, hacia la semana 15 de gestación. Esta fase está regulada por INSL3 (insuline-like 3), que es un marcador sensible de la diferenciación y función de las células de Leydig, encargado de masculinizar el gubernaculum testis para el descenso testicular.
Fase inguino-escrotal
A partir de la 28ª semana de gestación, el testículo que se encuentra en la entrada del canal inguinal, es guiado por el gubernaculum testis hasta el escroto, situación que alcanza en la semana 35. Esta fase depende de la producción y acción androgénica normal, que actúa a través de su receptor. Las mutaciones en el receptor de andrógenos producen alteraciones en el desarrollo de los genitales internos y externos. En el síndrome de insensibilidad parcial a los andrógenos, se ha encontrado asociación con criptorquidia.
Testículo postnatal
Durante los 6 primeros meses de vida postnatal, se produce una elevación transitoria de las gonadotropinas que estimulan las células de Leydig, produciendo un incremento de los niveles de testosterona. Asimismo, se produce un aumento de los niveles séricos de inhibina B y de hormona antimülleriana (AMH), secretadas por las células de Sertoli.
Causas genéticas
La criptorquidia puede estar relacionada con diferentes alteraciones cromosómicas, como: el síndrome de Klinefelter o las alteraciones estructurales del cromosoma Y.
Se han descrito síndromes, en los que la criptorquidia constituye un rasgo clínico: síndrome de Noonan, Prader-Willi y Beckwith-Wiederman, entre otros.
Las mutaciones en el gen INSL-3 y en su receptor RXFP2 (relaxine/insuline-like family peptide receptor 2) se asocian a criptorquidia. Otros genes candidatos son: el del receptor de andrógenos (AR) y el del receptor alfa de los estrógenos (ESR1).
Factores ambientales
La prematuridad, el bajo peso al nacer y el ser pequeño para la edad gestacional influyen en el desarrollo de la criptorquidia no sindrómica.
La mayor incidencia se debería al mayor contacto con sustancias químicas con propiedades estrogénicas, que son capaces de interferir en la síntesis o en la acción de los andrógenos, son los llamados disruptores endocrinos, que incluyen: pesticidas, filatos y talatos (constituyente de algunos plásticos)(3).
Factores maternos
El consumo de analgésicos maternos de manera prolongada durante el 1º-2º trimestre de la gestación aumenta el riesgo de criptorquidia.
Diagnóstico
Anamnesis
• Antecedentes familiares de criptorquidia u otras alteraciones relacionadas (trastornos de la olfacción e hipospadias, entre otros).
• Antecedentes obstétricos: edad gestacional, peso al nacimiento, ingesta o contacto con fármacos antiandrogénicos.
• Preguntar sobre el momento desde que apreciaron la falta del testículo de la bolsa, y de si fue uni o bilateral.
Exploración física
Se debe realizar la exploración en un ambiente cálido. El paciente debe estar en decúbito supino, con las piernas flexionadas y en abducción completa. En caso de duda, se puede explorar en posición de “cuclillas” o bien realizar la exploración de Taylor (niño sentado con las piernas cruzadas).
Se debe valorar:
• Si el testículo está en el canal inguinal.
• Si existe asimetría o hipoplasia de escroto.
• El tamaño, la consistencia y la movilidad del testículo.
• La palpación de la zona inguino-escrotal: se deslizarán los dedos a lo largo del canal inguinal hasta la base del escroto para detectar el testículo. Se debe registrar en la exploración: la localización, el volumen y la consistencia del mismo.
Estudios hormonales
Ante la presencia de criptorquidia unilateral asociada a otras anomalías, criptorquidia bilateral o ausencia de testículos palpables, se debe descartar un trastorno de la diferenciación sexual, debiendo realizar los siguientes estudios hormonales:
• Cariotipo.
• Gonadotropinas y testosterona basales: antes de los seis meses de edad.
• Inhibina B y AMH: son marcadores de integridad de las células de Sertoli, y se pueden detectar durante el periodo prepuberal.
• Estímulo con HCG (hormona gonadotropina coriónica de efecto similar a la LH, estimulando la secreción de testosterona). Existen diferentes protocolos, siendo los más aceptados aquellos que administran tres dosis de HCG a días alternos de: 500 UI de HCG en menores de dos años, 1000 UI entre los dos y los cuatro años, 1500 UI hasta los 12 años y 2500 UI a partir de esta edad). Se considera una respuesta normal, unos valores de testosterona tras el estímulo de 1-1,5 ng/mL. Esta prueba tiene un valor predictivo positivo del 89% y negativo del 100%; por lo que, su negatividad es diagnóstica de anorquia, y su positividad sugiere la presencia de testículo de tamaño suficiente para intentar la orquidopexia. Actualmente, no disponemos de HCG en nuestro país, pero se puede solicitar por medicación extranjera.
Pruebas de imagen
Ecografía: permite visualizar la presencia de testículos en la zona inguino-escrotal. Presenta una sensibilidad del 96% y una especificidad del 100%.
Resonancia magnética: es de utilidad en los testículos intraabdominales, con el inconveniente de precisar la sedación en el niño y el alto coste. La angioresonancia se considera la prueba de elección en los pacientes que la ecografía preoperatoria no ha sido capaz de localizar el tejido testicular.
Tratamiento
El objetivo del tratamiento de los testículos no descendidos es la colocación del testículo en su posición escrotal normal, con el objetivo de disminuir el riesgo de secuelas y complicaciones futuras, como: infertilidad, torsión, traumatismo o cáncer testicular.
Aunque tradicionalmente se han aplicado tratamientos médicos con gonadotropinas, en la actualidad el tratamiento indicado en la criptorquidia es siempre quirúrgico; ya que además de descender el testículo al escroto, permite la exploración del parénquima testicular y la confirmación de la existencia o no de un proceso vaginal persistente (conducto peritoneovaginal persistente, cpvp: pliegue peritoneal que acompaña a los testículos en su descenso desde el abdomen durante la gestación). La eliminación de tejido testicular atrófico, malformado y no viable, así como el cierre mediante ligadura de este proceso vaginal, evitan los riesgos futuros de degeneración maligna y de aparición de hernia inguinal, respectivamente.
Algunos autores proponen la asociación de tratamiento hormonal al tratamiento quirúrgico, en casos individualizados, con el fin de mejorar la fertilidad, sin que exista un consenso universal a este respecto; ya que, los resultados, como se comenta posteriormente, son en muchos casos contradictorios.
Tratamiento quirúrgico
Los aspectos fundamentales a tener en cuenta en el tratamiento quirúrgico del maldescenso testicular son: la edad indicada para la intervención quirúrgica, la distinción entre testes palpables y no palpables en cuanto a la elección de las técnicas quirúrgicas a realizar, y el seguimiento de los testes retráctiles (“en ascensor”) hasta descartar definitivamente un ascenso testicular que requiera tratamiento quirúrgico.
Edad
Las recomendaciones actuales indican el tratamiento quirúrgico en torno al año de edad, al considerarse una etapa en la que el procedimiento quirúrgico es ya seguro, y ante la teoría de que en este momento hay tiempo para la recuperación de una fertilidad dañada, sobre todo, en los testículos no palpables situados proximalmente al anillo inguinal interno, en los que se ha confirmado un mayor riesgo de depleción de células de Leydig y germinales testiculares(4).
Nunca debe llevarse a cabo antes de los 6 meses de edad, ya que es un periodo en el que se puede producir el descenso testicular al escroto de forma espontánea.
Aunque no existe un consenso definitivo en cuanto a la edad exacta de tratamiento, siempre se recomienda antes de los 2 años de edad, justificado por la posibilidad de poder ofrecer la oportunidad de que se produzca este denominado rescate (“catch up”) de una fertilidad deteriorada descrita en pacientes con criptorquidia en estas edades(5). Estas recomendaciones se basan en los resultados publicados en pacientes con maldescenso testicular operados al año de edad, que demuestran un mayor crecimiento del volumen testicular (medido por ecografía) y mejores índices de espermiogénesis detectados mediante contajes histológicos de células germinales y de Leydig, en biopsias testiculares realizadas durante los procedimientos quirúrgicos en estas etapas(6). Falta por esclarecer, sin embargo, si estos hallazgos histológicos se correlacionan con una infertilidad futura, siendo necesarios estudios prospectivos en adultos, en los que se pueda investigar su fertilidad mediante análisis del semen, estudios hormonales o adquisición de la paternidad, no disponibles aún en la actualidad.
Testículos palpables
La técnica estándar para el tratamiento del teste palpable es la funiculolisis y orquidopexia, por vía inguinal, que consiste en sección del gubernáculum y disección del músculo cremáster y de los elementos del cordón (vasos espermáticos y conducto deferente) para la liberación del testículo de sus fijaciones al pubis, así como la ligadura del cpvp, si existe, y fijación del testículo al escroto mediante sutura en un plano inferior al dartos.
Mediante este procedimiento, el éxito de posicionamiento testicular en el escroto es del 96%(7). Habitualmente, se considera un proceso de cirugía mayor ambulatoria (CMA), excepto en los pacientes menores de un año, en los que por consideraciones anestésicas, se recomienda el ingreso hospitalario durante las 24 horas posteriores a la intervención quirúrgica.
No está indicada la administración de antibioterapia profiláctica de forma sistemática. Aunque generalmente, en los casos de maldescenso testicular bilateral, se indica un tratamiento quirúrgico escalonado en dos tiempos, en los pacientes con testículos palpables y de localización distal, es posible el tratamiento quirúrgico bilateral en un solo procedimiento.
A continuación, se enumeran los pasos clave de esta técnica quirúrgica, para la que es fundamental el buen conocimiento de la anatomía del retroperitoneo en la zona inguinal (Fig. 1).
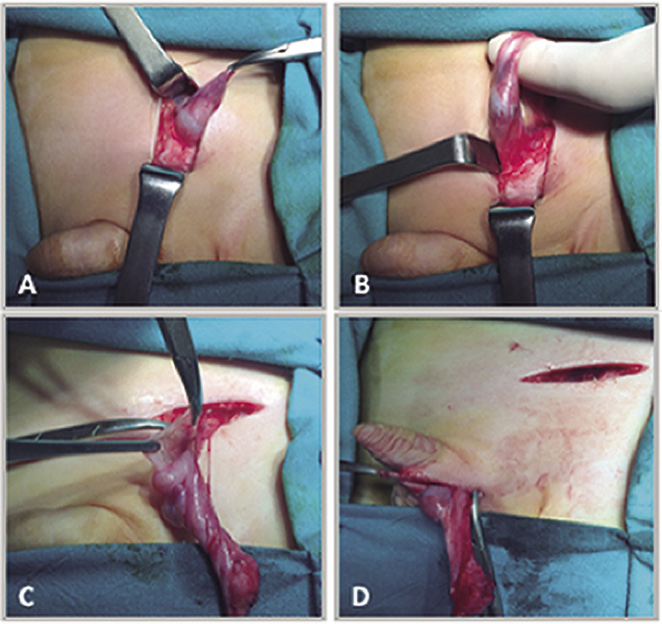
Figura 1. Orquidopexia por vía inguinal: principales pasos quirúrgicos. A. Teste en canal inguinal. B. Exteriorización de teste y cordón espermático con fijación de gubernáculum a pubis. C.Disección para ligadura de conducto peritoneovaginal (cpvp). D.Descenso testicular desde canal inguinal a bolsa escrotal para posterior orquidopexia.
1. La intervención se inicia mediante la realización de una incisión cutánea inguinal transversa sobre el anillo inguinal interno.
2. Movilización del teste y cordón espermático mediante la sección del gubernáculo, que fija el teste al pubis. En este momento, se comprueba el aspecto del teste y se informa sobre su localización exacta, tamaño y posibles malformaciones existentes. Extirpación de apéndices testiculares o del epidídimo si se confirman.
3. Sutura del proceso vaginal mediante ligadura y sección del cpvp, si existe. La disección retroperitoneal, a través del anillo inguinal interno, es crucial para la movilización del cordón y del testículo y permite la realización de la pexia testicular en el escroto con mínima tensión.
4. Disección de los elementos del cordón, para eliminar tensión en la orquidopexia y apertura del canal inguinal en sentido proximal, si es necesaria para el descenso testicular. En este paso, se debe tener especial cuidado en la disección de los vasos del cordón, para evitar la atrofia testicular, y en no lesionar el nervio ilioinguinal, que discurre por el canal inguinal adyacente al cordón espermático.
5. Por último: incisión escrotal cutánea y creación de la bolsa escrotal en el plano inferior al dartos, donde se aloja el teste mediante sutura del mismo con material absorbible. Sutura de ambos abordajes: inguinal y escrotal, por planos.
Una alternativa a la vía inguinal es la orquidopexia por vía escrotal o técnica de Bianchi, indicada cuando el teste está en una posición distal al anillo inguinal externo, siendo este accesible desde el escroto(8). Mediante este abordaje, se realiza una única incisión escrotal (en su región superior), continuando con los mismos pasos de disección retroperitoneal, anteriormente descritos en la vía inguinal. Cuando la indicación quirúrgica es correcta y se lleva a cabo en testículos distales al anillo inguinal externo, la tasa de éxitos y complicaciones es similar a la técnica convencional inguino-escrotal(9); por lo que, la elección de una u otra técnica se hará en función de la experiencia y preferencias particulares del cirujano.
Durante el periodo postoperatorio (por cualquiera de los procedimientos descritos), se debe evitar el esfuerzo físico y los deportes que provoquen microtraumatismos en la zona escrotal, que puedan incrementar la inflamación de la zona quirúrgica y/o movilizar el testículo (montar en bicicleta, por ejemplo), durante aproximadamente un mes.
El seguimiento postoperatorio, se realizará a intervalos variables (comenzando cada 3-6 meses durante el primer año), valorando la posición del testículo y su crecimiento en cada revisión, hasta la pubertad.
A excepción de los cambios inflamatorios locales en el postoperatorio inmediato, las complicaciones producidas a largo plazo son poco frecuentes y consisten en: atrofia testicular (0,3%) o reascenso (4%), requiriendo reintervención quirúrgica en este último caso.
Testículos no palpables
En el tratamiento de los testículos no palpables, se puede optar por un abordaje inicial por vía inguinal, o bien por una exploración abdominal por laparoscopia que nos permitirá tanto confirmar la localización del testículo intraabdominal, como su tratamiento, al ser un procedimiento diagnóstico-terapéutico.
Siempre, en ambos casos, la primera medida a realizar antes de la intervención quirúrgica es la exploración de ambos testículos bajo anestesia; ya que hasta en un 20% de testes no palpables, estos se palpan en la región inguinal, hecho que descarta la realización de un abordaje laparoscópico, estando indicada la orquidopexia por vía inguinal.
La exploración laparoscópica (habitualmente mediante la colocación de un trócar umbilical para la introducción de una óptica) permite: confirmar la presencia o ausencia de testículos intraabdominales, su entrada en el canal inguinal (la no visualización ecográfica no descarta su presencia) y su aspecto, estando indicada su extirpación en el caso de testículos atróficos y no viables mediante esta vía(10-12). Con esta técnica, además de poder explorar la cavidad abdominal y confirmar el diagnóstico de teste intraabdominal, se pueden explorar los anillos inguinales, evaluar la persistencia del proceso vaginal y examinar los elementos del cordón espermático: conducto deferente y vasos espermáticos.
Los hallazgos laparoscópicos son variables, existiendo distintas posibilidades según la siguiente distribución:
• Entrada de los elementos del cordón al canal inguinal a través del anillo inguinal interno (40%).
• Testículo atrófico/restos no viables (11%).
• Vasos espermáticos con terminación “ciega” (10%).
• Testículo intraabdominal viable (37%).
En el primer caso, en el que se confirma la presencia del cordón espermático entrando en el canal inguinal, se debe continuar la exploración quirúrgica por vía inguinal para confirmar la existencia de testículo y fijarlo a la bolsa escrotal si este es viable.
Si se observa un cordón espermático con un extremo ciego atrófico (“blind ending cord”), situación considerada como atrofia testicular, se da por finalizado el procedimiento, no siendo necesaria la exploración inguinal (Fig. 2).
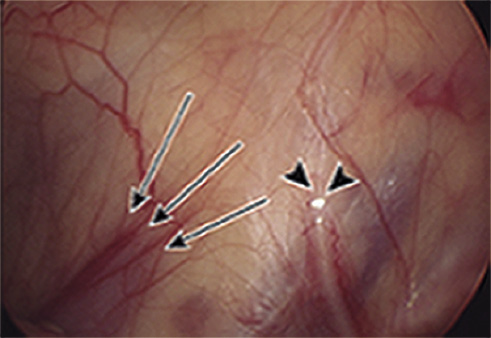
Figura 2.Teste no palpable: procedimiento laparoscópico. Imagen laparoscópica a nivel del anillo inguinal interno, que muestra los vasos espermáticos con extremo ciego (flechas) y conducto deferente amputado (puntas de flecha); junto a ausencia de testículo.
En el caso en el que se objetive la presencia de testículo intraabdominal viable, se puede continuar el procedimiento de descenso y pexia testicular en el escroto, tanto por vía laparoscópica como por vía inguinal.
En los casos de cordones espermáticos cortos, en los que no es posible el descenso testicular a escroto, la técnica laparoscópica gold standardes la denominada “técnica de Stephens-Fowler”(10-12). Consiste en un procedimiento quirúrgico secuencial, en el que en el primer tiempo, se realiza la coagulación de los vasos espermáticos, dejando la vascularización del teste con el aporte vascular de la arteria deferencial. El objetivo del tratamiento en dos tiempos es dar tiempo para el desarrollo de vasos colaterales desde la arteria deferencial para la vascularización del testículo. El segundo procedimiento en el que se realiza el descenso testicular definitivo, se indica a partir de los 6 meses de la primera intervención quirúrgica.
Aunque está aceptada la variante de la técnica Stephens-Fowler en un solo tiempo, esta es menos aceptada por el mayor riesgo de atrofia testicular. Así, la probabilidad de supervivencia testicular en dos tiempos está en torno al 90%, frente al 50-60% en un solo tiempo(13). En aquellos pacientes en los que se observe un cordón espermático largo, se podrá optar por el descenso del testículo por el canal inguinal y pexia escrotal, tal y como se realiza por vía inguinal.
Por último, la orquiectomía laparoscópica se indica en aquellos casos, en los que se confirma un testículo intraabdominal atrófico.
Si se opta por el abordaje inguinal: se realiza una exploración del canal inguinal en busca del cordón espermático y testículo, tal y como se ha descrito para los testes palpables, realizándose orquidopexia inguinal si se confirma un testículo viable, o extirpación de restos testiculares si se diagnostica atrofia testicular. Cuando no se visualizan el teste ni los elementos del cordón en el canal inguinal, se continuará la disección hacia el peritoneo a través del anillo inguinal interno, en busca de los elementos del cordón espermático y del testículo. Si aun así, no se observan dichos elementos, se realizará una laparoscopia en busca de hallazgos intraabdominales.
Como consideración general en los testículos no palpables bilaterales, para cualquiera de las técnicas elegidas, se recomienda la orquidopexia en dos tiempos, retrasando el descenso testicular del segundo lado para dar tiempo a evaluar los resultados de la primera orquidopexia.
En aquellas situaciones en las que se haya producido atrofia testicular en el primer teste operado, existe la posibilidad de hacer una cirugía menos agresiva en el contralateral, con menor disección del cordón espermático y menor riesgo de atrofia testicular, dejando el testículo en posición inguinal palpable, para conservar una adecuada función hormonal(11). Esta medida también es aconsejable en el maldescenso testicular unilateral, en el que no es posible descender el teste a escroto en un primer momento.
Por último, es importante señalar que la biopsia testicular no es un procedimiento rutinario indicado durante las técnicas de orquidopexia, siendo recomendada solo en situaciones especiales, como en los casos de genitales ambiguos, alteraciones cromosómicas o como parte de otros estudios en pacientes con patologías endocrinológicas(11).
Complicaciones del tratamiento quirúrgico
Dentro de las complicaciones del tratamiento quirúrgico, la más importante es la atrofia testicular, que se puede producir tanto por daño de los vasos espermáticos en la manipulación del cordón durante la reparación quirúrgica, como por cambios inflamatorios severos locales durante el postoperatorio, describiéndose hasta en el 1,8% de los casos más severos(7).
A parte de los cambios inflamatorios típicos, otras complicaciones posibles son: infección de herida quirúrgica, hemorragia local y formación de hematomas, presencia de hernia inguinal en los casos en los que no se ha reparado un proceso vaginal persistente, o el reascenso testicular. En estas dos últimas situaciones, será necesaria la reintervención quirúrgica.
Testículos retráctiles
Los pacientes con testículos retráctiles deben seguirse mediante exploración anual o bianual hasta descartar de forma definitiva la situación de maldescenso testicular.
La media del tiempo de seguimiento es de 2-3 años, y la tasa de “ascenso tardío” ocurre en 1/3 de los casos aproximadamente, estando indicada la cirugía dentro de los 6 meses desde el momento del diagnóstico. En el resto de los pacientes, los testes descienden espontáneamente o quedan como retráctiles, por lo que en la mayoría de los casos no está indicado el tratamiento quirúrgico.
Tratamiento hormonal
Puesto que las concentraciones de testosterona son un factor local influyente fundamental en el descenso testicular y aunque, como se ha comentado anteriormente, el tratamiento de elección es indiscutiblemente quirúrgico, algunos autores recomiendan en las Guías de la Sociedad Europea de Urología Pediátrica (Tabla I), el tratamiento hormonal con gonadotropina coriónica humana (hCG) u hormona liberadora de gonadotropinas (GnRH) en casos seleccionados, con el objetivo de estimular la producción testicular de testosterona hasta alcanzar las concentraciones necesarias de la misma, que permitan el descenso del testículo al escroto(12). Sin embargo, el hecho de que los resultados obtenidos con estas recomendaciones no hayan podido considerarse exitosos de una forma global, supone que no esté justificado la administración de tratamiento hormonal de forma generalizada(14). Los porcentajes máximos de descenso testicular obtenidos se describen entre el 10%-20%, con riesgo además de reascenso posterior en un 20% de estos(7,12), por lo que la indicación prioritaria del tratamiento hormonal se centra en la mejora de la fertilidad en la etapa postpuberal(12,15,16).
Además, el hecho de que se hayan observado mayores porcentajes de éxito en los testículos localizados más distalmente hace suponer que los datos informados como exitosos se refieran a testículos con mayor probabilidad de descenso espontáneo o incluso retráctil. Pero más aún, algunos autores proscriben este tipo de tratamiento, argumentando daños sobre la espermatogénesis, con incremento de la apoptosis de células germinales, producción de cambios inflamatorios y disminuciones del volumen testicular(11).
Como conclusión general, la mayoría de los grupos de cirujanos pediátricos descartan el tratamiento hormonal generalizado, recomendándolo solo en casos individualizados como: criptorquidia bilateral, niños > 1 año con testículos pequeños en la ecografía, testículos abdominales, en testículos únicos o si el contralateral se ha dañado anteriormente(10), con el objetivo de mejorar la fertilidad.
Los efectos secundarios del tratamiento hormonal son reversibles, consistentes fundamentalmente en signos de virilización: pigmentación escrotal, alargamiento peneano, erecciones frecuentes, ganancia de peso, crecimiento de vello pubiano, y a veces comportamiento agresivo.
Pronóstico: fertilidad y cáncer testicular
Desde hace décadas es sabido que los pacientes con diagnóstico de criptorquidia presentan un mayor riesgo de infertilidad y de desarrollo de tumores malignos testiculares en la edad adulta. La gran mayoría de los estudios realizados hasta la fecha pretenden establecer de qué manera influyen los diferentes aspectos de la patología del descenso testicular, tanto en la capacidad reproductiva como en el riesgo de padecer cáncer testicular. A la luz de las investigaciones publicadas en las últimas décadas, se ha ido adelantado la indicación de orquidopexia a una edad cada vez más temprana, situándola actualmente, entre los seis meses y un año de edad. En este sentido, la hipótesis de que el tratamiento quirúrgico precoz es beneficioso para mejorar la espermatogénesis y disminuir el riesgo de desarrollo de tumores a largo plazo, parece cobrar cada vez más evidencia(17). Sin embargo, esta práctica es relativamente reciente, por lo que aún carecemos de estudios prospectivos randomizados que puedan corroborar estas teorías y que puedan establecer el pronóstico real de estos pacientes.
Fertilidad
La criptorquidia se ha considerado desde siempre una causa de infertilidad o subfertilidad. Se ha demostrado que los pacientes con criptorquidia bilateral tienen peor pronóstico en este sentido. Por lo que parece que, en casos unilaterales, el testículo sano contralateral puede suplir la deficiencia del teste ascendido(17).
Alteraciones de la fertilidad se han descrito en un 33% de los casos unilaterales y en un 66% de los bilaterales.
Existen dos momentos claves en la diferenciación espermática en la infancia: a los 2-3 meses de edad, cuando la célula germinal por la influencia de la elevación de gonadotropinas (FSH/LH) y testosterona pasa a espermatogonia, que es considerada la célula madre espermática; y a los 4 años de edad, cuando comienza la meiosis, apareciendo los primeros espermatocitos primarios, que permanecen quiescentes hasta el estímulo hormonal de la pubertad.
Algunos autores han documentado fallos en la maduración andrógeno-dependiente de las células germinales a espermatogonias en testículos criptorquídicos, lo que implica un bajo recuento de células madre para la posterior espermatogénesis postpuberal y, por lo tanto, mayor riesgo de infertilidad(18). Sin embargo, no se ha podido demostrar una relación estadísticamente significativa entre los hallazgos histológicos en el momento de la orquidopexia en el niño y los parámetros de fertilidad (niveles hormonales y seminogramas) en la edad adulta por lo que, actualmente, no se recomienda realizar biopsias testiculares para predecir la futura fertilidad(19).
Cáncer testicular
Se sabe que la criptorquidia aislada es un factor de riesgo para el desarrollo de tumores testiculares en la edad adulta. Entre el 5-10% de los pacientes adultos con cáncer testicular tienen historia previa de criptorquidia en la infancia(20). Aunque las cifras varían mucho según las diferentes publicaciones, se estima que un varón que nace con criptorquidia tiene, aproximadamente, 3 veces más riesgo de padecer cáncer testicular que un hombre sano(20). Además, sabemos que este riesgo aumenta cuanto más tarde se realice la corrección quirúrgica. El testículo contralateral que se encuentra en una posición normal, no parece tener aumentado el riesgo de padecer cáncer testicular.
Los tumores testiculares asociados a testículos criptorquídicos no aparecen en la infancia, sino posteriormente, entre los 20-40 años de edad. Los más frecuentemente asociados a esta patología son los seminomas, que surgen a partir de células germinales mutadas.
Aunque no se ha podido demostrar de forma clara el origen exacto, parece que en los pacientes con criptorquidia, las células malignas tienen su origen en las células germinales neonatales, que no pudieron madurar a espermatogonia durante los primeros meses de vida y que quedan quiescentes en el parénquima testicular. Cómo influyen en este proceso de carcinogénesis los factores ambientales a los que está sometido el teste ascendido (mayor temperatura), está aún por determinar(18). Los factores de riesgo demostrados para el padecimiento de tumores malignos testiculares en pacientes con criptorquidia son: la afectación bilateral, la presentación del teste en posición intraabdominal y la corrección quirúrgica tardía, siendo peor, si esta se realiza después de la pubertad o no se lleva a cabo.
Funciones del pediatra de Atención Primaria
Se recomienda la exploración de los genitales externos en el primer control de salud de los varones tras el nacimiento y a los 6 meses de edad, así como en cualquier momento, si no se hubiera realizado previamente.
Los niños con criptorquidia deben ser derivados a un cirujano o urólogo infantil, si la situación persiste a los 6 meses o cuando se detecte a una edad posterior.
En presencia de criptorquidia bilateral y/o hipospadias u otra alteración genital externa, se derivará lo antes posible para estudio genético y endocrinológico.
Los pacientes con testículos retráctiles deben seguirse mediante exploración anual o bianual hasta descartar de forma definitiva la situación de maldescenso testicular. No requieren tratamiento, pero sí controles en los exámenes de salud, ante la posibilidad de un “ascenso tardío” que ocurre en 1/3 de los casos aproximadamente.
Bibliografía
Los asteriscos reflejan el interés del artículo a juicio del autor.
1.*** Abaci A, Catli G, Anik A, Böber E. Epidemiology, classification and management of undescended testes: does medication have value in its treatment? J Clin Res Pediatr Endocrinol. 5: 65-72, 2013.
2.** Lee PA, Houk CP: Cryptorchidism. Curr Opin Endocrinol Diabetes Obes 20:210-216, 2013.
3.*** Kolon TF, Herndon CD, Baker LA, Baskin LS, Baxter CG, Cheng EY et al; American Urological Assocation. Evaluation and treatment of cryptorchidism: AUA guideline. J Urol. 2014 Aug; 192(2): 337-45.
4. Tasian GE, Hittelman AB, Kim GE, DiSandro MJ, Baskin LS: Age at orchiopexy and testis palpability predict germ and Leydig cell loss: clinical predictors of adverse histological features of cryptorchidism. J Urol. 182: 704-709, 2009.
5.Kim SO, Hwang EC, Hwang IS, Oh KJ, Jung SI, Kang TW et al. Testicular catch up growth: the impact of orchiopexy age. Urology. 78: 886-889, 2011.
6.** Kollin C, Granholm T, Nordenskjold A, Ritzén EM Growth of spontaneously descended and surgically treated testes during early childhood. Pediatrics. 131: e1174-1180, 2013.
7. Penson D, Krishnaswami S, Jules A, McPheeters ML: Effectiveness of hormonal and surgical therapies for cryptorchidism: a systematic review. Pediatrics. 131: e1897-1907, 2013.
8. Bassel YS, Scherz HC, Kirsch AJ: Scrotal incision orchiopexy for undescended testes with or without a patent processus vaginalis. J Urol. 177: 1516-1518, 2007.
9.* Gutiérrez Dueñas JM, Lorenzo G, Ardela Díaz E, Martin Pinto F, Domínguez Vallejo FJ.: [First results of the orchiopexy via scrotal approach]. Cir Pediatr. 24: 79-83, 2011.
10.** Evi Comploj AP: Diagnosis and Management of Cryptorchidism. European Urology Supplements. 11: 2-9, 2012.
11.*** Ritzen EM, Bergh A, Bjerknes R, Christiansen P, Cortes D, Haugen SE,et al: Nordic consensus on treatment of undescended testes. Acta Paediatrica. 96:638-643, 2007.
12.*** Tekgüll SRE, Gerharz P. Cryptorchidism in Urology ESfPUEAo (ed). Guidelines on Paediatric Urology, 2013.
13. Esposito C, Iacobelli S, Farina A, Perricone F, Savanelli A, Settimi A.: Exploration of inguinal canal is mandatory in cases of non palpable testis if laparoscopy shows elements entering a closed inguinal ring. Eur J Pediatr Surg. 20: 138-139, 2010.
14.* Ludwikowski B, Gonzalez R: The controversy regarding the need for hormonal treatment in boys with unilateral cryptorchidism goes on: a review of the literature. European journal of pediatrics. 172: 5-8, 2013.
15. Jallouli M, Rebai T, Abid N, Bendhaou M, Kassis M, Mhiri R.: Neoadjuvant gonadotropin-releasing hormone therapy before surgery and effect on fertility index in unilateral undescended testes: a prospective randomized trial. Urology. 73: 1251-1254, 2009.
16. Schwentner C, Oswald J, Kreczy A, Lunacek A, Bartsch G, Deibl M et al: Neoadjuvant gonadotropin-releasing hormone therapy before surgery may improve the fertility index in undescended testes: a prospective randomized trial. J Urol. 173: 974-977, 2005.
17. Kollin C, Ritzen EM: Cryptorchidism: a clinical perspective. Pediatr Endocrinol Rev. 11 Suppl 2: 240-250, 2014.
18. Hutson JM, Balic A, Nation T, Southwell B: Cryptorchidism. Semin Pediatr Surg 19: 215-224, 2010.
19. Kraft KH, Canning DA, Snyder HM, 3rd, Kolon TF: Undescended testis histology correlation with adult hormone levels and semen analysis. J Urol. 188: 1429-1435, 2012.
20.** Lip SZ, Murchison LE, Cullis PS, Govan L, Carachi R: A meta-analysis of the risk of boys with isolated cryptorchidism developing testicular cancer in later life. Arch Dis Child. 98: 20-26, 2013.
Bibliografía recomendada
- Abaci A, Catli G, Anik A, Böber E. Epidemiology, classification and management of undescended testes: does medication have value in its treatment? J Clin Res Pediatr Endocrinol. 5: 65-72, 2013.
Los factores etiológicos más importantes en el desarrollo de la criptorquidia son: genéticos, hormonales y anatómicos. Según el Consenso de Países Nórdicos en 2007, la cirugía es el tratamiento de elección y debe estar indicada entre los 6 y 12 meses de edad.
- Kolon TF, Herndon CD, Baker LA, Baskin LS, Baxter CG, Cheng EY et al; American Urological Association. Evaluation and treatment of cryptorchidism: AUA guideline. J Urol. 2014 Aug; 192(2): 337-45.
Esta guía recomendada para atención primaria y especializada, plantea una actualización en la evaluación diagnóstica y el tratamiento de la criptorquidia. Asimismo, sugiere que la cirugía podría reducir los efectos secundarios a largo plazo, como la infertilidad o el cáncer testicular.
- Kollin C, Ritzen EM: Cryptorchidism: a clinical perspective. Pediatr Endocrinol Rev. 11 Suppl 2: 240-250, 2014.
El tratamiento de la criptorquidia debe realizarse lo más pronto posible. Estudios randomizados han demostrado que el tratamiento quirúrgico antes del año de edad es beneficioso para el desarrollo testicular y la futura espermatogénesis.
| Caso clínico |
|
Paciente de 6 meses de edad que acude a la consulta de su pediatra en su revisión correspondiente de niño sano. En la exploración física, se confirma testículo no palpable derecho, ya constatado en revisiones previas. Los padres refieren no haber observado dicho testículo en escroto en ningún momento. La exploración de los genitales externos es normal, incluyendo la confirmación del testículo contralateral en bolsa escrotal. |
Puede realizar el cuestionario de acreditación pinchando AQUÍ.
Le recordamos que debe ser socio y estar registrado.
El cuestionario debe realizarlo en el orden en que los temas aparecen en la revista (del primero al último).
Al finalizar las preguntas de cada tema, estas se guardan automáticamente.

